Dernière mise à jour le 02/02/2026
NASACORT 55 microgrammes par dose, suspension pour pulvérisation nasale
Indications thérapeutiques
Classe pharmacothérapeutique : GLUCOCORTICOÏDE PAR VOIE LOCALE.
(R : Système Respiratoire).
C’est un médicament anti-inflammatoire indiqué dans le traitement des symptômes de la rhinite allergique de l’adulte et de l’enfant âgé de 2 ans et plus.
Présentations
> 1 flacon(s) pulvérisateur(s) polyéthylène de 15 ml avec pompe doseuse avec embout nasal
Code CIP : 342 922-9 ou 34009 342 922 9 3
Déclaration de commercialisation : 01/02/1999
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 7,47 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 8,49 €
- Taux de remboursement :30%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Faible | Avis du 05/02/2020 | Extension d'indication | Le service médical rendu par NASACORT 55 µg par dose (acétonide de triamcinolone), suspension pour pulvérisation nasale est faible dans l’extension indication au traitement des symptômes : • de la rhinite allergique saisonnière (RAS) de l’enfant âgés de 2 à 5 ans • de la rhinite allergique perannuelle (RAP), de l’enfant et de l’adolescent âgés de 2 à 17 ans. |
| Modéré | Avis du 05/10/2016 | Renouvellement d'inscription (CT) | Le service médical rendu par NASACORT reste modéré dans les indications de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 05/02/2020 | Extension d'indication | Compte tenu : • de la démonstration de la supériorité de l’acétonide de triamcinolone par rapport au placebo dans une seule des deux études réalisées et un seul des deux co-critères de jugement étudiés (indice nasal évaluant la congestion nasale, la rhinorrhée et les éternuements), chez des patients pédiatriques ayant une rhinite allergique perannuelle, • la faible quantité d’effet observée sur la réduction de l’indice nasal par rapport au placebo, • de l’absence de données dans la rhinite allergique saisonnière, • de l’absence de données chez les enfants de plus de 12 ans dans la rhinite allergique perannuelle, • de l’absence de données de qualité de vie, • des risques en termes de ralentissement de la croissance des enfants et d’effets indésirables liés au passage systémique dans le cas d’un traitement prolongé, • de l’absence de comparaison aux autres corticoïdes par voie nasale disponibles, NASACORT 55 µg/ml (acétonide de triamcinolone), suspension pour pulvérisation nasale, n’apporte pas d’amélioration du service médical rendu (ASMR V) dans la stratégie thérapeutique du traitement de la rhinite allergique saisonnière chez l’enfant de 2 à 5 ans et de la rhinite allergique perannuelle chez l’enfant et l’adolescent de 2 à 17 ans. |
ANSM - Mis à jour le : 01/07/2023
NASACORT 55 microgrammes par dose, suspension pour pulvérisation nasale
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Par pulvérisation :
Triamcinolone (acétonide) .................................................................................... 55 microgrammes
Pour une dose
Un flacon correspond à 120 pulvérisations. Une pulvérisation de 100 milligrammes délivre une dose de 55 microgrammes d'acétonide de triamcinolone.
Excipients à effet notoire : chlorure de benzalkonium 15 microgrammes par dose (voir rubrique 4.4).
Pour la liste complète des excipients, voir rubrique 6.1.
Suspension pour pulvérisation nasale.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Adultes :
· La dose initiale recommandée est de 220 microgrammes par jour, soit 2 pulvérisations dans chaque narine 1 fois par jour le matin. Une fois l’amélioration des symptômes obtenue, les patients peuvent être maintenus à une dose de 110 microgrammes par jour (1 pulvérisation dans chaque narine 1 fois par jour).
Population pédiatrique
Enfants âgés de 12 ans et plus :
· La dose initiale recommandée est de 220 microgrammes par jour, soit 2 pulvérisations dans chaque narine 1 fois par jour le matin. Une fois l’amélioration des symptômes obtenue, les patients peuvent être maintenus à une dose de 110 microgrammes par jour (1 pulvérisation dans chaque narine 1 fois par jour).
Enfants âgés de 6 à 12 ans :
· La dose recommandée est de 110 microgrammes par jour soit une pulvérisation dans chaque narine 1 fois par jour le matin. Chez les patients présentant des symptômes plus sévères, une dose de 220 microgrammes par jour peut être utilisée. Mais une fois l'amélioration des symptômes obtenue, les patients doivent être maintenus à la dose efficace la plus faible (voir rubriques 4.4 et 5.1).
Enfants âgés de 2 à 5 ans :
· La dose maximale recommandée est de 110 microgrammes par jour administrée en 1 pulvérisation dans chaque narine 1 fois par jour le matin (voir rubrique 4.4 et 5.1).
L’initiation et la durée du traitement sont fonction de l'exposition allergénique.
Chez l'enfant de moins de 12 ans, le traitement continu de plus de 3 mois n’est pas recommandé
Mode d’administration
Voie nasale.
· Agiter légèrement le flacon avant emploi.
· Lors du premier usage, la pompe doit être amorcée par 5 pulvérisations. Inutilisée, celle-ci reste correctement amorcée pendant environ 2 semaines. Au-delà, elle peut être réamorcée par 1 seule pulvérisation.
· Hypersensibilité à la triamcinolone ou à l’un des excipients mentionnés à la rubrique 6.1.
· Trouble de l'hémostase, notamment épistaxis.
· Infection oro-bucco-nasale et ophtalmique par herpès simplex virus.
· Enfant de moins de 2 ans en l'absence de données cliniques.
4.4. Mises en garde spéciales et précautions d'emploi
Population pédiatrique
NASACORT ne doit pas être utilisé chez les enfants de moins de 2 ans (voir rubrique 4.3).
Le risque d'effet systémique, de freination corticosurrénalienne et de retentissement sur la croissance de l'enfant est majoré en cas d'administration concomitante d'une corticothérapie par voie inhalée ou à fortiori par voie systémique.
Un ralentissement de croissance a été rapporté chez les enfants sous corticothérapie nasale incluant NASACORT aux doses thérapeutiques dans des études à long terme (1 an de traitement). Voir rubrique 5.1.
Il est recommandé une surveillance régulière de la taille des enfants sous corticothérapie nasale. L’effet du traitement doit être contrôlé afin de réduire la dose de corticostéroïde nasal, si possible, à la dose la plus faible à laquelle un contrôle efficace des symptômes est obtenu. Les effets à long terme d’un ralentissement de la croissance associée aux corticoïdes par voie nasale, incluant l’impact sur la taille adulte finale ne sont pas connus. Par ailleurs, il est fortement recommandé d’adresser le patient à un pédiatre, en particulier pour les enfants de moins de 6 ans.
Troubles visuels : des troubles visuels peuvent apparaitre lors d’une corticothérapie par voie systémique ou locale. En cas de vision floue ou d’apparition de tout autre symptôme visuel apparaissant au cours d’une corticothérapie, un examen ophtalmologique est requis à la recherche notamment d’une cataracte, d’un glaucome, ou d’une lésion plus rare telle qu’une choriorétinopathie séreuse centrale, décrits avec l’administration de corticostéroïdes par voie systémique ou locale. Aussi une surveillance étroite est justifiée chez les patients présentant des troubles visuels ou des antécédents d’élévation de la pression intraoculaire, de glaucome et/ou de cataracte.
Des effets systémiques peuvent apparaître, en particulier, lors du traitement au long cours avec des doses élevées de corticoïdes par voie nasale. Le risque de retentissement systémique reste néanmoins moins important qu’avec les corticoïdes oraux et peut varier en fonction de la susceptibilité individuelle et de la composition de la spécialité corticoïde utilisée (peut varier en fonction de la puissance, du dosage et des propriétés pharmacocinétiques (lipophilie, volume de distribution et demi-vie d’élimination) du stéroïde). Les effets systémiques possibles sont syndrome de Cushing ou symptômes cushingoïdes, amincissement cutané, hématomes sous cutanés, insuffisance surrénalienne, retard de croissance chez les enfants et les adolescents, diminution de la densité osseuse, cataracte et glaucome et plus rarement, troubles psychologiques et du comportement comprenant hyperactivité psychomotrice, troubles du sommeil, anxiété, dépression ou agressivité (en particulier chez l’enfant), , L'administration conjointe de corticoïde par voie nasale chez les patients sous corticothérapie orale au long cours ne dispense pas des précautions nécessaires lors d'une réduction des doses de corticoïde par voie orale.
Celles-ci seront diminuées très progressivement et le sevrage devra être effectué sous surveillance médicale attentive (à la recherche de l'apparition de signes d'insuffisance surrénale aiguë ou subaiguë) se prolongeant au-delà de l'arrêt de la corticothérapie générale.
L'administration locale par voie nasale de corticoïde n'est pas recommandée chez les patients ayant présenté récemment une ulcération de la cloison nasale, ou ayant subi une intervention ou un traumatisme au niveau du nez, tant que la guérison n'est pas complète.
Les risques associés à l'arrêt soudain des corticostéroïdes après une utilisation prolongée peuvent inclure une exacerbation ou une récurrence de la maladie sous-jacente, une insuffisance corticosurrénale ou un syndrome de sevrage des stéroïdes. Cependant, ces effets sont extrêmement rares pour les corticostéroïdes par voie nasale, et beaucoup moins susceptibles de se produire avec les corticostéroïdes par voie nasale qu'avec les corticostéroïdes par voie orale.
Chlorure de benzalkonium
Ce médicament contient 15 microgrammes de chlorure de benzalkonium par dose.
En raison de la présence de chlorure de benzalkonium, ce médicament peut provoquer un œdème de la muqueuse nasale, particulièrement dans les cas d’une utilisation à long terme et une gêne respiratoire.
Précautions particulières d'emploi
Il conviendra d'assurer la perméabilité des fosses nasales pour assurer la diffusion optimale du produit. En avertir le patient en lui conseillant de les assécher par mouchage avant l'instillation.
En cas d'obstruction nasale majeure, un examen détaillé de la sphère ORL doit être pratiqué.
En cas de traitement prolongé, des examens répétés de la muqueuse nasale sont recommandés afin d'évaluer le retentissement éventuel de la corticothérapie sur la muqueuse nasale. Si une atrophie de la muqueuse nasale est constatée, il conviendra d'envisager la diminution des doses de corticoïdes locaux.
En cas de tuberculose pulmonaire, d'infection mycosique pulmonaire, l'instauration d'une surveillance étroite et d'un traitement adapté s'impose.
Avertir le patient qu'il s'agit d'un traitement régulier, et qu'un délai de plusieurs jours de traitement peut être nécessaire avant d'observer les effets sur les symptômes de la rhinite.
L'attention des sportifs sera attirée sur le fait que cette spécialité contient un principe actif pouvant induire une réaction positive des tests pratiqués lors de contrôle anti-dopage.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Associations déconseillées
+ Inhibiteurs du CYP3A
Il est prévu que l’administration concomitante d’inhibiteurs du CYP3A, y compris de produits contenant du cobicistat, augmente le risque d’effets secondaires systémiques. L’association doit être évitée, sauf si les bénéfices sont supérieurs au risque accru d’effets secondaires systémiques des corticostéroïdes ; dans ce cas, les patients doivent être surveillés en vue de détecter les éventuels effets secondaires systémiques des corticostéroïdes.
4.6. Fertilité, grossesse et allaitement
Grossesse
Chez l'animal, l'expérimentation met en évidence un effet tératogène variable selon les espèces.
Chez l'homme, les études épidémiologiques n'ont décelé aucun risque malformatif lié à la prise de corticoïdes per os lors du premier trimestre.
Lors de maladies chroniques nécessitant un traitement tout au long de la grossesse, un léger retard de croissance intra-utérin est possible. Une insuffisance surrénale néonatale a été exceptionnellement observée après corticothérapie à doses élevées.
Il peut être justifié d'observer une période de surveillance clinique (poids, diurèse) et biologique (glycémie) du nouveau-né.
En conséquence, ce médicament peut être prescrit pendant la grossesse si besoin.
Le passage dans le lait de l'acétonide de triamcinolone n'a pas été étudié. Néanmoins, les autres corticoïdes sont excrétés dans le lait.
Les données disponibles semblent montrer une bonne tolérance chez l'enfant ; cependant, le retentissement biologique ou clinique d'un traitement maternel de longue durée n'est pas évalué à ce jour.
En conséquence, l'allaitement est possible en cas de traitement bref. En cas de traitement chronique, par mesure de précaution, l'allaitement est à éviter.
Fertilité
Sans objet.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
|
Classes de système d’organes |
Fréquence |
Effets indésirables |
|
Affections du système immunitaire |
Fréquence indéterminée |
Hypersensibilité incluant prurit ou rash. |
|
Affections endocriniennes |
Fréquence indéterminée |
Syndrome de sevrage des stéroïdes (voir rubrique 4.4) |
|
Affections du Système nerveux |
Fréquents |
Céphalées. |
|
Fréquence indéterminée |
Dysgueusie, parosmie. |
|
|
Affections oculaires |
Très rares |
Cataracte, glaucome. |
|
Fréquence indéterminée |
Vision floue (voir rubrique 4.4), pression intraoculaire augmentée*, choriorétinopathie. |
|
|
Affections respiratoires, thoraciques et médiastinaux |
Fréquents |
Epistaxis, toux. |
|
Fréquence indéterminée |
Irritation ou sensation de brûlure nasale, sécheresse des muqueuses nasales et oropharyngées, irritation pharyngée, congestion nasale, éternuements, dyspnée, perforation de la cloison nasale*, atrophie de la muqueuse nasale*. |
|
|
Infections et infestations |
Fréquents |
Rhinite, pharyngite, syndrome grippal. |
|
Fréquence indéterminée |
Candidoses nasales et oropharyngées. |
|
|
Affections gastro-intestinales |
Fréquents |
Dyspepsie, anomalies dentaires |
|
Fréquence indéterminée |
Nausées. |
|
|
Affections psychiatriques |
Fréquence indéterminée |
Insomnie. |
|
Troubles généraux et anomalies au site d’administration |
Fréquence indéterminée |
Fatigue. |
|
Investigations |
Fréquence indéterminée |
Baisse du taux de cortisol sanguin. |
*De rares cas de perforations du septum nasal, d’hypertonie oculaire et d'atrophie de la muqueuse nasale ont été rapportés avec les corticoïdes administrés par voie nasale au long cours.
Infections à Candida albicans
Ont été décrits des cas d'infections à Candida albicans nasales et pharyngées lors du traitement. Il conviendra dans ce cas d'interrompre la corticothérapie par voie nasale et d'envisager la mise en route d'un traitement adapté.
Effets systémiques
Le risque d'effets systémiques lié à l'acétonide de triamcinolone administré par voie nasale n'est pas exclu. Ce risque est majoré en cas d'administration concomitante d'une corticothérapie par voie inhalée ou a fortiori par voie systémique. Le retentissement clinique notamment à long terme n'est pas clairement établi. Le risque d'insuffisance corticotrope latente après administration prolongée devra être considéré en cas d'infection intercurrente, d'accident ou d'intervention chirurgicale.
Population pédiatrique
Un retard de croissance a été rapporté chez les enfants et les adolescents sous corticothérapie nasale (voir rubrique 4.4).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr
Il pourrait entraîner une freination hypophyso-surrénalienne et, s'il se prolongeait, des signes cliniques d'hypercorticisme. Ces symptômes disparaîtront après l'arrêt du traitement qui doit être progressif.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Glucocorticoïde par voie locale, code ATC : R01AD11.
(R : Système Respiratoire).
L'acétonide de triamcinolone est un glucocorticoïde. Il exerce une activité anti-inflammatoire locale. C'est un dérivé plus puissant que la triamcinolone, son activité est environ 8 fois plus importante que celle de la prednisone.
Dans des études cliniques réalisées chez l’adulte et l’enfant de 6 ans et plus, à des doses intranasales jusqu’à 440 microgrammes/j, et chez les enfants âgés de 2 à 5 ans à des doses intranasales de 110 microgrammes/j, il n’a pas été observé de suppression de l’axe hypothalamique-pituitaire-surrénalien (axe HPS).
5.2. Propriétés pharmacocinétiques
La concentration plasmatique moyenne du produit est inférieure à 0,06 ng/ml à la 12ème heure, et inférieure au seuil de détection de la méthode de dosage à la 24ème heure. La demi-vie est de 3 à 3,3 heures.
Population pédiatrique
Après administration de doses multiples intranasales de NASACORT, l’exposition systémique observée chez les patients pédiatriques âgés de 6 à 12 ans était similaire à celle observée chez les patients adultes.
L’administration intranasale de NASACORT à des doses de 110 microgrammes/j chez les patients pédiatriques âgés de 2 à 5 ans présentait une exposition systémique similaire à celle obtenue chez les patients adultes à des doses de 220 microgrammes/j.
La clairance apparente et le volume de distribution chez les patients pédiatriques âgés de 2 à 5 ans correspondaient approximativement à la moitié de ceux obtenus chez les adultes.
5.3. Données de sécurité préclinique
Aucun effet mutagène n'a été noté dans les tests in vitro ("reverse mutation test" sur salmonelle et "forward mutation test" sur cellules ovariennes de hamster chinois).
Les études chez le rongeur n'ont pas montré d'effet cancérogène lié à l'administration d'acétonide de triamcinolone. Comme d'autres corticostéroïdes, l’acétonide de triamcinolone est tératogène chez l'animal et induit (chez le rat et le lapin) des fentes palatines et/ou des hydrocéphalies internes et des anomalies squelettiques au niveau de la colonne vertébrale. D'autres effets tératogènes tels que des anomalies du système nerveux central et des malformations crâniennes ont été observées chez le singe. L'acétonide de triamcinolone induit une augmentation des résorptions fœtales, de la mortinatalité et une diminution du poids des nouveau-nés et du taux de survie chez le rongeur sans modification du taux de gestation.
2 ans.
6.4. Précautions particulières de conservation
Pas de condition particulière de conservation.
6.5. Nature et contenu de l'emballage extérieur
15 ml en flacon pulvérisateur (PE) de 120 pulvérisations avec pompe doseuse et embout nasal.
6.6. Précautions particulières d’élimination et de manipulation
· Agiter légèrement le flacon avant emploi.
· Lors du premier usage la pompe doit être amorcée par 5 pulvérisations. Inutilisée, celle-ci reste correctement amorcée pendant environ 2 semaines.
Au-delà, elle peut être réamorcée par 1 seule pulvérisation.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
157 avenue Charles de Gaulle
92200 Neuilly-sur-Seine
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 342 922 9 3 : 15 ml en flacon pulvérisateur (PE) de 120 pulvérisations avec pompe doseuse et embout nasal.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
CONDITIONS DE PRESCRIPTION ET DE DELIVRANCE
Liste I.
ANSM - Mis à jour le : 01/07/2023
NASACORT 55 microgrammes par dose, suspension pour pulvérisation nasale
Acétonide de triamcinolone
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que NASACORT 55 microgrammes par dose, suspension pour pulvérisation nasale et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser NASACORT 55 microgrammes par dose, suspension pour pulvérisation nasale ?
3. Comment utiliser NASACORT 55 microgrammes par dose, suspension pour pulvérisation nasale ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver NASACORT 55 microgrammes par dose, suspension pour pulvérisation nasale ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE NASACORT 55 microgrammes par dose, suspension pour pulvérisation nasale ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : GLUCOCORTICOÏDE PAR VOIE LOCALE.
(R : Système Respiratoire).
C’est un médicament anti-inflammatoire indiqué dans le traitement des symptômes de la rhinite allergique de l’adulte et de l’enfant âgé de 2 ans et plus.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER NASACORT 55 microgrammes par dose, suspension pour pulvérisation nasale ?
N’utilisez jamais NASACORT 55 microgrammes par dose, suspension pour pulvérisation nasale :
· si vous êtes allergique à la triamcinolone ou à l’un des autres composants contenus dans NASACORT 55 microgrammes par dose, suspension pour pulvérisation nasale, mentionnés à la rubrique 6.
· si vous saignez du nez,
· en cas d’herpès nasal, buccal ou oculaire,
· chez l’enfant de moins de 2 ans.
EN CAS DE DOUTE, IL EST INDISPENSABLE DE DEMANDER L’AVIS DE VOTRE MÉDECIN OU DE VOTRE PHARMACIEN.
Avertissements et précautions
Mises en garde spéciales
En cas de surinfection (mouchage purulent), de fièvre ou d’infection broncho-pulmonaire concomitante, prévenir votre médecin.
Les corticoïdes par voie nasale (comme NASACORT 55 microgrammes par dose, suspension pour pulvérisation nasale) peuvent :
· dans de rares cas, provoquer des effets indésirables systémiques (effets généraux indépendants de la voie d'administration) en particulier s'ils sont pris longtemps à fortes doses.
· lorsqu’ils sont pris longtemps, ralentir la croissance chez l’enfant et l’adolescent. Votre médecin vérifiera régulièrement la taille de votre enfant, et s’assurera que celui-ci prend la dose efficace la plus faible.
· lorsqu’ils sont pris longtemps ou à des doses élevées pendant longtemps, provoquer des effets secondaires en raison de l'absorption du médicament dans l'organisme (par exemple la production normale d'hormones stéroïdiennes peut être affectée). Ces effets secondaires sont beaucoup moins susceptibles de se produire avec les corticostéroïdes par voie nasale qu'avec les corticostéroïdes pris par voie orale (par exemple des comprimés). Parlez à votre médecin si vous ressentez des effets secondaires.
· entraîner des troubles oculaires comme un glaucome (augmentation de la pression à l’intérieur de l’œil), une cataracte (opacification du cristallin de l’œil),
Contactez votre médecin en cas de vision floue ou d’autres troubles visuels ou si vous avez déjà eu des troubles visuels liés à un glaucome ou à une cataracte ou si vous remarquez un changement de votre vision au cours d’un traitement par NASACORT 55 microgrammes par dose, suspension pour pulvérisation nasale.
Ce produit n’est pas recommandé chez les patients ayant subi récemment une intervention chirurgicale ou un traumatisme au niveau du nez, tant que la guérison n’est pas complète.
Population pédiatrique
Ce médicament ne doit pas être utilisé chez les enfants de moins de 2 ans.
Par ailleurs, il est fortement recommandé d’adresser le patient à un pédiatre, en particulier pour les enfants de moins de 6 ans.
Précautions d’emploi
Ce médicament est un traitement régulier. Son efficacité sur les symptômes peut n’apparaître que plusieurs jours après le début du traitement.
Pour que ce médicament soit actif, les fosses nasales doivent être libres. Il convient par conséquent de se moucher avant l’instillation du produit.
Si l’obstruction nasale (sensation de nez bouché) persiste malgré la mise en route du traitement, consultez votre médecin afin qu’il réévalue le traitement.
En cas de traitement prolongé, un examen ORL détaillé de la muqueuse nasale doit être réalisé régulièrement.
EN CAS DE DOUTE NE PAS HÉSITER À DEMANDER L'AVIS DE VOTRE MÉDECIN OU DE VOTRE PHARMACIEN.
Autres médicaments et NASACORT 55 microgrammes par dose, suspension pour pulvérisation nasale
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Certains médicaments peuvent augmenter les effets de NASACORT 55 microgrammes par dose, suspension pour pulvérisation nasale et il est possible que votre médecin souhaite vous surveiller attentivement si vous prenez ces médicaments (y compris certains médicaments pour traiter l’infection à VIH : ritonavir, cobicistat).
Ce médicament ne peut être utilisé pendant la grossesse que sur les conseils de votre médecin.
Si vous découvrez que vous êtes enceinte pendant le traitement, consultez votre médecin car lui seul peut juger du traitement le mieux adapté à votre cas.
Ce médicament peut être administré en cure courte pendant l’allaitement.
En cas de traitement prolongé, il est préférable d’éviter l’allaitement pendant ce traitement.
D’une façon générale, il convient, au cours de la grossesse et de l’allaitement, de toujours demander avis à votre médecin ou à votre pharmacien avant de prendre un médicament.
Sportifs
Sportifs, attention, cette spécialité contient un principe actif pouvant induire une réaction positive des tests pratiqués lors de contrôles antidopage.
NASACORT 55 microgrammes par dose, suspension pour pulvérisation nasale contient du chlorure de benzalkonium.
Ce médicament contient 15 microgrammes de chlorure de benzalkonium par dose.
En raison de la présence de chlorure de benzalkonium, ce médicament peut provoquer une gêne respiratoire et des irritations ou un gonflement à l’intérieur du nez, surtout s’il est utilisé sur une longue période.
3. COMMENT UTILISER NASACORT 55 microgrammes par dose, suspension pour pulvérisation nasale ?
Adultes :
· La dose initiale recommandée est de 220 microgrammes par jour, soit 2 pulvérisations dans chaque narine, 1 fois par jour le matin. Une fois l’amélioration des symptômes obtenue, la posologie peut être diminuée à une dose de 110 microgrammes par jour (1 pulvérisation dans chaque narine 1 fois par jour).
Enfants âgés de 12 ans et plus :
· La dose initiale recommandée est de 220 microgrammes par jour, soit 2 pulvérisations dans chaque narine, 1 fois par jour le matin. Une fois l’amélioration des symptômes obtenue, la posologie peut être diminuée à une dose de 110 microgrammes par jour (1 pulvérisation dans chaque narine 1 fois par jour).
Enfants âgés de 6 à 12 ans :
· La dose recommandée est de 110 microgrammes par jour, soit 1 pulvérisation dans chaque narine, 1 fois par jour le matin. Pour les enfants présentant des symptômes sévères, il faut consulter votre médecin.
Enfants âgés de 2 à 5 ans :
· La dose habituelle et maximale est 1 pulvérisation dans chaque narine par jour le matin.
La mise en route et la durée du traitement sont fonction de l’exposition à l’allergène.
Ne pas utiliser NASACORT pour une durée de plus de 3 mois chez l'enfant de moins de 12 ans.
Un adulte doit aider le jeune enfant à utiliser ce médicament
En cas de persistance des troubles, ne pas augmenter la dose, mais consulter votre médecin.
DANS TOUS LES CAS SE CONFORMER À L’ORDONNANCE DE VOTRE MÉDECIN.
Mode d’administration
Voie nasale.
|
|
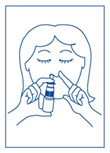
1. Se moucher avant la prise. |
|
|
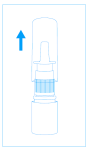
2. Retirer le capuchon de protection du flacon. |
|
|
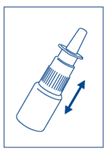
3. Agiter légèrement le flacon avant emploi. |
|
|
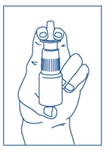
4. Lors du premier usage, la pompe doit être amorcée par 5 pulvérisations. Inutilisée, celle-ci reste correctement amorcée pendant environ 2 semaines. Au-delà, elle peut être réamorcée par une seule pulvérisation. |
|
|
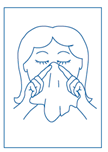
5. Boucher une narine. Insérer l’applicateur nasal dans l’autre narine, le flacon étant toujours en position verticale. Selon la posologie, appuyer 1 ou 2 fois de haut en bas sur la collerette pour libérer 1 ou 2 pulvérisations en inspirant par cette narine. Répéter cette opération pour l’autre narine. |
|
|
6. Essuyer l’applicateur nasal. 7. Remettre le capuchon protecteur sur le flacon. |
Fréquence et moments auxquels le médicament doit être administré
Ce médicament doit être administré une fois par jour le matin.
DANS TOUS LES CAS SE CONFORMER À L’ORDONNANCE DE VOTRE MÉDECIN.
Durée du traitement
DANS TOUS LES CAS SE CONFORMER À L’ORDONNANCE DE VOTRE MÉDECIN.
Si vous avez utilisé plus de NASACORT 55 microgrammes par dose, suspension pour pulvérisation nasale que vous n’auriez dû
Dans tous les cas, se conformer à l'ordonnance de votre médecin. Ne pas augmenter ou diminuer la dose sans l'avis de votre médecin ou de votre pharmacien.
Si vous oubliez d’utiliser NASACORT 55 microgrammes par dose, suspension pour pulvérisation nasale
Si vous avez oublié d’utiliser ce médicament, ne faites pas de pulvérisations supplémentaires mais poursuivez votre traitement normalement.
Si vous arrêtez d’utiliser NASACORT 55 microgrammes par dose, suspension pour pulvérisation nasale
Suite à une utilisation prolongée, si vous ressentez des effets secondaires (symptômes de sevrage) après avoir arrêté soudainement de prendre ce médicament parlez-en à votre médecin. Voir section 4 « QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ? » pour plus d'informations.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
Fréquent (peut affecter jusqu’à une personne sur 10)
· saignement de nez,
· maux de tête,
· rhinite,
· toux,
· syndrome grippal,
· anomalies dentaires
Très rare (affecte moins d’une personne sur 10 000)
· cataracte (opacification du cristallin de l’œil),
· glaucome (augmentation de la pression à l’intérieur de l’œil).
Fréquence inconnue (ne peut être estimée sur la base des données disponibles)
· irritation de la gorge, irritation ou sensation de brûlure nasale, sécheresse des muqueuses nasales et oropharayngées, éternuements, congestion nasale, dyspnée (difficultés à respirer),
· altération du goût et de l’odorat, dyspepsie (difficulté pour digérer), nausées,
· insomnie, sensation de fatigue,
· vision floue (voir rubrique 2 « Avertissement et précautions »),
· choriorétinopathie (maladie de la rétine),
· prurit (démangeaisons), réaction allergique, rash cutanée (éruption cutanée),
· baisse du taux de cortisol sanguin,
· l'arrêt soudain des corticostéroïdes après une utilisation prolongée peut entraîner des symptômes de sevrage tels que des douleurs articulaires, des douleurs musculaires, des tremblements, une perte de poids, de l'anxiété, un écoulement nasal et des saignements du nez. Cependant, ces symptômes sont extrêmement rares avec les corticostéroïdes par voie nasale, et beaucoup moins susceptibles de se produire avec les corticostéroïdes par voie nasale qu'avec les corticostéroïdes pris par voie orale (par exemple des comprimés).
· une candidose du nez ou de la gorge (infection due à certains champignons microscopiques) peut parfois apparaître. Il conviendra alors d’interrompre le traitement et d’envisager un traitement adapté. Consultez votre médecin afin qu’il envisage avec vous un traitement adapté. Dans ce cas, il est préférable d’interrompre le traitement corticoïde jusqu’à guérison de la candidose.
Dans de rares cas, les corticoïdes par voie nasale (comme NASACORT 55 microgrammes par dose, suspension pour pulvérisation nasale) peuvent provoquer des effets indésirables systémiques (effets qui apparaissent dans l’organisme en un site distant du lieu d’administration), en particulier s'ils sont pris longtemps à de fortes doses (voir rubrique 2 « Avertissement et précautions »).
En cas de persistance des symptômes ou d’apparition de nouveaux symptômes, consulter votre médecin.
EN CAS DE DOUTE NE PAS HÉSITER À DEMANDER L'AVIS DE VOTRE MÉDECIN OU DE VOTRE PHARMACIEN.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER NASACORT 55 microgrammes par dose, suspension pour pulvérisation nasale ?
Tenir ce médicament hors de la vue et de la portée des enfants.
Ne pas dépasser la date limite d’utilisation figurant sur le conditionnement extérieur.
Pas de conditions particulières de conservation.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient NASACORT 55 microgrammes par dose, suspension pour pulvérisation nasale
· La substance active est :
Triamcinolone (acétonide)................................................................................ 55 microgrammes
Pour une dose
· Les autres composants sont :
Édétate disodique, glucose anhydre, cellulose microcristalline et carmellose sodique (AVICEL CL 611), polysorbate 80, chlorure de benzalkonium, acide chlorhydrique dilué, hydroxyde de sodium, eau purifiée.
Un flacon correspond à 120 pulvérisations. Une pulvérisation de 100 milligrammes correspond à une dose de 55 microgrammes d'acétonide de triamcinolone.
Ce médicament se présente sous forme de suspension pour pulvérisation nasale.
Flacon pulvérisateur de 15 ml (120 pulvérisations) avec pompe doseuse et embout nasal.
Titulaire de l’autorisation de mise sur le marché
157 avenue Charles de Gaulle
92200 Neuilly-sur-Seine
Exploitant de l’autorisation de mise sur le marché
157 avenue Charles de Gaulle
92200 Neuilly-sur-Seine
30 A 36, AVENUE GUSTAVE EIFFEL
37100 TOURS
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).