
Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.
Pour plus d'information sur les pictogrammes, consultez l'aide.
FEBUXOSTAT ZENTIVA LAB agit en réduisant le taux d’acide urique dans le sang (uricémie). Le maintien de l’uricémie à un niveau bas, grâce à la prise quotidienne de FEBUXOSTAT ZENTIVA LAB, permet d’arrêter l'accumulation de cristaux et de réduire progressivement les symptômes. Le maintien d’une uricémie suffisamment basse pendant une durée suffisamment longue peut également permettre une diminution de la taille des tophi.
FEBUXOSTAT ZENTIVA LAB à 120 mg est aussi utilisé pour traiter et éviter une élévation du taux sanguin d’acide urique, qui peut apparaître quand on commence à recevoir une chimiothérapie pour traiter les cancers du sang.
Quand on reçoit une chimiothérapie, les cellules cancéreuses sont détruites, et par conséquent le taux d’acide urique augmente dans le sang, à moins que l’on empêche la formation d’acide urique.
FEBUXOSTAT ZENTIVA LAB est indiqué chez l’adulte.
Ce médicament appartient au(x) groupe(s) générique(s) suivants :
 Comprimé (Composition pour un comprimé)
Comprimé (Composition pour un comprimé)
 120 mg
120 mg
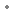 sous forme de : fébuxostat hémihydraté
sous forme de : fébuxostat hémihydraté Ce médicament étant un générique, le SMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |