Dernière mise à jour le 02/02/2026
GLIADEL 7,7 mg, implant
Présentations
> 8 sachet(s)-dose(s) aluminium de 1 implant(s)
Code CIP : 561 907-5 ou 34009 561 907 5 1
Déclaration de commercialisation : 13/09/1999
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
Autres informations
- Titulaire de l'autorisation : CLINIGEN HEALTHCARE B.V.
- Conditions de prescription et de délivrance :
- liste I
- médicament nécessitant une surveillance particulière pendant le traitement
- prescription réservée aux médecins compétents en CANCEROLOGIE
- prescription réservée aux spécialistes et services HEMATOLOGIE
- prescription réservée aux spécialistes et services NEUROCHIRURGIE
- prescription réservée aux spécialistes et services ONCOLOGIE MEDICALE
- réservé à l'usage HOSPITALIER
- Statut de l'autorisation : Valide
- Type de procédure : Procédure de reconnaissance mutuelle
- Code CIS : 6 775 826 9
ANSM - Mis à jour le : 21/10/2025
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque implant contient 7,7 mg de carmustine.
Pour la liste complète des excipients, voir rubrique 6.1.
Implant discoïde plat de couleur blanc cassé à jaune pâle.
Implant.
4.1. Indications thérapeutiques
GLIADEL Implant est indiqué en traitement d'appoint de la chirurgie chez les patients adultes atteints d’un glioblastome multiforme récurrent attesté histologiquement et pour lequel une résection chirurgicale est indiquée.
4.2. Posologie et mode d'administration
A usage intralésionnel uniquement.
Chaque implant GLIADEL contient 7,7 mg de carmustine, correspondant à une dose de 61,6 mg lorsque huit implants sont placés dans la cavité de résection tumorale.
Population pédiatrique
La sécurité et l’efficacité de GLIADEL Implant chez les enfants âgés de moins de 18 ans n’ont pas été établies. Aucune donnée n’est disponible.
Mode d’administration
Il est recommandé de placer au maximum huit implants si la taille et la forme de la cavité de résection le permettent. Les implants cassés en deux peuvent être utilisés mais ceux qui sont cassés en plus de deux morceaux doivent être jetés dans les conteneurs réservés aux déchets à risques biologiques (voir rubrique 6.6).
Il est recommandé de placer les implants directement de l'emballage stérile intérieur du produit à la cavité de résection. Il est possible de placer de la cellulose régénérée oxydée sur les implants pour les fixer à la surface de la cavité (voir rubrique 6.6).
Hypersensibilité à la substance active carmustine ou à l’un des excipients de GLIADEL.
4.4. Mises en garde spéciales et précautions d'emploi
Des modifications de la paroi des vaisseaux sanguins cérébraux situés à proximité des implants Gliadel, notamment des cas d’anévrisme entraînant une hémorragie cérébrale plusieurs mois après la mise en place des implants GLIADEL, ont été décrites. La mise en place des implants GLIADEL à proximité des gros vaisseaux cérébraux doit être évitée.
Le développement d'un œdème cérébral avec effet de masse (dû à une récurrence tumorale, une infection intracrânienne ou une nécrose) peut nécessiter une nouvelle intervention, et dans certains cas, le retrait de GLIADEL Implant ou de ses résidus.
Il faut éviter la communication entre la cavité de résection chirurgicale et le système ventriculaire afin d’empêcher la migration des implants dans le système ventriculaire et d’éviter la survenue éventuelle d'une hydrocéphalie occlusive. S'il existe une voie de communication dont la taille dépasse celle du diamètre de l'implant, celle-ci doit être fermée avant la pose de GLIADEL Implant.
Des examens par tomodensitométrie et imagerie par résonance magnétique peuvent montrer une amplification au niveau du tissu cérébral entourant la cavité de résection après la mise en place des implants GLIADEL. Cette amplification peut représenter un œdème ou une inflammation provoqués par les implants GLIADEL ou par la progression tumorale.
Les femmes en âge de procréer doivent utiliser une contraception efficace pendant au moins 6 mois après l’insertion de GLIADEL Implant.
Il est recommandé que les patients de sexe masculin ayant une partenaire en âge de procréer utilisent une contraception efficace pendant au moins 90 jours après l’insertion de GLIADEL Implant.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Les interactions des implants GLIADEL avec d'autres médicaments ou chimiothérapie n'ont pas été formellement évaluées.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n'existe pas d'études sur GLIADEL Implant chez la femme enceinte ni d'études évaluant la toxicité de GLIADEL Implant sur la reproduction. La carmustine, le principe actif de GLIADEL Implant, en administration systémique, peut exercer des effets génotoxiques et peut nuire au développement fœtal. (voir rubrique 5.3). Par conséquent, GLIADEL Implant n’est pas recommandé pendant la grossesse et chez les femmes en âge de procréer n’utilisant pas de contraception. Les femmes en âge de procréer doivent utiliser une contraception efficace pendant au moins 6 mois après l’insertion de GLIADEL Implant.
Il est recommandé que les patients de sexe masculin ayant une partenaire en âge de procréer utilisent une contraception efficace pendant au moins 90 jours après l’insertion de GLIADEL Implant. Si l’emploi de GLIADEL Implant est malgré tout jugé nécessaire au cours d’une grossesse, la patiente doit être informée du risque potentiel pour le fœtus. En cas de grossesse survenant après l’insertion de GLIADEL Implant, il convient d’avoir recours à une consultation génétique.
Il n'y a pas de données sur le passage de GLIADEL Implant dans le lait maternel. Compte tenu du fait que certains médicaments sont excrétés dans le lait maternel et en raison du risque potentiel d'effets secondaires sérieux liés à la carmustine chez les nourrissons, l'allaitement est contre-indiqué.
Fertilité
Aucune étude sur les troubles de la fertilité n’a été réalisée avec GLIADEL Implants.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Le spectre des effets indésirables observés chez les patients souffrant de gliome malin de haut grade nouvellement diagnostiqué et de gliome malin récurrent correspondait généralement à celui rencontré chez les patients subissant une craniotomie pour le traitement de gliomes malins.
La liste des effets indésirables très fréquents (³ 1/10), fréquents (³ 1/100 à < 1/10) et peu fréquents (³ 1/1 000 à <1/100) notifiés chez les patients ayant reçu l’implant GLIADEL au cours des études cliniques figure ci-dessous.
Au sein de chaque fréquence de groupe, les effets indésirables doivent être présentés suivant un ordre décroissant de gravité.
Première intervention chirurgicale
Les données suivantes représentent les effets indésirables les plus fréquents observés chez 5 % ou plus des patients souffrant de gliome malin nouvellement diagnostiqué, recevant GLIADEL Implant pendant l'étude.
Effets indésirables fréquents observés chez > 5 % des patients recevant GLIADEL Implant lors de la première intervention chirurgicale
|
Classification par discipline médicale |
Effets indésirables |
|||
|
Affections endocriniennes |
fréquent |
Diabète sucré |
||
|
Affections psychiatriques |
très fréquent |
Dépression |
||
|
fréquent |
Trouble de la personnalité, anxiété, pensées anormales, hallucinations, insomnie |
|||
|
Affections du système nerveux |
très fréquent |
Hémiplégie, convulsion, confusion, œdème cérébral, aphasie, somnolence, troubles de l'élocution |
||
|
|
fréquent |
Amnésie, augmentation de la pression intracrânienne, trouble de la personnalité, anxiété, paralysie faciale, neuropathie, ataxie, hypoesthésie, paresthésies, pensées anormales, démarche anormale, étourdissements, crise d'épilepsie généralisée tonico-clonique, hallucinations, insomnie, tremblements |
||
|
Affections oculaires |
fréquent |
Œdème conjonctival, vision anormale, trouble du champ visuel |
||
|
Affections vasculaires |
très fréquent |
Thrombophlébite |
|
|
|
fréquent |
Hémorragie |
|
||
|
Affections respiratoires, thoraciques et médiastinales |
fréquent |
Embolie pulmonaire |
|
|
|
Infections et infestations |
fréquent |
Pneumonie |
|
|
|
Affections gastro-intestinales |
très fréquent |
Nausées, vomissements, constipation |
|
|
|
fréquent |
Diarrhée |
|
||
|
Affections de la peau et du tissu sous-cutané
|
très fréquent |
Éruption cutanée, alopécie |
|
|
|
Affections des reins et des voies urinaires |
fréquent |
Infection des voies urinaires, incontinence urinaire |
|
|
|
Troubles généraux et anomalies au site d’administration |
très fréquent |
Réaction d’aggravation, maux de tête, asthénie, infection, fièvre, douleur, cicatrisation anormale |
|
|
|
fréquent |
Douleur abdominale, douleur dorsale, œdème facial, douleur thoracique, abcès, lésion accidentelle, œdème périphérique |
|
||
Une hypertension intracrânienne a été observée plus fréquemment chez les patients traités par GLIADEL Implant que chez ceux recevant un placebo (9,2 % contre 1,7 %). Elle a été observée en général tardivement, au moment de la récurrence de la tumeur et il est peu probable qu'elle soit associée à l'utilisation de GLIADEL Implant (voir rubrique 4.4).
Des fuites du LCR étaient plus fréquentes chez les patients traités par GLIADEL Implant que chez ceux recevant un placebo. Toutefois, le nombre d'infections intracrâniennes et d'autres anomalies de la cicatrisation n'était pas accru (voir rubrique 4.4).
Intervention chirurgicale récurrente
Les effets indésirables post-opératoires suivants ont été observés chez 4 % ou plus des 110 patients recevant GLIADEL Implant lors d'une intervention chirurgicale récurrente au cours d'une étude clinique contrôlée contre placebo. A l’exception des effets sur le système nerveux qui ont pu être provoqués par les implants placebo, seuls des évènements plus fréquents concernant le groupe traité par GLIADEL Implant sont énumérés. Ces effets indésirables étaient soit absents avant l’opération soit ont empirés après l'intervention pendant la période de suivi qui s'est prolongée sur une durée allant jusqu'à 71 mois.
Effets indésirables fréquents survenus chez ≥4 % des patients recevant GLIADEL Implant lors d’une intervention chirurgicale récurrente
|
Classification par discipline médicale |
Effets indésirables |
|
|
Affections hématologiques et du système lymphatique |
fréquent |
Anémie |
|
Troubles du métabolisme et de la nutrition |
fréquent |
Hyponatrémie |
|
Affections du système nerveux |
très fréquent |
Convulsion, hémiplégie, maux de tête, somnolence, confusion |
|
fréquent |
Aphasie, stupeur, œdème cérébral, augmentation de la pression intracrânienne, méningite ou abcès |
|
|
Affections vasculaires |
fréquent |
Thrombophlébite |
|
Affections respiratoires, thoraciques et médiastinales |
fréquent |
Embolie pulmonaire |
|
Infections et infestations |
fréquent |
Pneumonie, candidose orale |
|
Affections gastro-intestinales |
fréquent |
Nausées, vomissements, |
|
Affections de la peau et du tissu sous-cutané |
fréquent |
Éruption cutanée |
|
Affections du rein et des voies urinaires |
très fréquent |
Infection des voies urinaires |
|
Troubles généraux et anomalies au site d'administration |
très fréquent |
Fièvre, cicatrisation anormale |
|
fréquent |
Infection, douleur |
|
Les effets indésirables suivants, non énumérés dans le tableau ci-dessus, ont été rapportés dans toutes les études chez des patients traités par GLIADEL Implant. Les effets énumérés soit étaient absents avant l’opération soit ont empirés après l'intervention. Il n’est pas possible de déterminer si ces évènements sont dus à GLIADEL Implant.
Effets indésirables chez les patients recevant GLIADEL Implant
|
Classification par discipline médicale |
Évènements indésirables |
|
|
Affections hématologiques et du système lymphatique |
fréquent |
Thrombocytopénie, leucocytose |
|
Troubles du métabolisme et de la nutrition |
fréquent |
Hyponatrémie, hyperglycémie, hypokaliémie |
|
Affections du système nerveux |
fréquent |
Hydrocéphalie, ataxie, étourdissements, hémiplégie, coma, amnésie, diplopie, |
|
peu fréquent |
hémorragie cérébrale, infarctus cérébral |
|
|
Affections psychiatriques |
fréquent |
Dépression, pensées anormales, insomnie, réaction paranoïaque |
|
Affections oculaires |
fréquent |
Défaut de la vision, douleur oculaire |
|
Affections cardiaques et vasculaires |
fréquent |
Hypertension, hypotension |
|
Affections respiratoires, thoraciques et médiastinales |
fréquent |
Infection, pneumonie par aspiration |
|
Affections gastro-intestinales |
fréquent |
Diarrhée, constipation, dysphagie, hémorragie gastro-intestinale, incontinence fécale |
|
Affections de la peau et du tissu sous-cutané |
fréquent |
Éruption cutanée |
|
Affections musculosquelettiques et du tissu conjonctif |
fréquent |
Infection |
|
Affections du rein et des voies urinaires |
fréquent |
Incontinence urinaire |
|
Troubles généraux et anomalies au site d'administration |
fréquent |
Œdème périphérique, douleur au cou, lésion accidentelle, douleur dorsale, réaction allergique, asthénie, douleur thoracique, septicémie |
|
Lésions, intoxications et complications liées aux procédures |
peu fréquent |
Pneumocéphale |
Des cas d’accumulation d’air au site d’implantation, parfois associée à des symptômes neurologiques (hémiplégie, aphasie, crises convulsives), ont été rapportés avec GLIADEL.
Les quatre catégories d’effets indésirables suivantes sont éventuellement liées au traitement par GLIADEL Implant.
Convulsions
Lors des essais en première intervention chirurgicale, l'incidence de convulsions au cours des 5 premiers jours suivant l'implantation des implants était de 2,5 % dans le groupe GLIADEL Implant.
Lors des essais en intervention chirurgicale récurrente, l'incidence de crises d'épilepsie post-opératoires était de 19 % chez les patients recevant GLIADEL Implant. 12/22 (54 %) des patients traités par GLIADEL Implant ont présenté une première crise d'épilepsie ou une aggravation de cette crise au cours des cinq premiers jours suivant l'opération. La période moyenne avant le début des premières crises post-opératoires ou de leur aggravation était de 3,5 jours chez les patients traités par GLIADEL Implant.
Œdème cérébral
Le développement d'un œdème cérébral avec effet de masse (dû à une récurrence de la tumeur, une infection intracrânienne ou une nécrose) peut nécessiter une nouvelle intervention et dans certains cas, le retrait de GLIADEL Implant ou de ses résidus (voir rubrique 4.4).
Anomalies de la cicatrisation
Les anomalies de cicatrisation suivantes ont été rapportées dans des essais cliniques sur GLIADEL Implant : déhiscence de la plaie, retard de cicatrisation, épanchement sous-dural, sous-galéal ou suintement de la plaie et fuite de liquide céphalo-rachidien.
Dans l'étude portant sur l'intervention initiale, des fuites du LCR sont survenues chez 5 % des patients traités par GLIADEL Implant. Pendant l'intervention chirurgicale, il est nécessaire d’obtenir une fermeture durale étanche pour minimiser le risque de fuite de liquide céphalorachidien (voir section 4.4).
Infection intracrânienne
Lors des essais en première intervention chirurgicale, l'incidence d'abcès cérébral ou de méningite était de 5 % chez les patients traités par GLIADEL Implant.
Pour l’intervention chirurgicale récurrente, l'incidence d'abcès cérébral ou de méningite était de 4 % chez les patients traités par GLIADEL Implant.
Dans une étude clinique publiée la formation de kyste après traitement par GLIADEL Implant survient chez 10 % des patients. Toutefois, la formation de kyste est possible après la résection d'un gliome malin.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : agents antinéoplasiques, code ATC : L01AD01
Données non cliniques
GLIADEL Implant délivre la carmustine directement dans la cavité chirurgicale formée après la résection tumorale. Exposées à l’environnement aqueux de la cavité, les liaisons anhydrides du copolymère sont hydrolysées, libérant la carmustine, le carboxyphénoxypropane et l'acide sébacique. La carmustine libérée par GLIADEL Implant se diffuse dans les tissus cérébraux environnants et produit un effet anti-néoplasique par alkylation de l'ADN et de l'ARN.
La carmustine est spontanément dégradée et métabolisée. La fraction alkylante ainsi produite et qui est vraisemblablement l'ion chloroéthyl-carbonium, entraîne la formation de réticulations d'ADN irréversibles.
L'activité antinéoplasique de GLIADEL Implant dépend de la libération de la carmustine dans la cavité tumorale en concentrations suffisantes pour entraîner une cytotoxicité efficace.
Plus de 70 % du copolymère se dégradent dans les trois semaines. Le comportement métabolique et l'excrétion des monomères diffèrent. Chez l'animal, le carboxyphénoxypropane est principalement éliminé par les reins et l'acide sébacique, un acide gras endogène, est métabolisé par le foie et rejeté sous la forme de CO2 .
Données cliniques
Première intervention chirurgicale
Dans une étude randomisée, en double aveugle, contrôlée contre placebo chez 240 adultes présentant un gliome malin de haut grade nouvellement diagnostiqué et ayant subi une craniotomie initiale pour une résection tumorale, le taux de survie moyen a augmenté de 11,6 mois sous placebo à 13,9 mois avec GLIADEL Implant (valeur p 0,079, test des rangs logarithmiques non stratifiés) dans la phase d'étude d'origine. Dans cette étude, le type de tumeur le plus courant était le glioblastome multiforme (GBM) (n=207), suivi par l'oligoastrocytome anaplasique (n=11), l'oligodendrogliome anaplasique (n=11), et l'astrocytome anaplasique (n=2). La proportion du risque de GLIADEL Implant était de 0,77 (IC 95 % : 0,57 – 1,03). Au cours de la phase de suivi à long terme, les patients toujours en vie à l'issue de la phase initiale ont été suivis pendant une durée allant jusqu'à au moins trois ans ou jusqu'au décès.
Le taux de survie moyen a augmenté de 11,6 mois sous placebo à 13,9 mois avec GLIADEL Implant (valeur p <0,05, test des rangs logarithmiques). La proportion du risque pour le traitement par GLIADEL Implant était de 0,73 (IC 95% : 0,56-0,95).
Intervention chirurgicale récurrente
Dans une étude clinique randomisée, en double aveugle, avec contrôle contre placebo chez 145 adultes présentant un glioblastome récurrent (GBM), GLIADEL Implant a prolongé le taux de survie chez ces patients. Quatre-vingt-quinze pour cent des patients traités par GLIADEL Implant ont reçu 7 à 8 implants.
Le taux de survie sur six mois était de 36 % (26/73) sous placebo contre 56 % (40/72) sous traitement par GLIADEL Implant. Le taux de survie moyen des patients présentant un GBM est de 20 semaines sous placebo contre 28 semaines sous traitement GLIADEL Implant.
5.2. Propriétés pharmacocinétiques
Après une perfusion intraveineuse de carmustine à des doses de l'ordre de 30 à 170 mg/m2, la demi-vie terminale moyenne, la clairance et le volume d'équilibre de la distribution sont respectivement de 22 minutes, 56 mL/min/kg, et 3,25 L/kg. Environ 60 % de la dose intraveineuse de 200 mg/m2 du produit marqué au C14 sont éliminés dans l'urine sur 96 heures, et 6 % sont éliminés sous forme de CO2.
Les implants GLIADEL sont biodégradables dans le cerveau humain lorsqu'ils sont placés dans la cavité après résection tumorale. Le taux de biodégradabilité varie d'un patient à l'autre. Pendant le processus de biodégradabilité, un résidu d'implant peut être observé sur les tomodensitogrammes cérébraux ou lors de nouvelles opérations, même en cas de dégradation majeure de tous les composants.
5.3. Données de sécurité préclinique
La carmustine, principe actif des implants GLIADEL, en administration systémique, a des effets embryotoxiques, tératogènes, génotoxiques et carcinogènes et peut provoquer une dégénérescence testiculaire sur plusieurs modèles animaux.
6.4. Précautions particulières de conservation
A conserver dans un congélateur à une température inférieure ou égale à -20°C.
Les sachets extérieurs non ouverts peuvent être conservés à une température ne dépassant pas 22°C pendant une durée maximale de six heures.
Le produit peut être recongelé une seule fois si les sachets n'ont pas été ouverts et conservés ensuite pendant une durée maximale de 6 heures à une température ne dépassant pas 22°C. Après recongélation, le produit doit être utilisé dans les 30 jours
6.5. Nature et contenu de l'emballage extérieur
GLIADEL Implants est livré dans une boîte contenant huit implants. Chaque implant est conditionné individuellement dans deux sachets d'aluminium laminé.
6.6. Précautions particulières d’élimination et de manipulation
Les implants doivent être manipulés par un personnel portant des gants chirurgicaux compte tenu du fait que l'exposition à la carmustine peut provoquer des brûlures sévères et une hyperpigmentation cutanée. Il est recommandé de porter deux paires de gants, les gants extérieurs devant être jetés après utilisation dans un conteneur réservé aux déchets présentant un risque biologique. Un instrument chirurgical réservé à la manipulation des implants doit être utilisé pour leur mise en place. Si l’intervention neurochirurgicale doit être renouvelée, tout implant ou reste d'implant doit être manipulé comme un agent potentiellement cytotoxique. Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Les implants GLIADEL doivent être manipulés avec précaution. Les sachets contenant les implants GLIADEL doivent être apportés dans la salle d'opération et doivent rester fermés jusqu'au moment de leur mise en place dans la cavité de résection. Seule la surface extérieure du sachet externe n'est pas stérile. En cas de chute d’un implant, celui-ci doit impérativement être éliminé selon la procédure appropriée.
Instructions pour l'ouverture des sachets contenant l'implant :
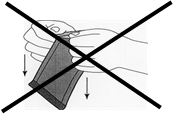
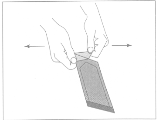
· Pour ouvrir le sachet extérieur, repérez le coin replié et tirez-le lentement dans un mouvement orienté vers l'extérieur. Ne pas tirer vers le bas afin de ne pas toucher le sachet avec les doigts, ce qui risquerait d’exercer une pression sur l’implant et provoquer sa rupture.
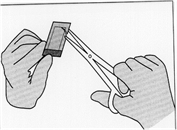
· Retirer le sachet intérieur en le saisissant à l'aide d'une pince en le tirant vers le haut.
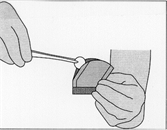
· Pour ouvrir le sachet intérieur, le tenir délicatement et découper en arc de cercle autour de l'implant.
· Pour retirer l'implant, le saisir délicatement à l'aide d’une pince et le placer directement dans la cavité de résection.
En cas de chute d’un implant, celui-ci doit impérativement être éliminé selon la procédure appropriée.
Une fois que la résection de la tumeur est réalisée, que la pathologie tumorale est confirmée, et que l'hémostase est obtenue, jusqu'à huit implants peuvent être placés de façon à couvrir la majeure partie de la cavité de résection. Un léger chevauchement des implants est acceptable. Les implants cassés en deux peuvent être utilisés mais ceux cassés en plus de deux morceaux doivent être éliminés dans les conteneurs réservés aux déchets présentant un risque biologique.
Il est possible de placer sur les implants de la cellulose régénérée oxydée pour les fixer à la surface de la cavité. Après la mise en place des implants, la cavité de résection doit être irriguée et la dure-mère refermée de manière étanche.
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur en matière de risque biologique.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
Schiphol Boulevard 359
WTC Schiphol Airport, D Tower 11th floor
1118BJ Schiphol
Pays-Bas
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 561 907 5 1: implant en sachet (aluminium; boite de 8).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste 1.
Médicament réservé à l’usage hospitalier. Prescription réservée aux spécialistes en oncologie, hématologie ou neurochirurgie, ou aux médecins compétents en cancérologie.
Médicament nécessitant une surveillance particulière pendant le traitement.
ANSM - Mis à jour le : 21/10/2025
Carmustine
Veuillez lire attentivement l'intégralité de cette notice avant de recevoir ce médicament car elle contient des informations importantes pour vous.
· Gardez cette notice, vous pourriez avoir besoin de la relire.
· Si vous avez toute autre question, si vous avez un doute, demandez plus d’informations à votre médecin ou à votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez jamais à quelqu’un d’autre, même en cas de symptômes identiques, cela pourrait lui être nocif.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que GLIADEL et dans quel cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d’utiliser GLIADEL ?
3. Comment utiliser GLIADEL ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver GLIADEL ?
6. Contenu de l’emballage et autres informations
1. QU’EST-CE QUE GLIADEL 7.7 mg Implant ET DANS QUELS CAS EST-IL UTILISE ?
Les implants GLIADEL peuvent être utilisés en combinaison avec des radiations pour le traitement de tumeurs cérébrales.
Il a été démontré que les implants GLIADEL prolongent la survie de patients atteints d’une tumeur cérébrale.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER GLIADEL 7.7 mg Implant ?
N’utilisez jamais GLIADEL 7.7 mg Implant
si vous êtes allergique (hypersensible) à la carmustine ou au polifeprosan 20.
Avertissements et précautions
Suite à l’intervention chirurgicale visant à retirer la tumeur cérébrale et insérer les implants GLIADEL, votre médecin et votre chirurgien vous surveilleront étroitement, étant donné les complications. Dans certains cas (complications ou récurrence de la tumeur), votre chirurgien devra réaliser une nouvelle intervention. Les complications incluent :
convulsions (crises épileptiques)
Infections du cerveau (infections dans le crâne)
Gonflement du cerveau dû à l’accumulation de liquide
Fuite de liquide céphalo-rachidien
Problèmes de cicatrisation de la plaie
Votre médecin vous surveillera étroitement si vous prenez des corticoïdes en raison du risque de gonflement ou de pression artérielle élevée dans le cerveau
Avant d’insérer les implants, votre médecin pourra avoir besoin de fermer un canal dans votre cerveau, afin d’éviter tout passage des implants dans ce canal, susceptible d’entraîner une accumulation de liquides dans le cerveau.
Après l’insertion des implants Gliadel, des examens par imagerie peuvent montrer un gonflement du cerveau lié à l’accumulation de liquide et une inflammation causée par les implants Gliadel ou une progression de la tumeur.
Autres médicaments et GLIADEL 7.7 mg Implant
Si vous prenez ou avez pris récemment un autre médicament, y compris un médicament obtenu sans ordonnance, parlez-en à votre médecin.
Grossesse et allaitement
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin avant de prendre ce médicament. GLIADEL n’a pas été étudié chez les femmes enceintes. Il a été démontré que la carmustine, la substance active, pouvait nuire au développement des enfants à naître. Les implants GLIADEL ne doivent pas être utilisés si vous êtes enceinte ou si vous allaitez. Il est recommandé que les femmes en âge de procréer utilisent une contraception efficace pendant 6 mois après l’insertion des implants GLIADEL. Les hommes ayant une partenaire en âge de procréer doivent utiliser une contraception pendant 90 jours après l’insertion des implants GLIADEL.
Conduite de véhicules et utilisation de machines
La conduite de véhicules et l’utilisation de machines ne sont pas recommandées après le traitement. Vérifiez auprès de votre médecin si vous pouvez conduire ou utiliser des outils ou des machines.
3. COMMENT UTILISER GLIADEL 7.7 mg Implant?
L’usage des implants GLIADEL est strictement réservé à l’adulte.
Le chirurgien ou le pharmacien s’assurera que le produit est disponible lors de l’opération. Après l’excision de la tumeur cérébrale, le chirurgien insèrera jusqu’à huit implants dans l’espace que la tumeur occupait. Votre chirurgien décidera combien d’implants doivent être insérés dans la cavité créée par le retrait de votre tumeur cérébrale. Les implants sont placés de manière à couvrir la tumeur le mieux possible. Après l’opération, les implants se dissolvent doucement en une durée de deux à trois semaines libérant ainsi la carmustine sur les cellules environnantes.
Si vous avez des questions supplémentaires quant à l’usage de ce médicament, adressez-vous à votre chirurgien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les effets indésirables qui ont été majoritairement observés durant les essais cliniques portant sur des gliomes (tumeur du cerveau) malins nouvellement diagnostiqués (120 patients) ou bien sur des gliomes malins récurrents (110 patients), sont présentés ci-dessous.
Les quatre catégories d’effets indésirables suivants sont possiblement liées à l’utilisation des implants GLIADEL:
1. Les convulsions (crises épileptiques) ont été très fréquentes. La plupart d’entre elles étaient d’intensité légère à modérée et ont eu lieu dans les 5 jours suivant l’opération chirurgicale.
2. Le gonflement du cerveau était très fréquent. Le gonflement du cerveau peut nécessiter une nouvelle opération chirurgicale soit pour enlever les implants, ou bien les restes de ceux-ci.
3. Des problèmes de cicatrisation légers à sévères de la plaie chirurgicale étaient très fréquents.
4. Des infections du cerveau (infection dans le crâne) telles que la méningite ou des abcès (concentration localisée de pus) étaient fréquentes.
Les effets indésirables qui suivent ont été observés durant les essais cliniques. Ils sont très similaires à ceux rencontrés sur des patients opérés pour une tumeur au cerveau sans l’usage d’implants GLIADEL.
Effets indésirables très fréquents (peuvent concerner plus d’1 patient sur 10)
Affections psychiatriques
Dépression
Affections du système nerveux
Faiblesse, spécialement d’un côté du corps; convulsion (spasmes); confusion; maux de tête ; gonflement du crâne; somnolence; problèmes d’élocution
Affections vasculaires
Inflammation vasculaire
Affections gastro-intestinales
Nausées; vomissements; constipation
Affections de la peau et du tissu sous-cutané
Eruption cutanée ; perte de cheveux
Affections du rein et des voies urinaires
Infection urinaire.
Troubles généraux et anomalies au site d’administration
Empirement des conditions générales; infection; mal de tête; fatigue; fièvre; douleur ; cicatrisation anormale (lente) de la plaie chirurgicale
Effets indésirables fréquents (peuvent concerner jusqu’à 1 patient sur 10)
Affections hématologiques et du système lymphatique
Réduction de la quantité de globules rouges ce qui peut rendre la peau pale et causer fatigue et essoufflements; réduction de la quantité de plaquettes sanguines ce qui augmente les risques de saignements; augmentation de la quantité de globules blancs.
Affections endocriniennes (problèmes hormonaux)
Diabète sucré (concentration anormalement haute de sucre dans le sang)
Troubles du métabolisme et de la nutrition
Œdème périphérique (excès de liquide dans les bras ou les jambes); faible concentration de sodium dans le sang ce qui engendrer fatigue et confusion, crispation des muscles, spasmes et coma ; glycémie élevée ; faible concentration de potassium dans le sang ce qui peut engendrer faiblesse musculaire, crispation ou un rythme cardiaque anormal.
Affections psychiatriques
Changements dans la personnalité ; anxiété excessive ; pensées anormales ; hallucinations ; insomnie (peu de sommeil ou sommeil de mauvaise qualité)
Affections du système nerveux
Amnésie (perte de mémoire); augmentation de la pression artérielle dans le crâne due à un excès de liquide; paralysie du visage; manque de coordination; insensibilité ; sensations de brûlure et de piqûres anormales; difficultés à marcher; vertiges; crise d’épilepsie (spasmes); tremblements ; méningite (inflammation à la tête) ; abcès (concentration localisée de pus); perte de conscience.
Affections oculaires
Vision trouble ou anormale; gonflement du contour des yeux; douleur des yeux
Affections vasculaires
Saignements ; tension artérielle élevée ou faible
Affections respiratoires, thoraciques et médiastinales
Infection des poumons ou pneumonie qui provoque de l’essoufflement, toux et augmentation de la température
Affections gastro-intestinales
Infection microbienne de la bouche; diarrhée; constipation; incontinence fécale (selles incontrôlées); difficultés à avaler; saignements dans l’estomac ou les intestins.
Affections de la peau et du tissu sous-cutané (tissu sous la peau)
Éruption cutanée
Affections musculo-squelettiques et systémiques
Infection générale
Affections du rein et des voies urinaires
Infection urinaire, incontinence urinaire
Troubles généraux et anomalies au site d’administration
Douleur abdominale, du dos et à la poitrine; gonflement du visage; abcès (concentration localisée de pus) ; blessure accidentelle; réaction allergique; douleur du cou et infection du système sanguin.
Effets indésirables peu fréquents (peuvent concerner entre 1 et 10 patients sur 1 000)
Lésions, intoxications et complications liées aux procédures
Pneumocéphale (accumulation d’air au site d’implantation)
Si vous remarquez des effets indésirables non mentionnés dans cette notice, ou si certains effets indésirables deviennent graves, veuillez en informer votre médecin ou votre pharmacien.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice.
Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER GLIADEL 7.7 mg Implant ?
Tenir hors de la vue et de la portée des enfants.
A conserver dans un congélateur à une température inférieure ou égale à -20°C.
Les sachets extérieurs non ouverts peuvent être conservés à une température ne dépassant pas 22°C pendant un maximum de six heures.
Le produit peut être recongelé une fois si les sachets n’ont pas été ouverts et conservés pendant un maximum de 6 heures à une température ne dépassant pas 22°C. Après la recongélation, le produit doit être utilisé dans les 30 jours.
Ne pas utiliser GLIADEL après la date de péremption figurant sur l’emballage extérieur et/ou le sachet. La date d’expiration fait référence au dernier jour du mois. Votre chirurgien ou le pharmacien de l’hôpital vérifieront la date d’expiration avant l’utilisation des implants.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient GLIADEL 7.7 mg Implant
· La substance active est la carmustine. Chaque implant contient 7,7 mg de carmustine.
· Les autres composants sont le polifeprosan 20.
Qu’est-ce que GLIADEL 7.7 mg Implant et contenu de l’emballage extérieur
Les implants GLIADEL sont disponibles en boîtes de huit hosties implantables. Ces hosties sont des implants discoïdes plats de couleur blanc cassé à jaune pâle Chaque hostie est emballée individuellement dans un sachet couvert d’une feuille d’aluminium.
Titulaire de l’autorisation de mise sur le marché
Schiphol Boulevard 359
WTC Schiphol Airport, D Tower 11th floor
1118BJ Schiphol
PAYS-BAS
Exploitant de l’autorisation de mise sur le marché
20 Avenue Rene Cassin
69009 Lyon
France
ALMAC PHARMA SERVICES (IRELAND) LIMITED
FINNABAIR INDUSTRIAL ESTATE,
DUNDALK
CO. LOUTH, A91 P9KD
IRELAND
Ou
ALMAC PHARMA SERVICES LIMITED
SEAGOE INDUSTRIAL ESTATE, PORTADOWN
CRAIGAVON, NORTHERN IRELAND, BT63 5UA
ROYAUME-UNI
Ou
CLINIGEN CLINICAL SUPPLIES MANAGMENT GMBH
AM KRONBERGER HANG 3
65824 SCHWALBACH AM TAUNUS
ALLEMAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé:
1. DENOMINATION DU MEDICAMENT
GLIADEL 7,7 mg Implant
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque implant contient 7,7 mg de carmustine.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Implant discoïde plat de couleur blanc cassé à jaune pâle.
Implant.
4. DONNEES CLINIQUES
4.1. Indications thérapeutiques
GLIADEL Implant est indiqué en traitement d'appoint de la chirurgie et de la radiothérapie chez les patients adultes présentant un gliome malin de haut grade nouvellement diagnostiqué.
GLIADEL Implant est indiqué en traitement d'appoint de la chirurgie chez les patients adultes atteints d’un glioblastome multiforme récurrent attesté histologiquement et pour lequel une résection chirurgicale est indiquée.
4.2. Posologie et mode d'administration
Posologie
A usage intralésionnel uniquement.
Chaque implant GLIADEL contient 7,7 mg de carmustine, correspondant à une dose de 61,6 mg lorsque huit implants sont placés dans la cavité de résection tumorale.
Population pédiatrique
La sécurité et l’efficacité de GLIADEL Implant chez les enfants âgés de moins de 18 ans n’ont pas été établies. Aucune donnée n’est disponible.
Mode d’administration
Il est recommandé de placer au maximum huit implants si la taille et la forme de la cavité de résection le permettent. Les implants cassés en deux peuvent être utilisés mais ceux qui sont cassés en plus de deux morceaux doivent être jetés dans les conteneurs réservés aux déchets à risques biologiques (voir rubrique 6.6).
Il est recommandé de placer les implants directement de l'emballage stérile intérieur du produit à la cavité de résection. Il est possible de placer de la cellulose régénérée oxydée sur les implants pour les fixer à la surface de la cavité (voir rubrique 6.6).
4.3. Contre-indications
Hypersensibilité à la substance active carmustine ou à l’un des excipients de GLIADEL.
4.4. Mises en garde spéciales et précautions d'emploi
Les patients subissant une craniotomie en raison d'un glioblastome et l’implantation de GLIADEL Implant doivent faire l'objet d’une surveillance étroite, étant donné les complications connues de la craniotomie, à savoir convulsions, infections intracrâniennes, cicatrisation anormale, œdème cérébral et pneumocéphale (voir rubrique 4.8). Des cas d’effet de masse intracérébrale non sensibles aux corticostéroïdes ont été décrits chez les patients traités par GLIADEL Implant, notamment un cas entraînant un engagement cérébral. Les patients traités par GLIADEL Implant doivent faire l'objet d'une surveillance attentive quant à la survenue d'œdème cérébral, d'hypertension intracrânienne suite à l'utilisation de stéroïdes (voir rubrique 4.8). Une fuite de liquide céphalo-rachidien (LCR) a été observée plus couramment chez les patients traités par GLIADEL Implant. La fermeture durale étanche et le soin des plaies locales doivent faire l'objet d'une attention particulière (voir rubrique 4.8).
Des modifications de la paroi des vaisseaux sanguins cérébraux situés à proximité des implants Gliadel, notamment des cas d’anévrisme entraînant une hémorragie cérébrale plusieurs mois après la mise en place des implants GLIADEL, ont été décrites. La mise en place des implants GLIADEL à proximité des gros vaisseaux cérébraux doit être évitée.
Le développement d'un œdème cérébral avec effet de masse (dû à une récurrence tumorale, une infection intracrânienne ou une nécrose) peut nécessiter une nouvelle intervention, et dans certains cas, le retrait de GLIADEL Implant ou de ses résidus.
Il faut éviter la communication entre la cavité de résection chirurgicale et le système ventriculaire afin d’empêcher la migration des implants dans le système ventriculaire et d’éviter la survenue éventuelle d'une hydrocéphalie occlusive. S'il existe une voie de communication dont la taille dépasse celle du diamètre de l'implant, celle-ci doit être fermée avant la pose de GLIADEL Implant.
Des examens par tomodensitométrie et imagerie par résonance magnétique peuvent montrer une amplification au niveau du tissu cérébral entourant la cavité de résection après la mise en place des implants GLIADEL. Cette amplification peut représenter un œdème ou une inflammation provoqués par les implants GLIADEL ou par la progression tumorale.
Les femmes en âge de procréer doivent utiliser une contraception efficace pendant au moins 6 mois après l’insertion de GLIADEL Implant.
Il est recommandé que les patients de sexe masculin ayant une partenaire en âge de procréer utilisent une contraception efficace pendant au moins 90 jours après l’insertion de GLIADEL Implant.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Les interactions des implants GLIADEL avec d'autres médicaments ou chimiothérapie n'ont pas été formellement évaluées.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n'existe pas d'études sur GLIADEL Implant chez la femme enceinte ni d'études évaluant la toxicité de GLIADEL Implant sur la reproduction. La carmustine, le principe actif de GLIADEL Implant, en administration systémique, peut exercer des effets génotoxiques et peut nuire au développement fœtal (voir rubrique 5.3).. Par conséquent, GLIADEL Implant n’est pas recommandé pendant la grossesse et chez les femmes en âge de procréer n’utilisant pas de contraception. Les femmes en âge de procréer doivent utiliser une contraception efficace pendant au moins 6 mois après l’insertion de GLIADEL Implant.
Il est recommandé que les patients de sexe masculin ayant une partenaire en âge de procréer utilisent une contraception efficace pendant au moins 90 jours après l’insertion de GLIADEL Implant. Si l’emploi de GLIADEL Implant est malgré tout jugé nécessaire au cours d’une grossesse, la patiente doit être informée du risque potentiel pour le fœtus. En cas de grossesse survenant après l’insertion de GLIADEL Implant, il convient d’avoir recours à une consultation génétique.
Allaitement
Il n'y a pas de données sur le passage de GLIADEL Implant dans le lait maternel. Compte tenu du fait que certains médicaments sont excrétés dans le lait maternel et en raison du risque potentiel d'effets secondaires sérieux liés à la carmustine chez les nourrissons, l'allaitement est contre-indiqué.
Fertilité
Aucune étude sur les troubles de la fertilité n’a été réalisée avec GLIADEL Implants.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
GLIADEL Implant n’a aucun effet sur l'aptitude à conduire des véhicules et à utiliser des machines. Toutefois, la craniotomie et GLIADEL Implant sont susceptibles d’entraîner des anomalies au niveau du système nerveux et de la vue. Par conséquent, il convient d’avertir les patients des effets possibles de ces évènements sur leur aptitude à conduire des véhicules ou à utiliser des machines.
4.8. Effets indésirables
Le spectre des effets indésirables observés chez les patients souffrant de gliome malin de haut grade nouvellement diagnostiqué et de gliome malin récurrent correspondait généralement à celui rencontré chez les patients subissant une craniotomie pour le traitement de gliomes malins.
La liste des effets indésirables très fréquents (³ 1/10), fréquents (³ 1/100 à < 1/10) et peu fréquents (³ 1/1 000 à <1/100) notifiés chez les patients ayant reçu l’implant GLIADEL au cours des études cliniques figure ci-dessous.
Au sein de chaque fréquence de groupe, les effets indésirables doivent être présentés suivant un ordre décroissant de gravité.
Première intervention chirurgicale
Les données suivantes représentent les effets indésirables les plus fréquents observés chez 5 % ou plus des patients souffrant de gliome malin nouvellement diagnostiqué, recevant GLIADEL Implant pendant l'étude.
Effets indésirables fréquents observés chez > 5 % des patients recevant GLIADEL Implant lors de la première intervention chirurgicale
|
Classification par discipline médicale |
Effets indésirables |
||||
|
Affections endocriniennes |
fréquent |
Diabète sucré |
|||
|
Affections psychiatriques |
très fréquent |
Dépression |
|||
|
fréquent |
Trouble de la personnalité, anxiété, pensées anormales, hallucinations, insomnie |
||||
|
Affections du système nerveux |
très fréquent |
Hémiplégie, convulsion, confusion, œdème cérébral, aphasie, somnolence, troubles de l'élocution |
|||
|
|
fréquent |
Amnésie, augmentation de la pression intracrânienne, trouble de la personnalité, anxiété, paralysie faciale, neuropathie, ataxie, hypoesthésie, paresthésies, pensées anormales, démarche anormale, étourdissements, crise d'épilepsie généralisée tonico-clonique, hallucinations, insomnie, tremblements |
|||
|
Affections oculaires |
fréquent |
Œdème conjonctival, vision anormale, trouble du champ visuel |
|||
|
Affections vasculaires |
très fréquent |
Thrombophlébite |
|
||
|
fréquent |
Hémorragie |
|
|||
|
Affections respiratoires, thoraciques et médiastinales |
fréquent |
Embolie pulmonaire |
|
||
|
Infections et infestations |
fréquent |
Pneumonie |
|
||
|
Affections gastro-intestinales |
très fréquent |
Nausées, vomissements, constipation |
|
||
|
fréquent |
Diarrhée |
|
|||
|
Affections de la peau et du tissu sous-cutané
|
très fréquent |
Éruption cutanée, alopécie |
|
||
|
Affections des reins et des voies urinaires |
fréquent |
Infection des voies urinaires, incontinence urinaire |
|
||
|
Troubles généraux et anomalies au site d’administration |
très fréquent |
Réaction d’aggravation, maux de tête, asthénie, infection, fièvre, douleur, cicatrisation anormale |
|
||
|
fréquent |
Douleur abdominale, douleur dorsale, œdème facial, douleur thoracique, abcès, lésion accidentelle, œdème périphérique |
|
|||
Une hypertension intracrânienne a été observée plus fréquemment chez les patients traités par GLIADEL Implant que chez ceux recevant un placebo (9,2 % contre 1,7 %). Elle a été observée en général tardivement, au moment de la récurrence de la tumeur et il est peu probable qu'elle soit associée à l'utilisation de GLIADEL Implant (voir rubrique 4.4).
Des fuites du LCR étaient plus fréquentes chez les patients traités par GLIADEL Implant que chez ceux recevant un placebo. Toutefois, le nombre d'infections intracrâniennes et d'autres anomalies de la cicatrisation n'était pas accru (voir rubrique 4.4).
Intervention chirurgicale récurrente
Les effets indésirables post-opératoires suivants ont été observés chez 4 % ou plus des 110 patients recevant GLIADEL Implant lors d'une intervention chirurgicale récurrente au cours d'une étude clinique contrôlée contre placebo. A l’exception des effets sur le système nerveux qui ont pu être provoqués par les implants placebo, seuls des évènements plus fréquents concernant le groupe traité par GLIADEL Implant sont énumérés. Ces effets indésirables étaient soit absents avant l’opération soit ont empirés après l'intervention pendant la période de suivi qui s'est prolongée sur une durée allant jusqu'à 71 mois.
Effets indésirables fréquents survenus chez ≥4 % des patients recevant GLIADEL Implant lors d’une intervention chirurgicale récurrente
|
Classification par discipline médicale |
Effets indésirables |
|
|
Affections hématologiques et du système lymphatique |
fréquent |
Anémie |
|
Troubles du métabolisme et de la nutrition |
fréquent |
Hyponatrémie |
|
Affections du système nerveux |
très fréquent |
Convulsion, hémiplégie, maux de tête, somnolence, confusion |
|
fréquent |
Aphasie, stupeur, œdème cérébral, augmentation de la pression intracrânienne, méningite ou abcès |
|
|
Affections vasculaires |
fréquent |
Thrombophlébite |
|
Affections respiratoires, thoraciques et médiastinales |
fréquent |
Embolie pulmonaire |
|
Infections et infestations |
fréquent |
Pneumonie, candidose orale |
|
Affections gastro-intestinales |
fréquent |
Nausées, vomissements, |
|
Affections de la peau et du tissu sous-cutané |
fréquent |
Éruption cutanée |
|
Affections du rein et des voies urinaires |
très fréquent |
Infection des voies urinaires |
|
Troubles généraux et anomalies au site d'administration |
très fréquent |
Fièvre, cicatrisation anormale |
|
fréquent |
Infection, douleur |
|
Les effets indésirables suivants, non énumérés dans le tableau ci-dessus, ont été rapportés dans toutes les études chez des patients traités par GLIADEL Implant. Les effets énumérés soit étaient absents avant l’opération soit ont empirés après l'intervention. Il n’est pas possible de déterminer si ces évènements sont dus à GLIADEL Implant.
Effets indésirables chez les patients recevant GLIADEL Implant
|
Classification par discipline médicale |
Évènements indésirables |
|
|
Affections hématologiques et du système lymphatique |
fréquent |
Thrombocytopénie, leucocytose |
|
Troubles du métabolisme et de la nutrition |
fréquent |
Hyponatrémie, hyperglycémie, hypokaliémie |
|
Affections du système nerveux |
fréquent |
Hydrocéphalie, ataxie, étourdissements, hémiplégie, coma, amnésie, diplopie, |
|
peu fréquent |
hémorragie cérébrale, infarctus cérébral |
|
|
Affections psychiatriques |
fréquent |
Dépression, pensées anormales, insomnie, réaction paranoïaque |
|
Affections oculaires |
fréquent |
Défaut de la vision, douleur oculaire |
|
Affections cardiaques et vasculaires |
fréquent |
Hypertension, hypotension |
|
Affections respiratoires, thoraciques et médiastinales |
fréquent |
Infection, pneumonie par aspiration |
|
Affections gastro-intestinales |
fréquent |
Diarrhée, constipation, dysphagie, hémorragie gastro-intestinale, incontinence fécale |
|
Affections de la peau et du tissu sous-cutané |
fréquent |
Éruption cutanée |
|
Affections musculosquelettiques et du tissu conjonctif |
fréquent |
Infection |
|
Affections du rein et des voies urinaires |
fréquent |
Incontinence urinaire |
|
Troubles généraux et anomalies au site d'administration |
fréquent |
Œdème périphérique, douleur au cou, lésion accidentelle, douleur dorsale, réaction allergique, asthénie, douleur thoracique, septicémie |
|
Lésions, intoxications et complications liées aux procédures |
peu fréquent |
Pneumocéphale |
Des cas d’accumulation d’air au site d’implantation, parfois associée à des symptômes neurologiques (hémiplégie, aphasie, crises convulsives), ont été rapportés avec GLIADEL.
Les quatre catégories d’effets indésirables suivantes sont éventuellement liées au traitement par GLIADEL Implant.
Convulsions
Lors des essais en première intervention chirurgicale, l'incidence de convulsions au cours des 5 premiers jours suivant l'implantation des implants était de 2,5 % dans le groupe GLIADEL Implant.
Lors des essais en intervention chirurgicale récurrente, l'incidence de crises d'épilepsie post-opératoires était de 19 % chez les patients recevant GLIADEL Implant. 12/22 (54 %) des patients traités par GLIADEL Implant ont présenté une première crise d'épilepsie ou une aggravation de cette crise au cours des cinq premiers jours suivant l'opération. La période moyenne avant le début des premières crises post-opératoires ou de leur aggravation était de 3,5 jours chez les patients traités par GLIADEL Implant.
Œdème cérébral
Le développement d'un œdème cérébral avec effet de masse (dû à une récurrence de la tumeur, une infection intracrânienne ou une nécrose) peut nécessiter une nouvelle intervention et dans certains cas, le retrait de GLIADEL Implant ou de ses résidus (voir rubrique 4.4).
Anomalies de la cicatrisation
Les anomalies de cicatrisation suivantes ont été rapportées dans des essais cliniques sur GLIADEL Implant : déhiscence de la plaie, retard de cicatrisation, épanchement sous-dural, sous-galéal ou suintement de la plaie et fuite de liquide céphalo-rachidien.
Dans l'étude portant sur l'intervention initiale, des fuites du LCR sont survenues chez 5 % des patients traités par GLIADEL Implant. Pendant l'intervention chirurgicale, il est nécessaire d’obtenir une fermeture durale étanche pour minimiser le risque de fuite de liquide céphalorachidien (voir section 4.4).
Infection intracrânienne
Lors des essais en première intervention chirurgicale, l'incidence d'abcès cérébral ou de méningite était de 5 % chez les patients traités par GLIADEL Implant.
Pour l’intervention chirurgicale récurrente, l'incidence d'abcès cérébral ou de méningite était de 4 % chez les patients traités par GLIADEL Implant.
Dans une étude clinique publiée la formation de kyste après traitement par GLIADEL Implant survient chez 10 % des patients. Toutefois, la formation de kyste est possible après la résection d'un gliome malin.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
4.9. Surdosage
Sans objet
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : agents antinéoplasiques, code ATC : L01AD01
Données non cliniques
GLIADEL Implant délivre la carmustine directement dans la cavité chirurgicale formée après la résection tumorale. Exposées à l’environnement aqueux de la cavité, les liaisons anhydrides du copolymère sont hydrolysées, libérant la carmustine, le carboxyphénoxypropane et l'acide sébacique. La carmustine libérée par GLIADEL Implant se diffuse dans les tissus cérébraux environnants et produit un effet anti-néoplasique par alkylation de l'ADN et de l'ARN.
La carmustine est spontanément dégradée et métabolisée. La fraction alkylante ainsi produite et qui est vraisemblablement l'ion chloroéthyl-carbonium, entraîne la formation de réticulations d'ADN irréversibles.
L'activité antinéoplasique de GLIADEL Implant dépend de la libération de la carmustine dans la cavité tumorale en concentrations suffisantes pour entraîner une cytotoxicité efficace.
Plus de 70 % du copolymère se dégradent dans les trois semaines. Le comportement métabolique et l'excrétion des monomères diffèrent. Chez l'animal, le carboxyphénoxypropane est principalement éliminé par les reins et l'acide sébacique, un acide gras endogène, est métabolisé par le foie et rejeté sous la forme de CO2 .
Données cliniques
Première intervention chirurgicale
Dans une étude randomisée, en double aveugle, contrôlée contre placebo chez 240 adultes présentant un gliome malin de haut grade nouvellement diagnostiqué et ayant subi une craniotomie initiale pour une résection tumorale, le taux de survie moyen a augmenté de 11,6 mois sous placebo à 13,9 mois avec GLIADEL Implant (valeur p 0,079, test des rangs logarithmiques non stratifiés) dans la phase d'étude d'origine. Dans cette étude, le type de tumeur le plus courant était le glioblastome multiforme (GBM) (n=207), suivi par l'oligoastrocytome anaplasique (n=11), l'oligodendrogliome anaplasique (n=11), et l'astrocytome anaplasique (n=2). La proportion du risque de GLIADEL Implant était de 0,77 (IC 95 % : 0,57 – 1,03). Au cours de la phase de suivi à long terme, les patients toujours en vie à l'issue de la phase initiale ont été suivis pendant une durée allant jusqu'à au moins trois ans ou jusqu'au décès. Le taux de survie moyen a augmenté de 11,6 mois sous placebo à 13,9 mois avec GLIADEL Implant (valeur p <0,05, test des rangs logarithmiques). La proportion du risque pour le traitement par GLIADEL Implant était de 0,73 (IC 95% : 0,56-0,95).
Intervention chirurgicale récurrente
Dans une étude clinique randomisée, en double aveugle, avec contrôle contre placebo chez 145 adultes présentant un glioblastome récurrent (GBM), GLIADEL Implant a prolongé le taux de survie chez ces patients. Quatre-vingt-quinze pour cent des patients traités par GLIADEL Implant ont reçu 7 à 8 implants.
Le taux de survie sur six mois était de 36 % (26/73) sous placebo contre 56 % (40/72) sous traitement par GLIADEL Implant. Le taux de survie moyen des patients présentant un GBM est de 20 semaines sous placebo contre 28 semaines sous traitement GLIADEL Implant.
5.2. Propriétés pharmacocinétiques
L'absorption, la distribution, le métabolisme et l'excrétion du copolymère chez l'Homme sont inconnus. Les concentrations de carmustine délivrées par GLIADEL Implant dans les tissus cérébraux humains n'ont pas été déterminées. Les taux de carmustine dans le plasma après implantation de GLIADEL Implant ne peuvent pas être évalués. Chez les lapins ayant reçu des implants contenant 3,85 % de carmustine, la carmustine n'a pas été détectée dans le sang ou dans le liquide céphalo-rachidien.
Après une perfusion intraveineuse de carmustine à des doses de l'ordre de 30 à 170 mg/m2, la demi-vie terminale moyenne, la clairance et le volume d'équilibre de la distribution sont respectivement de 22 minutes, 56 mL/min/kg, et 3,25 L/kg. Environ 60 % de la dose intraveineuse de 200 mg/m2 du produit marqué au C14 sont éliminés dans l'urine sur 96 heures, et 6 % sont éliminés sous forme de CO2.
Les implants GLIADEL sont biodégradables dans le cerveau humain lorsqu'ils sont placés dans la cavité après résection tumorale. Le taux de biodégradabilité varie d'un patient à l'autre. Pendant le processus de biodégradabilité, un résidu d'implant peut être observé sur les tomodensitogrammes cérébraux ou lors de nouvelles opérations, même en cas de dégradation majeure de tous les composants.
5.3. Données de sécurité préclinique
On ne dispose pas d'études sur la carcinogénicité, la mutagénicité, la toxicité embryo-fœtale, la toxicité pré- et post-natale, et l'effet sur la fertilité concernant GLIADEL Implants.
La carmustine, principe actif des implants GLIADEL, en administration systémique, a des effets embryotoxiques, tératogènes, génotoxiques et carcinogènes et peut provoquer une dégénérescence testiculaire sur plusieurs modèles animaux.
6. DONNEES PHARMACEUTIQUES
6.1. Liste des excipients
Polifeprosan 20.
6.2. Incompatibilités
Sans objet.
6.3. Durée de conservation
4 ans.
6.4. Précautions particulières de conservation
A conserver dans un congélateur à une température inférieure ou égale à -20°C.
Les sachets extérieurs non ouverts peuvent être conservés à une température ne dépassant pas 22°C pendant une durée maximale de six heures.
Le produit peut être recongelé une seule fois si les sachets n'ont pas été ouverts et conservés ensuite pendant une durée maximale de 6 heures à une température ne dépassant pas 22°C. Après recongélation, le produit doit être utilisé dans les 30 jours
6.5. Nature et contenu de l'emballage extérieur
GLIADEL Implants est livré dans une boîte contenant huit implants. Chaque implant est conditionné individuellement dans deux sachets d'aluminium laminé.
6.6. Précautions particulières d’élimination et de manipulation
Les implants doivent être manipulés par un personnel portant des gants chirurgicaux compte tenu du fait que l'exposition à la carmustine peut provoquer des brûlures sévères et une hyperpigmentation cutanée. Il est recommandé de porter deux paires de gants, les gants extérieurs devant être jetés après utilisation dans un conteneur réservé aux déchets présentant un risque biologique. Un instrument chirurgical réservé à la manipulation des implants doit être utilisé pour leur mise en place. Si l’intervention neurochirurgicale doit être renouvelée, tout implant ou reste d'implant doit être manipulé comme un agent potentiellement cytotoxique. Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Les implants GLIADEL doivent être manipulés avec précaution. Les sachets contenant les implants GLIADEL doivent être apportés dans la salle d'opération et doivent rester fermés jusqu'au moment de leur mise en place dans la cavité de résection. Seule la surface extérieure du sachet externe n'est pas stérile. En cas de chute d’un implant, celui-ci doit impérativement être éliminé selon la procédure appropriée.
Instructions pour l’ouverture des sachets contenant les implants:
|
Illustration 1: Pour ouvrir le sachet extérieur, repérez le coin replié et tirez-le lentement dans un mouvement orienté vers l'extérieur.
|
|
|
Illustration 2: Ne pas tirer vers le bas afin de ne pas toucher le sachet avec les doigts, ce qui risquerait d’exercer une pression sur l’implant et provoquer sa rupture.
|
|
|
Illustration 3: Retirer le sachet intérieur en le saisissant à l'aide d'une pince en le tirant vers le haut.
|
|
|
Illustration 4: Pour ouvrir le sachet intérieur, le tenir délicatement et découper en arc de cercle autour de l'implant
|
|
|
Illustration 5: Pour retirer l'implant, le saisir délicatement à l'aide d’une pince et le placer directement dans la cavité de résection.
|
|
En cas de chute d’un implant, celui-ci doit impérativement être éliminé selon la procédure appropriée.
Une fois que la résection de la tumeur est réalisée, que la pathologie tumorale est confirmée, et que l'hémostase est obtenue, jusqu'à huit implants peuvent être placés de façon à couvrir la majeure partie de la cavité de résection. Un léger chevauchement des implants est acceptable. Les implants cassés en deux peuvent être utilisés mais ceux cassés en plus de deux morceaux doivent être éliminés dans les conteneurs réservés aux déchets présentant un risque biologique.
Il est possible de placer sur les implants de la cellulose régénérée oxydée pour les fixer à la surface de la cavité. Après la mise en place des implants, la cavité de résection doit être irriguée et la dure-mère refermée de manière étanche.
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur en matière de risque biologique.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
Schiphol Boulevard 359
WTC Schiphol Airport, D Tower 11th floor
1118BJ Schiphol
PAYS-BAS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
34009 561 907 5 1: implant en sachet (aluminium; boite de 8).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]