Dernière mise à jour le 08/01/2026
SCYOVA 240 mg/mL + 12 mg/mL, solution pour perfusion
Indications thérapeutiques
Classe pharmacothérapeutique : Antiparkinsoniens, foslévodopa et inhibiteur de la décarboxylase, code ATC : N04BA07.
SCYOVA contient deux composants actifs, la foslévodopa et la foscarbidopa, et est utilisé pour traiter la maladie de Parkinson.
Comment agit SCYOVA 240 mg/mL + 12 mg/mL, solution pour perfusion ?
· Dans l’organisme, la foslévodopa est transformée en une substance appelée « dopamine ». Elle vient s’ajouter à la dopamine déjà présente dans votre cerveau et votre moelle épinière. La dopamine facilite la transmission des signaux entre les cellules nerveuses.
· Un déficit en dopamine provoque les signes de la maladie de Parkinson tels que les tremblements, la sensation de rigidité, le ralentissement des mouvements et les troubles de l’équilibre.
· Le traitement par foslévodopa augmente la quantité de dopamine dans votre organisme. Cela permet de réduire ces signes.
· La foscarbidopa améliore les effets de la foslévodopa. Elle permet également de réduire les effets indésirables liés à la foslévodopa.
Présentations
> 7 flacons en verre de 10 mL
Code CIP : 34009 302 790 8 3
Déclaration de commercialisation : 28/10/2024
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 519,34 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 520,36 €
- Taux de remboursement :65 %
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 10/01/2024 | Inscription (CT) | Le service médical rendu par SCYOVA (foslévodopa/foscarbidopa) 240 mg/mL + 12 mg/mL, solution pour perfusion est important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 10/01/2024 | Inscription (CT) | Compte-tenu : • de la démonstration de la supériorité uniquement versus lévodopa/carbidopa par voie orale après 12 semaines de traitement sur : • la variation de la durée moyenne quotidienne normalisée en état « on » sans dyskinésie gênante (critère de jugement principal) : 2,72 heures versus 0,97 heures, soit une différence moyenne de 1,75 heures (p=0,0083), • la variation de la durée moyenne normalisée en état « off » (critère de jugement secondaire clé) : -2,75 heures versus -0,96 heures, soit une différence moyenne de -1,79 heures (p=0,0054), • de l’absence de comparaison versus les traitements de deuxième intention de la maladie de Parkinson disponibles, notamment l’apomorphine en perfusion sous-cutanée continue, bien que celle-ci était possible, • de l’absence de démonstration sur la qualité de vie, faute de données robustes, • du profil de tolérance de la foslévodopa/foscarbidopa marqué par des événements indésirables spécifiques de type cutanés, la Commission considère que SCYOVA (foslévodopa/foscarbidopa) 240 mg/mL + 12 mg/mL, solution pour perfusion n’apporte pas d’amélioration du service médical rendu (ASMR V) dans la stratégie thérapeutique du traitement de la maladie de Parkinson à un stade avancé avec fluctuations motrices et hyperkinésie ou dyskinésie sévères et répondant à la lévodo-pa, lorsque les associations disponibles d’antiparkinsoniens n’ont pas donné de résultats satisfaisants. |
ANSM - Mis à jour le : 10/10/2025
SCYOVA 240 mg/mL + 12 mg/mL, solution pour perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Foscarbidopa........................................................................................................................ 12 mg
Pour 1 mL.
10 mL contient 2 400 mg de foslévodopa et 120 mg de foscarbidopa.
La foslévodopa et la foscarbidopa sont des prodrogues qui correspondent approximativement à 170 mg de lévodopa et 9 mg de carbidopa pour 1 mL.
Excipient à effet notoire :
SCYOVA contient environ 1,84 mmol (42,4 mg) de sodium par mL.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution pour perfusion (perfusion).
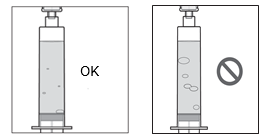
SCYOVA est une solution limpide à légèrement opalescente fournie dans un flacon en verre. La solution doit être exempte de particules. La couleur de SCYOVA peut varier d’incolore à jaune jusqu’ au brun et peut présenter une teinte violette ou rouge. Les changements de couleur sont attendus et n’ont aucun impact sur la qualité du produit. La solution peut prendre une couleur plus foncée après avoir percé le bouchon du flacon ou lorsque la solution est dans la seringue.
Le pH est approximativement égal à 7,4. L’osmolalité est comprise entre 2 200 et 2 500 mOsmol/kg, mais peut atteindre 2 700 mOsmol/kg.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
SCYOVA est administré par perfusion sous-cutanée continue, 24 heures sur 24.
Le débit de perfusion initial recommandé pour SCYOVA est déterminé en convertissant la prise de lévodopa pendant la journée en équivalents lévodopa (EL), puis en l’augmentant pour prendre en compte une administration sur 24 heures (voir Instauration du traitement). La dose peut être ajustée pour obtenir une réponse clinique qui maximise le temps « ON » fonctionnel et minimise le nombre et la durée des épisodes « OFF » et des épisodes « ON » avec dyskinésies gênantes. La dose quotidienne maximale recommandée de foslévodopa est de 6 000 mg (ou 25 mL de SCYOVA par jour, correspondant à environ 4 260 mg de lévodopa par jour).
SCYOVA remplace les médicaments contenant de la lévodopa et les inhibiteurs de la catéchol-O-méthyl-transférase (COMT). Si besoin, d’autres classes de médicaments pour traiter la maladie de Parkinson peuvent être prises de façon concomitante.
Instauration du traitement
Les patients sélectionnés pour le traitement par SCYOVA doivent être capables de comprendre et d’utiliser le système d’administration eux-mêmes ou avec l’aide d’un aidant.
Les patients doivent être formés à l’utilisation correcte de SCYOVA et du système d’administration (voir Mode d’administration) avant l’instauration du traitement par SCYOVA et par la suite, si nécessaire.
Trois étapes sont requises pour instaurer le traitement par SCYOVA.
· Etape 1 : Calculer les EL en fonction des médicaments contenant de la lévodopa utilisés pendant la période d’éveil du patient.
· Etape 2 : Déterminer le débit horaire de perfusion de SCYOVA.
· Etape 3 : Déterminer le volume de la dose de charge.
Etape 1 : Calculer les EL en fonction des médicaments contenant de la lévodopa utilisés pendant la période d’éveil du patient.
Les quantités de lévodopa de toutes les formulations contenant de la lévodopa utilisées pendant la période d’éveil en journée (généralement 16 heures/jour) doivent être converties en EL grâce au facteur de multiplication de dose approprié du Tableau 1, puis additionnées. Pour ce calcul, seuls la lévodopa et les inhibiteurs de la COMT doivent être pris en compte. La lévodopa de secours ou tout autre médicament ou traitement de la maladie de Parkinson, y compris les médicaments pris en dehors de la période d’éveil (par exemple, administration nocturne), ne doivent pas être inclus dans ce calcul. Si des inhibiteurs de la COMT sont pris sur une période de 24 heures, quelle que soit la dose, un facteur de correction doit être appliqué à la somme des EL, comme indiqué dans le Tableau 1.
Tableau 1. Calcul des équivalents lévodopa (EL)
|
Formulation de lévodopa |
Facteur de multiplication de dose |
|
Libération immédiate, y compris la suspension entérale |
1 |
|
Libération prolongée, libération contrôlée ou libération continuea |
0,75 |
|
Si un inhibiteur de la COMT est utilisé, multipliez la somme des EL calculés ci-dessus par 1,33a |
|
|
a La lévodopa contenue dans les formulations combinées de LD/CD/inhibiteur de la COMT est considérée comme à libération immédiate et doit être ajoutée aux EL de toutes les autres sources de lévodopa avant de multiplier la somme par le facteur de correction des inhibiteurs de la COMT (c’est-à-dire, ne pas appliquer le facteur de correction COMT à un seul EL). CD = carbidopa ; LD = lévodopa ; COMT = catéchol-O-méthyl-transférase ; EL = équivalents lévodopa. |
|
Etape 2 : Déterminer le débit horaire de perfusion de SCYOVA.
Se reporter au Tableau 2 pour les suggestions de débits de perfusion initiaux de SCYOVA selon les EL calculés à l’étape 1.
Le débit horaire de perfusion de SCYOVA indiqué dans le Tableau 2 est basé sur la prise d’EL par le patient au cours d’une période d’éveil qui est généralement de 16 heures (EL16).
Si les EL déterminés à l’étape 1 étaient basés sur une période d’éveil plus longue ou plus courte que 16 heures, les EL doivent être ajustés pour une période de 16 heures. Pour cela, divisez les EL calculés à l’étape 1 par le nombre d’heures pendant lesquelles le patient est généralement éveillé, puis multipliez par 16. Reportez-vous ensuite au Tableau 2 pour les débits de perfusion initiaux suggérés pour SCYOVA. Une alternative consiste à calculer le débit de perfusion horaire initial selon la formule présentée sous le Tableau 2, où X est le nombre d’heures d’éveil par jour du patient.
Le débit horaire de perfusion déterminé lors de cette étape doit être saisi comme débit de perfusion de base lors de la programmation de la pompe (consulter le mode d’emploi de la pompe pour plus de détails).
Tableau 2. Suggestion de débit horaire de perfusion initial pour SCYOVA
|
Suggestion de débit horaire de perfusion initial pour SCYOVA (mL/h)a administré sur 24 heures |
|
|
< 400 |
0,15 |
|
400– 499 |
0,15– 0,17 |
|
500– 599 |
0,17– 0,20 |
|
600– 699 |
0,20– 0,24 |
|
700– 799 |
0,24– 0,27 |
|
800– 899 |
0,27– 0,30 |
|
900– 999 |
0,30– 0,34 |
|
1 000– 1 099 |
0,34– 0,37 |
|
1 100– 1 199 |
0,37– 0,40 |
|
1 200– 1 299 |
0,40– 0,44 |
|
1 300– 1 399 |
0,44– 0,47 |
|
1 400– 1 499 |
0,47– 0,51 |
|
1 500– 1 599 |
0,51– 0,54 |
|
1 600– 1 699 |
0,54– 0,57 |
|
1 700– 1 799 |
0,57– 0,61 |
|
1 800– 1 899 |
0,61– 0,64 |
|
1 900– 1 999 |
0,64– 0,68 |
|
2 000– 2 099 |
0,68– 0,71 |
|
2 100– 2 199 |
0,71– 0,74 |
|
2 200– 2 299 |
0,74– 0,78 |
|
2 300– 2 399 |
0,78– 0,81 |
|
2 400– 2 499 |
0,81– 0,84 |
|
2 500– 2 599 |
0,84– 0,88 |
|
2 600– 2 699 |
0,88– 0,91 |
|
2 700– 2 799 |
0,91– 0,94 |
|
2 800– 2 899 |
0,94– 0,98 |
|
2 900– 2 999 |
0,98– 1,01 |
|
3 000– 3 099 |
1,01– 1,04 |
|
> 3 100 |
1,04 |
|
a Le débit horaire de perfusion peut être calculé à l’aide de la formule suivante, où X est le nombre d’heures pendant lesquelles le patient est éveillé, utilisé pour déterminer les EL (par exemple, X = 16, dans le Tableau ci– dessus). Débit horaire de perfusion (mL/h) = [(EL ∙ 0,92 ∙ 1,41) ∕ 240] ∕ X Hypothèses utilisées pour déterminer la « Suggestion de débit horaire de perfusion initial pour SCYOVA » : · Le total quotidien d’EL sur 16 heures est augmenté de 50 % pour prendre en compte l’administration sur 24 heures · La biodisponibilité de la foslévodopa sous– cutanée est 8 % plus élevée que celle de la lévodopa absorbée par voie entérale · Le rapport de poids moléculaire entre la foslévodopa et la lévodopa est de 1,41:1 · Un millilitre de SCYOVA contient 240 mg de foslévodopa et 12 mg de foscarbidopa · La plupart des patients atteints de la maladie de Parkinson sont traités à l’aide d’antiparkinsoniens oraux pendant leur période d’éveil (généralement une période de traitement de 16 heures par jour) ; une fois que la quantité de foslévodopa requise sur une période de 16 heures a été calculée, celle-ci est divisée par 240 mg afin de déterminer le nombre de millilitres nécessaires sur une période de 16 heures, puis divisée par 16 pour établir le débit horaire de perfusion EL = équivalents lévodopa ; LD = lévodopa. |
|
Etape 3 : Déterminer le volume de la dose de charge.
Une dose de charge peut être immédiatement administrée avant de commencer la perfusion afin d’obtenir rapidement le contrôle des symptômes lorsque le traitement par SCYOVA est instauré à l’état « OFF » (ou si la pompe est arrêtée depuis plus de 3 heures). Les doses de charge peuvent être administrées soit via la pompe soit par voie orale à l’aide de comprimés de lévodopa/carbidopa à libération immédiate.
Le Tableau 3 présente le volume recommandé de la dose de charge (mL) de SCYOVA devant être programmé dans la pompe (consulter le mode d’emploi de la pompe pour plus de détails) et la quantité correspondante de lévodopa à libération immédiate (mg), quel que soit l’inhibiteur de la DOPA décarboxylase périphérique administré en association (par exemple, carbidopa, bensérazide).
Tableau 3. Détermination du volume recommandé de SCYOVA pour la dose de charge
|
Volume recommandé de la dose de charge (mL) devant être programmé dans la pompe |
Quantité correspondante approximative de lévodopa (mg) |
|
0,6 |
100 |
|
0,9– 1,2 |
150– 200 |
|
1,5– 1,8 |
250– 300 |
|
2,0 |
350 |
|
0,1 mL de SCYOVA contient 24 mg de foslévodopa (correspondant à environ 17 mg de lévodopa). La pompe est capable de fournir une dose de charge allant de 0,1 mL à 3,0 mL maximum, par paliers de 0,1 mL. |
|
Optimisation et entretien
Le professionnel de santé peut ajuster le débit horaire de perfusion initial pour obtenir la réponse clinique optimale pour le patient. Le débit horaire de perfusion doit être administré en continu sur une période de perfusion quotidienne de 24 heures. Si souhaité, le professionnel de santé peut programmer et activer 2 débits horaires de perfusion alternatifs (faible/élevé). Tous les débits de perfusion peuvent être ajustés par paliers de 0,01 mL/h (ce qui correspond à environ 1,7 mg de lévodopa/heure) et ne doivent pas dépasser 1,04 mL/h (ou environ 4 260 mg de lévodopa par jour [6 000 mg de foslévodopa par jour]). La pompe intègre une sécurisation de l’accès pour la configuration de la dose afin d’éviter que les patients apportent des modifications à leurs débits préprogrammés ou à la fonctionnalité de dose supplémentaire.
Selon l’avis du professionnel de santé, SCYOVA peut être administré seul ou, si besoin, avec d’autres traitements antiparkinsoniens concomitants. Une diminution des autres traitements antiparkinsoniens concomitants, suivie d’un ajustement de la dose de SCYOVA, peut être envisagée pendant la perfusion de SCYOVA. L’utilisation concomitante de SCYOVA avec d’autres médicaments contenant de la lévodopa ou d’autres médicaments régulant de manière significative les taux de dopamine synaptique (comme les inhibiteurs de la COMT) n’a pas été étudiée.
Débit alternatif
La pompe permet également de programmer 2 options de débit de perfusion alternatives (faible/élevé) pour une utilisation par le patient. Les débits de perfusion alternatifs doivent être activés et préprogrammés par le professionnel de santé et peuvent être sélectionnés par les patients pour répondre aux modifications des exigences fonctionnelles, par exemple, diminuer la dose la nuit ou augmenter la dose lors d’une activité intense prolongée (consulter le mode d’emploi de la pompe pour plus de détails).
Doses supplémentaires
Si le professionnel de santé le permet, les patients peuvent s’administrer eux-mêmes une dose supplémentaire pour gérer les symptômes « OFF » aigus pouvant apparaître pendant la perfusion continue. Le volume de la dose supplémentaire peut être sélectionné parmi 5 options (voir Tableau 4). La fonction de dose supplémentaire est limitée à un maximum de 1 dose supplémentaire par heure. Si le patient utilise 5 doses supplémentaires ou plus pendant une période de traitement de 24 heures, alors un ajustement du débit de perfusion de base doit être envisagé. La capacité à activer cette fonction, ainsi que le temps minimum requis entre les doses supplémentaires, sont déterminés par le professionnel de santé et ne peuvent pas être modifiés par le patient (consulter le mode d’emploi de la pompe pour plus de détails sur la programmation de la fonction de dose supplémentaire).
Tableau 4. Option de dose supplémentaire de SCYOVA
|
Volume de SCYOVA (mL) |
Equivalents lévodopa (mg) |
|
17 |
|
|
0,15 |
25,5 |
|
0,20 |
34 |
|
0,25 |
42,5 |
|
0,30 |
51 |
Mode d’administration
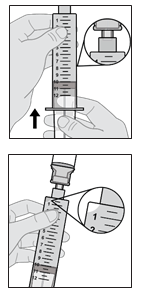
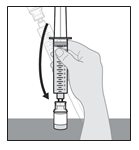
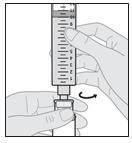
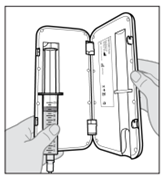
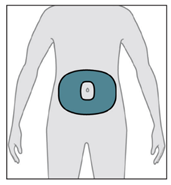
SCYOVA est administré par voie sous-cutanée, de préférence dans l’abdomen, en évitant une zone circulaire de 5 cm autour du nombril. Utiliser une technique aseptique lors de la préparation et de l’administration du produit. Le set de perfusion (canule) peut rester en place pendant une durée maximale de 3 jours lors de la perfusion continue du médicament. Changer régulièrement le site de perfusion et utiliser un nouveau set de perfusion au moins tous les 3 jours. Il est recommandé que les nouveaux sites de perfusion soient distants de 2,5 cm minimum des sites utilisés dans les 12 jours précédents. SCYOVA ne doit pas être perfusé dans des zones sensibles, contusionnées, rouges ou indurées. Utiliser uniquement la pompe Vyafuser pour l’administration de SCYOVA (consulter le mode d’emploi de la pompe pour plus de détails) avec des composants pour perfusion stériles, à usage unique (seringue, set de perfusion et adaptateur de flacon), approuvés pour cette utilisation. Les patients doivent être formés à l’utilisation correcte de SCYOVA et au système d’administration (pompe, flacon de solution, adaptateur de flacon, seringue, set de perfusion, accessoire de transport, batterie rechargeable et chargeur) avant l’instauration du traitement par SCYOVA et reformés, par la suite, si nécessaire.
Dans une étude croisée de pharmacocinétique, l’administration de SCYOVA dans le bras et dans la cuisse a généré une exposition presque équivalente à celle dans l’abdomen (voir rubrique 5.2 Absorption). La sécurité d’emploi et l’efficacité à long terme de l’administration dans le bras et dans la cuisse n’ont pas été évaluées.
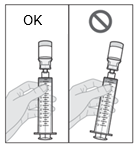
Le médicament doit être conservé et manipulé comme décrit dans la rubrique 6.4, Précautions particulières de conservation. Les flacons de médicament sont à usage unique. Une fois que le contenu d’un flacon a été transféré dans la seringue, le contenu de la seringue doit être administré dans les 24 heures qui suivent. Les flacons de médicaments et seringues usagés doivent être éliminés conformément aux réglementations locales. Les seringues doivent être jetées, même en présence de produit résiduel, conformément aux directives du professionnel de santé (voir rubrique 6.6 Précautions particulières d’élimination).
Interruption du traitement
Il est préférable d’éviter l’interruption soudaine ou la réduction rapide des doses de SCYOVA sans administration d’un autre traitement dopaminergique (voir rubrique 4.4).
SCYOVA peut être interrompu sans prendre d’autres mesures pendant de courtes périodes, par exemple lorsque le patient prend une douche. Pour les interruptions de plus d’une heure, un nouveau set de perfusion (tubulure et canule) doit être utilisé sur un autre site de perfusion. En cas d’interruption de la perfusion pendant plus de 3 heures, le patient peut également s’administrer lui-même une dose de charge, si cette fonction a été activée par le professionnel de santé, afin de rétablir rapidement le contrôle des symptômes.
Si le traitement par SCYOVA est interrompu pendant une longue période (> 24 heures) ou de façon permanente, le professionnel de santé doit décider d’un autre traitement dopaminergique approprié (par exemple, lévodopa/carbidopa par voie orale). Le traitement par SCYOVA peut reprendre à tout moment en suivant les mêmes instructions que pour l’instauration du traitement (voir rubrique 4.2 Instauration du traitement).
Populations particulières
La pharmacocinétique de SCYOVA n’a été évaluée dans aucune population particulière. SCYOVA est destiné à être utilisé chez les patients atteints de la maladie de Parkinson et recevant déjà une dose stable de lévodopa par voie orale. Les différences d’exposition ne sont pas considérées comme cliniquement significatives, car SCYOVA est optimisé une fois que les patients commencent le traitement. Les effets des covariables ne devraient donc pas avoir d’incidence sur l’efficacité et la sécurité cliniques. Voir la rubrique 5.2 pour plus d’informations sur la pharmacocinétique de la lévodopa et de la carbidopa dans les populations particulières.
SCYOVA est contre-indiqué dans les cas suivants :
· Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1 ;
· Glaucome à angle fermé ;
· Insuffisance cardiaque sévère ;
· Accident vasculaire cérébral aigu ;
· Arythmie cardiaque sévère ;
· Les inhibiteurs non sélectifs de la MAO et les inhibiteurs sélectifs de la MAO-A sont contre-indiqués avec SCYOVA. Ces inhibiteurs doivent être arrêtés au moins deux semaines avant l'instauration du traitement par SCYOVA. SCYOVA peut être administré en même temps que la dose recommandée par le fabricant d'un inhibiteur de la MAO-B (par exemple, chlorhydrate de sélégiline) (voir rubrique 4.5) ;
· Conditions dans lesquelles les adrénergiques sont contre-indiqués, par exemple : phéochromocytome, hyperthyroïdie et syndrome de Cushing.
Comme la lévodopa peut activer un mélanome, SCYOVA ne doit pas être utilisé chez les patients présentant des lésions cutanées suspectes non diagnostiquées ou des antécédents de mélanome.
4.4. Mises en garde spéciales et précautions d'emploi
Mises en garde spéciales et précautions d’emploi pour SCYOVA
Plusieurs mises en garde et précautions d’emploi ci-dessous s’appliquent à tous les médicaments à base de lévodopa et donc également à SCYOVA.
· SCYOVA n'est pas recommandé pour le traitement des syndromes extrapyramidaux induits par les médicaments.
· Le traitement par SCYOVA doit être administré avec précaution chez les patients présentant une maladie cardiovasculaire ou pulmonaire sévère, un asthme bronchique, une maladie rénale, hépatique ou endocrinienne, ou des antécédents d'ulcère gastro-duodénal ou de convulsions.
· Chez les patients présentant des antécédents d'infarctus du myocarde avec des arythmies atriales, nodales ou ventriculaires résiduelles, la fonction cardiaque doit être particulièrement surveillée pendant la période d'ajustement de la posologie initiale.
· Tous les patients traités par SCYOVA doivent être étroitement surveillés afin de déceler le développement éventuel d'altérations de l'état mental, de dépression avec tendances suicidaires, ou d'autres changements psychiques graves. Les patients présentant des antécédents ou des symptômes de psychose doivent être traités avec précaution. Des hallucinations plus fréquentes peuvent survenir chez les patients traités par des agonistes de la dopamine et/ou d’autres traitements dopaminergiques contenant de la lévodopa, notamment SCYOVA. Il est recommandé de revoir le traitement si de tels symptômes apparaissent.
· L'administration concomitante de neuroleptiques inhibiteurs des récepteurs de la dopamine, en particulier les antagonistes des récepteurs D2, doit être effectuée avec précaution, et le patient doit être surveillé étroitement afin de contrôler l'apparition éventuelle d'une perte de l'effet antiparkinsonien ou d'une aggravation des symptômes parkinsoniens (voir rubrique 4.5).
· Des patients souffrant de glaucome chronique à angle ouvert peuvent être traités par SCYOVA avec précaution, à condition que la pression intraoculaire soit convenablement contrôlée et surveillée afin de détecter les changements de la pression intraoculaire au cours du traitement.
· SCYOVA peut induire une hypotension orthostatique. Par conséquent, SCYOVA sera administré avec précaution chez les patients recevant d'autres médicaments susceptibles de provoquer une hypotension orthostatique (voir rubrique 4.5).
· La lévodopa a été associée à une somnolence ainsi qu'à des épisodes d'endormissement soudain chez les patients atteints de la maladie de Parkinson. Par conséquent, la conduite d’un véhicule ou l’utilisation de machines doit être effectuée avec précaution chez ces patients (voir rubrique 4.7).
· Un symptôme complexe évoquant le syndrome malin des neuroleptiques (SMN), tel qu’une rigidité musculaire, une augmentation de la température corporelle, des changements psychiques (par exemple, agitation, confusion, coma) et une augmentation des concentrations sériques de créatine phosphokinase, a été notifié lors de l'arrêt brutal de médicaments antiparkinsoniens. Une rhabdomyolyse secondaire à un SMN ou une dyskinésie sévère ont été observées rarement chez des patients présentant une maladie de Parkinson. Par conséquent, les patients doivent être étroitement observés lorsque la posologie des associations lévodopa/carbidopa est brutalement réduite ou interrompue, en particulier si le patient est traité par des neuroleptiques. Il n'a été rapporté ni SMN ni rhabdomyolyse en association avec SCYOVA.
· Les patients doivent être régulièrement surveillés afin de déceler le développement éventuel d’un trouble du contrôle des impulsions. Les patients et les aidants doivent être informés que chez des patients traités par des agonistes dopaminergiques et/ou des traitements dopaminergiques contenant de la lévodopa, dont SCYOVA, il est possible que surviennent des symptômes comportementaux liés à un trouble du contrôle des impulsions tels que jeu pathologique, augmentation de la libido, hypersexualité, dépenses ou achats compulsifs, consommation excessive de nourriture et alimentation compulsive. Il est recommandé de revoir le traitement si de tels symptômes apparaissent.
· Des études épidémiologiques ont montré que les patients atteints de la maladie de Parkinson ont un risque plus élevé de développer un mélanome que la population générale. On ne sait pas si l'augmentation observée du risque est due à la maladie de Parkinson ou à d'autres facteurs, tels que les médicaments utilisés pour traiter cette maladie. Les patients et les médecins devront donc surveiller régulièrement la survenue éventuelle de mélanomes pendant l'utilisation de SCYOVA, quelle que soit l'indication. Idéalement, des examens cutanés périodiques devront être réalisés par des personnes dûment qualifiées (dermatologues, par exemple).
· Le syndrome de dysrégulation dopaminergique (SDD) est un trouble addictif entraînant une utilisation abusive du produit, observé chez certains patients traités par lévodopa/carbidopa. Avant l’instauration du traitement, les patients et leurs aidants doivent être avertis du risque potentiel de développer un SDD.
· La dose de SCYOVA peut devoir être réduite afin d'éviter les dyskinésies induites par la lévodopa.
· Une évaluation périodique des fonctions hépatique, hématopoïétique, cardiovasculaire et rénale est recommandée au cours d'un traitement prolongé par SCYOVA.
· SCYOVA contient de l’hydrazine, un produit de dégradation de la foscarbidopa qui peut être génotoxique et probablement carcinogène. La dose quotidienne médiane de SCYOVA est d’environ 2 541 mg/jour de foslévodopa et 127 mg/jour de foscarbidopa. La dose quotidienne maximale recommandée est de 6 000 mg de foslévodopa et 300 mg de foscarbidopa. Ceci correspond à une exposition médiane à l’hydrazine allant jusqu’à 0,2 mg/jour, et 0,5 mg/jour au maximum. Les conséquences cliniques de cette exposition à l’hydrazine ne sont pas connues.
· Une capacité réduite à manipuler le système d’administration peut entraîner des complications. Chez ces patients, un aidant (par exemple, une infirmière ou un parent proche) doit assister le patient.
· Une aggravation brutale ou graduelle de la bradykinésie peut indiquer une obstruction du dispositif pour une raison quelconque, et nécessiter une investigation.
· Une polyneuropathie a été rapportée chez des patients traités par des produits contenant l’association lévodopa/carbidopa. Avant de débuter le traitement et périodiquement par la suite, les patients doivent être évalués à la recherche d’antécédents ou de signes d’une polyneuropathie et de facteurs de risque connus.
· Des événements au niveau du site de perfusion (voir rubrique 4.8) ont été rapportés chez des patients ayant reçu SCYOVA. Il est conseillé d’utiliser des techniques aseptiques lors de l’utilisation de ce médicament et de changer de site de perfusion régulièrement afin de réduire les risques. Dans les études cliniques, quelques patients qui ont rapporté des réactions au site de perfusion ont également présenté des infections au site de perfusion. Il est donc recommandé de surveiller attentivement les réactions et infections graves au site de perfusion.
SCYOVA contient du sodium
SCYOVA contient 42,4 mg (environ 1,84 mmol) de sodium par mL, ce qui équivaut à 2,1 % de l’apport alimentaire quotidien maximal en sodium recommandé par l’OMS. La dose quotidienne maximale de ce médicament contient 54 % de l’apport quotidien maximal en sodium recommandé par l’OMS.
SCYOVA contient beaucoup de sodium. Cela doit être pris en compte, particulièrement chez les patients suivant un régime pauvre en sel.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
L'administration concomitante de SCYOVA avec les médicaments suivants doit être effectuée avec précaution :
Antihypertenseurs
Une hypotension orthostatique symptomatique est survenue lorsque des associations de lévodopa et d'un inhibiteur de la décarboxylase ont été ajoutées au traitement de patients recevant déjà des antihypertenseurs. Un ajustement de la posologie de l'antihypertenseur peut être nécessaire.
Antidépresseurs
Des effets indésirables, notamment hypertension et dyskinésies, ont été rarement rapportés à la suite de l'administration concomitante d'antidépresseurs tricycliques (par exemple, amoxapine et trimipramine) et d'associations lévodopa/carbidopa.
Inhibiteurs de la COMT (par exemple, tolcapone, entacapone, opicapone)
L’utilisation concomitante d’inhibiteurs de la COMT (catéchol-O-méthyl-transférase) et de SCYOVA peut augmenter la biodisponibilité de la lévodopa. Il peut s’avérer nécessaire d’ajuster la dose de SCYOVA.
Autres médicaments
Les antagonistes des récepteurs de la dopamine (certains neuroleptiques, notamment phénothiazines, butyrophénones et rispéridone ainsi que des antiémétiques, notamment le métoclopramide), les benzodiazépines, l'isoniazide, la phénytoïne et la papavérine peuvent réduire les effets thérapeutiques de la lévodopa. Les patients recevant ces médicaments de manière simultanée avec SCYOVA doivent être surveillés étroitement afin de déceler une éventuelle diminution de la réponse thérapeutique.
Les inhibiteurs de la MAO sont contre-indiqués chez les patients sous SCYOVA, à l’exception des inhibiteurs sélectifs de la MAO-B (par exemple, chlorhydrate de sélégiline). La posologie de SCYOVA peut nécessiter d’être réduite lorsqu’un inhibiteur sélectif de la MAO-B est ajouté.
L'utilisation concomitante de sélégiline et de lévodopa/carbidopa a été associée à une hypotension orthostatique grave.
L'amantadine exerce un effet synergique avec la lévodopa et peut augmenter les événements indésirables liés à la lévodopa. Un ajustement de la posologie de SCYOVA peut être nécessaire.
Les sympathomimétiques (par exemple, les médicaments adrénergiques tels que, sans s’y limiter, salbutamol, phényléphrine, isoprotérénol, dobutamine) peuvent augmenter les événements indésirables cardiovasculaires liés à la lévodopa.
La foscarbidopa a été identifiée comme un inducteur potentiel du CYP1A2 in vitro. Il convient d’être prudent lors de la prescription de SCYOVA en association avec des substrats sensibles du CYP1A2 (par exemple, fluvoxamine, clozapine, caféine, théophylline, duloxétine et mélatonine). Aucune étude clinique d’interactions médicamenteuses n’a été menée pour évaluer la pertinence clinique de cette observation.
4.6. Fertilité, grossesse et allaitement
Il n’existe pas de données sur l’utilisation de SCYOVA chez la femme enceinte. Les études sur la lévodopa et la carbidopa effectuées chez l’animal ont mis en évidence une toxicité sur la reproduction (voir rubrique 5.3). SCYOVA n’est pas recommandé pendant la grossesse et chez les femmes en âge de procréer n'utilisant pas de contraception sauf si les bénéfices pour la mère l’emportent sur les risques éventuels pour le fœtus.
Allaitement
La lévodopa et, potentiellement, les métabolites de la lévodopa sont excrétés dans le lait maternel. Des données montrent que la lactation est supprimée au cours d'un traitement par lévodopa.
On ne sait pas si la carbidopa ou ses métabolites sont excrétés dans le lait maternel. Les études chez l’animal ont mis en évidence l’excrétion de la carbidopa dans le lait maternel.
Il n’existe pas de données suffisantes sur les effets de SCYOVA ou de ses métabolites chez les nouveau-nés/nourrissons. L’allaitement doit être interrompu au cours du traitement par SCYOVA.
Fertilité
Dans les études sur la reproduction, aucun effet sur la fertilité n’a été observé chez les rats recevant l’association lévodopa/carbidopa.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil de tolérance
Les effets indésirables les plus fréquents (≥ 10 %) rapportés dans l’ensemble des études de phase III chez les patients exposés à SCYOVA étaient les réactions au site de perfusion (érythème au site de perfusion, cellulite au site de perfusion, nodule au site de perfusion, douleur au site de perfusion, œdème au site de perfusion, réaction au site de perfusion et infection au site de perfusion), les hallucinations, les chutes et l’anxiété.
Liste tabulée des effets indésirables
Les effets indésirables rapportés dans l’ensemble des études de phase III chez les patients exposés à SCYOVA (379 patients avec une exposition totale de 414,13 personne-années, 230 patients exposés pendant au moins 6 mois, 204 patients exposés pendant au moins 12 mois) ou les données issues de Duodopa gel intestinal, en fonction des fréquences de survenue au cours du traitement, quelle que soit la cause attribuée, sont présentés dans le Tableau 5, répertoriés par classe de système d’organe MedDRA. Les fréquences des effets indésirables sont définies selon la convention suivante : très fréquent (≥ 1/10) ; fréquent (≥ 1/100 à < 1/10) ; peu fréquent (≥ 1/1 000 à < 1/100) ; rare (≥ 1/10 000 à < 1/1 000) et très rare (< 1/10 000).
Tableau 5. Liste des effets indésirables
|
Classe de système d’organe |
Fréquence |
Effets indésirables |
|
Infections et infestations |
Très fréquent |
Cellulite au site de perfusion Infection au site de perfusion Infection des voies urinairesb |
|
Fréquenta |
Abcès au site de perfusion |
|
|
Affections hématologiques et du système lymphatique |
Fréquent |
Anémieb |
|
Peu fréquent |
Leucopénieb Thrombopénieb |
|
|
Affections du système immunitaire |
Fréquence indéterminée |
Réaction anaphylactiqueb,e |
|
Troubles du métabolisme et de la nutrition |
Fréquent |
Diminution de l’appétit |
|
Affections psychiatriques |
Très fréquent |
Anxiété Dépression Hallucinationsc |
|
Fréquent |
Rêves anormauxb Agitationb état confusionnel Idées délirantes
Troubles du contrôle des impulsions Insomnie Paranoïa Troubles psychotiques Attaques de sommeilb Troubles du sommeilb Idées suicidaires |
|
|
Peu fréquent |
Suicideb Démenceb Désorientationb Syndrome de dysrégulation dopaminergique Humeur euphoriqueb Peurb Augmentation de la libidob Cauchemarb
Tentatives de suicideb |
|
|
|
Rare |
Pensées anormalesb |
|
Affections du système nerveux |
|
|
|
Fréquent |
Troubles cognitifs Vertiges Vertiges posturaux Dyskinésie Dystonie Maux de tête Hypoesthésie Phénomène « on-off » Paresthésie Polyneuropathied Somnolence Syncope Tremblementsb |
|
|
Peu fréquent |
Ataxieb Convulsionsb Troubles de la marcheb |
|
|
Affections oculaires |
Peu fréquent |
Glaucome par fermeture de l’angleb Blépharospasmeb Diplopieb Neuropathie optique ischémiqueb Vision troubleb |
|
Affections cardiaques |
Fréquent |
Fréquence cardiaque irrégulièreb |
|
Peu fréquent |
Palpitations |
|
|
Affections vasculaires |
Fréquent |
Hypertension Hypotension Hypotension orthostatique |
|
Peu fréquent |
Phlébiteb |
|
|
Affections respiratoires, thoraciques et médiastinales |
Fréquent |
Dyspnée Douleur oropharyngéeb |
|
Peu fréquent |
Dysphonieb |
|
|
Rare |
Respiration anormaleb |
|
|
Affections gastro-intestinales |
Fréquent |
Distension abdominaleb Douleurs abdominales Constipation Diarrhée Bouche sèche Dysgueusieb Dyspepsieb Dysphagieb Flatulencesb Nausées Vomissements |
|
Peu fréquent |
Hypersécrétion salivaireb |
|
|
Rare |
Bruxismeb Coloration anormale de la saliveb Glossodynieb Hoquetb |
|
|
Affections de la peau et du tissu sous-cutané |
Fréquent |
Dermatite de contactb Hyperhidroseb Prurit Rash |
|
Peu fréquent |
Alopécieb Erythèmeb Urticaireb |
|
|
Rare |
Coloration anormale de la sueurb Mélanomeb |
|
|
Affections musculo-squelettiques et systémiques |
Fréquent |
Spasmes musculaires Douleur cervicaleb |
|
Affections du rein et des voies urinaires |
Fréquent |
Incontinence urinaire Rétention urinaire |
|
Peu fréquent |
Chromaturieb |
|
|
Rare |
Priapismeb |
|
|
Troubles généraux et anomalies au site d'administration |
Très fréquent |
Erythème au site de perfusion Réaction au site de perfusion Nodule au site de perfusion Œdème au site de perfusion Douleur au site de perfusion |
|
Fréquenta |
Asthénie Fatigue Contusion au site de perfusion Exfoliation au site de perfusion Extravasation au site de perfusion Hématome au site de perfusion Hémorragie au site de perfusion Induration au site de perfusion Inflammation au site de perfusion Irritation au site de perfusion Masse au site de perfusion Papule au site de perfusion Prurit au site de perfusion Rash au site de perfusion Gonflement au site de perfusion Malaise Œdèmes périphériques Douleurb |
|
|
Peu fréquent |
Douleur thoraciqueb |
|
|
Investigations |
Fréquent |
Taux d’acides aminés augmenté (acide méthylmalonique augmenté) b Taux sanguin d’homocystéine augmentéb Vitamine B6 diminuée Déficit en vitamine B12b Perte de poids Prise de poidsb |
|
Lésions, intoxications et complications liées aux procédures |
Très fréquent |
Chute |
|
a Les effets indésirables fréquents relatifs aux réactions au site de perfusion ont été inclus si ≥ 2 %. b Ces effets indésirables ont été identifiés avec Duodopa, gel intestinal, comme des événements indésirables liés au médicament. En revanche, ces événements n’étaient pas considérés comme des effets indésirables dans le cas de SCYOVA. c Les hallucinations comprennent les hallucinations, les hallucinations visuelles, les hallucinations auditives, les hallucinations olfactives, les hallucinations tactiles et les hallucinations mixtes. d La polyneuropathie comprend la neuropathie périphérique, la polyneuropathie, la diminution de la sensibilité vibratoire, la neuropathie périphérique sensitive, les troubles sensoriels et la perte sensorielle. e Selon les données post-autorisation. |
||
Description d’effets indésirables sélectionnés
Evènements au site de perfusion
Dans les études de phase III, les événements indésirables les plus fréquents liés à SCYOVA étaient les réactions au site de perfusion 77,6 % (N = 294) et les infections au site de perfusion 41,4 % (N = 157). Dans les études cliniques, des événements au niveau du site de perfusion, notamment des réactions et des infections au site de perfusion, se manifestant fréquemment lors des perfusions sous-cutanées, ont été observés avec SCYOVA. La majorité des événements au site de perfusion étaient non graves, de sévérité légère ou modérée et se sont résolus spontanément ou avec un traitement tel que des antibiotiques et/ou l’incision et le drainage. Trois sujets présentant des infections au site de perfusion ont été hospitalisés pour une complication à type de septicémie. Surveiller les changements cutanés au niveau du site de perfusion qui pourraient indiquer une éventuelle infection, comme une rougeur associée à une sensation de chaleur, un gonflement, une douleur ou une décoloration en cas d’application d’une pression. Il est conseillé d’utiliser des techniques aseptiques lors de l’utilisation de ce médicament et d’envisager de changer le site de perfusion plus souvent que tous les 3 jours, en utilisant un nouveau set de perfusion si vous observez ces changements cutanés. Il est recommandé que les nouveaux sites de perfusion soient distants de 2,5 cm minimum des sites utilisés au cours des 12 jours précédents.
Examens biologiques : les anomalies biologiques suivantes ont été signalées lors d’un traitement par lévodopa/carbidopa et doivent par conséquent être prises en considération lors du traitement des patients par SCYOVA : augmentation de l'urée, des phosphatases alcalines, de I'ASAT sérique, de l'ALAT sérique, de la LDH, de la bilirubine, de la glycémie, de la créatinine, de l'acide urique, et test de Coombs positif, ainsi que diminution des valeurs de l'hémoglobine et de l'hématocrite. La présence de leucocytes, de bactéries et de sang dans l'urine a été signalée. L'association lévodopa/carbidopa, et par conséquent SCYOVA, peut provoquer un résultat faux positif lorsque les cétones urinaires sont testées à l'aide d'une bandelette urinaire ; cette réaction n'est pas modifiée en portant l'échantillon d'urine à ébullition. L'utilisation des méthodes basées sur la glucose oxydase peut générer des résultats faux négatifs pour la glycosurie.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
SCYOVA (foslévodopa/foscarbidopa) 240 mg/12 mg par mL, solution pour perfusion, est une association des prodrogues monophosphate de lévodopa et monophosphate de carbidopa (rapport 20:1) dans une solution pour perfusion sous-cutanée continue 24 heures sur 24 chez des patients atteints de la maladie de Parkinson à un stade avancé qui ne sont pas correctement contrôlés par les traitements actuels. La foslévodopa et la foscarbidopa sont converties in vivo en lévodopa et carbidopa. La lévodopa soulage les symptômes de la maladie de Parkinson après décarboxylation en dopamine dans le cerveau. La carbidopa, qui ne franchit pas la barrière hémato-encéphalique, inhibe la décarboxylation extracérébrale de la lévodopa en dopamine, ce qui veut dire que de plus grandes quantités de lévodopa deviennent disponibles pour être transportées vers le cerveau et y subir une transformation en dopamine.
Effets pharmacodynamiques
L’administration sous-cutanée de SCYOVA et l’administration intestinale de Duodopa ont présenté des Cmax, ASC et degré de fluctuation de lévodopa comparables, ce qui corrobore un profil d’efficacité comparable. En atteignant les mêmes concentrations de lévodopa que Duodopa, SCYOVA réduit les fluctuations motrices et accroît le temps « ON » chez les patients atteints de la maladie de Parkinson à un stade avancé et répondant à la lévodopa. Les fluctuations motrices et l’hyperkinésie ou la dyskinésie sont réduites grâce au maintien des concentrations plasmatiques de lévodopa à un niveau stable à l’intérieur de la fenêtre thérapeutique individuelle. L’effet thérapeutique sur les symptômes moteurs (état « ON ») est obtenu dès la première journée de traitement.
Efficacité et sécurité clinique
Etudes menées sur la formulation Duodopa, gel intestinal
L’efficacité de Duodopa, gel intestinal a été confirmée dans deux études de phase III de design identique, multicentriques, randomisées, en double aveugle, double placebo, contrôlées contre comparateur actif, en groupes parallèles, de 12 semaines, évaluant l’efficacité, la sécurité d’emploi et la tolérance de Duodopa, gel intestinal versus la lévodopa/carbidopa 100/25 mg en comprimés. Les études ont été conduites chez des patients atteints de la maladie de Parkinson à un stade avancé, répondant à la lévodopa et présentant des fluctuations motrices persistantes malgré un traitement optimisé par lévodopa/carbidopa orale et d’autres médicaments antiparkinsoniens disponibles ; elles ont inclus 71 patients au total. Les résultats des deux études ont été regroupés et une seule analyse a été réalisée.
Le critère principal d’évaluation de l’efficacité, à savoir la variation du temps « OFF » normalisé (entre la visite d’inclusion et la visite finale de l’étude) sur la base des données de l’agenda patient (Parkinson’s Disease Diary) avec utilisation de la méthode du report de la dernière valeur observée, a démontré une différence des moyennes des moindres carrés (MC) statistiquement significative en faveur du groupe de traitement Duodopa (Tableau 6).Les résultats du critère principal d'évaluation ont été confirmés par une analyse Modèle Mixte de Mesures Répétées (MMMR) qui a examiné la variation entre la visite d’inclusion et chacune des visites de suivi de l'étude. Cette analyse du temps « OFF » a montré une amélioration plus importante statistiquement significative dans le groupe Duodopa versus le groupe contrôle traitement actif à la semaine 4 ; cette amélioration a été statistiquement significative aux semaines 8, 10 et 12.Cette variation du temps « OFF » a été associée à une différence des moyennes des MC statistiquement significative par rapport à l’inclusion pour le temps « ON » quotidien moyen normalisé sans dyskinésies gênantes entre le groupe de traitement par Duodopa, gel intestinal et le groupe contrôle traitement actif, sur la base des données de l’agenda patient pour la maladie de Parkinson (PD Diary). Les valeurs à l'inclusion ont été recueillies trois jours avant la randomisation et après 28 jours de standardisation du traitement oral.
Tableau 6. Variation du temps « OFF » et du temps « ON » sans dyskinésies gênantes entre l’inclusion et la visite finale de l’étude
|
Groupe de traitement |
N |
Valeur initiale moyenne (ET) (heures) |
Valeur finale moyenne (ET) (heures) |
Moyenne des MC (ES) de la variation (heures) |
Moyenne des MC (ES) de la différence (heures) |
Valeur de p |
|
|
Mesure principale : Période « OFF » |
|||||||
|
Contrôle actifa |
31 |
6,90 (2,06) |
4,95 (2,04) |
-2,14 (0,66) |
|||
|
Duodopa, gel intestinal |
35 |
6,32 (1,72) |
3,05 (2,52) |
-4,04 (0,65) |
-1,91 (0,57) |
0,0015 |
|
|
Principale mesure secondaire : Temps « ON » sans dyskinésies gênantes |
|||||||
|
Contrôle actif |
31 |
8,04 (2,09) |
9,92 (2,62) |
2,24 (0,76) |
|||
|
Duodopa, gel intestinal |
35 |
8,70 (2,01) |
11,95 (2,67) |
4,11 (0,75) |
1,86 (0,65) |
0,0059 |
|
|
|
ET = écart type ; ES = erreur standard a. Groupe contrôle traitement actif, lévodopa/carbidopa orale 100/25 mg en comprimés (Sinemet comprimé sur-encapsulé) |
||||||
Les analyses des autres critères secondaires d’évaluation de l’efficacité, dans l’ordre de la procédure de tests hiérarchisés, ont montré des résultats statistiquement significatifs pour Duodopa, gel intestinal comparativement à la lévodopa/carbidopa orale pour les paramètres suivants : index résumé du questionnaire de la maladie de Parkinson (Parkinson’s Disease Questionnaire, PDQ-39) (index relatif à la qualité de vie dans la maladie de Parkinson), score à l’échelle des Impressions Cliniques Globales - Amélioration (Clinical Global Impression-Improvement, CGI-I) et score à l’échelle d’évaluation unifiée de la maladie de Parkinson partie II (Unified Parkinson’s Disease Scale, UPDRS II) (Activités de la vie quotidienne). L’index résumé PDQ-39 a montré une diminution de 10,9 points à la semaine 12 par rapport à l’inclusion pour le groupe de traitement par Duodopa, gel intestinal. Les autres critères secondaires d’évaluation, le score UPDRS III, l’index résumé du questionnaire EuroQol 5 dimensions (EQ-5D) et le score total de l’échelle de fardeau de Zarit (Zarit Burden Interview, ZBI), n’ont pas atteint le seuil de significativité statistique sur la base de la procédure des tests hiérarchisés.
Une étude de phase III, multicentrique, en ouvert, en un seul bras, a été menée afin d'évaluer la sécurité d'emploi et la tolérance à long terme de Duodopa sur 12 mois chez 354 patients. La population étudiée était composée de patients atteints de la maladie de Parkinson à un stade avancé, répondant à la lévodopa et présentant des fluctuations motrices persistantes malgré un traitement par les médicaments antiparkinsoniens disponibles optimisé. Le temps « OFF » quotidien moyen normalisé a diminué de 4,44 heures entre le début et la fin de l'étude (6,77 heures à la visite d’inclusion et 2,32 heures à la visite finale), avec une augmentation correspondante de 4,8 heures du temps « ON » sans dyskinésies gênantes.
Une étude de phase III, multicentrique, en ouvert, randomisée a été menée afin d’évaluer l’effet de Duodopa, gel intestinal sur les dyskinésies par rapport à un traitement médical optimisé sur 12 semaines chez 61 patients. La population étudiée était composée de patients atteints de la maladie de Parkinson à un stade avancé, répondant à la lévodopa et présentant des fluctuations motrices contrôlées de manière inappropriée par un traitement médical optimisé et présentant un score total ≥ 30 sur l'échelle unifiée d'évaluation des dyskinésies (UDysRS) lors de la visite d'inclusion. La variation du score total UDysRS entre la visite d'inclusion et la semaine 12 (critère principal d'évaluation de l'efficacité) a démontré une différence des moyennes des moindres carrés (MC) statistiquement significative (-15,05 ; valeur de p < 0,0001) en faveur du groupe de traitement Duodopa par rapport au groupe ayant reçu le traitement médical optimisé. L’analyse des critères secondaires d’évaluation de l’efficacité à l’aide d’une procédure de test à séquence fixe a montré des résultats statistiquement significatifs en faveur du groupe Duodopa par rapport au groupe ayant reçu le traitement médical optimisé pour le temps « ON » sans dyskinésies gênantes, tel que mesuré par le PD Diary, l’index résumé du questionnaire 8 de la maladie de Parkinson (Parkinson’s Disease Questionnaire-8, PDQ-8), le score à l’échelle des impressions cliniques globales de changement (Clinical Global Impression Change, CGI-C), le score UPDRS partie II et le temps « OFF » tel que mesuré par le PD Diary. Le score UPDRS III n'a pas atteint le seuil de significativité statistique.
Etudes portant sur SCYOVA
SCYOVA est une association des prodrogues monophosphate de lévodopa et monophosphate de carbidopa (rapport 20:1) dans une solution pour perfusion sous-cutanée continue 24 heures sur 24. L’administration sous-cutanée de SCYOVA et l’administration intestinale de Duodopa ont présenté des Cmax et des paramètres ASC de lévodopa comparables, ce qui corrobore un profil d’efficacité comparable. L’étude a montré une exposition stable à la lévodopa avec des valeurs de fluctuation de 0,262 pour SCYOVA et 0,404 pour Duodopa.
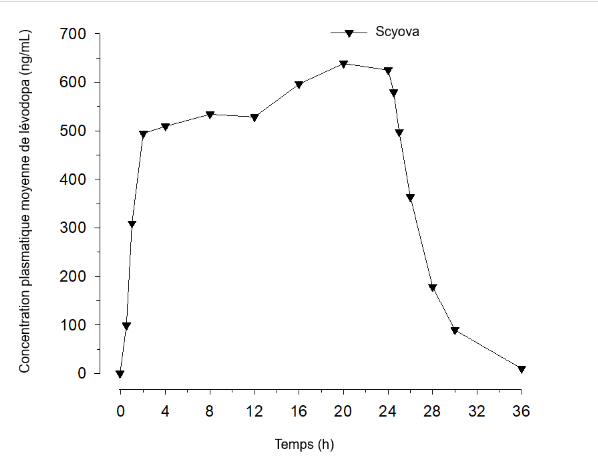
Après l’administration de SCYOVA chez des volontaires sains, l’état d’équilibre de la lévodopa est rapidement atteint, généralement dans les 2 heures qui suivent, et est maintenu pendant la période de perfusion. La Figure 1 ci-dessous montre l’exposition à la lévodopa après une administration de SCYOVA sur 24 heures.
Figure 1. Exposition moyenne à la lévodopa après une perfusion de 24 heures de SCYOVA
|
|
Les résultats d’une étude supplémentaire de comparabilité pharmacocinétique ont démontré que l’exposition à la lévodopa était comparable pour SCYOVA et Duodopa lorsqu’ils étaient tous les deux administrés sur une période de 24 heures.
Une étude de phase III multicentrique, randomisée en double aveugle, à double placebo, contrôlée contre comparateur actif, a été menée afin d’évaluer l’effet de SCYOVA sur 12 semaines chez des patients atteints de la maladie de Parkinson à un stade avancé. Au total, 145 patients ont été randomisés selon un rapport 1:1 et 141 patients ont reçu soit SCYOVA en perfusion sous‑cutanée continue 24 heures sur 24 et le placebo sous forme de gélules (N = 74), soit une solution placebo en perfusion sous‑cutanée continue 24 heures sur 24 et la lévodopa/carbidopa en comprimés à libération immédiate (LI) encapsulés (N = 67).
La population étudiée était composée de patients atteints de la maladie de Parkinson répondant à la lévodopa chez lesquels les fluctuations motrices étaient contrôlées de manière inappropriée par le traitement actuel et qui présentaient au minimum 2,5 heures de temps « OFF » par jour tel que mesuré par les agendas patients pour la maladie de Parkinson.
SCYOVA a démontré des améliorations statistiquement significatives du temps « ON » sans dyskinésies gênantes et du temps « OFF » entre la baseline et la semaine 12 par rapport au groupe recevant la lévodopa/carbidopa en comprimés à libération immédiate (Tableau 7). Les résultats des autres critères d’évaluation secondaires, les expériences motrices de la vie quotidienne, l’akinésie matinale, le sommeil et les scores de qualité de vie, n’ont pas atteint la significativité statistique basée sur la procédure séquentielle hiérarchique.
Tableau 7. Variation du critère d’évaluation principal et des principaux critères secondaires entre la baseline et la visite finale de l’étude
|
Groupe de traitement |
N |
Valeur moyenne à la baseline (ET) |
Variation moyenne entre la baseline et la fin de l’étude (ET) |
Moyenne des MC de la variation |
Moyenne des MC de la différence |
Valeur de P (Intervalle de confiance à 95 %) |
|
Critère d’évaluation principal |
||||||
|
Temps « ON » sans dyskinésies gênantes (heures)a |
||||||
|
Lévodopa/carbidopa LI par voie oraleb |
67 |
9,49 (2,62) |
0,85 (3,46) |
0,97 |
- |
- |
|
SCYOVA |
73 |
9,20 (2,42) |
3,36 (3,62) |
2,72 |
1,75 |
0,0083 (0,46 ; 3,05) |
|
Critères d'évaluation secondaires |
||||||
|
Temps « OFF » (heures)a |
||||||
|
Lévodopa/carbidopaLI par voie oraleb |
67 |
5,91 (1,88) |
‑0,93 (3,31) |
‑0,96 |
- |
- |
|
SCYOVA |
73 |
6,34 (2,27) |
‑3,41 (3,76) |
‑2,75 |
‑1,79 |
0,0054 (‑3,03 ; ‑0,54) |
|
ET = écart‑type. b Lévodopa/carbidopa comprimés à libération immédiate. |
||||||
Une étude de phase III, en ouvert, en un seul bras, a été menée afin d’évaluer la sécurité d’emploi et la tolérance d’une exposition 24 heures sur 24 à une perfusion sous-cutanée continue de SCYOVA pendant 52 semaines chez 244 patients. La population étudiée était composée de patients atteints de la maladie de Parkinson, répondant à la lévodopa et présentant des symptômes moteurs contrôlés de manière inappropriée avec le traitement actuel et un minimum de 2,5 heures de temps « OFF » par jour tel que mesuré par les agendas patients pour la maladie de Parkinson (PD Diaries). Au total, 137 patients ont terminé l’étude. Les raisons les plus fréquentes de la sortie de l’étude étaient la survenue d’événements indésirables (26 %) et le retrait du consentement (16 %). Les événements indésirables rapportés chez au moins 10 % des patients étaient les événements au site de perfusion, les hallucinations, les chutes, l’anxiété et les vertiges. Les événements indésirables liés à SCYOVA les plus fréquents étaient les événements au site de perfusion, qui étaient non graves, de sévérité légère ou modérée et qui se sont résolus.
Le résumé du profil de tolérance de SCYOVA de cette étude est présenté dans la rubrique 4.8 (voir rubrique 4.8 Effets indésirables).
Population pédiatrique
La sécurité de SCYOVA chez les patients âgés de moins de 18 ans n'a pas été établie et l'utilisation de SCYOVA n'est donc pas recommandée dans cette population.
5.2. Propriétés pharmacocinétiques
SCYOVA est administré directement dans l’espace sous-cutané et est rapidement absorbé et converti en lévodopa et carbidopa. Dans une étude de phase I chez des volontaires sains, les taux plasmatiques de lévodopa et carbidopa étaient détectables dans un délai de 30 minutes lors du premier temps de prélèvement pharmacocinétique.
Chez la plupart des sujets, l’état d’équilibre était atteint dans un délai de 2 heures lorsque SCYOVA était administré sous forme d’une dose de charge, puis d’une perfusion continue.
Afin de déterminer l’absorption de SCYOVA au niveau de différents sites sous-cutanés, SCYOVA a été administré à des volontaires sains dans l’abdomen, le bras et la cuisse à l’aide d’un plan croisé à 3 voies. L’analyse pharmacocinétique de cette étude a montré que les 3 sites présentaient une exposition pratiquement identique à la lévodopa et à la carbidopa, suggérant que l’absorption de SCYOVA est semblable au niveau des différents sites sous-cutanés.
SCYOVA court-circuite l’intestin, les aliments ne modifient donc pas l’absorption ou l’exposition à la lévodopa/carbidopa.
Distribution
Le volume de distribution de la lévodopa est modérément faible. Le coefficient de partage pour la lévodopa entre les globules rouges et le plasma est d'environ 1. La fixation de la lévodopa aux protéines plasmatiques est négligeable (< 10 %). La lévodopa est transportée jusque dans le cerveau par le mécanisme de transport des acides aminés volumineux neutres.
La fixation de la carbidopa aux protéines plasmatiques est d'environ 36 %. La carbidopa ne traverse pas la barrière hémato-encéphalique.
La fixation de la foslévodopa et de la foscarbidopa aux protéines plasmatiques est faible (24 % à 26 %).
Biotransformation et élimination
Les prodrogues foslévodopa et foscarbidopa sont rapidement converties par les phosphatases alcalines en lévodopa et carbidopa. La lévodopa est principalement métabolisée par la décarboxylase des acides aminés aromatiques (DAAA) et les enzymes COMT. Les autres voies du métabolisme sont la transamination et l'oxydation. La décarboxylation de la lévodopa en dopamine par l'intermédiaire de la DAAA est la voie enzymatique majeure en l'absence d'administration concomitante d'un inhibiteur enzymatique. La O-méthylation de la lévodopa par la COMT aboutit à la formation de 3-O-méthyldopa. En cas d'administration avec la carbidopa, la demi-vie d'élimination de la lévodopa est de l'ordre de 1,5 heure.
La carbidopa est métabolisée en deux métabolites principaux (acide α-méthyl-3-méthoxy-4-hydroxyphénylpropionique et acide α-méthyl-3,4-dihydroxyphénylpropionique). Ces 2 métabolites sont principalement éliminés dans les urines sous forme inchangée ou sous forme glucuronoconjuguée. La carbidopa inchangée représente 30 % de l'excrétion urinaire totale. La demi-vie d'élimination de la carbidopa est d'environ 2 heures.
Populations particulières
SCYOVA est destiné à être utilisé chez les patients atteints de la maladie de Parkinson et recevant déjà une dose stable de lévodopa par voie orale et SCYOVA est optimisé une fois que les patients commencent le traitement.
Sujets âgés
Les effets du vieillissement sur la pharmacocinétique de la lévodopa suite à la perfusion de SCYOVA n’ont pas été spécifiquement évalués. Les études portant sur la lévodopa suggèrent une légère diminution de la clairance avec l’âge.
Insuffisance rénale ou hépatique
La pharmacocinétique de SCYOVA chez les sujets présentant une insuffisance rénale et/ou hépatique n’a pas été établie.
La charge journalière de phosphore anticipée avec la dose clinique proposée la plus élevée de foslévodopa/foscarbidopa (6 000 mg/300 mg/jour de foslévodopa/foscarbidopa) est d’environ 700 mg, soit une valeur considérablement moins élevée que la limite supérieure des apports nutritionnels de référence de l’Académie nationale des sciences aux Etats-Unis, qui est de 3 000 mg/jour ; toutefois, aucune donnée en termes de pharmacocinétique et de tolérance n’est disponible pour SCYOVA chez des patients présentant une insuffisance rénale en phase terminale nécessitant une dialyse. Par conséquent, la prudence est de rigueur chez les patients présentant une insuffisance rénale en phase terminale sous dialyse nécessitant un traitement par SCYOVA en raison de la diminution de la capacité des reins à éliminer le phosphate.
Poids corporel
Les effets du poids corporel sur la pharmacocinétique de la lévodopa suite à la perfusion de SCYOVA n’ont pas été spécifiquement évalués. Des études précédentes portant sur la lévodopa ont révélé que le poids augmentait le volume de distribution et pouvait réduire l’exposition à la lévodopa.
Sexe et origine ethnique
Après l’administration de SCYOVA, l’exposition à la carbidopa et à la lévodopa chez les sujets japonais et chinois Han était comparable à celle des sujets caucasiens.
Les effets du sexe sur la pharmacocinétique suite à la perfusion de SCYOVA n’ont pas été spécifiquement évalués. Les effets du genre sur la pharmacocinétique de la lévodopa ont été évalués et des études ont suggéré qu’il n’existait aucune différence cliniquement significative d’exposition à la lévodopa liée au genre. Après l’administration de SCYOVA, l’exposition à la lévodopa, une fois le poids pris en considération, était environ 18 % plus élevée chez les femmes d’après les valeurs de l’ASC.
5.3. Données de sécurité préclinique
L’hydrazine est un produit de dégradation de la foscarbidopa. Au cours des études chez l’animal, l’hydrazine a montré une toxicité systémique notable, en particulier en cas d’exposition par inhalation. Ces études ont mis en évidence une hépatotoxicité de l’hydrazine, une toxicité au niveau du système nerveux central (bien que non retrouvée après traitement par voie orale), et une génotoxicité ainsi qu’un pouvoir carcinogène (voir également rubrique 4.4).
Après ouverture : utiliser immédiatement. Le produit doit être utilisé dans les 24 heures une fois qu’il a été transféré du flacon dans la seringue.
6.4. Précautions particulières de conservation
A conserver et transporter réfrigéré (entre 2 °C et 8 °C). Ne pas congeler.
Conserver les flacons dans l’emballage extérieur pour éviter qu’ils se cassent.
Peut être conservé à température ambiante (jusqu’à 30 °C) pendant une seule période pouvant aller jusqu’à 28 jours. Une fois qu’un flacon a été conservé à température ambiante, le produit ne doit pas être remis au réfrigérateur. Noter la date à laquelle SCYOVA a été retiré du réfrigérateur pour la première fois dans l’espace prévu à cet effet sur l’emballage.
Pour les conditions de conservation du médicament après première ouverture, voir rubrique 6.3.
Le médicament doit être à température ambiante avant la perfusion. S’il est réfrigéré avant l’utilisation, le flacon doit être sorti du réfrigérateur et laissé à température ambiante à l’abri de la lumière directe du soleil pendant 30 minutes. Si le médicament est réfrigéré, il ne doit pas être réchauffé (dans le flacon ou la seringue) d’une autre manière qu’en le laissant à température ambiante. Il ne doit pas être réchauffé dans un micro-ondes ou de l’eau chaude, par exemple.
6.5. Nature et contenu de l'emballage extérieur
Quantité totale de 10 mL dans un flacon en verre transparent et incolore de type I muni d’un bouchon en caoutchouc gris, d’un opercule en aluminium et d’un capuchon amovible en plastique turquoise, boîte de 7 flacons.
Les composants pour perfusion stériles et à usage unique (seringue, set de perfusion et adaptateur de flacon), approuvés pour utilisation, sont fournis séparément.
La pompe Vyafuser est fournie séparément.
6.6. Précautions particulières d’élimination et de manipulation
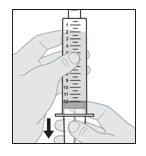
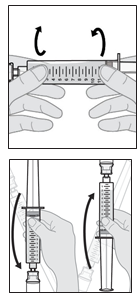
Les flacons sont à usage unique. L’intégralité du contenu d’un flacon doit être transférée dans une seringue pour l’administration. Ne pas diluer la solution et ne pas remplir la seringue avec une autre solution. Jeter le flacon après avoir transféré le médicament dans la seringue.
Ne pas réutiliser un flacon ouvert.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Jeter le flacon s’il n’est pas utilisé dans les 28 jours de conservation à température ambiante.
Jeter la seringue et tout produit non utilisé dans la seringue lorsque cela fait 24 heures que le médicament est dans la seringue. Ne pas utiliser le produit s’il se trouve dans le même flacon ou la même seringue depuis plus de 24 heures.
Un aperçu des instructions d’utilisation est fourni dans la notice.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
10, RUE D’ARCUEIL
94528 RUNGIS CEDEX
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 790 8 3 : Boîte de 7 flacons de 10 ml.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 10/10/2025
SCYOVA 240 mg/mL + 12 mg/mL, solution pour perfusion
Foslévodopa et foscarbidopa
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
2. Quelles sont les informations à connaître avant d'utiliser SCYOVA 240 mg/mL + 12 mg/mL, solution pour perfusion ?
3. Comment utiliser SCYOVA 240 mg/mL + 12 mg/mL, solution pour perfusion ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver SCYOVA 240 mg/mL + 12 mg/mL, solution pour perfusion ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE SCYOVA 240 mg/mL + 12 mg/mL, solution pour perfusion ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Antiparkinsoniens, foslévodopa et inhibiteur de la décarboxylase, code ATC : N04BA07.
SCYOVA contient deux composants actifs, la foslévodopa et la foscarbidopa, et est utilisé pour traiter la maladie de Parkinson.
Comment agit SCYOVA 240 mg/mL + 12 mg/mL, solution pour perfusion ?
· Dans l’organisme, la foslévodopa est transformée en une substance appelée « dopamine ». Elle vient s’ajouter à la dopamine déjà présente dans votre cerveau et votre moelle épinière. La dopamine facilite la transmission des signaux entre les cellules nerveuses.
· Un déficit en dopamine provoque les signes de la maladie de Parkinson tels que les tremblements, la sensation de rigidité, le ralentissement des mouvements et les troubles de l’équilibre.
· Le traitement par foslévodopa augmente la quantité de dopamine dans votre organisme. Cela permet de réduire ces signes.
· La foscarbidopa améliore les effets de la foslévodopa. Elle permet également de réduire les effets indésirables liés à la foslévodopa.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER SCYOVA 240 mg/mL + 12 mg/mL, solution pour perfusion ?
N’utilisez jamais SCYOVA 240 mg/mL + 12 mg/mL, solution pour perfusion si :
· Vous êtes allergique à la foslévodopa, à la foscarbidopa ou à l’un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6) ;
· Vous avez un trouble oculaire appelé « glaucome à angle fermé » ;
· Vous avez des troubles cardiovasculaires graves ;
· Vous avez des troubles sévères du rythme cardiaque (arythmie) ;
· Vous avez eu un accident vasculaire cérébral aigu ;
· Vous prenez actuellement des médicaments appelés inhibiteurs non sélectifs de la MAO et inhibiteurs sélectifs de la MAO-A tels que le moclobémide ou la phénelzine. Vous devez arrêter d’utiliser ces médicaments au moins deux semaines avant de commencer à prendre SCYOVA ;
· Vous avez une tumeur des glandes surrénales (phéochromocytome) ;
· Vous avez des problèmes hormonaux tels qu’un excès de cortisol (syndrome de Cushing) ou vos taux d'hormone thyroïdienne sont trop élevés (hyperthyroïdie) ;
· Vous avez déjà eu un cancer de la peau ou vous remarquez des marques ou grains de beauté inhabituels sur votre peau qui n'ont pas été examinés par votre médecin.
Si l’une de ces situations s’applique à votre cas, n’utilisez pas SCYOVA. En cas de doute, adressez-vous à votre médecin avant d’utiliser ce médicament.
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien ou infirmier/ère avant d’utiliser SCYOVA et durant son utilisation si :
· Vous avez déjà eu une crise cardiaque, des vaisseaux sanguins obstrués au niveau de votre cœur ou tout autre problème cardiaque, y compris des troubles du rythme cardiaque (arythmie) ;
· Vous avez des problèmes pulmonaires, tels qu’un asthme ;
· Vous avez déjà eu des problèmes hormonaux ;
· Vous avez déjà eu une dépression avec des idées suicidaires ou d’autres problèmes mentaux ;
· Vous avez un trouble oculaire appelé « glaucome à angle ouvert » ;
· Vous avez déjà eu un ulcère de l’estomac ;
· Vous avez déjà eu des convulsions ;
· Vous avez une maladie des reins ou du foie ;
· Vous suivez un régime pauvre en sel (voir « SCYOVA contient du sodium ») ;
· Vous présentez des changements cutanés au niveau du site de perfusion comme une rougeur, une sensation de chaleur, un gonflement, une douleur ou une décoloration lorsque vous appliquez une pression dessus ;
· Vous avez une faiblesse progressive, une douleur, un engourdissement ou une perte de sensation dans les doigts ou les pieds (polyneuropathie). Votre médecin recherchera les signes et symptômes d’une neuropathie avant et régulièrement après le début de votre traitement par SCYOVA. Informez votre médecin si vous avez déjà présenté une neuropathie ou une affection associée à une neuropathie.
Si l’une de ces situations s’applique à vous ou en cas de doute, adressez-vous à votre médecin avant d’utiliser SCYOVA.
Informez votre médecin si vous remarquez des mouvements involontaires et incontrôlables des membres, du dos, du cou ou du menton (dyskinésies) ou une augmentation de la raideur ou un ralentissement des mouvements. Votre dose quotidienne peut nécessiter un ajustement ou il se peut que le dispositif soit obstrué.
Syndrome malin des neuroleptiques
N’arrêtez pas d’utiliser SCYOVA sauf si votre médecin vous demande de le faire. En effet, un arrêt brutal ou une diminution trop rapide des doses de SCYOVA pourrait entraîner un trouble grave appelé « syndrome malin des neuroleptiques ». Les signes peuvent inclure :
· Battements de cœur rapides, fluctuations de la pression artérielle et sueurs, suivis de fièvre ;
· Respiration rapide, raideur musculaire, diminution du niveau de conscience et coma ;
· Taux sanguin élevé d’une protéine (une enzyme appelée « créatine phosphokinase »). Il est mesuré par votre médecin.
Troubles du contrôle des impulsions modifications de votre comportement
Informez votre médecin si vous, votre famille ou votre soignant constatez que vous développez des envies irrésistibles qui vous conduisent à vous comporter d’une manière inhabituelle ou si vous ne pouvez pas résister à une pulsion ou à la tentation de réaliser certaines activités qui pourraient être dangereuses pour vous ou votre entourage. Ces comportements sont appelés « troubles du contrôle des impulsions » et peuvent inclure
· Jeu pathologique ;
· Ingestion de nourriture ou dépenses excessives ;
· Libido anormalement élevée ou augmentation des pensées ou désirs sexuels.
Votre médecin pourrait avoir besoin de revoir vos traitements. Il discutera avec vous de la façon dont il est possible de gérer ou de réduire ces symptômes (voir également rubrique 4 « Troubles du contrôle des impulsions - modifications de votre comportement »).
Syndrome de dysrégulation dopaminergique
Informez votre médecin si vous, votre famille ou votre soignant constatez que vous développez des symptômes de type addictif conduisant à une envie irrépressible de prendre de fortes doses de SCYOVA et d’autres médicaments utilisés pour traiter la maladie de Parkinson.
Infections au site de perfusion
Informez votre médecin si vous remarquez des changements cutanés au niveau du site de perfusion comme une rougeur, une sensation de chaleur, un gonflement, une douleur ou une décoloration lorsque vous appliquez une pression dessus. Vous devez toujours utiliser des techniques aseptiques (stériles) lors de l’utilisation de ce médicament et changer régulièrement le site de perfusion (au moins tous les 3 jours), en utilisant un nouveau set de perfusion. Veillez à ce que le nouveau site de perfusion soit distant de 2,5 cm minimum du site utilisé au cours des 12 jours précédents. Vous devrez peut-être changer le site de perfusion plus souvent que tous les 3 jours si vous observez l’un des changements cutanés mentionnés ci-dessus.
SCYOVA et cancer
Dans l’organisme, la foscarbidopa (un composant de SCYOVA) se dégrade en une substance appelée « hydrazine ». L’hydrazine pourrait éventuellement endommager vos gènes, ce qui pourrait provoquer un cancer. Cependant, on ignore si la quantité d’hydrazine produite lors de l’utilisation de SCYOVA à une dose habituelle peut provoquer un cancer.
Enfants et adolescents
L’utilisation de SCYOVA n’est pas recommandée chez les enfants et adolescents âgés de moins de 18 ans, car il n’a fait l’objet d’aucune étude dans cette tranche d’âge.
Autres médicaments et SCYOVA 240 mg/mL + 12 mg/mL, solution pour perfusion
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament. Cela inclut les médicaments obtenus sans ordonnance et les médicaments à base de plantes.
Avant d’utiliser SCYOVA, indiquez à votre médecin ou à votre pharmacien si vous prenez d’autres médicaments pour le traitement
· De la tuberculose - tels que l’isoniazide ;
· De l’anxiété - tels que des benzodiazépines ;
· Des nausées ou des vomissements - tels que le métoclopramide ;
· De l’hypertension artérielle - tels que des antihypertenseurs ;
· De la contraction des vaisseaux sanguins - tels que la papavérine ;
· Des convulsions ou de l’épilepsie - tels que la phénytoïne ;
· D’une maladie psychiatrique - tels que des neuroleptiques comprenant les phénothiazines, les butyrophénones et la rispéridone ;
· De la maladie de Parkinson - tels que la tolcapone, l’entacapone, l’opicapone et l’amantadine ;
· De la dépression - tels que les antidépresseurs tricycliques, dont l’amoxapine et la trimipramine.
Informez votre médecin ou votre pharmacien si vous prenez un inhibiteur de la COMT (catéchol-O-méthyl-transférase) car cela pourrait augmenter la quantité de lévodopa dans votre sang. Votre médecin devra peut-être ajuster la dose de l’un ou l’autre des médicaments.
Informez votre médecin ou pharmacien si vous prenez des médicaments appelés sympathomimétiques tels que -sans s’y limiter- salbutamol, phényléphrine, isoprotérénol, dobutamine, pour traiter une hypotension. Les médicaments sympathomimétiques et la lévodopa peuvent accroître le risque d’augmentation de la pression artérielle (hypertension) ou de rythme cardiaque irrégulier (arythmie).
Informez votre médecin ou pharmacien si vous prenez des médicaments connus pour être éliminés par une enzyme appelée « CYP1A2 ». Ces médicaments sont notamment :
· Caféine (stimule la vigilance mentale) ;
· Mélatonine (favorise le sommeil) ;
· Fluvoxamine, duloxétine (antidépresseurs qui améliorent l’humeur) ;
· Clozapine (contrôle la schizophrénie) ;
· Théophylline (soulage l’asthme).
Certains médicaments (tels que la sélégiline) que vous prenez peuvent provoquer une baisse de votre pression artérielle, pouvant entraîner des sensations vertigineuses lorsque vous vous levez d’une chaise ou du lit (hypotension orthostatique). SCYOVA peut aggraver ces sensations vertigineuses. Pour limiter ces sensations vertigineuses, il est conseillé de passer lentement de la position couchée à la position debout.
N’utilisez pas SCYOVA si vous prenez
· Des médicaments pour la dépression appelés inhibiteurs sélectifs de la MAO-A et inhibiteurs non sélectifs de la MAO tels que le moclobémide ou la phénelzine.
SCYOVA 240 mg/mL + 12 mg/mL, solution pour perfusion avec des aliments et boissons
Sans objet.
Grossesse et allaitement
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin avant d’utiliser ce médicament.
SCYOVA n’est pas recommandé pendant la grossesse et chez les femmes en âge de procréer n’utilisant pas de contraception sauf si les bénéfices pour la mère dépassent les risques éventuels pour le fœtus.
On ne sait pas si SCYOVA passe dans le lait maternel. L’allaitement doit être interrompu pendant le traitement par SCYOVA.
Conduite de véhicules et utilisation de machines
Ne conduisez pas de véhicules ou n’utilisez pas d’outils ni de machines tant que vous n’êtes pas sûr(e) des effets que SCYOVA a sur vous.
· SCYOVA peut vous rendre très somnolent(e) ou peut provoquer un endormissement de façon soudaine (attaques de sommeil).
· SCYOVA peut provoquer une baisse de votre pression artérielle, pouvant entraîner des étourdissements ou des vertiges.
Ne conduisez pas de véhicules ou n’utilisez pas d’outils ni de machines jusqu’à ce que vous vous sentiez à nouveau complètement éveillé(e) ou jusqu’à ce que vous ne ressentiez plus ces étourdissements ou ces vertiges.
SCYOVA 240 mg/mL + 12 mg/mL, solution pour perfusion contient du sodium
Adressez-vous à votre médecin ou votre pharmacien si vous devez prendre au moins 9 mL de SCYOVA quotidiennement pendant une période prolongée, notamment s’il vous a été conseillé de suivre un régime pauvre en sel (sodium).
3. COMMENT UTILISER SCYOVA 240 mg/mL + 12 mg/mL, solution pour perfusion ?
Comment utiliser SCYOVA 240 mg/mL + 12 mg/mL, solution pour perfusion
· Avant de commencer le traitement, vous ou votre aidant devez être formés à la manipulation du produit et de la pompe de perfusion.
· SCYOVA est une solution qui est administrée sous la peau (ce que l’on appelle « perfusion sous-cutanée ») le plus souvent dans l’abdomen, à l’aide d’une pompe à perfusion. Vous devez éviter d’utiliser la pompe à perfusion dans une zone circulaire de 5 cm autour du nombril.
· Votre médecin ou votre infirmier/ère ajustera les paramètres de la pompe afin que la dose administrée réponde à vos besoins spécifiques.
· La pompe vous administre le médicament en continu pendant 24 heures. Vous devrez peut-être recharger la pompe avec une nouvelle seringue au cours de la période de 24 heures afin de vous assurer que vous avez suffisamment de médicament dans votre sang pour contrôler vos symptômes.
Quelle quantité de médicament utiliser ?
· Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin.
· Votre médecin décidera à quelle dose vous devez utiliser SCYOVA et pendant combien de temps. En règle générale, une dose d’entretien continue est administrée.
· Si nécessaire, vous pouvez recevoir des doses supplémentaires (fonction disponible sur votre pompe) pour gérer les symptômes « OFF » pouvant apparaître soudainement pendant la perfusion continue - cette décision sera prise par votre médecin.
· En cas d’interruption de la perfusion pendant plus de 3 heures, vous devrez peut-être également vous administrer vous-même une dose de charge (fonction disponible sur votre pompe) avant de reprendre la perfusion continue afin de rétablir rapidement le contrôle de vos symptômes.
Veuillez lire la rubrique 7 « Instructions d’utilisation de la perfusion de SCYOVA à l’aide de la pompe Vyafuser » avant d’utiliser SCYOVA.
Si vous avez utilisé plus de SCYOVA 240 mg/mL + 12 mg/mL, solution pour perfusion que vous n’auriez dû
Si vous avez utilisé plus de SCYOVA que vous n’auriez dû, arrêtez immédiatement la perfusion et consultez votre médecin ou rendez-vous directement à l’hôpital. Prenez la boîte du médicament avec vous. Les effets suivants pourraient apparaître
· Rythme cardiaque inhabituel rapide, lent ou irrégulier (arythmie) ;
· Baisse de la pression artérielle (hypotension).
Si vous oubliez d’utiliser SCYOVA 240 mg/mL + 12 mg/mL, solution pour perfusion
Si vous interrompez SCYOVA 240 mg/mL + 12 mg/mL, solution pour perfusion
SCYOVA peut être interrompu pendant de courtes périodes, par exemple lorsque vous prenez une douche. Si vous interrompez la perfusion pendant plus d’une heure, veillez à remplacer votre set de perfusion (tubulure et canule) et à utiliser un autre site de perfusion. En cas d’interruption de la perfusion pendant plus de 3 heures, vous pouvez également vous administrer vous-même une dose de charge afin de rétablir rapidement le contrôle de vos symptômes. La fonction de dose de charge est disponible sur votre pompe après activation par votre médecin ou votre infirmier/ère.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Arrêtez immédiatement d’utiliser SCYOVA et prévenez votre médecin si vous remarquez l’un des effets indésirables graves suivants. Vous pourriez avoir besoin d’un traitement médical urgent.
· Glaucome par fermeture de l’angle (douleur oculaire aiguë, maux de tête, vision trouble, nausées et vomissements).
· Gonflement du visage, de la langue ou de la gorge pouvant entraîner des difficultés pour avaler ou respirer, ou éruption cutanée de type urticaire. Ces symptômes peuvent être des signes de réaction allergique sévère (réaction anaphylactique). La fréquence est indéterminée. Elle ne peut pas être estimée sur la base des données disponibles.
Votre médecin déterminera si vous pouvez continuer à utiliser SCYOVA.
Autres effets indésirables
Veuillez consulter votre médecin, votre pharmacien ou votre infirmier/ère si vous remarquez l'un des symptômes suivants.
Très fréquent : pouvant affecter plus de 1 personne sur 10
· Infections au site de perfusion (cellulite au site de perfusion) (voir rubrique 2) ;
· Anxiété ;
· Voir, entendre ou sentir des choses qui n’existent pas (hallucinations) ;
· Dépression ;
· Réactions au site de perfusion (rougeur, grosseur, gonflement, douleur) ;
· Chutes ;
· Infection des voies urinaires.
Fréquent : pouvant affecter jusqu’à 1 personne sur 10
· Réactions au site de perfusion (ecchymoses (« bleus »), desquamation de fines couches de peau, fuite de médicament, saignement, inflammation, irritation, masse, bosse, démangeaisons, éruption cutanée) ;
· Abcès au site de perfusion ;
· Diminution de l’appétit ;
· Confusion ;
· Fausses croyances (idées délirantes) ;
· Paranoïa ;
· Idées suicidaires ;
· Difficultés à penser, à apprendre et à se souvenir (troubles cognitifs) ;
· Mouvements involontaires (dyskinésies) ;
· Spasmes musculaires que vous n’arrivez pas à contrôler affectant les yeux, la tête, le cou et le corps (dystonie) ;
· Maux de tête ;
· Diminution de la sensibilité au toucher, picotements ou engourdissement, sensation de brûlure ou de fourmillement dans les mains, les bras, les jambes ou les pieds (hypoesthésie, paresthésie) ;
· Faiblesse ou douleurs ou engourdissement ou perte de sensibilité au niveau des doigts ou des pieds progressifs (polyneuropathie) ;
· Les symptômes de la maladie de Parkinson peuvent réapparaître subitement ou de façon inattendue - cela s’appelle le « phénomène ON-OFF » ;
· Endormissement soudain (attaques de sommeil), somnolence, troubles du sommeil ;
· Pression artérielle élevée ou basse ;
· Sensation vertigineuse ;
· Vertiges, quand vous vous levez ou que vous changez de position (hypotension orthostatique, vertiges posturaux) - cela est dû à une baisse de la pression artérielle. Changez toujours lentement de position, ne vous levez pas trop rapidement ;
· Evanouissement ;
· Douleurs au niveau du ventre (abdomen) ;
· Constipation ;
· Bouche sèche ;
· Nausées, diarrhée ou vomissements ;
· Incapacité à contrôler le débit urinaire (incontinence) ;
· Difficultés pour uriner (rétention urinaire) ;
· Manque d’énergie, sensation de faiblesse (fatigue) ;
· Gonflement dans le bas des jambes ou les mains dû à un excès de liquide (œdème périphérique) ;
· Troubles psychotiques ;
· Déficit en vitamine B6 dans le corps ;
· Déficit en vitamine B12 dans le corps ;
· Augmentation des taux d’acides aminés, les petites molécules qui constituent les protéines de l’organisme ;
· Augmentation du taux sanguin d’homocystéine, qui est utilisée par l’organisme pour la synthèse des protéines ;
· Mal de gorge ;
· Prise de poids ;
· Perte de poids ;
· Difficulté à dormir (insomnie) ;
· Eruptions cutanées, démangeaisons, transpiration excessive ;
· Spasmes musculaires ;
· Sensation d’essoufflement ;
· Sensation de malaise général ;
· Anémie ;
· Rêves anormaux ;
· Agitation ;
· Gonflement de l’abdomen (distension abdominale), gaz (flatulences), indigestion (dyspepsie) ;
· Douleurs ;
· Douleurs cervicales ;
· Difficultés pour avaler ou trouble du goût (goût amer) ;
· Rythme cardiaque irrégulier.
Troubles du contrôle des impulsions - modifications de votre comportement. Ces effets sont fréquents et peuvent affecter jusqu’à 1 personne sur 10.
Certaines personnes sont incapables de résister à l’envie d’exercer une action qui pourrait être dangereuse pour elles-mêmes ou pour les autres. Cela inclut notamment :
· Une forte pulsion à jouer (de l’argent) de manière excessive en dépit de graves conséquences pour vous ou votre famille ;
· Un intérêt pour la sexualité altéré ou augmenté et un comportement qui peut vous gêner, vous ou votre entourage. Cela peut inclure une augmentation des pulsions sexuelles ;
· Des dépenses ou achats excessifs incontrôlables ;
· Manger de façon excessive - prise de nourriture en grande quantité sur une courte période, ou manger de façon compulsive - prise de nourriture en quantité plus importante que la normale et plus importante que celle dont votre organisme a besoin.
Informez votre médecin si vous, votre famille ou un soignant remarquez l’un de ces comportements. Votre médecin pourrait avoir besoin de revoir votre traitement. Il/Elle pourra discuter avec vous de la façon dont il est possible de gérer ou de réduire ces symptômes.
Peu fréquent : pouvant affecter jusqu'à 1 personne sur 100
· Envie de prendre de fortes doses de SCYOVA, supérieures à celles requises pour contrôler les symptômes moteurs, connue sous le nom de syndrome de dysrégulation dopaminergique ;
· Coloration foncée des urines ;
· Voix enrouée, douleur thoracique ;
· Perte de cheveux, rougeur de la peau, urticaire ;
· Salivation plus abondante que d’habitude ;
· Modification de votre façon de marcher ;
· Tentatives de suicide, suicide ;
· Taux anormalement bas de globules blancs ou modification du taux de cellules sanguines pouvant entraîner des saignements ;
· Exaltation de l’humeur (humeur euphorique), augmentation du désir sexuel, démence, sentiment de peur ;
· Difficultés pour contrôler vos mouvements et mouvements vifs incontrôlables ;
· Difficultés pour ouvrir les paupières, vision double, vision trouble, lésions du nerf optique (neuropathie optique ischémique) ;
· Rythme cardiaque irrégulier (palpitations) ;
· Confusion ;
· Cauchemar ;
· Gonflement d’une veine.
Rares : pouvant affecter jusqu'à 1 personne sur 1 000
· Grincement des dents ;
· Erection douloureuse et prolongée ;
· Apparition ou aggravation de marques ou de grains de beauté inhabituels sur votre peau ou cancer de la peau (mélanome) ;
· Coloration foncée de la salive ou de la sueur, sensation de brûlure de la langue, hoquet ;
· Pensées anormales ;
· Respiration anormale.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER SCYOVA 240 mg/mL + 12 mg/mL, solution pour perfusion ?
Tenir ce médicament hors de la vue et de la portée des enfants.
Conserver les flacons dans l’emballage extérieur pour éviter qu’ils se cassent.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette du flacon et sur la boîte. La date de péremption fait référence au dernier jour de ce mois.
· Ne pas congeler.
· A conserver et transporter réfrigéré (entre 2 °C et 8 °C).
· Les flacons peuvent être conservés à température ambiante (jusqu’à 30 °C) pendant une seule période pouvant aller jusqu’à 28 jours (un espace est prévu sur l’emballage pour noter la date à laquelle vous retirez le médicament du réfrigérateur).
· Une fois que le médicament a été conservé à température ambiante, il ne doit pas être remis au réfrigérateur.
· Jetez le médicament s’il n’est pas utilisé dans les 28 jours de conservation à température ambiante.
· L’intégralité du contenu d’un flacon doit être transférée en une seule fois dans une seringue pour l’administration.
· Ne réutilisez pas un flacon ouvert car les flacons sont à usage unique.
· Après ouverture : utiliser immédiatement. Utiliser SCYOVA dans les 24 heures une fois transféré du flacon dans la seringue.
· Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d'éliminer les médicaments que vous n'utilisez plus. Ces mesures contribueront à protéger l’environnement.
· Jetez le flacon après avoir transféré le médicament dans la seringue.
· Jetez la seringue et tout médicament non utilisé dans la seringue lorsque cela fait 24 heures que le médicament est dans la seringue.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient SCYOVA 240 mg/mL + 12 mg/mL, solution pour perfusion
· Les composants actifs sont :
Foslévodopa.................................................................................................................. 240 mg
Foscarbidopa.................................................................................................................. 12 mg
Pour 1 mL.
10 mL contient 2 400 mg de foslévodopa et 120 mg de foscarbidopa.
· Les autres composants sont l’hydroxyde de sodium 10N (pour ajustement du pH), l’acide chlorhydrique, concentré (pour ajustement du pH) et l’eau pour préparations injectables.
SCYOVA est une solution limpide à légèrement opalescente, exempte de particules, fournie dans un flacon en verre transparent et incolore muni d’un bouchon en caoutchouc gris et d’un capuchon en plastique turquoise. La couleur de la solution peut varier d’incolore à jaune jusqu’au brun et peut présenter une teinte violette ou rouge. Les changements de couleur sont attendus et n’ont aucun impact sur la qualité du médicament. La solution peut prendre une couleur plus foncée après avoir percé le bouchon du flacon ou lorsque la solution est dans la seringue.
Chaque boîte contient 7 flacons de 10 mL chacun.
Les composants pour perfusion stériles et à usage unique (seringue, set de perfusion et adaptateur de flacon), approuvés pour utilisation, sont fournis séparément par votre médecin ou votre pharmacie. La pompe Vyafuser est fournie séparément.
Titulaire de l’autorisation de mise sur le marché
10, RUE D’ARCUEIL
94528 RUNGIS CEDEX
Exploitant de l’autorisation de mise sur le marché
10, RUE D’ARCUEIL
94528 RUNGIS CEDEX
S.R. 148 PONTINA KM 52 SNC
04011 CAMPOVERDE DI APRILIA (LT)
ITALIE
ou
ABBVIE DEUTSCHLAND GMBH & CO. KG
KNOLLSTRASSE
67061 LUDWIGSHAFEN
ALLEMAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen et au Royaume-Uni (Irlande du Nord) sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Instructions d’utilisation de la perfusion de SCYOVA à l’aide de la pompe Vyafuser
Veuillez lire l’intégralité de la rubrique avant d’utiliser SCYOVA.
Informations importantes
Veuillez lire attentivement les instructions ci-dessous ces instructions expliquent comment préparer et utiliser SCYOVA.
· SCYOVA est administré par perfusion sous-cutanée à l’aide de la pompe Vyafuser et des composants pour perfusion (seringue, set de perfusion et adaptateur de flacon).
· Vous pouvez vous procurer les composants du set de perfusion auprès de votre médecin ou de votre pharmacie.
· Vous devez aussi lire attentivement l’intégralité des instructions avant d’utiliser SCYOVA
o Instructions d’utilisation de l’adaptateur de flacon.
o Instructions d’utilisation du set de perfusion.
o Instructions d’utilisation de la pompe Vyafuser destinées au patient.
· Votre médecin ou votre infirmier/ère configurera la pompe pour vous afin que vous receviez toujours la dose appropriée.
· Votre médecin ou votre infirmier/ère vous indiquera comment prendre le médicament et comment manipuler la pompe avant le début du traitement.
· Si quelque chose ne vous semble pas clair, adressez-vous à votre médecin ou à votre infirmier/ère.
Comment préparer votre médicament
· Ne diluez pas la solution de SCYOVA et ne remplissez pas la seringue avec une autre solution.
· Le médicament doit être à température ambiante avant la perfusion. S’il est réfrigéré avant l’utilisation, retirez le flacon du réfrigérateur et laissez-le à température ambiante à l’abri de la lumière directe du soleil pendant 30 minutes. Si le médicament est réfrigéré, ne le réchauffez pas (dans le flacon ou la seringue) d’une autre manière qu’en le laissant à température ambiante. Ne le réchauffez pas dans un micro-onde ou de l’eau chaude, par exemple.
1. Mise en place
Suivez les étapes ci-dessous chaque fois que vous devez recharger votre pompe en SCYOVA.
· Lavez-vous les mains à l’eau et au savon et séchez-les.
· Assurez-vous que votre surface plane est propre. Cela vous permettra d’éviter toute contamination lorsque vous préparerez la seringue.
· Placez les éléments suivants sur la surface plane :
o Seringue (dans son emballage).
o Flacon de solution de SCYOVA.
o Adaptateur de flacon (dans son emballage). Un nouvel adaptateur de flacon doit être utilisé avec chaque nouveau flacon de solution de SCYOVA.
o Tampons alcoolisés (non fournis avec le médicament).
· Inspectez le flacon, l’adaptateur de flacon et la seringue pour vérifier la date de péremption et toute détérioration éventuelle de l’emballage.
o N’utilisez pas le flacon, l’adaptateur de flacon ou la seringue si leur emballage stérile a été endommagé.
o N’utilisez pas la solution de SCYOVA, l’adaptateur de flacon ou la seringue si la date de péremption est dépassée.
N’utilisez pas la solution de SCYOVA si celle-ci est trouble ou contient des flocons ou des particules.
2. Préparation du flacon de solution
|
|
1) Préparez le flacon de solution. |
|
|
a. Retirez le capuchon en plastique du flacon de solution. |
|
|
b. Essuyez le haut du flacon de solution avec un tampon alcoolisé et laissez sécher. |
|
|
2) Fixez l'adaptateur de flacon au flacon de solution. |
|
|
Votre adaptateur de flacon peut être différent de celui illustré dans cette section. a. Détachez l’opercule en papier de l’emballage de l’adaptateur de flacon. Conservez l’adaptateur dans l’emballage en plastique pour l’étape 3. b. Utilisez l’emballage pour pousser fermement l’adaptateur de flacon directement sur le flacon de solution jusqu'à ce qu’il s’enclenche. c. Retirez directement l’emballage de l’adaptateur de flacon. Pour des informations détaillées, consultez le mode d’emploi de l’adaptateur de flacon. |
|
|
3) Tout en maintenant fermement l’adaptateur de flacon, fixez la seringue à l’adaptateur de flacon en la poussant puis en la vissant (dans le sens des aiguilles d’une montre). Ne serrez pas trop fort. |
|
|
4) Retournez l’ensemble et maintenez la seringue verticalement avec le flacon de solution sur le dessus. 5) Il est important de maintenir la seringue dirigée vers le haut. |
|
|
6) Tout en maintenant fermement la seringue dans une main, tirez le piston avec l’autre main pour prélever la totalité du contenu du flacon de solution dans la seringue jusqu’au repère de 12 mL environ ou jusqu’à ce que vous aperceviez de l’air à l’extrémité de la seringue. a. Assurez-vous que vous prélevez la totalité du contenu du flacon de solution dans la seringue. b. Vous apercevrez de l’air à l’extrémité de la seringue (espace de tête). |
|
|
7) Vérifiez l’absence de bulles d’air. a. De petites bulles sont acceptables et la présence d’air à l’extrémité de la seringue est normale. Si vous apercevez de petites bulles d’air ou si vous n’en voyez pas, sautez la section suivante et passez à l’étape 9 : Expulsez l’air de la seringue. b. En cas de présence de grosses bulles d’air, celles-ci doivent être éliminées. Si vous apercevez de grosses bulles d’air, passez à la section suivante, étape 8 : Eliminez manuellement les bulles d’air. |
|
|
8) Eliminez manuellement les bulles d’air. a. Tournez lentement et délicatement la seringue et inclinez-la d’avant en arrière. Cela permettra de rassembler les bulles en une seule bulle. Ne secouez pas et ne tapotez pas la seringue pour éliminer les bulles d’air. b. S’il reste des bulles d’air, rassemblez les bulles en tournant délicatement la seringue d’une extrémité à l'autre. c. Lorsque les grosses bulles se sont rassemblées en une seule bulle, passez à l’étape suivante. |
|
|
9) Expulsez l’air de la seringue. a. Avec le flacon de solution toujours fixé, dirigez la seringue vers le haut. b. Expulsez lentement l’air de la seringue dans le flacon. Une certaine résistance sera ressentie lorsque l’air repassera dans le flacon de solution. c. Continuez à pousser jusqu’à ce que la totalité de l’air ait été expulsée de la seringue jusque dans le flacon de solution et que la solution de médicament soit visible à l’extrémité de la seringue. d. Si vous inclinez la seringue, vous pouvez apercevoir une petite bulle d’air dans le coin. Cela est acceptable. |
|
|
10) Retournez la seringue et le flacon de solution de sorte que le flacon de solution soit à la verticale sur la surface plane. |
|
|
11) Détachez la seringue de l’adaptateur de flacon. a. Maintenez fermement l’adaptateur de flacon d’une main et le corps de la seringue de l’autre. b. Dévissez la seringue de l’adaptateur de flacon. Lorsque vous détachez la seringue du flacon, ne poussez pas le piston, sinon la solution va fuir. c. Placez la seringue sur une surface propre, en vous assurant que l’extrémité de la seringue n’entre pas en contact avec une surface sale. |
|
|
12) Votre seringue est désormais prête à être utilisée. |
3. Mise en place de votre perfusion de SCYOVA
|
|
· Fixez la tubulure du set de perfusion à la nouvelle seringue. o Tout en maintenant fermement la seringue, fixez la tubulure du set de perfusion à la seringue et tournez-la jusqu’à ce qu’elle soit bien serrée. o Voir le mode d’emploi du set de perfusion pour des instructions détaillées. |
|
|
· Placez la seringue dans la pompe. o Voir le mode d’emploi de la pompe Vyafuser destiné au patient pour des instructions détaillées. |
|
|
· Remplissez la tubulure du set de perfusion. Le remplissage signifie que la pompe pousse votre médicament de la seringue à travers la tubulure du set de perfusion afin d’éliminer l’air dans la tubulure. o Voir le mode d’emploi de la pompe Vyafuser destiné au patient pour des instructions détaillées. |
4. Choix et préparation du site de perfusion
|
|
· Choisissez une zone indiquée (au niveau de l’abdomen) à au moins 5 cm du nombril. · Evitez toute zone de peau cicatrisée, tout tissu induré, toute vergeture, ou tout pli ou sillon cutané où le corps se plie naturellement beaucoup, ainsi que les zones où les vêtements pourraient provoquer une irritation (par exemple, près de la ceinture). · Ouvrez un sachet de tampon alcoolisé et essuyez le site de perfusion choisi avec le tampon alcoolisé, puis laissez sécher à l’air libre pendant au moins 1 minute. Voir le mode d’emploi du set de perfusion et le mode d’emploi de la pompe Vyafuser destiné au patient pour des instructions détaillées. |
|
|
· Placez la canule sur le corps et le set de perfusion à la canule. o Insérez la canule dans votre corps. o Reliez la tubulure de perfusion à la canule. o Voir le mode d’emploi du set de perfusion pour des instructions détaillées. |
5. Début de la perfusion de SCYOVA
|
|
Démarrez la pompe. Voir le mode d’emploi de la pompe Vyafuser destiné au patient pour des informations détaillées. |
||||||||||||
|
· Options de fonctionnement de la pompe
· La pompe dispose d’options d’administration alternatives qui peuvent être configurées par votre médecin si nécessaire. |
|||||||||||||
6. Après utilisation
· Les flacons de solution usagés avec l’adaptateur de flacon encore fixé doivent être éliminés conformément aux réglementations locales ou selon les instructions de votre médecin, de votre pharmacien ou de votre infirmier/ère.