Dernière mise à jour le 06/11/2025
ENANTONE LP 30 mg, poudre et solvant pour suspension injectable (S.C.) à libération prolongée en seringue-pré-remplie
Indications thérapeutiques
Classe pharmacothérapeutique : ANALOGUE DE L’HORMONE ENTRAINANT LA LIBERATION DE GONADOTROPHINES - code ATC : L02AE02
Qu’est-ce que ENANTONE LP 30 mg
Analogue de l’hormone entrainant la libération de gonadotrophines.
Dans quels cas est-il utilisé ?
Il est utilisé chez l’homme dans certaines maladies de la prostate et des os, seul ou associé à des rayons (radiothérapie).
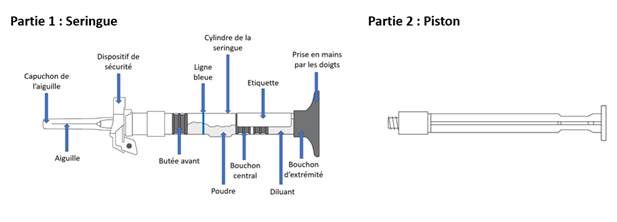
Présentations
> 1 seringue(s) préremplie(s) bicompartimenté(e)(s)/à 2 compartiments de 270 mg de poudre et de 1 ml de solvant avec système de sécurité
Code CIP : 384 583-8 ou 34009 384 583 8 1
Déclaration de commercialisation : 15/09/2008
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 461,03 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 462,05 €
- Taux de remboursement :100%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 05/12/2018 | Renouvellement d'inscription (CT) | Le service médical rendu par ENANTONE reste important dans les indications de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 21/07/2010 | Inscription (CT) | ENANTONE LP 30 mg, n'apporte pas d'amélioration du service médical rendu (niveau V) par rapport aux autres analogues de la GnRH dans le traitement du cancer de la prostate à un stade localement avancé. |
ANSM - Mis à jour le : 10/07/2025
ENANTONE LP 30 mg, poudre et solvant pour suspension injectable (S.C.) à libération prolongée en seringue pré-remplie
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Acétate de leuproréline....................................................................................................... 30,00 mg
Equivalent à leuproréline base............................................................................................ 28,58 mg
Pour une seringue pré-remplie.
Excipient à effet notoire : ce médicament contient moins de 1 mmol (23 mg) de sodium par dose, c’est-à-dire qu’il est essentiellement « sans sodium ».
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre et solvant pour suspension injectable (S.C.) à libération prolongée en seringue pré-remplie.
4.1. Indications thérapeutiques
Traitement concomitant et adjuvant à la radiothérapie externe dans le cancer de la prostate localement avancé (stade T3-T4 de la classification TNM ou stade C de la classification AUA).
4.2. Posologie et mode d'administration
Une injection sous-cutanée à renouveler tous les 6 mois (26 semaines).
Mode d’administration
ENANTONE LP 30 mg, doit être préparé, reconstitué et administré uniquement par un professionnel de santé ayant pris connaissance des instructions relatives aux étapes de reconstitution et d’administration.
Comme pour les autres spécialités administrées par voie sous-cutanée, le site d’injection doit être modifié périodiquement.
Durée du traitement :
La nécessité de poursuivre le traitement par ENANTONE LP 30 mg sera évaluée par le médecin traitant.
Dans l’indication « Traitement concomitant et adjuvant à la radiothérapie externe dans le cancer de la prostate localement avancé (stade T3-T4 de la classification TNM ou stade C de la classification AUA) », il est recommandé de poursuivre le traitement pendant 3 ans.
La mesure de la testostéronémie doit être réalisée au moins tous les six mois pendant un traitement par ENANTONE LP 30 mg.
Chez les patients traités par analogues de la GnRH pour un cancer de la prostate métastatique, le traitement est généralement maintenu en cas de développement d’un cancer de la prostate résistant à la castration. Il convient de tenir compte des recommandations en vigueur.
Mode d’administration
Ce produit doit être préparé, reconstitué et administré uniquement par des professionnels de santé familiarisés avec ces procédures.
Pour les instructions de reconstitution et de dilution du produit avant administration, se reporter à la rubrique 6.6.
4.4. Mises en garde spéciales et précautions d'emploi
Des cas isolés d’aggravation des symptômes (en particulier de douleurs osseuses), souvent transitoires, ont été observés lors de l’instauration d’un traitement par les analogues de la GnRH.
Une surveillance attentive sera effectuée lors de l’instauration du traitement par leuproréline et pendant les premières semaines suivant celle-ci :
chez les patients porteurs d’une obstruction des voies excrétrices ;
chez les malades présentant des métastases vertébrales (voir rubrique 4.8) ;
chez les sujets présentant des signes annonçant une compression médullaire.
En début de traitement, une augmentation transitoire des phosphatases acides peut être observée.
Dépression
Il existe un risque accru de survenue de dépression incidente (qui peut être sévère) chez les patients traités par agonistes de la GnRH, tels que la leuproréline. Les patients doivent être informés en conséquence et traités de façon appropriée si des symptômes apparaissent.
Risque cardiovasculaire et métabolique
Des données épidémiologiques ont montré que des modifications métaboliques (par exemple réduction de la tolérance au glucose, stéatose hépatique ou aggravation d’un diabète préexistant) ainsi qu’une augmentation du risque de maladie cardiovasculaire peuvent survenir pendant un traitement par privation androgénique. Toutefois, les données prospectives n’ont pas confirmé le lien entre le traitement par analogues de la GnRH et une augmentation de la mortalité cardiovasculaire. Les patients à haut risque de maladies cardiovasculaires ou métaboliques doivent être surveillés de façon appropriée.
Les traitements par privation androgénique peuvent allonger l’intervalle QT.
Chez les patients ayant un antécédent ou des facteurs de risque d’allongement de l’intervalle QT et chez les patients recevant un traitement concomitant qui risque d’allonger l’intervalle QT (voir rubrique 4.5), le rapport bénéfice risque incluant le risque potentiel de torsade de pointe devra être évalué avant l’instauration du traitement par ENANTONE.
Veiller à ne pas injecter la suspension par voie intra-artérielle.
Des cas de convulsions ont été rapportés par les patients traités par la leuproréline après sa mise sur le marché. Ces convulsions ont été observées aussi bien chez les adultes que chez les enfants, possédant ou non des antécédents, troubles ou facteurs de risque liés aux convulsions.
Hypertension intracrânienne idiopathique
Des cas d’hypertension intracrânienne idiopathique (méningite séreuse) ont été rapportés chez des patients recevant de la leuproréline. Les patients doivent être avertis de la possibilité de signes et symptômes d’hypertension intracrânienne idiopathique, notamment des céphalées sévères ou récurrentes, de troubles visuels et d’acouphènes. En présence d’une hypertension intracrânienne idiopathique, l’interruption du traitement par leuproréline doit être envisagée.
Réactions indésirables cutanées sévères
Des réactions indésirables cutanées sévères (SCAR), dont le syndrome de Stevens-Johnson (SSJ), et la nécrolyse épidermique toxique (NET, ou syndrome de Lyell), qui peuvent engager le pronostic vital ou être fatals, ont été rapportés en association avec le traitement par leuproréline. Au moment de la prescription, les patients doivent être informés des signes et symptômes, et surveillés étroitement en cas de réactions cutanées graves. En cas d’apparition de signes et symptômes évocateurs de ces réactions, le traitement par leuproréline doit être arrêté immédiatement et un autre traitement doit être envisagé (le cas échéant).
Précautions d’emploi
La testostéronémie doit être vérifiée périodiquement en cours de traitement, sa valeur ne devant pas être supérieure à 1 ng/ml.
Une appréciation de la réponse au traitement sera effectuée périodiquement par un examen clinique et prostatique (toucher rectal), des dosages sanguins (dosage de l’antigène prostatique spécifique ou PSA), voire une scintigraphie osseuse.
Si l’on observe un changement de couleur des microsphères à libération prolongée ou une turbidité au niveau du solvant de dilution avant la mise en suspension, ne pas utiliser la seringue pré-remplie. Chez l’homme, une privation à long terme d’androgènes par orchidectomie bilatérale ou par administration d’analogues de la GnRH est associée à un risque accru de perte osseuse qui, chez les patients présentant des facteurs de risque additionnels, peut entrainer une ostéoporose et accroître le risque de fracture osseuse (voir rubrique 4.8).
Il est rare d’observer des abcès provoqués par une injection. Si un tel phénomène se produisait avec ENANTONE LP 30 mg, surveiller la testostéronémie ; en effet, une augmentation de la testostéronémie peut se produire, due à une absorption inadéquate de la leuproréline contenue dans les microsphères.
Dans l’éventualité de l’apparition de signes cliniques de progression malgré un traitement adéquat, il est recommandé de surveiller régulièrement le patient en cours de traitement par ENANTONE LP 30 mg par la réalisation d’examens adaptés, examen clinique incluant le toucher rectal, l’échographie, la scintigraphie osseuse, et/ou la tomodensitométrie ainsi que par un suivi biologique des taux sanguins de phosphatases, de PSA et de testostéronémie.
Sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose, c’est-à-dire qu’il est essentiellement « sans sodium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Les traitements par privation androgénique pouvant allonger l’intervalle QT, l’utilisation concomitante d’ENANTONE avec des médicaments connus pour allonger l’intervalle QT ou avec des médicaments induisant des torsades de pointe tels que les antiarythmiques de classe IA (par exemple quinidine, disopyramide) ou de classe III (par exemple amiodarone, sotalol, dofetilide, ibutilide), méthadone, moxifloxacine, antipsychotiques, etc devra être évaluée avec prudence (voir rubrique 4.4).
4.6. Fertilité, grossesse et allaitement
Non évalué, cette formulation n’étant pas indiquée chez la femme.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Ils sont en partie dus à l’activité pharmacologique du produit, soit la privation hormonale. La fréquence d’observation des évènements indésirables au cours des essais cliniques et de l’expérience post commercialisation avec ENANTONE LP 30 mg sont énumérés ci-dessous par catégorie de fréquence. Les catégories sont définies comme suit : très fréquente (> 1/10), fréquente (> 1/100, < 1/10), peu fréquente (> 1/1 000, < 1/100), rare (> 1/10 000, < 1/1 000), très rare (< 1/10 000), indéterminée (ne peut être estimée sur la base des données disponibles).
|
Classes de systèmes d’organes |
Très fréquent |
Fréquent |
Peu fréquent |
Rare |
Très rare |
Indéterminée |
|
Affections hématologiques et du système lymphatique |
|
Anémie |
|
|
|
|
|
Affectations du système immunitaire |
|
|
Réactions allergiques généralisées (fièvre, prurit, éosinophilie et rash cutané)
|
|
Réaction anaphylactique (urticaire, angiœdème, choc anaphylactique) |
|
|
Troubles du métabolisme et de la nutrition |
|
Perte d’appétit |
|
Modification du métabolisme du glucose (diminution ou augmentation) |
|
Intolérance au glucose |
|
Affections psychiatriques |
|
Altération d’humeur, dépression ont été fréquemment observées lors des traitements à long terme |
Altération d’humeur, dépression ont été peu fréquemment observées lors des traitements à court terme |
|
|
|
|
Affections du système nerveux |
|
Céphalées |
|
Sensation de malaise, altérations transitoires du goût |
Apoplexie hypophysaire (après administration initiale chez des patients porteurs d’un adénome hypophysaire) |
Convulsions Hypertension intracrânienne idiopathique (méningite séreuse) (voir rubrique 4.4) |
|
Affections oculaires |
|
|
|
|
|
Troubles visuels |
|
Affections cardiaques |
|
|
|
|
|
Allongement de l’intervalle QT (voir rubriques 4.4 et 4.5) |
|
Affections vasculaires |
Bouffées de chaleur |
|
|
Modification de la pression artérielle (hypertension ou hypotension) |
|
|
|
Affections gastro-intestinales |
|
Nausées |
Vomissements, diarrhées |
|
|
|
|
Affections hépatobiliaires |
|
Fonction hépatique anormale |
|
|
|
|
|
Affections de la peau et du tissu sous-cutané |
|
|
Sécheresse cutanée ou des muqueuses |
Alopécie |
|
Syndrome de Stevens-Johnson (SSJ) / nécrolyse épidermique toxique (NET ou syndrome de Lyell) (voir rubrique 4.4), éruption cutanée toxique, érythème polymorphe |
|
Affections musculosquelettiques et du tissu conjonctif |
Douleurs osseuses |
Douleurs articulaires, faiblesse musculaire |
Myalgie |
|
|
|
|
Affections des organes de reproduction et du sein |
Troubles de la libido, impuissance, réduction de la taille des testicules |
Gynécomastie |
Douleurs testiculaires |
|
|
|
|
Affections du rein et des voies urinaires |
Nycturie, dysurie |
|
|
|
|
|
|
Troubles généraux et anomalies au site d'administration |
Réactions au point d’injection, notamment érythème, douleur, œdème, prurit. Ces événements diminuent généralement lors de la poursuite du traitement ; des cas isolés d’abcès ont été observés. Sueurs |
Fatigue, œdème périphérique, paresthésies, troubles du sommeil |
|
|
|
|
|
Affections respiratoires, thoraciques et médiastinales |
|
|
|
|
|
Pneumopathie interstitielle |
|
Investigations |
Prise de poids |
Elévation des taux sanguins de LDH, transaminases, gamma-GT et phosphatases alcalines |
Perte de poids |
|
|
|
Mise en route du traitement (voir rubrique 4.4) :
Elle est parfois accompagnée d'une accentuation des signes cliniques et des symptômes (en particulier des douleurs osseuses).
Quelques cas d'aggravation d'une hématurie préexistante ou d'une obstruction urinaire, de sensations de faiblesse ou de paresthésies des membres inférieurs ont été signalés avec les analogues de la GnRH.
Ces manifestations sont habituellement transitoires, disparaissant en 1 à 2 semaines lors de la poursuite du traitement. Néanmoins, la possibilité d'une exacerbation temporaire des symptômes durant les premières semaines de traitement doit être prise en compte chez des malades menacés par la survenue de désordres neurologiques ou chez ceux présentant une obstruction urinaire.
Altération des paramètres biologiques
Fréquent : des cas d’élévation des taux sanguins de LDH, des transaminases, de gamma-GT et des phosphatases alcalines ont été notés, pouvant être liés à la maladie sous-jacente ; diminution du taux sanguin d’hémoglobine.
Variations de la densité osseuse
Une diminution de la densité osseuse a été rapportée dans la littérature médicale chez les hommes ayant bénéficié d’une orchidectomie ou ceux traités par un agoniste de la GnRH. Il est probable qu’un traitement à long terme par la leuproréline révèle des signes d’aggravation d’ostéoporose, en ce qui concerne l’augmentation du risque de fracture d’origine ostéoporotique (voir rubrique 4.4).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
Sans objet.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Le principe actif d’ENANTONE LP 30 mg, la leuproréline, est un nonapeptide de synthèse, analogue de la GnRH naturelle, hormone ayant pour effet de contrôler la libération des hormones gonadotropes LH (luteinizing hormone) et FSH (follicle-stimulating hormone) par le lobe antérieur de la glande hypophysaire.
La leuproréline est 80 fois plus puissante que l’hormone naturelle, mais elle agit de manière opposée : en utilisation chronique, elle bloque les récepteurs de la LHRH de la glande hypophysaire et, après une phase initiale de stimulation, elle désensibilise ces récepteurs.
Il se produit ainsi une suppression réversible des gonadotrophines hypophysaires, suivie d’une diminution rapide des taux sanguins de testostérone, stoppant ainsi la croissance du cancer prostatique (en effet, celle-ci est habituellement stimulée par la dihydrotestostérone qui est formée à partir de la testostérone au niveau des cellules de la prostate).
L’administration régulière d’acétate de leuproréline conduit à une réduction du nombre et/ou de la sensibilité des récepteurs à la GnRH de la glande hypophysaire et donc à une diminution des taux de LH, FSH et DHT (dihydrotestostérone), réduisant ainsi le taux de testostérone en dessous du seuil de castration.
L’effet inhibiteur anti-androgène de l’acétate de leuproréline sur la croissance du cancer prostatique a été démontré chez l’animal.
Des études expérimentales et cliniques ont démontré qu’un traitement de 6 mois avec ENANTONE LP 30 mg conduit à une inhibition de la libération de gonadotrophines après un effet initial stimulant.
L’administration sous cutanée d’ENANTONE LP 30 mg produit une augmentation des taux sanguins de LH et de FSH, entraînant une augmentation initiale des taux de stéroïdes gonadiques (testostérone et DHT). Des cas isolés d’exacerbation des symptômes durant les quelques premières semaines de traitement par agoniste de la GnRH ont été rapportés ; l’administration concomitante d’un anti-androgène approprié pourra être envisagée en début de traitement par leuproréline.
La poursuite du traitement entraîne une diminution des taux de LH et de FSH chez tous les patients, conduisant ainsi à une diminution des taux d’androgènes à des taux comparables à ceux d’une castration chirurgicale. Ceci se produit généralement dans un délai de 2 à 3 semaines après le début du traitement par l’agoniste de la GnRH et se maintient aussi longtemps que le produit est administré.
De plus, l’administration d’ENANTONE LP 30 mg permet de vérifier la sensibilité hormonale du cancer de prostate en cours de traitement. Elle représente une alternative à la castration chirurgicale.
A ce jour, il a été démontré que la leuproréline pouvait maintenir le taux de testostérone sous le seuil de castration durant 5 ans en administration continue.
La réponse clinique au traitement par ENANTONE LP 30 mg peut être évaluée en mesurant les taux sériques de testostérone, de phosphatase acide et de PSA (Prostate Specific Antigen). En particulier, il est généralement observé une augmentation du taux de testostérone suivie d’une diminution exponentielle puis d’une phase de stabilisation suggérant une suppression de la testostérone (taux inférieur au seuil de castration) qui se poursuit tout au long du traitement.
5.2. Propriétés pharmacocinétiques
Le premier pic de concentration plasmatique est atteint 2 heures après l’injection. Celui-ci est suivi d’une diminution rapide pour atteindre un niveau minimum de concentration. Un second pic de concentration est observé à la 4e semaine ; les concentrations diminuent ensuite lentement pour atteindre un niveau inférieur à 100 pg/ml (observé à la 20e semaine après l’injection).
5.3. Données de sécurité préclinique
Des études de toxicité aiguë chez la souris et le rat (mâles et femelles) ont été menées avec la leuproréline administrée selon 4 voies (parentérale, intramusculaire, sous-cutanée et orale). Aucun décès n’a été observé à des doses allant jusqu’à 2000 mg et 5000 mg respectivement d’acétate de leuproréline.
Toxicité en administration répétée
Des études de toxicité en utilisation continue ont été menées chez le rat et le chien, recevant des injections d’acétate de leuproréline :
durant 13 semaines, en sous-cutané ou en intramusculaire, à des doses allant jusqu’à 8 mg/kg/semaine ;
et durant 12 mois, en sous-cutané, à des doses pouvant aller jusqu’à 32 mg/kg/mois.
A tous les dosages testés (au minimum 0,8 mg/kg/mois) ont été observés des lésions au niveau du site d’injection ainsi qu’une atrophie des organes reproducteurs. Chez le rat, les cellules du foie ainsi que les cellules épithéliales tubulaires rénales ont présenté des vacuoles à tous les dosages. Les modifications des organes reproducteurs sont dues à l’effet endocrine de la substance active.
Carcinogénicité, mutagénicité, effet sur la fertilité
Carcinogénicité
Des études de carcinogenèse ont été menées chez le rat et la souris sur une durée de 2 ans. Une augmentation dose-dépendante d’adénomes hypophysaires a été observée chez le rat secondairement à une administration quotidienne sous-cutanée de leuproréline à des doses allant de 0,6 à 4 mg ; tandis qu’aucun adénome hypophysaire n’a été observé chez la souris lors d’administrations quotidiennes durant 2 ans de 60 mg/kg de leuproréline.
Mutagénicité
Des études in vitro et in vivo avec l’acétate de leuproréline n’ont pas montré de potentiel mutagène en termes de mutations génétiques ou chromosomiques.
Poudre : acide polylactique, mannitol
Solvant : carmellose sodique, mannitol, polysorbate 80, eau pour préparations injectables
3 ans
La stabilité de la suspension reconstituée a été démontrée pendant 24 heures à 25°C. Toutefois du point de vue microbiologique, le produit doit être utilisé immédiatement.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
A conserver dans l’emballage extérieur d’origine, à l’abri de la lumière.
6.5. Nature et contenu de l'emballage extérieur
270 mg de poudre + 1 ml de solvant en seringue pré-remplie à double compartiment ; boîte de 1.
6.6. Précautions particulières d’élimination et de manipulation
Ce produit doit être préparé, reconstitué et administré uniquement par des professionnels de santé familiarisés avec ces procédures.
Se laver les mains avant d'ouvrir l'emballage de la seringue.
Tenir la seringue en position verticale (aiguille tournée vers le haut) pendant toute la durée de la préparation pour éviter les fuites.
Utilisez le mélange immédiatement après reconstitution car la suspension forme un dépôt très rapidement après reconstitution.
Vérifiez la date de péremption imprimée sur l'étiquette de la seringue et vérifiez la poudre et le diluant dans le cylindre de la seringue. La poudre doit être blanche et sèche, le diluant doit être transparent. Inspectez la seringue pour vérifier qu'elle n'est pas endommagée.
· Ne pas utiliser la seringue si la date de péremption est dépassée.
· Ne pas utiliser la seringue si la poudre semble agglutinée ou collée.
· Ne pas utiliser la seringue si la poudre ou le diluant semblent décolorés.
· Ne pas utiliser la seringue si l’une de ses parties est endommagée.
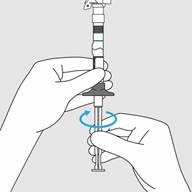
Etape 1. Visser le piston à la seringue et fixer l’aiguille
· Retirez le piston (partie 2) de l’emballage.
· Vissez la tige du piston au bout de la seringue pré-remplie (côté opposé à l’aiguille) jusqu’à ce que le joint en plastique commence à tourner dans la seringue.
o Ne pas tordre ou tirer vers l’arrière la tige du piston une fois qu’elle a été fixée à la seringue.
· Sans retirer le capuchon de l’aiguille, tournez l’aiguille vers la droite (dans le sens des aiguilles d’une montre) pour vous assurer qu’elle est bien fixée.
o Ne pas retirer le capuchon de l’aiguille avant d’être prêt à injecter.
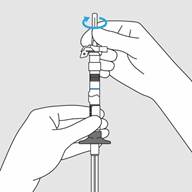
Etape 2. Libération du diluant
· En tenant la seringue à la verticale, libérer le diluant en poussant lentement le piston jusqu’à ce que le joint mobile séparant les 2 chambres atteigne la ligne bleue au milieu de la seringue. Vous devriez voir le diluant s’écouler dans la chambre intérieure au-dessus de la ligne bleue.
o Ne pas pousser le piston trop rapidement et ne pas dépasser la ligne bleue afin de ne pas provoquer des fuites.
o Ne pas retirer pas le piston à nouveau.
Etape 3. Homogénéisation de la suspension
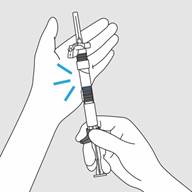
· Taper légèrement la seringue contre la paume de votre main pour mélanger la poudre et le diluant aussi longtemps que nécessaire pour obtenir une suspension homogène et de couleur blanche.
o Remarque : Si des particules collent au bouchon pendant le mélange, délogez-les en tapotant doucement la seringue avec votre doigt.
· Ne pas secouer afin d’éviter la formation de bulles.
· Utiliser immédiatement après le mélange car la suspension forme un dépôt très rapidement après la reconstitution.
Important : La suspension ainsi obtenue doit être homogène et de couleur blanche (lactescente) avant de procéder à l’injection.
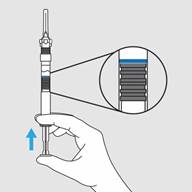
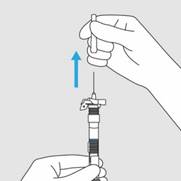
Etape 4. Retirer le capuchon de l’aiguille
· Oter le capuchon de l’aiguille en le tirant droit vers le haut.
· Ne pas tordre le capuchon de l’aiguille.
· Amorcez la seringue en poussant le piston vers le haut jusqu’à ce que tout l’air ait été expulsé de la seringue.
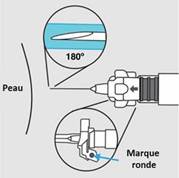
Etape 5. Injection
· La seringue est maintenant prête pour l’injection. Utiliser immédiatement car la suspension se stabilise très rapidement après la reconstitution.
o Au moment de l’injection, vérifiez la direction du dispositif de sécurité (avec une marque ronde pointant vers vous) et injectez tout le contenu de la seringue par voie sous-cutanée ou comme vous le feriez pour une injection normale.
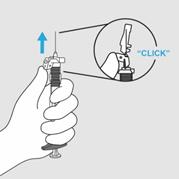
Etape 6. Activer le système de sécurité
· Lorsque l’injection est terminée, retirez l’aiguille du patient. Activez immédiatement le dispositif de sécurité en poussant le capuchon protecteur vers le haut juste en dessous de la flèche jusqu’à ce qu’un « CLIC » soit entendu ou ressenti et que l’aiguille soit complètement recouverte.
Etape 7. Jeter la seringue
· Jetez l’appareil usagé dans le contenant approprié conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
16 PLACE DE L’IRIS
92400 COURBEVOIE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Liste I
ANSM - Mis à jour le : 10/07/2025
Acétate de leuproréline
Gardez cette notice. Vous pourriez avoir besoin de la relire.
Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que ENANTONE LP 30 mg, poudre et solvant pour suspension injectable (S.C.) à libération prolongée en seringue pré-remplie et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser ENANTONE LP 30 mg, poudre et solvant pour suspension injectable (S.C.) à libération prolongée en seringue pré-remplie ?
3. Comment utiliser ENANTONE LP 30 mg, poudre et solvant pour suspension injectable (S.C.) à libération prolongée en seringue pré-remplie ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver ENANTONE LP 30 mg, poudre et solvant pour suspension injectable (S.C.) à libération prolongée en seringue pré-remplie ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE ENANTONE LP 30 mg, poudre et solvant pour suspension injectable (S.C.) à libération prolongée en seringue pré-remplie ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : ANALOGUE DE L’HORMONE ENTRAINANT LA LIBERATION DE GONADOTROPHINES - code ATC : L02AE02
Qu’est-ce que ENANTONE LP 30 mg
Analogue de l’hormone entrainant la libération de gonadotrophines.
Dans quels cas est-il utilisé ?
Il est utilisé chez l’homme dans certaines maladies de la prostate et des os, seul ou associé à des rayons (radiothérapie).
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER ENANTONE LP 30 mg, poudre et solvant pour suspension injectable (S.C.) à libération prolongée en seringue pré-remplie ?
si vous êtes allergique (hypersensible) à la leuproréline, aux dérivés ou aux analogues de la GnRH ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Avertissements et précautions
Faites attention avec ENANTONE L.P. 30 mg, poudre et solvant pour suspension injectable (S.C.) à libération prolongée en seringue pré-remplie :
Des cas de dépression, pouvant être sévère ont été rapportés chez des patients traités par ENANTONE LP 30 mg, poudre et solvant pour suspension injectable (SC) à libération prolongée en seringue pré-remplie.
Si vous prenez ENANTONE LP 30 mg, poudre et solvant pour suspension injectable (SC) à libération prolongée en seringue pré-remplie et si vous ressentez une humeur dépressive, parlez-en à votre médecin.
Veuillez signaler à votre médecin si vous souffrez du cœur ou des vaisseaux, y compris si vous avez des troubles du rythme (arythmies) ou si vous êtes traités par des médicaments pour ces problèmes. Le risque de troubles du rythme cardiaque peut être augmenté avec ENANTONE.
Lors de la mise en route d’un traitement par ENANTONE, des cas isolés d’aggravation des symptômes cliniques (en particulier des douleurs osseuses), le plus souvent transitoires, ont été observés.
Une surveillance attentive sera effectuée pendant les premières semaines de traitement et une consultation médicale sera demandée rapidement devant toute aggravation des symptômes.
Des cas de convulsions ont été rapportés chez les patients traités par ENANTONE LP 30 mg poudre et solvant après sa mise sur le marché. Ces convulsions ont été observées chez les adultes avec ou sans antécédents, troubles, ou facteurs de risque liés aux convulsions.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Si vous souffrez de maux de tête intenses ou récurrents, de problèmes de vue et de sifflements ou bourdonnements dans les oreilles, contactez votre médecin immédiatement.
Des éruptions cutanées sévères, dont le syndrome de Stevens-Johnson (SSJ) et la nécrolyse épidermique toxique (NET ou syndrome de Lyell) ont été rapportées en association avec la leuproréline. Arrêtez d’utiliser la leuproréline et consultez immédiatement un médecin si vous remarquez l’un des symptômes liés à ces réactions cutanées graves, décrits à la rubrique 4.
Adressez-vous à votre médecin, pharmacien ou infirmier/ère avant d’utiliser ENANTONE L.P. 30 mg, poudre et solvant pour suspension injectable (S.C.) à libération prolongée en seringue pré-remplie si vous :
- présentez une stéatose hépatique (une maladie dans laquelle un excès de graisse s’accumule dans le foie).
Prendre des précautions particulières avec ENANTONE L.P. 30 mg, poudre et solvant pour suspension injectable (S.C.) à libération prolongée en seringue pré-remplie :
Ce médicament doit être utilisé sous surveillance médicale.
Votre médecin surveillera votre taux sanguin de sucre régulièrement car ENANTONE peut modifier votre métabolisme et donc votre taux sanguin de sucre.
Votre médecin doit s’assurer de la surveillance de votre densité osseuse et peut vous prescrire un traitement approprié car l’utilisation de ce médicament peut entraîner une diminution de la densité osseuse, une ostéoporose (fragilisation des os) et un risque accru de fractures osseuses.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Autres médicaments et ENANTONE L.P. 30 mg, poudre et solvant pour suspension injectable (S.C.) à libération prolongée en seringue pré-remplie
Veuillez indiquer à votre médecin ou à votre pharmacien si vous prenez ou avez pris récemment un autre médicament, même s’il s’agit d’un médicament obtenu sans ordonnance.
D’autres médicaments et ENANTONE peuvent interagir avec les médicaments utilisés pour traiter les problèmes de rythme cardiaque (par exemple quinidine, procainamide, amiodarone et sotalol) ou peuvent augmenter le risque de troubles du rythme quand ils sont utilisés avec d’autres médicaments (par exemple méthadone (utilisé pour le traitement de la douleur et en désintoxication de l’addiction médicamenteuse, moxifloxacine (un antibiotique), antipsychotiques utilisés pour les maladies mentales graves).
ENANTONE L.P. 30 mg, poudre et solvant pour suspension injectable (S.C.) à libération prolongée en seringue pré-remplie avec des aliments, boissons et de l’alcool
Sans objet.
Grossesse, allaitement et fertilité
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Sportifs
Sans objet.
Conduite de véhicules et utilisation de machines
Les effets d’ENANTONE L.P. 30 mg sur l’aptitude à conduire des véhicules et à utiliser des machines n’ont pas été étudiés. Une fatigue, une faiblesse musculaire et des troubles du sommeil peuvent survenir au cours de votre maladie ou de votre traitement. Si vous ressentez l’un de ces effets, vous devez être prudent si vous conduisez ou utilisez des machines.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose, c’est-à-dire qu’il est essentiellement « sans sodium ».
3. COMMENT UTILISER ENANTONE LP 30 mg, poudre et solvant pour suspension injectable (S.C.) à libération prolongée en seringue pré-remplie ?
ENANTONE LP 30 mg doit être uniquement administré par votre médecin ou un(e) infirmier(e). Ce sont eux qui seront chargés de préparer le produit.
La dose habituelle est de 1 injection tous les 6 mois.
Ce médicament sera injecté sous la peau.
Le mode d’administration de ce médicament est également expliqué dans la partie réservée aux professionnels de santé (voir ci-après).
Durée du traitement :
Votre médecin vous dira pendant combien de temps vous devez utiliser ce médicament.
Si vous avez utilisé plus de ENANTONE L.P. 30 mg, poudre et solvant pour suspension injectable (S.C.) à libération prolongée en seringue pré-remplie que vous n’auriez dû :
Demandez conseil à votre médecin ou votre pharmacien.
Si vous oubliez d’utiliser ENANTONE L.P. 30 mg, poudre et solvant pour suspension injectable (S.C.) à libération prolongée en seringue pré-remplie :
Ne prenez pas de dose double pour compenser la dose simple que vous avez oublié de prendre.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Ces effets indésirables décrits ci-après peuvent survenir même si l’effet du traitement est favorable.
Cependant, vous devez avertir immédiatement votre médecin traitant si l’un de ces effets survient.
Lors de la mise en route du traitement :
En début de traitement, une aggravation des effets et des symptômes pour lesquels vous êtes traité peut survenir (et en particulier des douleurs osseuses).
Quelques personnes qui avaient :
· du sang dans leur urine,
· une difficulté à uriner (obstruction des voies urinaires),
· des sensations de faiblesse ou des sensations anormales au niveau des jambes,
ont ressenti une aggravation de ces symptômes lorsqu’ils ont pris un médicament de la même famille qu’ENANTONE.
Ces aggravations sont habituellement temporaires et disparaissent après 1 ou 2 semaines de traitement.
Vous devez néanmoins prévenir votre médecin si vous ressentez une aggravation de ces symptômes et notamment si vous avez des difficultés à uriner ou si vous avez un risque de maladie des nerfs et/ou du cerveau.
Pendant le traitement
Les effets indésirables suivants peuvent survenir :
Effets très fréquents (peuvent affecter plus de 1 personne sur 10) :
o des bouffées de chaleur,
o des douleurs osseuses,
o une diminution de la libido, une impuissance, une diminution de la taille des testicules,
o des troubles urinaires,
o une douleur, une réaction, une rougeur, des démangeaisons ou un gonflement au point d’injection. Ces effets diminuent généralement lors de la poursuite du traitement,
o des sueurs,
o une prise de poids.
Effets fréquents (peuvent affecter jusqu’à 1 personne sur 10) :
o une diminution ou une perte de l’appétit (anorexie),
o une altération de l’humeur et une dépression (à long terme),
o des maux de tête,
o des nausées,
o des douleurs articulaires, une faiblesse musculaire,
o une augmentation du volume des seins,
o une fatigue, un gonflement des extrémités (bras et jambes), des fourmillements, des troubles du sommeil,
o une diminution du nombre de globules rouges,
o une augmentation de certaines enzymes,
o une fonction hépatique anormale.
Effets peu fréquents (peuvent affecter jusqu’à 1 personne sur 100) :
o Allergie : des réactions allergiques généralisées peuvent apparaître. Vous reconnaitrez les signes d’une allergie par de la fièvre, des démangeaisons, une augmentation du taux de certains globules blancs (les éosinophiles) et des boutons et/ou des plaques rouges. Si une allergie survient, vous devez arrêter le traitement et contacter immédiatement un médecin.
o des diarrhées,
o des vomissements,
o une sécheresse de la peau ou des muqueuses (à l’intérieur du nez, de la bouche et/ou les parties génitales),
o des douleurs des testicules,
o des douleurs musculaires,
o une perte de poids,
o une dépression (à court terme).
Effets rares (peuvent affecter jusqu’à 1 personnes sur 1 000) :
o une diminution ou une augmentation du taux de glucose dans le sang,
o une sensation de malaise, une altération temporaire du goût,
o une baisse ou une augmentation de la tension artérielle (hypotension ou hypertension),
o une chute des cheveux ou des poils.
Effets très rares (concernent moins de 1 personne sur 10 000) :
o un arrêt du fonctionnement d’une glande du cerveau, l’hypophyse (apoplexie hypophysaire) chez des patients présentant une hypophyse de taille augmentée : si vous avez une lésion hypophysaire préexistante, il peut y avoir une augmentation du risque d’hémorragie dans cette région, pouvant provoquer des maux de tête violents, des troubles visuels et des troubles de la conscience nécessitant une prise en charge en urgence.
o réaction anaphylactique : réaction allergique grave pouvant se manifester par une urticaire, un choc allergique, un angiœdème (réaction allergique grave provoquant un gonflement du cou et du visage, gêne respiratoire).
Effets de fréquence indéterminée (ne peut être estimée sur la base des données disponibles) :
o Modification de l’ECG (allongement de l’intervalle QT),
o Convulsions,
o Hypertension intracrânienne idiopathique (augmentation de la pression intracrânienne dans la zone du cerveau caractérisée par des maux de tête, une vision double et autres symptômes visuels et des sifflements ou bourdonnements dans une ou les deux oreilles),
o Inflammation des poumons, maladie pulmonaire,
o Intolérance au glucose (élévation du taux de glucose dans le sang),
o Troubles visuels,
o Rougeur cutanée et éruption cutanée accompagnée de démangeaisons (éruption cutanée toxique),
o Eruption cutanée qui provoque l’apparition de boutons ou de plaques rouges sur la peau, pouvant ressembler à une cible, avec un centre rouge entouré de cercles rouges plus pâles (érythème polymorphe).
Variation de la densité des os :
Il est probable qu’un traitement à long terme par la leuproréline révèle des signes d’aggravation d’ostéoporose (fragilisation osseuse).
Consultez immédiatement un médecin si vous remarquez l’un des symptômes suivants :
Si vous présentez des plaques rougeâtres non surélevées, en forme de cible ou circulaires sur le tronc, souvent avec des cloques centrales, une desquamation de la peau, des aphtes de la bouche, de la gorge, du nez, des organes génitaux et des yeux. Ces éruptions cutanées graves peuvent être précédées de fièvre et de symptômes pseudo-grippaux (Syndrome de Stevens-Johnson/Nécrolyse épidermique toxique).
Rougeur cutanée et éruption cutanée accompagnée de démangeaisons (éruption cutanée toxique).
Une éruption cutanée qui provoque l’apparition de boutons ou de plaques rouges sur la peau, pouvant ressembler à une cible, avec un centre rouge entouré de cercles rouges plus pâles (érythème polymorphe).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER ENANTONE LP 30 mg, poudre et solvant pour suspension injectable (S.C.) à libération prolongée en seringue pré-remplie ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas 25°C.
A conserver dans l’emballage extérieur d’origine, à l’abri de la lumière.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
La substance active est :
Acétate de leuproréline..................................................................................................... 30 mg
Equivalent à leuproréline base...................................................................................... 28,58 mg
Pour une seringue pré-remplie.
Les autres composants sont :
o Poudre : Acide polylactique, mannitol.
o Solvant : Carmellose sodique, mannitol, polysorbate 80, eau pour préparations injectables.
Ce médicament se présente sous forme de poudre et de solvant pour suspension injectable (S.C.) à libération prolongée en seringue pré-remplie.
Chaque boîte contient 1 seringue pré-remplie.
Titulaire de l’autorisation de mise sur le marché
16 PLACE DE L’IRIS
92400 COURBEVOIE
Exploitant de l’autorisation de mise sur le marché
TAKEDA FRANCE SAS
16 PLACE DE L’IRIS
92400 COURBEVOIE
VIA CROSA, 86
28065 CERANO (NO)
ITALIE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Sans objet.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé :
Posologie
Une injection toutes les 26 semaines (6 mois).
Mode et voie d’administration
Voie sous-cutanée.
Mode d’utilisation
Ce produit doit être préparé, reconstitué et administré uniquement par des professionnels de santé familiarisés avec ces procédures.
Avertissements
Se laver les mains avant d'ouvrir l'emballage de la seringue.
Tenir la seringue en position verticale (aiguille tournée vers le haut) pendant toute la durée de la préparation pour éviter les fuites.
Utilisez le mélange immédiatement après reconstitution car la suspension forme un dépôt très rapidement après la reconstitution.
Vérifiez la date de péremption imprimée sur l'étiquette de la seringue, vérifiez la poudre et le diluant dans le cylindre de la seringue. La poudre doit être blanche et sèche, le diluant doit être transparent. Inspectez la seringue pour vérifier qu'elle n'est pas endommagée.
· Ne pas utiliser la seringue si la date de péremption est dépassée.
· Ne pas utiliser la seringue si la poudre semble agglutinée ou collée.
· Ne pas utiliser la seringue si la poudre ou le diluant semblent décolorés.
· Ne pas utiliser la seringue si l’une de ses parties est endommagée.
|
|
|
||||
|
Etape 1. Visser le piston à la seringue et fixer l’aiguille · Retirez le piston (partie 2) de l’emballage. · Vissez la tige du piston au bout de la seringue pré-remplie (côté opposé à l’aiguille) jusqu’à ce que le joint en plastique commence à tourner dans la seringue. (Figure A) · Ne pas tordre ou tirer vers l’arrière la tige du piston une fois qu’elle a été fixée à la seringue.
· Sans retirer le capuchon de l’aiguille, tournez l’aiguille vers la droite (dans le sens des aiguilles d’une montre) pour vous assurer qu’elle est bien fixée. (Figure B) · Ne pas retirer le capuchon de l’aiguille avant d’être prêt à injecter. |
Figure A : Visser la tige du piston
Figure B : Vérifier la fixation de l’aiguille |
||||
|
Etape 2. Libération du diluant · En tenant la seringue à la verticale, libérer le diluant en poussant lentement le piston jusqu’à ce que le joint mobile séparant les 2 chambres atteigne la ligne bleue au milieu de la seringue. Vous devriez voir le diluant s’écouler dans la chambre intérieure au-dessus de la ligne bleue. (Figure C) · Ne pas pousser le piston trop rapidement et ne pas dépasser la ligne bleue afin de ne pas provoquer des fuites. · Ne pas retirer pas le piston à nouveau. |
Figure C : Libérer le diluant |
||||
|
Etape 3. Homogénéisation de la suspension · Taper légèrement la seringue contre la paume de votre main pour mélanger la poudre et le diluant aussi longtemps que nécessaire pour obtenir une suspension homogène et de couleur blanche. (Figure D) · Remarque : Si des particules collent au bouchon pendant le mélange, délogez-les en tapotant doucement la seringue avec votre doigt. · Ne pas secouer afin d’éviter la formation de bulles. · Utiliser immédiatement après le mélange car la suspension forme un dépôt très rapidement après la reconstitution.
Important : La suspension ainsi obtenue doit être homogène et de couleur blanche (lactescente) avant de procéder à l’injection.
|
Figure D : Taper légèrement la seringue contre la paume de main pour uniformiser la suspension |
||||
|
Etape 4. Retirer le capuchon de l’aiguille · Oter le capuchon de l’aiguille en le tirant droit vers le haut. · Ne pas tordre le capuchon de l’aiguille.
· Amorcez la seringue en poussant le piston vers le haut jusqu’à ce que tout l’air ait été expulsé de la seringue. |
Figure E : Tirez vers le haut pour retirer le capuchon de l’aiguille |
||||
|
Etape 5. · La seringue est maintenant prête pour l’injection. Utiliser immédiatement car la suspension se stabilise très rapidement après la reconstitution. · Au moment de l’injection, vérifiez la direction du dispositif de sécurité (avec une marque ronde pointant vers vous) et injectez tout le contenu de la seringue par voie sous-cutanée (Figure F) comme vous le feriez pour une injection normale.
|
|
||||
|
Etape 6. Activer le système de sécurité · Lorsque l’injection est terminée, retirez l’aiguille du patient. Activez immédiatement le dispositif de sécurité en poussant le capuchon protecteur vers le haut juste en dessous de la flèche jusqu’à ce qu’un « CLIC » soit entendu ou ressenti et que l’aiguille soit complètement recouverte. (Figure G)
|
Figure G : Activer le système de sécurité |
||||
|
Etape 7. Jeter la seringue · Jetez l’appareil usagé dans le contenant approprié conformément à la réglementation en vigueur.
|
|
||||
Des informations détaillées sur l’utilisation de la seringue pré-remplie et la reconstitution ce produit sont disponibles en scannant ce QR Code avec un smartphone. Les mêmes informations sont également disponibles sur l’URL suivante :
https://cloud.takeda-france.com/enantone-video-reconstitution
Fréquence d’administration : les injections seront renouvelées toutes les 26 semaines (6 mois).