Dernière mise à jour le 02/02/2026
UMATROPE 12 mg/3 mL, poudre et solvant pour solution injectable
Ce médicament n'est ou ne sera bientôt plus disponible sur le marché.
Si vous prenez actuellement ce médicament, il vous est recommandé d'en parler avec votre médecin
ou avec votre pharmacien qui pourra vous orienter vers un autre traitement.
Indications thérapeutiques
Classe pharmacothérapeutique : SOMATROPINE et ANALOGUE - code ATC : H01AC01
Votre médicament ou le médicament de la personne dont vous vous occupez s’appelle UMATROPE. Il contient une hormone de croissance humaine, aussi appelée somatropine. UMATROPE est obtenue par un procédé spécial appelé la technique de l’ADN recombinant. Il a la même structure que l’hormone de croissance produite par votre corps.
L’hormone de croissance régule la croissance et le développement des cellules dans votre corps. Lorsqu’elle stimule la croissance des cellules dans la colonne vertébrale et dans les os longs des jambes, cela provoque une augmentation de la taille. Lors d’un déficit en hormone de croissance, l’hormone de croissance augmente aussi la teneur minérale de l’os, le nombre et la taille des cellules musculaires et réduit le stockage de graisses.
UMATROPE est indiqué dans les situations suivantes :
· Traitement des enfants et adolescents avec l’un des troubles de croissance suivants :
o Production insuffisante de l’hormone de croissance (déficit en hormone de croissance).
o Absence (totale ou partielle) de certains chromosomes sexuels X chez les femmes avec une petite taille (syndrome de Turner).
o Maladie dans laquelle les reins sont endommagés (problèmes chroniques en relation avec le fonctionnement des reins) chez les enfants pré-pubères avec un retard de croissance.
o Retard de croissance chez les enfants de 4 ans ou plus nés petits pour l’âge gestationnel.
o Retard de croissance chez les enfants associé à une altération d’un gène appelé SHOX (déficit du gène SHOX), confirmé par analyse chromosomique.
Présentations
> 1 cartouche(s) en verre - 1 seringue(s) préremplie(s) de 3,15 ml
Code CIP : 342 159-3 ou 34009 342 159 3 3
Déclaration d'arrêt de commercialisation : 01/10/2025
Cette présentation n'est pas agréée aux collectivités
- Prix hors honoraire de dispensation : 268,78 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 269,80 €
- Taux de remboursement :100%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Modéré | Avis du 10/04/2024 | Réévaluation SMR | Le service médical rendu par UMATROPE (somatropine) est modéré dans l’indication du retard de croissance (taille actuelle < -3 DS et taille des parents ajustée < -1 DS) chez les enfants nés petits pour l’âge gestationnel avec un poids et/ou une taille de naissance < -2 DS, n’ayant pas rattrapé leur retard de croissance (vitesse de croissance < 0 DS au cours de la dernière année) à l’âge de 4 ans ou plus. |
| Modéré | Avis du 18/09/2019 | Nouvel examen suite au dépôt de nouvelles données | Le service médical rendu par ces spécialités reste modéré dans le traitement substitutif chez l’adulte ayant un déficit en hormone de croissance. |
| Faible | Avis du 17/06/2015 | Renouvellement d'inscription (CT) | Le service médical rendu par UMATROPE reste faible chez les enfants nés petits pour l’âge gestationnel avec un poids et/ou une taille de naissance < - 2 DS, n'ayant pas rattrapé leur retard de croissance (vitesse de croissance < 0 DS au cours de la dernière année) à l'âge de 4 ans ou plus et dont la taille pour l’âge chronologique est inférieure ou égale à - 3 DS et à - 1 DS par rapport à la taille attendue en fonction des tailles des parents. |
| Important | Avis du 17/06/2015 | Renouvellement d'inscription (CT) | Le service médical rendu par UMATROPE reste important dans : • le traitement à long terme des enfants atteints d'un retard de croissance lié à un déficit en hormone de croissance normale endogène • le traitement de la petite taille chez les enfants atteints du syndrome de Turner, confirmé par analyse chromosomique • le traitement du retard de croissance chez l'enfant pré-pubère atteint d'une insuffisance rénale chronique |
| Modéré | Avis du 17/06/2015 | Renouvellement d'inscription (CT) | Le service médical rendu par UMATROPE reste modéré : • chez les enfants ayant un déficit du gène SHOX (Short Stature HOmeoboX- Containing gene) confirmé par un test ADN • dans le traitement substitutif chez le sujet adulte présentant un déficit en hormone de croissance sévère |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 07/12/2011 | Réévaluation SMR | UMATROPE n'apporte pas d'amélioration du service médical rendu (ASMR V) dans la stratégie thérapeutique chez l'enfant né petit pour l'âge gestationnel et du déficit en gène SHOX. |
| IV (Mineur) | Avis du 07/12/2011 | Réévaluation SMR | UMATROPE apporte une amélioration du service médical rendu mineure (ASMR IV) dans la prise en charge du syndrome de Turner et de l'insuffisance rénale. |
| IV (Mineur) | Avis du 16/07/2008 | Extension d'indication | ASMR de niveau IV dans la prise en charge de la petite taille des enfants ayant une anomalie du gène SHOX confirmée par un test ADN. |
| V (Inexistant) | Avis du 04/07/2007 | Extension d'indication | UMATROPE n'apporte pas d'amélioration du service médical rendu (ASMR V) dans le traitement du retard de croissance chez les enfants nés petits pour l'âge gestationnel par rapport aux autres hormones de croissance ayant une indication similaire. |
Autres informations
- Titulaire de l'autorisation : LILLY France
- Conditions de prescription et de délivrance :
- liste I
- prescription initiale hospitalière annuelle
- prescription réservée aux spécialistes et services ENDOCRINOLOGIE
- prescription réservée aux spécialistes et services MALADIES METABOLIQUES
- prescription réservée aux spécialistes et services PEDIATRIE
- Statut de l'autorisation : Valide
- Type de procédure : Procédure de reconnaissance mutuelle
- Code CIS : 6 567 528 7
ANSM - Mis à jour le : 06/07/2021
UMATROPE 12 mg/3 mL, poudre et solvant pour solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
La cartouche contient :
Somatropine......................................................................................................................... 12 mg
Une fois reconstituée, elle contient 4,17 mg/mL.
La somatropine est produite dans des cellules d’Escherichia coli par la technique de l’ADN recombinant.
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre et solvant pour solution injectable.
La poudre est une poudre blanche à blanchâtre.
Le solvant est une solution transparente.
4.1. Indications thérapeutiques
Traitement à long terme des enfants atteints d’un retard de croissance lié à un déficit en hormone de croissance normale endogène.
Traitement de la petite taille chez les enfants atteints du syndrome de Turner, confirmé par analyse chromosomique.
Traitement du retard de croissance chez l’enfant pré-pubère atteint d’une insuffisance rénale chronique.
Traitement des patients ayant un retard de croissance associé à un déficit du gène SHOX (Short Stature HOmeoboX- Containing gene) confirmé par un test ADN.
UMATROPE est aussi indiqué dans le retard de croissance (taille actuelle < - 2,5 SDS et taille des parents ajustée < - 1 SDS) chez les enfants nés petits pour l’âge gestationnel, avec un poids et/ou une taille de naissance < - 2 DS, n’ayant pas rattrapé leur retard de croissance (vitesse de croissance < 0 SDS au cours de la dernière année) à l’âge de 4 ans ou plus.
Chez l’adulte :
UMATROPE est indiqué dans le traitement substitutif chez le sujet adulte présentant un déficit en hormone de croissance sévère.
Ces patients sont définis comme présentant un déficit somatotrope sévère acquis à l’âge adulte, secondaire à une pathologie hypothalamo-hypophysaire connue et associé au minimum à un autre déficit hormonal hypophysaire (excepté le déficit en prolactine). Un seul test dynamique sera pratiqué pour affirmer ou exclure un déficit en hormone de croissance.
Chez les patients présentant un déficit somatotrope acquis dans l’enfance (sans maladie hypothalamo-hypophysaire ni antécédent d’irradiation crânienne), deux tests dynamiques sont recommandés, sauf en cas de taux bas d’IGF-1 (< - 2 SDS) ce qui peut être considéré comme un test. Les valeurs limites des tests dynamiques doivent être strictement définies.
4.2. Posologie et mode d'administration
Le schéma posologique et d’administration doit être personnalisé pour chaque patient ; cependant, pour :
· Les enfants atteints d’un déficit somatotrope :
La posologie recommandée est de 0,025 à 0,035 mg/kg de poids corporel et par jour, en injection sous-cutanée, soit environ 0,7 à 1,0 mg/m² par jour.
· Les adultes atteints d’un déficit somatotrope :
La posologie recommandée à l’initiation du traitement est de 0,15 à 0,30 mg/jour. Une dose de départ plus faible peut être préférable chez les patients âgés et/ou obèses.
La dose doit être augmentée progressivement suivant les besoins du patient, en fonction de la réponse clinique et du taux sérique d’IGF-1.
La dose journalière ne doit généralement pas dépasser 1 mg.
La concentration en IGF-1 doit être maintenue à des valeurs ne dépassant pas la limite normale supérieure en fonction de l’âge. La dose minimale efficace devra être utilisée ; les besoins peuvent diminuer avec l’âge.
Les femmes peuvent nécessiter des doses plus élevées que les hommes, les hommes montrant une sensibilité croissante à l'IGF-1 au fil du temps. Cela signifie qu'il y a un risque que les femmes, notamment celles qui reçoivent un traitement œstrogénique par voie orale, soient sous-traitées alors que les hommes sont sur-traités.
La dose de somatropine devra être réduite en cas d’œdème persistant ou de paresthésies sévères, pour éviter un syndrome du canal carpien (voir rubrique 4.8 Effets indésirables).
· Les patientes atteintes du syndrome de Turner :
La posologie recommandée est de 0,045 à 0,050 mg/kg de poids corporel et par jour, administrée en injection sous cutanée de préférence le soir, soit environ 1,4 mg/m² par jour.
· Les enfants pré-pubères atteints d’insuffisance rénale chronique :
La posologie recommandée est de 0,045 à 0,050 mg/kg de poids corporel et par jour administrée en injection sous-cutanée.
· Les enfants présentant un déficit du gène SHOX :
La posologie recommandée est de 0,045 à 0,050 mg/kg de poids corporel par jour, en injection sous-cutanée.
· Les enfants nés petits pour l’âge gestationnel :
La posologie recommandée est de 0,035 mg/kg de poids corporel et par jour, en injection sous-cutanée (soit 1,0 mg/m² de surface corporelle par jour) jusqu’à ce que la taille finale soit atteinte (voir rubrique 5.1). Le traitement devra être interrompu après la première année de traitement, si la vitesse de croissance est inférieure à + 1,0 SDS. Le traitement devra être interrompu si la vitesse de croissance est < 2 cm par an et, si une confirmation est nécessaire, l’âge osseux est > 14 ans (pour les filles) ou > 16 ans (pour les garçons), correspondant à la soudure des cartilages de conjugaison.
Mode d’administration
UMATROPE doit être administré par voie sous-cutanée après reconstitution.
Afin d’éviter des lipoatrophies les sites d’injection sous-cutanée doivent varier.
Pour les instructions concernant la reconstitution du médicament avant administration, voir la rubrique 6.6.
UMATROPE ne doit pas être reconstitué avec le solvant joint chez les sujets ayant une hypersensibilité au métacrésol ou au glycérol.
UMATROPE ne doit pas être utilisé pour favoriser la croissance chez les enfants dont les épiphyses sont soudées.
Le traitement par hormone de croissance ne doit pas être entrepris chez les patients présentant un état critique aigu du fait de complications d’interventions chirurgicales à cœur ouvert ou abdominales, d'un polytraumatisme, ou chez les patients en insuffisance respiratoire aiguë (voir rubrique 4.4 Mises en garde spéciales et Précautions d’emploi).
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
La dose maximale quotidienne recommandée ne doit pas être dépassée (voir rubrique 4.2).
Le déficit somatotrope des sujets ayant été traités pendant l'enfance et jusqu'à leur taille finale par l'hormone de croissance doit être réévalué après la soudure des cartilages de conjugaison avant l'instauration du traitement substitutif aux doses recommandées pour l'adulte.
Le diagnostic et le traitement par UMATROPE doivent être réalisés et suivis par un médecin spécialisé et expérimenté dans le diagnostic et le traitement de patients atteints d'un déficit en hormone de croissance.
A ce jour, il n'a pas été montré que la substitution en hormone de croissance influence le taux de récidive ou la progression des néoplasies intracrâniennes ; cependant en pratique clinique, des contrôles réguliers d’imagerie hypophysaire sont nécessaires chez les patients ayant des antécédents de pathologie hypophysaire. Une imagerie de base est recommandée chez ces patients avant d'instaurer le traitement substitutif par hormone de croissance.
Un risque plus élevé de second néoplasme (bénin ou malin) a été rapporté chez les patients traités par somatropine, ayant survécu à un cancer durant leur enfance. Parmi ces seconds néoplasmes, les tumeurs intracrâniennes, en particulier, ont été les plus fréquentes.
En cas de céphalées sévères ou récidivantes, de problèmes visuels, de nausées et/ou vomissements, il est conseillé de pratiquer un examen du fond de l'œil à la recherche d'un œdème papillaire. En cas d'œdème papillaire confirmé, il faut envisager un diagnostic d'hypertension intracrânienne bénigne et le cas échéant, le traitement par hormone de croissance doit être interrompu.
L’état actuel des connaissances ne permet pas de recommander la poursuite du traitement chez des patients ayant une hypertension intracrânienne résolue. Si le traitement par hormone de croissance est réinstitué, une surveillance rapprochée à la recherche de signes d'hypertension intracrânienne s'impose.
Les patients atteints de pathologies endocriniennes, dont le déficit en hormone de croissance, peuvent présenter plus fréquemment une épiphysiolyse de hanche. Tout enfant présentant une claudication au cours du traitement par l'hormone de croissance devra être examiné.
L'hormone de croissance augmente la conversion périphérique de T4 en T3 et peut ainsi révéler une hypothyroïdie débutante. C'est pourquoi la surveillance thyroïdienne devrait être effectuée chez tous les patients.
Chez les patients présentant un hypopituitarisme, les autres traitements substitutifs doivent être adaptés étroitement lors de l’introduction du traitement par l’hormone de croissance.
Chez les enfants, le traitement doit être poursuivi jusqu'à l'achèvement de la croissance. Il est conseillé de ne pas dépasser la posologie recommandée étant donné les risques potentiels d'acromégalie, d'hyperglycémie et de glycosurie.
Avant d'instaurer le traitement par de la somatropine pour le retard de la croissance secondaire à une insuffisance rénale chronique, les patients doivent avoir été suivis pendant un an afin de confirmer ce retard. Un traitement conservateur de l'insuffisance rénale (incluant le contrôle de l'acidose, de l'hyperparathyroïdie et de l'état nutritionnel pendant l'année précédant l'instauration du traitement) doit avoir été établi et doit être maintenu pendant toute la durée de traitement. Le traitement par la somatropine doit être arrêté au moment de la transplantation rénale.
Les effets de l'hormone de croissance sur l'évolution d'un état critique ont été étudiés dans deux essais contrôlés versus placebo chez 522 adultes présentant des complications secondaires à une intervention chirurgicale à cœur ouvert ou abdominale, un polytraumatisme, ou une insuffisance respiratoire aiguë. La mortalité a été plus élevée dans le groupe de patients traités par l'hormone de croissance (doses de GH : 5,3-8 mg/jour) que dans le groupe sous placebo (41,9 % versus 19,3 %). La sécurité d'emploi sur la poursuite du traitement par l'hormone de croissance chez les patients recevant des doses substitutives dans les indications validées et qui développeraient parallèlement ces pathologies n'a pas été établie. En conséquence, le bénéfice potentiel de la poursuite du traitement chez les patients en état critique aigu doit être évalué au regard de ce risque potentiel.
Si une femme traitée par somatropine débute un traitement œstrogénique par voie orale, il peut être nécessaire d'augmenter la dose de somatropine pour maintenir les taux sériques d'IGF-1 dans l’intervalle normal pour l'âge. Inversement, si une femme sous somatropine interrompt un traitement œstrogénique oral, il se peut que la dose de somatropine doive être réduite pour éviter un excès d'hormone de croissance et / ou des effets indésirables (voir rubrique 4.5). La dose administrée d'hormone de croissance devra être réadaptée lors de toute modification de la voie d'administration des œstrogènes (voie orale vers voie transdermique ou vice-versa). Une augmentation de la sensibilité à l’hormone de croissance (se traduisant par un changement du taux d’IGF-1 à la même dose d’hormone de croissance) peut apparaître en cours de traitement notamment chez l’homme.
L'initiation du traitement par la somatropine peut entraîner une inhibition de la 11βHSD-1 et réduire les concentrations sériques de cortisol. Chez les patients traités par la somatropine, une insuffisance surrénale centrale (secondaire) non diagnostiquée auparavant peut être découverte et un traitement substitutif par glucocorticoïde peut être nécessaire. De plus, les patients traités par glucocorticoïde pour une insuffisance surrénalienne préalablement diagnostiquée peuvent nécessiter une augmentation de leurs doses d'entretien ou de stress, après le début du traitement par la somatropine (voir rubrique 4.5).
A moins que les patients ayant un syndrome de Prader-Willi ne présentent un déficit en hormone de croissance, UMATROPE n’est pas indiqué pour le traitement des patients atteints d’un retard de croissance lié à un syndrome de Prader-Willi confirmé génétiquement.
Des cas d’apnée du sommeil et de mort subite ont été rapportés après l’initiation d’un traitement par hormone de croissance chez des patients présentant un syndrome de Prader-Willi et ayant un ou plusieurs facteurs de risque suivants : obésité sévère, antécédents d’obstruction des voies aériennes supérieures, d’apnée du sommeil, ou d’infection respiratoire non identifiée.
La somatropine pouvant réduire la sensibilité à l’insuline, les patients doivent être surveillés à la recherche d’une intolérance au glucose. Il peut être nécessaire d’ajuster la dose d’insuline après l’instauration d’un traitement par de la somatropine chez les patients diabétiques. Les patients diabétiques ou intolérants au glucose doivent être étroitement surveillés lors du traitement par de la somatropine.
Les patients âgés (âge ≥ 65 ans) sont plus sensibles à l’action d’UMATROPE et peuvent être plus prédisposés à développer des effets indésirables (sévères).
Les données concernant les patients âgés de plus de 80 ans sont limitées.
Il n’y a pas de données concernant le traitement prolongé chez l’adulte.
Chez les enfants nés petits pour l’âge gestationnel, les autres causes ou traitements pouvant expliquer un retard de croissance doivent être exclus avant d’initier le traitement.
Chez les enfants nés petits pour l’âge gestationnel, il est recommandé de mesurer l’insulinémie et la glycémie à jeun avant de commencer le traitement, puis annuellement. Chez les patients présentant un risque accru de diabète (antécédents familiaux de diabète, obésité, insulino-résistance sévère, acanthosis nigricans, par exemple), un test d’hyperglycémie provoquée par voie orale doit être réalisé. Si un diabète est diagnostiqué, l’hormone de croissance ne devra pas être administrée tant que le diabète ne sera pas équilibré. L’hormone de croissance pourra ensuite être instaurée avec un étroit contrôle de l’équilibre glycémique. Une augmentation de la dose d’insuline pourra être nécessaire.
Chez les enfants nés petits pour l’âge gestationnel, il est recommandé de mesurer la concentration plasmatique d’IGF-1 avant d’initier le traitement, et par la suite de le faire 2 fois par an. Si sur des mesures répétées, les taux d’IGF-1 sont supérieurs à + 2 DS comparés aux valeurs standard pour le sexe, l’âge et le stade pubertaire, le ratio IGF-1/IGFBP-3 devrait être pris en considération pour l’ajustement de la dose.
Chez les patients nés petits pour l’âge gestationnel ou les enfants présentant un déficit du gène SHOX, il n’est pas recommandé d’initier le traitement proche du début de la puberté, l’expérience étant limitée.
Une partie du gain de taille obtenu chez les enfants nés petits pour l’âge gestationnel pourrait être perdue si le traitement est arrêté avant que la taille finale ne soit atteinte.
Pancréatite
Bien que rare, une pancréatite doit être envisagée chez les patients traités par somatropine qui présentent une douleur abdominale, surtout chez les enfants.
Progression de la scoliose chez les enfants
Une scoliose peut progresser chez tout enfant lors d’une croissance rapide. Les signes de scoliose doivent être surveillés pendant le traitement.
Excipient(s) à effet notoire
Ce médicament contient moins de 1 mmol de sodium par dose (23 mg), c’est-à-dire qu’il est essentiellement sans sodium.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Un traitement concomitant par des glucocorticoïdes inhibe les effets stimulants de la croissance de la somatropine. Le traitement substitutif par glucocorticoïdes des patients présentant un déficit en ACTH doit être ajusté avec précaution afin d'éviter tout effet inhibiteur sur la croissance. L'hormone de croissance diminue la conversion de la cortisone en cortisol et peut mettre en évidence une insuffisance surrénale centrale non encore diagnostiquée ou rendre inefficaces de faibles doses des glucocorticoïdes (voir rubrique 4.4).
Chez les femmes ayant un traitement oral substitutif par œstrogènes, une dose plus élevée d’hormone de croissance est parfois nécessaire pour obtenir le résultat escompté (voir rubrique 4.4).
La somatropine peut augmenter l’activité de l’enzyme cytochrome P450 (CYP) chez l’homme et peut conduire à une diminution des concentrations plasmatiques et de l’efficacité des médicaments métabolisés par le CYP3A tels que les stéroïdes sexuels, les corticostéroïdes, la cyclosporine et les anticonvulsivants.
4.6. Fertilité, grossesse et allaitement
Grossesse
Aucune étude de reproduction animale n'a été réalisée avec UMATROPE. L'éventualité d'un effet nocif d'UMATROPE sur le fœtus lors de l'administration chez la femme enceinte ou sur la capacité de reproduction n'est pas connue. UMATROPE ne doit être administré à la femme enceinte qu'en cas de nécessité.
Aucune étude n'a été réalisée avec UMATROPE chez la femme en période de lactation. Il n'existe aucune donnée sur la sécrétion du produit dans le lait. Etant donné le grand nombre de médicaments sécrétés dans le lait, la prudence s'impose lorsqu’UMATROPE est administré chez la femme en période de lactation.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
UMATROPE n'a aucun effet connu sur l’aptitude à conduire des véhicules ou à utiliser des machines.
La liste suivante détaille les effets indésirables ainsi que leur fréquence basée sur les essais cliniques et rapports spontanés de post-marketing :
Affections du système immunitaire
Hypersensibilité aux solvants (métacrésol/glycérol) : 1 %-10 %.
Hypersensibilité à la substance active : fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Affections endocriniennes
Hypothyroïdisme : 1 %-10 %.
Affections des organes de reproduction et du sein
Gynécomastie : 0,1 %-1 %.
Troubles du métabolisme et de la nutrition
Hyperglycémie modérée : 1 % enfants ; 1 %-10 % adultes.
Diabète de type 2 : 0,1 %-1 % enfants ; des cas adultes ont été rapportés spontanément avec une fréquence indéterminée.
Résistance à l’insuline.
Affections du système nerveux
Hypertension intracrânienne bénigne : 0,01 %-0,1 %.
Maux de tête : > 10 % adultes.
Insomnie : < 0,01 % enfants ; 1 %-10 % adultes.
Paresthésie : 0,01 %-0,1% enfants ; 1 %-10 % adultes.
Syndrome du canal carpien : 1 %-10 % adultes.
Affections vasculaires
Hypertension : < 0,01 % enfants ; 1 %-10 % adultes.
Affections respiratoires, thoraciques et médiastinales
Dyspnée : 1 %-10 % adultes.
Apnée du sommeil : 1 %-10 % adultes.
Affections musculo-squelettiques et systémiques
Douleur musculaire localisée (myalgie) : 1 %-10 % adultes ; 0,01 %-0,1 % enfants.
Douleur et trouble articulaire (arthralgie) : > 10 % adultes
Progression de la scoliose : 1 %-10 % enfants.
Troubles généraux et anomalies au site d’administration
Faiblesse : 0,1 %-1 %.
Douleur au niveau du site d’injection (réaction) : 1 %-10 %.
Œdème (local et généralisé) : 1 %-10 % enfants ; 10 % adultes.
Investigations
Glycosurie : < 0,01 % enfants ; 0,01 %-0,1 % adultes
Population pédiatrique
Dans les études cliniques réalisées chez des patients ayant un déficit en hormone de croissance, environ 2 % des patients ont développé des anticorps contre l'hormone de croissance. Dans les études réalisées dans le cas de syndrome de Turner et comportant l'administration de fortes doses, jusqu'à 8 % des patients ont développé des anticorps contre l'hormone de croissance.
La capacité de fixation de ces anticorps était faible et la vitesse de croissance n'était pas perturbée. La présence d'anticorps contre l'hormone de croissance doit être recherchée chez tout patient qui ne répond pas au traitement.
Un léger œdème transitoire précoce a été observé au cours du traitement.
Des cas de leucémies ont été rapportés chez un petit nombre d'enfants traités par l'hormone de croissance. Cependant, il n’y a pas de preuve que l’incidence de leucémies soit augmentée chez les patients traités par l’hormone de croissance, en l’absence de facteurs prédisposants.
Chez l'adulte :
Chez les adultes qui ont un déficit en hormone de croissance, des phénomènes d'œdème, de douleur musculaire, de douleur et d'affection articulaires ont été rapportés en début de traitement et étaient le plus souvent transitoires.
La fréquence des effets indésirables est plus faible chez les adultes traités par hormone de croissance qui ont un déficit somatotrope depuis l’enfance que ceux ayant un déficit acquis à l’âge adulte.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance – Site internet : www.signalement-sante.gouv.fr
Un surdosage aigu provoquerait d'abord une hypoglycémie, suivie d'une hyperglycémie. Un surdosage chronique entraînerait une symptomatologie d'acromégalie concordant avec les effets connus d'un excès d'hormone de croissance.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : hormones de l'anté-hypophyse et analogues, code ATC : H01AC01.
La somatropine est une hormone polypeptidique obtenue par recombinaison génétique. Elle est formée de 191 résidus d'acides aminés et a un poids moléculaire de 22 125 daltons. La séquence d'acides aminés du produit est identique à celle de l'hormone de croissance humaine d'origine hypophysaire. UMATROPE est synthétisée à partir d'une souche d'Escherichia coli modifiée par l'insertion du gène codant pour l'hormone de croissance humaine.
Les effets biologiques d'UMATROPE sont équivalents à ceux de l'hormone de croissance d'origine hypophysaire.
L'effet principal d'UMATROPE est la stimulation des cartilages de conjugaison des os longs. Elle facilite la synthèse protéique et la rétention d'azote.
UMATROPE stimule le métabolisme lipidique, elle augmente le taux d'acides gras et d'HDL cholestérol et diminue le cholestérol total.
Un traitement par UMATROPE a un effet bénéfique sur la composition corporelle des patients qui ont un déficit en hormone de croissance en diminuant l'accumulation des graisses et en augmentant la masse maigre. Un traitement à long terme chez les sujets déficitaires en hormone de croissance augmente la densité minérale osseuse.
UMATROPE peut induire un état de résistance à l'insuline. De fortes doses d'hormone de croissance humaine peuvent perturber la tolérance au glucose.
Les données disponibles à partir des études cliniques réalisées chez les patients ayant un syndrome de Turner montrent, alors que certains patients peuvent ne pas répondre à ce traitement, qu’une augmentation de la taille prédite a été observée, le gain moyen étant de 3,3 ± 3,9 cm.
Dans un essai clinique, des patients nés petits pour l’âge gestationnel (moyenne d’âge 9,5 ± 0,9 ans) traités par UMATROPE pendant 2 ans à la dose 0,067 mg/kg/jour ont obtenu un gain de taille moyen de + 1,2 DS. Les résultats obtenus dans cet essai sont comparables à ceux décrits pour les autres spécialités d’hormone de croissance recombinante.
Population pédiatrique
Une étude ouverte, multicentrique, observationnelle GeNeSIS (Genetics and Neuroendocrinology of Short Stature International Study) a été conduite en tant que programme de surveillance de la sécurité post-autorisation. Les données pédiatriques des gains sur tailles finales exprimés en score de déviation standard dans les indications approuvées sont : déficit en hormone de croissance, 1,39 ± 1,14 ; syndrome de Turner, 0,95 ± 0,82 ; retard de croissance associé à un déficit du gène SHOX, 0,86 ± 0,91 ; enfants nés petits pour l’âge gestationnel, 1,11 ± 0,96 et insuffisance rénale chronique (IRC), 0,88 ± 0,81 après respectivement 6,0 ± 3,7 ; 6,4 ± 3,3 ; 4,7 ± 2,6 ; 5,4 ± 3,0 ; et 5,8 ± 2,8 années de traitement par somatropine.
Les résultats de l’étude observationnelle à long terme d’enfants traités par somatropine (GeNeSIS) incluaient des données de 22 311 patients traités par somatropine (63,0 % atteints d’un déficit en hormone de croissance, 12,7 % présentant une petite taille idiopathique, 8,4 % atteints de syndrome de Turner, 5,7 % d’enfants nés petits pour l’âge gestationnel, 2,6 % présentant un déficit du gène SHOX, 0,4 % atteints d’insuffisance rénale chronique, 5,5 % de diagnostics autres et 1,7 % de diagnostic inconnu) et étaient cohérents avec le profil de sécurité connu de la somatropine. Les principaux objectifs de sécurité concernant l’incidence du diabète de type 2, les cancers de novo et la mortalité étaient évalués en comparaison avec un registre de données de la population générale actuelle. Dans l’étude, sur les 21 448 patients traités par somatropine éligibles pour l’analyse, 18 ont développé un diabète de type 2 ; cependant, des facteurs de risques préexistants de diabète ont été rapportés chez 13 de ces 18 patients. Le ratio standardisé d’incidence (IC 95 %) pour les enfants traités par somatropine et atteints de diabète de type 2 était significativement élevé [3,77 (2,24 à 5,96)], mais l’incidence de 16,8 cas pour une exposition de 100 000 personnes-années était faible.
Le ratio standardisé d’incidence (IC 95 %) pour les cancers primitifs de toutes localisations chez les patients sans antécédent de cancer était de 0,71 (0,39 à 1,20), basé sur 14 cas. Quarante-cinq décès ont été rapportés chez les patients traités par somatropine.
Le ratio standardisé de mortalité (IC 95 %), basé sur 42 décès chez les patients suivis pendant l’étude, était de 0,6 (0,4 à 0,8) pour toute cause de mortalité et toutes causes de petite taille confondues. Seuls les sous-groupes de patients avec un historique médical de diagnostic de déficit en hormone de croissance de cause organique, en particulier causé par une tumeur maligne antérieure, avaient un ratio standardisé de mortalité significativement augmenté.
5.2. Propriétés pharmacocinétiques
Une dose de 100 µg/kg chez le volontaire sain de sexe masculin entraîne un pic de concentration sérique (Cmax) d'environ 55 ng/mL, une demi-vie (t½) de presque 4 heures et une absorption maximale (AUC0-¥) d'environ 475 ng.h/mL.
5.3. Données de sécurité préclinique
UMATROPE est une hormone de croissance humaine obtenue par génie génétique.
Aucun événement indésirable grave n'a été rapporté dans les études de toxicologie subchronique. Aucune étude de carcinogénicité et de fertilité à long terme chez l'animal n'a été réalisée avec cette hormone de croissance humaine.
Il n'y a à ce jour aucun argument en faveur d'un effet mutagène d'UMATROPE.
Mannitol, glycine, phosphate disodique, acide phosphorique et hydroxyde de sodium.
Seringues de solvant :
Glycérol, métacrésol, eau pour préparations injectables, acide chlorhydrique et hydroxyde de sodium.
Avant reconstitution : 3 ans.
Après reconstitution : le produit peut être conservé jusqu'à 28 jours entre 2°C et 8°C. L'exposition quotidienne à une température ambiante ne doit pas excéder 30 minutes.
6.4. Précautions particulières de conservation
A conserver au réfrigérateur (entre 2°C et 8°C). Ne pas congeler.
6.5. Nature et contenu de l'emballage extérieur
UMATROPE est disponible dans les conditionnements suivants :
1 cartouche (verre de type I) de 12 mg de poudre pour solution injectable et 3,15 mL d’une solution de solvant en seringue pré-remplie (verre de type I) munie d’un piston (caoutchouc) ; boîtes de 1, 5 ou 10.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Instructions de préparation et de manipulation
Reconstitution :
Chaque cartouche d'UMATROPE doit être reconstituée à l'aide de la seringue de solvant. Pour reconstituer, fixer la cartouche à la seringue de solvant préremplie puis injecter la totalité du contenu de la seringue de solvant dans la cartouche. L'aiguille de la seringue de solvant permet de diriger automatiquement le jet de liquide contre la paroi en verre de la cartouche. Après reconstitution, retourner doucement la cartouche dix fois jusqu'à ce que le contenu soit complètement dissout. NE PAS AGITER. La solution obtenue doit être claire et exempte de particules. Si la solution est trouble ou contient des particules, le contenu NE DOIT PAS être injecté.
Les cartouches d'UMATROPE peuvent être utilisées avec des systèmes de stylo injecteur compatible, avec marquage CE.
Les instructions du fabricant accompagnant le stylo injecteur doivent être suivies pour charger la cartouche, fixer l'aiguille et pratiquer l'injection d'UMATROPE.
La seringue de solvant est à usage unique. La jeter après usage. Utiliser une aiguille stérile pour chaque administration d'UMATROPE.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
24, BOULEVARD VITAL BOUHOT
CS 50004
92521 NEUILLY-SUR-SEINE CEDEX
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 342 159 3 3 : poudre en cartouche (verre de type I) + 3,15 mL de solvant en seringue ; boîte de 1.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
Prescription initiale hospitalière annuelle réservée aux spécialistes en pédiatrie et/ou en endocrinologie et maladies métaboliques exerçant dans les services spécialisés en pédiatrie et/ou en endocrinologie et maladies métaboliques.
ANSM - Mis à jour le : 06/07/2021
UMATROPE 12 mg/3 mL, poudre et solvant pour solution injectable
somatropine
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que UMATROPE 12 mg/3 mL, poudre et solvant pour solution injectable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser UMATROPE 12 mg/3 mL, poudre et solvant pour solution injectable ?
3. Comment utiliser UMATROPE 12 mg/3 mL, poudre et solvant pour solution injectable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver UMATROPE 12 mg/3 mL, poudre et solvant pour solution injectable?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE UMATROPE 12 mg/3 mL, poudre et solvant pour solution injectable ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : SOMATROPINE et ANALOGUE - code ATC : H01AC01
Votre médicament ou le médicament de la personne dont vous vous occupez s’appelle UMATROPE. Il contient une hormone de croissance humaine, aussi appelée somatropine. UMATROPE est obtenue par un procédé spécial appelé la technique de l’ADN recombinant. Il a la même structure que l’hormone de croissance produite par votre corps.
L’hormone de croissance régule la croissance et le développement des cellules dans votre corps. Lorsqu’elle stimule la croissance des cellules dans la colonne vertébrale et dans les os longs des jambes, cela provoque une augmentation de la taille. Lors d’un déficit en hormone de croissance, l’hormone de croissance augmente aussi la teneur minérale de l’os, le nombre et la taille des cellules musculaires et réduit le stockage de graisses.
UMATROPE est indiqué dans les situations suivantes :
· Traitement des enfants et adolescents avec l’un des troubles de croissance suivants :
o Production insuffisante de l’hormone de croissance (déficit en hormone de croissance).
o Absence (totale ou partielle) de certains chromosomes sexuels X chez les femmes avec une petite taille (syndrome de Turner).
o Maladie dans laquelle les reins sont endommagés (problèmes chroniques en relation avec le fonctionnement des reins) chez les enfants pré-pubères avec un retard de croissance.
o Retard de croissance chez les enfants de 4 ans ou plus nés petits pour l’âge gestationnel.
o Retard de croissance chez les enfants associé à une altération d’un gène appelé SHOX (déficit du gène SHOX), confirmé par analyse chromosomique.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER UMATROPE 12 mg/3 mL, poudre et solvant pour solution injectable ?
N’utilisez jamais UMATROPE 12 mg/3 mL, poudre et solvant pour solution injectable:
· si vous êtes allergique (hypersensible) à la somatropine ou à l’un des autres composants contenus dans UMATROPE (par exemple, aux solvants suivants : métacrésol, glycérol) (voir rubrique 6).
· et informez votre médecin si vous avez une tumeur active (cancer). Les tumeurs doivent être inactives et vous devez avoir terminé votre traitement anti-tumoral avant de commencer votre traitement par UMATROPE.
· si vous avez déjà arrêté de grandir et vous voulez favoriser encore la croissance en taille (soudure des plaques de croissance situées à l’extrémité des os longs). Votre médecin vous examinera et décidera si vous avez toujours besoin d’UMATROPE après que vos os aient arrêté de grandir.
· si vous êtes très malade et vous avez besoin de soins médicaux intensifs du fait d’une opération grave du cœur ou d’une opération abdominale, si vous êtes traités pour des blessures multiples suite à un accident ou si vous avez besoin d’un respirateur mécanique suite à une insuffisance respiratoire aiguë.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser UMATROPE.
Si vous avez un traitement substitutif par des glucocorticoïdes, vous devez consulter votre médecin régulièrement, car la dose des glucocorticoïdes peut nécessiter un ajustement.
Si vous avez été traité pour un déficit en hormone de croissance durant l’enfance, votre médecin vous réexaminera pour votre déficit en hormone de croissance et décidera si vous avez encore besoin d’un traitement par UMATROPE pendant l’âge adulte.
Si vous avez terminé votre traitement anti-tumoral, un scanner de votre cerveau sera peut-être nécessaire avant de commencer votre traitement par UMATROPE. Vous devrez être examiné régulièrement pour être sûr que la tumeur n’est pas revenue ou commence à grandir.
Un risque plus élevé d’avoir une deuxième tumeur (bénigne ou maligne) a été rapporté chez les patients traités par somatropine ayant survécu à leur cancer. Parmi ces secondes tumeurs, les tumeurs du cerveau, en particulier, ont été les plus fréquentes.
Si vous avez des symptômes tels que des maux de tête fréquents ou sévères, avec des nausées et/ou si des problèmes de vision apparaissent, prévenez immédiatement votre médecin. Votre médecin devra réaliser un examen des yeux afin de rechercher une augmentation de pression au niveau de votre cerveau. En fonction des résultats de cet examen, le traitement par UMATROPE pourra être interrompu.
Si vous vous mettez à boiter ou si vous avez une douleur à la hanche, demandez conseil à votre médecin. En effet, pendant la période de croissance, vous pouvez développer des problèmes osseux au niveau de vos hanches.
Si vous commencez le traitement, UMATROPE peut modifier la quantité d’hormones thyroïdiennes dans votre sang. Si le niveau d’hormones thyroïdiennes est bas, cela peut diminuer votre réponse à UMATROPE. Par conséquent, des tests réguliers de la fonction thyroïdienne doivent être réalisés que vous receviez ou non un traitement à base d’hormone thyroïdienne.
Chez l’enfant, le traitement sera continué jusqu’à la fin de la croissance.
Si vous prenez une dose d’UMATROPE plus importante que celle qui vous a été prescrite, certaines parties de votre corps telles que les oreilles, le nez, la mâchoire, les mains et les pieds peuvent grandir de manière excessive. Un surdosage peut provoquer une augmentation des niveaux de sucre dans le sang et dans les urines. Utilisez toujours UMATROPE selon les recommandations de votre médecin.
Si vous avez des troubles de la croissance dus à des problèmes rénaux, le traitement par UMATROPE doit être arrêté avant une transplantation rénale.
Si vous avez une maladie à un stade aigu et grave, vous devez prévenir votre médecin. Des décès ont été rapportés chez les patients présentant une maladie grave et recevant de la somatropine.
Si vous avez un déficit en hormone de croissance et si vous souffrez aussi d’un syndrome de Prader-Willi (un trouble génétique), avant de commencer le traitement par UMATROPE, votre médecin devra vous examiner pour chercher d’éventuels problèmes respiratoires ou des infections respiratoires, surtout si vous êtes en surpoids, si vous avez déjà eu des problèmes respiratoires graves (surtout pendant le sommeil), ou si vous souffrez d’une infection des poumons ou des voies respiratoires.
Si au cours du traitement vous avez des signes de problèmes respiratoires (ronflement), le traitement devra être interrompu et votre médecin devra rechercher la cause.
UMATROPE peut affecter la manière dont votre corps gère le sucre contenu dans la nourriture et les boissons en interférant avec la manière dont votre corps utilise l’insuline. Par conséquent, si vous prenez UMATROPE, votre médecin doit vérifier si votre corps gère correctement les sucres.
Si vous êtes diabétique, il peut être nécessaire d’ajuster votre dose d’insuline après avoir commencé votre traitement par UMATROPE. Votre médecin vérifiera la quantité de sucre dans votre sang et pourra ajuster votre traitement antidiabétique.
Si vous avez un trouble de la croissance associé au fait que vous soyez né petit pour l’âge gestationnel, vos niveaux de sucre dans le sang et d’insuline seront vérifiés avant de commencer le traitement puis régulièrement pendant le traitement.
Les patients âgés (plus de 65 ans), peuvent être plus sensibles à UMATROPE et plus prédisposés à développer des effets indésirables.
Une scoliose (une augmentation de la déviation latérale de la colonne vertébrale) peut progresser chez tout enfant lors d’une croissance rapide. Les signes de scoliose doivent être surveillés pendant le traitement.
Enfants et adolescents
Sans objet.
Autres médicaments et UMATROPE 12 mg/3 mL, poudre et solvant pour solution injectable
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
En particulier, informez votre médecin si vous prenez ou avez pris récemment l’un des médicaments suivants. Votre médecin devra peut-être ajuster la dose d’UMATROPE ou des autres médicaments :
· médicaments pour le traitement du diabète sucré qui peuvent être ajustés ;
· hormones stéroïdiennes surrénaliennes (glucocorticoïde), telle que la cortisone ou la prednisolone ; votre médecin pourra avoir besoin d’ajuster la dose car l’association de ces médicaments avec UMATROPE peut réduire l’effet de ces traitements ;
· œstrogène pris par voie orale ou autres hormones sexuelles, étant donné que cela peut affecter la réponse au traitement par hormone de croissance. S’il y a un changement de voie d’administration des œstrogènes (par exemple orale vers transdermique : à travers la peau) ; la posologie d’UMATROPE pourra être ajustée ;
· médicaments préventifs des convulsions (anticonvulsivants) ou de la ciclosporine.
UMATROPE 12 mg/3 mL, poudre et solvant pour solution injectable avec des aliments et, boissons et de l’alcool
Sans objet.
UMATROPE ne doit pas être utilisé pendant la grossesse, sauf avis contraire de votre médecin. Si vous êtes enceinte, prévenez votre médecin immédiatement.
Il n’est pas établi si la somatropine est sécrétée dans le lait maternel. Si vous allaitez ou si vous avez l’intention d’allaiter, demandez conseil à votre médecin avant d’utiliser UMATROPE.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Conduite de véhicules et utilisation de machines
UMATROPE n’a pas d’effet connu sur l’aptitude à conduire ou à utiliser des machines.
UMATROPE 12 mg/3 mL, poudre et solvant pour solution injectable contient du sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose journalière, c’est-à-dire qu’il est essentiellement sans sodium.
3. COMMENT UTILISER UMATROPE 12 mg/3 mL, poudre et solvant pour solution injectable ?
· Assurez-vous toujours que vous utilisez le dosage de cartouche que votre médecin vous a prescrit (soit le dosage 6 mg, 12 mg ou 24 mg) et le stylo injecteur UMATROPE approprié avec marquage CE. N’utilisez jamais des cartouches d’autres médicaments dans votre stylo UMATROPE.
· Chaque cartouche d’UMATROPE est fournie avec une seringue contenant un diluant (solvant pour solution injectable) pour reconstitution (mélange et préparation de la solution d’injection).
· Vous ne devez pas mélanger ou injecter UMATROPE tant que vous n’avez pas reçu une formation appropriée de la part de votre médecin ou d’un autre professionnel de santé qualifié.
· Pour une description complète de la préparation et de l’injection d’UMATROPE, référez-vous à la rubrique « Comment injecter UMATROPE ? » à la fin de cette notice. Vous devez mélanger UMATROPE seulement avec le diluant fourni. Ne mélangez jamais avec quelque chose d’autre sauf si votre médecin vous le demande.
· Après la reconstitution, UMATROPE doit être injecté dans le tissu graisseux, juste sous la peau, au moyen d’une aiguille courte et d’un stylo injecteur.
· Les sites d’injection doivent varier afin d’éviter un amincissement et un endurcissement locaux du tissu graisseux sous la peau (lipoatrophie).
· Après avoir reconstitué UMATROPE, ne le laissez pas hors du réfrigérateur plus de 30 minutes par jour.
· Gardez votre stylo et la quantité d’UMATROPE restante dans le réfrigérateur. N’utilisez pas la quantité d’UMATROPE restante plus de 28 jours après la reconstitution.
Posologie
Votre médecin vous conseillera le schéma posologique et l’administration les plus adaptés. Ne changez pas votre posologie sans en parler à votre médecin.
Habituellement, UMATROPE est un traitement au long terme ; selon votre poids corporel et votre réponse au traitement, votre médecin pourra avoir besoin d’ajuster votre posologie au cours du temps. En général, la dose est calculée selon les recommandations suivantes et est administrée une fois par jour :
Enfants et adolescents avec :
· Déficit en hormone de croissance :
0,025 - 0,035 mg/kg de poids corporel et par jour,
· Syndrome de Turner :
0,045 - 0,050 mg/kg de poids corporel et par jour,
· Problèmes chroniques avec le fonctionnement des reins :
0,045 - 0,050 mg/kg de poids corporel et par jour,
· Les enfants nés petits pour l’âge gestationnel à la naissance :
0,035 mg/kg de poids corporel et par jour. Si la vitesse de croissance est insuffisante, le traitement doit être arrêté après la première année de traitement,
· Déficit au niveau du gène SHOX :
0,045 - 0,050 mg/kg de poids corporel et par jour.
Adultes atteints d’un déficit en hormone de croissance :
Le traitement doit être débuté à une faible dose de 0,15 à 0,30 mg par jour. Des doses de départ plus faibles peuvent être nécessaires chez les patients plus âgés ou en surpoids. La dose de départ peut être augmentée progressivement selon les besoins individuels. La dose journalière totale ne doit généralement pas dépasser 1 mg.
Les besoins peuvent diminuer avec l’âge. Les femmes, notamment celles prenant un traitement substitutif par œstrogène, peuvent avoir besoin d’une dose plus élevée que celle des hommes.
Si vous avez utilisé plus d’UMATROPE 12 mg/3 mL, poudre et solvant pour solution injectable que vous n’auriez dû
Si vous avez injecté plus d’UMATROPE que vous n’auriez dû, demandez conseil à votre médecin.
· Si vous avez injecté trop d’UMATROPE, dans un premier temps votre taux de sucre dans le sang peut diminuer et devenir trop bas (hypoglycémie) puis il peut augmenter et devenir trop haut (hyperglycémie).
· Si vous injectez trop d’UMATROPE pendant une longue période (des années), certaines parties de votre corps, telles que les oreilles, le nez, la mâchoire, les mains et les pieds peuvent grandir de manière excessive (acromégalie).
Si vous oubliez d’utiliser UMATROPE 12 mg/3 mL, poudre et solvant pour solution injectable
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre. Continuez avec la dose prescrite. Si vous oubliez d’injecter UMATROPE et que vous avez des doutes sur ce qu’il faut faire, contactez votre médecin.
Si vous arrêtez d’utiliser UMATROPE 12 mg/3 mL, poudre et solvant pour solution injectable
Demandez conseil à votre médecin avant d’arrêter le traitement. Une interruption ou un arrêt précoce du traitement par UMATROPE peut compromettre le succès du traitement par UMATROPE.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Vous pouvez ressentir l’un des effets indésirables suivant après l’injection d’UMATROPE :
La convention suivante a été utilisée pour classer les effets indésirables :
Effets indésirables très fréquents pouvant apparaitre chez plus d’1 patient sur 10 ;
Effets indésirables fréquents pouvant apparaitre chez 1 patient sur 100 à 1 patient sur 10 ;
Effets indésirables peu fréquents pouvant apparaitre chez 1 patient sur 1 000 à 1 patient sur 100 ;
Effets indésirables rares pouvant apparaitre chez 1 patient sur 10 000 à 1 patient sur 1 000 ;
Effets indésirables très rares pouvant apparaitre chez moins d’1 patient sur 10 000, rapports isolés inclus ;
Autres effets indésirables possibles (fréquence ne pouvant être estimée sur la base des données disponibles).
|
Enfants |
||||
|
Fréquent |
Peu fréquent |
Rare |
Très rare |
Fréquence indéterminée |
|
Douleur au niveau du site d’injection. |
Faiblesse. |
Des maux de tête sévères ou fréquents avec nausées et/ou des problèmes de vision sont des signes d’une augmentation de la pression dans le cerveau (hypertension intracrânienne bénigne). Si cela arrive, prévenez immédiatement votre médecin. |
Difficulté pour dormir (insomnie). |
Hypersensibilité à la substance active. |
|
Gonflement (œdème). |
Diabète de type 2. |
Engourdissement et picotement (paresthésie). |
Pression artérielle élevée (hypertension). |
|
|
Taux de sucre élevé dans le sang (hyperglycémie). |
Grossissement de la poitrine chez le garçon (gynécomastie). |
Douleur musculaire localisée (myalgie). |
Sucre dans les urines (glycosurie). |
|
|
Hypersensibilité au métacrésol et/ou au glycérol. |
|
|
|
|
|
Niveaux bas d’hormone thyroïdienne. |
|
|
|
|
|
Apparition d’anticorps anti-hormone de croissance. |
|
|
|
|
|
Progression de la scoliose (une augmentation de la déviation latérale de la colonne vertébrale). |
|
|
|
|
|
Adultes |
||||
|
Très fréquent |
Fréquent |
Peu fréquent |
Rare |
Fréquence indéterminée |
|
Mal de tête. |
Douleur au niveau du site d’injection. |
Faiblesse. |
Des maux de tête sévères ou fréquents avec nausées et/ou des problèmes de vision sont des signes d’une augmentation de la pression dans le cerveau (hypertension intracrânienne bénigne). Si cela arrive, prévenez immédiatement votre médecin. |
Diabète de type 2. |
|
Douleur dans les articulations (arthralgie). |
Gonflement (œdème). |
Grossissement de la poitrine chez l’homme (gynécomastie). |
Sucre dans les urines (glycosurie). |
Hypersensibilité à la substance active. |
|
|
Taux de sucre élevé dans le sang (hyperglycémie). |
|
|
|
|
|
Hypersensibilité au métacrésol et/ou au glycérol. |
|
|
|
|
|
Niveaux bas d’hormone thyroïdienne. |
|
|
|
|
|
Difficulté pour dormir (insomnie). |
|
|
|
|
|
Engourdissement et picotement (paresthésie). |
|
|
|
|
|
Engourdissement et picotement dans les doigts et la paume de la main dus à la compression d’un nerf au niveau du poignet (syndrome du canal carpien). |
|
|
|
|
|
Douleur musculaire localisée (myalgie). |
|
|
|
|
|
Pression artérielle élevée (hypertension). |
|
|
|
|
|
Essoufflement (dyspnée). |
|
|
|
|
|
Interruption temporaire de la respiration au cours du sommeil (apnée du sommeil). |
|
|
|
Les effets de l’insuline peuvent être réduits.
Des cas de leucémies ont été rapportés chez un petit nombre d’enfants qui avaient été traités par une hormone de croissance. Cependant, il n’y a pas de preuve que la fréquence de leucémies soit élevée chez les patients recevant de l’hormone de croissance.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER UMATROPE 12 mg/3 mL, poudre et solvant pour solution injectable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette et l’emballage après EXP. La date de péremption fait référence au dernier jour de ce mois.
N’utilisez pas ce médicament si vous remarquez que la solution est trouble ou contient des particules.
Conservez toujours UMATROPE au réfrigérateur (2°C - 8°C). Ne pas congeler.
Après le mélange d’UMATROPE, ne pas le laisser hors du réfrigérateur plus de 30 minutes par jour. UMATROPE peut être utilisé jusqu’à 28 jours après mélange si vous le conservez dans le réfrigérateur et que vous ne le laissez pas à température ambiante plus de 30 minutes par jour.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient UMATROPE 12 mg/3 mL, poudre et solvant pour solution injectable
Poudre en cartouche.
La substance active est : la somatropine.
Chaque cartouche contient 12 mg. Une fois reconstituée :
· UMATROPE 12 mg correspond à 4,17 mg de somatropine par mL de solution.
Les autres composants sont : Mannitol, glycine, phosphate disodique. [De l’acide phosphorique ou de l’hydroxyde de sodium (ou les deux) peuvent être utilisés dans le procédé de fabrication pour ajuster l’acidité].
Diluant stérile de la seringue
Le solvant en seringue préremplie contient : glycérol, métacrésol, eau pour préparations injectables. [De l’acide chlorhydrique ou de l’hydroxyde de sodium (ou les deux) peuvent être utilisés dans le procédé de fabrication pour ajuster l’acidité].
|
UMATROPE 12 mg |
· 1 cartouche de poudre blanche pour solution injectable |
|
|
· 3,15 mL d’une solution de solvant limpide et incolore en seringue préremplie |
|
|
Boîte de 1, 5 ou 10 |
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
24, BOULEVARD VITAL BOUHOT
CS 50004
92521 NEUILLY-SUR-SEINE CEDEX
Exploitant de l’autorisation de mise sur le marché
24, BOULEVARD VITAL BOUHOT
CS 50004
92521 NEUILLY-SUR-SEINE CEDEX
RUE DU COLONEL LILLY
67640 FEGERSHEIM
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants :
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[À compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Comment injecter UMATROPE ?
Les instructions suivantes expliquent comment injecter UMATROPE.
Veuillez lire attentivement les instructions et les suivre étape par étape.
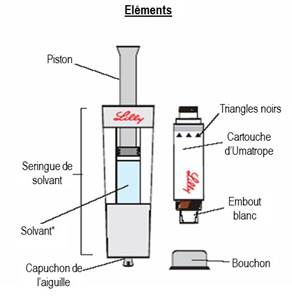
Avant de commencer : Vous allez avoir besoin de 5 éléments : 1. La cartouche d’UMATROPE au bon dosage 2. Une seringue remplie avec du diluant 3. Un stylo UMATROPE avec marquage CE 4. Une aiguille stérile et 5. Un tampon d'alcool Lavez-vous les mains avant de passer à la prochaine étape. |
Utilisez uniquement ce kit pour préparer la cartouche.
*Note : Le liquide est incolore. Il est représenté en bleu ici uniquement pour l’illustration. |
|
Les étapes suivantes vont vous guider pour vous préparer à l’utilisation de votre nouvelle cartouche |
|
|
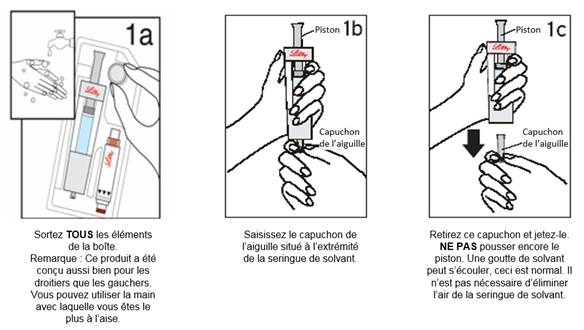
Etape 1 : Déballage · Vous devez mélanger UMATROPE uniquement avec le diluant fourni. Ne le mélangez jamais avec autre chose sauf avis contraire de votre médecin. · Lisez le manuel utilisateur fourni avec votre stylo. Cela vous rappellera ce que votre médecin ou votre professionnel de santé vous a appris. · Suivez les instructions figurant sous les schémas.
|
|
|
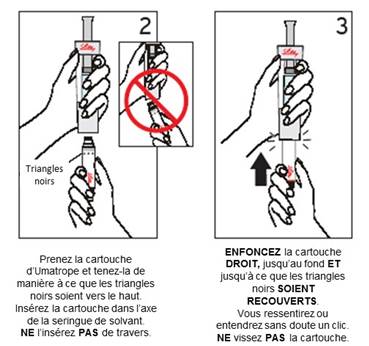
Etapes 2 et 3 : Fixation de la cartouche
|
|
|
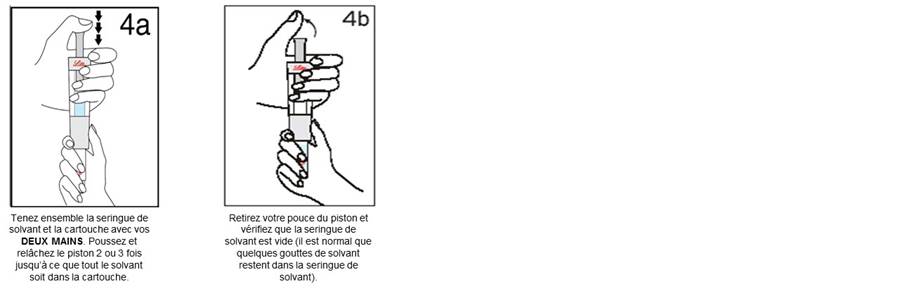
Etape 4 : Mélange d’UMATROPE
|
|
|
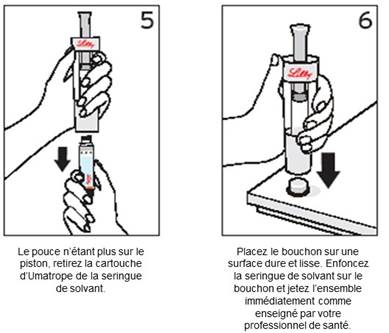
Etapes 5 et 6 : Libération de la cartouche et élimination du solvant
|
|
|
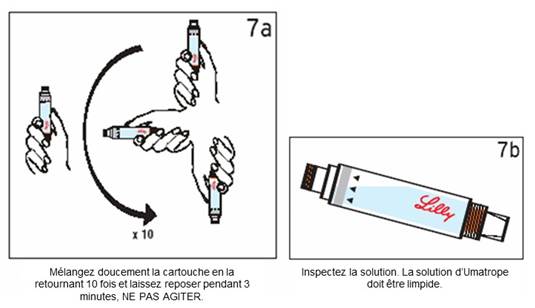
Etape 7 : Mélange doux · Mélangez la solution en retournant doucement la cartouche dix fois. NE PAS AGITER LA CARTOUCHE. Laissez reposer pendant 3 minutes, puis inspectez attentivement la solution. · Si la solution est trouble ou contient des particules, retournez doucement la cartouche 10 fois. Laissez reposer la cartouche 5 minutes de plus. Si la solution reste trouble ou contient des particules, LA CARTOUCHE NE DOIT PAS ETRE UTILISEE.
|
|
|
Etape 8 : Injection d’UMATROPE en utilisant un stylo injecteur approprié · Si la solution est limpide, votre cartouche est maintenant prête à être fixée sur le stylo UMATROPE approprié. · Mettez la cartouche dans le stylo (voir le manuel utilisateur du stylo). · Utilisez toujours une nouvelle aiguille stérile à chaque injection. · Essuyez soigneusement la peau avec un coton imbibé d’alcool. Laissez la peau sécher. · Programmez la dose correcte (voir le manuel utilisateur du stylo). · Injectez lentement sous la peau (sous-cutanée) selon la méthode enseignée par votre médecin. · Retirez l’aiguille de votre peau et jetez l’aiguille selon les recommandations de votre médecin ou de votre professionnel de santé. · Gardez votre stylo avec le reste d’UMATROPE dans le réfrigérateur. N’utilisez pas la cartouche au-delà de 28 jours après la reconstitution même s’il reste du produit dans la cartouche. |
|
UMATROPE est une marque déposée d’ELI LILLY and Company Limited.