Dernière mise à jour le 08/01/2026
IZIXATE 27,5 mg/0,55 mL, solution injectable en stylo injecteur prérempli
Indications thérapeutiques
Classe pharmacothérapeutique: Autres immunosuppresseurs - Code ATC : L04AX03.
La substance active contenue dans IZIXATE est le méthotrexate.
Le méthotrexate est une substance ayant les propriétés suivantes :
· il interfère avec la croissance de certaines cellules du corps qui se reproduisent rapidement ;
· il réduit l’activité du système immunitaire (le mécanisme de défense propre au corps) ;
· il a des effets anti-inflammatoires.
IZIXATE est indiqué dans le traitement :
· de la polyarthrite rhumatoïde (PR) chez l’adulte. La PR est une maladie chronique caractérisée par une inflammation des membranes synoviales (membranes des articulations). Ces membranes sécrètent un liquide qui agit comme un lubrifiant pour de nombreuses articulations. L’inflammation provoque un épaississement de la membrane et un gonflement de l’articulation.
· des formes polyarticulaires de l’arthrite juvénile idiopathique active sévère, en cas de réponse inadéquate aux anti-inflammatoires non stéroïdiens (AINS). (L'arthrite juvénile touche les enfants et les adolescents âgés de moins de 16 ans).
· des formes sévères du rhumatisme psoriasique chez les patients adultes (le rhumatisme psoriasique est une forme d’arthrite accompagnée de lésions psoriasiques de la peau et des ongles, en particulier au niveau des articulations des doigts et des orteils).
· des formes sévères de psoriasis qui n’ont pas répondu à d’autres formes de traitement (le psoriasis est une affection cutanée chronique courante, caractérisée par des plaques rouges recouvertes de squames adhérentes nacrées, épaisses et sèches).
· de la maladie de Crohn chez les patients adultes (la maladie de Crohn est un type de maladie inflammatoire des intestins provoquant des symptômes tels que des douleurs abdominales, des diarrhées, des vomissements ou une perte de poids).
IZIXATE modifie et ralentit la progression de la maladie.
Présentations
> 1 seringue préremplie en verre de 0,55 mL avec aiguille dans un stylo injecteur
Code CIP : 34009 302 438 8 6
Déclaration de commercialisation : 17/05/2022
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 09/02/2022 | Inscription (CT) | Le service médical rendu par IZIXATE (méthotrexate) est important : • dans la polyarthrite rhumatoïde active chez l’adulte . • dans les formes polyarticulaires de l’arthrite juvénile idiopathique active sévère, en cas de réponse inadéquate aux anti-inflammatoires non stéroïdiens (AINS) . • dans le psoriasis récalcitrant sévère invalidant de l’adulte, ne répondant pas suffisamment à d’autres types de thérapie telles que la photothérapie, la puvathérapie et les rétinoïdes . • dans les formes sévères du rhumatisme psoriasique chez l'adulte. |
| Modéré | Avis du 09/02/2022 | Inscription (CT) | Le service médical rendu par IZIXATE (méthotrexate) est modéré dans les formes légères à modérées de la maladie de Crohn, seul ou en association avec des corticostéroïdes, chez les patients adultes réfractaires ou intolérants aux thiopurines. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 09/02/2022 | Inscription (CT) | Ces spécialités sont des spécialités hybrides qui n’apportent pas d’amélioration du service médical rendu (ASMR V) par rapport à la spécialité de référence. |
ANSM - Mis à jour le : 26/12/2024
IZIXATE 27,5 mg/0,55 mL, solution injectable en stylo injecteur prérempli
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
1 stylo injecteur prérempli avec 0,55 mL de solution contient 27,5 mg de méthotrexate.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution injectable en stylo injecteur prérempli.
Solution transparente, de couleur jaune-brun.
pH : Entre 7,0 et 9,0.
4.1. Indications thérapeutiques
Le méthotrexate est indiqué dans le traitement :
· de la polyarthrite rhumatoïde active chez l’adulte ;
· des formes polyarticulaires de l’arthrite juvénile idiopathique active sévère, en cas de réponse inadéquate aux anti-inflammatoires non stéroïdiens (AINS);
· du psoriasis récalcitrant sévère invalidant de l’adulte, ne répondant pas suffisamment à d’autres types de thérapie telles que la photothérapie, la puvathérapie et les rétinoïdes, et des formes sévères du rhumatisme psoriasique chez l'adulte ;
· des formes légères à modérées de la maladie de Crohn, seul ou en association avec des corticostéroïdes, chez les patients adultes réfractaires ou intolérants aux thiopurines.
4.2. Posologie et mode d'administration
Le méthotrexate est injecté une fois par semaine.
Le patient doit être informé de façon claire du fait que le méthotrexate doit être administré une fois par semaine seulement. Il est recommandé de choisir un jour de la semaine approprié comme jour d'injection à respecter chaque semaine.
Avertissement important concernant l’administration de méthotrexate :
Dans le traitement de la polyarthrite rhumatoïde, de l’arthrite juvénile idiopathique, du psoriasis, du rhumatisme psoriasique et de la maladie de Crohn, le méthotrexate doit être utilisé une fois par semaine seulement. Des erreurs de posologie lors de l’utilisation méthotrexate peuvent entraîner des effets indésirables graves, voire le décès du patient. Veuillez lire très attentivement cette rubrique du résumé des caractéristiques du produit.
L’élimination du méthotrexate est diminuée chez les patients présentant un espace de distribution tiers (ascite, épanchement pleural). Chez ces patients, il convient de surveiller étroitement les signes de toxicité et il peut être nécessaire de diminuer la posologie, voire, dans certains cas, d’arrêter le traitement par méthotrexate (voir rubriques 5.2 et 4.4).
Posologie
Posologie chez les patients adultes atteints de polyarthrite rhumatoïde
La dose initiale recommandée est de 7,5 mg de méthotrexate une fois par semaine, administrée par voie sous-cutanée. En fonction de l’activité individuelle de la maladie et de la tolérance du patient, la dose initiale pourra être augmentée progressivement de 2,5 mg par semaine. Une dose hebdomadaire de 25 mg ne pourra en général pas être dépassée. Cependant, les doses supérieures à 20 mg/semaine sont associées à une augmentation significative de la toxicité, notamment de l’aplasie médullaire. La réponse au traitement peut être attendue après 4 à 8 semaines de traitement environ. Après obtention du résultat thérapeutique souhaité, la posologie doit être diminuée progressivement jusqu’à la dose d’entretien efficace la plus faible possible.
Posologie chez les enfants et les adolescents de moins de 16 ans présentant des formes polyarticulaires de l’arthrite juvénile idiopathique (AJI)
Les enfants ayant une surface corporelle inférieure à 0,75 m2 ne doivent pas recevoir ce produit. Si des doses inférieures à 7,5 mg sont requises, un autre traitement médical devra être envisagé.
La dose recommandée est de 10 à 15 mg/m2 de surface corporelle (SC) une fois par semaine. Dans les cas réfractaires au traitement, la posologie hebdomadaire pourrait être augmentée jusqu’à 20 mg/m2 de surface corporelle une fois par semaine. Toutefois, une surveillance plus fréquente est indiquée si la dose est augmentée.
Compte tenu des données limitées concernant l’administration intraveineuse chez l’enfant et l’adolescent, l’administration parentérale doit être limitée à la voie sous-cutanée.
Les patients atteints d’AJI doivent toujours être adressés à un rhumatologue spécialisé dans le traitement des enfants et des adolescents.
L’utilisation chez les enfants de moins de 3 ans n’est pas recommandée compte tenu de l’insuffisance de données concernant la sécurité et l’efficacité du produit dans cette population (voir rubrique 4.4).
Posologie chez les patients atteints de psoriasis en plaques ou de rhumatisme psoriasique
Il est recommandé d’administrer une dose test de 5 à 10 mg par voie parentérale une semaine avant le début du traitement pour détecter des effets indésirables idiosyncrasiques. La dose initiale recommandée est de 7,5 mg de méthotrexate une fois par semaine, administrée par voie sous-cutanée. La posologie doit être augmentée progressivement mais en général, elle ne doit pas dépasser une dose hebdomadaire de 25 mg de méthotrexate. Les doses supérieures à 20 mg/semaine peuvent être associées à une augmentation significative de la toxicité, notamment de l’aplasie médullaire. La réponse au traitement est généralement observée dans les 2 à 6 semaines environ suivant le début du traitement. Après obtention du résultat thérapeutique souhaité, la posologie doit être diminuée progressivement jusqu’à la dose d’entretien efficace la plus faible possible.
Dose hebdomadaire maximale
La dose doit être augmentée selon les besoins mais en général, elle ne doit pas dépasser la dose hebdomadaire maximale recommandée de 25 mg. Dans certains cas exceptionnels, une dose plus élevée peut être cliniquement justifiée, mais elle ne doit pas dépasser une dose hebdomadaire maximale de 30 mg de méthotrexate du fait de l’augmentation notable de la toxicité.
Posologie chez les patients atteints de la maladie de Crohn
· Traitement d'induction :
25 mg/semaine administrés par voie sous-cutanée.
La réponse au traitement peut être attendue après 8 à 12 semaines environ.
· Traitement d’entretien :
15 mg/semaine administrés par voie sous-cutanée.
L'expérience chez la population pédiatrique n’est pas suffisante pour que l’utilisation du méthotrexate puisse être recommandée pour le traitement de la maladie de Crohn chez cette population.
Patients ayant une insuffisance rénale
Le méthotrexate doit être utilisé avec prudence chez les patients présentant une insuffisance rénale. La posologie doit être adaptée comme suit :
|
Clairance de la créatinine (mL/min) |
Dose |
|
> 60 |
100 % |
|
30 – 59 |
50 % |
|
<30 |
Ne pas utiliser le méthotrexate |
Voir rubrique 4.3.
Patients ayant une insuffisance hépatique
Le méthotrexate doit être administré avec une grande prudence, voire évité, chez les patients présentant ou ayant des antécédents d’hépatopathie sévère, en particulier d’origine éthylique. Le méthotrexate est contre-indiqué chez les patients ayant un taux de bilirubine > 5 mg/dL (85,5 µmol/L).
Pour la liste complète des contre-indications, voir rubrique 4.3.
Utilisation chez les patients âgés
Une réduction de la posologie doit être envisagée chez les patients âgés en raison de la diminution des fonctions hépatique et rénale et des réserves d’acide folique plus faibles chez ces patients.
Utilisation chez les patients présentant un espace de distribution tiers (épanchement pleural, ascite).
La demi-vie du méthotrexate pouvant être prolongée jusqu’à 4 fois la valeur normale chez les patients qui présentent un espace de distribution tiers, il peut être nécessaire de diminuer la posologie voire, dans certains cas, d’arrêter le traitement par méthotrexate (voir rubriques 5.2 et 4.4).
Durée et mode d’administration
Ce médicament est à usage unique exclusivement.
IZIXATE solution injectable en stylo injecteur prérempli peut uniquement être administré par voie sous-cutanée.
La durée globale du traitement est déterminée par le médecin.
Des instructions concernant l’utilisation d’IZIXATE solution injectable en stylo injecteur prérempli sont disponibles dans la rubrique 6.6. Veuillez noter que la totalité du contenu du stylo injecteur prérempli doit être utilisée lors de chaque administration.
Remarque :
En cas de passage de la voie orale à une administration parentérale, il peut être nécessaire de diminuer la posologie du fait de la biodisponibilité variable du méthotrexate après administration orale.
Une supplémentation en acide folique peut être envisagée conformément aux recommandations thérapeutiques en vigueur.
Le méthotrexate est contre-indiqué dans les cas suivants :
· hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1 ;
· insuffisance hépatique sévère (voir rubrique 4.2) ;
· alcoolisme ;
· insuffisance rénale sévère (clairance de la créatinine inférieure à 30 ml/min, voir rubrique 4.2 et rubrique 4.4) ;
· dyscrasies sanguines pré-existantes, telles qu’hypoplasie médullaire, leucopénie, thrombopénie ou anémie sévère ;
· infections graves, aiguës ou chroniques telles que tuberculose, infection par le VIH ou autres syndromes d’immunodéficience ;
· ulcères de la cavité buccale et maladie ulcéreuse gastro-intestinale évolutive avérée ;
· grossesse, allaitement (voir rubrique 4.6) ;
· administration concomitante de vaccins vivants.
4.4. Mises en garde spéciales et précautions d'emploi
Les patients sous traitement doivent faire l’objet d’une surveillance appropriée visant à détecter et évaluer le plus tôt possible d’éventuels signes de toxicité ou effets indésirables. Par conséquent, un traitement par méthotrexate doit uniquement être instauré et supervisé par un médecin connaissant bien les traitements par antimétabolites et ayant l’expérience de leur utilisation. Compte tenu du risque de réactions toxiques sévères voire fatales, le patient doit être pleinement informé par le médecin des risques encourus et des mesures de sécurité recommandées.
Examens et mesures de sécurité recommandés
Avant l’instauration ou la réintroduction du traitement par le méthotrexate après une période de repos
Numération formule sanguine complète comprenant la numération différentielle et plaquettes, enzymes hépatiques, bilirubine, albuminémie, radiographie thoracique et tests de la fonction rénale. Si les circonstances cliniques le justifient, des examens doivent être pratiqués pour écarter la présence d'une tuberculose ou d’une hépatite.
Pendant le traitement
Les examens suivants doivent être réalisés une fois par semaine au cours des deux premières semaines puis toutes les deux semaines pendant le mois suivant ; ensuite, en fonction de la numération leucocytaire et de la stabilité du patient, au moins une fois par mois durant les six mois qui suivent et au moins tous les trois mois par la suite.
Une augmentation de la fréquence de suivi doit également être envisagée lors d’une augmentation de la dose. Les patients âgés, en particulier, doivent être examinés fréquemment pour détecter les signes précoces de toxicité.
1. Examen de la bouche et de la gorge visant à détecter des modifications des muqueuses.
2. Numération formule sanguine complète comprenant la numération différentielle et de plaquettes. L’inhibition de l’hématopoïèse causée par le méthotrexate peut survenir subitement et à des doses habituellement sûres. Toute chute sévère du taux de leucocytes ou de plaquettes impose l’arrêt immédiat du médicament et la mise en place d'un traitement symptomatique approprié. Les patients doivent être incités à signaler tous les signes et symptômes évocateurs d’une infection. La numération formule sanguine et les plaquettes doivent être étroitement surveillées chez les patients recevant de façon concomitante des médicaments hématotoxiques (par ex., du léflunomide).
3. Tests de la fonction hépatique :
Le traitement ne doit pas être initié ou doit être interrompu en cas d'anomalies persistantes ou significatives des tests de la fonction hépatique, d'autres examens non invasifs de la fibrose hépatique ou des biopsies hépatiques.
Des augmentations temporaires des transaminases jusqu'à deux ou trois fois la limite supérieure de la normale ont été rapportées chez des patients à une fréquence de 13 à 20 %. Une élévation persistante des enzymes hépatiques et/ou une diminution de l'albumine sérique peuvent indiquer une hépatotoxicité sévère. En cas d'augmentation persistante des enzymes hépatiques, il faut envisager de réduire la dose ou d'arrêter le traitement.
Les modifications histologiques, la fibrose et plus rarement la cirrhose du foie peuvent ne pas être précédées de tests anormaux de la fonction hépatique. Il existe des cas de cirrhose où les transaminases sont normales. Par conséquent, des méthodes de diagnostic non invasives pour la surveillance de l'état du foie doivent être envisagées, en plus des tests de la fonction hépatique. La biopsie hépatique doit être envisagée au cas par cas en tenant compte des comorbidités du patient, de ses antécédents médicaux et des risques liés à la biopsie. Les facteurs de risque d'hépatotoxicité comprennent une consommation antérieure excessive d'alcool, une élévation persistante des enzymes hépatiques, des antécédents de maladie hépatique, des antécédents familiaux de troubles hépatiques héréditaires, le diabète sucré, l'obésité et un contact antérieur avec des médicaments ou des produits chimiques hépatotoxiques et un traitement prolongé au méthotrexate.
Des médicaments hépatotoxiques supplémentaires ne doivent pas être administrés pendant le traitement par méthotrexate, sauf en cas de nécessité absolue. La consommation d'alcool doit être évitée (voir rubriques 4.3 et 4.5). Une surveillance plus étroite des enzymes hépatiques doit être entreprise chez les patients prenant simultanément d'autres médicaments hépatotoxiques.
Une prudence accrue doit être exercée chez les patients atteints de diabète sucré insulino-dépendant, car pendant le traitement par méthotrexate, une cirrhose du foie s'est développée dans des cas isolés sans élévation des transaminases.
4. La fonction rénale doit être surveillée par des tests de la fonction rénale et des analyses d’urine (voir rubriques 4.2 et 4.3).
Le méthotrexate étant éliminé essentiellement par voie rénale, une élévation des concentrations sériques pouvant entraîner des effets indésirables sévères peut être attendue en cas d'insuffisance rénale.
La surveillance doit être plus fréquente chez les patients dont la fonction rénale peut être altérée (par ex., chez les sujets âgés). Cette précaution s’impose en particulier en cas d’administration concomitante de médicaments qui affectent l’élimination du méthotrexate, qui provoquent une atteinte rénale (par ex., les anti-inflammatoires non stéroïdiens) ou qui sont susceptibles de diminuer de l’hématopoïèse. La déshydratation peut également majorer la toxicité du méthotrexate.
5. Évaluation de l’appareil respiratoire : il convient de surveiller l'apparition des symptômes d’une insuffisance respiratoire et si nécessaire, de pratiquer des tests de la fonction pulmonaire. Une affection pulmonaire doit être diagnostiquée rapidement et impose l’arrêt du méthotrexate. L’apparition de symptômes pulmonaires (en particulier une toux sèche, non productive) ou d’une pneumopathie non spécifique pendant le traitement par méthotrexate peut être le signe d’une lésion potentiellement dangereuse et impose l’interruption du traitement et des investigations approfondies. Il existe un risque de pneumonie interstitielle aiguë ou chronique, souvent associée à une éosinophilie sanguine, et des cas fatals ont été rapportés.
Bien que le tableau clinique soit variable, les symptômes typiques d’une pneumopathie induite par le méthotrexate sont une fièvre, une toux, une dyspnée, une hypoxémie et la présence d’un infiltrat à la radiographie thoracique ; la présence d’une infection doit être exclue. Les maladies pulmonaires induites par le méthotrexate ne sont pas toujours totalement réversibles. Cette lésion peut survenir à tous les dosages.
En outre, des cas d’hémorragie alvéolaire pulmonaire ont été rapportés lorsque le méthotrexate est utilisé pour des indications rhumatologiques et apparentées. Cette affection peut également être associée à une vasculite et à d’autres comorbidités. Des examens doivent rapidement être envisagés en cas de suspicion d’hémorragie alvéolaire pulmonaire afin de confirmer le diagnostic.
6. En raison de ses effets sur le système immunitaire, le méthotrexate peut diminuer la réponse aux vaccinations et modifier les résultats des tests immunologiques. . Les patients présentant des infections chroniques inactives (par exemple zona, tuberculose, hépatite B ou C) doivent faire l’objet d’une attention particulière en raison d’une activation possible de l’infection. L’administration de vaccins vivants est contre-indiquée pendant le traitement par le méthotrexate.
Des lymphomes malins peuvent survenir chez les patients recevant le méthotrexate à faible dose, dans ce cas, le traitement doit être arrêté. L'absence de signes de régression spontanée du lymphome impose l’instauration d’une chimiothérapiecytotoxique.
De rares cas de pancytopénie mégaloblastique aiguë ont été rapportés lors de l’administration concomitante d’antagonistes de l’acide folique tels que le triméthoprime / sulfaméthoxazole.
Une photosensibilité se manifestant par une réaction d’exanthème solaire exagérée a été observée chez certaines personnes prenant du méthotrexate (voir rubrique 4.8). Sauf indication médicale, l’exposition au soleil intense ou aux rayons UV doit être évitée. Les patients doivent utiliser une protection solaire adéquate pour se protéger du soleil intense.
Les dermatites radio-induites et les érythèmes solaires peuvent réapparaître pendant le traitement par méthotrexate (réactions de rappel). Les lésions psoriasiques peuvent s’aggraver en cas d’irradiation UV et d’administration concomitante de méthotrexate.
L’élimination du méthotrexate est diminuée chez les patients présentant un espace de distribution tiers (ascite, épanchement pleural). Chez ces patients, il convient de surveiller étroitement les signes de toxicité et il peut être nécessaire de diminuer la posologie, ou, dans certains cas, d’arrêter le traitement par le méthotrexate. Les épanchements pleuraux et les ascites doivent être drainés avant l’instauration du traitement par le méthotrexate (voir rubrique 5.2).
Des diarrhées et une stomatite ulcérative peuvent être des effets toxiques et imposent l’interruption du traitement, en raison du risque d’entérite hémorragique et de décès dû à une perforation intestinale.
Les préparations vitaminiques ou les autres produits contenant de l’acide folique, de l’acide folinique ou leurs dérivés peuvent diminuer l’efficacité du méthotrexate.
Dans le psoriasis, le traitement par le méthotrexate doit être limité aux formes récalcitrantes sévères, invalidantes qui ne répondent pas suffisamment aux autres formes de thérapie, mais uniquement lorsque le diagnostic a été confirmé par biopsie et/ou après une consultation dermatologique.
Des cas d’encéphalopathie / de leucoencéphalopathie ont été rapportés chez des patients cancéreux recevant un traitement par méthotrexate et leur survenue ne peut être exclue lors d’un traitement par le méthotrexate dans des indications non oncologiques.
Fertilité et reproduction
Fertilité
Il a été constaté que le méthotrexate entraîne une oligospermie, un dysfonctionnement menstruel et une aménorrhée chez les humains, pendant le traitement et pendant une brève période après l’arrêt de celui-ci, et une altération de la fertilité, affectant la spermatogenèse et l’ovogenèse durant la période de son administration - effets qui semblent être réversibles après l’interruption du traitement.
Tératogénicité – Risque inhérent à la reproduction
Le méthotrexate provoque une toxicité embryonnaire, des avortements et des malformations fœtales chez les humains. Par conséquent, les risques potentiels d’effets sur la reproduction, de fausses couches et de malformations congénitales doivent être abordés avec les patientes en âge de procréer (voir rubrique 4.6). L'absence de grossesse doit être confirmé avant d’utiliser IZIXATE solution injectable en stylo injecteur prérempli. Si des femmes en âge de procréer sont traitées, une méthode de contraception efficace durant le traitement et pendant au moins six mois après l’arrêt du traitement doit être utilisée.
Pour des conseils sur les méthodes contraceptives masculines, voir rubrique 4.6.
Leucoencéphalopathie multifocale progressive (LEMP)
Des cas de leucoencéphalopathie multifocale progressive (LEMP) ont été rapportés chez des patients recevant du méthotrexate, le plus souvent en association avec d’autres médicaments immunosuppresseurs. La LEMP peut être fatale et doit être prise en compte dans le diagnostic différentiel chez les patients immunodéprimés présentant une nouvelle apparition ou une aggravation des symptômes neurologiques.
IZIXATE solution injectable en stylo injecteur prérempli contient du sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose, c’est-à-dire qu’il est essentiellement « sans sodium ».
Population pédiatrique
Ce médicament ne doit pas être utilisé chez l’enfant de moins de 3 ans compte tenu de l’insuffisance de données concernant la sécurité et l’efficacité du produit chez cette population (voir rubrique 4.2).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Alcool, médicaments hépatotoxiques, médicaments hématotoxiques
Le risque d’effets hépatotoxiques du méthotrexate est majoré en cas de consommation régulière d’alcool ou d’administration concomitante d’autres médicaments hépatotoxiques (voir rubrique 4.4). Une surveillance particulière s’impose chez les patients qui prennent simultanément d’autres médicaments hépatotoxiques (par ex., du léflunomide). Les mêmes précautions doivent être prises en cas de co-administration de médicaments hématotoxiques (par ex., du léflunomide, de l’azathioprine, des rétinoïdes, de la sulfasalazine). L’incidence de pancytopénie et l’hépatotoxicité peuvent être augmentées en cas d’association du léflunomide avec le méthotrexate. L’administration d’autres médicaments hématotoxiques accroît la probabilité d’effets indésirables hématotoxiques sévères au méthotrexate. L’administration concomitante de métamizole et de méthotrexate peut augmenter l’effet hématotoxique du méthotrexate, en particulier chez les patients âgés. Par conséquent, l’administration concomitante doit être évitée.
L’utilisation de protoxyde d’azote potentialise l’effet du méthotrexate sur le métabolisme des folates, et conduit à une toxicité accrue telle qu’une myélosuppression sévère imprévisible et une stomatite. Bien qu’il soit possible d’atténuer cet effet par administration de folinate de calcium, l’utilisation concomitante de protoxyde d’azote et de méthotrexate doit être évitée.
Le risque d’hépatotoxicité est majoré en cas d’administration concomitante de méthotrexate et de rétinoïdes tels que l’acitrétine ou l’étrétinate.
Antibiotiques oraux
Les antibiotiques oraux tels que les tétracyclines, le chloramphénicol et les antibiotiques non absorbables à large spectre peuvent interférer avec la circulation entérohépatique par inhibition de la flore intestinale ou la suppression du métabolisme bactérien.
Antibiotiques
Les antibiotiques tels que les pénicillines, les glycopeptides, les sulfamides, la ciprofloxacine et la céfalotine peuvent dans certains cas diminuer la clairance rénale du méthotrexate, ce qui peut entraîner une augmentation des concentrations sériques de méthotrexate et une toxicité hématologique et gastro-intestinale.
Médicaments fortement liés aux protéines plasmatiques
Le méthotrexate se lie aux protéines plasmatiques et peut être déplacé par d’autres médicaments liés aux protéines tels que les salicylés, les hypoglycémiants, les diurétiques, les sulfamides, les diphénylhydantoïnes, les tétracyclines, le chloramphénicol et l’acide p-aminobenzoïque et les anti-inflammatoires acides, ce qui peut entraîner une toxicité accrue en cas d’administration concomitante.
Probénécide, acides organiques faibles, pyrazolés et anti-inflammatoires non stéroïdiens
Le probénécide, les acides organiques faibles tels que les diurétiques de l’anse, et les pyrazolés (phénylbutanone) peuvent réduire l’élimination du méthotrexate, et des concentrations sériques plus élevées sont susceptibles de majorer la toxicité hématologique. La toxicité peut également être augmentée en cas d’association de méthotrexate à faible dose et d’anti-inflammatoires non stéroïdiens ou de salicylés.
Médicaments ayant des effets indésirables sur la moelle osseuse
Il convient de prêter attention au risque d’altération sévère de l’hématopoïèse en cas de traitement par des médicaments susceptibles d’avoir des effets indésirables sur la moelle osseuse (par exemple, sulfamides, triméthoprime-sulfaméthoxazole, chloramphénicol, pyriméthamine).
Médicaments entraînant une carence en acide folique
L'administration concomitante de produits qui induisent une carence en acide folique (par ex., sulfamides, triméthoprime-sulfaméthoxazole) peut majorer la toxicité du méthotrexate. Une prudence particulière est donc recommandée en cas de déficit en acide folique préexistant.
Produits contenant de l’acide folique ou de l’acide folinique
Les préparations vitaminiques ou autres produits contenant de l’acide folique, de l’acide folinique ou leurs dérivés peuvent diminuer l’efficacité du méthotrexate.
Autres antirhumatismaux
En général, il n’est pas attendu d’augmentation des effets toxiques du méthotrexate lorsque la solution injectable d’IZIXATE est administrée de façon concomitante avec d’autres agents antirhumatismaux (par ex., sels d’or, pénicillamine, hydroxychloroquine, sulfasalazine, azathioprine, ciclosporine).
La cyclosporine est susceptible de potentialiser l’efficacité et la toxicité du méthotrexate. Il en résulte un risque accru d’insuffisance rénale. En outre, il existe une possibilité biologique d’immunosuppression excessive et de complications associées.
Sulfasalazine
Bien que l’association de méthotrexate et de sulfasalazine puisse potentialiser l’efficacité du méthotrexate et par conséquent augmenter les effets indésirables dus à l’inhibition de la synthèse d’acide folique par la sulfasalazine, ces effets indésirables n’ont été observés que dans de rares cas isolés au cours de plusieurs études.
Mercaptopurine
Le méthotrexate augmente les concentrations plasmatiques de la mercaptopurine. Il peut donc être nécessaire d’adapter la posologie en cas d’association de méthotrexate et de mercaptopurine.
Inhibiteurs de la pompe à protons
L'administration concomitante d’inhibiteurs de la pompe à protons tels que l’oméprazole ou le pantoprazole peut provoquer des interactions : l’administration concomitante de méthotrexate et d’oméprazole a retardé l’élimination rénale du méthotrexate. L'association avec le pantoprazole a inhibé l’élimination rénale du métabolite 7-hydroxyméthotrexate, et des myalgies et des tremblements ont été rapportés chez un sujet.
Théophylline
Le méthotrexate peut diminuer la clairance de la théophylline ; les concentrations de théophylline doivent être surveillées en cas d’administration concomitante avec le méthotrexate.
Boissons contenant de la caféine ou de la théophylline
La consommation excessive de boissons contenant de la caféine ou de la théophylline (café, sodas contenant de la caféine, thé noir) doit être évitée durant le traitement par méthotrexate.
4.6. Fertilité, grossesse et allaitement
Femmes en âge de procréer / Contraception chez les femmes
Les femmes doivent éviter de tomber enceintes pendant le traitement par méthotrexate, et une méthode de contraception efficace doit être utilisée pendant le traitement par méthotrexate et pendant au moins six mois après l’arrêt du traitement (voir rubrique 4.4). Avant le début du traitement, les femmes en âge de procréer doivent être informées du risque de malformations associées au méthotrexate et il convient d’exclure toute grossesse avec certitude en prenant des mesures appropriées, par exemple en réalisant un test de grossesse.
Pendant le traitement, il convient de faire de nouveaux tests de grossesse si cela est jugé cliniquement pertinent (par ex., après une mauvaise observance de la contraception). Les patientes en âge de procréer doivent être conseillées sur la prévention et la planification d’une grossesse.
Contraception masculine
Il n’a pas été déterminé si le méthotrexate est présent dans le sperme. Les études chez l’animal ont mis en évidence une génotoxicité du méthotrexate, de sorte que le risque d’effets génotoxiques sur les spermatozoïdes ne peut pas être complètement écarté. Les preuves cliniques limitées n’indiquent pas un risque accru de malformations ou de fausses couches à la suite d'une exposition paternelle au méthotrexate à faible dose (moins de 30 mg/semaine). À plus fortes doses, les données sont insuffisantes pour estimer le risque de malformations ou de fausses couches à la suite d'une exposition paternelle.
Par mesure de précaution, il est recommandé aux patients de sexe masculin sexuellement actifs ou à leurs partenaires de sexe féminin d’utiliser une contraception efficace pendant le traitement du patient masculin et pendant au moins 3 mois après l’arrêt du traitement par méthotrexate. Les hommes ne doivent pas faire de don de sperme pendant le traitement ou pendant 3 mois après l’arrêt du traitement par méthotrexate.
Grossesse
Le méthotrexate est contre-indiqué pendant la grossesse dans des indications non oncologiques (voir rubrique 4.3). En cas de survenue d'une grossesse pendant le traitement par méthotrexate et jusqu’à six mois après l’arrêt de celui-ci, une information médicale sur les risques d’effets nocifs du méthotrexate sur l’enfant doit être fournie. Des échographies devront également être effectuées afin de confirmer le développement normal du fœtus.
Les études chez l’animal ont mis en évidence une toxicité du méthotrexate sur la reproduction, en particulier au cours du premier trimestre (voir rubrique 5.3). Le méthotrexate s'est avéré tératogène chez les humains ; des cas de mort fœtale, de fausses couches et/ou d’anomalies congénitales (par ex., cranio-faciales, cardiovasculaires, du système nerveux central et des extrémités) ont été rapportés.
Le méthotrexate est un puissant tératogène humain, associé à un risque accru d’avortements spontanés, de retard de croissance intra-utérine et de malformations congénitales en cas d’exposition pendant la grossesse.
· Des avortements spontanés ont été rapportés chez 42,5 % des femmes enceintes exposées à un traitement par méthotrexate à faible dose (moins de 30 mg/semaine), contre un taux de 22,5 % rapporté chez des patientes dont la maladie présente des caractéristiques comparables et qui sont traitées par des médicaments autres que le méthotrexate.
· Des anomalies congénitales majeures ont été observées pour 6,6 % des naissances vivantes chez des femmes exposées à un traitement par méthotrexate à faible dose (moins de 30 mg/semaine) pendant la grossesse, contre environ 4 % des naissances vivantes chez des patientes dont la maladie présente des caractéristiques comparables et qui sont traitées par des médicaments autres que le méthotrexate.
L’exposition pendant la grossesse à des doses de méthotrexate supérieures à 30 mg/semaine est insuffisamment documentée, mais des taux plus élevés d’avortements spontanés et de malformations congénitales sont attendus.
Des cas de grossesses normales ont été rapportés lorsque le méthotrexate était arrêté avant la conception.
Le méthotrexate est excrété dans le lait maternel. Compte tenu du risque de réactions indésirables graves pour le nourrisson allaité, IZIXATE est contre-indiqué pendant l’allaitement (voir rubrique 4.3). L’allaitement doit par conséquent être interrompu avant et pendant le traitement.
Fertilité
Le méthotrexate affecte la spermatogenèse et l’ovogenèse et peut diminuer la fertilité. Chez les humains, il a été constaté que le méthotrexate pouvait entraîner une oligospermie, un dysfonctionnement menstruel et une aménorrhée. Dans la plupart des cas, ces effets semblent être réversibles après l’arrêt du traitement.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Le méthotrexate a une influence mineure ou modérée sur l’aptitude à conduire des véhicules et à utiliser des machines.
Résumé du profil de sécurité
La plupart des effets indésirables graves du méthotrexate comprennent : aplasie médullaire, toxicité pulmonaire, hépatotoxicité, toxicité rénale, neurotoxicité, accidents thromboemboliques, choc anaphylactique et syndrome de Stevens-Johnson.
Les effets indésirables du méthotrexate ayant été observés le plus fréquemment (très fréquents) comprennent des affections gastro-intestinales (par ex., stomatite, dyspepsie, douleurs abdominales, nausées, perte d’appétit) et des anomalies au niveau des tests de la fonction hépatique (par ex., élévation des taux d’ALAT, d’ASAT, de bilirubine et de phosphatase alcaline). Les autres effets indésirables qui ont été fréquemment observés (fréquents) sont la leucopénie, l’anémie, la thrombopénie, les céphalées, la fatigue, la somnolence, la pneumonie, l’alvéolite/pneumonie interstitielle souvent associée à une éosinophilie, les ulcérations buccales, la diarrhée, l'exanthème, l’érythème et le prurit.
Liste des effets indésirables
Les effets indésirables les plus significatifs sont l’inhibition du système hématopoïétique et les troubles gastro-intestinaux.
Les effets indésirables sont présentés par ordre de fréquence selon la convention suivante :
Très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1 000 à < 1/100), rare (≥ 1/10 000 à < 1/1 000), très rare (< 1/10 000), fréquence indéterminée (ne peut pas être estimée à partir des données disponibles).
Infections et infestations
Peu fréquent : Pharyngite.
Rare : Infection (y compris réactivation d'une infection chronique inactive), sepsis, conjonctivite.
Tumeurs bénignes, malignes et non précisées (incluant kystes et polypes)
Très rare : il y a eu quelques cas isolés de lymphome qui ont régressé dans un certain nombre de cas après l’arrêt du traitement par méthotrexate.
Affections hématologiques et du système lymphatique
Fréquent : Leucopénie, anémie, thrombopénie.
Peu fréquent : Pancytopénie.
Très rare : Agranulocytose, aplasie médullaire d’évolution sévère, syndrome lymphoprolifératif (voir la « description » ci-après).
Fréquence indéterminée : Éosinophilie
Affections du système immunitaire
Rare : Réactions allergiques, choc anaphylactique, hypogammaglobulinémie.
Troubles du métabolisme et de la nutrition
Peu fréquent : Aggravation du diabète.
Affections psychiatriques
Peu fréquent : Dépression, confusion.
Rare : Altérations de l’humeur.
Affections du système nerveux
Fréquent : Céphalées, fatigue, somnolence.
Peu fréquent : Étourdissements.
Très rare : Douleurs, asthénie musculaire, paresthésie/hypoesthésie, dysgueusie (goût métallique), convulsions, méningisme, méningite aseptique aiguë, paralysie.
Fréquence indéterminée : Encéphalopathie / leucoencéphalopathie.
Affections oculaires
Rare : Troubles visuels.
Très rare : Baisse de la vision, rétinopathie.
Affections cardiaques
Rare : Péricardite, épanchement péricardique, tamponnade péricardique.
Affections vasculaires
Rare : Hypotension, accidents thromboemboliques.
Affections respiratoires, thoraciques et médiastinales
Fréquent : Pneumonie, alvéolite/pneumonie interstitielle souvent associée à une éosinophilie. Les symptômes indiquant une atteinte pulmonaire potentiellement sévère (pneumonie interstitielle) sont : toux sèche non productive, essoufflement et fièvre.
Rare : Fibrose pulmonaire, pneumonie à Pneumocystis jirovecii, essoufflement et asthme bronchique, épanchement pleural.
Fréquence indéterminée : Épistaxis, hémorragie alvéolaire pulmonaire.
Affections gastro-intestinales
Très fréquent : Stomatite, dyspepsie, nausées, perte d’appétit, douleurs abdominales.
Fréquent : Ulcérations buccales, diarrhées.
Peu fréquent : Ulcères et saignements gastro-intestinaux, entérite, vomissements, pancréatite.
Rare : Gingivite.
Très rare : Hématémèse, hémorragies abondantes, colectasie.
Affections hépatobiliaires (voir rubrique 4.4)
Très fréquent : anomalies des tests de la fonction hépatique (élévation des taux d’ALAT, d’ASAT, de phosphatase alcaline et de bilirubine).
Peu fréquent : Cirrhose, fibrose et stéatose hépatique, hypoalbuminémie.
Rare : Hépatite aiguë.
Très rare : Insuffisance hépatique.
Affections de la peau et du tissu sous-cutané
Fréquent : Exanthème, érythème, prurit.
Peu fréquent : Alopécie, augmentation des nodosités rhumatismales, ulcères cutanés, zona, vascularite, éruptions cutanées herpétiformes, urticaire, réactions de photosensibilisation.
Rare : Hyperpigmentation, acné, pétéchies, ecchymoses, vascularite allergique.
Très rare : Syndrome de Stevens-Johnson, nécro-épidermolyse bulleuse aiguë (syndrome de Lyell), hyperpigmentation des ongles, panaris aigu, furonculose, télangiectasie.
Fréquence indéterminée : exfoliation cutanée / dermatite exfoliative.
Affections musculosquelettiques et systémiques
Peu fréquent : Arthralgie, myalgie, ostéoporose.
Rare : Fracture de fatigue.
Fréquence indéterminée : Ostéonécrose de la mâchoire (secondaire au syndrome lymphoprolifératif)
Affections du rein et des voies urinaires
Peu fréquent : Inflammation et ulcération de la vessie, diminution de la fonction rénale, troubles de la miction.
Rare : Insuffisance rénale, oligurie, anurie, déséquilibres électrolytiques.
Fréquence indéterminée : Protéinurie.
Affections des organes de reproduction et du sein
Peu fréquent : Inflammation et ulcération vaginales.
Très rare : Diminution de la libido, impuissance, gynécomastie, oligospermie, aménorrhées, pertes vaginales.
Troubles généraux et anomalies au site d’administration
Rare : Fièvre, difficultés de cicatrisation.
Très rare : Lésions locales (formation d’abcès stériles, lipodystrophie) du site d’injection après administration intramusculaire ou sous-cutanée.
Fréquence indéterminée : Asthénie, nécrose au point d’injection, œdème.
La survenue et la sévérité des effets indésirables dépendent de la dose utilisée et de la fréquence d’administration. Cependant, des effets indésirables sévères pouvant même survenir à faibles doses, une surveillance médicale régulière et fréquente des patients est indispensable.
L’administration sous-cutanée de méthotrexate est bien tolérée localement. Seules des réactions cutanées locales bénignes (telles que sensations de brûlure, érythème, œdème, décoloration, prurit, démangeaisons sévères, douleurs), régressant pendant le traitement, ont été observées.
Description de certains effets indésirables
Lymphome / syndrome lymphoprolifératif : il y a eu quelques cas isolés de lymphomes et d’autres syndromes lymphoprolifératifs qui ont régressé dans un certain nombre de cas après l’arrêt du traitement par méthotrexate.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Symptômes d’un surdosage
La toxicité du méthotrexate affecte essentiellement le système hématopoïétique.
Conduite à tenir en cas de surdosage
Le folinate de calcium est l’antidote spécifique pour neutraliser les effets toxiques du méthotrexate.
En cas de surdosage accidentel, une dose de folinate de calcium égale ou supérieure à la dose de méthotrexate reçue par le patient doit être administrée par voie intraveineuse ou intramusculaire dans un délai d’une heure, et l’administration doit être poursuivie jusqu’à ce que la concentration sérique de méthotrexate soit inférieure à 10-7 mol/L.
En cas de surdosage massif, une hydratation et une alcalinisation des urines peuvent être nécessaires pour éviter la précipitation du méthotrexate et/ou de ses métabolites dans les tubules rénaux. Ni l’hémodialyse ni la dialyse péritonéale ne se sont révélées efficaces pour améliorer l’élimination du méthotrexate. Une clairance efficace du méthotrexate a été observée en cas d’hémodialyse immédiate intermittente à l’aide d’un dialyseur à haut débit.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Autres immunosuppresseurs, code ATC : L04AX03.
Médicament antirhumatismal destiné au traitement des maladies rhumatismales inflammatoires chroniques et aux formes polyarticulaires de l’arthrite juvénile idiopathique. Agent immunomodulateur et anti-inflammatoire destiné au traitement de la maladie de Crohn.
Mécanisme d’action
Le méthotrexate est un antagoniste de l’acide folique qui appartient à la classe d’agents cytotoxiques appelés antimétabolites. Il agit par inhibition compétitive de l’enzyme dihydrofolate réductase et inhibe ainsi la synthèse de l’ADN. Il n’a pas encore été clairement déterminé si l’efficacité du méthotrexate dans le traitement du psoriasis, du rhumatisme psoriasique, de la polyarthrite chronique et de la maladie de Crohn est due à un effet anti-inflammatoire ou immunodépresseur et dans quelle mesure l’augmentation induite par le méthotrexate de la concentration d’adénosine extracellulaire dans les sites inflammatoires contribue à ces effets.
Les recommandations cliniques internationales font état de l’utilisation du méthotrexate en deuxième intention chez les patients atteints de la maladie de Crohn qui ont présenté une intolérance ou un échec thérapeutique lors du traitement de première intention par des agents immunomodulateurs tels que l’azathioprine (AZA) ou la 6-mercaptopurine (6-MP).
Les effets indésirables observés lors des études menées avec le méthotrexate pour le traitement de la maladie de Crohn en administration répétée n’ont pas révélé un profil de sécurité du méthotrexate différent du profil déjà connu. Par conséquent, les mêmes précautions doivent être prises lors de l’utilisation du traitement par méthotrexate pour la maladie de Crohn que pour les autres indications du méthotrexate dans le traitement des maladies rhumatismales et non rhumatismales (voir rubriques 4.4 et 4.6).
5.2. Propriétés pharmacocinétiques
Après administration orale, le méthotrexate est absorbé au niveau des voies gastro-intestinales. En cas d’administration à faibles doses (doses de 7,5 mg/m2 à 80 mg/m2 de surface corporelle), la biodisponibilité moyenne est d’environ 70 %, mais des variations interindividuelles et intra-individuelles importantes sont possibles (25 à 100 %). Le pic de concentration sérique est atteint en 1 à 2 heures. La biodisponibilité est comparable et proche de 100 % en cas d’administration sous-cutanée, intraveineuse et intramusculaire.
Distribution
Le méthotrexate se lie à 50 % environ aux protéines plasmatiques. Après distribution dans les tissus corporels, des concentrations élevées sous forme de polyglutamates sont retrouvées notamment dans le foie, les reins et la rate et elles peuvent persister pendant plusieurs semaines ou plusieurs mois. Lorsqu’il est administré à faibles doses, le méthotrexate passe dans le liquide céphalo-spinal en quantités minimes.
Biotransformation
Environ 10 % de la dose de méthotrexate administrée sont métabolisés dans le foie. Le métabolite principal est le 7-hydroxyméthotrexate.
Élimination
Le méthotrexate est éliminé essentiellement sous forme inchangée, par voie rénale principalement, par filtration glomérulaire et sécrétion active dans le tubule proximal.
Environ 5 à 20 % du méthotrexate et 1 à 5 % du 7-hydroxyméthotrexate sont éliminés par voie biliaire. La circulation entérohépatique est importante. La demi-vie terminale est en moyenne de 6 à 7 heures, avec des variations considérables (3 à 17 heures). La demi-vie peut être prolongée jusqu’à 4 fois la durée normale chez les patients qui présentent un espace de distribution tiers (épanchement pleural, ascites).
Populations particulières
L’élimination est fortement retardée en cas d’insuffisance rénale. Les effets d’une insuffisance hépatique sur l’élimination ne sont pas connus.
5.3. Données de sécurité préclinique
Hydroxyde de sodium (pour l’ajustement du pH)
Eau pour préparations injectables
3 ans.
6.4. Précautions particulières de conservation
6.5. Nature et contenu de l'emballage extérieur
Nature de l’emballage extérieur :
Stylo injecteur prérempli contenant une seringue préremplie en verre (type I) incolore avec bouchon-piston (caoutchouc élastomère chlorobutyle) et aiguille d’injection fixée. La seringue est intégrée dans un dispositif d’auto-administration (stylo injecteur prérempli).
Présentations :
Boîtes en carton contenant 1 ou 12 stylos injecteurs préremplis, 4 (4 boîtes de 1), 6 (6 boîtes de 1) ou 12 (12 boîtes de 1) stylos injecteurs préremplis.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Les procédures pour la manipulation et l’élimination doivent être conformes à celles utilisées pour les autres préparations cytotoxiques et respecter les exigences en vigueur. Les femmes enceintes appartenant au personnel soignant ne doivent pas manipuler et/ou administrer le méthotrexate.
Le méthotrexate ne doit pas entrer en contact avec la peau ou les muqueuses. En cas de contamination, la zone affectée doit être rincée immédiatement et abondamment à l’eau.
Destiné à un usage unique exclusivement. Veuillez noter que la totalité du contenu doit être utilisée.
Tout médicament non utilisé ou déchet doit être éliminé conformément aux règlementations en vigueur.
Instructions pour l’administration sous-cutanée.
Les zones les plus appropriées pour l’injection sous-cutanée sont :
L’abdomen ou la cuisse si le/la patient(e) s'auto-injecte le produit, avec comme option supplémentaire la partie postérieure du bras s’il/elle se fait aider par un(e) prestataire de soins ou un(e) aidant(e).
1. Se laver les mains avec du savon sous l’eau chaude courante.
2. Choisir le site d’injection.
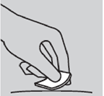
3. Nettoyer le site d'injection : utiliser pour cela une compresse imprégnée d’alcool. Laisser sécher à l’air.
4. Examiner le liquide dans la fenêtre du stylo injecteur. Contrôler la couleur, la limpidité et la présence éventuelle de particules visibles.
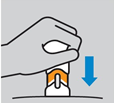
5. Retirer le capuchon inférieur. Tirer sur le capuchon en le faisant tourner pour le retirer. Tenir les mains à l’écart du protège-aiguille une fois que le capuchon a été retiré. Ne pas reboucher. Jeter immédiatement le capuchon inférieur. Ne pas pratiquer l’injection si vous faites tomber le stylo injecteur après avoir retiré le capuchon. Pratiquer l’injection dans un délai de 5 minutes après avoir retiré le capuchon inférieur.
6. Placer le stylo injecteur sur la peau : Positionner le dispositif tout droit sur la peau (à un angle d’environ 90 degrés). Pratiquer l’injection dans un délai de 5 minutes après avoir retiré le capuchon inférieur.
7. Appuyer tout droit sur le bouton-poussoir : Le médicament est injecté lorsque vous appuyez sur le bouton-poussoir. L’injection peut être pratiquée à la vitesse qui vous convient. Ne pas soulever le dispositif pendant l’injection.
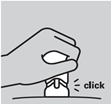
8. L’injection est terminée : lorsque le bouton-poussoir descend aussi bas que possible, vous entendez un déclic et le corps orange n'est plus visible.
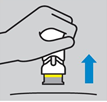
9. Soulever le dispositif tout droit : La bande jaune indique que le protège-aiguille est verrouillé.
Pour des instructions illustrées sur l’administration sous-cutanée, voir la notice.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
635 RUE DE LA CHAUDE RIVIERE
59000 LILLE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 438 8 6 : 0,55 mL en seringue préremplie (verre) avec aiguille, intégrée dans un stylo injecteur. Boîte de 1.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 26/12/2024
IZIXATE 27,5 mg/0,55 mL, solution injectable en stylo injecteur prérempli
Méthotrexate
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, ou votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que IZIXATE 27,5 mg/0,55 mL, solution injectable en stylo injecteur prérempli et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser IZIXATE 27,5 mg/0,55 mL, solution injectable en stylo injecteur prérempli ?
3. Comment utiliser IZIXATE 27,5 mg/0,55 mL, solution injectable en stylo injecteur prérempli ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver IZIXATE 27,5 mg/0,55 mL, solution injectable en stylo injecteur prérempli ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE IZIXATE 27,5 mg/0,55 mL, solution injectable en stylo injecteur prérempli ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique: Autres immunosuppresseurs - Code ATC : L04AX03.
La substance active contenue dans IZIXATE est le méthotrexate.
Le méthotrexate est une substance ayant les propriétés suivantes :
· il interfère avec la croissance de certaines cellules du corps qui se reproduisent rapidement ;
· il réduit l’activité du système immunitaire (le mécanisme de défense propre au corps) ;
· il a des effets anti-inflammatoires.
IZIXATE est indiqué dans le traitement :
· de la polyarthrite rhumatoïde (PR) chez l’adulte. La PR est une maladie chronique caractérisée par une inflammation des membranes synoviales (membranes des articulations). Ces membranes sécrètent un liquide qui agit comme un lubrifiant pour de nombreuses articulations. L’inflammation provoque un épaississement de la membrane et un gonflement de l’articulation.
· des formes polyarticulaires de l’arthrite juvénile idiopathique active sévère, en cas de réponse inadéquate aux anti-inflammatoires non stéroïdiens (AINS). (L'arthrite juvénile touche les enfants et les adolescents âgés de moins de 16 ans).
· des formes sévères du rhumatisme psoriasique chez les patients adultes (le rhumatisme psoriasique est une forme d’arthrite accompagnée de lésions psoriasiques de la peau et des ongles, en particulier au niveau des articulations des doigts et des orteils).
· des formes sévères de psoriasis qui n’ont pas répondu à d’autres formes de traitement (le psoriasis est une affection cutanée chronique courante, caractérisée par des plaques rouges recouvertes de squames adhérentes nacrées, épaisses et sèches).
· de la maladie de Crohn chez les patients adultes (la maladie de Crohn est un type de maladie inflammatoire des intestins provoquant des symptômes tels que des douleurs abdominales, des diarrhées, des vomissements ou une perte de poids).
IZIXATE modifie et ralentit la progression de la maladie.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER IZIXATE 27,5 mg/0,55 mL, solution injectable en stylo injecteur prérempli ?
N’utilisez jamais IZIXATE 27,5 mg/0,55 mL, solution injectable en stylo injecteur prérempli :
· si vous êtes allergique au méthotrexate ou à l’un des autres composants de ce médicament, mentionnés à la rubrique 6 ;
· si vous souffrez d’une maladie sévère du foie ou des reins ou d’une affection du sang ;
· si vous consommez régulièrement des quantités importantes d’alcool ;
· si vous souffrez d’une infection grave, par exemple de tuberculose, d’une infection par le VIH ou d’autres syndromes d’immunodéficience ;
· si vous souffrez d’ulcères buccaux, d’ulcères de l’estomac ou d'ulcères intestinaux ;
· si vous devez recevoir en même temps des vaccinations avec des vaccins vivants ;
· si vous êtes enceinte ou si vous allaitez (voir la rubrique « Grossesse, allaitement et fertilité »).
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien ou votre infirmier/ère avant d’utiliser IZIXATE 27,5 mg/0,55 mL, solution injectable en stylo injecteur prérempli si :
· vous êtes âgé(e) ou si vous vous sentez généralement souffrant(e) et faible ;
· vous avez des problèmes au foie ;
· vous souffrez de déshydratation (manque d’eau) ;
· vous êtes diabétique et êtes traité par de l’insuline.
Des saignements aigus au niveau des poumons chez des patients souffrant de maladies rhumatologiques sous-jacentes ont été rapportés avec le méthotrexate. Si vous présentez des symptômes tels qu’expectorations (crachats) ou toux accompagnés de sang, contactez immédiatement votre médecin.
Mesures de précaution spéciales pour le traitement par IZIXATE 27,5 mg/0,55 mL, solution injectable en stylo injecteur prérempli
Le méthotrexate affecte temporairement la production du sperme et des ovules, ces effets étant réversibles dans la plupart des cas. Le méthotrexate peut provoquer des fausses couches et de graves anomalies congénitales. Vous devez éviter de tomber enceinte pendant votre traitement par méthotrexate et pendant au moins six mois après l’arrêt du traitement si vous êtes une femme. Si vous êtes un homme, vous devez éviter de concevoir un enfant pendant votre traitement par méthotrexate et pendant au moins 3 mois après l’arrêt du traitement. Voir également la rubrique « Grossesse, allaitement et fertilité ».
Si vous, votre partenaire ou votre aidant remarquez une nouvelle apparition ou une aggravation de symptômes neurologiques, notamment une faiblesse musculaire générale, des troubles de la vision, des changements de pensée, de mémoire et d’orientation entraînant une confusion et des modifications de la personnalité, contactez immédiatement votre médecin car il peut s’agir de symptômes d’une infection cérébrale grave très rare appelée leucoencéphalopathie multifocale progressive (LEMP).
Examens de suivi et précautions recommandés :
Avant le début du traitement :
Avant de commencer le traitement, votre sang sera vérifié pour voir si vous avez suffisamment de cellules sanguines. Votre sang sera également testé pour vérifier votre fonction hépatique et pour savoir si vous avez une hépatite. De plus, l'albumine sérique (une protéine dans le sang), le statut de l'hépatite (infection du foie) et la fonction rénale seront vérifiés. Le médecin peut également décider d'effectuer d'autres tests hépatiques, certains d'entre eux peuvent être des images de votre foie et d'autres peuvent nécessiter un petit échantillon de tissu prélevé sur le foie afin de l'examiner de plus près. Votre médecin peut également vérifier si vous avez la tuberculose et il peut radiographier votre poitrine ou effectuer un test de la fonction pulmonaire.
Pendant le traitement :
Votre médecin peut effectuer les examens suivants :
· examen de la cavité buccale et du pharynx à la recherche de modifications de la membrane muqueuse telles qu'une inflammation ou une ulcération
· tests sanguins/numération sanguine avec nombre de cellules sanguines et mesure des taux sériques de méthotrexate
· test sanguin pour surveiller la fonction hépatique
· tests d'imagerie pour surveiller l'état du foie
· petit échantillon de tissu prélevé sur le foie afin de l'examiner de plus près
· prise de sang pour surveiller la fonction rénale
· surveillance des voies respiratoires et, si nécessaire, test de la fonction pulmonaire
Il est très important que vous vous présentiez à ces examens programmés.
Si les résultats de l'un de ces tests sont évidents, votre médecin ajustera votre traitement en conséquence.
Patients âgés
Les patients âgés sous traitement par méthotrexate doivent être étroitement surveillés par un médecin afin que les éventuels effets indésirables puissent être détectés le plus tôt possible.
L'altération des fonctions hépatique et rénale liée à l'âge ainsi que les faibles réserves corporelles de la vitamine acide folique chez les personnes âgées nécessitent une dose relativement faible de méthotrexate.
Les infections chroniques inactives (par ex., zona, tuberculose, hépatite B ou C) peuvent se réactiver pendant le traitement par méthotrexate.
Les dermatites radio-induites et les érythèmes solaires peuvent réapparaître pendant le traitement par méthotrexate (réactions de rappel). Les lésions psoriasiques peuvent s'aggraver si vous êtes exposé(e) à des rayons UV pendant le traitement par méthotrexate.
Une hypertrophie des ganglions lymphatiques (lymphome) peut survenir et le traitement doit alors être arrêté.
La diarrhée peut être un effet toxique d’IZIXATE qui nécessite une interruption du traitement. En cas de diarrhées, consultez votre médecin.
Certains troubles cérébraux (encéphalopathie/leucoencéphalopathie) ont été rapportés chez des patients atteints de cancer recevant un traitement par méthotrexate. La survenue de tels effets indésirables ne peut pas être exclue lorsque le méthotrexate est utilisé pour traiter d’autres maladies.
Enfants
Sans objet.
Autres médicaments et IZIXATE 27,5 mg/0,55 mL, solution injectable en stylo injecteur prérempli
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament. Ceci concerne également les médicaments que vous pourriez prendre dans un avenir plus ou moins proche.
Les effets du traitement peuvent être modifiés si IZIXATE est administré en même temps que certains autres médicaments :
· les antibiotiques tels que : tétracycline, chloramphénicol et antibiotiques à large spectre non absorbables, pénicillines, glycopeptides, sulfamides, ciprofloxacine et céfalotine (médicaments utilisés pour prévenir / combattre certaines infections) ;
· les anti-inflammatoires non stéroïdiens ou les salicylés (médicaments utilisés pour soulager la douleur et/ou l’inflammation, tels que l’acide acétylsalicylique, le diclofénac et l’ibuprofène ou les pyrazolés) ;
· le probénécide (médicament utilisé dans le traitement de la goutte) ;
· les acides organiques faibles tels que les diurétiques de l’anse (médicaments augmentant la production d’urine) ;
· les médicaments qui peuvent avoir des effets indésirables sur la moelle osseuse, par ex., le triméthoprime-sulfaméthoxazole (un antibiotique) et la pyriméthamine ;
· d’autres médicaments utilisés pour traiter la polyarthrite rhumatoïde tels que le léflunomide, la sulfasalazine et l’azathioprine ;
· la cyclosporine (pour la suppression du système immunitaire) ;
· la mercaptopurine (un agent cytostatique) ;
· les rétinoïdes (médicaments utilisés dans le traitement du psoriasis et d’autres maladies de la peau) ;
· la théophylline (médicament utilisé dans le traitement de l’asthme bronchique et d’autres maladies des poumons) ;
· certains médicaments utilisés dans le traitement des troubles gastriques tels que l’oméprazole et le pantoprazole) ;
· les hypoglycémiants (médicaments utilisés pour faire diminuer le taux de sucre dans le sang) ;
· du métamizole (synonymes novaminsulfone et dipyrone) (médicaments contre les fortes douleurs et/ou la fièvre).
Les préparations vitaminiques contenant de l’acide folique peuvent modifier l’effet de votre traitement et vous ne devez les prendre qu’avec l’accord de votre médecin.
La vaccination avec des vaccins vivants doit impérativement être évitée.
IZIXATE 27,5 mg/0,55 mL, solution injectable en stylo injecteur prérempli avec des aliments, boissons et de l’alcool
Grossesse, allaitement et fertilité
Grossesse
N’utilisez pas IZIXATE pendant la grossesse ou si vous essayez de tomber enceinte. Le méthotrexate peut provoquer des anomalies congénitales, avoir des effets nocifs sur l’enfant à naître ou provoquer des fausses couches. Il est associé à des malformations du crâne, du visage, du cœur et des vaisseaux sanguins, du cerveau et des membres. Il est dès lors très important de ne pas administrer le méthotrexate aux patientes enceintes ou à celles qui envisagent de le devenir.
Chez les femmes en âge de procréer, toute possibilité de grossesse doit être exclue en prenant des mesures appropriées, par exemple, en réalisant un test de grossesse avant le début du traitement. Vous devez éviter de tomber enceinte pendant le traitement par méthotrexate et pendant au moins 6 mois après l’arrêt du traitement en utilisant une méthode de contraception fiable durant toute cette période (voir également la rubrique « Mises en garde et précautions »).
Si vous tombez enceinte au cours du traitement ou si vous pensez l’être, consultez votre médecin dès que possible. Une information médicale sur les risques d’effets nocifs du méthotrexate sur l’enfant doit vous être fournie.
Si vous souhaitez tomber enceinte, vous devez consulter votre médecin, qui pourra vous adresser à un spécialiste avant le début planifié du traitement.
Allaitement
L'allaitement doit être interrompu avant et pendant le traitement par IZIXATE.
Fertilité masculine
Les preuves cliniques limitées n’indiquent pas un risque accru de malformations ou de fausses couches si le père prend une dose de méthotrexate inférieure à 30 mg/semaine. Un risque ne peut cependant pas être complètement exclu. Le méthotrexate peut être génotoxique, ce qui signifie que ce médicament peut provoquer des mutations génétiques. Le méthotrexate peut altérer la production du sperme, ce qui peut provoquer des anomalies congénitales. Par conséquent, vous devriez éviter de concevoir un enfant ou de faire des dons de sperme pendant votre traitement par méthotrexate et pendant au moins 3 mois après l’arrêt du traitement.
Conduite de véhicules et utilisation de machines
Le traitement par IZIXATE peut entraîner des effets indésirables sur le système nerveux central, par exemple, de la fatigue et des étourdissements. Par conséquent, la capacité à conduire un véhicule et/ou à utiliser des machines peut être altérée dans certains cas. Abstenez-vous de conduire ou d’utiliser des machines si vous vous sentez fatigué(e) ou somnolent(e).
IZIXATE 27,5 mg/0,55 mL, solution injectable en stylo injecteur prérempli contient du sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose, c’est-à-dire qu’il est essentiellement « sans sodium ».
3. COMMENT UTILISER IZIXATE 27,5 mg/0,55 mL, solution injectable en stylo injecteur prérempli ?
Votre médecin déterminera la posologie, qui est adaptée personnellement à chaque patient. En général, l’effet du traitement apparaît après 4 à 8 semaines.
IZIXATE est administré par voie sous-cutanée (sous la peau) par, ou sous la surveillance d’un médecin ou d'un membre du personnel de santé. IZIXATE est injecté une fois par semaine seulement. Vous déciderez avec votre médecin du jour de la semaine approprié pour recevoir votre injection hebdomadaire.
Avertissement important concernant la dose d’IZIXATE solution injectable en stylo injecteur prérempli :
Utilisez IZIXATE une fois par semaine seulement pour le traitement de la polyarthrite rhumatoïde, de l’arthrite juvénile, du rhumatisme psoriasique, du psoriasis, de la maladie de Crohn. L’utilisation d’une dose excessive d’IZIXATE peut avoir des conséquences fatales. Veuillez lire très attentivement la rubrique 3 de cette notice. Si vous avez des questions, veuillez-vous adresser à votre médecin ou pharmacien avant d’utiliser ce médicament.
Au début de votre traitement, le méthotrexate pourra vous être administré par un professionnel de santé. Toutefois, votre médecin pourra décider de vous apprendre à injecter vous-même le méthotrexate. Vous recevrez alors une formation appropriée. En aucun cas vous ne devrez essayer de vous auto-injecter le produit si vous n’avez pas été formé à cet effet.
Utilisation chez les enfants et les adolescents
Chez les enfants et les adolescents atteints des formes polyarticulaires de l’arthrite juvénile idiopathique, la dose appropriée sera déterminée par le médecin.
IZIXATE ne doit pas être utilisé chez l’enfant de moins de 3 ans compte tenu de l’expérience insuffisante dans ce groupe d’âge.
Mode d’administration et durée du traitement
IZIXATE est injecté une fois par semaine !
La durée du traitement est déterminée par le médecin traitant. Le traitement de la polyarthrite rhumatoïde, de l’arthrite juvénile idiopathique, du psoriasis en plaques, du rhumatisme psoriasique et de la maladie de Crohn par IZIXATE est un traitement de longue durée.
Le méthotrexate ne doit être prescrit que par des médecins qui connaissent les diverses caractéristiques du médicament et son mode d’action. S’il le juge approprié, le médecin traitant peut dans certains cas, laisser le patient pratiquer lui-même l’administration sous-cutanée.
Les patients doivent apprendre à utiliser la technique d’injection correcte. En aucun cas vous ne devrez essayer de vous auto-injecter le produit si vous n’avez pas été formé à cet effet.
Exclusivement destiné à un usage unique. Veuillez noter que la totalité du contenu du stylo injecteur prérempli doit être utilisée à chaque injection.
Les procédures pour la manipulation et l’élimination doivent être conformes à celles utilisées pour les autres préparations cytotoxiques et respecter les exigences en vigueur. Les femmes enceintes appartenant au personnel soignant ne doivent pas manipuler et/ou administrer IZIXATE solution injectable en stylo injecteur prérempli.
Instructions d’utilisation :
Veuillez lire attentivement ces instructions avant d’utiliser le stylo injecteur prérempli d’IZIXATE. Avant d’utiliser ce stylo injecteur, vous devez avoir reçu une formation par un professionnel de santé.
En cas de problème ou si vous avez des questions, contactez votre médecin, votre pharmacien ou votre infirmier/ère.
Avant de commencer
· Choisir un plan de travail propre et bien éclairé pour administrer votre médicament.
· Vérifier la date de péremption sur l’emballage. N’utilisez pas le médicament si la date de péremption est dépassée.
· Rassembler une compresse imprégnée d’alcool et un récipient pour objets tranchants.
|
Préparation |
|
|
|
Se laver les mains avec du savon sous l’eau chaude courante.
|
|
|
Choisir le site d’injection (l’abdomen ou la cuisse si le/la patient(e) s'auto-injecte le produit, avec comme option supplémentaire la partie postérieure du bras s’il ou elle se fait aider par un(e) prestataire de soins ou un(e) aidant(e)).
|
|
|
Nettoyer le site d'injection : utiliser pour cela une compresse imprégnée d’alcool. Laisser sécher à l’air.
|
|
1. Avant l’injection |
|
|
|
Examiner le liquide dans la fenêtre du stylo injecteur. Vérifier que la solution n'est pas décolorée, qu’elle n’est pas trouble et ne comporte pas de particules visibles.
|
|
|
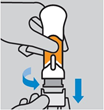
Retirer le capuchon inférieur. Tirer sur le capuchon inférieur en le faisant tourner pour le retirer. Tenir les mains à l’écart du protège-aiguille une fois que le capuchon a été retiré. Ne pas remettre le capuchon en place. Jeter immédiatement le capuchon inférieur. Ne pas pratiquer l’injection si vous faites tomber le stylo injecteur prérempli après avoir retiré le capuchon. Pratiquer l’injection dans un délai de 5 minutes après avoir retiré le capuchon inférieur. |
|
2. Injection |
|
|
|
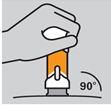
Placer le stylo injecteur tout droit sur la peau (à un angle d’environ 90 degrés).
|
|
|
Appuyer tout droit sur le bouton-poussoir : Le médicament sera injecté en poussant. Pratiquer l’injection à une vitesse qui vous convient. Ne pas soulever le stylo injecteur pendant l’injection.
|
|
|
L’injection est terminée lorsque le bouton-poussoir a été poussé aussi bas que possible, vous entendez un déclic et le corps orange n'est plus visible.
|
|
|
Soulever le dispositif tout droit : La bande jaune indique que le protège-aiguille est verrouillé.
|
|
3. Élimination |
|
|
|
Éliminer le stylo injecteur prérempli d’IZIXATE : Placer le stylo-injecteur dans un récipient à objets tranchants approuvé. Les réglementations varient en fonction des régions. Vérifiez auprès de votre médecin ou pharmacien comment éliminer correctement le stylo injecteur. Ne pas jeter le stylo injecteur avec les ordures ménagères.
|
Le méthotrexate ne doit pas entrer en contact avec la surface de la peau ou les muqueuses. En cas de contamination, la zone concernée doit être rincée immédiatement et abondamment à l’eau.
Si vous vous blessez ou une autre personne se blesse avec l’aiguille, consultez immédiatement votre médecin et n’utilisez pas ce stylo injecteur prérempli d’IZIXATE.
Si vous avez utilisé plus de IZIXATE 27,5 mg/0,55 mL, solution injectable en stylo injecteur prérempli que vous n’auriez dû
Si vous avez utilisé plus d’IZIXATE que vous n’auriez dû, contactez immédiatement votre médecin.
Si vous oubliez d’utiliser IZIXATE 27,5 mg/0,55 mL, solution injectable en stylo injecteur prérempli
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez d’utiliser IZIXATE 27,5 mg/0,55 mL, solution injectable en stylo injecteur prérempli
Si vous arrêtez d’utiliser IZIXATE, contactez immédiatement votre médecin.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
La fréquence et la sévérité des effets indésirables dépendent de la dose utilisée et de la fréquence d’administration. Comme des effets indésirables sévères peuvent survenir même à faibles doses, il est important que vous soyez suivi(e) régulièrement par votre médecin. Votre médecin réalisera des tests pour contrôler les anomalies pouvant apparaître dans le sang (par exemple, faible taux de globules blancs, faible taux de plaquettes, lymphome) et les modifications affectant les reins et le foie.
Prévenez immédiatement votre médecin si vous présentez l’un des symptômes suivants car ils pourraient être le signe d’un effet indésirable grave, pouvant mettre la vie en danger, qui nécessite un traitement spécifique en urgence :
· toux sèche, non productive, persistante, essoufflement et fièvre ; il peut s'agir de signes d’une inflammation des poumons [fréquent - peut toucher jusqu’à 1 personne sur 10]
· expectorations (crachats) ou toux accompagnées de sang, ceci peut être le signe de saignements au niveau des poumons [fréquence indéterminée]
· symptômes d’une atteinte hépatique tels qu’une coloration jaune de la peau et du blanc des yeux ; le méthotrexate peut provoquer des dommages chroniques du foie (cirrhose hépatique), la formation de tissu cicatriciel dans le foie (fibrose hépatique), une dégénérescence graisseuse du foie [peu fréquent dans tous les cas - peut toucher jusqu’à 1 personne sur 100], une inflammation du foie (hépatite aiguë) [rare - peut toucher jusqu’à 1 personne sur 1 000] et une insuffisance hépatique [très rare - peut toucher jusqu’à 1 personne sur 10 000]
· symptômes allergiques tels qu’une éruption cutanée pouvant se manifester par des rougeurs et des démangeaisons, un gonflement des mains, des pieds, des chevilles, du visage, des lèvres, de la bouche ou de la gorge (pouvant entraîner des difficultés à avaler ou à respirer) et une sensation d’évanouissement imminent ; ces symptômes peuvent être les signes de réactions allergiques sévères ou d’un choc anaphylactique [rare - peut toucher jusqu’à 1 personne sur 1 000]
· symptômes d’affection rénale tels que gonflement des mains, des chevilles ou des pieds ou changement de fréquence du besoin d’uriner ou une diminution (oligurie) ou une absence (anurie) des urines ; ces symptômes peuvent être des signes d'une insuffisance rénale [rare - peut toucher jusqu’à 1 personne sur 1 000]
· symptômes d’infection, par ex., fièvre, frissons, douleurs, maux de gorge ; le méthotrexate peut vous rendre plus sensible aux infections. Des infections sévères comme un certain type de pneumonie (pneumonie à Pneumocystis jirovecii) ou un empoisonnement du sang (septicémie) peuvent se produire [rare - peut toucher jusqu’à 1 personne sur 1 000]
· symptômes tels que faiblesse d’un côté du corps (accident vasculaire cérébral) ou douleur, gonflement, rougeur et sensation de chaleur inhabituelle au niveau de l’une de vos jambes (thrombose veineuse profonde) ; cela peut se produire lorsqu'un caillot de sang s’est détaché et bloque un vaisseau sanguin (événement thromboembolique) [rare - peut toucher jusqu’à 1 personne sur 1 000]
· fièvre et grave dégradation de l’état général, ou fièvre soudaine accompagnée de maux de gorge ou de douleurs dans la bouche, ou problèmes urinaires ; le méthotrexate peut provoquer une chute soudaine du nombre de certains globules blancs (agranulocytose) et une sévère inhibition de la moelle osseuse [très rare - peut toucher jusqu’à 1 personne sur 10 000]
· saignement inattendu, par ex., saignements des gencives, présence de sang dans les urines, vomissement de sang ou ecchymoses (bleus) ; il peut s’agir des signes d’une diminution sévère du nombre de plaquettes sanguines due à une importante inhibition de la moelle osseuse [très rare - peut toucher jusqu’à 1 personne sur 10 000]
· des symptômes tels que des maux de tête sévères souvent associés à de la fièvre, à une raideur de la nuque, à des nausées, à des vomissements, à une désorientation et à une sensibilité à la lumière peuvent indiquer une inflammation des membranes du cerveau (méningite aseptique aiguë) [très rare - peut toucher jusqu’à 1 personne sur 10 000]
· certains troubles cérébraux (encéphalopathie / leucoencéphalopathie) ont été signalés chez des patients atteints de cancer recevant un traitement par méthotrexate. La survenue de tels effets indésirables ne peut pas être exclue lorsque le méthotrexate est utilisé pour traiter d’autres maladies. Les signes de ce type de troubles cérébraux peuvent être une dégradation de l’état mental, des troubles du mouvement (ataxie), des troubles visuels ou des troubles de la mémoire [fréquence indéterminée - ne peut pas être estimée à partir des données disponibles]
· éruption cutanée sévère ou formation de cloques sur la peau (pouvant également affecter la bouche, les yeux et les organes génitaux) ; il peut s’agir des signes d’affections appelées « syndrome de Stevens-Johnson » ou « syndrome de brûlure de la peau » (nécrolyse épidermique toxique / syndrome de Lyell) [très rare - peut toucher jusqu’à 1 personne sur 10 000].
Les autres effets indésirables pouvant survenir sont les suivants :
Très fréquents : peuvent toucher plus de 1 personne sur 10
· Inflammation des muqueuses de la bouche, indigestion, nausées, perte d’appétit, douleurs abdominales
· Anomalies des tests de la fonction hépatique (ASAT, ALAT, bilirubine, phosphatase alcaline)
Fréquents : peuvent toucher jusqu’à 1 personne sur 10
· Ulcères dans la bouche, diarrhées
· Éruption cutanée, rougeurs cutanées, démangeaisons
· Maux de tête, fatigue, somnolence
· Diminution de la formation des cellules sanguines avec baisse du taux des globules blancs et/ou des globules rouges et/ou des plaquettes
Peu fréquents : peuvent toucher jusqu’à 1 personne sur 100
· Inflammation de la gorge
· Inflammation des intestins, vomissements, inflammation du pancréas, selles de couleur noire ou à l’aspect goudronneux, ulcères et saignements gastro-intestinaux
· Réactions de type coup de soleil dues à une plus grande sensibilité de la peau au soleil, perte de cheveux, augmentation du nombre de nodosités rhumatismales, ulcère cutané, zona, inflammation des vaisseaux sanguins, éruption cutanée de type herpès, urticaire
· Apparition d'un diabète
· Étourdissements, confusion, dépression
· Diminution du taux sérique d’albumine
· Diminution du nombre de toutes les cellules sanguines et des plaquettes
· Inflammation et ulcération de la vessie ou du vagin, diminution de la fonction rénale, troubles urinaires
· Douleurs articulaires, douleurs musculaires, diminution de la masse osseuse
Rares : peuvent toucher jusqu’à 1 personne sur 1 000
· Inflammation du tissu gingival
· Accentuation de la pigmentation de la peau, acné, taches bleues sur la peau dues au saignement d’un vaisseau (ecchymoses, pétéchies), inflammation allergique des vaisseaux sanguins
· Diminution du nombre d’anticorps dans le sang
· Infection (y compris réactivation d'une infection chronique inactive), yeux rouges (conjonctivite).
· Sautes d’humeur (altérations de l’humeur)
· Troubles visuels
· Inflammation du sac entourant le cœur, accumulation de liquide dans le sac entourant le cœur, altération du remplissage cardiaque en raison de la présence de liquide dans le sac autour du sac
· Hypotension
· Formation de tissu cicatriciel dans les poumons (fibrose pulmonaire), essoufflement et asthme bronchique, accumulation de liquide dans le sac entourant les poumons
· Fracture de stress
· Déséquilibres électrolytiques
· Fièvre, difficultés de cicatrisation
Très rares : peuvent toucher jusqu’à 1 personne sur 10 000
· Dilatation toxique aiguë de l’intestin (mégacôlon toxique)
· Accentuation de la pigmentation des ongles, inflammation des cuticules (panaris aigu), infection profonde des follicules pileux (furonculose), gonflement visible des petits vaisseaux sanguins
· Douleurs, manque de force, sensation d’engourdissement ou de fourmillements / d’être moins sensible à la stimulation que la normale, modifications du goût (goût métallique), convulsions, paralysie, méningisme
· Baisse de la vision, affection oculaire non inflammatoire (rétinopathie)
· Diminution du désir sexuel, impuissance, hypertrophie mammaire chez les hommes, production de sperme défectueuse (oligospermie), troubles menstruels, pertes vaginales
· Hypertrophie des ganglions lymphatiques (lymphome)
· Syndrome lymphoprolifératif (augmentation excessive des globules blancs)
Fréquence indéterminée (ne peut pas être estimée à partir des données disponibles)
· Augmentation du nombre de certains globules blancs
· Saignements de nez
· Présence de protéines dans les urines
· Sensation de faiblesse
· Saignement des poumons
· Lésion osseuse de la mâchoire (secondaire à une augmentation excessive des globules blancs)
· Rougeur et desquamation de la peau
· Gonflement
· Destruction des tissus au point d’injection.
L’administration sous-cutanée de méthotrexate est bien tolérée localement. Seules des réactions cutanées locales bénignes (telles que sensations de brûlure, érythème, œdème, décoloration, démangeaisons sévères, douleurs), régressant pendant le traitement, ont été observées.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER IZIXATE 27,5 mg/0,55 mL, solution injectable en stylo injecteur prérempli ?
Tenir ce médicament hors de la vue et de la portée des enfants.
À conserver à une température ne dépassant pas 30 °C.
Conserver le stylo injecteur prérempli dans l’emballage extérieur d’origine, à l’abri de la lumière.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette/la boîte après EXP. La date de péremption fait référence au dernier jour de ce mois.
N’utilisez pas ce médicament si vous remarquez un changement de couleur ou des particules visibles.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient IZIXATE 27,5 mg/0,55 mL, solution injectable en stylo injecteur prérempli
· La substance active est : le méthotrexate.
1 stylo injecteur prérempli avec 0,55 mL de solution contient 27,5 mg de méthotrexate
· Les autres composants sont : le chlorure de sodium, l’hydroxyde de sodium (pour ajustement du pH) et l’eau pour préparations injectables.
IZIXATE contient une solution transparente, de couleur jaune-brun.
Nature de l’emballage extérieur : Stylo injecteur prérempli contenant une seringue préremplie en verre incolore (type I) avec bouchon-piston (caoutchouc élastomère chlorobutyle) et aiguille d’injection fixée. La seringue est intégrée dans un dispositif d’auto-administration (stylo injecteur prérempli).
Les présentations suivantes sont disponibles :
Boîtes contenant 1 ou 12 stylos injecteurs préremplis, 4 (4 boîtes de 1), 6 (6 boîtes de 1) ou 12 (12 boîtes de 1) stylos injecteurs préremplis.
Toutes les présentations peuvent ne pas être commercialisées
Titulaire de l’autorisation de mise sur le marché
635 RUE DE LA CHAUDE RIVIERE
59000 LILLE
Exploitant de l’autorisation de mise sur le marché
ACCORD HEALTHCARE FRANCE SAS
635 RUE DE LA CHAUDE RIVIERE
59800 LILLE
ACCORD HEALTHCARE POLSKA SP.Z.O.O.
UL. LUTOMIERSKA 50
95-200 PABIANICE
POLOGNE
Ou
Accord Healthcare B.V.
Winthontlaan 200
3526 KV Utrecht
PAYs-BAS
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen ou au Royaume-Uni (Irlande du Nord) sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
{mois AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).