
Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.
Pour plus d'information sur les pictogrammes, consultez l'aide.
LECIGIMON est utilisé pour le traitement de la maladie de Parkinson. Il est utilisé lorsque la maladie est au stade avancé et lorsque les médicaments pris par voie orale (pris par la bouche) n’ont plus un effet suffisant.
LECIGIMON est un gel administré de façon continue au moyen d’une pompe et d’une sonde directement dans votre intestin grêle.
LECIGIMON contient trois substances actives :
· lévodopa
· carbidopa (sous forme de carbidopa monohydratée)
· entacapone
Comment agit LECIGIMON 20 mg/5 mg/20 mg par mL, gel intestinal
Chez une personne atteinte de la maladie de Parkinson, les taux de dopamine dans le cerveau sont faibles. La lévodopa est convertie en dopamine dans le cerveau, atténuant ainsi les symptômes de la maladie de Parkinson. La carbidopa et l’entacapone améliorent les effets antiparkinsoniens de la lévodopa.
Ce médicament n'appartient à aucun groupe générique
 Gel (Composition pour 1 mL de gel)
Gel (Composition pour 1 mL de gel)
 20 mg
20 mg
 4,6 mg
4,6 mg
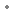 sous forme de : carbidopa monohydratée
sous forme de : carbidopa monohydratée  5 mg
5 mg
 20 mg
20 mg
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 14/12/2022 | Inscription (CT) | Le service médical rendu par LECIGIMON (levodopa/carbidopa/entacapone) est important dans l’indication de l’AMM. |
| Insuffisant | Avis du 30/03/2022 | Inscription (CT) | Le service médical rendu par LECIGIMON (lévodopa/carbidopa/entacapone) est insuffisant pour justifier d’une prise en charge par la solidarité nationale dans l’indication de l’AMM. |
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 14/12/2022 | Inscription (CT) | Compte tenu : • des données évaluées lors de la première inscription issues d’une étude de pharmacocinétique versus DUODOPA (lévodopa/carbidopa) réalisée à court terme (deux jours) sur un faible ef-fectif de patients (n=11), n’ayant pas permis de démontrer l’intérêt clinique de l’ajout de l’entacapone à la bithérapie levodopa/carbidopa administrée par une pompe implantable, • des nouvelles données d’efficacité de faible niveau de preuve issues de la littérature, • de l’absence de données robustes sur la qualité de vie des patients, et prenant en compte : • le profil de tolérance connu des trois molécules (lévodopa/carbidopa/entacapone) • les modalités d’administration permettant une administration entérale de l’entacapone là où celle-ci est uniquement disponible en administration orale, • le besoin médical partiellement couvert avec uniquement une seule spécialité disponible en administration intestinale continue (DUODOPA (lévodopa/carbidopa)), la Commission considère que LECIGIMON (lévodopa/carbidopa/entacapone) n’apporte pas d’amélioration du service médical rendu (ASMR V) dans la stratégie de prise en charge de la maladie de Parkinson à un stade avancé avec fluctuations motrices et hyperkinésie ou dyski-nésie sévère, lorsque les associations disponibles d’antiparkinsoniens par voie orale n’ont pas donné de résultats satisfaisants. |
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |