Dernière mise à jour le 01/12/2025
FENTANYL ARROW 400 microgrammes, comprimé buccogingival
Ce médicament n'est ou ne sera bientôt plus disponible sur le marché.
Si vous prenez actuellement ce médicament, il vous est recommandé d'en parler avec votre médecin
ou avec votre pharmacien qui pourra vous orienter vers un autre traitement.
Indications thérapeutiques
Classe pharmacothérapeutique : analgésiques, opioïdes - code ATC : N02AB03
La substance active de FENTANYL ARROW est le citrate de fentanyl. Le fentanyl est un médicament antalgique, également connu sous le nom de morphinique. Il est utilisé pour traiter l’accès douloureux paroxystique chez les patients adultes atteints d’un cancer et prenant déjà d’autres antalgiques de type morphinique pour le traitement des douleurs persistantes (permanentes) d’origine cancéreuse.
L’accès douloureux paroxystique est une douleur supplémentaire qui survient brutalement en dépit de la prise des autres antalgiques habituels de type morphinique.
Documents de bon usage du médicament
- Prévenir le risque de surdose d’opioïdes
Auteur : Haute autorité de santé
Type : Fiche Bon Usage du Médicament
Date de mise à jour :Avril 2023
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 19/06/2024
FENTANYL ARROW 400 microgrammes, comprimé buccogingival
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Fentanyl (sous forme de citrate)........................................................................... 400 microgrammes
Pour un comprimé buccogingival
Excipient à effet notoire : chaque comprimé buccogingival contient 67,1 mg de sorbitol.
Pour la liste complète des excipients, voir rubrique 6.1.
Comprimé blanc, rond (diamètre environ 10 mm), à bords biseautés, gravé « 4 » sur une face.
4.1. Indications thérapeutiques
Un accès douloureux paroxystique est une exacerbation passagère d'une douleur chronique par ailleurs contrôlée par un traitement de fond.
Les patients sous traitement de fond morphinique sont ceux prenant au moins 60 mg de morphine par voie orale par jour, au moins 25 microgrammes de fentanyl transdermique par heure, au moins 30 mg d’oxycodone par jour, au moins 8 mg d’hydromorphone par voie orale par jour ou une dose équianalgésique d’un autre opioïde pendant une durée d’au moins une semaine.
4.2. Posologie et mode d'administration
Posologie
Titration de la dose
La posologie « efficace » des comprimés buccogingivaux de fentanyl doit être déterminée individuellement pour chaque patient (titration), c'est-à-dire la dose produisant l'effet antalgique approprié avec un minimum d'effets indésirables. Lors des études cliniques, il n’a pas été possible de prédire la dose efficace de fentanyl pour le traitement des accès douloureux paroxystiques en fonction de la dose quotidienne du traitement de fond morphinique.
Les patients doivent être surveillés étroitement jusqu’à l’obtention d’une dose efficace.
Titration chez des patients recevant du fentanyl pour la première fois
La dose initiale en comprimés buccogingivaux de fentanyl doit être de 100 microgrammes, avec augmentation de la posologie, si nécessaire, conformément à la gamme de dosages disponibles (100, 200, 400, 600, et 800 microgrammes).
Titration chez des patients passant d’un autre médicament contenant du fentanyl aux comprimés buccogingivaux de fentanyl
Compte tenu du fait que ces produits possèdent des profils d’absorption différents, la substitution ne doit pas se faire selon un rapport de 1:1. Chez les patients passant d’une autre forme orale de citrate de fentanyl aux comprimés buccogingivaux de fentanyl, la titration de la dose doit être réalisée indépendamment étant donné que la biodisponibilité entre les produits diffère significativement. Néanmoins, chez ces patients, une dose initiale supérieure à 100 microgrammes peut être envisagée.
Méthode de titration
Durant la titration, si une analgésie satisfaisante n’est pas obtenue dans les 30 minutes suivant l’administration d’un seul comprimé, un deuxième comprimé buccogingival de fentanyl du même dosage peut être utilisé.
Si le traitement d’un accès douloureux paroxystique requiert plus d'un comprimé, il convient d'envisager de passer au dosage immédiatement supérieur pour le traitement de l’accès douloureux paroxystique suivant.
Plusieurs comprimés peuvent être utilisés lors de la phase titration de la dose : jusqu’à quatre comprimés de 100 microgrammes ou jusqu’à quatre comprimés de 200 microgrammes peuvent être utilisés pour traiter un seul accès douloureux paroxystique selon le schéma suivant :
· Si la prise initiale d’un comprimé à 100 microgrammes n’est pas efficace, il faut informer le patient qu’il doit traiter le prochain accès douloureux paroxystique avec deux comprimés de 100 microgrammes. Il est recommandé de placer un comprimé de chaque côté de la bouche. Si cette dose est considérée comme la dose efficace, le traitement des accès douloureux paroxystiques ultérieurs doit être poursuivi avec un seul comprimé buccogingival de 200 microgrammes de fentanyl.
· Si l’utilisation d’un seul comprimé buccogingival de 200 microgrammes de fentanyl (ou de deux comprimés de 100 microgrammes) n’est pas considérée comme étant efficace, il faut indiquer au patient de prendre deux comprimés de 200 microgrammes (ou quatre comprimés de 100 microgrammes) pour traiter l’accès douloureux paroxystique suivant. Il est recommandé de placer deux comprimés de chaque côté de la bouche. Si cette dose est considérée comme la dose efficace, le traitement des accès douloureux paroxystiques ultérieurs doit être poursuivi avec un seul comprimé buccogingival de 400 microgrammes de fentanyl.
· Il convient d’utiliser des comprimés de 200 microgrammes pour une augmentation posologique à 600 microgrammes ou à 800 microgrammes.
Des doses supérieures à 800 microgrammes n’ont pas été évaluées lors des études cliniques.
Il ne faudra pas utiliser plus de deux comprimés pour traiter un même accès douloureux paroxystique, sauf lors de l’adaptation posologique décrite ci-dessus, utilisant jusqu’à quatre comprimés. Lors de la titration, les patients doivent attendre au moins 4 heures avant de traiter un autre accès douloureux paroxystique par des comprimés buccogingivaux de fentanyl.
Traitement d’entretien
Une fois la dose efficace déterminée lors de la phase de titration, les patients doivent continuer d’utiliser un seul comprimé de cette dose. Les accès douloureux paroxystiques peuvent varier en intensité et la dose requise en comprimés buccogingivaux de fentanyl pourrait augmenter avec le temps en raison de la progression de la maladie cancéreuse sous-jacente. Dans ces cas, un second comprimé de la même dose peut être utilisé. Si un second comprimé buccogingival de fentanyl s’est avéré nécessaire plusieurs fois de suite, la dose d'entretien habituelle devrait être réajustée (voir ci-dessous).
Lors du traitement d’entretien, les patients doivent attendre au moins 4 heures avant de traiter un autre accès douloureux paroxystique.
Réajustement de la dose
La dose d’entretien en comprimés buccogingivaux de fentanyl doit être augmentée si le traitement de plusieurs accès douloureux paroxystiques consécutifs requiert plus d’un comprimé par accès. Pour la dose de réajustement les mêmes principes que ceux décrits pour la titration s'appliquent (voir ci-dessus).
Si les patients présentent régulièrement plus de quatre accès douloureux paroxystiques par 24 heures, il peut être nécessaire de réajuster le traitement morphinique de fond.
En l’absence de contrôle adéquat de la douleur, la possibilité d’hyperalgésie, de tolérance et de progression de la maladie sous-jacente doit être envisagée (voir rubrique 4.4).
Durée et objectifs du traitement
Avant l’instauration du traitement par FENTANYL ARROW, une stratégie thérapeutique comprenant la durée et les objectifs du traitement doivent être convenus avec le patient, conformément aux lignes directrices relatives à la prise en charge de la douleur. Pendant le traitement, des contacts fréquents doivent avoir lieu entre le médecin et le patient afin d’évaluer la nécessité de poursuivre le traitement, d’envisager l’arrêt du traitement et d’ajuster les doses si nécessaire. En l’absence d’un contrôle adéquat de la douleur, la possibilité d’hyperalgésie, de tolérance et de progression de la maladie sous-jacente doit être envisagée (voir rubrique 4.4). FENTANYL ARROW ne doit pas être utilisé plus longtemps que nécessaire.
Arrêt du traitement
Le traitement par comprimé buccogingival de fentanyl doit être immédiatement arrêté si le patient ne présente plus d’accès douloureux paroxystiques. Le traitement des douleurs de fond chroniques doit être poursuivi conformément à la prescription.
Si l’arrêt de tout traitement opioïde est nécessaire, le patient doit être surveillé de près par le médecin afin de gérer le risque d’effets liés à un sevrage brutal.
Insuffisance hépatique ou rénale
Les comprimés buccogingivaux de fentanyl doivent être administrés avec prudence chez les patients avec une insuffisance hépatique ou rénale modérée ou sévère (voir rubrique 4.4).
Patients présentant une xérostomie
Il est conseillé aux patients présentant une xérostomie de boire de l’eau avant l’administration des comprimés buccogingivaux de fentanyl afin d’humidifier la cavité buccale. Il est conseillé de changer de traitement dans le cas où cette recommandation ne suffirait pas à obtenir une désagrégation appropriée du comprimé.
Utilisation chez le sujet âgé (de plus de 65 ans)
Au cours des études cliniques, la dose efficace tendait à être plus faible chez les patients âgés de plus de 65 ans que chez les patients plus jeunes. La plus grande prudence est de rigueur lors de la titration de la dose des comprimés buccogingivaux de fentanyl chez les patients âgés.
Population pédiatrique
La sécurité et l'efficacité des comprimés buccogingivaux de fentanyl chez les enfants âgés de 0 à 18 ans n'ont pas été établies. Aucune donnée n'est disponible.
Mode d’administration
Il est recommandé aux patients de ne pas ouvrir la plaquette avant d’être prêts à placer le comprimé dans la cavité buccale.
Ouverture de la plaquette
Les patients doivent être informés de NE PAS essayer de pousser le comprimé à travers la feuille de couverture car cela pourrait endommager le comprimé buccogingival. La méthode appropriée pour l’ouverture de la plaquette est :
Détacher une des alvéoles de la plaquette en découpant selon les perforations. Plier l’alvéole le long de la ligne imprimée sur la feuille de couverture. Retirer la feuille de couverture pour laisser apparaître le comprimé.
Les patients doivent être prévenus qu’il ne faut pas écraser ni couper le comprimé.
Le comprimé ne doit pas être conservé une fois la feuille de couverture retirée car l’intégrité du comprimé ne peut être garantie dans ce cas et il existe un risque d’exposition accidentelle au produit.
Administration des comprimés
Les patients doivent retirer un comprimé de la plaquette et le placer immédiatement dans la cavité buccale (près d’une molaire entre la joue et la gencive).
Les comprimés buccogingivaux de fentanyl ne doivent pas être sucés, mâchés ou avalés, car les concentrations plasmatiques seraient alors inférieures à celles obtenues lors de l’utilisation selon les instructions.
Le comprimé buccogingival de fentanyl doit être placé dans la cavité buccale et y rester pendant une période de temps suffisante pour permettre la désagrégation du comprimé, ce qui peut prendre jusqu’à 30 minutes.
Le comprimé peut également être placé sous la langue (voir rubrique 5.2).
Après 30 minutes, s’il reste des morceaux de comprimé, il est possible de les avaler avec un verre d’eau.
Le temps de désagrégation totale du comprimé après administration par voie buccale transmuqueuse ne semble pas avoir d’influence sur l’exposition systémique précoce au fentanyl.
Lorsqu’un comprimé se trouve dans la cavité buccale, les patients ne doivent ni boire ni manger. En cas d’irritation des muqueuses buccales, il est recommandé de changer l’emplacement du comprimé.
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
· Patients non traités par un traitement de fond morphinique, en raison d’un risque accru de dépression respiratoire.
· Dépression respiratoire sévère ou obstruction sévère des voies aériennes.
· Traitement de la douleur aiguë autre que les accès douloureux paroxystiques.
· Patients traités avec des médicaments contenant de l’oxybate de sodium.
4.4. Mises en garde spéciales et précautions d'emploi
Utilisation accidentelle chez les enfants
Il est impératif d'informer les patients et les soignants que les comprimés buccogingivaux de fentanyl contiennent une substance active à une dose qui peut être mortelle, en particulier pour un enfant. Ils doivent donc tenir tous les comprimés hors de la vue et de la portée des enfants.
Surveillance
Afin de réduire au minimum les risques d'effets indésirables liés aux morphiniques et de déterminer la dose efficace, il est indispensable que les patients soient étroitement surveillés par des professionnels de santé durant la phase de titration.
Traitement de fond morphinique
Il est important de s’assurer que le traitement de fond morphinique utilisé pour traiter la douleur chronique du patient a été stabilisé avant d’amorcer un traitement par comprimés buccogingivaux de fentanyl et que le patient continue le traitement de fond morphinique tout en prenant les comprimés buccogingivaux. Le produit ne doit pas être administré à des patients qui n’ont pas de traitement de fond morphinique en raison du risque accru de dépression respiratoire et de décès.
Dépression respiratoire
Comme avec tous les opioïdes, l’utilisation de fentanyl est associée à un risque de dépression respiratoire cliniquement significative. L’utilisation chez un patient sélectionné de façon non adaptée (par exemple, chez les patients sans traitement de fond morphinique) et/ou un dosage non adapté du médicament ont entraîné une issue fatale aussi bien avec des comprimés buccogingivaux de fentanyl qu’avec d’autres spécialités à base de fentanyl.
Les comprimés buccogingivaux de fentanyl doivent être utilisés uniquement selon les conditions décrites dans la rubrique 4.1.
Pathologie pulmonaire chronique obstructive
La prudence est de rigueur lors de la titration des comprimés buccogingivaux de fentanyl chez des patients présentant une bronchopneumopathie chronique obstructive non sévère ou toute autre pathologie les prédisposant à une dépression respiratoire car même administrés aux doses thérapeutiques normales, les comprimés buccogingivaux de fentanyl peuvent aggraver les troubles respiratoires jusqu'à provoquer une insuffisance respiratoire.
Troubles respiratoires liés au sommeil
Les opioïdes peuvent provoquer des troubles respiratoires liés au sommeil, notamment une apnée centrale du sommeil (ACS) et une hypoxémie liée au sommeil. L’utilisation d’opioïdes augmente le risque d’ACS de façon dose-dépendante. Chez les patients présentant une ACS, une réduction de la dose totale d’opioïdes doit être envisagée.
Alcool
L’utilisation concomitante d’alcool et de fentanyl peut entraîner une augmentation des effets dépresseurs pouvant être fatale (voir rubrique 4.5).
Risques en cas d’administration concomitante de benzodiazépines ou de médicaments apparentés
L’utilisation concomitante d’opioïdes, dont FENTANYL ARROW, et de benzodiazépines ou de médicaments apparentés peut entraîner une sédation profonde, une dépression respiratoire, un coma et le décès. Compte tenu de ces risques, la prescription concomitante d’opioïdes et de benzodiazépines ou de médicaments apparentés ne doit se faire que chez les patients pour lesquels il n’existe pas d’autres options thérapeutiques adéquates.
Si la décision est prise de prescrire du fentanyl conjointement à des benzodiazépines ou des médicaments apparentés, il conviendra de choisir la plus faible dose efficace et la durée minimale d’utilisation concomitante. Les patients doivent être étroitement surveillés pour déceler tout signe et symptôme éventuel de dépression respiratoire et de sédation (voir rubrique 4.5).
Augmentation de la pression intracrânienne, troubles de la conscience
Les comprimés buccogingivaux de fentanyl ne doivent être administrés qu’avec une extrême prudence chez les patients qui pourraient être particulièrement sensibles aux effets cérébraux de l'hypercapnie, par exemple chez les patients présentant des signes d'hypertension intracrânienne ou des troubles de la conscience. Les opioïdes pouvant masquer l'évolution clinique en cas de traumatisme crânien, ils ne doivent être utilisés dans ce cadre qu'en cas de nécessité clinique.
Bradyarythmie
Le fentanyl peut provoquer une bradycardie. Il doit être utilisé avec prudence chez les patients présentant des antécédents de bradyarythmie ou une bradyarythmie préexistante.
Insuffisance rénale ou hépatique
En outre, les comprimés buccogingivaux de fentanyl doivent être administrés avec prudence chez les patients présentant une insuffisance hépatique ou rénale. L’influence d'une insuffisance hépatique ou rénale sur la pharmacocinétique du fentanyl n’a pas été étudiée. Cependant, lors de l'administration intraveineuse, la clairance du fentanyl est modifiée par l'insuffisance hépatique ou rénale en raison d'une altération de la clairance métabolique et de la liaison aux protéines plasmatiques. Après administration de comprimé buccogingival de fentanyl, l'insuffisance hépatique ou rénale peut d’une part augmenter la biodisponibilité du fentanyl absorbé par voie buccale et d’autre part diminuer sa clairance systémique, ce qui pourrait entraîner des effets morphiniques accrus et prolongés. Une prudence particulière est donc de rigueur lors de la phase de titration chez des patients présentant une insuffisance hépatique ou rénale modérée à sévère.
Le traitement par le fentanyl doit être envisagé avec prudence en cas d'hypovolémie ou d'hypotension.
Syndrome sérotoninergique
Il est conseillé de faire preuve de prudence lorsque des comprimés buccogingivaux de fentanyl sont administrés en association avec des médicaments qui affectent les systèmes de neurotransmission sérotoninergique.
Un syndrome sérotoninergique, susceptible de mettre en jeu le pronostic vital, peut se développer lors de l'utilisation concomitante de médicaments sérotoninergiques tels que des inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) et des inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN), ainsi qu’avec des médicaments qui altèrent le métabolisme de la sérotonine (y compris les inhibiteurs de la monoamine oxydase [IMAO]). Cela peut se produire aux doses recommandées.
Le syndrome sérotoninergique peut s’accompagner d’altérations de l'état mental (p. ex. agitation, hallucinations, coma), d’une instabilité du système nerveux autonome (p. ex. tachycardie, pression artérielle labile, hyperthermie), de troubles neuromusculaires (p. ex. hyperréflexie, incoordination, rigidité) et/ou de symptômes gastro-intestinaux (p. ex. nausées, vomissements, diarrhée).
En cas de suspicion de syndrome sérotoninergique, il convient d’arrêter le traitement par comprimés buccogingivaux de fentanyl.
Tolérance et troubles liés à l’usage d’opioïdes (abus et dépendance)
Une accoutumance, une dépendance physique et une dépendance psychologique sont susceptibles d'apparaître lors de l'administration répétée de morphiniques. Le risque d’une utilisation abusive peut apparaître avec fentanyl de la même manière qu’avec d’autres morphiniques, et tous les patients traités par morphiniques doivent faire l’objet d’une surveillance dans le but de mettre en évidence tout signe d’utilisation abusive et d’addiction. Les patients ayant un risque accru d’utilisation abusive des morphiniques peuvent malgré tout être traités par morphiniques, mais l’apparition de tout signe de mésusage, d’utilisation abusive ou d’addiction doit être étroitement surveillé.
L’utilisation répétée de FENTANYL ARROW peut induire un trouble lié à l’usage d’opioïdes (TUO). Une dose plus élevée et une durée plus longue du traitement par opioïdes peuvent augmenter le risque de développer un TUO. L’abus ou le mésusage intentionnel de FENTANYL ARROW peut entraîner un surdosage et/ou le décès du patient. Le risque de développer un TUO est accru chez les patients ayant des antécédents personnels ou familiaux (parents ou frères et sœurs) de troubles liés à la consommation de substances (y compris ceux liés à la consommation abusive d’alcool), chez les fumeurs actifs ou chez les patients ayant des antécédents personnels de troubles de la santé mentale (par ex. dépression majeure, anxiété et troubles de la personnalité).
Avant l’instauration du traitement par FENTANYL ARROW et pendant le traitement, les objectifs du traitement et un plan d’arrêt doivent être convenus en accord avec le patient (voir rubrique 4.2). Avant et pendant le traitement, le patient doit également être informé des risques et des signes de TUO. En cas d’apparition de ces signes, les patients doivent être invités à contacter leur médecin.
Les patients devront être surveillés pour détecter tout signe d’abus ou d’addiction (par exemple une demande de renouvellement prématurée). Cela inclut la revue de la prise concomitante d’opioïdes et de psychotropes (comme les benzodiazépines). Pour les patients présentant des signes et des symptômes de TUO, il convient d’envisager une consultation chez un spécialiste en toxicomanie.
Effets endocriniens
Les morphiniques peuvent avoir une action pharmacologique sur l’axe hypothalamo-hypophysosurrénalien ou sur l’axe hypothalamo-hypophyso-gonadique. Une augmentation de la prolactine sérique et une diminution du cortisol plasmatique et de la testostérone peuvent être observés. Des signes et des symptômes cliniques peuvent apparaître suite à ces modifications hormonales.
Hyperalgésie
Comme avec les autres opioïdes, en cas de contrôle insuffisant de la douleur en réponse à une dose plus élevée de fentanyl, la possibilité d’hyperalgésie induite par les opioïdes doit être envisagée. Une réduction de la dose de fentanyl, l’arrêt du traitement par le fentanyl ou une réévaluation du traitement peuvent être indiqués.
Anaphylaxie et hypersensibilité
Des cas d’anaphylaxie et d’hypersensibilité ont été rapportés avec l’utilisation de médicaments à base de fentanyl administrés par voie buccale transmuqueuse (voir rubrique 4.8).
Excipient
Ce médicament contient 67,1 mg de sorbitol par comprimé buccogingival.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Agents ayant un effet sur l’activité du CYP3A4
Le fentanyl est principalement métabolisé par l’isoenzyme 3A4 du cytochrome P450 (CYP3A4). Par conséquent, des interactions potentielles peuvent survenir en cas d’administration concomitante de comprimés buccogingivaux de fentanyl et d’agents ayant un effet sur l’activité du CYP3A4.
Inducteurs du CYP3A4
L’efficacité des comprimés buccogingivaux de fentanyl peut être réduite en cas d’administration concomitante d’agents ayant un effet inducteur sur l’activité du CYP3A4.
Inhibiteurs du CYP3A4
L’administration concomitante de comprimés buccogingivaux de fentanyl et d’inhibiteurs puissants du CYP3A4 (par ex. ritonavir, kétoconazole, itraconazole, troléandomycine, clarithromycine, et nelfinavir) ou modérés (par ex. amprénavir, aprépitant, diltiazem, érythromycine, fluconazole, fosamprénavir, jus de pamplemousse, et vérapamil) est susceptible d’augmenter les concentrations plasmatiques de fentanyl, ce qui pourrait entraîner des effets indésirables graves, y compris une dépression respiratoire. Les patients recevant des comprimés buccogingivaux de fentanyl en même temps que des inhibiteurs modérés ou puissants du CYP3A4 doivent faire l’objet d’une surveillance étroite pendant une période de temps prolongée. L’augmentation posologique doit être réalisée avec prudence.
Agents pouvant augmenter les effets dépresseurs sur le SNC
L'administration concomitante de fentanyl et d'autres dépresseurs du SNC (autres morphiniques, sédatifs ou hypnotiques [dont les benzodiazépines], anesthésiques généraux, phénothiazines, tranquillisants, myorelaxants, antihistaminiques sédatifs, alcool et gabapentinoïdes [gabapentine et prégabaline]) peut potentialiser les effets dépresseurs de chaque produit, ce qui peut conduire à une dépression respiratoire, une hypotension, une sédation profonde, un coma ou une issue fatale (voir rubrique 4.4).
Sédatifs tels que les benzodiazépines ou les médicaments apparentés
L’utilisation concomitante d’opioïdes et de sédatifs tels que les benzodiazépines ou les médicaments apparentés augmente le risque de sédation, de dépression respiratoire, de coma et de décès en raison de l’effet dépresseur additif exercé sur le SNC. La dose et la durée de l’utilisation concomitante doivent être limitées (voir rubrique 4.4).
Antalgiques morphiniques agonistes/antagonistes partiels
L’utilisation concomitante d’antalgiques morphiniques agonistes/antagonistes partiels (exemples : buprénorphine, nalbuphine, pentazocine) n’est pas recommandée. En effet, ils possèdent une forte affinité pour les récepteurs morphiniques avec une activité intrinsèque relativement faible et donc antagonisent partiellement l’effet analgésique du fentanyl pouvant ainsi induire un syndrome de sevrage chez les patients dépendants aux opioïdes.
Agents sérotoninergiques
L'administration concomitante de fentanyl et d’un agent sérotoninergique, tel qu’un inhibiteur sélectif de la recapture de la sérotonine (ISRS), un inhibiteur de la recapture de la sérotonine et de la noradrénaline (IRSN) ou un inhibiteur de la monoamine oxydase (IMAO), peut augmenter le risque de syndrome sérotoninergique, une pathologie pouvant mettre en jeu le pronostic vital. Sachant qu’une potentialisation sévère et imprévisible a été rapportée lors de l’administration concomitante d’IMAO et d’analgésiques morphiniques, les comprimés buccogingivaux de fentanyl ne sont pas recommandés chez les patients ayant reçu des IMAO dans les 14 jours précédant la prise.
Oxybate de sodium
L’administration concomitante de fentanyl avec des médicaments contenant de l’oxybate de sodium est contre-indiquée (voir rubrique 4.3). Le traitement par l’oxybate de sodium doit être arrêté avant de débuter le traitement avec FENTANYL ARROW.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n’existe pas de données suffisamment pertinentes sur l’utilisation de fentanyl chez la femme enceinte. Les études effectuées chez l’animal ont mis en évidence une toxicité sur la reproduction (voir rubrique 5.3). Le risque potentiel en clinique n’est pas connu. Les comprimés buccogingivaux de fentanyl ne doivent pas être utilisés pendant la grossesse à moins d’une nécessité absolue.
En cas d’utilisation prolongée de fentanyl pendant la grossesse, il existe un risque de syndrome de sevrage des opioïdes chez le nouveau-né, pouvant engager le pronostic vital s’il n’est pas identifié et traité, et nécessitant une prise en charge conformément aux protocoles développés par les experts en néonatalogie. Si l’utilisation d’opioïdes est nécessaire sur une durée prolongée chez une femme enceinte, la patiente doit être informée du risque de syndrome de sevrage néonatal des opioïdes et un traitement approprié doit être tenu à disposition (voir rubrique 4.8).
Il est recommandé de ne pas utiliser du fentanyl pendant le travail et l'accouchement (y compris en cas de césarienne), car le fentanyl franchit la barrière placentaire et peut entraîner une dépression respiratoire chez le fœtus. En cas d’administration de comprimés buccogingivaux de fentanyl, un antidote pour l’enfant doit être disponible immédiatement.
Le fentanyl est excrété dans le lait maternel et peut entraîner une sédation et/ou une dépression respiratoire chez le nourrisson. Le fentanyl ne doit pas être utilisé pendant l’allaitement et celui-ci ne doit pas reprendre moins de 5 jours après la dernière administration du fentanyl.
Fertilité
Il n'existe pas de données sur la fertilité chez l’être humain. Dans les études animales, la fertilité des mâles était altérée (voir rubrique 5.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil de sécurité
Les effets indésirables attendus avec les comprimés buccogingivaux de fentanyl sont les effets indésirables typiques des morphiniques. Le plus souvent, ces effets cesseront ou diminueront d’intensité avec la poursuite du traitement et l’obtention de la dose appropriée pour le patient. Cependant, les effets indésirables les plus graves étant la dépression respiratoire (pouvant entraîner une apnée ou un arrêt respiratoire), la dépression circulatoire, l’hypotension et l’état de choc ; l’apparition éventuelle de ces effets doit être étroitement surveillée chez tous les patients.
Les études cliniques menées avec des comprimés buccogingivaux de fentanyl ayant eu pour but d'évaluer la sécurité et l’efficacité du produit dans le traitement des accès douloureux paroxystiques, les patients inclus ont reçu en même temps d'autres morphiniques (morphine à libération prolongée ou fentanyl par voie transdermique) pour traiter leurs douleurs chroniques.
Par conséquent, il n'est pas possible d'isoler avec certitude les effets indésirables dus au seul traitement par des comprimés buccogingivaux de fentanyl.
Liste tabulée des effets indésirables
Les effets indésirables suivants ont été rapportés avec des comprimés buccogingivaux de fentanyl et/ou d’autres médicaments contenant du fentanyl, durant les essais cliniques ou en post-marketing. Les effets indésirables sont répertoriés ci-dessous selon la classification MedDRA par classe d’organe et par fréquence (les fréquences sont définies comme suit : très fréquent ≥ 1/10, fréquent ≥ 1/100, < 1/10, peu fréquent ≥ 1/1 000, < 1/100, rare ≥ 1/10 000, < 1/1 000, fréquence indéterminée (ne peut être estimée sur la base des données disponibles) ; au sein de chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité :
|
|
Très fréquent (≥ 1/10) |
Fréquent (≥ 1/100, < 1/10) |
Peu fréquent (≥ 1/ 1 000, < 1/100) |
Rare (≥ 1/10 000, < 1/1 000) |
Fréquence indéterminée (ne peut pas être estimée sur la base des données disponibles |
|
Infections et infestations |
|
Candidose orale |
Pharyngite |
Pustule buccale |
|
|
Affections hématologiques et du système lymphatique |
|
Anémie Neutropénie |
Thrombocytopénie |
|
|
|
Affections du système immunitaire |
|
|
|
Hypersensibilité* |
|
|
Troubles endocriniens |
|
|
|
Hypogonadisme |
Insuffisance surrénalienne, Hypoandrogénie |
|
Troubles métaboliques et nutritionnels |
|
Anorexie |
|
|
|
|
Affections psychiatriques |
|
Dépression, Anxiété, Syndrome confusionnel, Insomnie |
Humeur euphorique, Nervosité, Hallucination, Hallucination visuelle, Changements de l’état mental, Désorientation |
|
Pharmacodépendance (addiction)*, Utilisation abusive (voir rubrique 4.4), Délire |
|
Affections du système nerveux |
Etat vertigineux, Maux de tête |
Dysgueusie, Somnolence, Léthargie, Tremblement, Sédation, Hypoesthésie, Migraine |
Diminution du niveau de conscience, Trouble de l’attention, Trouble de l’équilibre, Dysarthrie |
Troubles cognitifs, Dysfonctionnements moteurs |
Perte de la conscience*, Convulsions |
|
Affections oculaires |
|
|
Trouble de la vision, Hyperémie oculaire, Vision trouble, Diminution de l’acuité visuelle |
Sensations oculaires anormales, Photopsie |
|
|
Affections de l’oreille et du labyrinthe |
|
|
Vertiges, Acouphènes, Inconfort auditif |
|
|
|
Troubles cardiaques |
|
Tachycardie |
Bradycardie |
|
|
|
Affections vasculaires |
|
Hypotension, Hypertension |
Bouffée vasomotrice, Bouffée de chaleur |
|
|
|
Affections respiratoires, thoraciques et médiastinales |
|
Dyspnée, Douleur pharyngolaryngée |
Dépression respiratoire, Syndrome d’apnée du sommeil |
|
Arrêt respiratoire* |
|
Affections gastro- intestinales |
Nausée, Vomissement |
Constipation, Stomatite, Sécheresse buccale, Diarrhée, Douleur abdominale, Reflux gastro- œsophagien, Inconfort gastrique, Dyspepsie, Douleur dentaire |
Iléus, Ulcération buccale, Hypoesthésie orale, Inconfort oral, Décoloration de la muqueuse buccale, Troubles des tissus mous, Glossodynie, Bulles au niveau de la langue, Douleur gingivale, Ulcération de la langue, Trouble au niveau de la langue, Œsophagite, Lèvres gercées, Trouble dentaire |
Bulles au niveau de la muqueuse buccale, Sécheresse labiale |
|
|
Affections hépatobiliaires |
|
|
Dilatation des voies biliaires |
|
|
|
Affections de la peau et du tissu sous-cutané |
|
Prurit, Hyperhidrose, Eruption cutanée |
Sueurs froides, Œdème facial, Prurit généralisé, Alopécie |
Onychorrhexis |
|
|
Affections musculo- squelettiques et systémiques |
|
Myalgie, Douleur dorsale |
Contractions Musculaires, Faiblesse musculaire |
|
|
|
Affections du rein et des voies urinaires |
|
|
Rétention urinaire |
|
|
|
Troubles généraux et anomalies au site d’administration |
Réactions au site d’administration y compris saignements, Douleur, Ulcère, Irritation, Paresthésie, Anesthésie, Erythème, Œdème, Gonflement et vésicules |
Œdème périphérique, Fatigue, Asthénie, Syndrome de sevrage*, Frissons |
Malaise, Sensation de faiblesse, Inconfort thoracique, Sensation de ne pas être dans un état normal, Sensation de nervosité, Soif, Sensation de froid, Sensation de chaud |
|
Pyrexie, Syndrome de sevrage néonatal (voir rubrique 4.6), Tolérance au médicament |
|
Investigations |
|
Perte de poids |
Diminution du nombre de plaquettes, Augmentation de la fréquence cardiaque, Diminution de l'hématocrite, Diminution du taux d’hémoglobine |
|
|
|
Lésions, intoxications et complications liées aux procédures |
|
Chute |
|
|
|
|
* Voir la rubrique « Description des effets indésirables sélectionnés » |
|||||
Description des effets indésirables sélectionnés
Tolérance
La tolérance peut se développer lors d’une utilisation répétée.
Pharmacodépendance
L’utilisation répétée de FENTANYL ARROW peut entraîner une dépendance aux médicaments (pharmacodépendance), même à des doses thérapeutiques. Le risque de pharmacodépendance aux médicaments peut varier selon les facteurs de risque propres au patient, la posologie et la durée du traitement par opioïdes (voir rubrique 4.4). Des symptômes de sevrage morphinique tels que nausées, vomissements, diarrhée, anxiété, frissons, tremblements et sudation ont été observés lors de l’utilisation de fentanyl par voie transmuqueuse.
En cas de surdosage, il a été observé une perte de conscience et un arrêt respiratoire (voir rubrique 4.9).
Des réactions d’hypersensibilité ont été rapportées après commercialisation, dont des éruptions cutanées, des érythèmes, des gonflements des lèvres et du visage et de l’urticaire (voir rubrique 4.4).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
Symptômes
Les symptômes attendus en cas de surdosage par fentanyl sont de même nature que ceux observés après l'administration intraveineuse de fentanyl ou d'autres morphiniques, et résultent de son action pharmacologique. Les effets indésirables les plus graves sont l’altération des facultés mentales, la perte de conscience, le coma, l’hypotension, la dépression respiratoire, la détresse respiratoire et l’insuffisance respiratoire pouvant entraîner la mort.
Des cas de respiration de Cheyne-Stokes ont été constatés en cas de surdosage en fentanyl, en particulier chez les patients ayant des antécédents d’insuffisance cardiaque.
Une leucoencéphalopathie toxique a également été observée lors d’un surdosage en fentanyl.
Prise en charge
Les mesures à prendre immédiatement en cas de surdosage morphinique consistent à retirer immédiatement le comprimé buccogingival de la bouche du patient s’il s'y trouve encore, s’assurer de la perméabilité des voies respiratoires, effectuer des stimulations physiques et verbales du patient et déterminer son niveau de conscience ainsi que son état ventilatoire et circulatoire et instaurer si nécessaire une ventilation assistée (assistance respiratoire).
Surdosage (ingestion accidentelle) chez une personne n’ayant jamais reçu de traitement morphinique
Le traitement du surdosage chez une personne qui n'a jamais reçu de traitement morphinique (ingestion accidentelle), nécessite de mettre en place une voie d'abord veineuse et administrer de la naloxone ou un autre antagoniste des morphiniques, selon l'état clinique. La durée de la dépression respiratoire due au surdosage peut être plus longue que les effets de l'antagoniste morphinique (ex. la demi-vie de la naloxone est comprise entre 30 et 81 minutes) et il peut donc être nécessaire de répéter l'administration de l'antidote. Pour plus de détails sur le mode d'emploi de l'antagoniste morphinique utilisé, se référer au résumé des caractéristiques du produit en question.
Surdosage chez les patients recevant un traitement d’entretien morphinique
Chez les patients recevant un traitement morphinique bien toléré, mettre en place une voie d'abord veineuse. Dans certains cas, l'utilisation judicieuse de naloxone ou d'autres antagonistes des morphiniques peut être justifiée, mais elle est associée à un risque de déclenchement d'un syndrome de sevrage aigu.
Bien qu'il n'ait jamais été décrit de rigidité musculaire associée à la dépression respiratoire après administration de comprimés buccogingivaux de de fentanyl, un tel phénomène est possible avec le fentanyl ou d'autres morphiniques. Si une telle rigidité musculaire apparaît, il faudra instaurer une ventilation assistée, administrer un antagoniste des morphiniques et, en dernier recours, un curarisant.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : analgésiques, opioïdes, code ATC : N02AB03.
Mécanisme d’action et effets pharmacodynamiques
Le fentanyl, agoniste morphinomimétique pur, agit essentiellement sur le récepteur morphinique µ. Ses effets thérapeutiques principaux sont l’analgésie et la sédation. Les effets pharmacologiques secondaires sont la dépression respiratoire, la bradycardie, l’hypothermie, la constipation, le myosis, la dépendance physique et l’euphorie.
Les effets analgésiques du fentanyl sont liés à ses concentrations plasmatiques. En règle générale, les concentrations efficace et toxique augmentent parallèlement à l’augmentation de la tolérance aux morphiniques. Il existe une grande variation interindividuelle du taux de développement d’une tolérance morphinique. Par conséquent, la titration de la dose de comprimés buccogingivaux de fentanyl permettant d’obtenir l’effet recherché doit être réalisée pour chaque patient (voir rubrique 4.2).
Tous les agonistes des récepteurs morphiniques µ, y compris le fentanyl, induisent une dépression respiratoire dose-dépendante. Le risque de dépression respiratoire est moindre chez les patients qui reçoivent un traitement morphinique de fond, car ces patients développent une tolérance à la dépression respiratoire.
Les opioïdes peuvent influer sur l’axe hypothalamo-hypophyso-surrénalien ou sur l’axe hypothalamo- hypophyso-gonadique. Les modifications pouvant être observées comprennent notamment une augmentation de la prolactine sérique et des diminutions du cortisol plasmatique et de la testostérone. Ces modifications hormonales peuvent se manifester par des signes et symptômes cliniques (voir également rubrique 4.8).
Efficacité et sécurité clinique
La sécurité et l’efficacité des comprimés buccogingivaux de fentanyl ont été évaluées chez les patients prenant le médicament à l’apparition de l’accès douloureux paroxystique. L’utilisation préventive des comprimés buccogingivaux de fentanyl dans les épisodes douloureux prévisibles n’a pas été étudiée dans les études cliniques. Deux études cliniques croisées, randomisées, en double insu, ont été menées sur un total de 248 patients cancéreux présentant en moyenne 1 à 4 accès douloureux paroxystique(s) quotidien(s) alors qu’ils recevaient un traitement de fond morphinique. La détermination de la dose efficace en comprimés buccogingivaux de fentanyl a été réalisée lors d’une phase initiale de titration en ouvert. Les patients pour lesquels une dose efficace était établie participaient à la phase en double insu de l’étude. Le critère principal d’efficacité était l’évaluation de l’intensité de la douleur par le patient. Les patients ont évalué l’intensité de la douleur selon une échelle de 11 points. A chaque accès douloureux paroxystique, l’intensité de la douleur était évaluée avant et à différents points dans le temps après le traitement.
La titration d’une dose efficace a été possible chez 67 % des patients.
Dans l’étude clinique pivotale (étude 1), le critère principal d’évaluation a été la somme moyenne des différences des scores d’intensité douloureuse évaluée de la prise du traitement jusqu’à 60 minutes compris (SPID60). Cette valeur a été statistiquement significative par rapport au placebo (p < 0,0001).
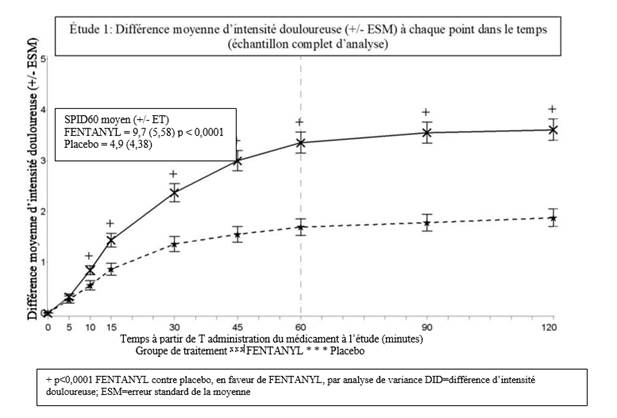
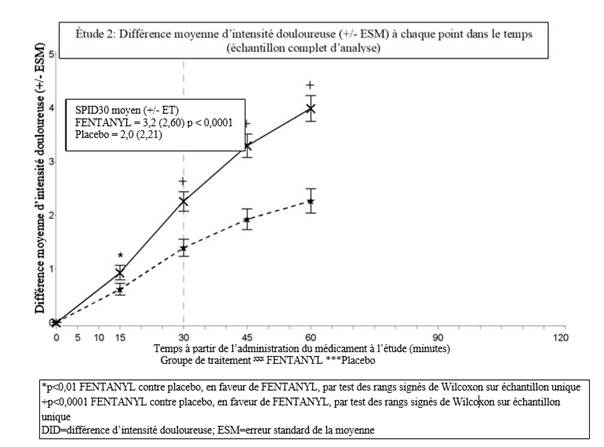
Dans la seconde étude pivotale (étude 2), le critère principal d’évaluation était SPID30. Cette valeur a également été statistiquement significative par rapport au placebo (p < 0,0001).
Le soulagement des accès douloureux paroxystiques induit par les comprimés buccogingivaux de fentanyl a été significativement supérieur à celui du placebo dès 10 minutes dans l’étude 1 et dès 15 minutes (évaluation la plus précoce) dans l’étude 2. Ces différences ont continué à être statistiquement significatives à chaque point dans le temps et dans chacune des deux études.
5.2. Propriétés pharmacocinétiques
Généralités
Le temps de présence du comprimé (défini comme étant la période de temps de désagrégation totale du comprimé après administration orale) ne semble pas avoir d’influence sur l’exposition systémique précoce au fentanyl. Une étude comparative entre un comprimé buccogingival de fentanyl à 400 mcg administré soit par voie buccale (par exemple, entre la joue et la gencive) soit par voie sublinguale, a montré la bioéquivalence de ces deux voies d’administration.
L’effet d’une insuffisance rénale ou hépatique sur la pharmacocinétique des comprimés buccogingivaux de fentanyl n’a pas été étudié.
Absorption
Après administration par voie buccale transmuqueuse de comprimés buccogingivaux de fentanyl, le fentanyl est rapidement absorbé avec une biodisponibilité absolue de 65 %. Le profil d’absorption des comprimés buccogingivaux de fentanyl résulte largement d’une absorption initiale rapide à partir de la muqueuse buccale. Les prélèvements sanguins montrent que les concentrations plasmatiques maximales sont obtenues dans l’heure qui suit l’administration par voie buccale transmuqueuse. Environ 50 % de la dose totale administrée est rapidement absorbée par la voie transmuqueuse et devient disponible sur le plan systémique. Les 50 % restants de la dose totale sont ingérés et lentement absorbés à partir du tractus gastro-intestinal. Environ 30 % de la fraction ingérée (50 % de la dose totale) échappent à l'élimination lors du premier passage hépatique et intestinal et devient disponible sur le plan systémique.
Le tableau ci-dessous illustre les principaux paramètres pharmacocinétiques.
Paramètres pharmacocinétiques* chez les sujets adultes recevant du fentanyl en comprimé buccogingival
|
Paramètre pharmacocinétique |
Fentanyl en comprimé buccogingival 400 microgrammes |
|
Biodisponibilité absolue |
65 % (± 20 %) |
|
Fraction absorbée par voie transmuqueuse |
48 % (± 31,8 %) |
|
Tmax(minute) ** |
46,8 (20-240) |
|
Cmax(ng/mL) |
1,02 (± 0,42) |
|
ASC0-tmax(ng.hr/mL) |
0,40 (± 0,18) |
|
ASC0-inf (ng.hr/mL) |
6,48 (± 2,98) |
*sur la base des échantillons sanguins veineux (plasma). Les concentrations du fentanyl obtenues dans le sérum étaient supérieures à celles du plasma. L’ASC et la Cmax ont été respectivement d’environ 20 % à 30 % supérieures à l’ASC et à la Cmax du plasma. La raison de cette différence n’est pas connue.
** Valeurs médianes de Tmax (valeurs extrêmes).
Lors d’études de pharmacocinétique comparant la biodisponibilité absolue et relative des comprimés buccogingivaux de fentanyl à celle du citrate de fentanyl par voie buccale transmuqueuse (OTFC), le taux et la fraction d’absorption du fentanyl en comprimé buccogingival se sont avérés avoir une exposition 30 % à 50 % supérieure à celle du citrate de fentanyl par voie buccale transmuqueuse. Chez les patients passant d’une autre forme orale de citrate de fentanyl aux comprimés buccogingivaux, la titration de la dose des comprimés buccogingivaux de fentanyl doit être réalisée indépendamment étant donné que la biodisponibilité entre les produits diffère significativement. Néanmoins, chez ces patients, une dose initiale supérieure à 100 microgrammes peut être envisagée.
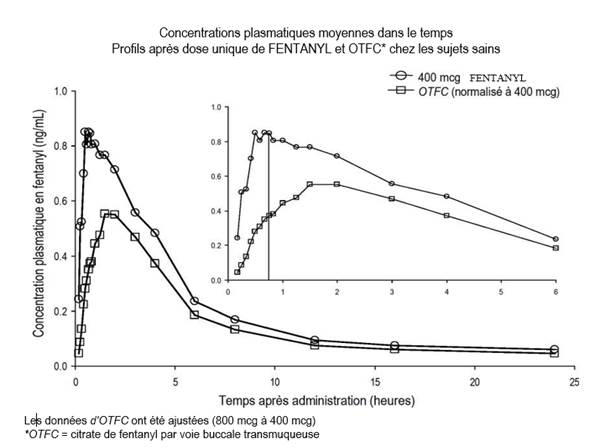
Des différences d’exposition aux comprimés buccogingivaux de fentanyl ont été observées au cours d’une étude clinique chez des patients atteints de mucite de grade 1. La Cmaxet l’ASC0-8 ont été respectivement 1 % et 25 % plus élevées chez les patients atteints de mucite par rapport à ceux qui n’étaient pas atteints. Les différences observées n’étaient pas cliniquement significatives.
Distribution
Le fentanyl est une substance fortement lipophile qui présente une bonne distribution extravasculaire et un volume apparent de distribution élevé. Après administration buccale de comprimés buccogingivaux de fentanyl, le fentanyl subit une distribution initiale rapide qui représente une équilibration du fentanyl entre le plasma et les tissus fortement vascularisés (cerveau, cœur et poumons). Par la suite, le fentanyl est redistribué entre le compartiment tissulaire profond (tissus musculaires et adipeux) et le plasma.
Le taux de liaison du fentanyl aux protéines plasmatiques est de 80 à 85 %. La principale protéine de liaison est l'alpha-1 glycoprotéine acide mais l'albumine et les lipoprotéines sont également impliquées, dans une certaine mesure. L'acidose augmente la fraction libre de fentanyl.
Métabolisme
Les voies métaboliques empruntées par les comprimés gingivaux de fentanyl après administration buccale n’ont pas été déterminées lors des études cliniques. Le fentanyl est métabolisé en norfentanyl dans le foie et la muqueuse intestinale sous l'effet de l'isoenzyme 3A4 du cytochrome P450. Lors des expérimentations animales, le norfentanyl n'a pas montré d'effet pharmacologique. Plus de 90 % de la dose de fentanyl administrée sont éliminés par biotransformation en métabolites N-désalkylés et hydroxylés inactifs.
Élimination
Après administration intraveineuse de fentanyl, moins de 7 % de la dose administrée est excrétée sous forme inchangée dans les urines et seul 1 % environ est excrété sous forme inchangée dans les selles. Les métabolites sont essentiellement excrétés par voie urinaire, l'excrétion fécale étant moins importante.
Après administration de comprimés gingivaux de fentanyl, la phase terminale d’élimination du fentanyl résulte de la redistribution entre le plasma et un compartiment tissulaire profond. Cette phase d’élimination est lente et résulte en une demi-vie d’élimination terminale médiane t1/2 d’environ 22 heures après administration buccale de la forme effervescente et d’environ 18 heures après administration intraveineuse. La clairance plasmatique totale de fentanyl après administration intraveineuse est d’environ 42 L/h.
Linéarité/non-linéarité
Pour la gamme de dosages disponibles (100 à 1 000 microgrammes), les paramètres pharmacocinétiques du fentanyl sont dose-proportionnels.
5.3. Données de sécurité préclinique
Les études de toxicité sur le développement embryo-fœtal conduites chez le rat et le lapin n’ont révélé aucune malformation ou modification du développement lorsque le traitement était administré pendant la période d'organogenèse.
Dans une étude de fertilité et de développement embryonnaire précoce chez le rat, un effet médié par les mâles a été observé à forte dose (300 mcg/kg/jour, voie sous-cutanée) qui est considéré comme secondaire aux effets sédatifs du fentanyl dans les études animales.
Dans les études de développement pré et post-natal chez le rat, le taux de survie de la descendance était significativement réduit à des doses entraînant une toxicité maternelle sévère. Les effets des doses toxiques maternelles sur la première génération sont : un retard du développement physique, des fonctions sensorielles, du reflexe et du comportement. Ces effets peuvent être des effets indirects de négligence maternelle et/ ou de diminution de l’allaitement ou un effet direct du fentanyl.
Les études de cancérogenèse (test alternatif par voie cutanée chez la souris transgénique Tg.AC durant 26 semaines, étude de cancérogénèse par voie sous-cutanée chez le rat durant deux ans) avec le fentanyl n’ont pas révélé de résultats suggérant un potentiel oncogène. L’analyse de coupes de cerveau provenant de l’étude de cancérogenèse réalisée chez le rat a montré des lésions cérébrales chez les animaux ayant reçu des doses élevées de citrate de fentanyl. La pertinence clinique de ces résultats n’est pas connue.
Mannitol, sorbitol, acide citrique, macrogol, L-arginine, stéarate de magnésium.
2 ans.
6.4. Précautions particulières de conservation
6.5. Nature et contenu de l'emballage extérieur
Plaquette laminée d’aluminium [PVC/aluminium/polyamide/PVC] avec une feuille de couverture [papier/polyester].
Les plaquettes sont disponibles en boîtes de 4 ou 28 comprimés.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
26 AVENUE TONY GARNIER
69007 LYON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 890 8 5 : 4 comprimés sous plaquettes (PVC/Aluminium/Polyamide/PVC)
· 34009 301 890 9 2 : 28 comprimés sous plaquettes (PVC/Aluminium/Polyamide/PVC)
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Prescription limitée à 28 jours.
Délivrance fractionnée de 7 jours maximum, sauf mention expresse du prescripteur « délivrance en une fois ».
Prescription sur ordonnance répondant aux spécifications fixées par l'arrêté du 31 mars 1999.
ANSM - Mis à jour le : 19/06/2024
FENTANYL ARROW 400 microgrammes, comprimé buccogingival
Fentanyl
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que FENTANYL ARROW 400 microgrammes, comprimé buccogingival et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre FENTANYL ARROW 400 microgrammes, comprimé buccogingival ?
3. Comment prendre FENTANYL ARROW 400 microgrammes, comprimé buccogingival ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver FENTANYL ARROW 400 microgrammes, comprimé buccogingival ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE FENTANYL ARROW 400 microgrammes, comprimé buccogingival ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : analgésiques, opioïdes - code ATC : N02AB03
La substance active de FENTANYL ARROW est le citrate de fentanyl. Le fentanyl est un médicament antalgique, également connu sous le nom de morphinique. Il est utilisé pour traiter l’accès douloureux paroxystique chez les patients adultes atteints d’un cancer et prenant déjà d’autres antalgiques de type morphinique pour le traitement des douleurs persistantes (permanentes) d’origine cancéreuse.
L’accès douloureux paroxystique est une douleur supplémentaire qui survient brutalement en dépit de la prise des autres antalgiques habituels de type morphinique.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE FENTANYL ARROW 400 microgrammes, comprimé buccogingival ?
Ne prenez pas FENTANYL ARROW 400 microgrammes, comprimé buccogingival :
· si vous ne prenez pas régulièrement des médicaments de type opioïde sous ordonnance (par exemple codéine, fentanyl, hydromorphone, morphine, oxycodone, péthidine) tous les jours à intervalles réguliers depuis au moins une semaine pour contrôler votre douleur persistante. Si vous ne prenez pas ces médicaments, vous ne devez pas utiliser FENTANYL ARROW car cela peut augmenter le risque que votre respiration devienne dangereusement lente et/ou superficielle, voire qu’elle s’arrête ;
· si vous êtes allergique au fentanyl ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6 ;
· si vous prenez un médicament qui contient de l’oxybate de sodium ;
· si vous souffrez de graves problèmes respiratoires ou d’un syndrome respiratoire obstructif sévère ;
· si vous souffrez de douleurs de courte durée autres que des accès douloureux paroxystiques.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant de prendre FENTANYL ARROW 400 microgrammes, comprimé buccogingival.
Au cours de votre traitement par FENTANYL ARROW, continuez à utiliser l'antalgique morphinique que vous prenez pour vos douleurs persistantes (permanentes) dues au cancer.
Pendant votre traitement par FENTANYL ARROW, n’utilisez pas d’autres traitements contenant du fentanyl précédemment prescrits pour soulager vos douleurs paroxystiques. Si vous avez encore certains de ces traitements chez vous, contactez votre pharmacien pour vérifier comment les éliminer.
Conservez ce médicament dans un endroit sûr et sécurisé, où d’autres personnes n’y ont pas accès (voir rubrique 5 « Comment conserver FENTANYL ARROW 400 microgrammes, comprimé buccogingival ? » pour plus d’informations). AVANT d’utiliser FENTANYL ARROW, informez votre médecin ou votre pharmacien si :
· la posologie de votre autre antalgique de type morphinique pris pour traiter vos douleurs persistantes (permanentes) d’origine cancéreuse n’est pas encore stabilisée ;
· vous êtes atteint d’une affection ayant un effet sur votre respiration (par exemple asthme, respiration sifflante, ou dyspnée) ;
· vous présentez un traumatisme crânien ;
· votre rythme cardiaque est inhabituellement lent ou vous présentez d’autres problèmes cardiaques ;
· vous avez des problèmes au foie ou aux reins, car ces organes ont un effet sur la manière dont votre organisme dégrade le médicament ;
· vous avez un volume sanguin bas ou une tension artérielle basse ;
· vous êtes âgé(e) de plus de 65 ans – vous pourriez devoir prendre une dose plus faible et toute augmentation de dose serait soigneusement contrôlée par votre médecin ;
· vous avez des problèmes cardiaques, notamment une fréquence cardiaque lente ;
· vous prenez des benzodiazépines (voir rubrique 2 « Autres médicaments et FENTANYL ARROW 400 microgrammes, comprimé buccogingival »). L’utilisation de benzodiazépines peut augmenter le risque d’effets indésirables graves, y compris le décès ;
· vous prenez des antidépresseurs ou des neuroleptiques (inhibiteurs sélectifs de la recapture de la sérotonine [ISRS], inhibiteurs de la monoamine oxydase [IMAO], voir « Ne prenez pas FENTANYL ARROW 400 microgrammes, comprimé buccogingival » et « Autres médicaments et FENTANYL ARROW 400 microgrammes, comprimé buccogingival » dans la rubrique 2). L’utilisation de ces médicaments avec FENTANYL ARROW peut entraîner un syndrome sérotoninergique, une affection potentiellement mortelle (voir « Autres médicaments et FENTANYL ARROW 400 microgrammes, comprimé buccogingival » dans la rubrique 2) ;
· vous avez déjà présenté une insuffisance surrénalienne, une affection au cours de laquelle les glandes surrénaliennes ne produisent pas suffisamment d’hormones, ou un manque d’hormones sexuelles (carence en androgènes) lors de l’utilisation d’opioïdes (voir les « Effets indésirables graves » dans la rubrique 4) ;
· vous avez déjà utilisé de manière abusive ou été dépendant(e) d’opioïdes ou de tout autre médicament, alcool ou drogue illicite ;
· vous consommez de l’alcool (veuillez consulter la rubrique « FENTANYL ARROW 400 microgrammes, comprimé buccogingival avec des aliments, boissons et de l’alcool »).
Consultez votre médecin PENDANT votre traitement par FENTANYL ARROW si :
· vous ressentez une douleur ou une sensibilité accrue à la douleur (hyperalgésie) qui ne répond pas à une augmentation de la dose du médicament prescrite par votre médecin ;
· vous présentez une association des symptômes suivants : nausées, vomissements, anorexie, fatigue, faiblesse, sensations vertigineuses et pression artérielle basse. Ensemble, ces symptômes peuvent être le signe d’une maladie pouvant engager le pronostic vital appelée insuffisance surrénalienne, dans laquelle les glandes surrénaliennes ne produisent pas suffisamment d’hormones ;
· troubles respiratoires liés au sommeil : FENTANYL ARROW peut provoquer des troubles respiratoires liés au sommeil, tels qu’une apnée du sommeil (interruption de la respiration pendant le sommeil) et une hypoxémie liée au sommeil (faible taux d’oxygène dans le sang). Les symptômes associés comprennent des arrêts de la respiration pendant le sommeil, des réveils nocturnes dus à un essoufflement, des difficultés à rester endormi ou une somnolence excessive pendant la journée. Si vous ou une personne de votre entourage remarquez ces symptômes, contactez votre médecin. Une réduction de la dose pourra être envisagée par votre médecin.
Utilisation au long cours et tolérance
Ce médicament contient du fentanyl, qui est un médicament opioïde. L’utilisation répétée d’analgésiques opioïdes peut entraîner une diminution de l’efficacité du médicament (vous vous y habituez, ce que l’on appelle la tolérance aux médicaments). Vous pouvez également devenir plus sensible à la douleur lors de l’utilisation de FENTANYL ARROW. C’est ce que l’on appelle l’hyperalgésie. L’augmentation de la dose de FENTANYL ARROW peut vous aider à réduire davantage vos douleurs pendant un certain temps, mais elle peut également être nocive. Si vous remarquez que votre médicament devient moins efficace, parlez-en à votre médecin. Votre médecin décidera s’il est préférable pour vous d’augmenter la dose ou de diminuer progressivement votre utilisation de FENTANYL ARROW.
Dépendance et addiction
L’utilisation répétée de FENTANYL ARROW peut également entraîner une dépendance, un abus et une addiction, qui peuvent aboutir à un surdosage mettant la vie en danger. Le risque de ces effets indésirables peut augmenter avec une dose plus élevée et une durée d’utilisation plus longue. La dépendance ou l’addiction peut vous donner l’impression que vous ne contrôlez plus la quantité de médicament que vous devez utiliser ou la fréquence à laquelle vous devez l’utiliser. Vous pouvez avoir l’impression que vous devez continuer à prendre votre médicament, même s’il ne vous aide pas à soulager votre douleur.
Le risque de développer une dépendance ou une addiction varie d’une personne à l’autre. Vous pouvez présenter un risque plus élevé de développer une dépendance ou une addiction à FENTANYL ARROW si :
· vous ou un membre de votre famille avez déjà consommé de façon abusive ou été dépendant(e) de l’alcool, à des médicaments prescrits sur ordonnance ou à des substances illicites (« addiction ») ;
· vous fumez ;
· vous avez déjà présenté des troubles de l’humeur (dépression, anxiété ou trouble de la personnalité) ou avez été traité(e) par un psychiatre pour d’autres maladies mentales.
Si vous remarquez l’un des signes suivants lors de l’utilisation de FENTANYL ARROW, il pourrait s’agir d’un signe que vous avez développé une dépendance ou une addiction :
· vous avez besoin d’utiliser le médicament pendant une durée plus longue que celle indiquée par votre médecin ;
· vous avez besoin d’utiliser une dose supérieure à la dose recommandée ;
· vous utilisez le médicament pour des raisons autres que celles qui vous ont été prescrites, par exemple « pour rester calme » ou « pour vous aider à dormir » ;
· vous avez tenté à plusieurs reprises et sans succès d’arrêter d’utiliser le médicament ou de contrôler son utilisation ;
· lorsque vous arrêtez de prendre le médicament, vous vous sentez mal (par exemple, nausées, vomissements, diarrhées, anxiété, frissons, tremblements et transpiration), et vous vous sentez mieux lorsque vous reprenez le médicament (« effets de sevrage »).
Si vous remarquez l’un de ces signes, parlez-en à votre médecin pour discuter de la meilleure voie de traitement pour vous, y compris le moment opportun pour arrêter et la façon d’arrêter en toute sécurité.
Consultez IMMÉDIATEMENT un médecin si :
· vous présentez des symptômes tels que des difficultés respiratoires ou des étourdissements, un gonflement de la langue, des lèvres ou de la gorge pendant votre traitement par FENTANYL ARROW. Il pourrait s’agir des premiers symptômes d’une grave réaction allergique (anaphylaxie, hypersensibilité ; voir « Effets indésirables graves » dans la rubrique 4).
Que faire en cas d’ingestion accidentelle de FENTANYL ARROW par une personne
Si vous pensez qu’une personne a accidentellement ingéré un comprimé de FENTANYL ARROW, contactez immédiatement un médecin. Essayez de garder la personne éveillée jusqu’à l’arrivée des secours.
Si une personne a accidentellement ingéré FENTANYL ARROW, elle peut présenter les mêmes effets indésirables que ceux décrits à la rubrique 3 intitulée « Si vous avez pris plus de FENTANYL ARROW, comprimé buccogingival que vous n’auriez dû ».
Enfants et adolescents
Ne donnez pas ce médicament aux enfants et adolescents âgés de moins de 18 ans.
Autres médicaments et FENTANYL ARROW 400 microgrammes, comprimé buccogingival
Avant de débuter un traitement par FENTANYL ARROW, informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre l’un des médicaments suivants :
· l’utilisation concomitante de fentanyl et de sédatifs, tels que des benzodiazépines ou des médicaments apparentés, augmente le risque d’étourdissements, de difficultés respiratoires (dépression respiratoire), de coma et peut menacer le pronostic vital. Compte tenu de ces risques, l’utilisation concomitante ne doit être envisagée que lorsque les autres options de traitement ne sont pas possibles. Toutefois, si votre médecin vous prescrit du fentanyl avec des sédatifs, il devra limiter la dose et la durée du traitement concomitant. Veuillez avertir votre médecin de tous les sédatifs que vous prenez (tels que des somnifères, des médicaments contre l’anxiété, certains médicaments pour traiter les réactions allergiques [antihistaminiques] ou des tranquillisants) et respecter scrupuleusement les recommandations de votre médecin. Il pourrait être utile de demander à vos amis et à votre famille d’être attentifs aux signes et symptômes décrits ci-dessus. Contactez votre médecin si vous présentez de tels symptômes ;
· l’utilisation concomitante de fentanyl avec des médicaments contenant de l’oxybate de sodium est contre-indiquée (voir « Ne prenez pas FENTANYL ARROW 400 microgrammes, comprimé buccogingival »). Le traitement par l’oxybate de sodium doit être arrêté avant de débuter le traitement avec FENTANYL ARROW ;
· certains relaxants musculaires, tels que le baclofène, le diazépam (voir également la rubrique « Avertissements et précautions ») ;
· tout médicament qui pourrait avoir un effet sur la manière dont votre organisme dégrade le fentanyl, tel que le ritonavir, le nelfinavir, l’amprénavir, et le fosamprénavir (traitement de l’infection au VIH) ou d’autres médicaments appelés inhibiteurs du CYP3A4 tels que le kétoconazole, l’itraconazole ou le fluconazole (traitement des infections fongiques), la troléandomycine, la clarithromycine ou l’érythromycine (traitement des infections bactériennes), l’aprépitant (utilisé en cas de nausées sévères) ainsi que le diltiazem et le vérapamil (traitement de l’hypertension ou de maladies cardiaques) ;
· médicaments appelés inhibiteurs de la monoamine-oxydase (IMAO) (utilisés dans la dépression sévère) ou prise de ces traitements au cours des 2 dernières semaines ;
· un certain type de médicaments anti-douleur puissants, appelés agonistes/antagonistes partiels, par exemple : buprénorphine, nalbuphine et pentazocine (traitement de la douleur). Vous pourriez ressentir les symptômes d’un syndrome de sevrage (nausées, vomissements, diarrhée, anxiété, frissons, tremblements et transpiration) lors de l’utilisation de ces médicaments ;
· certains médicaments contre les douleurs neuropathiques (gabapentine et prégabaline) ;
· le risque d’effets indésirables augmente si vous prenez des médicaments tels que certains antidépresseurs ou neuroleptiques. FENTANYL ARROW peut interagir avec ces médicaments et il est possible que vous développiez des altérations de votre état mental (par exemple, agitation, hallucinations, coma) et d’autres effets tels qu’une température corporelle supérieure à 38°C, une augmentation de la fréquence cardiaque, une instabilité de la pression artérielle, une exagération des réflexes, une rigidité musculaire, un manque de coordination et/ou des symptômes gastro-intestinaux (par exemple, nausées, vomissements, diarrhée). Votre médecin vous dira si FENTANYL ARROW est approprié pour vous.
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
FENTANYL ARROW 400 microgrammes, comprimé buccogingival avec des aliments, boissons et de l’alcool
· Vous ne devez pas boire de jus de pamplemousse lorsque vous prenez FENTANYL ARROW car ceci peut influencer la manière dont votre organisme dégrade le fentanyl.
· Ne buvez pas d’alcool lorsque vous prenez FENTANYL ARROW. L’alcool peut augmenter le risque d’apparition d’effets indésirables graves pouvant être fatals.
Grossesse et allaitement
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant d’utiliser ce médicament.
Grossesse
FENTANYL ARROW ne doit pas être utilisé pendant la grossesse à moins d’en avoir parlé avec votre médecin. Si FENTANYL ARROW est utilisé de façon prolongée pendant la grossesse, il existe également un risque de survenue de symptômes de sevrage chez le nouveau-né pouvant engager le pronostic vital s’ils ne sont pas identifiés et traités par un médecin.
Vous ne devez pas utiliser FENTANYL ARROW lors de l’accouchement car le fentanyl peut entraîner une dépression respiratoire chez le nouveau-né.
Allaitement
Le fentanyl peut passer dans le lait maternel et entraîner des effets indésirables chez le nourrisson. N’utilisez pas FENTANYL ARROW si vous allaitez. Vous ne devriez pas commencer l'allaitement moins de 5 jours après la dernière dose de FENTANYL ARROW.
Conduite de véhicules et utilisation de machines
Discutez avec votre médecin afin de savoir s’il est sans danger pour vous de conduire un véhicule ou d’utiliser des machines après avoir pris FENTANYL ARROW. Ne conduisez pas de véhicules ou n’utilisez pas de machines si vous présentez l’un des symptômes suivants : somnolence, étourdissement, vision trouble ou double, difficulté à se concentrer. Il est important de savoir comment vous réagissez à FENTANYL ARROW avant de conduire un véhicule ou d’utiliser des machines.
FENTANYL ARROW 400 microgrammes, comprimé buccogingival contient du sorbitol
Chaque comprimé contient 67,1 mg de sorbitol.
3. COMMENT PRENDRE FENTANYL ARROW 400 microgrammes, comprimé buccogingival ?
Veillez à toujours prendre ce médicament en suivant exactement les indications de votre médecin. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
Dose et fréquence
Lorsque vous commencerez à prendre FENTANYL ARROW pour la première fois, votre médecin s’emploiera à trouver, avec vous, la dose qui vous soulagera de vos accès douloureux paroxystiques. Il est très important que vous preniez FENTANYL ARROW tel qu’indiqué par votre médecin. La dose initiale est de 100 microgrammes. Pendant la détermination de la dose adéquate, votre médecin peut vous permettre de prendre plus d’un comprimé par épisode. Si votre accès douloureux paroxystique n’est pas soulagé après 30 minutes, prenez 1 seul comprimé de plus de FENTANYL ARROW pendant la période de titration.
Une fois que la dose adéquate a été déterminée avec votre médecin, prenez en règle générale 1 comprimé pour un épisode d’accès douloureux paroxystique. Dans la suite du traitement, votre besoin pour traiter la douleur peut changer. De plus fortes doses pourraient être nécessaires. Si la douleur persiste après 30 minutes, prenez uniquement 1 comprimé de plus de FENTANYL ARROW pendant la période de réajustement de la dose.
Contactez votre médecin si votre dose adéquate de FENTANYL ARROW ne soulage pas votre accès douloureux paroxystique. Votre médecin décidera si votre dose a besoin d’être modifiée.
Attendez au moins 4 heures avant de traiter un autre accès douloureux paroxystique avec FENTANYL ARROW.
Vous devez signaler immédiatement à votre médecin si vous prenez FENTANYL ARROW plus de quatre fois par jour car un changement de votre schéma thérapeutique peut être nécessaire. Votre médecin pourrait modifier votre traitement pour les douleurs persistantes ; lorsque vos douleurs persistantes seront contrôlées, il sera peut-être nécessaire que votre médecin modifie la dose de FENTANYL ARROW que vous prenez. Si votre médecin pense que vous présentez une sensibilité à la douleur due à FENTANYL ARROW (une hyperalgésie), une réduction de votre dose de fentanyl sera peut-être envisagée (voir « Avertissements et précautions » dans la rubrique 2). Pour bénéficier d’un soulagement efficace, parlez avec votre médecin de votre douleur et de l’efficacité de FENTANYL ARROW, de sorte que la dose puisse être modifiée si nécessaire.
Vous ne devez pas changer les doses de FENTANYL ARROW ou de vos autres antalgiques par vous-même. Tout changement de dose doit être prescrit et contrôlé par votre médecin.
Si vous n’êtes pas sûr de la dose adéquate ou si vous avez des questions au sujet de la prise de ce médicament, vous devez contacter votre médecin.
Mode d’administration
Les comprimés buccogingivaux de FENTANYL ARROW se prennent par voie buccale transmuqueuse. Quand vous placez un comprimé dans votre bouche, il se dissout et le médicament est absorbé au travers de la muqueuse de la bouche, dans la circulation sanguine. Prendre le médicament de cette façon lui permet d’être absorbé rapidement pour soulager votre accès douloureux paroxystique.
Prise du médicament
· N’ouvrez la plaquette que lorsque vous êtes prêt à prendre le comprimé. Le comprimé doit être pris immédiatement après avoir été retiré de la plaquette.
· Détachez une des alvéoles de la plaquette en tirant selon les perforations.
· Pliez l’alvéole le long de la ligne indiquée sur la feuille de couverture.
· Détachez la feuille de couverture pour laisser apparaître le comprimé. NE PAS tenter de pousser le comprimé à travers la feuille de couverture car cela pourrait l’endommager.
· Retirez le comprimé de l’alvéole et placez immédiatement le comprimé entier près d’une molaire entre la gencive et la joue (voir illustration). Parfois, le médecin peut vous dire de placer le comprimé sous la langue à la place.
· Ne pas tenter d’écraser ou de couper le comprimé.
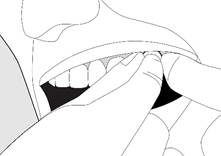
· Ne pas croquer, sucer, mâcher ou avaler le comprimé car cela entraînerait un soulagement moindre de la douleur par rapport à la méthode préconisée.
· Le comprimé doit être laissé en place entre la gencive et la joue jusqu’à dissolution complète, ce qui peut prendre jusqu’à 30 minutes.
· En cas d'irritation, vous pouvez changer l'emplacement du comprimé sur la gencive.
· S’il reste des morceaux de comprimé après 30 minutes, ils peuvent être avalés avec un verre d’eau.
· Les effets indésirables les plus fréquents sont la somnolence, la nausée ou les étourdissements. Si vous commencez à ressentir une forte sensation de vertige ou de somnolence avant la dissolution complète du comprimé, vous devez immédiatement rincer votre bouche avec de l’eau et recracher les morceaux restants du comprimé au lavabo ou aux toilettes.
· L’un des effets indésirables graves du fentanyl est une respiration lente et/ou superficielle. Cet effet peut se produire si votre dose de fentanyl est trop élevée ou si vous prenez trop de FENTANYL ARROW. Dans les cas sévères, la prise d’une quantité trop importante de FENTANYL ARROW peut également conduire à un coma. Si vous ressentez une forte sensation de vertige, une grande somnolence ou si votre respiration est lente ou superficielle, contactez immédiatement un médecin.
· Un surdosage peut également entraîner une affection du cerveau connue sous le nom de leucoencéphalopathie toxique.
Si vous oubliez de prendre FENTANYL ARROW 400 microgrammes, comprimé buccogingival
Si vous arrêtez de prendre FENTANYL ARROW 400 microgrammes, comprimé buccogingival
Vous devez arrêter la prise de FENTANYL ARROW une fois que vous n’avez plus d’accès douloureux paroxystiques. Vous devez toutefois continuer de prendre votre antalgique morphinique habituel pour traiter vos douleurs cancéreuses persistantes comme indiqué par votre médecin. À l’arrêt du traitement par FENTANYL ARROW, vous pourriez ressentir des symptômes de sevrage similaires aux effets indésirables éventuels du fentanyl. Si vous ressentez des symptômes de sevrage ou si vous avez des inquiétudes concernant le soulagement de vos douleurs, vous devez contacter votre médecin. Votre médecin déterminera si vous avez besoin de médicaments pour atténuer ou éliminer les symptômes de sevrage.
Si vous avez d'autres questions sur l’utilisation de ce médicament, demandez plus d'informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Effets indésirables graves
· Les effets indésirables les plus graves sont : respiration superficielle, tension artérielle basse et état de choc. FENTANYL ARROW, comme les autres médicaments contenant du fentanyl, peut provoquer de très graves problèmes respiratoires pouvant entraîner la mort. Si vous ressentez une somnolence importante ou que votre respiration est lente et/ou superficielle, vous ou votre soignant, devez contacter votre médecin et appeler les services médicaux d’urgence.
· Contactez immédiatement votre médecin si vous ressentez plusieurs des symptômes suivants :
o nausées, vomissements, anorexie, fatigue, faiblesse, sensations vertigineuses et tension artérielle basse
La présence conjointe de ces symptômes peut être le signe d’une affection pouvant engager le pronostic vital, appelée insuffisance surrénalienne, qui correspond à une incapacité des glandes surrénales à produire suffisamment d’hormones.
Autres effets indésirables
Très fréquents : pouvant toucher plus d’1 personne sur 10 :
· étourdissement, maux de tête ;
· sensations nauséeuses, vomissements ;
· au site d’application du comprimé : douleur, ulcère, irritation, saignements, engourdissement, perte de sensation, rougeur, gonflement ou taches.
Fréquents : pouvant toucher jusqu’à 1 personne sur 10 :
· sentiments d’anxiété ou de confusion, dépression, insomnie ;
· goût anormal, perte de poids ;
· somnolence, sédation, fatigue excessive, faiblesse, migraine, engourdissement, œdème des bras ou des jambes, syndrome de sevrage (pouvant se manifester par l’apparition d’effets indésirables tels que des nausées, des vomissements, une diarrhée, une anxiété, des frissons, des tremblements et une transpiration), tremblement, chutes, frissons ;
· constipation, inflammation de la bouche, sécheresse buccale, diarrhée, brûlures d'estomac, perte d'appétit, maux d'estomac, inconfort gastrique, indigestion, douleurs dentaires, mycose buccale ;
· démangeaison, transpiration excessive, éruption cutanée ;
· essoufflement, maux de gorge ;
· diminution des globules blancs dans le sang, diminution des globules rouges, diminution ou augmentation de la pression artérielle, fréquence cardiaque anormalement rapide ;
· douleurs musculaires, douleurs dorsales ;
· fatigue.
Peu fréquents : pouvant toucher jusqu’à 1 personne sur 100 :
· gorge douloureuse ;
· diminution de la quantité de cellules contribuant à la coagulation du sang ;
· sensations d’excitation, nervosité, état anormal, agitation ou lenteur ; voir ou entendre quelque chose qui n’existe pas (hallucinations), diminution de la conscience, changement dans l’état mental, dépendance (dépendance au médicament, toxicomanie), désorientation, manque de concentration, perte d’équilibre, vertige, problème d’élocution, acouphène, inconfort auditif ;
· perturbation de la vision ou vision trouble, œil rouge ;
· rythme cardiaque inhabituellement lent, sensation d’avoir très chaud (bouffées de chaleur) ;
· problèmes respiratoires importants, difficulté à respirer pendant le sommeil ;
· un ou plusieurs des problèmes suivants au niveau de la bouche : ulcère, perte de sensation, inconfort, couleur inhabituelle, trouble des tissus mous, trouble de la langue, langue douloureuse ou présentant des cloques ou des ulcérations, douleur gingivale, lèvres gercées, trouble dentaire ;
· inflammation de l’œsophage, paralysie de l'intestin, troubles de la vésicule biliaire ;
· sueurs froides, œdème facial, démangeaisons généralisées, alopécie, contractions musculaires, faiblesse musculaire, sensation de malaise, inconfort thoracique, soif, sensation de froid, sensation de chaud, difficulté à uriner ;
· malaise ;
· rougeur du visage et du cou.
Rares : pouvant toucher jusqu’à 1 personne sur 1 000 :
· perturbation de la pensée, troubles moteurs ;
· cloques dans la bouche, lèvres sèches, accumulation de pus sous la peau dans la bouche ;
· manque de testostérone, sensation de gêne oculaire, observation d’éclairs de lumière, ongles cassants ;
· réactions allergiques telles que des éruptions cutanées, des rougeurs, des gonflements des lèvres et du visage et de l’urticaire.
Fréquence indéterminée : ne peut être estimée sur la base des données disponibles :
· perte de conscience, arrêt respiratoire, convulsions (crises d’épilepsie) ;
· manque d’hormones sexuelles (carence en androgènes) ;
· pharmacodépendance (addiction) (voir rubrique 2) ;
· utilisation abusive (voir rubrique 2) ;
· tolérance au médicament (voir rubrique 2) ;
· délire (combinaison de symptômes pouvant inclure une agitation, une nervosité, une désorientation, une confusion, un sentiment de peur, voir ou entendre quelque chose qui n’existe pas, des troubles du sommeil, des cauchemars) ;
· un traitement de longue durée par le fentanyl pendant la grossesse peut provoquer des symptômes de sevrage chez le nouveau-né pouvant engager le pronostic vital (voir rubrique 2).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou à votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER FENTANYL ARROW 400 microgrammes, comprimé buccogingival ?
Conservez ce médicament dans un endroit sûr et sécurisé, où d’autres personnes ne peuvent pas y accéder. Il peut causer des dommages graves et être fatal pour les personnes qui peuvent prendre ce médicament par accident, ou intentionnellement alors qu’il ne leur a pas été prescrit.
L’antalgique contenu dans FENTANYL ARROW est très puissant et pourrait mettre en danger la vie d’un enfant en cas d’ingestion accidentelle. Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage après EXP. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température inférieure à 30°C. A conserver dans l'emballage d'origine, à l'abri de l’humidité.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient FENTANYL ARROW 400 microgrammes, comprimé buccogingival
· La substance active est le fentanyl.
Fentanyl (sous forme de citrate)..................................................................... 400 microgrammes
Pour un comprimé buccogingival
· Les autres composants sont : mannitol, sorbitol, acide citrique, macrogol, L-arginine, stéarate de magnésium.
Les comprimés buccogingivaux sont blancs, ronds, à bords biseautés, gravés « 4 » sur une face.
Chaque comprimé a un diamètre d’environ 10 mm.
Chaque plaquette contient 4 comprimés buccogingivaux présentés dans des boîtes de 4 ou 28 comprimés buccogingivaux.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
26 AVENUE TONY GARNIER
69007 LYON
Exploitant de l’autorisation de mise sur le marché
26 AVENUE TONY GARNIER
69007 LYON
BLUEPHARMA – INDUSTRIA FARMACEUTICA, S.A.
S. MARTINHO DO BISPO
3045-016 COIMBRA
PORTUGAL
OU
ARDENA PAMPLONA S.L.
POLIGONO MOCHOLI C/NOAIN, no. 1
31110 NOAIN (NAVARRA)
ESPAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).