Dernière mise à jour le 06/11/2025
KYLEENA 19,5 mg, système de diffusion intra-utérin
Indications thérapeutiques
KYLEENA est un système de diffusion intra-utérin en forme de T, également appelé stérilet hormonal. C’est un contraceptif : il permet d’éviter une grossesse pendant une durée maximale de cinq ans. KYLEENA contient une hormone appelée lévonorgestrel.
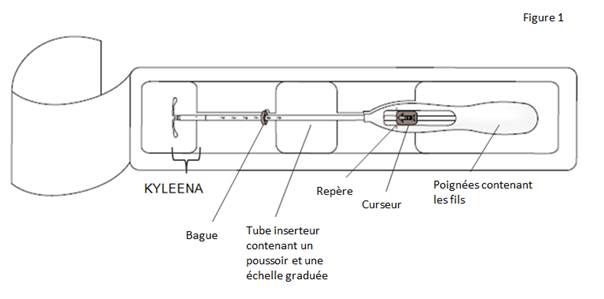
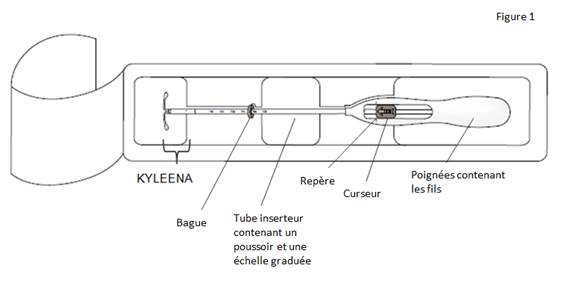
Figure 1 : Stérilet hormonal KYLEENA

Comment KYLEENA agit-il ?
Un professionnel de santé placera KYLEENA dans votre utérus. Une fois mis en place, il libère une petite quantité d’hormones de façon continue.
KYLEENA empêche les spermatozoïdes et les ovules d’entrer en contact, ce qui permet d’éviter une grossesse. Voici comment :
· Il épaissit le mucus au niveau du col de l’utérus. Cela empêche les spermatozoïdes de le traverser.
· Il permet à la muqueuse de l’utérus (l’endomètre) de rester fine.
Figure 2 : KYLEENA dans l’utérus

Présentations
> 1 plaquette(s) thermoformée(s) polytéréphtalate (PET) de 1 dispositif(s)
Code CIP : 34009 300 947 5 4
Déclaration de commercialisation : 28/03/2018
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 90,02 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 91,04 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 13/12/2017 | Inscription (CT) | Le service médical rendu par KYLEENA est important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 13/12/2017 | Inscription (CT) | Prenant en compte : • L’absence d’avantage démontré par rapport aux autres dispositifs intra-utérins en termes d’efficacité et de tolérance, • Le besoin médical couvert au regard des alternatives contraceptives existantes, La Commission considère que KYLEENA n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport aux comparateurs pertinents que sont MIRENA et JAYDESS. |
ANSM - Mis à jour le : 24/04/2025
KYLEENA 19,5 mg, système de diffusion intra-utérin
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Lévonorgestrel.................................................................................................................... 19,5 mg
Pour un système
Pour la liste complète des excipients, voir rubrique 6.1.
Pour plus d’informations sur les taux de libération, voir rubrique 5.2.
Système de diffusion intra-utérin (SIU).
Le produit est composé d’un réservoir médicamenteux blanc ou blanchâtre avec une membrane semi-opaque, monté sur la tige verticale du corps en T du système. En outre, la tige verticale comporte un anneau d’argent situé à proximité des bras horizontaux. Le corps blanc en T est doté d’une boucle à une extrémité de la tige verticale et de deux bras horizontaux à l’autre extrémité. Les fils de retrait de couleur bleue sont fixés sur la boucle.
La tige verticale du SIU est placée dans le tube d’insertion, à l’extrémité de l’inserteur. L’inserteur est constitué d’un tube d’insertion courbé, d'une bague, d’un poussoir et d’une butée intégrés à une poignée avec curseur. Les fils de retrait sont situés à l'intérieur du tube d'insertion et de la poignée.
Dimensions de KYLEENA : 28 x 30 x 1,55 mm
4.1. Indications thérapeutiques
Contraception pour une durée maximale de 5 ans.
4.2. Posologie et mode d'administration
Après insertion dans la cavité utérine, KYLEENA est efficace pour une durée maximale de 5 ans.
Insertion
Il est recommandé que la pose de KYLEENA soit réalisée exclusivement par un professionnel de santé familiarisé avec la technique de pose des SIU et/ou ayant reçu une formation à la technique de pose de KYLEENA.
Avant l’insertion, la patiente doit avoir été soigneusement examinée afin de détecter toute contre-indication à l’insertion d’un SIU. Toute grossesse doit être exclue avant l’insertion. Interroger la femme sur sa période d’ovulation et sur une possible conception avant d’utiliser ce produit. KYLEENA ne doit pas être utilisé comme une méthode de contraception post-coïtale (voir rubriques 4.3 et 4.4 sous le paragraphe « Consultation/examen médical »).
Tableau 1 : Quand insérer KYLEENA chez la femme en âge de procréer
|
Commencer avec KYLEENA |
- KYLEENA doit être inséré dans la cavité utérine au cours des 7 jours qui suivent le début des règles. Dans ce cas, KYLEENA assure une protection contraceptive dès l’insertion et aucune contraception supplémentaire n’est nécessaire. - Si l’insertion n’est pas possible au cours des 7 jours qui suivent le début des règles ou si la femme n’a pas de règles régulières, KYLEENA peut être inséré à n’importe quel moment du cycle à condition qu’une fécondation ait été exclue de manière fiable par le professionnel de santé. Cependant, dans ce cas, la protection contraceptive immédiate après l'insertion n'est plus assurée de manière fiable. Par conséquent, une méthode contraceptive barrière doit être utilisée ou la patiente doit s'abstenir de rapports sexuels vaginaux pendant les 7 jours suivants pour éviter une grossesse. |
|
Insertion post partum |
En plus des instructions ci-dessus (« Commencer avec KYLEENA ») : Au cours du post-partum, le système ne peut être mis en place qu’après involution complète de l’utérus et, dans tous les cas, au plus tôt 6 semaines après l’accouchement. Si l’involution utérine est significativement retardée, il convient d’attendre jusqu’à 12 semaines après l’accouchement. |
|
Insertion après le premier trimestre d’avortement |
KYLEENA peut être inséré immédiatement après un avortement du premier trimestre. Dans ce cas, aucune contraception supplémentaire n’est nécessaire. |
|
Remplacer KYLEENA |
KYLEENA peut être remplacé par un nouveau système à n’importe quel moment du cycle. Dans ce cas, aucune contraception supplémentaire n’est nécessaire |
|
Relai après une autre méthode contraceptive (par exemple après contraceptifs hormonaux combinés, implant) |
- KYLEENA peut être inséré immédiatement s'il est raisonnablement certain que la femme n'est pas enceinte. - Une contraception supplémentaire est nécessaire : si cela fait plus de 7 jours que les saignements menstruels ont commencé, la femme doit alors s'abstenir de rapports sexuels vaginaux ou utiliser une protection contraceptive supplémentaire pendant les 7 jours suivants. |
Informations importantes à prendre en compte pendant ou après l’insertion
En cas d’insertion difficile, ou de douleurs ou de saignements anormaux, pendant ou après l’insertion, la possibilité d’une perforation doit être envisagée et des mesures appropriées, telles qu’un examen clinique et une échographie, doivent être prises.
Après l'insertion, les femmes doivent être réexaminées après 4 à 6 semaines pour vérifier les fils et pour s'assurer que le dispositif est bien positionné. Un examen clinique seul (avec vérification des fils de retrait) peut ne pas être suffisant pour exclure une perforation partielle et une échographie peut être envisagée (voir rubrique 4.4).
KYLEENA se distingue des autres SIU par l’association de la visibilité de son anneau d’argent à l’échographie et de la couleur bleue des fils de retrait. La structure en T de KYLEENA contient du sulfate de baryum, ce qui permet de rendre le système visible à la radiographie.
Retrait/Remplacement
Le retrait de KYLEENA est effectué en tirant délicatement sur les fils à l’aide d’une pince. L’utilisation d’une force excessive ou d’instruments pointus lors du retrait peut entrainer la casse du système. Après le retrait de KYLEENA, le système doit être inspecté pour s’assurer qu’il est intact et qu’il a été complètement retiré.
Si les fils ne sont pas visibles mais si la présence du système dans la cavité utérine est confirmée par l’échographie ou par une autre méthode, celui-ci peut être retiré à l’aide d’une pince fine. Une dilatation du canal cervical ou une autre intervention chirurgicale peut être nécessaire.
Le système doit être retiré au plus tard à la fin de la cinquième année.
Poursuite de la contraception après le retrait
· Si la patiente souhaite continuer d’utiliser la même méthode, un nouveau système peut être posé immédiatement après le retrait de l’ancien système.
· Si la patiente ne souhaite pas continuer à utiliser la même méthode mais qu’une grossesse n’est pas souhaitée, le système doit être retiré pendant les 7 premiers jours du cycle menstruel, si la patiente présente un cycle menstruel régulier. Si le système est retiré à un autre moment du cycle ou que la patiente n’a pas de règles régulières, et si elle a eu des rapports sexuels au cours de la semaine précédente, l’efficacité contraceptive n’est pas assurée. Pour assurer une contraception continue, une contraception barrière doit être utilisée (telle que les préservatifs) et commencée au moins 7 jours avant le retrait. Après le retrait, la nouvelle contraception doit être démarrée immédiatement (suivre les instructions d’utilisation de la nouvelle méthode contraceptive).
Patientes âgées
KYLEENA n’est pas indiqué chez les femmes ménopausées.
Insuffisance hépatique
KYLEENA n’a pas été étudié chez les femmes atteintes d’insuffisance hépatique. L’utilisation de KYLEENA est contre-indiquée chez les femmes présentant une affection hépatique aiguë ou une tumeur hépatique (voir rubrique 4.3).
Insuffisance rénale
KYLEENA n’a pas été étudié chez les femmes atteintes d’insuffisance rénale.
Population pédiatrique
L’utilisation de ce produit n’est pas indiquée avant la ménarche. Pour les données concernant la sécurité d’emploi et l’efficacité chez les adolescentes, voir rubrique 5.1.
Mode d’administration
L’insertion de KYLEENA doit être effectuée par un professionnel de santé, dans des conditions d’asepsie.
KYLEENA est conditionné sous emballage stérile, intégré à un inserteur qui permet sa mise en place d’une seule main. L’emballage ne doit être ouvert qu’au moment de l’insertion. Ne pas restériliser. Tel qu’il est fourni, KYLEENA est à usage unique strict. Ne pas l’utiliser si l’emballage thermoformé est endommagé ou ouvert. Ne pas insérer le système après la date de péremption indiquée sur la boîte et sur l’emballage thermoformé après EXP.
Tout médicament non utilisé ou tout déchet doit être éliminé conformément à la réglementation en vigueur.
KYLEENA est fourni avec une carte patiente à l’intérieur de l’étui carton. Remplissez la carte patiente et remettez-la à la patiente après l'insertion.
Préparation à l’insertion
· Examiner la patiente afin d’exclure toute contre-indication à la pose de KYLEENA (voir rubriques 4.3 et 4.4 sous le paragraphe « Consultation/examen médical »).
· Placer le spéculum, visualiser le col utérin, puis nettoyer soigneusement le col et le vagin à l’aide d’une solution antiseptique adaptée.
· Faire appel à un assistant si nécessaire.
· Saisir la lèvre antérieure du col utérin à l’aide d’une pince de Pozzi ou d’une autre pince pour aligner le canal cervical et la cavité utérine. Dans le cas d’un utérus rétroversé, il peut être plus adapté de saisir la lèvre postérieure du col utérin. Une légère traction sur la pince permet d’aligner le canal cervical. La pince doit être maintenue en place et une légère traction sur le col doit être exercée pendant toute la durée de la procédure d’insertion.
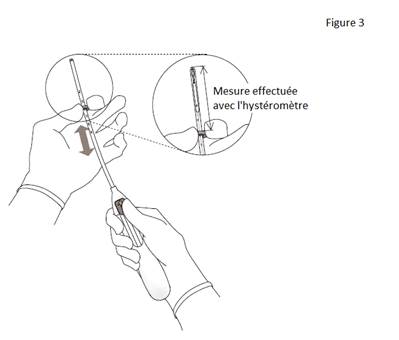
· Insérer un hystéromètre à travers le canal cervical et jusqu’au fond de la cavité utérine pour déterminer la profondeur et la direction de la cavité utérine et afin d’écarter tout signe d’anomalies intra-utérines (par exemple septum, fibromyomes sous-muqueux) ou la présence d’un contraceptif intra-utérin qui aurait été préalablement posé et n’aurait pas été retiré.
En cas de difficulté, il faut envisager la dilatation du canal cervical. Lorsqu’une dilatation cervicale est requise, envisager le recours à des analgésiques ou à un bloc para-cervical.
Insertion
|
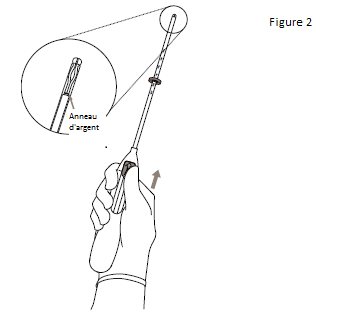
1. Commencer par ouvrir entièrement l’emballage stérile (figure 1). Travailler dans des conditions d’asepsie, avec des gants stériles.
|
||
|
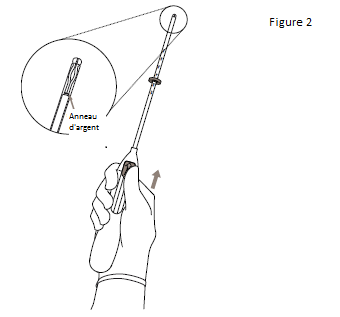
2. Pousser le curseur vers l’avant (dans le sens de la flèche) jusqu’au bout afin de faire entrer KYLEENA dans le tube inserteur (figure 2). |
|
|
|
IMPORTANT ! Ne pas ramener le curseur vers le bas car cette action pourrait libérer KYLEENA prématurément. Une fois libéré, KYLEENA ne peut plus être replacé dans le tube inserteur. |
||
|
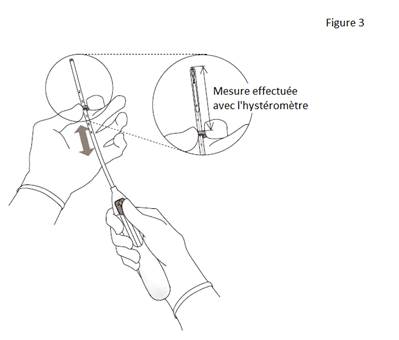
3. Tout en maintenant le curseur avancé en position haute, positionner le bord supérieur de la bague au niveau de la valeur correspondant à la profondeur utérine mesurée avec l’hystéromètre (figure 3). |
|
|
|
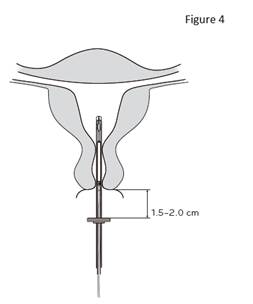
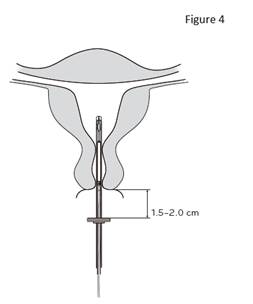
4. Tout en maintenant le curseur en position haute, introduire le tube inserteur dans le canal cervical jusqu’à ce que la bague soit à une distance d’environ 1,5 à 2,0 cm de l’orifice externe du col utérin (figure 4). |
|
|
|
IMPORTANT ! Ne pas forcer lors de l’introduction du tube inserteur. Si nécessaire, dilater le canal cervical. |
||
|
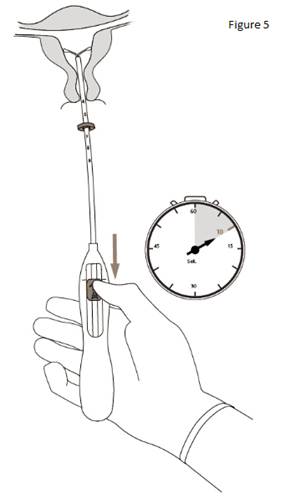
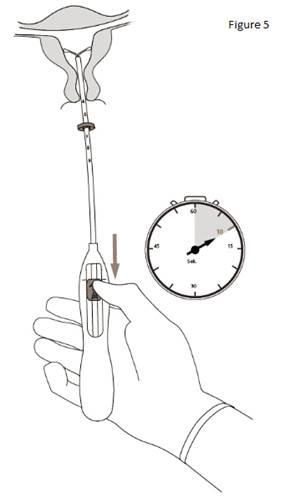
5. Tout en tenant fermement l’inserteur, ramener le curseur jusqu’au repère pour déployer les bras latéraux de KYLEENA (figure 5). Attendre 5 à 10 secondes que les bras latéraux soient totalement déployés. |
|
|
|
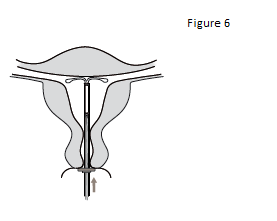
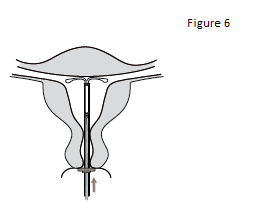
6. Pousser délicatement l’inserteur vers le fond de l’utérus jusqu’à ce que la bague soit au contact du col utérin. KYLEENA est à présent positionné sur le fond utérin (figure 6). |
|
|
|
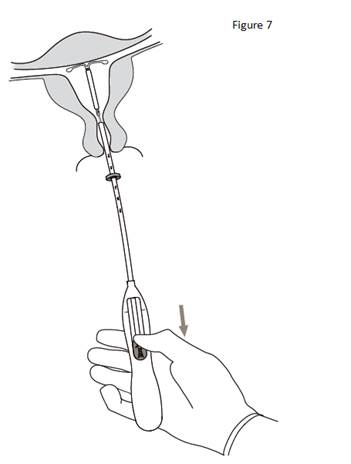
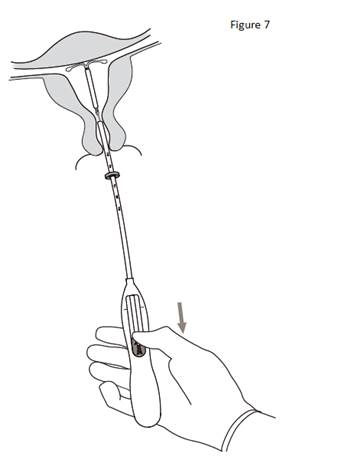
7. Tout en maintenant l’inserteur en place, ramener complètement le curseur vers le bas pour libérer KYLEENA (figure 7). Retirer le tube inserteur tout en gardant le curseur dans la position basse. Couper les fils à environ 2– 3 cm du col utérin pour les laisser visibles. |
|
|
|
IMPORTANT ! En cas de doute sur le bon positionnement de KYLEENA, vérifier sa position (par exemple par une échographie). En cas de mauvaise position dans la cavité utérine, KYLEENA doit être retiré. Ne jamais réinsérer un système qui a été retiré. |
||
Concernant le retrait/remplacement du système, voir la rubrique 4.2, « Insertion et retrait/ remplacement ».
|
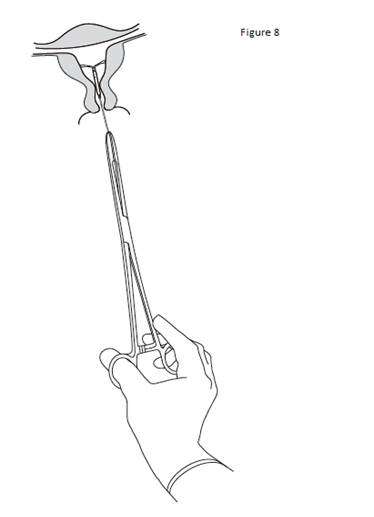
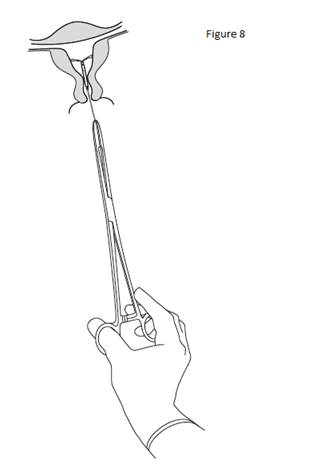
Pour retirer KYLEENA, tirer délicatement sur les fils avec une pince (figure 8). Un nouveau système KYLEENA peut être inséré immédiatement après le retrait de l’ancien. Après le retrait de KYLEENA, le système doit être inspecté afin de vérifier qu’il est intact et qu’il a été complètement retiré. |
|
· Grossesse (voir rubrique 4.6) ;
· Maladie inflammatoire pelvienne aiguë ou récidivante ou affections associées à un risque accru d’infections pelviennes ;
· Cervicite ou vaginite aiguë ;
· Endométrite du postpartum ou antécédent d’avortement septique au cours des trois derniers mois ;
· Néoplasie cervicale intra-épithéliale, jusqu’à résolution ;
· Affection maligne du col ou du corps utérin ;
· Tumeurs sensibles aux progestatifs, par exemple, cancer du sein ;
· Saignements utérins anormaux d’étiologie inconnue ;
· Anomalies congénitales ou acquises de l’utérus, notamment les fibromyomes susceptibles de perturber la pose ou le maintien en place du système intra-utérin (s’ils déforment la cavité utérine) ;
· Affection hépatique aiguë ou tumeur hépatique ;
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
· migraine, migraine focale avec perte de vision asymétrique ou autres symptômes indiquant une ischémie cérébrale transitoire
· maux de tête exceptionnellement sévères
· ictère
· augmentation importante de la pression artérielle
· pathologie artérielle sévère telle qu’un AVC ou un infarctus du myocarde
Le lévonorgestrel à faible dose peut affecter la tolérance au glucose et la glycémie doit être surveillée chez les utilisatrices de KYLEENA qui sont atteintes de diabète. Cependant, il n’est généralement pas nécessaire de modifier la posologie du traitement antidiabétique chez les femmes diabétiques utilisant un SIU au lévonorgestrel.
Consultation/examen médical
Avant insertion du système, la patiente doit être informée des bénéfices et risques de KYLEENA, notamment des signes et des symptômes de perforation et du risque de grossesse extra-utérine, voir ci-après. Un examen clinique, incluant un examen pelvien et un examen des seins doit être pratiqué. Au besoin, un frottis cervical, doit être réalisé suivant l’évaluation du professionnel de santé. Toute grossesse ou maladie sexuellement transmissible doit être exclue. Les infections génitales doivent avoir été traitées avec succès avant l’insertion. La position de l’utérus et la taille de la cavité utérine doivent être déterminées. Il est important que KYLEENA soit positionné au fond de la cavité afin d’en optimiser l’efficacité et de réduire le risque d’expulsion. Les instructions de pose doivent être scrupuleusement suivies.
Une formation à la technique de pose appropriée est recommandée.
L’insertion et le retrait peuvent provoquer des douleurs et des saignements. La procédure peut déclencher une réaction vasovagale (par exemple, une syncope) ou une crise convulsive si la patiente est épileptique.
La patiente doit être à nouveau examinée 4 à 6 semaines après l’insertion afin de contrôler les fils et de vérifier que le système est correctement positionné. Une échographie vaginale peut être envisagée afin de vérifier que le système est bien placé correctement. Si KYLEENA ne peut être localisé dans la cavité utérine, la possibilité d’une expulsion ou d’une perforation complète (voir rubrique « Perforation » ci-dessous) doit être envisagée, et une radiographie peut être réalisée. Par la suite, un réexamen est recommandé tous les ans, ou plus fréquemment si cela est cliniquement indiqué. KYLEENA ne doit pas être utilisé en tant que contraception post coïtale.
L'utilisation de KYLEENA dans le traitement des saignements menstruels abondants ou la protection contre l’hyperplasie de l'endomètre lors d’un traitement hormonal de substitution par œstrogène n'a pas été établie. Par conséquent, son utilisation n’est pas recommandée dans ces pathologies.
Perforation
Un contraceptif intra-utérin peut perforer ou pénétrer le corps ou le col de l’utérus, le plus souvent au cours de l’insertion, bien que cela ne puisse être détecté que quelque temps plus tard et puisse réduire l’efficacité de KYLEENA. Si la pose a été difficile et/ou si des douleurs ou des saignements exceptionnels apparaissent pendant ou après l’insertion, des mesures appropriées, telles qu’un examen clinique et une échographie, doivent être prises immédiatement afin d’exclure toute perforation. Dans certains cas, le système peut être situé hors de la cavité utérine. Dans de telles situations, le système doit être retiré et une intervention chirurgicale peut s’avérer nécessaire.
Dans une importante étude de cohorte prospective non interventionnelle et comparative chez des utilisatrices d’autres DIUs (N = 61 448 femmes) avec une période d’observation de 1 an, l’incidence de perforation a été de 1,3 (IC à 95 % : 1,1 - 1,6) pour 1000 insertions dans la cohorte globale de l’étude. Cette incidence a été de 1,4 (IC à 95 % : 1,1 - 1,8) pour 1000 insertions dans la cohorte utilisant un autre SIU au lévonorgestrel et de 1,1 (IC à 95 % : 0,7 - 1,6) pour 1000 insertions dans la cohorte utilisant un DIU au cuivre.
L’étude a montré que l’allaitement au moment de l’insertion et une insertion dans les 36 semaines après l’accouchement étaient tous deux associés à un risque accru de perforation (voir tableau 2). Ces deux facteurs de risque étaient indépendants du type de DIU utilisé.
Tableau 2 : Incidence de perforation pour 1000 insertions dans la cohorte globale de l’étude observée sur 1 an, stratifiée en fonction de l’allaitement et du temps écoulé depuis l’accouchement au moment de l’insertion (femmes pares)
|
|
Allaitement au moment de l’insertion |
Pas d’allaitement au moment de l’insertion |
|
Insertion ≤ 36 semaines après l’accouchement |
5,6 (IC à 95 % 3,9-7,9 ; N = 6047 insertions) |
1,7 (IC à 95 % 0,8-3,1 ; N = 5927 insertions) |
|
Insertion > 36 semaines après l’accouchement |
1,6 (IC à 95 % 0,0-9,1 ; N = 608 insertions) |
0,7 (IC à 95 % 0,5-1,1 ; N = 41 910 insertions) |
En prolongeant la période d’observation à 5 ans dans un sous-groupe de cette étude (N = 39 009 femmes utilisatrices d’un autre SIU au lévonorgestrel ou d’un DIU au cuivre, des informations étaient disponibles pour 73 % de ces femmes sur les 5 années complètes de suivi), l’incidence des perforations détectées à tout moment pendant toute la période de 5 ans était de 2,0 (IC à 95 % : 1,6 – 2,5) pour 1000 insertions. L’allaitement au moment de l’insertion et l’insertion dans les 36 semaines après l’accouchement ont été confirmés comme facteurs de risques également dans le sous-groupe suivi pendant 5 ans.
Le risque de perforation peut être augmenté chez la femme présentant un utérus rétroversé fixé.
L’examen de contrôle après l’insertion doit suivre les recommandations fournies ci-dessus au paragraphe « Consultation / examen médical » y compris la possibilité de réaliser une échographie vaginale pour vérifier la position correcte du système 4 à 6 semaines après l’insertion. Ces recommandations peuvent être adaptées selon la situation clinique, notamment chez les femmes présentant des facteurs de risque de perforation.
Disparition des fils
Si les fils de retrait ne sont plus visibles au niveau du col de l’utérus lors d’un examen de contrôle, une grossesse, ainsi qu’une expulsion du système qui serait passée inaperçue, doivent être exclues. Les fils peuvent être remontés dans l’utérus ou le canal cervical et réapparaître lors des règles suivantes. Une fois la présence d’une grossesse exclue, les fils peuvent généralement être localisés en explorant délicatement le canal cervical à l’aide d’un instrument adapté. S’ils restent introuvables, il faut envisager l’éventualité d’une expulsion ou d’une perforation. L’échographie vaginale peut être utilisée pour vérifier le positionnement du système. En cas d’indisponibilité ou d’échec de l’échographie, la radiographie peut être utilisée pour localiser KYLEENA.
Grossesse extra-utérine
Dans les essais cliniques, l’incidence globale des grossesses extra-utérines avec KYLEENA a été d’environ 0,20 pour 100 années-femmes. Environ la moitié des grossesses survenant avec KYLEENA sont susceptibles d’être extra-utérines.
Les patientes envisageant d’utiliser KYLEENA doivent être informées des signes et symptômes de la grossesse extra-utérine et des risques associés. Chez toute femme présentant une grossesse pendant l’utilisation de KYLEENA, la possibilité d’une grossesse extra-utérine doit être envisagée et évaluée.
Le risque de grossesse extra-utérine est accru chez les femmes ayant des antécédents de grossesse extra-utérine, de chirurgie des trompes ou d’infection pelvienne. La possibilité d’une grossesse extra-utérine doit être envisagée en cas de douleur abdominale basse, en particulier si elle s’accompagne d’une absence de menstruation ou si des saignements apparaissent chez une femme jusque-là en aménorrhée.
Une grossesse extra-utérine peut avoir un impact sur la fertilité ultérieure ; il convient donc d’évaluer avec attention les bénéfices et les risques liés à l’utilisation de KYLEENA chez chaque femme de manière individuelle.
Effets sur le cycle menstruel
Des effets sur le cycle menstruel sont attendus chez la plupart des utilisatrices de KYLEENA. Ces modifications résultent de l’action directe du lévonorgestrel sur l’endomètre et peuvent ne pas être en corrélation avec l’activité ovarienne.
Des saignements irréguliers et des spottings sont fréquents au cours des premiers mois d’utilisation. Par la suite, la forte inhibition de l’endomètre entraîne une réduction de la durée et du volume des saignements menstruels. Il est fréquent qu’un flux menstruel rare évolue vers une oligoménorrhée ou une aménorrhée.
Dans les essais cliniques, une oligoménorrhée et/ou une aménorrhée se sont progressivement installées. Au bout de la cinquième année, environ 26,4% et 22,6 % des utilisatrices ont respectivement développé des saignements peu fréquents et/ou une aménorrhée.
L’éventualité d’une grossesse doit être envisagée si les règles ne surviennent pas dans les 6 semaines suivant le début des règles précédentes. Devant la persistance d’une aménorrhée, la répétition d’un test de grossesse n’est justifiée que si d’autres signes de grossesse sont présents.
Si les saignements deviennent plus abondants et/ou plus irréguliers au fil du temps, des mesures diagnostiques appropriées doivent être prises car les saignements irréguliers peuvent être un symptôme de polypes endométriaux, d’hyperplasie ou de cancer et les saignements abondants peuvent être le signe d’une expulsion du système qui serait passée inaperçue.
Infection pelvienne
Des infections pelviennes ont été signalées lors de l’utilisation de tous les systèmes ou dispositifs intra-utérins. Bien que le système KYLEENA et l’inserteur soient stériles, ils peuvent, suite à une contamination bactérienne lors de l’insertion, devenir un vecteur d’infection microbienne au niveau de l’appareil génital haut. Dans les essais cliniques, les cas de maladie inflammatoire pelvienne (MIP) ont été plus fréquents en début d’utilisation de KYLEENA. Ceci est cohérent avec les données publiées sur les DIU au cuivre, avec lesquels la fréquence des MIP est maximale lors des 3 premières semaines suivant l’insertion et diminue ensuite.
Avant de choisir KYLEENA, les facteurs de risque associés aux infections pelviennes (par exemple : partenaires multiples, infections sexuellement transmissibles, antécédents de MIP) doivent faire l’objet d’une évaluation complète. Les infections pelviennes telles que les MIP peuvent avoir de graves conséquences et peuvent altérer la fécondité et augmenter le risque de grossesse extra‑utérine.
Une infection sévère ou une septicémie (y compris une septicémie à streptocoques du groupe A) peut survenir après l'insertion d’un DIU, comme cela peut également être le cas avec d'autres interventions gynécologiques ou chirurgicales, mais ce type d’évènement est extrêmement rare.
KYLEENA doit être retiré si la femme présente une endométrite ou une maladie inflammatoire pelvienne récidivante ; ou en cas d’infection aiguë sévère ou ne répondant pas au traitement.
Des examens bactériologiques sont indiqués et une surveillance est recommandée, même en cas de symptômes mineurs évocateurs d’une infection.
Expulsion
Dans les essais cliniques menés avec KYLEENA, l’incidence des expulsions a été faible (< 4% des insertions) et du même ordre que celle décrite pour les autres systèmes ou dispositifs intra-utérins. Une expulsion partielle ou complète de KYLEENA peut se manifester par des saignements ou des douleurs. Cependant, le système peut être expulsé de la cavité utérine sans que la patiente ne s’en aperçoive, entraînant une perte de l’effet contraceptif. Dans la mesure où KYLEENA diminue le flux menstruel, l’augmentation du flux menstruel peut être le signe d’une expulsion.
Le risque d’expulsion est augmenté chez :
· Les femmes ayant des antécédents de saignements menstruels abondants,
· Les femmes ayant un IMC supérieur à la normale au moment de l’insertion ; ce risque augmente progressivement avec l’augmentation de l’IMC.
Les femmes doivent être conseillées sur les signes possibles d’expulsion et sur la manière de vérifier les fils de KYLEENA et de contacter un professionnel de santé si elles ne sentent plus les fils. Une méthode contraceptive barrière (tel qu’un préservatif) doit être utilisée jusqu’à ce que le positionnement de KYLEENA ait été confirmé.
En cas d’expulsion partielle, l’efficacité de KYLEENA peut être diminuée.
En cas d’expulsion partielle, KYLEENA doit être retiré. Un nouveau système peut être inséré au moment du retrait, à condition que toute grossesse ait été exclue.
Kystes ovariens/hypertrophie des follicules ovariens
L’efficacité contraceptive de KYLEENA étant principalement due à ses effets locaux au niveau de l’utérus, il n’est généralement pas observé de modification de la fonction ovulatoire, y compris des processus normaux de développement folliculaire, de libération des ovocytes et d’atrésie folliculaire chez les femmes en âge de procréer. Dans certains cas, l’atrésie folliculaire est retardée et la folliculogenèse se poursuit. Ces follicules hypertrophiés ne peuvent être distingués cliniquement des kystes ovariens. Des kystes ovariens (y compris des kystes ovariens hémorragiques et des kystes ovariens rompus) ont été signalés au cours des essais cliniques en tant qu’effet indésirable survenu au moins une fois chez environ 22,2 % des femmes utilisant KYLEENA. Ces kystes sont le plus souvent asymptomatiques, bien que certains puissent être accompagnés de douleurs pelviennes ou d’une dyspareunie.
Dans la plupart des cas, les follicules hypertrophiés disparaissent spontanément dans les deux à trois mois.
En l’absence de disparition spontanée des follicules hypertrophiés, la poursuite d’une surveillance échographique et d’autres mesures diagnostiques ou thérapeutiques pourront être indiquées. Dans de rares cas, une intervention chirurgicale pourra s’imposer.
Troubles psychiatriques
L’état dépressif et la dépression sont des effets indésirables bien connus liés à l’utilisation de contraceptifs hormonaux (voir rubrique 4.8). La dépression peut être grave et constitue un facteur de risque bien connu de comportement suicidaire et de suicide. Il convient de conseiller aux femmes de contacter leur professionnel de santé en cas de changements d’humeur et de symptômes dépressifs, y compris peu de temps après le début du traitement.
Précautions au moment du retrait
L'utilisation d'une force excessive ou d'instruments pointus lors du retrait peut entraîner la casse du système (voir rubrique 4.2). Après le retrait de KYLEENA, le système doit être inspecté pour s'assurer qu'il est intact et qu’il a été complètement retiré.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Remarque : Les informations relatives à la prescription des médicaments associés doivent être consultées pour identifier toute interaction potentielle.
Effets d'autres médicaments sur KYLEENA
Des interactions sont possibles avec les médicaments inducteurs des enzymes microsomales ce qui peut entraîner une augmentation de la clairance des hormones sexuelles.
Substances augmentant la clairance du lévonorgestrel, par exemple :
La phénytoïne, les barbituriques, la primidone, la carbamazépine, la rifampicine, ainsi que, éventuellement, l’oxcarbazépine, le topiramate, le felbamate, la griséofulvine et les produits contenant du millepertuis.
L’influence de ces médicaments sur l’efficacité contraceptive de KYLEENA n’est pas connue, mais elle ne devrait pas avoir d’impact majeur étant donné le mécanisme d’action local du système.
Substances ayant des effets variables sur la clairance du lévonorgestrel, par exemple :
Lorsqu’ils sont co‑administrés avec des hormones sexuelles, de nombreux inhibiteurs de la protéase du VIH et du VHC ainsi que des inhibiteurs non-nucléosidiques de la transcriptase inverse peuvent augmenter ou diminuer les concentrations plasmatiques du progestatif.
Substances diminuant la clairance du lévonorgestrel (inhibiteurs enzymatiques) :
Les inhibiteurs puissants ou modérés du CYP3A4 tels que les antifongiques azolés (par ex. le fluconazole, l’itraconazole, le kétoconazole et le voriconazole), le vérapamil, les macrolides (par ex. la clarithromycine, l’érythromycine), le diltiazem et le jus de pamplemousse peuvent augmenter les concentrations plasmatiques du progestatif.
Imagerie par résonance magnétique (IRM)
Les tests non cliniques réalisés avec un autre SIU au lévonorgestrel possédant un anneau d’argent et un corps en T de mêmes dimensions que KYLEENA ont montré qu’une patiente pouvait bénéficier d’une IRM en toute sécurité lorsque KYLEENA est placé dans les conditions suivantes :
· champ magnétique statique de 3 Tesla ou moins,
· gradient spatial de champ magnétique maximal de 36000 Gauss/cm (360 T/m) ou moins,
· taux d'absorption spécifique (TAS) moyen maximum pour le corps entier de 4 W / kg lors du premier niveau en mode contrôlé pendant 15 minutes d’exploration en continu.
Lors des tests non-cliniques, ledit SIU au lévonorgestrel a produit une hausse de température inférieure ou égale à 1,8°C avec un taux d'absorption spécifique (TAS) moyen maximum pour le corps entier de 2,9 W/kg, pendant 15 minutes d’exploration par Résonance Magnétique à 3 T avec utilisation d’une antenne corps émettrice/ réceptrice.
Des artéfacts limités peuvent être observés si la région d’intérêt se trouve dans la même zone que le système KYLEENA ou en est relativement proche.
4.6. Fertilité, grossesse et allaitement
Fertilité
L’utilisation d’un système de diffusion intra-utérin au lévonorgestrel n’a aucune incidence sur la fertilité ultérieure. Après le retrait du système intra-utérin, les patientes retrouvent leur fertilité normale (voir rubrique 5.1).
Grossesse
L’utilisation de KYLEENA est contre-indiquée pendant la grossesse (voir rubrique 4.3). En cas de grossesse débutant pendant l’utilisation de KYLEENA, le système doit être retiré dès que possible car le maintien en place de tout contraceptif intra-utérin peut augmenter le risque d’avortement et d’accouchement prématuré. Le retrait de KYLEENA ou l’exploration de l’utérus peuvent également provoquer un avortement spontané. Une grossesse-extra-utérine doit être exclue.
Si la patiente souhaite poursuivre la grossesse et si le système ne peut pas être retiré, elle devra être informée des risques et des conséquences possibles d’une naissance prématurée de l’enfant. Toute grossesse se déroulant dans un tel contexte doit faire l’objet d’une étroite surveillance. Il convient de demander à la patiente de signaler tout symptôme évocateur de complications gestationnelles, tel que des crampes abdominales accompagnées de fièvre.
De plus, un risque accru d'effets virilisants chez un fœtus féminin en raison de l'exposition intra-utérine au lévonorgestrel ne peut être exclu. Des cas isolés de virilisation des organes génitaux externes des fœtus féminins ont été rapportés à la suite d’une exposition locale au lévonorgestrel avec un système intra-utérin au lévonorgestrel maintenu en place pendant la grossesse.
De façon générale, l’utilisation de méthodes uniquement progestatives à partir de 6 semaines après l’accouchement ne semble induire aucun effet délétère sur la croissance ou le développement du nourrisson. L’utilisation d’un système de diffusion intra-utérin au lévonorgestrel n’altère ni la quantité ni la qualité du lait maternel. Lors de l’allaitement, de faibles quantités de progestatif (environ 0,1 % de la dose de lévonorgestrel) passent dans le lait maternel.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
KYLEENA n’a aucun effet connu sur l’aptitude à conduire des véhicules et à utiliser des machines.
Résumé du profil de sécurité
La plupart des femmes présentent des modifications de leur cycle menstruel après l’insertion de KYLEENA. Au fil du temps, la fréquence de l’aménorrhée et de l’oligoménorrhée augmente et la fréquence des saignements prolongés, irréguliers ou fréquents diminue. Les évolutions suivantes du cycle menstruel ont été observées lors des essais cliniques :
Tableau 3 : Évolutions du cycle menstruel décrites avec KYLEENA lors des essais cliniques
|
KYLEENA |
90 premiers jours |
90 jours suivants |
Fin de la 1ère année |
Fin de la 3ème année |
Fin de la 5ème année |
|
Aménorrhée |
< 1 % |
5 % |
12 % |
20 % |
23 % |
|
Oligoménorrhée |
10 % |
20 % |
26 % |
26 % |
26 % |
|
Saignements fréquents |
25 % |
10 % |
4 % |
2 % |
2 % |
|
Saignements prolongés * |
57 % |
14 % |
6 % |
2 % |
1 % |
|
Saignements irréguliers |
43 % |
25 % |
17 % |
10 % |
9 % |
* Les patientes ayant présenté des saignements prolongés peuvent également être incluses dans l’une des autres catégories (sauf l’aménorrhée)
Tableau récapitulatif des effets indésirables
Les fréquences des effets indésirables signalés avec KYLEENA sont récapitulées dans le tableau ci‑dessous. Au sein de chaque groupe de fréquence, les effets indésirables sont présentés par ordre décroissant de gravité.
Les fréquences sont définies comme suit :
· très fréquent (≥ 1/10),
· fréquent (≥ 1/100 ; < 1/10),
· peu fréquent (≥ 1/1 000 ; < 1/100),
· rare (≥ 1/10 000 ; < 1/1 000)
· très rare (< 1/10 000).
|
Classe de systèmes d’organes |
Très fréquent |
Fréquent |
Peu fréquent |
|
Affections psychiatriques |
|
Humeur dépressive/ Dépression Baisse de la libido |
|
|
Affections du système nerveux |
Céphalée |
Migraine |
|
|
Affections vasculaires |
|
Sensations vertigineuses |
|
|
Affections gastro-intestinales |
Douleur abdominale/ pelvienne |
Nausées |
|
|
Affections de la peau et du tissu sous-cutané |
Acné/séborrhée |
Alopécie |
Hirsutisme |
|
Affections des organes de reproduction et du sein |
Modifications des saignements y compris augmentation et réduction des saignements menstruels, spottings, oligoménorrhée et aménorrhée Kyste ovarien* Vulvo-vaginite |
Infection de l’appareil génital haut Dysménorrhée Douleur/gêne mammaire Expulsion du dispositif (complète ou partielle) Ecoulement génital |
Perforation utérine** |
|
Investigations |
|
Prise de poids |
|
* Dans les essais cliniques, les kystes ovariens devaient être signalés en tant qu’effets indésirables s’il s’agissait de kystes anormaux, non fonctionnels, et/ou ayant un diamètre > 3 cm à l’échographie.
** Cette fréquence est basée sur une importante étude de cohorte prospective, non interventionnelle et comparative chez des femmes utilisant un autre SIU au lévonorgestrel et des DIUs au cuivre, qui a montré que l’allaitement au moment de l’insertion et l’insertion dans les 36 semaines après l’accouchement sont des facteurs de risque de perforation indépendants (voir le paragraphe « Perforation » dans la rubrique 4.4). Dans les essais cliniques avec KYLEENA qui excluaient les femmes qui allaitaient, la fréquence de perforation était « rare ».
Description de certains effets indésirables particuliers
Lors de l’utilisation d’un SIU au lévonorgestrel, des cas d’hypersensibilité, avec notamment éruption cutanée, urticaire et angio-œdème ont été signalés.
Lorsqu’une femme débute une grossesse pendant l’utilisation de KYLEENA, le risque relatif que cette grossesse soit extra-utérine est accru (voir le paragraphe « Grossesse extra-utérine » dans la rubrique 4.4).
Il est possible que le partenaire sente les fils de retrait pendant les rapports sexuels.
Les effets indésirables suivants ont été signalés lors de la pose ou du retrait de KYLEENA :
Douleur associée à l’intervention, saignement associé à l’intervention, réaction vasovagale liée à l’insertion avec sensation vertigineuse ou syncope. La procédure peut déclencher une crise convulsive si la patiente est épileptique.
Des cas de septicémie (y compris des septicémies à streptocoques du groupe A) ont été rapportés après l’insertion de DIUs (voir le paragraphe « Infection pelvienne » dans la rubrique 4.4).
Population pédiatrique
Chez les adolescentes de moins de 18 ans, un profil de sécurité similaire à celui observé chez les patientes âgées de 18 ans et plus, est attendu pour KYLEENA. Se référer à la rubrique 5.1 pour les données concernant la sécurité chez les adolescentes.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
Sans objet.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Effets pharmacodynamiques
KYLEENA exerce principalement des effets progestatifs locaux dans la cavité utérine.
La forte concentration en lévonorgestrel dans l’endomètre entraîne une régulation négative des récepteurs endométriaux aux œstrogènes et à la progestérone. L’endomètre devient relativement insensible à l’œstradiol circulant et un puissant effet antiprolifératif est observé. Des modifications morphologiques de l’endomètre et une faible réaction locale à un corps étranger sont constatées au cours de l’utilisation. L’épaississement de la glaire cervicale empêche le passage des spermatozoïdes au travers du canal cervical. L’environnement local de l’utérus et des trompes de Fallope inhibe la mobilité et la fonctionnalité des spermatozoïdes, empêchant la fécondation. Lors des essais cliniques menés avec KYLEENA, une ovulation a été observée chez la majorité du sous‑groupe de patientes étudiées. L’ovulation a été mise en évidence chez 23 femmes sur 26 la première année, 19 femmes sur 20 la deuxième année et chez la totalité des 16 femmes la troisième année. Au cours de la quatrième année, l’ovulation a été observée chez la seule patiente restant dans le groupe étudié et au cours de la cinquième année, il ne restait aucune femme dans ce sous‑groupe.
Efficacité et sécurité clinique
L’efficacité contraceptive de KYLEENA a été évaluée dans une étude clinique menée chez 1 452 femmes âgées de 18 à 35 ans, dont 39,5 % (574) de femmes nullipares, parmi lesquelles 84,0 % (482) étaient nulligestes. L’indice de Pearl à 1 an a été de 0,16 (intervalle de confiance à 95 % : 0,02 ‑ 0,58) et l’indice de Pearl à 5 ans a été de 0,29 (intervalle de confiance à 95 % : 0,16 ‑ 0,50). Le taux d’échec à 1 an a été d’environ 0,2 % et le taux d’échec cumulé a été d’environ 1,4 % à 5 ans. Ce taux d’échec prend également en compte les grossesses dues aux expulsions et perforations passées inaperçues. L’utilisation d’un système de diffusion intra-utérin au lévonorgestrel n’a aucune incidence sur la fécondité ultérieure.
Lors d’une étude de 5 ans menée avec KYLEENA, 116 des 163 femmes (71,2 %) qui ont interrompu le traitement car elles désiraient une grossesse, sont devenues enceintes au cours des 12 mois de suivi post-retrait.
Lors d’une étude réalisée chez 304 adolescentes, le profil de tolérance observé avec un autre système de diffusion intra-utérin au lévonorgestrel plus faiblement dosé, était conforme à celui observé chez la femme adulte. Chez les adolescentes de moins de 18 ans, une efficacité similaire à celle observée chez les utilisatrices âgées de 18 ans et plus est attendue.
Lors de l’utilisation de KYLEENA, les modifications du cycle menstruel résultent de l’action directe du lévonorgestrel sur l’endomètre et ne reflètent pas nécessairement le cycle ovarien. Aucune différence nette n’est observée au niveau du développement folliculaire, de l’ovulation ou de la production d’œstradiol et de progestérone chez les femmes présentant des schémas de saignements différents. Dans le cadre de l’inhibition de la prolifération endométriale, une augmentation initiale des spottings peut être observée au cours des premiers mois d’utilisation.
Par la suite, la forte inhibition de l’endomètre entraîne une réduction de la durée et du volume des saignements menstruels au cours de l’utilisation de KYLEENA. Il est fréquent que la diminution du flux menstruel évolue vers une oligoménorrhée ou une aménorrhée. La fonction ovarienne reste normale et les taux d’œstradiol se maintiennent, même en cas d’aménorrhée chez les utilisatrices de KYLEENA.
5.2. Propriétés pharmacocinétiques
Le lévonorgestrel est libéré localement dans la cavité utérine. La courbe de libération in vivo est caractérisée par une forte baisse initiale, qui ralentit progressivement, pour rester pratiquement constante après 1 an jusqu’à la fin des 5 années d’utilisation prévue.
Les taux de libération in vivo estimés aux différents temps sont présentés dans le tableau 4.
Tableau 4 : taux de libération in vivo estimés d’après les données sur les teneurs résiduelles mesurées ex vivo
|
Délai |
Taux de libération in vivo estimé |
|
24 jours après l’insertion |
17,5 |
|
60 jours après l’insertion |
15,3 |
|
1 an après l’insertion |
9,8 |
|
3 ans après l’insertion |
7,9 |
|
5 ans après l’insertion |
7,4 |
|
Moyenne sur la 1ère année |
12,6 |
|
Moyenne sur 5 ans |
9 |
Suite à l’insertion, le lévonorgestrel est immédiatement libéré par le SIU dans la cavité utérine. Plus de 90 % du lévonorgestrel libéré est disponible au niveau systémique. Les pics de concentrations sériques du lévonorgestrel sont atteints dans les deux semaines suivant l’insertion de KYLEENA. Sept jours après l’insertion, une concentration moyenne du lévonorgestrel de 162 pg/ml (5ème percentile : 81 pg/ml – 95ème percentile : 308 pg/ml) a été mise en évidence. Par la suite, les concentrations sériques du lévonorgestrel déclinent au fil du temps jusqu’à atteindre des concentrations moyennes de 91 pg/ml (5ème percentile : 47 pg/ml – 95ème percentile : 170 pg/ml) au bout de 3 ans et 83 pg/ml (5ème percentile : 45 pg/ml – 95ème percentile : 153 pg/ml) au bout de 5 ans. Lors de l’utilisation d’un système de diffusion intra-utérin au lévonorgestrel, l’importante exposition locale au lévonorgestrel dans la cavité utérine entraîne un fort gradient de concentration entre l’endomètre et le myomètre (gradient entre l’endomètre et le myomètre > facteur 100) et de faibles concentrations en lévonorgestrel dans le sérum (gradient entre l’endomètre et le sérum > facteur 1 000).
Distribution
Le lévonorgestrel se lie de façon non spécifique à l’albumine sérique et de façon spécifique à la SHBG. Moins de 2 % du lévonorgestrel circulant est présent sous forme de stéroïde libre. Le lévonorgestrel se lie à la SHBG avec une forte affinité.
En conséquence, les modifications de la concentration sérique de la SHBG entraînent une augmentation (si les concentrations de SHBG sont accrues) ou une diminution (si les concentrations de SHBG sont réduites) de la concentration sérique totale du lévonorgestrel. La concentration de la SHBG a décliné en moyenne d’environ 30 % durant les 3 premiers mois après l’insertion de KYLEENA et est restée relativement stable au cours des 5 années d’utilisation. Le volume de distribution apparent moyen du lévonorgestrel est d’environ 106 litres.
Biotransformation
Le lévonorgestrel est très largement métabolisé. Les principales voies métaboliques sont la réduction du groupement ∆4-3oxo et l’hydroxylation en positions 2α, 1β et 16β suivies de conjugaison. Le CYP3A4 est la principale enzyme intervenant dans la métabolisation oxydative du lévonorgestrel. Les données disponibles in vitro suggèrent que les réactions de biotransformations médiées par le CYP seraient de moindre importance pour le lévonorgestrel en comparaison à la réduction et la conjugaison.
Élimination
La clairance plasmatique totale du lévonorgestrel est d’environ 1,0 ml/min/kg. Le lévonorgestrel n’est excrété sous forme inchangée qu’à l’état de traces. Les métabolites sont excrétés dans les selles et les urines avec un rapport d’excrétion d’environ 1. La demi-vie d’excrétion est d’environ 1 jour.
Linéarité/non-linéarité
Les propriétés pharmacocinétiques du lévonorgestrel dépendent de la concentration de la SHBG, laquelle est elle-même influencée par les œstrogènes et les androgènes. Une réduction de la concentration de SHBG entraîne une réduction de la concentration sérique totale du lévonorgestrel, ce qui indique un profil non linéaire des propriétés pharmacocinétiques du lévonorgestrel en fonction du temps. Étant donné le mode d’action principalement local de KYLEENA, aucun impact sur l’efficacité de KYLEENA n’est attendu.
Population pédiatrique
Lors d’une étude de phase III d’un an, réalisée chez des adolescentes après la ménarche (patientes âgées de 12 à 18 ans - moyenne d’âge : 16,2), utilisant un autre système de diffusion intra-utérin plus faiblement dosé en lévonorgestrel, l’analyse pharmacocinétique chez 283 patientes a montré des concentrations sériques estimées de lévonorgestrel légèrement supérieures (environ 10 %) chez les adolescentes, comparées à la population adulte. Ceci est en corrélation avec le poids corporel généralement plus faible chez les adolescentes. La fourchette estimée pour les adolescentes reste néanmoins dans la fourchette estimée pour la population adulte, montrant une grande similarité.
Aucune différence au niveau pharmacocinétique n’est attendue avec KYLEENA entre les adolescentes et les femmes adultes.
Différences ethniques
Une étude de phase III de 3 ans, utilisant un autre système de diffusion intra-utérin plus faiblement dosé en lévonorgestrel, a été réalisée dans la région Asie‑Pacifique (93 % de patientes Asiatiques, 7% provenant d’autres ethnies). Les caractéristiques pharmacocinétiques du lévonorgestrel obtenues sur la population Asiatique de cette étude ont été comparées avec celles obtenues avec la population caucasienne d’une autre étude de phase III et aucune différence clinique pertinente concernant l’exposition systémique et les autres paramètres pharmacocinétiques n’a été mise en évidence. De plus, le taux de libération quotidien du SIU au lévonorgestrel était identique dans les deux populations.
Aucune différence pharmacocinétique n’est attendue avec KYLEENA entre les femmes issues de différentes ethnies.
5.3. Données de sécurité préclinique
L’évaluation de la sécurité des composants du produit (composants élastomère du réservoir hormonal, matériaux polyéthylène et polypropylène, anneau d’argent du produit et association de l’élastomère et du lévonorgestrel) basée sur l’évaluation de la toxicologie génétique à l’aide des systèmes de test in vitro et in vivo standards ainsi que sur des tests de biocompatibilité chez la souris, le rat, le cobaye, le lapin et à l’aide de systèmes de test in vitro, n’ont pas révélé de bio-incompatibilité.
Evaluation du Risque Environnemental (ERE)
Les études d’Evaluation du Risque Environnemental ont montré que le lévonorgestrel peut présenter un risque pour l’environnement aquatique (voir rubrique 6.6).
Élastomère polydiméthylsiloxane
Silice colloïdale anhydre
Polyéthylène
Sulfate de baryum
Polypropylène
Phthalocyanine de cuivre
Argent
3 ans.
6.4. Précautions particulières de conservation
Ce médicament ne nécessite pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
Le système de diffusion intra-utérin est conditionné individuellement dans un emballage thermoformé (PETG) avec un opercule détachable (PE).
Boîtes de 1 x 1 et 5 x 1.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Le produit est fourni dans un emballage stérile qui ne doit être ouvert qu’au moment de l’insertion. Le système doit être manipulé en respectant les conditions d’asepsie. Si l’emballage stérile n’est pas hermétiquement fermé, le système contenu dans celui-ci doit être éliminé conformément à la réglementation en vigueur pour la manipulation des déchets à risque biologique. Les systèmes KYLEENA retirés et les inserteurs doivent également être éliminés conformément à cette réglementation.
Doit être inséré par un professionnel de santé, selon une technique aseptique (voir rubrique 4.2).
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Ce médicament peut présenter un risque pour l’environnement (voir rubrique 5.3).
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
1 RUE CLAUDE BERNARD
59000 LILLE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 300 947 5 4 : Système de diffusion intra-utérin dans un emballage thermoformé (PETG) avec un opercule détachable (PE). Boîte de 1.
· 34009 550 334 6 2 : Système de diffusion intra-utérin dans un emballage thermoformé (PETG) avec un opercule détachable (PE). Boîte de 5.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
ANSM - Mis à jour le : 24/04/2025
KYLEENA 19,5 mg, système de diffusion intra-utérin
Veuillez lire attentivement cette notice avant d’utiliser ce médicament car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre professionnel de santé.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre professionnel de santé. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que KYLEENA 19,5 mg, système de diffusion intra-utérin et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser KYLEENA 19,5 mg, système de diffusion intra-utérin ?
3. Comment utiliser KYLEENA 19,5 mg, système de diffusion intra-utérin ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver KYLEENA 19,5 mg, système de diffusion intra-utérin ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE KYLEENA 19,5 mg, système de diffusion intra-utérin ET DANS QUELS CAS EST-IL UTILISE ?
KYLEENA est un système de diffusion intra-utérin en forme de T, également appelé stérilet hormonal. C’est un contraceptif : il permet d’éviter une grossesse pendant une durée maximale de cinq ans. KYLEENA contient une hormone appelée lévonorgestrel.
Figure 1 : Stérilet hormonal KYLEENA

Comment KYLEENA agit-il ?
Un professionnel de santé placera KYLEENA dans votre utérus. Une fois mis en place, il libère une petite quantité d’hormones de façon continue.
KYLEENA empêche les spermatozoïdes et les ovules d’entrer en contact, ce qui permet d’éviter une grossesse. Voici comment :
· Il épaissit le mucus au niveau du col de l’utérus. Cela empêche les spermatozoïdes de le traverser.
· Il permet à la muqueuse de l’utérus (l’endomètre) de rester fine.
Figure 2 : KYLEENA dans l’utérus

2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER KYLEENA 19,5 mg, système de diffusion intra-utérin ?
Informations utiles sur KYLEENA
Votre professionnel de santé doit s’assurer que ce contraceptif est adapté à votre cas. C’est pourquoi il/elle vous posera d’abord quelques questions sur votre santé. Ce n’est qu’après que le dispositif pourra vous être prescrit.
En tant que contraceptif, KYLEENA permet d’éviter les grossesses. Cependant, aucun contraceptif ne peut éviter toutes les grossesses. Chaque année, environ 2 à 3 femmes sur 1 000 qui utilisent KYLEENA débutent une grossesse.
KYLEENA ne vous protège pas contre l’infection par le VIH ou les autres maladies sexuellement transmissibles.
KYLEENA n’est pas un contraceptif d’urgence comme la pilule du lendemain. Les femmes qui ont eu des rapports sexuels non protégés peu de temps avant sa mise en place, peuvent débuter une grossesse.
N’utilisez jamais KYLEENA 19,5 mg, système de diffusion intra-utérin si :
· vous êtes enceinte (voir la rubrique « Grossesse, allaitement et fertilité » ci-dessous) ;
· vous avez une infection de l’utérus, des trompes de Fallope ou des ovaires (maladie inflammatoire pelvienne) ou si vous en avez eu plusieurs fois dans le passé ;
· vous avez une maladie qui augmente le risque d’infections pelviennes, par exemple : maladies sexuellement transmissibles ou maladies qui diminuent la capacité de votre corps à combattre les infections, comme une infection par le VIH à un stade avancé ;
· vous avez une infection du vagin ou du col de l’utérus ;
· vous avez accouché, avorté ou fait une fausse-couche au cours des trois derniers mois et que vous avez ensuite eu une infection de l’utérus ;
· les résultats de votre dernier frottis (dépistage du cancer du col de l’utérus) étaient anormaux ;
· vous avez un cancer de l’utérus ou du col de l’utérus, ou si votre professionnel de santé pense que vous pourriez en avoir un ;
· vous avez une tumeur qui a besoin d’hormones progestatives pour se développer, comme un cancer du sein ;
· vous avez des saignements au niveau du vagin dont la cause n’est pas connue ;
· votre col de l’utérus ou votre utérus n’a pas une forme normale, par exemple à cause de la formation de tissus non cancéreux dans votre utérus (fibromes);
· vous avez une maladie du foie ou une tumeur au foie ;
· vous êtes allergique au lévonorgestrel ou à l’un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6).
N’utilisez pas KYLEENA si vous êtes concernée par l’une des situations ci-dessus. En cas de doute, adressez-vous à votre professionnel de santé.
Avertissements et précautions
Avant d’utiliser KYLEENA, adressez-vous à votre professionnel de santé si :
· vous avez un diabète. En général, il n’est pas nécessaire de modifier votre traitement pour le diabète lors de l’utilisation de KYLEENA, mais votre professionnel de santé devra peut-être s’en assurer ;
· vous êtes épileptique : une crise d’épilepsie pourrait se produire lors de la mise en place ou du retrait de KYLEENA ;
· vous avez déjà eu une grossesse qui se développe à l’extérieur de l’utérus (grossesse extra-utérine) ;
· vous avez des migraines qui s’accompagnent de troubles de la vision, comme une perte soudaine de la vision dans un œil, ou qui provoquent d’autres problèmes (migraines avec aura) ou si vous avez un autre type de maux de tête sévères d’origine inconnue ;
· vous avez une jaunisse (la peau, les ongles et le blanc des yeux deviennent jaunes) ;
· vous avez une tension artérielle élevée ;
· vous avez déjà eu un accident vasculaire cérébral (AVC) ou une crise cardiaque.
Si vous êtes concernée par l’une des situations ci-dessus (ou en cas de doute), adressez-vous à votre professionnel de santé avant la mise en place de KYLEENA.
Pendant l’utilisation de KYLEENA, adressez-vous immédiatement à votre professionnel de santé si :
· vous présentez des signes de grossesse ou vous avez fait un test de grossesse et qu’il est positif. Voir la rubrique « Grossesse, allaitement et fertilité » ci-dessous ;
· vous présentez des signes de grossesse mais aussi des douleurs, des saignements au niveau du vagin ou des vertiges. Cela pourrait signifier que vous avez une grossesse qui se développe à l’extérieur de l’utérus. Voir « Grossesse à l’extérieur de l’utérus » dans la rubrique 4 ;
· vous avez des maux d’estomac, de la fièvre, des pertes vaginales inhabituelles ou des douleurs pendant les rapports sexuels. Cela pourrait signifier que vous avez une infection et que vous devez recevoir un traitement rapidement. Voir « Infection pelvienne » dans la rubrique 4 ;
· vous ressentez des douleurs pendant les rapports sexuels. Une petite poche remplie de liquide (kyste) pourrait s’être formée dans votre ovaire. Voir « Kyste ovarien » dans la rubrique 4 ;
· vous ressentez une douleur intense, vous avez des saignements très abondants ou ne sentez plus les fils de KYLEENA. Vous pourriez avoir une perforation. Voir « Perforation » dans la rubrique 4.
Adressez-vous immédiatement à votre professionnel de santé si vous avez l’un des symptômes ci-dessus.
Parlez aussi de votre dispositif KYLEENA avec votre professionnel de santé si :
· vous avez une migraine ou des maux de tête très intenses pour la première fois ;
· vous remarquez que votre peau, vos ongles et le blanc de vos yeux deviennent jaunes (signes de jaunisse) ;
· vous remarquez une augmentation de votre tension artérielle ;
· vous avez eu un AVC ou une crise cardiaque.
Votre professionnel de santé décidera si vous pouvez continuer d’utiliser KYLEENA en toute sécurité.
Surveillez les signes indiquant que KYLEENA pourrait ne plus être en place
Les signes indiquant que KYLEENA pourrait ne plus être en place sont les suivants :
· Vous ne sentez plus les fils de KYLEENA dans votre vagin avec le doigt. Voir « Comment vérifier vous-même que KYLEENA est en place » dans la rubrique 3.
· Vous ou votre partenaire sentez l’extrémité inférieure en plastique de KYLEENA. Voir « Comment vérifier vous-même que KYLEENA est en place » dans la rubrique 3.
· Vos règles ont soudainement changé, par exemple : vos règles se sont arrêtées avec KYLEENA, puis sont soudainement réapparues.
Ces signes pourraient indiquer que KYLEENA n’est plus en place (voir « Si KYLEENA n’est plus en place » dans la rubrique 4), ou bien cela pourrait indiquer que vous avez une perforation (voir « Perforation » dans la rubrique 4).
Si vous présentez l’un de ces signes indiquant que KYLEENA n’est plus en place, parlez-en immédiatement à votre professionnel de santé. Vous ne devrez pas avoir de rapports sexuels, sauf si vous utilisez un préservatif ou un diaphragme, jusqu’à ce que votre professionnel de santé ait vérifié qu’il est toujours en place.
Il est possible que votre partenaire sente les fils de KYLEENA pendant les rapports sexuels. Cela ne veut pas dire qu’il n’est plus en place. Cependant, si cela gêne votre partenaire de sentir les fils, votre professionnel de santé pourra faire quelque chose pour vous aider.
Protections hygiéniques pour les règles
Si vous avez vos règles, il est préférable d’utiliser des serviettes hygiéniques. Si vous utilisez des tampons ou une coupe menstruelle, faites attention en les retirant. Sinon, vous pourriez accidentellement tirer sur les fils de KYLEENA. Si vous pensez l’avoir retiré (voir la liste ci-dessus pour les signes possibles), vous ne devrez pas avoir de rapports sexuels, sauf si vous utilisez un préservatif ou un diaphragme, jusqu’à ce que vous ayez vu votre professionnel de santé.
Problèmes de santé mentale :
Certaines femmes qui utilisent des contraceptifs hormonaux, y compris KYLEENA ont connu une dépression ou un état dépressif. Voir « Problèmes de santé mentale » dans la rubrique 4 pour plus d’informations.
Enfants et adolescents
Les filles qui n’ont pas encore leurs règles ne doivent pas utiliser KYLEENA.
Autres médicaments et KYLEENA 19,5 mg, système de diffusion intra-utérin
Informez votre professionnel de santé si vous prenez, avez récemment pris ou pourriez commencer à prendre tout autre médicament, même s’il s’agit d’un médicament obtenu sans ordonnance.
KYLEENA 19,5 mg, système de diffusion intra-utérin avec des aliments et des boissons
Sans objet.
Grossesse, allaitement et fertilité
Grossesse
KYLEENA ne doit pas être mis en place pendant la grossesse.
Si vous n’avez plus vos règles pendant l’utilisation de KYLEENA
Certaines femmes n’ont plus leurs règles pendant l’utilisation de KYLEENA. Si vous n’avez plus vos règles, c’est probablement dû à KYLEENA. Pour en savoir plus à ce sujet, voir « Règles irrégulières ou peu fréquentes » dans la rubrique 4.
Vous n’avez pas eu vos règles depuis 6 semaines ? Dans ce cas, vous pouvez faire un test de grossesse. Si le test dit que vous n’êtes pas enceinte, il n’est pas nécessaire d’en refaire un.
Si vous ressentez les symptômes d’une grossesse
Si vous présentez des signes de grossesse, tels qu’un arrêt des règles, des nausées et une sensibilité des seins, vous devez :
1. faire un test de grossesse ;
2. contacter votre professionnel de santé pour qu’il/elle vous examine.
Si vous débutez une grossesse
Si vous débutez une grossesse avec KYLEENA, consultez immédiatement votre professionnel de santé. Il/elle retirera KYLEENA.
Il existe un risque de fausse-couche lors du retrait de KYLEENA. Cependant, si vous continuez votre grossesse en gardant KYLEENA, vous aurez un plus grand risque de :
· fausse-couche
· naissance prématurée du bébé
Discutez avec votre professionnel de santé des bénéfices et des risques liés à la poursuite de la grossesse en laissant KYLEENA en place. Votre professionnel de santé vous surveillera étroitement. Vous devez contacter immédiatement votre professionnel de santé si vous ressentez :
· des crampes d'estomac,
· des douleurs à l'estomac
· de la fièvre.
KYLEENA contient une hormone, appelée lévonorgestrel. Demandez à votre professionnel de santé de vous expliquer quels effets l’hormone pourrait avoir sur votre bébé en cours de développement. Dans de très rares cas, des effets des dispositifs au lévonorgestrel sur les organes génitaux de bébés filles dans l’utérus ont été signalés.
Demandez conseil à votre professionnel de santé avant de prendre tout médicament.
Grossesse à l’extérieur de l’utérus
Le risque qu’une grossesse survienne avec KYLEENA est très faible. Cependant, si vous débutez une grossesse pendant l’utilisation de KYLEENA, le risque que l’ovule fécondé ne soit pas dans votre utérus mais dans votre trompe de Fallope ou votre cavité abdominale (grossesse extra-utérine) est plus important. Ce type de grossesse est une situation grave et nécessite une prise en charge médicale immédiate. Après une grossesse extra-utérine, il peut être plus difficile d’être à nouveau enceinte. Voir « Grossesse à l’extérieur de l’utérus » dans la rubrique 4.
Allaitement
Vous pouvez utiliser KYLEENA pendant l’allaitement. Une faible quantité de l’hormone se retrouve dans le lait maternel. Cependant, il est improbable que KYLEENA ait un effet sur la qualité ou la quantité du lait maternel ou sur la croissance et le développement du bébé allaité.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Fertilité
Si vous voulez être enceinte, vous devez contacter votre professionnel de santé pour que KYLEENA soit retiré.
Une fois retiré, KYLEENA n’a pas d’effet sur la fertilité. Demandez conseil à votre médecin ou à votre professionnel de santé avant de prendre tout médicament.
Conduite de véhicules et utilisation de machines
KYLEENA n’a aucun effet connu sur l’aptitude à conduire des véhicules et à utiliser des machines.
3. COMMENT UTILISER KYLEENA 19,5 mg, système de diffusion intra-utérin ?
Commencer à utiliser KYLEENA
· Avant d’insérer KYLEENA, il faut s’assurer que vous n’êtes pas enceinte.
· KYLEENA doit être inséré dans les 7 jours suivant le début de vos règles. Lorsqu’il est inséré pendant cette période, il fonctionne immédiatement et vous protégera d’une grossesse.
· Si KYLEENA ne peut pas être inséré 7 jours après le début de vos règles ou si vos règles sont irrégulières, alors il peut être inséré à n'importe quel autre moment. Dans ce cas, vous ne devez pas avoir eu de rapport sexuel non protégé depuis vos dernières règles et vous devez avoir un test de grossesse négatif avant l’insertion. De plus, KYLEENA ne peut pas empêcher une grossesse immédiatement et de manière fiable. Donc, vous devez utiliser une méthode de contraception barrière (telle que des préservatifs) ou éviter les rapports sexuels vaginaux pendant 7 jours après son insertion.
· KYLEENA n’est pas une méthode de contraception d’urgence comme la pilule du lendemain.
Commencer à utiliser KYLEENA après un accouchement
· KYLEENA peut être inséré après un accouchement une fois que l’utérus a retrouvé sa taille normale mais pas avant 6 semaines après l’accouchement (voir « Perforation » dans la rubrique 4).
· Voir également « Commencer à utiliser KYLEENA » ci-dessus pour en savoir davantage sur le moment de l’insertion.
Commencer à utiliser KYLEENA après un avortement
KYLEENA peut être inséré immédiatement après un avortement qui s’est déroulé au cours des 3 premiers mois de grossesse si vous n’avez pas d’infection au niveau de vos organes génitaux. Il fonctionnera alors immédiatement.
Commencer à utiliser un nouveau KYLEENA lorsque le dispositif actuel doit être remplacé
KYLEENA peut être remplacé par un nouveau KYLEENA à tout moment de votre cycle menstruel. Il fonctionnera alors immédiatement.
Relai après une autre méthode contraceptive (comme les contraceptifs hormonaux combinés, implant)
· KYLEENA peut être inséré immédiatement s'il est raisonnablement certain que vous n'êtes pas enceinte.
· Si plus de 7 jours se sont écoulés depuis le début de vos règles, vous devez éviter les rapports sexuels vaginaux ou utiliser une protection contraceptive supplémentaire pendant les 7 jours suivants.
Comment se passe la mise en place de KYLEENA ?
Examen avant la mise en place
Parfois, votre professionnel de santé pourra juger nécessaire de faire certains examens avant de mettre en place KYLEENA, par exemple:
· un examen des cellules du col de l’utérus (frottis cervical) ;
· un examen des seins ;
· si nécessaire, d’autres tests, par exemple pour dépister les maladies sexuellement transmissibles.
Mise en place de KYLEENA
D’abord, le professionnel de santé examinera la taille de votre utérus et sa position exacte dans votre abdomen (examen pelvien).
Le professionnel de santé introduit un instrument (spéculum) dans votre vagin, et nettoie le col de l’utérus à l’aide d’un liquide antiseptique. Parfois, le professionnel de santé applique un anesthésiant local sur le col de l’utérus. Le professionnel de santé place ensuite KYLEENA dans votre utérus à l’aide d’un fin tube flexible en plastique (le tube inserteur).
Parfois, la mise en place de KYLEENA peut être inconfortable. Certaines femmes ressentent des vertiges ou s’évanouissent.
Vous pourriez ressentir une douleur ou avoir des saignements au niveau de votre vagin. Cela n’est pas inhabituel.
Une fois la mise en place terminée, votre professionnel de santé vous donnera une carte : la carte patiente. Sur cette carte, vous pouvez noter la date de votre prochain rendez-vous de contrôle de KYLEENA. Apportez cette carte à tous les rendez-vous.
Contrôles après la mise en place
Vous devez faire contrôler votre KYLEENA par un professionnel de santé 4 à 6 semaines après sa mise en place. Votre professionnel de santé décidera à quelle fréquence vous devrez ensuite revenir pour les visites de contrôle. Vous devrez revenir faire contrôler votre KYLEENA au moins une fois par an.
Apportez la carte patiente à tous les rendez-vous.
Comment vérifier vous-même que KYLEENA est en place
Vous pouvez le vérifier en introduisant délicatement un doigt dans votre vagin. Vous devriez alors sentir les fils au fond de votre vagin, près du col de l’utérus. Le col de l’utérus est l’entrée de l’utérus. Remarque : ne tirez pas sur les fils car vous pourriez accidentellement faire sortir KYLEENA.
· Si vous ne sentez pas les fils, vous devez voir votre professionnel de santé pour qu’il/elle vérifie si KYLEENA est toujours à sa place. Vous ne devez pas avoir de rapports sexuels, sauf si vous utilisez un préservatif ou un diaphragme, jusqu’à ce que vous ayez vu votre professionnel de santé.
· Si vous ou votre partenaire sentez l’extrémité inférieure en plastique de KYLEENA, c’est que KYLEENA n’est pas à sa place. Consultez immédiatement votre professionnel de santé. Vous ne devez pas avoir de rapports sexuels jusqu’à ce que vous ayez vu votre professionnel de santé, sauf si vous utilisez un préservatif ou un diaphragme.
Retrait de KYLEENA
KYLEENA agit pendant 5 ans maximum. Il doit être retiré au bout de 5 ans, mais il peut aussi être retiré à tout moment avant la fin des 5 ans. Votre professionnel de santé le retirera. Une fois retiré, vous pouvez à nouveau être enceinte.
Le retrait de KYLEENA peut être un peu inconfortable. Certaines femmes ressentent des vertiges ou s’évanouissent pendant le retrait ou juste après. Vous pourriez aussi ressentir une légère douleur ou avoir des saignements au niveau du vagin. Ce n’est pas inhabituel.
Poursuite de la contraception après le retrait
Si vous ne voulez pas être enceinte après le retrait de KYLEENA, vous devez savoir que :
· KYLEENA doit être retiré idéalement dans les 7 premiers jours après le début des règles. S’il est retiré en dehors de vos règles, vous devez utiliser un préservatif ou un diaphragme au cours des rapports sexuels pendant 7 jours avant son retrait.
· Si vous avez des règles irrégulières ou si vous n’avez plus du tout de règles, vous devez utiliser un préservatif ou un diaphragme au cours des rapports sexuels pendant 7 jours avant le retrait de KYLEENA. On parle de règles irrégulières quand le nombre de jours entre les cycles menstruels n’est pas toujours le même.
· Il est également possible d’insérer un nouveau KYLEENA immédiatement après le retrait de l’ancien, auquel cas aucune mesure contraceptive supplémentaire n'est nécessaire. Si vous ne souhaitez pas continuer à utiliser la même méthode, demandez conseil à votre professionnel de santé sur les autres méthodes contraceptives fiables.
Si vous avez utilisé plus de KYLEENA 19,5 mg, système de diffusion intra-utérin que vous n’auriez dû :
Sans objet.
Si vous oubliez d’utiliser KYLEENA 19,5 mg, système de diffusion intra-utérin :
Sans objet.
Si vous arrêtez d’utiliser KYLEENA 19,5 mg, système de diffusion intra-utérin :
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Effets indésirables graves
Certains effets indésirables peuvent être graves, ce qui signifie que vous devez en parler immédiatement à votre professionnel de santé si vous les ressentez :
· des maux d’estomac, de la fièvre, des pertes inhabituelles, un saignement anormal au niveau du vagin, ou des douleurs pendant les rapports sexuels. Il pourrait s’agir d’une infection de l’utérus, des trompes de Fallope ou des ovaires. Voir « Infection pelvienne » ci-dessous.
· une douleur intense comparable aux douleurs des règles, une douleur plus importante qu’attendu ou un saignement très abondant au niveau du vagin après la mise en place. Ou si vous avez des douleurs ou des saignements qui durent plus de quelques semaines, des modifications soudaines de vos cycles menstruels, des douleurs pendant les rapports sexuels, ou si vous ne sentez plus les fils de KYLEENA. Il pourrait s’agir de signes d’une perforation. Voir « Perforation » ci-dessous.
· un arrêt de vos règles, mais vous avez ensuite eu des saignements ininterrompus au niveau de votre vagin, ou des douleurs intenses et persistantes dans le bas du ventre. Il pourrait s’agir de signes d’une grossesse qui se développe à l’extérieur de l’utérus. Voir « Grossesse à l’extérieur de l’utérus » ci-dessous.
· des changements d’humeur et des symptômes dépressifs. Voir « Problèmes de santé mentale » ci-dessous.
· une réaction allergique, telle qu’une éruption cutanée, de l’urticaire, ou un gonflement de la langue, des lèvres, du visage ou de la gorge. Ce type de réaction est très rare.
Si vous pensez ressentir l’un des effets indésirables ci-dessus, parlez-en immédiatement à votre professionnel de santé.
Autres effets indésirables
Les autres effets indésirables que vous pourriez ressentir sont présentés ci-dessous. Les effets indésirables les plus fréquents sont présentés en haut de la liste et les moins fréquents en bas de la liste.
Effets indésirables très fréquents : pouvant toucher plus d’1 personne sur 10
· maux de tête
· douleur abdominale ou douleur pelvienne
· boutons (acné) ou peau grasse
· modifications des règles, par exemple :
o saignements plus importants ou moins importants que d’habitude,
o saignements ou petites pertes de sang (spotting) en dehors des règles,
o règles irrégulières ou peu fréquentes
o plus de règles du tout
Pour en savoir plus à ce sujet, voir « Règles irrégulières ou peu fréquentes » ci-dessous
· petite poche remplie de liquide sur un ovaire (kyste ovarien). Pour en savoir plus à ce sujet, voir « Kyste ovarien » ci-dessous.
· inflammation des lèvres génitales et du vagin (vulvo‑vaginite)
Effets indésirables fréquents : pouvant toucher jusqu’à 1 personne sur 10
· diminution du désir sexuel (baisse de la libido)
· migraine
· vertiges
· envie de vomir (nausées)
· chute de cheveux
· douleurs pendant les règles
· douleur ou sensibilité au niveau des seins
· expulsion spontanée de KYLEENA (complète ou partielle). Pour en savoir plus à ce sujet, voir « Si KYLEENA n’est plus en place » ci-dessous
· pertes vaginales
· prise de poids
Effets indésirables peu fréquents : pouvant toucher jusqu’à 1 personne sur 100
· augmentation de la pilosité corporelle
Description de certains effets indésirables éventuels :
Grossesse à l’extérieur de l’utérus
Les signes d’une grossesse qui se développe à l’extérieur de l’utérus comprennent :
· vos règles se sont arrêtées, mais des saignements réapparaissent au niveau de votre vagin et ne s’arrêtent pas
· vous avez des douleurs intenses ou persistantes dans le bas du ventre
· vous présentez les signes habituels d’une grossesse, par exemple des nausées ou une sensibilité des seins, mais aussi des saignements au niveau du vagin et des vertiges
· vous avez fait un test de grossesse et le résultat est positif
Vous devez voir immédiatement votre professionnel de santé si vous présentez l’un de ces symptômes.
Il est très peu probable qu’une grossesse survienne avec KYLEENA. Cependant, si vous débutez une grossesse pendant l’utilisation de KYLEENA, le risque que l’ovule fécondé ne soit pas dans votre utérus mais dans votre trompe de Fallope ou votre cavité abdominale (grossesse extra-utérine) est plus important. Chaque année, environ 2 femmes sur 1 000 utilisant KYLEENA connaîtront une grossesse extra-utérine. Ce type de grossesse est une situation grave et nécessite une prise en charge médicale immédiate. Vous pourriez avoir besoin d’une opération chirurgicale.
Le risque de grossesse extra-utérine est plus important chez certaines femmes, notamment celles qui :
· ont déjà connu une grossesse extra-utérine auparavant
· ont été opérées au niveau des trompes de Fallope
· ont eu une infection pelvienne
Règles irrégulières ou peu fréquentes
Il est probable que KYLEENA modifie vos règles, par exemple :
· vous pourriez avoir de légers saignements en dehors des règles. Ces saignements sont appelés spottings.
· vos règles pourraient être moins régulières. Cela signifie que le nombre de jours entre vos règles n’est pas toujours le même.
· vos règles pourraient durer plus longtemps ou moins longtemps.
· les pertes de sang pendant vos règles pourraient être plus importantes ou moins importantes que d’habitude.
· vous pourriez ne plus avoir de règles du tout.
Parfois, ces modifications ont lieu seulement pendant les premiers mois après la mise en place, par exemple :
· les saignements en dehors des règles ou les spottings sont les plus fréquents pendant les 3 à 6 premiers mois.
· au début, certaines femmes ont des règles plus abondantes que d’habitude.
Vos pertes de sang pourraient diminuer progressivement chaque mois et vos règles pourraient durer moins longtemps. Chez certaines femmes, les règles peuvent finir par disparaître complètement.
Vous n’avez plus vos règles ? C’est habituellement normal. La plupart du temps, cela ne signifie pas que vous êtes enceinte ou que vous avez commencé votre ménopause. Voici l’explication : normalement, la muqueuse de votre utérus s’épaissit chaque mois pour préparer une grossesse, puis redevient plus fine quand vous avez vos règles. KYLEENA réduit l’épaississement de la muqueuse utérine, ce qui peut faire disparaître les règles. Généralement vos taux d’hormones restent normaux.
Une fois KYLEENA retiré, les règles reviennent habituellement à la normale. Si ce n’est pas le cas, contactez votre professionnel de santé.
Infection pelvienne
KYLEENA, tout comme son inserteur, ne contiennent pas de bactéries, de virus ou de champignons (ils sont stériles). Une infection pelvienne peut néanmoins survenir pendant la mise en place de KYLEENA ou dans les 3 premières semaines après sa mise en place, par exemple au niveau de la muqueuse de l’utérus, des trompes de Fallope ou des ovaires. Ces infections peuvent toucher jusqu’à 1 personne sur 10.
Vous pourriez alors avoir :
· des maux d’estomac
· de la fièvre
· des pertes inhabituelles au niveau du vagin
· des douleurs pendant les rapports sexuels
Le risque d’infection pelvienne est plus important si :
· vous avez une maladie sexuellement transmissible
· vous ou votre partenaire avez des partenaires sexuels multiples
· vous avez déjà eu une infection pelvienne auparavant
En cas d’infection pelvienne, il est important de consulter immédiatement un médecin. L’infection pelvienne peut entraîner :
· des problèmes de fertilité par la suite. Cela pourrait signifier qu’il vous sera plus difficile d’être enceinte.
· une grossesse qui se développe à l’extérieur de l’utérus (grossesse extra-utérine) si vous êtes enceinte
· une infection sévère ou un empoisonnement du sang (septicémie). Cet événement est très rare et survient peu après la mise en place de KYLEENA. L’empoisonnement du sang signifie que vous êtes très malade à cause d’une infection. L’empoisonnement du sang peut être fatal s’il n’est pas traité.
KYLEENA doit être retiré si l’infection pelvienne :
· réapparaît plusieurs fois
· est très grave
· ne disparaît pas avec le traitement
Si KYLEENA n’est plus en place
KYLEENA pourrait être délogé ou expulsé à cause des contractions des muscles de votre utérus pendant les règles. Cela peut toucher jusqu’à 1 personne sur 10, en particulier si :
· vous êtes en surpoids lors de la mise en place de KYLEENA
· vous avez déjà eu des règles abondantes auparavant
Si KYLEENA n’est plus en place, il risque de ne plus agir correctement. Le risque de grossesse est alors plus important. S’il a été expulsé, il ne vous empêchera plus de débuter une grossesse.
Si KYLEENA est déplacé ou a été expulsé, vous pourriez avoir des douleurs ou des saignements au niveau du vagin différents de d’habitude. Il est aussi possible que KYLEENA soit expulsé sans que vous vous en aperceviez.
KYLEENA diminue habituellement la quantité de sang perdue pendant les règles.
Plus vous l’utilisez pendant longtemps, moins vous perdrez de sang pendant les règles. Aussi, si vous recommencez soudainement à perdre plus de sang pendant vos règles, KYLEENA pourrait avoir été expulsé. Voir « Comment vérifier vous-même que KYLEENA est en place » dans la rubrique 3 pour savoir comment faire cette vérification et ce que vous devez faire si vous suspectez qu’il n’est plus en place.
Perforation
Il peut arriver que KYLEENA pénètre dans la paroi de l’utérus ou même qu’il la traverse. Cela s’appelle une perforation. Une perforation survient habituellement au moment où KYLEENA est mis en place. Une perforation ne fait pas toujours mal et vous pourriez donc ne vous en apercevoir que plus tard. S’il n’est plus à sa place à cause d’une perforation, il n’agit plus pour empêcher une grossesse. Un médecin doit alors le retirer dès que possible. Parfois, une opération chirurgicale est nécessaire. La perforation peut toucher jusqu’à 1 personne sur 1 000. Le risque de perforation est plus important (jusqu’à 1 personne sur 100) si :
· vous allaitez au moment de la mise en place de KYLEENA
· vous avez eu un enfant dans les 9 derniers mois avant la mise en place de KYLEENA
Vous pourriez avoir une perforation si :
· vous ressentez une douleur intense qui ressemble aux douleurs des règles ou des douleurs plus importantes qu’attendu
· vous avez des saignements très abondants au niveau du vagin après la mise en place
· vous avez des douleurs ou des saignements qui durent plus de quelques semaines
· vous observez des modifications soudaines de vos cycles menstruels
· vous ressentez des douleurs pendant les rapports sexuels
· vous ne sentez plus les fils de KYLEENA
Si vous pensez que vous avez peut-être une perforation, contactez immédiatement un professionnel de santé. Rappelez-lui que vous avez un KYLEENA, surtout si ce n’est pas la personne qui l’a mis en place.
Kyste ovarien
Parfois, avec KYLEENA, une petite poche de liquide peut se former sur un ovaire. Cette poche est appelée kyste ovarien.
Les signes d’un kyste ovarien peuvent être :
· une douleur dans la région pelvienne
· une douleur ou une sensation d’inconfort pendant les rapports sexuels
Habituellement, les kystes ovariens disparaissent d’eux-mêmes. Cependant, ils pourraient nécessiter une prise en charge médicale. Dans de rares cas, une opération chirurgicale peut être nécessaire. Si vous pensez que vous pourriez avoir un kyste ovarien, contactez votre professionnel de santé.
Problèmes de santé mentale
Certaines femmes utilisant des contraceptifs hormonaux, y compris KYLEENA, peuvent connaître une dépression ou un état dépressif.
La dépression peut être grave et peut parfois conduire à des pensées suicidaires. Si vous avez des changements d’humeur et des symptômes dépressifs, contactez votre professionnel de santé dès que possible. La dépression et l’état dépressif peuvent toucher jusqu’à 1 personne sur 100 utilisant KYLEENA.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre professionnel de santé. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER KYLEENA 19,5 mg, système de diffusion intra-utérin ?
Ce médicament ne nécessite pas de précautions particulières de conservation.
Tenir ce médicament hors de la vue et de la portée des enfants.
N’ouvrez pas l’emballage thermoformé (le récipient en plastique qui contient KYLEENA). Seul votre professionnel de santé doit s’en charger.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient KYLEENA 19,5 mg, système de diffusion intra-utérin
· La substance active est :
Lévonorgestrel ................19,5 mg
Pour un système.
· Les autres composants sont :
o élastomère polydiméthylsiloxane
o silice colloïdale anhydre
o polyéthylène
o sulfate de baryum
o polypropylène
o phthalocyanine de cuivre
o argent.
Qu’est-ce que KYLEENA 19,5 mg, système de diffusion intra-utérin et contenu de l’emballage extérieur
KYLEENA est un stérilet hormonal (système de diffusion placé dans l’utérus). Il a la forme de la lettre T et il est blanc. Sur la tige verticale se trouve un petit réservoir qui contient l’hormone lévonorgestrel. Deux fils bleus sont fixés sur la boucle, en bas. Ils permettent au professionnel de santé de retirer KYLEENA. Sur la tige, il y a aussi un anneau d’argent, près des bras horizontaux de KYLEENA. Votre professionnel de santé peut voir cet anneau au cours d’une échographie.
Boîte de 1 ou 5 systèmes de diffusion intra-utérins.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
1 RUE CLAUDE BERNARD
59000 LILLE
Exploitant de l’autorisation de mise sur le marché
BAYER HEALTHCARE SAS
1 RUE CLAUDE BERNARD
59000 LILLE
PANSIONTIE 47
20210 TURKU
FINLANDE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Des informations détaillées et mises à jour sur ce médicament sont disponibles en scannant le QR Code apposé sur la notice, l’étui carton et la carte patiente à l’aide d’un smartphone. Ces informations sont également disponibles via le lien suivant : www.pi.bayer.com/kyleena/fr et sur le site Internet de l’ANSM (France) : www.ansm.sante.fr.
{QR code renvoyant vers la Notice patiente}
Les informations suivantes sont destinées exclusivement aux professionnels de santé :
INSTRUCTIONS D’INSERTION
KYLEENA 19,5 mg, système de diffusion intra-utérin
Lévonorgestrel.
L’insertion doit être effectuée par un professionnel de santé, dans des conditions d’asepsie.
KYLEENA est conditionné sous emballage stérile, intégré à un inserteur qui permet sa mise en place d’une seule main. L’emballage ne doit être ouvert qu’au moment de l’insertion. Ne pas restériliser. Tel qu’il est fourni, KYLEENA est à usage unique strict. Ne pas l’utiliser si l’emballage thermoformé est endommagé ou ouvert. Ne pas insérer le système après la date de péremption indiquée sur la boîte et sur l’emballage thermoformé après EXP.
Tout médicament non utilisé ou tout déchet doit être éliminé conformément à la réglementation en vigueur.
KYLEENA est fourni avec une carte patiente à l’intérieur de l’étui carton. Remplissez la carte patiente et remettez-la à la patiente après l'insertion.
Préparation à l’insertion
· Examiner la patiente afin d’exclure toute contre-indication à la pose de KYLEENA (voir rubriques 4.3 et 4.4 du RCP sous le paragraphe « Examen médical/ consultation »).
· Placer le spéculum, visualiser le col utérin, puis nettoyer soigneusement le col et le vagin à l’aide d’une solution antiseptique adaptée.
· Faire appel à un assistant si nécessaire.
· Saisir la lèvre antérieure du col utérin à l’aide d’une pince de Pozzi ou d’une autre pince pour aligner le canal cervical et la cavité utérine. Dans le cas d’un utérus rétroversé, il peut être plus adapté de saisir la lèvre postérieure du col utérin. Une légère traction sur la pince permet d’aligner le canal cervical. La pince doit être maintenue en place et une légère traction sur le col doit être exercée pendant toute la durée de la procédure d’insertion.
· Insérer un hystéromètre à travers le canal cervical et jusqu’au fond de la cavité utérine pour déterminer la profondeur et la direction de la cavité utérine et afin d’écarter tout signe d’anomalies intra-utérines (par exemple septum, fibromyomes sous-muqueux) ou la présence d’un contraceptif intra-utérin qui aurait été préalablement posé et n’aurait pas été retiré. En cas de difficulté, il faut envisager la dilatation du canal cervical. Lorsqu’une dilatation cervicale est requise, envisager le recours à des analgésiques ou à un bloc para-cervical.
Insertion
|
1. Commencer par ouvrir entièrement l’emballage stérile (figure 1). Travailler dans des conditions d’asepsie, avec des gants stériles.
|
||
|
2. Pousser le curseur vers l’avant (dans le sens de la flèche) jusqu’au bout afin de faire entrer KYLEENA dans le tube inserteur (figure 2). |
|
|
|
IMPORTANT ! Ne pas ramener le curseur vers le bas car cette action pourrait libérer KYLEENA prématurément. Une fois libéré, KYLEENA ne peut plus être replacé dans le tube inserteur. |
||
|
3. Tout en maintenant le curseur avancé en position haute, positionner le bord supérieur de la bague au niveau de la valeur correspondant à la profondeur utérine mesurée avec l’hystéromètre (figure 3). |
|
|
|
4. Tout en maintenant le curseur en position haute, introduire le tube inserteur dans le canal cervical jusqu’à ce que la bague soit à une distance d’environ 1,5 à 2,0 cm de l’orifice externe du col utérin (figure 4). |
|
|
|
IMPORTANT ! Ne pas forcer lors de l’introduction du tube inserteur. Si nécessaire, dilater le canal cervical. |
||
|
5. Tout en tenant fermement l’inserteur, ramener le curseur jusqu’au repère pour déployer les bras latéraux de KYLEENA (figure 5). Attendre 5 à 10 secondes que les bras latéraux soient totalement déployés.
|
|
|
|
6. Pousser délicatement l’inserteur vers le fond de l’utérus jusqu’à ce que la bague soit au contact du col utérin. KYLEENA est à présent positionné sur le fond utérin (figure 6). |
|
|
|
7. Tout en maintenant l’inserteur en place, ramener complètement le curseur vers le bas pour libérer KYLEENA (figure 7). Retirer le tube inserteur tout en gardant le curseur dans la position basse. Couper les fils à environ 2– 3 cm du col utérin pour les laisser visibles. |
|
|
|
IMPORTANT ! En cas de doute sur le bon positionnement de KYLEENA, vérifier sa position (par exemple par une échographie). En cas de mauvaise position dans la cavité utérine, KYLEENA doit être retiré. Ne jamais réinsérer un système qui a été retiré. |
||
Retrait/remplacement
Concernant le retrait/remplacement du système, voir le Résumé des Caractéristiques du Produit.
|
Pour retirer KYLEENA, tirer délicatement sur les fils avec une pince (figure 8). Un nouveau système KYLEENA peut être inséré immédiatement après le retrait de l’ancien. Après le retrait de KYLEENA, le système doit être inspecté afin de vérifier qu’il est intact et qu’il a été complètement retiré. |
|
{QR code renvoyant vers le Résumé des Caractéristiques du Produit}
Résumé des Caractéristiques du Produit de KYLEENA en ligne sur www.pi.bayer.com/kyleena/fr
Mentions devant figurer sur les autres composants du conditionnement
Carte patiente
Apportez cette carte avec vous lors de toute consultation prévue.
KYLEENA 19,5 mg, système de diffusion intra-utérin
Lévonorgestrel
{QR code renvoyant vers la notice patiente}
www.pi.bayer.com/kyleena/fr
{Nom et adresse du titulaire de l’autorisation de mise sur le marché}
KYLEENA est utilisé pour éviter une grossesse (contraception) pour une durée maximale de cinq ans.
Nom de la patiente : {Nom de la patiente}
Nom et numéro de téléphone du professionnel de santé : {Nom et numéro de téléphone du professionnel de santé}
Date d’insertion : {Date d’insertion}
Date limite de retrait : {Date limite de retrait}
LOT {numéro}
Informations importantes
Les informations importantes disponibles pour ce médicament sont les suivantes :
- Les stérilets contenant le plus d'hormone présenteraient davantage de risque de troubles dépressifs
- Progestatifs et méningiome : pas d'augmentation du risque avec les DIU au lévonorgestrel mais confirmation du risque pour 3 nouvelles substances
- Progestatifs et risque de méningiomes intracrâniens : le BMJ publie une étude épidémiologique française