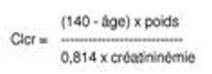Dernière mise à jour le 06/11/2025
TENORETIC 50 mg/12,5 mg, comprimé pelliculé
Présentations
> plaquette(s) thermoformée(s) PVC-Aluminium de 30 comprimé(s)
Code CIP : 372 008-3 ou 34009 372 008 3 7
Déclaration de commercialisation : 16/03/2007
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 5,33 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 6,35 €
- Taux de remboursement :65%
> plaquette(s) thermoformée(s) PVC-Aluminium de 90 comprimé(s)
Code CIP : 372 011-4 ou 34009 372 011 4 8
Déclaration de commercialisation : 24/04/2007
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 15,09 €
- Honoraire de dispensation : 2,76 €
- Prix honoraire compris : 17,85 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 03/02/2016 | Renouvellement d'inscription (CT) | Le service médical rendu par TENORETIC reste important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 28/12/2023
TENORETIC 50 mg/12,5 mg, comprimé pelliculé
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Aténolol.............................................................................................................................. 50,0 mg
Chlortalidone....................................................................................................................... 12,5 mg
Pour un comprimé pelliculé.
Pour la liste complète des excipients, voir rubrique 6.1.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Un comprimé par jour, de préférence le matin.
Cependant dans les cas d'hypertension non contrôlée par cette thérapeutique, une posologie supérieure pourra être nécessaire.
En fonction du contexte clinique, le passage direct d’une monothérapie à l’association fixe peut-être envisagé pour des patients présentant une pression artérielle non contrôlée.
Si nécessaire, l’ajout d’un autre antihypertenseur tel qu’un vasodilatateur peut être administré.
Populations particulières :
Enfants et adolescents de moins de 18 ans :
Il n’y a pas d’expérience chez l’enfant et l’adolescent. En conséquence, TENORETIC ne doit pas être utilisé chez les enfants et adolescents de moins de 18 ans.
Insuffisants rénaux :
En raison des propriétés de chlortalidone, l’efficacité de TENORETIC est réduite en cas d’insuffisance rénale. Cette association fixe ne doit pas être administrée aux patients ayant une insuffisance rénale sévère (voir rubrique 4.3).
Insuffisants hépatiques :
Aucune adaptation posologique n’est nécessaire en cas d’insuffisance hépatique.
Hypersensibilité à l’aténolol ou la chlortalidone ou à l’un des excipients.
Liées à l'aténolol
Ce médicament NE DOIT JAMAIS être utilisé dans les cas suivants :
· Asthme et broncho-pneumopathies chroniques obstructives, dans leurs formes sévères,
· Insuffisance cardiaque non contrôlée par le traitement,
· Choc cardiogénique,
· Blocs auriculo-ventriculaires des second et troisième degrés non appareillés,
· Angor de Prinzmetal (dans les formes pures et en l'absence d'autre traitement)
· Maladie du sinus (y compris bloc sino-auriculaire),
· Bradycardie (< 45-50 contractions par minute),
· Phénomène de Raynaud et troubles artériels périphériques, dans leurs formes sévères,
· Phéochromocytome non traité,
· Acidose métabolique,
· Hypotension,
· Antécédent de réaction anaphylactique.
Liées à la chlortalidone
Ce médicament NE DOIT JAMAIS être utilisé dans les cas suivants :
· Hypersensibilité aux sulfamides,
· Insuffisance rénale sévère,
· Encéphalopathie hépatique.
Ce médicament est généralement déconseillé en cas de grossesse et en cas d'allaitement et en cas d'association au lithium, au vérapamil, au diltiazem, au fingolimod et à l’ozanimod (voir rubrique 4.5).
4.4. Mises en garde spéciales et précautions d'emploi
Mises en garde spéciales Liées à l'aténolol
Liées à la chlortalidone
En cas d'atteinte hépatique, les diurétiques thiazidiques et apparentés peuvent induire une encéphalopathie hépatique. Dans ce cas, l'administration du diurétique doit être immédiatement interrompue.
Précautions d'emploi
Liées à l'aténolol
Arrêt du traitement
Le traitement ne doit pas être interrompu brutalement, en particulier chez les patients présentant une cardiopathie ischémique. La posologie doit être diminuée progressivement, c'est-à-dire idéalement sur une à deux semaines, en commençant en même temps, si nécessaire, le traitement substitutif, pour éviter une aggravation de l'angor.
Asthme et broncho-pneumopathies chroniques obstructives
Il est recommandé de faire pratiquer des épreuves fonctionnelles respiratoires avant et après la mise en route du traitement. En cas d’asthme et de bronchopneumopathie chronique obstructive, les patients ne doivent généralement pas recevoir de bêta-bloquants en raison d’une augmentation de la résistance des voies aériennes.
L’aténolol est un bêta-bloquant beta1-sélectif, cependant cette sélectivité n’est pas absolue. En conséquence, la posologie la plus faible possible devra être utilisée et la plus grande prudence doit être observée. En cas de crise, le traitement par TENORETIC doit être interrompu et un bronchodilatateur peut être administré si nécessaire.
Insuffisance cardiaque
Chez l'insuffisant cardiaque contrôlé par le traitement et en cas de nécessité, l'aténolol sera administré à très faibles doses progressivement croissantes et sous surveillance médicale stricte.
Bêta-bloquants
Les effets systémiques des bêta-bloquants oraux peuvent être potentialisés quand ils sont utilisés de façon concomitante avec des bêta-bloquants ophtalmiques.
Bradycardie
Si la fréquence s'abaisse au-dessous de 50-55 pulsations par minute au repos et que le patient présente des symptômes liés à la bradycardie, la posologie doit être diminuée.
Ischémie
TENORETIC ne doit pas être arrêté brusquement chez les patients souffrant d’une maladie cardiaque de type ischémique.
Bloc auriculo-ventriculaire du premier degré
Etant donné leur effet dromotrope négatif, les bêta-bloquants doivent être administrés avec prudence aux patients présentant un bloc auriculo-ventriculaire du premier degré.
Angor de Prinzmetal
Les bêta-bloquants peuvent augmenter le nombre et la durée des crises chez les patients souffrant d'un angor de Prinzmetal. L'utilisation d'un bêta-bloquant bêta-1 cardiosélectif est possible dans les formes mineures et associées, à condition d'administrer conjointement un vasodilatateur.
Troubles artériels périphériques
Chez les patients souffrant de troubles artériels périphériques (maladie ou syndrome de Raynaud, artérites ou artériopathies chroniques oblitérantes des membres inférieurs), les bêta-bloquants peuvent entraîner une aggravation de ces troubles. Dans ces situations, il convient de privilégier un bêta-bloquant cardiosélectif et doté d'un pouvoir agoniste partiel, que l'on administrera avec prudence.
Phéochromocytome
L'utilisation des bêta-bloquants dans le traitement de l'hypertension due au phéochromocytome traité nécessite une surveillance étroite de la pression artérielle.
Sujet âgé
Chez le sujet âgé, le respect absolu des contre-indications est impératif. On veillera à initier le traitement par une posologie faible et à assurer une surveillance étroite.
Insuffisant rénal
En cas d'insuffisance rénale, il convient d'adapter la posologie à l'état de la fonction rénale: en fonction de la clairance de la créatinine, ou de la créatininémie, ou encore en surveillant le rythme cardiaque, de façon à diminuer les doses s'il apparaît une bradycardie excessive (< 50-55 batt/min au repos).
Sujet diabétique
Prévenir le malade et renforcer en début de traitement l'autosurveillance glycémique. Les signes annonciateurs d'une hypoglycémie peuvent être masqués, en particulier tachycardie, palpitations et sueurs.
Psoriasis
Des aggravations de la maladie ayant été rapportées sous bêta-bloquants, l'indication mérite d'être pesée.
Réactions allergiques
Chez les patients susceptibles de faire une réaction anaphylactique sévère, quelle qu'en soit l'origine, en particulier avec des produits de contraste iodés ou la floctafénine (voir rubrique 4.5) ou au cours de traitements désensibilisants, le traitement bêta-bloquant peut entraîner une aggravation de la réaction et une résistance à son traitement par l'adrénaline aux posologies habituelles.
Anesthésie générale
Les bêta-bloquants vont entraîner une atténuation de la tachycardie réflexe et une augmentation du risque d'hypotension. La poursuite du traitement par bêta-bloquant diminue le risque d'arythmie, d'ischémie myocardique et de poussées hypertensives.
Il convient de prévenir l'anesthésiste que le patient est traité par un bêta-bloquant.
· Si l'arrêt du traitement est jugé nécessaire, une suspension de 48 heures est considérée comme suffisante pour permettre la réapparition de la sensibilité aux catécholamines.
· Dans certains cas le traitement bêta-bloquant ne peut être interrompu :
o chez les malades atteints d'insuffisance coronarienne, il est souhaitable de poursuivre le traitement jusqu'à l'intervention, étant donné le risque lié à l'arrêt brutal des bêta-bloquants;
o en cas d'urgence ou d'impossibilité d'arrêt, le patient doit être protégé d'une prédominance vagale par une prémédication suffisante d'atropine renouvelée selon les besoins. L'anesthésie devra faire appel à des produits aussi peu dépresseurs myocardiques que possible et les pertes sanguines devront être compensées;
o le risque anaphylactique devra être pris en compte.
Thyrotoxicose
Les bêta-bloquants sont susceptibles d'en masquer les signes cardiovasculaires.
Liées à la chlortalidone
· Equilibre hydroélectrolytique
Les électrolytes plasmatiques doivent être dosés à intervalles réguliers afin de détecter un éventuel déséquilibre notamment au niveau de la kaliémie et de la natrémie.
· Natrémie
Elle doit être contrôlée avant la mise en route du traitement, puis à intervalles réguliers par la suite. Tout traitement diurétique peut en effet provoquer une hyponatrémie, aux conséquences parfois graves. La baisse de la natrémie pouvant être initialement asymptomatique, un contrôle régulier est donc indispensable et doit être encore plus fréquent dans les populations à risque représentées par les sujets âgés, a fortiori dénutris, et les cirrhotiques (voir rubriques 4.8 et 4.9).
· Kaliémie
La déplétion potassique avec hypokaliémie constitue le risque majeur des diurétiques thiazidiques et apparentés. Le risque de survenue d'une hypokaliémie (< 3,5 mmol/l) doit être prévenu dans certaines populations à risque représentées par les sujets âgés et/ou dénutris et/ou polymédiqués, les cirrhotiques avec œdèmes et ascite, les coronariens, les insuffisants cardiaques. L'hypokaliémie majore la toxicité cardiaque des digitaliques et le risque de troubles du rythme.
Chez les patients présentant un espace QT long à l'ECG, d'origine congénitale ou médicamenteuse, l'hypokaliémie favorise la survenue de troubles du rythme sévères, en particulier des torsades de pointes, potentiellement fatales, surtout en présence d'une bradycardie.
Dans tous les cas, des contrôles plus fréquents de la kaliémie sont nécessaires. Le premier contrôle du potassium plasmatique doit être effectué au cours de la semaine qui suit la mise en route du traitement.
· Calcémie
Les diurétiques thiazidiques et apparentés peuvent diminuer l'excrétion urinaire du calcium et entraîner une augmentation légère et souvent transitoire de la calcémie. Une hypercalcémie franche peut être en rapport avec une hyperparathyroïdie méconnue. Dans ce cas, interrompre le traitement avant d'explorer la fonction parathyroïdienne.
· Glycémie
Il importe, chez le diabétique, de contrôler la glycémie notamment en présence d'hypokaliémie. Le contrôle de la glycosurie sera effectué à intervalles réguliers lors de la poursuite du traitement. La chlortalidone peut entraîner une diminuation de la tolérance au glucose. Il est important d’informer les patients diabétiques d’une éventuelle augmentation de leur glycémie.
· Uricémie
Des cas d’hyperuricémie peuvent survenir. En général, seule une augmentation mineure de l’acide urique est observée. Cependant, en cas d’augmentation prolongée, le recours à un agent uricosurique pourra être nécessaire. Chez les patients hyperuricémiques, la tendance aux accès de goutte peut être augmentée : la posologie sera alors adaptée en fonction des concentrations plasmatiques d'acide urique.
· Fonction hépatique
Chez les patients ayant une insuffisance hépatique ou une maladie dégénérative du foie, des changements mineurs de l’équilibre hydro-électrolytique peuvent déclencher l’apparition d’un coma hépatique.
· Fonction rénale et diurétique
Les diurétiques thiazidiques ne sont pleinement efficaces que lorsque la fonction rénale est normale ou peu altérée (créatininémie inférieure à des valeurs de l'ordre de 25 mg/l, soit 220 µmol/l pour un adulte). Chez le patient âgé, la valeur de la clairance de la créatinine doit être réajustée en fonction de l'âge, du poids et du sexe, selon la formule de Cockroft*, par exemple :
(avec l'âge exprimé en années, le poids en kg, la créatininémie en micromole/l).
Cette formule est valable pour les sujets âgés de sexe masculin, et doit être corrigée pour les femmes en multipliant le résultat par 0,85.
L'hypovolémie, secondaire à la perte d'eau et de sodium induite par le diurétique en début de traitement, entraîne une réduction de la filtration glomérulaire. Il peut en résulter une augmentation de l'urée sanguine et de la créatininémie.
Cette insuffisance rénale fonctionnelle transitoire est sans conséquence chez le sujet à fonction rénale normale mais peut aggraver une insuffisance rénale préexistante.
Épanchement choroïdien, myopie aiguë et glaucome aigu secondaire à angle fermé
Les sulfonamides ou leurs dérivés peuvent provoquer une réaction idiosyncratique qui peut conduire à un épanchement choroïdien avec anomalie du champ visuel, à une myopie transitoire et à un glaucome aigu à angle fermé. Les symptômes qui incluent une apparition soudaine de la diminution de l’acuité visuelle ou des douleurs oculaires surviennent en général quelques heures ou quelques semaines après l’initiation du traitement. Un glaucome aigu à angle fermé non traité peut conduire à la perte définitive de la vision.
Le premier traitement consiste à arrêter aussi rapidement que possible l’hydrochlorothiazide. Des mesures médicales ou chirurgicales doivent être envisagées si la pression intraoculaire demeure non contrôlée. Les facteurs de risque de développer un glaucome aigu à angle fermé pourraient inclure des antécédents d’allergie à la penicilline ou aux sulfonamides.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Associations déconseillées
+ Diltiazem et vérapamil
Troubles de l’automatisme (bradycardie excessive, arrêt sinusal), troubles de la conduction sino- auriculaire et auriculoventriculaire et défaillance cardiaque. Une telle association ne doit se faire que sous surveillance clinique et ECG étroite, en particulier chez le sujet âgé ou en début de traitement.
+ Fingolimod
Potentialisation des effets bradycardisants pouvant avoir des conséquences fatales. Les bêtabloquants sont d’autant plus à risque qu’ils empêchent les mécanismes de compensation adrénergique.
Surveillance clinique et ECG continu pendant les 24 heures suivant la première dose.
+ Ozanimod
Potentialisation des effets bradycardisants pouvant avoir des conséquences fatales. Les bêtabloquants sont d’autant plus à risque qu’ils empêchent les mécanismes de compensation adrénergique.
Surveillance clinique et ECG continu pendant au moins 6 heures.
Associations faisant l'objet de précautions d’emploi
+ Amiodarone
Troubles de l'automatisme et de la conduction (suppression des mécanismes sympathiques compensateurs).
Surveillance clinique et ECG.
+ Anesthésiques volatils halogénés
Réduction des réactions cardiovasculaires de compensation par les bêta-bloquants. L'inhibition bêta- adrénergique peut être levée durant l'intervention par les bêta-mimétiques. En règle générale, ne pas arrêter le traitement bêta-bloquant et, de toute façon, éviter l'arrêt brutal. Informer l'anesthésiste de ce traitement.
+ Antihypertenseurs centraux
Augmentation importante de la pression artérielle en cas d’arrêt brutal du traitement par l’antihypertenseur central. Eviter l’arrêt brutal du traitement par l’antihypertenseur central. Surveillance clinique.
+ Propafénone
Troubles de la contractilité, de l’automatisme et de la conduction (suppression des mécanismes sympathiques compensateurs). Surveillance attentive clinique et ECG.
+ Insuline, sulfamides hypoglycémiants
Tous les bêta-bloquants peuvent masquer certains symptômes de l'hypoglycémie : palpitations et tachycardie. Prévenir le patient et renforcer, surtout en début du traitement, l'autosurveillance glycémique.
+ Lidocaïne (avec la lidocaïne utilisée par voie IV)
Augmentation des concentrations plasmatiques de lidocaïne avec possibilité d’effets indésirables neurologiques et cardiaques (diminution de la clairance hépatique de la lidocaïne). Surveillance clinique, ECG et, éventuellement, contrôle des concentrations plasmatiques de lidocaïne pendant l’association et après l’arrêt du bêta-bloquant. Adaptation si besoin de la posologie de la lidocaïne.
+ Topiques gastro-intestinaux, antiacides et adsorbants
Diminution de l'absorption digestive du bêta-bloquant. Prendre les topiques gastro-intestinaux et antiacides à distance du bêta-bloquant (plus de 2 heures si possible).
+ Antiarythmiques classe I (sauf lidocaïne)
Troubles de la contractilité, de l'automatisme et de la conduction (suppression des mécanismes sympathiques compensateurs). Surveillance attentive clinique et ECG.
+ Bêta-bloquants dans l’insuffisance cardiaque
Tous les bêta-bloquants peuvent masquer certains symptômes de l’hypoglycémie : palpitations et tachycardie. Prévenir le patient et renforcer, surtout en début de traitement, l’autosurveillance glycémique.
Associations à prendre en compte
+ Dihydropyridines
Hypotension, défaillance cardiaque chez les patients en insuffisance cardiaque latente ou non contrôlée (addition des effets inotropes négatifs). Le bêta-bloquant peut par ailleurs minimiser la réaction sympathique réflexe mise en jeu en cas de répercussion hémodynamique excessive.
+ Dipyridamole (avec le dipyridamole IV)
Majoration de l’effet antihypertenseur.
+ Autres bradycardisants
Risque de bradycardie excessive (addition des effets).
+ Pilocarpine
Risque de bradycardie excessive (addition des effets).
Liées à la chlortalidone
Associations déconseillées
+ Lithium
Augmentation de la lithémie avec signes de surdosage, comme lors d'un régime désodé (diminution de l'excrétion urinaire du lithium). Si l’association ne peut être évitée, surveillance stricte de la lithémie et adaptation de la posologie du lithium.
Associations faisant l'objet de précautions d’emploi
+ Acide acétylsalicylique
Pour des doses anti-inflammatoires d’acide acétylsalicylique (> 1 g par prise et/ou > 3 g par jour) ou pour des doses antalgiques ou antipyrétiques (> 500 mg par prise et/ou < 3 g par jour).
Insuffisance rénale aiguë chez le malade déshydraté, par diminution de la filtration glomérulaire secondaire à une diminution de la synthèse des prostaglandines rénales. Par ailleurs, réduction de l’effet antihypertenseur. Hydrater le malade et surveiller la fonction rénale en début de traitement.
+ Antagonistes des récepteurs de l'angiotensine II
Risque d'hypotension artérielle brutale et/ou d'insuffisance rénale aiguë lors de l'instauration ou de l’augmentation de la posologie d’un traitement par un antagoniste de l’angiotensine II en cas de déplétion hydrosodée préexistante. Dans l'hypertension artérielle, lorsqu'un traitement diurétique préalable a pu entraîner une déplétion hydrosodée, il faut :
· soit arrêter le diurétique avant de débuter le traitement par l’antagoniste de l'angiotensine II et réintroduire un diurétique hypokaliémiant si nécessaire ultérieurement,
· soit administrer des doses initiales réduites d’antagoniste de l'angiotensine II et augmenter progressivement la posologie.
Dans tous les cas, surveiller la fonction rénale (créatininémie) dans les premières semaines du traitement par l’antagoniste de l'angiotensine II.
+ Autres hypokaliémiants (amphotéricine B (voie IV), gluco et minéralocorticoïdes (voie générale), tétracosactide, laxatifs stimulants)
Risque majoré d'hypokaliémie. Surveillance de la kaliémie et si besoin, correction.
+ Carbamazepine
Risque d’hyponatrémie symptomatique. Surveillance clinique et biologique. Si possible, utiliser une autre classe de diurétiques.
+ Digitaliques
Hypokaliémie favorisant les effets toxiques des digitaliques. Corriger auparavant toute hypokaliémie et réaliser une surveillance clinique, électrolytique et électrocardiographique.
+ Diurétiques épargneurs de potassium (seuls ou associés)
L'association rationnelle, utile pour certains patients, n'exclut pas la survenue d'hypokaliémie ou, en particulier chez l'insuffisant rénal et le diabétique, d'hyperkaliémie. Surveiller la kaliémie, éventuellement l'ECG, et, s'il y a lieu, reconsidérer le traitement.
+ Inhibiteurs de l'enzyme de conversion
Risque d'hypotension artérielle brutale et/ou d'insuffisance rénale aiguë lors de l'instauration ou de l’augmentation de la posologie d’un traitement par un inhibiteur de l'enzyme de conversion en cas de déplétion hydrosodée préexistante. Dans l'hypertension artérielle, lorsqu'un traitement diurétique préalable a pu entraîner une déplétion hydrosodée, il faut :
· soit arrêter le diurétique avant de débuter le traitement par l'IEC et réintroduire un diurétique hypokaliémiant si nécessaire ultérieurement,
· soit administrer des doses initiales réduites d’IEC et augmenter progressivement la posologie.
Dans tous les cas, surveiller la fonction rénale (créatininémie) dans les premières semaines du traitement par l'IEC.
+ Produits de contraste iodés
En cas de déshydratation provoquée par les diurétiques, risque majoré d'insuffisance rénale fonctionnelle aiguë, en particulier lors d’utilisation de doses importantes de produits de contraste iodés. Réhydratation avant administration du produit iodé.
Associations à prendre en compte
+ Calcium
Risque d'hypercalcémie par diminution de l'élimination urinaire du calcium.
+ Ciclosporine
Risque d'augmentation de la créatininémie sans modification des concentrations sanguines de ciclosporine, même en l'absence de déplétion hydrosodée. Egalement, risque d’hyperuricémie et de complications comme la goutte.
+ Autres médicaments hyponatriémiants
Majoration du risque d’hyponatrémie.
Liées à l'association
Associations faisant l'objet de précautions d’emploi
+ Anti-inflammatoires non stéroïdiens
Insuffisance rénale aiguë chez le malade à risque (sujet âgé et/ou déhydraté) par diminution de la filtration glomérulaire (inhibition des prostaglandines vasodilatatrices due aux anti-inflammatoires non stéroïdiens). Par ailleurs, réduction de l’effet antihypertenseur. Hydrater le malade et surveiller la fonction rénale en début de traitement.
Réduction de l’effet antihypertenseur (inhibition des prostaglandines vasodilatatrices par les anti- inflammatoires non stéroïdiens et rétention hydrosodée avec les anti-inflammatoires non stréroïdiens pyrazolés).
+ Baclofène
Majoration du risque d’hypotension, notamment orthostatique.
Surveillance de la pression artérielle et adaptation posologique de l'antihypertenseur si nécessaire.
+ Médicaments donnant des torsades de pointes (astémizole, diphémanil, érythromycine IV, halofantrine, pentamidine, sultopride, vincamine)
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Corriger toute hypokaliémie avant d’administrer le produit et réaliser une surveillance clinique, électrolytique et électrocardiographique.
Associations à prendre en compte
+ Amifostine, antidépresseurs imipraminiques, neuroleptiques
Majoration du risque d'hypotension, notamment orthostatique.
+ Alphabloquants à visée urologique (sauf doxazosine) et antihypertenseurs alpha-bloquants
Majoration de l’effet hypotenseur.
Risque d’hypotension orthostatique sévère.
+ Dérivés nitrés et apparentés
Majoration du risque d’hypotension, notamment orthostatique.
+ Doxazosine
Majoration de l’effet hypotenseur.
Risque d’hypotension orthostatique sévère.
4.6. Fertilité, grossesse et allaitement
Grossesse
La présence d'un diurétique thiazidique conditionne la non-utilisation de cette association pendant la grossesse.
Liés à l'aténolol
Les études chez l'animal n'ont pas mis en évidence d'effet tératogène. En l'absence d'effet tératogène chez l'animal, un effet malformatif dans l'espèce humaine n'est pas attendu. En effet, à ce jour, les substances responsables de malformations dans l'espèce humaine se sont révélées tératogènes chez l'animal au cours d'études bien conduites sur deux espèces.
En clinique, aucun effet tératogène n'a été rapporté à ce jour et les résultats d'études prospectives contrôlées avec quelques bêta-bloquants n'ont pas fait état de malformations à la naissance.
Chez le nouveau-né de mère traitée, l'action bêta-bloquante persiste plusieurs jours après la naissance: si cette rémanence est le plus souvent sans conséquence clinique, il peut néanmoins survenir une défaillance cardiaque nécessitant une hospitalisation en soins intensifs (voir rubrique 4.9), en évitant les solutés de remplissage (risque d'OAP); par ailleurs bradycardie, détresse respiratoire, hypoglycémie ont été signalées.
En conséquence, les bêta-bloquants, dans les conditions normales d'utilisation, peuvent être prescrits pendant la grossesse si besoin. En cas de traitement jusqu'à l'accouchement, une surveillance attentive du nouveau-né (fréquence cardiaque et glycémie pendant les 3 à 5 premiers jours de vie) est recommandée en milieu spécialisé.
Liés à la chlortalidone
En règle générale, l'administration de diurétiques thiazidiques et apparentés doit être évitée chez la femme enceinte et ne jamais être prescrit au cours des œdèmes physiologiques (et ne nécessitant donc pas de traitement) de la grossesse. Les diurétiques peuvent, en effet, entraîner une ischémie fœtoplacentaire, avec un risque d'hypotrophie fœtale.
Les diurétiques restent néanmoins un élément essentiel du traitement des œdèmes d'origine cardiaque, hépatique et rénale survenant chez la femme enceinte.
Allaitement
Liés à l'aténolol
Les bêta-bloquants sont excrétés dans le lait (voir rubrique 5.2).
Le risque de survenue d'hypoglycémie et de bradycardie n'a pas été évalué : en conséquence et par précaution, l'allaitement est déconseillé pendant la durée du traitement.
Liés à la chlortalidone
La chlortalidone passant dans le lait maternel, l'allaitement est déconseillé.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets sur l’aptitude à conduire des véhicules et à utiliser des machines n’ont pas été étudiés.
Cependant, les conducteurs de véhicules, et les utilisateurs de machines doivent prendre en compte la survenue possible d’étourdissements et de fatigue
Dans les études cliniques, les effets indésirables sont généralement attribuables aux actions pharmacologiques des composants de TENORETIC.
Les effets indésirables sont classés par système-organe et par fréquence, très fréquent (> 1/10), fréquent (> 1/100, < 1/10), peu fréquent (> 1/1000, < 1/100) rare (> 1/10000, < 1/1000), très rare (<1/10000), et fréquence indéterminée (ne pouvant pas être estimée sur la base des données disponibles).
Affections hématologiques et du système lymphatique :
Rare : purpura, thrombocytopénie, leucopénie, agranulocytose, aplasie médullaire, anémie hémolytique (liées à la chlortalidone).
Affections psychiatriques :
Peu fréquent : troubles du sommeil (de la même nature que ceux observés avec d’autres bêta- bloquants).
Rare : troubles de l’humeur, cauchemars, confusion, psychoses et hallucinations.
Fréquence indéterminée : dépression.
Affections du système nerveux :
Rare : sensations vertigineuses, céphalées, paresthésie.
Affections oculaires :
Rare : sécheresse oculaire, troubles de la vision. Indéterminée : épanchement choroïdien.
Affections cardiaques :
Fréquent : bradycardie.
Rare : insuffisance cardiaque, aggravation d’une insuffisance cardiaque pré-existante, ralentissement de la conduction auriculo-ventriculaire, intensification d’un bloc auriculo-ventriculaire.
Affections vasculaires :
Fréquent : refroidissements des extrémités.
Rare : hypotension orthostatique pouvant être associée à une syncope, aggravation d’une claudication intermittente existante, syndrome de Raynaud.
Affections respiratoires, thoraciques et médiastinales :
Rare : Bronchospasme chez les patients asthmatiques ou ayant des antécédents d’asthme.
Affections gastro-intestinales :
Fréquent : troubles gastro-intestinaux (incluant nausées, gastralgies et vomissements liées à la chlortalidone).
Rare : sécheresse buccale. Inconnu : constipation.
Affections hépatobiliaires :
Rare : toxicité hépatique incluant cholestase intra-hépatique, pancréatite (lié à la chlortalidone). En cas d’insuffisance hépatique, possibilité de survenue d’encéphalopathie hépatique (voir rubrique 4.3 et 4.4).
Affections de la peau et du tissu sous-cutané :
Rare : alopécie, éruptions psoriasiformes, exacerbation de psoriasis, et éruptions cutanées.
Indéterminée : réaction d’hypersensibilité essentiellement dermatologique, chez les sujets prédisposés aux manifestations allergiques et asthmatiques, éruptions maculopapuleuses, possibilité d’aggravation d’un lupus érythémateux aigu disséminé préexistant.
Affections musculo-squelettiques et systémiques :
Indéterminée : Syndrome de type lupus
Affections des organes de reproduction et du sein :
Rare : impuissance
Troubles généraux et anomalies au site d’administration :
Fréquent : asthénie.
Investigations :
Fréquent (lié à la chlortalidone) : hyperuricémie, hyponatrémie, hypokaliémie, diminution de la tolérance au glucose. Une hyponatrémie avec hypovolémie à l’origine d’une déshydratation et d’une hypotension orthostatique. La perte concomitante d’ions chlore peut secondairement entraîner une alcalose métabolique compensatrice : l’incidence et l’amplitude de cet effet sont faibles.
Très rare : hypercalcémie.
Peu fréquent : élévation du taux des transaminases. Indéterminée : hypoglycémie.
Rare : L’apparition d’anticorps antinucléaires ne s’accompagnant qu’exceptionnellement de manifestations cliniques à type de syndrome lupique et cédant à l’arrêt du traitement. Une augmentation des anticorps antinucléaires a été observée, cependant la pertinence clinique de ces données n’a pas été démontrée. Syndrome lupique.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Les manifestations les plus fréquentes d’un surdosage sont : bradycardie, hypotension, insuffisance cardiaque aiguë et bronchospasme.
Conduite à tenir
En cas de surdosage, le traitement doit consister en une surveillance étroite et un traitement en unité de soins intensifs incluant le recours au lavage gastrique, charbon activé et laxatif afin d’empêcher l’absorption du médicament encore présent dans le tractus gastro-intestinal ; l’utilisation de plasma ou de substituts plasmatiques pour traiter l’hypotension et le choc.
L’hémodialyse ou l’hémoperfusion peuvent être envisagées.
Liés à l'aténolol
En cas de bradycardie ou de baisse tensionnelle excessive, on aura recours à l'administration par voie veineuse:
· d'atropine, 1 à 2 mg en bolus,
· de glucagon à la dose de 10 mg en bolus lent suivi si nécessaire d'une perfusion de 1 à 10 mg par heure,
· puis, si nécessaire soit d'isoprénaline en injection lente à la dose de 15 à 85 µg, l'injection sera éventuellement renouvelée, la quantité totale à administrer ne devant pas dépasser 300 µg, ou soit de dobutamine 2,5 à 10 µg/kg/min.
La dobutamine, de par ses effets inotropes positifs, peut être utilisée pour traiter l’hypotension et l’insuffisance cardiaque aiguë. En cas de surdosage important, il est probable que ces doses s’avèrent insuffisantes pour renverser les effets cardiaques bêta-bloquants. La dose de dobutamine pourra donc être augmentée si nécessaire afin d’obtenir une réponse suffisante en fonction de l’état clinique du patient.
Liés à la chlortalidone
La diurèse excessive sera contrebalancée par le maintien de l’équilibre hydro-électrolytique.
Les signes de l'intoxication aiguë se manifestent surtout par des désordres hydroélectrolytiques (hyponatrémie, hypokaliémie). Cliniquement, possibilité de nausées, vomissements, hypotension artérielle, crampes, vertiges, somnolence, états confusionnels, polyurie ou oligurie allant jusqu'à l'anurie (par hypovolémie).
En cas de bronchospasme, l’utilisation de bronchodilatateurs est recommandée.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
Liées à l'aténolol
L'aténolol se caractérise par trois propriétés pharmacologiques:
· activité bêta-bloquante bêta-1 cardiosélective
· effet anti-arythmique
· absence de pouvoir agoniste partiel (ou d'activité sympathomimétique intrinsèque).
Liées à la chlortalidone
La chlortalidone est un diurétique thiazidique qui agit en inhibant la réabsorption du sodium au niveau du segment cortical de dilution. Il augmente l'excrétion urinaire du sodium et des chlorures et, à un moindre degré, l'excrétion du potassium et du magnésium, accroissant de la sorte la diurèse et exerçant une action antihypertensive.
Le délai d'apparition de l'activité diurétique est d'environ 2 heures. Cette activité se maintient pendant 48 à 72 heures
5.2. Propriétés pharmacocinétiques
Absorption
Biodisponibilité d'environ 50 % avec une très faible variabilité inter-individuelle.
La demi-vie d'élimination est de 9 heures mais l'activité antihypertensive couvre le nycthémère.
Distribution
Le volume de distribution est d'environ 75 l/1,73 m2 et la clairance rénale est de 100 ml/min/1,73 m2. La molécule est hydrophile et pénètre peu dans le LCR.
L'aténolol est lié aux protéines de façon négligeable (< 10 %). La fraction absorbée est excrétée pratiquement inchangée par le rein, ce qui nécessite un ajustement posologique chez l'insuffisant rénal (voir rubrique 4.4).
L'aténolol traverse le placenta et se retrouve dans le sang du cordon (concentrations supérieures de 50% à celles du sang maternel).
L'aténolol passe dans le lait où on le retrouve à une concentration trois à cinq fois supérieure aux concentrations maternelles.
Liés à la chlortalidone
Absorption
La biodisponibilité de la chlortalidone varie selon les sujets entre 50 et 75 %.
Distribution
La liaison aux protéines plasmatiques est de 75 %. La demi-vie est comprise entre 25 et 50 heures. Il existe un passage dans le placenta et le lait maternel.
Élimination
La clairance rénale représente la moitié environ de la clairance totale. Le pourcentage de produit inchangé retrouvé dans les urines est de 65 %.
5.3. Données de sécurité préclinique
Pelliculage : hydroxypropylméthylcellulose, glycérol, dioxyde de titane.
3 ans
6.4. Précautions particulières de conservation
A conserver à l’abri de l’humidité.
A conserver à température inférieure à 25°C.
6.5. Nature et contenu de l'emballage extérieur
28, 30, 84, 90, 91 ou 100 comprimés pelliculés sous plaquettes (PVC/Aluminium).
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
ATNAHS PHARMA NETHERLANDS B.V.
COPENHAGEN TOWERS
ØRESTADS BOULEVARD 108, 5.TV
DK-2300 KØBENHAVN S
DANEMARK
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 329 420 3 9: 28 comprimés pelliculés sous plaquettes (PVC/Aluminium).
· 34009 372 008 3 7: 30 comprimés pelliculés sous plaquettes (PVC/Aluminium).
· 34009 372 010 8 7: 84 comprimés pelliculés sous plaquettes (PVC/Aluminium).
· 34009 372 011 4 8: 90 comprimés pelliculés sous plaquettes (PVC/Aluminium).
· 34009 372 012 0 9: 91 comprimés pelliculés sous plaquettes (PVC/Aluminium).
· 34009 561 873 3 1: 100 comprimés pelliculés sous plaquettes (PVC/Aluminium).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 28/12/2023
TENORETIC 50 mg/12,5 mg, comprimé pelliculé
Aténolol/Chlortalidone
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que TENORETIC 50 mg/12,5 mg, comprimé pelliculé et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre TENORETIC 50 mg/12,5 mg, comprimé pelliculé ?
3. Comment prendre TENORETIC 50 mg/12,5 mg, comprimé pelliculé?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver TENORETIC 50 mg/12,5 mg, comprimé pelliculé ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE TENORETIC 50 mg/12,5 mg, comprimé pelliculé ET DANS QUELS CAS EST-IL UTILISE ?
Ce médicament est préconisé en cas d'hypertension artérielle en cas d'échec thérapeutique d'un traitement par diurétique ou par bêta bloquant administrés seuls.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE TENORETIC 50 mg/12,5 mg, comprimé pelliculé ?
Ne prenez jamais TENORETIC 50 mg/12,5 mg, comprimé pelliculé :
· hypersensibilité à l’aténolol ou la chlortalidone ou à l’un des excipients,
· insuffisance cardiaque non contrôlée par le traitement,
· bradycardie (rythme du pouls inférieur à 45 - 50 battements par minute),
· en cas de forme sévère d'asthme et broncho-pneumopathies obstructives (formes sévères de maladies des bronches et des poumons avec encombrements),
· choc cardiogénique (d'origine cardiaque),
· blocs auriculo-ventriculaires des second et troisième degrés non appareillés (troubles du rythme cardiaque caractérisés par le ralentissement ou l'arrêt de la conduction de l'onde d'excitation entre les oreillettes et les ventricules),
· angor de Prinzmetal dans les formes pures et en l'absence d'autre traitement (variété d'angine de poitrine caractérisée par des crises douloureuses très violentes, spontanées, prolongées survenant plusieurs fois par jour, parfois à heure fixe, le matin et le soir),
· maladie du sinus (manifestations en rapport avec un mauvais fonctionnement du tissu cardiaque le long duquel s'effectue la conduction de l'onde qui entraîne la contraction du cœur : palpitations, vertiges, sensation de perte de connaissance imminente, syncope),
· phénomène de Raynaud, (troubles circulatoires symétriques des doigts, souvent déclenchés par le froid avec engourdissements, coloration bleutée de la peau, douleurs puis une phase de rougeur) et troubles artériels périphériques graves,
· phéochromocytome non traité (excroissance anormale de la glande médullosurrénale, sécrétant des substances qui provoquent une hypertension artérielle sévère),
· acidose métabolique (excès de production d’acidité ou défaut d’élimination de cette acidité par les reins),
· hypotension (diminution de la pression artérielle),
· atteinte cérébrale d'origine hépatique,
· insuffisance rénale grave,
· allergie aux sulfamides.
Ce médicament est généralement déconseillé en cas de grossesse, d'allaitement, d'association au diltiazem et au vérapamil, au lithium (médicament du système nerveux central), au fingolimod, à l’ozanimod et aux médicaments susceptibles de donner des troubles du rythme cardiaque
Avertissements et précautions
Mises en garde spéciales
NE JAMAIS ARRETER BRUTALEMENT LE TRAITEMENT.
SANS AVIS DE VOTRE MEDECIN, l'ARRET BRUSQUE DU TRAITEMENT PEUT PROVOQUER DES TROUBLES CARDIAQUES GRAVES.
Adressez-vous à votre médecin, pharmacien ou infirmier/ère avant de prendre TENORETIC 50 mg/12,5 mg, comprimé pelliculé
si vous présentez une diminution de la vision ou une douleur oculaire. Ces dernières pourraient être des symptômes d’une accumulation de fluide dans la couche vasculaire de l'œil (épanchement choroïdien) ou d’une augmentation de la pression à l’intérieur de l'œil et pourraient se produire dans un délai de quelques heures ou quelques semaines après la prise de TENORETIC 50 mg/12,5 mg, comprimé pelliculé. A défaut de traitement, elles peuvent mener à une perte de vision permanente. Si vous avez déjà eu une allergie à la pénicilline ou aux sulfamides, vous pouvez avoir un risque plus élevé de développer cela.
En cas d'atteinte sévère du foie, les diurétiques peuvent induire une affection neurologique qui nécessite l'arrêt du diurétique.
Prévenir votre médecin en cas de goutte, hyperuricémie (élévation du taux d'acide urique dans le sang).
Précautions d'emploi
Prévenir le médecin en cas d'asthme ou de maladie des bronches ou des poumons, diabète, insuffisance rénale, certaines maladies des artères (syndrome de Raynaud).
Si vous devez subir une intervention chirurgicale, avertissez l'anesthésiste que vous prenez ce médicament.
Enfants et adolescents
Sans objet.
Autres médicaments et TENORETIC 50 mg/12,5 mg, comprimé pelliculé
AFIN D'EVITER D'EVENTUELLES INTERACTIONS ENTRE PLUSIEURS MEDICAMENTS notamment avec le lithium, le vérapamil, le diltiazem, le fingolimod et l’ozanimod, IL FAUT SIGNALER SYSTEMATIQUEMENT TOUT AUTRE TRAITEMENT EN COURS A VOTRE MEDECIN OU A VOTRE PHARMACIEN
TENORETIC 50 mg/12,5 mg, comprimé pelliculé avec des aliments et boissons
Sans objet.
Le plus souvent ce médicament n'a pas lieu d'être prescrit pendant la grossesse. Il ne sera utilisé que de façon exceptionnelle et sur les conseils de votre médecin.
Prévenir votre médecin en cas de grossesse.
En cas d'allaitement le traitement est déconseillé.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Conduite de véhicules et utilisation de machines
Les effets sur l’aptitude à conduire des véhicules et à utiliser des machines n’ont pas été étudiés. Cependant, les conducteurs de véhicules et les utilisateurs de machines doivent prendre en compte la survenue possible d’étourdissements et de fatigue.
TENORETIC 50 mg/12,5 mg, comprimé pelliculé contient
Sans objet.
3. COMMENT PRENDRE TENORETIC 50 mg/12,5 mg, comprimé pelliculé ?
La posologie habituelle est de 1 comprimé par jour. Respecter la prescription de votre médecin.
Mode d'administration
Les comprimés doivent être avalés avec un verre d'eau.
Fréquence d'administration
Le comprimé se prend à n'importe quel moment de la journée, mais essayer de le prendre tous les jours à la même heure pour ne pas l'oublier.
Durée de traitement
La durée du traitement est déterminée par votre médecin.
Si vous avez pris plus de TENORETIC 50 mg/12,5 mg, comprimé pelliculé que vous n’auriez dû
Prévenir votre médecin ou l'hôpital.
Si vous oubliez de prendre TENORETIC 50 mg/12,5 mg, comprimé pelliculé
En cas d'oubli, prendre dès que possible votre comprimé et poursuivre votre traitement normalement.
Ne jamais prendre une double dose le même jour.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Effets indésirables fréquents (1 cas sur 10 et 1 cas sur 1 000 patients) :
· refroidissements des extrémités.
· troubles gastro-intestinaux : nausées, douleurs à l'estomac, vomissements.
· fatigue.
· baisse du taux de sodium dans le sang pouvant dans les cas graves, entrainer une déshydratation et une chute de la tension artérielle. La diminution de chlore dans le sang peut entrainer une faible alcalose métabolique (diminution de l’acidité du sang) : incidence faible.
· diminution de la tolérance au glucose.
· diminution du taux de potassium dans le sang.
· élévation du taux d’acide urique dans le sang, crise de goutte.
· modification de la formule sanguine.
Effets indésirables peu fréquents (1 cas sur 100 et 1 cas sur 1 000 patients) :
· troubles du sommeil.
· élévation du taux des transaminases (certaines enzymes du foie).
Effets indésirables rares (1 cas sur 1 000 et 1 cas sur 10 000 patients) :
· baisse du nombre de plaquettes sanguines.
· troubles de l’humeur, cauchemars, confusion, psychoses et hallucinations.
· sensation de vertige.
· céphalées.
· troubles de la sensibilité.
· sécheresse oculaire et troubles de la vision.
· insuffisance cardiaque (maladie du cœur) ou aggravation d’une insuffisance cardiaque pré- existante.
· ralentissement du rythme cardiaque.
· chute de tension artérielle.
· aggravation d’une claudication intermittente existante (difficulté à marcher).
· syndrome de Raynaud (engourdissements des doigts dus à des problèmes de circulation de sang).
· contraction des bronches rendant la respiration difficile (bronchospasme, crise d’asthme).
· sécheresse de la bouche.
· diminution de la sécrétion de bile (cholestase).
· inflammation du pancréas, en cas d’insuffisance hépatique, possibilité de survenue d’encéphalopathie hépatique (affection neurologique observée au cours de maladies sévères du foie).
· perte de cheveux.
· diverses manifestations cutanées, notamment des éruptions ressemblant au psoriasis (maladie de la peau caractérisée par des éléments arrondis fermés de squames (lamelles qui se détachent de la surface de la peau) sèches, brillantes et nacrées, s’enlevant aisément par grattage et laissant une surface rouge luisante, saignant facilement.
· impuissance.
· apparition ou augmentation d’anticorps (anticorps anti-nucléaires) dans le sang accompagnée de manifestations cliniques à type de lupus et se résolvant à l’arrêt du traitement.
Effets indésirables très rares (1 cas sur 10 000 patients) :
· augmentation anormale du taux de calcium.
Effets indésirables de fréquence indéterminée :
· constipation.
· quantité insuffisante de sucre dans le sang (hypoglycémie).
· syndrome de type lupus (une maladie où le système immunitaire produit des anticorps qui attaquent principalement la peau et les articulations).
· réactions de type allergique essentiellement dermatologique chez les personnes prédisposées aux manifestions allergiques et asthmatiques.
· éruptions maculopapuleuses (éruptions cutanées sous forme de taches rouges ou de boutons).
· possibilité d’aggravation d’un lupus érythémateux aigu disséminé préexistant.
· diminution de la vision ou douleur dans les yeux due à une pression élevée [signes possibles d’une accumulation de fluide dans la couche vasculaire de l'œil (épanchement choroïdien) ou d’un glaucome aigu à angle fermé].
· dépression.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER TENORETIC 50 mg/12,5 mg, comprimé pelliculé ?
Tenir ce médicament hors de la vue et de la portée des enfants.
Ne pas utiliser TENORETIC 50 mg/12,5 mg, comprimé pelliculé après la date de péremption mentionnée sur la boîte.
Ce médicament doit être conservé à une température inférieure à 25°C. Tenir à l'abri de la lumière et de l'humidité.
Les médicaments ne doivent pas être jetés au tout-à-l'égout ou avec les ordures ménagères. Demandez à votre pharmacien ce qu'il faut faire des médicaments inutilisés. Ces mesures permettront de protéger l'environnement
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient TENORETIC 50 mg/12,5 mg, comprimé pelliculé
· Les substances actives sont :
Aténolol........................................................................................................................ 50,0 mg
Chlortalidone................................................................................................................. 12,5 mg
Pour un comprimé pelliculé.
· Les autres composants sont :
Carbonate de magnésium lourd, amidon de maïs, gélatine, laurylsulfate de sodium, stéarate de magnésium.
Pelliculage : hydroxypropylméthylcellulose, glycérol, dioxyde de titane.
Qu’est-ce que TENORETIC 50 mg/12,5 mg, comprimé pelliculé et contenu de l’emballage extérieur
Ce médicament se présente sous forme de comprimé pelliculé.
Boîte de 28, 30, 84, 90, 91 ou 100 comprimés pelliculés sous plaquettes (PVC/Aluminium).
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
ATNAHS PHARMA NETHERLANDS B.V.
COPENHAGEN TOWERS
ØRESTADS BOULEVARD 108, 5.TV
DK-2300 KØBENHAVN S
DANEMARK
Exploitant de l’autorisation de mise sur le marché
CENTRE SPECIALITES PHARMACEUTIQUES
76/78 AVENUE DU MIDI
63800 COURNON D’AUVERGNE
PARC INDUSTRIEL DE LA POMPELLE
CHEMIN DE VRILLY
51100 REIMS
ou
CORDEN PHARMA GMBH
OTTO-HAHN-STRASSE 1
68723 PLANKSTADT
ALLEMAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).