Dernière mise à jour le 02/02/2026
FLUCORTAC 100 microgrammes/mL, solution buvable
Indications thérapeutiques
Classe pharmacothérapeutique : minéralocorticoïdes - code ATC : H02AA02
Le nom de votre médicament est FLUCORTAC 100 microgrammes/mL, solution buvable. Chaque mL contient 100 microgrammes de principe actif (« acétate de fludrocortisone », désigné par le terme « fludrocortisone » dans cette notice).
La fludrocortisone appartient à un groupe de médicaments appelés « corticoïdes ». Ces corticoïdes sont présents naturellement dans l’organisme et aident à vous maintenir en bonne santé.
La fludrocortisone est utilisée pour :
· Remplacer les hormones normalement produites par les glandes surrénales. Ces hormones ne sont pas produites par votre organisme si vous souffrez de la maladie d’Addison.
· Traiter une maladie appelée « l’hyperplasie congénitale des surrénales avec perte de sel », qui est une forme différente de déséquilibre hormonal.
· Traiter une maladie appelée « hypotension orthostatique sévère », qui se traduit par une chute de la pression sanguine lors du passage de la position assise ou couchée à la position debout. FLUCORTAC 100 microgrammes/mL, solution buvable ne doit être utilisé que si les mesures générales et physiques ne sont pas suffisantes et pendant une courte durée, généralement limitée à un maximum de 2 mois.
Présentations
> 1 flacon en verre brun avec fermeture de sécurité enfant de 50 mL + seringue pour administration orale graduée tous les 0,1 mL.
Code CIP : 34009 302 453 4 7
Déclaration de commercialisation : 10/02/2023
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 138,98 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 140,00 €
- Taux de remboursement :65 %
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Faible | Avis du 21/09/2022 | Inscription (CT) | Le service médical rendu par FLUCORTAC (fludrocortisone) 100 µg/mL, solution buvable est faible uniquement dans le traitement à court terme de l’hypotension orthostatique neurogène sévère nécessitant un traitement pharmacologique dans toutes les caté-gories d’âge. |
| Important | Avis du 21/09/2022 | Inscription (CT) | Le service médical rendu par FLUCORTAC (fludrocortisone) 100 µg/mL, solution buvable est important dans le traitement substitutif en cas de déficit en minéralocorticoïdes, en association avec un glucocorticoïde, dans l’insuffisance surrénalienne primaire (maladie d’Addison) et l’hyperplasie congénitale des surrénales avec perte de sel dans toutes les catégories d’âge. |
| Insuffisant | Avis du 21/09/2022 | Inscription (CT) | Le service médical rendu par FLUCORTAC (fludrocortisone) 100 µg/mL, solution buvable est insuffisant chez les patients ayant une hypotension orthostatique non neurogène pour justifier une prise en charge par la solidarité nationale au regard des alterna-tives disponibles. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 21/09/2022 | Inscription (CT) | Compte tenu de : • l’usage bien établi de la fludrocortisone dans le traitement de l'insuffisance corticosurré-nale primaire, en cas de déficit en minéralocorticoïde . • l’intérêt pratique de cette formulation, en particulier chez les nouveau-nés, sans donnée clinique permettant d’étayer un avantage en termes de qualité de vie ou d’observance, la commission de la Transparence considère que FLUCORTAC (fludrocortisone) 100 µg/mL, solution buvable n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport à la spécialité à base de fludrocortisone déjà inscrite, FLUCORTAC (fludrocor-tisone) 50 µg, comprimé sécable. Compte tenu de : • la faible qualité de la démonstration qui suggère une augmentation modeste de la pres-sion artérielle lors du passage en position debout (études anciennes, principalement non comparative, avec un faible nombre de patients), • l’absence de données comparatives en termes d’efficacité et de tolérance par rapport à la midodrine, • le besoin médical à disposer d’alternatives et l’usage bien établi de la fludrocortisone dans le traitement de l’hypotension orthostatique neurogène, • l’absence de démonstration de l’intérêt pratique de cette formulation en termes de qualité de vie ou d’observance, la commission de la Transparence considère que FLUCORTAC (fludrocortisone) 100 µg/mL, solution buvable n’apporte pas d’amélioration du service médical rendu (ASMR V) dans la prise en charge de l’hypotension orthostatique neurogène. |
ANSM - Mis à jour le : 05/08/2024
FLUCORTAC 100 microgrammes/mL, solution buvable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Acétate de fludrocortisone................................................................................... 100 microgrammes
Pour 1 mL de solution buvable
Pour la liste complète des excipients, voir rubrique 6.1.
Liquide huileux, limpide, incolore ou légèrement jaunâtre.
4.1. Indications thérapeutiques
FLUCORTAC 100 microgrammes/mL, solution buvable est indiqué dans les cas suivants :
Traitement substitutif en cas de déficit en minéralocorticoïdes, en association avec un glucocorticoïde,
· dans l’insuffisance surrénalienne primaire (maladie d’Addison) et
· l’hyperplasie congénitale des surrénales avec perte de sel
dans toutes les catégories d’âge.
Traitement à court terme de l’hypotension orthostatique sévère nécessitant un traitement pharmacologique dans toutes les catégories d’âge. L’acétate de fludrocortisone en solution buvable n’est indiqué que si les mesures générales et physiques ne sont pas suffisantes. La durée du traitement doit être la plus courte possible.
4.2. Posologie et mode d'administration
La posologie dépend de la sévérité de la maladie et de la réponse du patient. Elle doit être ajustée en fonction de la pression sanguine, de la kaliémie, de la natrémie et de l’activité rénine plasmatique qui doit se situer dans les limites de la normale ou dans la limite supérieure de la normale (voir rubrique 4.4).
Il faut utiliser la dose la plus faible possible pour contrôler la maladie. La dose doit être réduite progressivement dès que possible.
Traitement substitutif
L’association de FLUCORTAC 100 microgrammes/mL, solution buvable avec un glucocorticoïde tel que l’hydrocortisone ou la cortisone permet d’obtenir une substitution optimale.
Maladie d’Addison
Les posologies proposées sont indicatives et le traitement doit être étroitement supervisé et surveillé par un médecin habilité.
Adultes :
La posologie habituelle est de 1 mL (100 microgrammes) d’acétate de fludrocortisone par jour ; toutefois, des posologies allant de 1 mL (100 microgrammes) trois fois par semaine jusqu’à 2 mL (200 microgrammes) par jour peuvent être envisagées.
En cas de survenue d’une hypertension transitoire pendant le traitement par FLUCORTAC 100 microgrammes/mL, solution buvable, la posologie doit être réduite à 0,5 mL (50 microgrammes) par jour. Si l’hypertension persiste à la posologie minimale, le traitement par FLUCORTAC 100 microgrammes/mL, solution buvable doit être arrêté.
Population pédiatrique :
Enfants de > 2 ans : la posologie recommandée est de 0,5 mL (50 microgrammes) à 1,5 mL (150 microgrammes) et peut être augmentée à 2 mL (200 microgrammes) (voir rubrique 4.3)
Nouveau-nés et enfants de < 2 ans : la posologie recommandée est de 0,5 mL (50 µg) à 1,5 mL (150 microgrammes) et peut être augmentée à 2 mL (200 microgrammes) et, dans des cas exceptionnels, des posologies plus élevées à 2– 3 mL (200– 300 microgrammes) par jour peuvent être utilisées.
Sujets âgés :
Pas de recommandation spécifique de la posologie (voir rubrique 4.4).
Hyperplasie congénitale des surrénales avec perte de sel
Adultes :
La posologie journalière recommandée est de 1 mL à 2 mL (100– 200 microgrammes) d’acétate de fludrocortisone.
Population pédiatrique :
La posologie journalière recommandée est de 0,5 mL (50 µg) à 1 mL (100 microgrammes).
Hypotension orthostatique sévère
La posologie doit être ajustée en fonction des signes d’orthostatisme et de la tolérance, et réévaluée régulièrement pendant le traitement.
Adultes :
Le traitement débute généralement avec une posologie de 1 mL (100 microgrammes) à 2 mL (200 microgrammes) une fois par jour. La posologie peut être augmentée jusqu’à 3 mL (300 microgrammes).
Population pédiatrique :
Débuter le traitement avec une posologie de 1 mL (100 microgrammes) jusqu’à 3 mL (300 microgrammes) de fludrocortisone une fois par jour. Une fois que l’on observe une amélioration des symptômes, la posologie est réduite de 1 mL (100 microgrammes) à 0,5 mL (50 microgrammes) une fois par jour. Les effets commencent généralement après 2– 3 jours et durent pendant plusieurs jours après la fin du traitement.
Durée du traitement :
Il est recommandé d’arrêter le traitement au bout de 2 mois, après une évaluation attentive par un médecin habilité. Dans tous les cas, la durée du traitement doit être la plus courte possible.
Mode d’administration
Voie orale (voir rubrique 6.6)
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1 ;
· Insuffisance cardiaque non traitée ;
· Hypotension due à une cardiopathie organique ;
· Hypokaliémie ;
· Alcalose métabolique ;
· Infection virale aiguë (en particulier infections oculaires à Herpes simplex) et infections fongiques systémiques.
4.4. Mises en garde spéciales et précautions d'emploi
Les contre-indications relatives incluent des antécédents d’ulcère, des antécédents psychiatriques, une hypertension et une ostéoporose sévère.
Comme tous les autres corticoïdes, l’acétate de fludrocortisone peut augmenter l’excrétion de calcium, ce qui peut conduire à une ostéoporose ou aggraver une ostéoporose existante.
L’acétate de fludrocortisone peut masquer certains signes d’infection et de nouvelles infections peuvent survenir pendant l’utilisation du produit. De plus, une diminution de la résistance est possible ainsi qu’une incapacité à localiser une infection. Par exemple, une varicelle, une rougeole, un zona ou un ténia peuvent se révéler plus sévères voire avoir une issue fatale chez les enfants ou les adultes traités par acétate de fludrocortisone.
Les patients ne doivent pas être vaccinés pendant un traitement par corticoïdes, en particulier à forte dose, en raison d’une diminution de la production d’anticorps et d’une prédisposition aux complications médicales, notamment aux complications neurologiques.
L’utilisation de FLUCORTAC 100 microgrammes/mL, solution buvable chez des patients atteints de tuberculose active doit être limitée aux cas de tuberculose fulminante ou disséminée dans lesquels le corticoïde est utilisé pour traiter la maladie avec un traitement antituberculeux approprié. Une chimioprophylaxie doit être utilisée chez les patients présentant une tuberculose latente ou une réactivité à la tuberculine et traités par corticoïdes.
L’utilisation prolongée de corticoïdes peut causer une cataracte sous-capsulaire postérieure ou un glaucome avec une possible atteinte du nerf optique. Une utilisation prolongée peut également accroître le risque d’infections oculaires secondaires.
Les corticoïdes doivent être utilisés avec prudence chez les patients souffrant d’herpès oculaire en raison du risque potentiel de perforation de la cornée.
Des effets indésirables peuvent se produire lorsque le traitement par FLUCORTAC 100 microgrammes/mL, solution buvable est brutalement arrêté ou en cas d’utilisation prolongée avec des doses élevées.
Pour éviter une insuffisance surrénalienne, une dose de supplémentation peut être nécessaire en situation de stress (traumatisme, intervention chirurgicale ou maladie grave) pendant le traitement par FLUCORTAC 100 microgrammes/mL, solution buvable et pendant un an après.
Chez les patients atteints d’hypothyroïdie ou de cirrhose, les corticoïdes ont un effet majoré.
Des troubles psychiatriques peuvent apparaître lors de l’utilisation de FLUCORTAC 100 µg/mL, solution buvable, y compris des insomnies, une dépression (parfois sévère), une euphorie, des sautes d’humeur, des symptômes psychotiques et des troubles de la personnalité. Les instabilités émotionnelles ou les psychoses préexistantes peuvent être aggravées par l’utilisation de FLUCORTAC 100 µg/mL, solution buvable. Certains de ces symptômes peuvent ne pas répondre complètement aux antidépresseurs.
Les corticoïdes doivent être utilisés avec prudence en cas de rectocolite hémorragique non spécifique (s’il y a un risque de perforation, d’abcès ou d’autre infection pyogène). La même prudence s’applique aux patients présentant une diverticulite ; des anastomoses intestinales récentes ; un ulcère gastroduodénal évolutif ou latent ; une insuffisance rénale ; une glomérulonéphrite aiguë ; une néphrite chronique ; une hypertension ; une insuffisance cardiaque ; une thrombophlébite ; une thromboembolie ; une ostéoporose ; un exanthème ; un syndrome de Cushing ; un diabète sucré ; des troubles convulsifs ; un cancer métastatique ; et une faiblesse musculaire sévère.
En outre, la corticothérapie a entraîné des irrégularités menstruelles et une hyperacidité ou un ulcère gastroduodénal.
Un apport protéique adéquat est conseillé chez les patients sous corticothérapie de longue durée de manière à contrer tout risque de perte de poids ou de dégénérescence/faiblesse musculaire associé à un bilan azoté négatif.
La clairance métabolique des adrénocorticoïdes est diminuée chez les patients atteints d’hypothyroïdie et augmentée chez les patients atteints d’hyperthyroïdie. Les modifications de l’état thyroïdien du patient peuvent nécessiter un ajustement de la posologie de l’adrénocorticoïde.
Surveillance de la pression sanguine et des taux d’électrolytes
Étant donné que FLUCORTAC 100 microgrammes/mL, solution buvable est un minéralocorticoïde puissant,
· Il convient de surveiller les électrolytes sériques, l’activité rénine plasmatique, la pression sanguine et les signes cliniques susceptibles d’indiquer qu’une adaptation de la posologie (augmentation ou diminution) est nécessaire
· L’apport en sel devra être étroitement surveillé de manière à éviter l’apparition d’une hypertension ou d’un œdème et une prise de poids.
Il peut être nécessaire d’instaurer un régime hyposodé et une supplémentation en potassium.
Chez le nouveau-né, un suivi clinique et biologique (poids, diurèse / taux sériques d’électrolytes) est également recommandé.
Troubles visuels
Des troubles visuels peuvent être rapportés en cas d’utilisation systémique et topique de corticoïdes. Si un patient présente des symptômes tels qu’une vision floue ou d’autres troubles visuels, il convient d’envisager de l’orienter vers un ophtalmologiste pour rechercher les causes potentielles de ces symptômes. Des causes telles que la cataracte, le glaucome ou des maladies rares telles qu’une choriorétinopathie séreuse centrale (CRSC), ont été rapportées suite à l’utilisation de corticoïdes systémiques ou topiques.
Population pédiatrique
Les corticoïdes peuvent inhiber la croissance. La croissance et le développement des enfants et des adolescents traités par FLUCORTAC 100 microgrammes/mL, solution buvable pendant une période prolongée doivent donc faire l’objet d’une surveillance attentive. Les corticoïdes peuvent également interférer avec la production de stéroïdes endogènes. Par conséquent, la posologie de fludrocortisone doit être maintenue au niveau le plus bas possible permettant un traitement de substitution adéquat, et devra être régulièrement réévaluée.
Les enfants jusqu’à 1 an ont besoin de posologies plus élevées de fludrocortisone et doivent prendre une supplémentation en sel : 1-3 g par jour en plusieurs prises.
Sujets âgés
Les effets indésirables associés aux corticoïdes systémiques, tels que l’ostéoporose ou l’hypertension, peuvent avoir des conséquences plus graves chez les personnes âgées. Il est donc recommandé de mettre en place un suivi clinique strict.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
+ Amphotéricine B injectable et médicaments hypokaliémiants :
Les patients doivent faire l’objet d’un suivi pour détecter l’apparition éventuelle d’une hypokaliémie.
+ Anticholinestérasiques :
Les effets des anticholinestérasiques peuvent être antagonisés.
+ Anticoagulants oraux :
Les corticoïdes peuvent augmenter ou diminuer l’action des anticoagulants. Les patients sous anticoagulants oraux et corticoïdes doivent donc faire l’objet d’un suivi attentif.
+ Antidiabétiques :
Les corticoïdes peuvent augmenter la glycémie ; le contrôle du diabète doit être surveillé, en particulier au début de la corticothérapie, lors de son arrêt ou en cas de modification de la posologie.
+ Antihypertenseurs, y compris diurétiques :
Les corticoïdes antagonisent les effets des antihypertenseurs et des diurétiques. L’effet hypokaliémiant des diurétiques, y compris de l’acétazolamide, est augmenté.
+ Antituberculeux :
Les concentrations sériques d’isoniazide peuvent être diminuées.
+ Ciclosporine :
Surveiller les signes de toxicité accrue de la ciclosporine en cas d’utilisation concomitante.
+ Inhibiteurs du CYP3A :
Il est attendu qu’un traitement concomitant par un inhibiteur du CYP3A, notamment un médicament contenant du cobicistat, augmente le risque d’effets indésirables systémiques. Cette association doit être évitée sauf si le bénéfice l’emporte sur le risque accru d’effets indésirables systémiques lié à l’utilisation de corticoïdes. Dans un tel cas, le patient doit être surveillé pour détecter tout éventuel effet indésirable systémique lié à l’utilisation de corticoïdes.
+ Glucosides digitaliques :
Une co-administration peut majorer le risque de toxicité des digitaliques.
+ Contraceptifs hormonaux oraux (p. ex. œstrogènes et progestatifs) :
La demi-vie et la concentration des corticoïdes peuvent être augmentées, et la clairance diminuée. La posologie de fludrocortisone peut devoir être réduite.
+ Inducteurs des enzymes hépatiques (p. ex. aminoglutéthimide, barbituriques, carbamazépine, phénytoïne, primidone, rifabutine, rifampicine) :
Possibilité d’augmentation de la clairance métabolique de l’acétate de fludrocortisone. Les patients doivent faire l’objet d’un suivi attentif pour détecter une éventuelle diminution de l’effet du corticoïde, et la posologie doit être ajustée en conséquence.
+ Hormone de croissance humaine :
L’effet sur la croissance attendu peut être inhibé.
+ Kétoconazole :
La clairance du corticoïde peut être diminuée, entraînant une augmentation de ses effets.
+ Réglisse ou extraits de réglisse :
Ces produits ont des effets de type minéralocorticoïde et peuvent causer une hypokaliémie, une hypertension, une arythmie cardiaque et une myopathie. Les patients qui prennent de la fludrocortisone doivent éviter de consommer de la réglisse ou de prendre des compléments contenant de l’extrait de réglisse.
+ Mifamurtide :
Les corticoïdes peuvent diminuer l’effet thérapeutique du mifamurtide. Comme le mifamurtide agit en stimulant le système immunitaire, l’utilisation chronique ou régulière de corticoïdes doit être évitée pendant le traitement par mifamurtide.
+ Myorelaxants non dépolarisants :
Les corticoïdes peuvent réduire ou accroître l’action de blocage neuromusculaire.
+ Anti-inflammatoires non stéroïdiens (AINS) :
Les corticoïdes peuvent augmenter l’incidence et/ou la sévérité des hémorragies et des ulcères GI associés aux AINS. De plus, les corticoïdes peuvent réduire les taux sériques de salicylate et donc diminuer leur efficacité. À l’inverse, l’arrêt des corticoïdes pendant un traitement par salicylate à haute dose peut entraîner une toxicité du salicylate. L’aspirine doit être utilisée avec prudence lorsqu’elle est administrée en association avec des corticoïdes en cas d’hypoprothrombinémie.
+ Médicaments à visée thyroïdienne :
La clairance métabolique des adrénocorticoïdes est diminuée chez les patients atteints d’hypothyroïdie et augmentée chez les patients atteints d’hyperthyroïdie. Les modifications de l’état thyroïdien du patient peuvent nécessiter un ajustement de la posologie de l’adrénocorticoïde.
+ Antiulcéreux (p. ex. carbénoxolone) :
Ces médicaments peuvent provoquer une hypokaliémie. La posologie de fludrocortisone peut devoir être réduite.
+ Vaccins :
Des complications neurologiques et une diminution de la production d’anticorps peuvent se produire lorsque des vaccins sont administrés à des patients sous corticothérapie. (Voir rubrique 4.4 Mises en garde spéciales et précautions d’emploi.)
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n’existe pas de données suffisamment pertinentes sur l’utilisation de l’acétate de fludrocortisone chez la femme enceinte pour pouvoir évaluer son potentiel toxique. Des doses élevées de corticoïdes se sont révélées tératogènes lors d’études conduites chez l’animal. Chez l’être humain, il n’existe à ce jour aucun élément indiquant un risque accru d’anomalies congénitales après l’utilisation de corticoïdes.
Lorsque le traitement substitutif par FLUCORTAC 100 microgrammes/mL, solution buvable est administré aux posologies faibles recommandées, il peut être poursuivi pendant la grossesse car aucun effet indésirable pour le fœtus n’est attendu dans ce cas.
L’allaitement peut être maintenu pendant le traitement substitutif par FLUCORTAC 100 microgrammes/mL, solution buvable aux posologies faibles recommandées.
Fertilité
Les données disponibles sont insuffisantes pour déterminer si FLUCORTAC 100 microgrammes/mL, solution buvable peut entraîner une diminution de la fertilité chez les hommes ou les femmes.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
L’influence de la corticothérapie sur l’aptitude à conduire des véhicules et à utiliser des machines est inconnue. Toutefois, aucun effet n’est attendu.
Aux posologies faibles recommandées, les effets indésirables de FLUCORTAC 100 microgrammes/mL, solution buvable ne constituent généralement pas un problème. La plupart des effets indésirables de FLUCORTAC 100 microgrammes/mL, solution buvable sont causés par l’activité minéralocorticoïde du médicament.
Les effets indésirables suivants ont été rapportés :
|
Troubles du métabolisme et de la nutrition |
Fréquence indéterminée |
Alcalose hypokaliémique1, anorexie2 |
|
Affections psychiatriques |
Fréquence indéterminée |
Hallucinations |
|
Affections du système nerveux |
Fréquence indéterminée |
Convulsions, céphalées, syncope, dysgueusie |
|
Affections cardiaques |
Fréquence indéterminée |
Augmentation du volume cardiaque1, insuffisance cardiaque congestive |
|
Affections vasculaires |
Fréquence indéterminée |
Hypertension1 |
|
Affections gastro-intestinales |
Fréquence indéterminée |
Diarrhée |
|
Affections musculosquelettiques et du tissu conjonctif |
Fréquence indéterminée |
Atrophie musculaire, faiblesse musculaire |
|
Troubles généraux et anomalies au site d’administration |
Fréquence indéterminée |
Œdème1, prise de poids significative1 |
|
Investigations |
Fréquence indéterminée |
Perte de potassium3 |
|
Lésions, intoxications et complications d’interventions |
Fréquence indéterminée |
Surdosage |
|
Affections oculaires |
Fréquence indéterminée |
Vision trouble (voir également rubrique 4.4) |
1 Ces effets indésirables peuvent être les premiers symptômes d’une posologie excessive de FLUCORTAC 100 microgrammes/mL, solution buvable. Si ces symptômes apparaissent, l’administration du médicament doit être arrêtée. Les symptômes disparaissent alors généralement au bout de quelques jours. Si la poursuite du traitement par FLUCORTAC 100 microgrammes/mL, solution buvable est nécessaire, elle doit se faire à une posologie plus faible.
2 Cet effet indésirable peut disparaître avec une utilisation prolongée.
3 Une faiblesse musculaire due à une perte de potassium sévère est possible et peut être traitée avec une supplémentation en potassium.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Aigu
Un surdosage unique aigu n’entraîne généralement pas d’intoxication. En cas de surdosage, des troubles hydro-électrolytiques doivent être envisagés : rétention hydrosodée, perte de potassium et hypertension.
En cas de surdosage massif, les symptômes des effets indésirables doivent être surveillés et un traitement symptomatique doit être institué, notamment pour corriger les désordres hydro-électrolytiques : administration d’eau et de potassium, restriction sodée ; une surveillance de l’ionogramme plasmatique et de la pression sanguine pendant au moins 48 heures est recommandée.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Minéralocorticoïdes, Code ATC : H02AA02.
Effets pharmacodynamiques
L’acétate de fludrocortisone est un adrénocorticoïde de synthèse dotée de puissantes propriétés minéralocorticoïdes ; il a également un effet glucocorticoïde, mais celui-ci est faible par rapport à l’effet minéralocorticoïde.
L’action de l’acétate de fludrocortisone sur l’équilibre électrolytique est considérablement plus forte et plus longue que celle de l’hydrocortisone. Aux doses orales faibles, l’acétate de fludrocortisone entraîne une rétention sodée notable et augmente l’excrétion urinaire de potassium. En conséquence des effets sur l’équilibre électrolytique, la pression sanguine peut augmenter.
Efficacité et sécurité clinique
La fludrocortisone (100– 300 microgrammes une fois par jour) est un minéralocorticoïde qui stimule la rétention rénale de sodium et augmente le volume liquidien. Les données en faveur de la fludrocortisone dans le déficit en minéralocorticoïdes proviennent de deux petites études observationnelles (en association avec un repos nocturne avec la tête surélevée) et d’un essai en double aveugle chez 60 patients ; les études observationnelles ont montré un bénéfice hémodynamique et, dans l’essai, les patients traités étaient moins symptomatiques avec une pression sanguine plus élevée. En outre, des petits essais cliniques non randomisés, des études de cas et l’expérience clinique montrent que les effets recherchés de la fludrocortisone l’emportent sur ses effets indésirables. La fludrocortisone augmente le volume liquidien et peut perturber l’équilibre électrolytique et induire une hypokaliémie ; elle ne doit donc pas être utilisée chez les patients présentant une hypertension ou une insuffisance cardiaque.
5.2. Propriétés pharmacocinétiques
L’administration orale d’acétate de fludrocortisone chez l’être humain est suivie d’une absorption rapide et complète. Les concentrations plasmatiques maximales sont atteintes en 1 heure.
Distribution
Chez l’être humain, 70-80 % de la fludrocortisone circulante est liée aux protéines plasmatiques.
Biotransformation
Après ingestion, l’acétate de fludrocortisone est rapidement hydrolysé en fludrocortisone. Ce phénomène se produit essentiellement dans les intestins et le foie. Le principal site de métabolisme est le foie.
Élimination
La fludrocortisone est excrétée par les reins, pour l’essentiel sous la forme d’un métabolite inactif. La demi-vie plasmatique de la fludrocortisone est de 3,5 heures ou plus et la demi-vie pharmacodynamique est de 18 à 36 heures. Environ 80 % du médicament est excrété sous forme de conjugués polaires dans les urines. Les 20 % restants sont partiellement excrétés dans les fèces.
5.3. Données de sécurité préclinique
Aucune étude n’a été conduite.
Triglycérides à chaîne moyenne
3 ans.
Après première ouverture : À utiliser dans les 4 mois
6.4. Précautions particulières de conservation
À conserver dans l’emballage d’origine à l’abri de la lumière.
6.5. Nature et contenu de l'emballage extérieur
FLUCORTAC 100 microgrammes/mL, solution buvable est conditionné dans des flacons en verre brun de type III de 60 mL fermés avec un bouchon en plastique avec sécurité enfant muni d’un dispositif d’inviolabilité. Il contient une seringue pour administration orale de 3 mL avec des graduations tous les 0,1 mL ainsi qu’un adaptateur de seringue pour le flacon.
6.6. Précautions particulières d’élimination et de manipulation
FLUCORTAC 100 microgrammes/mL, solution buvable se compose d’un flacon, un bouchon, une seringue et un adaptateur.
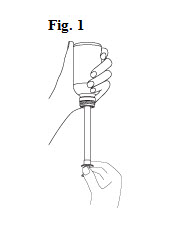
1. Le flacon doit être agité avant utilisation et le bouchon doit être retiré.
2. Lorsque le médicament est utilisé pour la première fois, l’adaptateur en plastique doit être introduit fermement dans le goulot du flacon.
3. La seringue doit être introduite fermement dans l’adaptateur. Le piston doit être bien enfoncé (Fig. 1).
4. Le flacon doit être retourné afin de remplir la seringue. Tout en maintenant la seringue en place, le piston doit être tiré délicatement jusqu’à la marque correspondante sur la seringue.
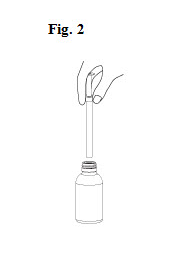
5. Le flacon doit être retourné à nouveau et la seringue remplie retirée de l’adaptateur en tournant doucement (Fig. 2).
6. L’extrémité de seringue doit être introduite dans la bouche du patient et le piston appuyé lentement pour administrer le médicament.
7. Après utilisation, bouchon doit être replacé le sur le flacon en laissant l’adaptateur en place.
La seringue doit être rincée à l’eau après chaque utilisation et laissée séchée complètement à l’air avant l’utilisation suivante.
Toute solution buvable non utilisée doit être éliminée après 4 mois suivant la première ouverture du flacon.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
43 AVENUE DE LA COTE DE NACRE
14000 CAEN
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 453 4 7 : 50 mL en flacon (verre brun) + seringue pour administration orale graduée tous les 0,1 mL.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 05/08/2024
FLUCORTAC 100 microgrammes/mL, solution buvable
Acétate de fludrocortisone
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou à votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que FLUCORTAC 100 microgrammes/mL, solution buvable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre FLUCORTAC 100 microgrammes/mL, solution buvable ?
3. Comment prendre FLUCORTAC 100 microgrammes/mL, solution buvable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver FLUCORTAC 100 microgrammes/mL, solution buvable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE FLUCORTAC 100 microgrammes/mL, solution buvable ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : minéralocorticoïdes - code ATC : H02AA02
Le nom de votre médicament est FLUCORTAC 100 microgrammes/mL, solution buvable. Chaque mL contient 100 microgrammes de principe actif (« acétate de fludrocortisone », désigné par le terme « fludrocortisone » dans cette notice).
La fludrocortisone appartient à un groupe de médicaments appelés « corticoïdes ». Ces corticoïdes sont présents naturellement dans l’organisme et aident à vous maintenir en bonne santé.
La fludrocortisone est utilisée pour :
· Remplacer les hormones normalement produites par les glandes surrénales. Ces hormones ne sont pas produites par votre organisme si vous souffrez de la maladie d’Addison.
· Traiter une maladie appelée « l’hyperplasie congénitale des surrénales avec perte de sel », qui est une forme différente de déséquilibre hormonal.
· Traiter une maladie appelée « hypotension orthostatique sévère », qui se traduit par une chute de la pression sanguine lors du passage de la position assise ou couchée à la position debout. FLUCORTAC 100 microgrammes/mL, solution buvable ne doit être utilisé que si les mesures générales et physiques ne sont pas suffisantes et pendant une courte durée, généralement limitée à un maximum de 2 mois.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE FLUCORTAC 100 microgrammes/mL, solution buvable ?
Ne prenez jamais FLUCORTAC 100 microgrammes/mL, solution buvable :
· Si vous êtes allergique à la fludrocortisone, à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6, ou à un autre médicament similaire.
· Si vous souffrez d’une infection et que vous ne prenez pas de médicament prescrit pour cela.
· Si vous avez une insuffisance cardiaque (puissance de pompage insuffisante du cœur) et que vous n’êtes pas encore traité(e) pour cela.
· Si vous souffrez d’une pression sanguine trop basse (hypotension due à une cardiopathie organique).
· Si vous avez un faible taux de potassium dans le sang (hypokaliémie).
· Si vous souffrez d’une alcalose métabolique.
Avertissements et précautions
Adressez-vous à votre médecin ou à votre pharmacien avant de prendre FLUCORTAC 100 microgrammes/mL, solution buvable si vous avez actuellement ou avez eu par le passé l’un des problèmes suivants :
· Si vos jambes ou vos chevilles sont enflées ou que vous prenez du poids. En raison de la diminution de l’excrétion de sel, l’apport en sel devra être étroitement surveillé pour éviter l’apparition d’une pression sanguine trop élevée (hypertension) ou d’un gonflement des jambes ou des chevilles (œdème) et une prise de poids. En cas de traitement à long terme, des analyses de sang, un régime hyposodé ainsi qu’une supplémentation en potassium pourront être demandés par votre médecin. Comme les autres corticoïdes, la fludrocortisone peut augmenter l’excrétion de calcium, ce qui peut conduire à une décalcification osseuse ou aggraver une décalcification osseuse existante.
· Si vous avez déjà eu un ulcère gastro-intestinal ou souffert d’une maladie mentale, d’une hypertension ou d’une ostéoporose sévère.
· Les corticoïdes inhibent la réponse immunitaire naturelle de l’organisme. Par conséquent, si vous êtes en contact avec une personne atteinte d’une maladie infectieuse telle que la varicelle, le zona ou la rougeole, consultez votre médecin dès que possible. Si vous avez une tuberculose active, l’utilisation de la fludrocortisone doit être limitée à des cas spécifiques.
· Si vous avez des problèmes gastro-intestinaux, des problèmes rénaux, une altération de la fonction de pompe du cœur (insuffisance cardiaque), une inflammation veineuse, une thrombose, une éruption cutanée (exanthème), un syndrome de Cushing, un diabète, des troubles convulsifs, un cancer métastatique ou une faiblesse musculaire sévère.
· Lors d’une utilisation prolongée, des problèmes oculaires sont possibles ; en outre, un apport protéique suffisant est conseillé pour éviter toute perte de poids ou faiblesse musculaire.
· En situation de stress (traumatisme, intervention chirurgicale ou maladie grave), pendant le traitement par fludrocortisone et pendant un an de plus, un ajustement de la posologie peut être nécessaire.
· Si vous avez une altération de la fonction thyroïdienne ou une cirrhose, cela peut affecter l’effet de la fludrocortisone.
· Chez les sujets âgés, les effets indésirables tels que l’ostéoporose et l’hypertension peuvent avoir des conséquences graves. Par conséquent, les personnes âgées seront davantage surveillées.
· Lors de l’utilisation de la fludrocortisone, il est possible que vous ayez des insomnies, une dépression, une sensation de joie extrême (euphorie), des sautes d’humeur, des symptômes psychotiques et des troubles de la personnalité. Les antidépresseurs ne sont pas forcément utiles dans ces cas.
· Le traitement par corticoïdes peut causer des ulcères gastriques, des brûlures d’estomac et des règles irrégulières.
Contactez votre médecin si vous remarquez une vision floue ou d’autres troubles visuels.
Consultez votre médecin si :
· Vous avez déjà eu une dépression sévère ou une maniaco-dépression (trouble bipolaire), notamment si vous avez déjà eu une dépression avant ou pendant la prise de corticoïdes comme la fludrocortisone.
· Un membre de votre famille a eu ce type de maladies.
Problèmes de santé mentale pendant le traitement par FLUCORTAC 100 µg/ml solution buvable
Des problèmes de santé mentale peuvent survenir pendant la prise de corticoïdes comme FLUCORTAC 100 microgrammes/mL, solution buvable (voir également rubrique 4).
· Ces problèmes peuvent être graves.
· Ils commencent généralement au bout de quelques jours ou semaines après le début du traitement.
· Ils sont davantage susceptibles de se produire avec des posologies élevées.
· La plupart de ces problèmes disparaissent avec une réduction de la posologie ou l’arrêt du traitement. Toutefois, si ces problèmes surviennent, ils peuvent nécessiter un traitement.
Consultez un médecin si vous (ou une autre personne prenant ce médicament) montrez des signes de problèmes mentaux. Cela est particulièrement important si vous êtes déprimé(e) ou avez des pensées suicidaires. Dans quelques cas, des problèmes de santé mentale sont survenus lors d’une diminution de la posologie ou de l’arrêt du traitement.
Votre médecin pourra vous demander de faire des analyses de sang et vérifier votre apport en sel pour s’assurer que vous n’avez pas d’hypertension ou de rétention d’eau et que vous n’êtes pas en surpoids.
Enfants et adolescents
Sans objet.
Autres médicaments et FLUCORTAC 100 microgrammes/mL, solution buvable
Informez votre médecin ou votre pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament, y compris un médicament obtenu sans ordonnance comme les préparations à base de plantes.
En particulier, informez votre médecin si vous prenez l’un des médicaments suivants :
· De l’aspirine, de l’ibuprofène ou d’autres anti-inflammatoires non stéroïdiens (AINS), car les corticoïdes peuvent augmenter les risques de saignement au niveau des intestins.
· Des antifongiques (p. ex. kétoconazole, amphotéricine)
· De la warfarine ou d’autres médicaments pour fluidifier le sang
· Une pilule contraceptive (p. ex. œstrogènes et progestatifs) ou un traitement hormonal de substitution (THS)
· De l’hormone de croissance humaine
· Des myorelaxants, p. ex. l’atracurium. Ces médicaments sont utilisés pendant l’anesthésie dans le cadre d’une intervention chirurgicale. Veuillez informer votre anesthésiste si vous prenez FLUCORTAC 100 µg/mL, solution buvable.
· Un médicament appelé « ciclosporine » (utilisé normalement après une transplantation)
· Des barbituriques. Ces médicaments sont utilisés comme sédatifs (pour produire un effet calmant), comme hypnotiques (pour induire le sommeil) ou comme traitement anesthésique d’appoint.
· Des médicaments contre le VIH comme le ritonavir ou le cobicistat. Ces médicaments peuvent augmenter les effets de FLUCORTAC 100 microgrammes/mL, solution buvable et votre médecin pourra souhaiter vous surveiller attentivement si vous prenez ces médicaments.
· Un médicament stimulant le système immunitaire (mifamurtide)
· De la réglisse ou des extraits de réglisse
Informez votre médecin si vous prenez des médicaments pour traiter :
· Une hypertension (p. ex. phénylbutyrate de sodium, clonidine, méthyldopa, inhibiteurs de l’enzyme de conversion de l’angiotensine, α et ß-bloquants, antagonistes des récepteurs de l’angiotensine II, inhibiteurs calciques et diurétiques)
· Des battements cardiaques irréguliers (p. ex. digoxine)
· Une épilepsie ou d’autres sortes de crises convulsives (p. ex. phénytoïne, primidone, carbamazépine)
· Une tuberculose (TB) (p. ex. isoniazide, rifampicine, rifabutine)
· Un diabète
· Des problèmes de thyroïde
· Un syndrome de Cushing (p. ex. aminoglutéthimide)
· Un glaucome (p. ex. acétazolamide)
· Des douleurs intestinales (p. ex. hyoscine)
· Un asthme et une bronchopneumopathie chronique obstructive (p. ex. tiotropium)
· Une rétention urinaire (p. ex. doxazosine)
· Une maladie d’Alzheimer (p. ex. donépézil, galantamine)
· Une myasthénie (p. ex. néostigmine)
· Un ulcère (p. ex. carbénoxolone)
Pendant votre traitement par ce médicament (ou si vous avez récemment arrêté votre traitement), ne vous faites pas vacciner sans avoir consulté votre médecin.
FLUCORTAC 100 microgrammes/mL, solution buvable avec des aliments, boissons et de l’alcool
Sans objet.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou à votre pharmacien avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
FLUCORTAC 100 microgrammes/mL, solution buvable n’a pas montré d’influence sur la capacité à conduire un véhicule ou à utiliser des machines.
FLUCORTAC 100 microgrammes/mL, solution buvable contient
Sans objet.
3. COMMENT PRENDRE FLUCORTAC 100 microgrammes/mL, solution buvable ?
· FLUCORTAC 100 microgrammes/mL, solution buvable ne doit être utilisé que pour la maladie pour laquelle votre médecin vous a prescrit ce médicament.
· Pour un résultat optimal, il est important de suivre scrupuleusement les instructions de votre médecin concernant la posologie.
· La posologie dépendra de la sévérité de votre maladie et de votre réponse au traitement. Votre médecin s’efforcera de vous donner la posologie la plus faible possible.
· Consultez votre médecin ou votre pharmacien si vous avez l’impression que l’effet de la fludrocortisone est trop fort ou trop faible.
Traitement substitutif
Adultes
Dans la maladie d’Addison, la posologie journalière habituelle est de 1 mL (100 microgrammes) de FLUCORTAC 100 microgrammes/mL, solution buvable ; toutefois, des posologies de 2 mL (200 microgrammes) par jour ou 3 mL (300 microgrammes) de solution par semaine peuvent également prescrites. Si votre pression sanguine augmente, votre médecin réduira votre posologie à 0,5 mL (50 microgrammes) de solution par jour. Si, malgré cette réduction de posologie, votre pression sanguine reste élevée, le traitement par FLUCORTAC 100 microgrammes/mL, solution buvable devra être arrêté.
Enfants et adolescents
Dans la maladie d’Addison, la posologie habituelle recommandée va de 0,5 mL (50 microgrammes) à 2 mL (200 microgrammes) de FLUCORTAC 100 microgrammes/mL, solution buvable à prendre une fois par jour. Dans des cas exceptionnels, la posologie quotidienne peut être augmentée à 3 mL (300 microgrammes) de solution. Dans l’hyperplasie congénitale des surrénales avec perte de sel, la posologie habituelle est de 0,5 mL à 1 mL (50 microgrammes à 100 microgrammes) de solution par jour.
Hypotension orthostatique sévère
Adultes
La posologie initiale recommandée va de 1 mL (100 microgrammes) à 2 mL (200 microgrammes) de FLUCORTAC 100 microgrammes/mL, solution buvable une fois par jour. La posologie peut être augmentée à 3 mL (300 microgrammes) de solution.
Enfants
La posologie initiale recommandée va de 1 mL (100 microgrammes) à 3 mL (300 µg) de FLUCORTAC 100 microgrammes/mL, solution buvable une fois par jour. Une fois les symptômes améliorés, la posologie est réduite de 1 mL (100 microgrammes) à 0,5 mL (50 microgrammes) une fois par jour. Les effets commencent généralement après 2– 3 jours et durent pendant plusieurs jours après la fin du traitement.
Mode d’administration
FLUCORTAC 100 microgrammes/mL, solution buvable doit être administré par voie orale.
FLUCORTAC 100 microgrammes/mL, solution buvable se compose d’un flacon, un bouchon, une seringue et un adaptateur.
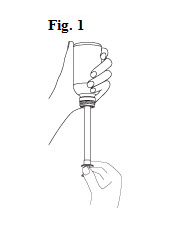
1. Bien agiter le flacon avant utilisation et retirer le bouchon.
2. Lorsque le médicament est utilisé pour la première fois, introduire fermement l’adaptateur en plastique dans le goulot du flacon.
3. Introduire fermement la seringue dans l’adaptateur. S’assurer que le piston est bien enfoncé (Fig. 1).
4. Retourner le flacon afin de remplir la seringue. Tout en maintenant la seringue en place, tirer doucement sur le piston et prélever le médicament jusqu’à la marque correspondante sur la seringue.
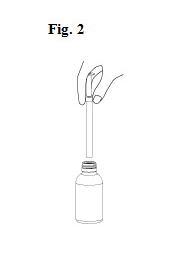
5. Retourner le flacon à nouveau et retirer la seringue remplie de l’adaptateur en tournant doucement (Fig. 2).
6. Introduire l’extrémité de la seringue dans la bouche et appuyer lentement sur le piston pour administrer le médicament.
7. Après utilisation, replacer le bouchon sur le flacon en laissant l’adaptateur en place.
Laver la seringue à l’eau après chaque utilisation et laisser sécher complètement à l’air avant l’utilisation suivante.
Durée du traitement
La durée du traitement dépend de la nature et de la sévérité de la maladie pour laquelle FLUCORTAC 100 microgrammes/mL, solution buvable vous a été prescrit.
Le traitement hormonal substitutif destiné à pallier la fonction insuffisante des glandes attachées à vos reins dure généralement toute la vie.
Dans le traitement du trouble sévère de la régulation de la pression sanguine lors du passage en position debout, la durée du traitement est généralement limitée à un maximum de 2 mois.
Si vous avez pris plus de FLUCORTAC 100 microgrammes/mL, solution buvable que vous n’auriez dû
Si vous avez pris plus de ce médicament que vous n’auriez dû, consultez votre médecin ou allez à l’hôpital le plus proche immédiatement. Prenez l’emballage du médicament avec vous.
Si vous oubliez de prendre FLUCORTAC 100 microgrammes/mL, solution buvable
Si vous oubliez de prendre une dose, ne vous inquiétez pas, prenez-la dès que vous vous en apercevez sauf s’il est presque temps de prendre votre dose suivante, auquel cas vous devez simplement poursuivre votre traitement normalement sans prendre la dose oubliée.
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez de prendre FLUCORTAC 100 microgrammes/mL, solution buvable
N’arrêtez pas de prendre ce médicament sans en avoir parlé à votre médecin car cela pourrait vous rendre malade - vous devrez peut-être réduire la dose progressivement.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Arrêtez de prendre FLUCORTAC 100 microgrammes/mL, solution buvable et contactez votre médecin sans délai/immédiatement en cas de survenue des effets suivants car ils peuvent être le signe :
· D’une réaction allergique (réaction d’hypersensibilité, y compris anaphylaxie) :
o Difficulté à respirer
o Gonflement du visage, des lèvres ou de la langue
o Douleurs sévères à l’estomac ou à l’abdomen
o Éruption cutanée
· D’un problème grave de santé mentale :
o Sensation de dépression, y compris pensées suicidaires.
o Sensation d’euphorie (manie) ou sautes d’humeur.
o Sensation d’anxiété, sommeil perturbé, difficultés à réfléchir ou confusion, et perte de mémoire.
o Ressentir, voir ou entendre des choses qui n’existent pas (hallucinations). Avoir des pensées étranges ou effrayantes, modification du comportement ou sensation d’être seul(e).
Les effets indésirables suivants ont été rapportés avec une fréquence indéterminée :
· Insuffisance cardiaque (essoufflement à l’effort, ou après être resté(e) allongé(e) pendant un certain temps),
· Pression sanguine élevée (hypertension),
· Perte de potassium (sous une forme sévère identifiée par des crampes musculaires ou une faiblesse musculaire et de la fatigue),
· Faiblesse musculaire,
· Réduction du tissu musculaire en raison de la non-utilisation du muscle à cause d’une atteinte du système nerveux ou non (atrophie musculaire),
· Maux de tête,
· Perception de choses qui n’existent pas (hallucinations), manque d’appétit (anorexie ; peut disparaître avec une utilisation prolongée),
· Convulsions,
· Évanouissement (syncope) ou perte de connaissance,
· Modification du goût,
· Diarrhée,
· Surdosage,
· Vision trouble,
· Prise de poids, œdème.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou à votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER FLUCORTAC 100 microgrammes/mL, solution buvable ?
Tenir ce médicament hors de la vue et de la portée des enfants. Conserver ce médicament dans l’emballage d’origine à l’abri de la lumière.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage et l’étiquette du flacon. La date de péremption fait référence au dernier jour de ce mois.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient FLUCORTAC 100 microgrammes/mL, solution buvable
· La substance active est :
Acétate de fludrocortisone............................................................................. 100 microgrammes
Pour 1 mL de solution buvable
· L’autre composant est : Triglycérides à chaîne moyenne.
Qu’est-ce que FLUCORTAC 100 microgrammes/mL, solution buvable et contenu de l’emballage extérieur
FLUCORTAC 100 microgrammes/mL, solution buvable est un liquide huileux, limpide, incolore ou légèrement jaunâtre. Il est conditionné dans des flacons en verre ambré de type III de 60 mL fermés par un bouchon en plastique de sécurité enfant muni d’un dispositif d’inviolabilité. Il contient une seringue pour administration orale de 3 mL avec des graduations tous les 0,1 mL ainsi qu’un adaptateur pour la seringue.
Titulaire de l’autorisation de mise sur le marché
43 AVENUE DE LA COTE DE NACRE
PERICENTRE II
14000 CAEN
Exploitant de l’autorisation de mise sur le marché
H.A.C. PHARMA
43 AVENUE DE LA COTE DE NACRE
PERICENTRE II
14000 CAEN
LABOMED PHARMACEUTICAL COMPANY S.A.
METAXA IOANNI 84
KARELLAS 194 41
GRECE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
{mois AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).