Dernière mise à jour le 30/06/2025
ZYMADUO 300 UI, solution buvable en gouttes
Indications thérapeutiques
Classe pharmacothérapeutique : Cholécalciférol, associations - code ATC : A11CC55
ZYMADUO 300 UI est destiné aux nourrissons de 6 à 18 mois.
Votre médecin a prescrit ce médicament à votre enfant afin de lui apporter les quantités de fluor et de vitamine D qui lui sont adaptées pour prévenir la carie dentaire et le rachitisme :
· En l’absence d’utilisation d’un lait supplémenté en vitamine D,
· Chez les enfants à peau pigmentée en cas d’utilisation d’un lait supplémenté en vitamine D.
Risque carieux élevé : antécédents de carie (personnes ou des parents ou de la fratrie), ou non-respect des règles d’hygiène alimentaire ou bucco-dentaire, ou facteurs de risque environnementaux.
Ce médicament ne doit pas être pris sans avis médical.
Présentations
> 1 flacon(s) polyéthylène de 12 ml avec compte-gouttes
Code CIP : 348 106-9 ou 34009 348 106 9 5
Déclaration de commercialisation : 26/04/2000
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 2,66 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 3,68 €
- Taux de remboursement :30%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Modéré | Avis du 17/12/2014 | Renouvellement d'inscription (CT) | Le service médical rendu par ZYMADUO reste modéré dans les indications de l’AMM. |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 08/02/2024
ZYMADUO 300 UI, solution buvable en gouttes
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Cholécalciférol (vitamine D3) .................................................................................................. 300 UI
Fluorure de sodium......................................................................................................... 0,1380 mg
Quantité correspondant à fluor.......................................................................................... 0,0625 mg
Pour une goutte
4 gouttes contiennent 1200 UI de vitamine D3 et 0,25 mg de fluor.
1 flacon de 12 ml contient 370 gouttes.
Excipients à effet notoire : Huile de ricin hydrogénée polyoxyéthylénée (Crémophor RH 40), sirop de maltitol, parahydroxybenzoate de méthyle sodé, parahydroxybenzoate de propyle sodé, sodium, éthanol, alcool benzylique.
Pour la liste complète des excipients, voir rubrique 6.1.
4.1. Indications thérapeutiques
· en l’absence d’utilisation d’un lait supplémenté en vitamine D,
· chez les enfants à peau pigmentée en cas d’utilisation d’un lait supplémenté en vitamine D.
NB : risque carieux élevé : antécédents de carie (personnes ou des parents ou de la fratrie), ou non-respect des règles d’hygiène alimentaire ou bucco-dentaire, ou facteurs de risque environnementaux.
Ce médicament ne doit pas être pris sans avis médical.
4.2. Posologie et mode d'administration
4 gouttes par jour
Mode d’administration
A prendre pures ou diluées dans un peu d'eau ou de jus de fruit (éviter les boissons lactées) en une seule prise quotidienne.
· Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1
· Hypercalcémie, hypercalciurie, lithiase calcique.
Ce produit ne doit pas être associé à la prise d’un autre médicament contenant du fluor du fait du risque de surdosage.
4.4. Mises en garde spéciales et précautions d'emploi
Tenir compte des autres apports éventuels en vitamine D ou en fluor.
Pour éviter tout surdosage, l’apport total en vitamine D toutes sources confondues doit être considéré, qu’il s’agisse de sources nutritionnelles ou d’autres supplémentations contenant déjà la vitamine D, y compris l’utilisation de lait supplémenté.
Toxicité de la vitamine D en situation d’hypervitaminose D :
Le risque de toxicité de la vitamine D est augmenté chez les patients présentant une pathologie et/ou des troubles entraînant une hypercalcémie et/ou une hypercalciurie, et chez les patients ayant une sensibilité accrue à la vitamine D, d’origine génétique, donnant lieu à une hypervitaminose D.
La posologie recommandée est de 0,05 mg de fluor/jour et par kg de poids corporel sans dépasser
1 mg par jour tous apports fluorés confondus. Une fluorose dentaire peut apparaître après ingestion de grandes quantités de fluor.
Avant de prescrire ce médicament, il faut :
· s’assurer que le patient ne reçoit pas d’autres sources de fluor : sels fluorés, eau embouteillée, eau du robinet (il est recommandé de s’enquérir à la mairie ou auprès de la DDASS de sa teneur en fluor) ;
· contrôler régulièrement les dents pour vérifier l’absence de développement d’une fluorose.
Chez le nourrisson, les sources d’apport extérieur en fluor sont potentiellement représentées par les eaux de boisson.
Les eaux qui comportent un taux de fluor supérieur à 0,3 mg/l ne doivent pas être utilisées pour la préparation des biberons, en association à une supplémentation fluorée.
La supplémentation fluorée ne dispense pas d’une bonne hygiène alimentaire (limitation des sucres, tout particulièrement sous forme de grignotages et de boissons sucrées entre les repas, pas d’endormissement avec un biberon contenant autre chose que de l’eau pure), et bucco-dentaire (brossage des dents réalisé par une adulte au moins une fois par jour avec un dentifrice fluoré contenant moins de 500 PP de fluor, consultation régulière chez le chirurgien-dentiste).
Dans le cas d’utilisation d’un lait supplémenté en vitamine D cette formulation n’est pas adaptée (à l’exception des enfants à peau pigmentée) ; utiliser alors la formulation délivrant 600 UI en 4 gouttes.
Ce médicament contient de l’huile de ricin et peut causer maux d’estomac et la diarrhée.
Ce médicament contient du sirop de maltitol (maltitol liquide). Les patients présentant de rares problèmes héréditaires d’intolérance au fructose ne doivent pas prendre ce médicament.
Ce médicament contient du parahydroxybenzoate de méthyle sodé et du parahydroxybenzoate de propyle sodé et peut provoquer des réactions allergiques (éventuellement retardées).
Ce médicament contient moins de 1 mmol de sodium (23 mg) par goutte, c’est-à-dire qu’il est essentiellement « sans sodium ».
Ce médicament contient 2,85 mg d'alcool (éthanol) par prise de 4 gouttes équivalent à 5,50 mg/ml ou 0,055% p/v. La quantité pour 4 gouttes de ce médicament équivaut à moins de 1 ml de bière ou 1 ml de vin.
La faible quantité d'alcool contenue dans ce médicament n'est pas susceptible d'entraîner d’effets notables.
Ce médicament contient 0,031 mg d’alcool benzylique par prise de 4 gouttes équivalent à 0,06 mg/ml. L’alcool benzylique peut provoquer des réactions allergiques.
L’alcool benzylique est associé à un risque d’effets secondaires graves y compris des problèmes respiratoires (appelés « syndrome de suffocation ») chez les jeunes enfants. La quantité minimale d’alcool benzylique susceptible d’entrainer une toxicité n’est pas connue.
Il existe un risque accru en raison de l’accumulation d’alcool benzylique chez les jeunes enfants (moins de 3 ans) en cas d’utilisation pendant plus d’une semaine.
Les volumes élevés doivent être utilisés avec prudence et en cas de nécessité uniquement, en particulier chez les personnes atteintes d’insuffisance hépatique ou rénale en raison du risque d’accumulation et de toxicité (acidose métabolique).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
L'ingestion simultanée de produits laitiers ou d'antiacides à base de sels de calcium, de magnésium ou d'aluminium doit être évitée.
Associations à prendre en compte
+ Orlistat:
Diminution de l'absorption de la vitamine D.
4.6. Fertilité, grossesse et allaitement
Sans objet.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets indésirables de ZYMADUO sont listés selon la classification MedDRA par système classe-organe. Au sein de chaque système classe-organe, les événements indésirables sont présentés par ordre décroissant de fréquence selon la convention suivante : très fréquent (≥1/10), fréquent (>1/100, <1/10), peu fréquent (>1/1 000, <1/100), rare (>1/10 000, <1/1 000), très rare (<1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
Fréquence |
Effet indésirable |
|
|
Troubles du métabolisme et de la nutrition |
Très rare |
Hypercalcémie (principalement en cas de surdosage, voir rubrique 4.9) |
|
Affections gastro-intestinales |
Très rare |
Régurgitation, nausées, vomissement (principalement en cas de surdosage, voir rubrique 4.9) |
|
Affections de la peau et du tissu sous-cutané |
Très rare |
Rash, éruption cutanée parfois prurigineuse, eczéma et urticaire |
|
Affections du rein et des voies urinaires |
Indéterminée |
Hypercalciurie |
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
Surdosage aigu
Le flacon de ZYMADUO 300 UI ne contenant que 110 880 UI de vitamine D3, seules des manifestations liées au fluor (23,11 mg de fluor par flacon) sont à craindre en cas d'ingestion importante accidentelle. Les premiers signes d'un surdosage aigu fluoré sont d'ordre gastro-intestinal : salivation, nausées, vomissements, douleurs abdominales et diarrhées.
Le traitement immédiat consiste en des vomissements provoqués, un traitement symptomatique (notamment un apport calcique per os tel que du lait) et une surveillance de quelques heures.
Surdosage chronique
· Fluor :
· Un surdosage quotidien durant des années est susceptible d'entraîner une fluorose dentaire.
· Vitamine D :
Signes cliniques :
o céphalées, asthénie, anorexie, amaigrissement, arrêt de croissance,
o nausées, vomissements,
o polyurie, polydipsie, déshydratation,
o hyperpression artérielle,
o lithiase calcique, calcifications tissulaires, en particulier rénales et vasculaires,
o insuffisance rénale.
Signes biologiques :
o hypercalcémie, hypercalciurie, hyperphosphatémie, hyperphosphaturie.
Pour des doses massives (supérieures à 5,0 mg/kg de fluor) une hospitalisation dans un centre spécialisé (lavage d'estomac, calcithérapie ...) est nécessaire.
Les symptômes d'un surdosage chronique en vitamine D3 peuvent nécessiter une diurèse forcée et l'administration de glucocorticoïdes ou de calcitonine.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Cholécalciférol, associations, code ATC : A11CC55
Donné au cours de la minéralisation de la dent, le fluor favorise la formation d'un émail plus résistant à la carie, en augmentant sa résistance mécanique et en réduisant sa dissolution en milieu acide.
De plus, le fluor modifie l'équilibre de la flore bactérienne responsable de la plaque dentaire en diminuant la quantité de bactéries sécrétant des substances attaquant l'émail.
Le rôle essentiel de la vitamine D s'exerce sur l'intestin, dont elle augmente la capacité à absorber le calcium et les phosphates, et sur le squelette, dont elle favorise la minéralisation (grâce à ses actions directes sur l'os en formation et à ses actions indirectes impliquant l'intestin, les parathyroïdes et l'os déjà minéralisé).
5.2. Propriétés pharmacocinétiques
Le fluorure de sodium est bien absorbé au niveau gastro-intestinal où sa biodisponibilité est de l'ordre de 90-100 %. Le pic de concentration est obtenu entre 30 minutes et une heure après la prise et la demi-vie d'élimination est d'environ 6 heures. Les ions fluorures se concentrent dans les tissus durs de l'organisme : dents et os. Ils sont éliminés par voie urinaire (48 – 61%).
Sous forme de gouttes, le fluorure de sodium assure, outre une activité systémique, une activité topique.
Vitamine D
La vitamine D est absorbée dans l'intestin grêle de façon passive, puis rejoint la circulation générale par voie lymphatique, incorporée aux chylomicrons. Le taux d'absorption de la vitamine D3 est d'environ 80 %. Toute vitamine non absorbée est excrétée dans les selles.
Après absorption, elle se lie à une protéine porteuse spécifique et est transportée jusqu'au foie pour y être convertie en 25-hydroxyvitamine D. Cette dernière se lie à son tour à la même protéine porteuse et est transportée jusqu'aux reins où elle est transformée en sa forme active, la 1,25‑dihydroxyvitamine D.
Ses sites de stockage essentiels sont le tissu adipeux, les muscles, mais aussi le sang. La 25-hydroxyvitamine D liée à sa protéine porteuse est la forme majeure de réserve circulante de la vitamine D. Sa demi-vie dans le sang est de 15 à 40 jours.
L'élimination de la vitamine D et de ses métabolites se fait par voie fécale, sous forme non transformée ou sous forme hydrosoluble (acide calcitroïque, dérivés glycuroconjugués).
5.3. Données de sécurité préclinique
* Composition de l’arôme orange caramel : alcool éthylique, limonène, benzaldéhyde, propylène glycol, alcool benzylique, coumarine, vanilline, éthylvanilline.
** Composition du Coviox T70 : alpha, bêta, gamma et delta tocophérols
*** Composition de la solution tampon phosphate : dihydrogénophosphate de potassium, hydrogénophosphate de sodium anhydre
3 ans.
6.4. Précautions particulières de conservation
6.5. Nature et contenu de l'emballage extérieur
12 ml en flacon (PE) avec compte-goutte (PE) et capsule (Polypropylène)
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
1 BIS PLACE DE LA DEFENSE – TOUR TRINITY
92400 COURBEVOIE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 348 106 9 5 : 12 ml en flacon (PE)
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 08/02/2024
ZYMADUO 300 UI, solution buvable en gouttes
Cholécalciférol – Fluorure de sodium
Vous devez toujours prendre ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin ou votre pharmacien.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre pharmacien pour tout conseil ou information.
· Si vous ressentez l’un des effets indésirables, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien.
Ne laissez pas ce médicament à la portée des enfants.
1. Qu'est-ce que ZYMADUO 300 UI, solution buvable en gouttes et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre ZYMADUO 300 UI, solution buvable en gouttes ?
3. Comment prendre ZYMADUO 300 UI, solution buvable en gouttes ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver ZYMADUO 300 UI, solution buvable en gouttes ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE ZYMADUO 300 UI, solution buvable en gouttes ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Cholécalciférol, associations - code ATC : A11CC55
ZYMADUO 300 UI est destiné aux nourrissons de 6 à 18 mois.
Votre médecin a prescrit ce médicament à votre enfant afin de lui apporter les quantités de fluor et de vitamine D qui lui sont adaptées pour prévenir la carie dentaire et le rachitisme :
· En l’absence d’utilisation d’un lait supplémenté en vitamine D,
· Chez les enfants à peau pigmentée en cas d’utilisation d’un lait supplémenté en vitamine D.
Risque carieux élevé : antécédents de carie (personnes ou des parents ou de la fratrie), ou non-respect des règles d’hygiène alimentaire ou bucco-dentaire, ou facteurs de risque environnementaux.
Ce médicament ne doit pas être pris sans avis médical.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE ZYMADUO 300 UI, solution buvable en gouttes ?
Ne prenez jamais ZYMADUO 300 UI, solution buvable en gouttes :
· si vous êtes allergique (hypersensible) aux substances actives ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· si vous présentez une augmentation du taux de calcium dans le sang ou les urines, ou un calcul rénal.
Ce produit ne doit pas être associé à la prise d’un autre médicament contenant du fluor du fait du risque de surdosage.
En cas de doute, il est indispensable de demander l’avis de votre médecin ou de votre pharmacien.
Faites attention avec ZYMADUO 300 UI, solution buvable en gouttes :
Mises en gardes spéciales :
Afin d’éviter tout surdosage, tenir compte des doses totales :
· de vitamine D en cas d’association avec un traitement contenant déjà cette vitamine. Cette spécialité délivrant en 4 gouttes 1200 UI de vitamine D est parfaitement adaptée lorsque l’enfant est nourri au sein ou par des laits non supplémentés en vitamine D, ou chez l’enfant à peau pigmentée en cas d’utilisation d’un lait supplémenté en vitamine D.
· de fluor : La posologie recommandée est de 0,05 mg de fluor/jour et par kg de poids corporel sans dépasser 1 mg par jour tous apports fluorés confondus. Prendre en compte également la teneur en fluor de certaines eaux embouteillées.
Précautions d’emploi :
Tenir compte des autres apports éventuels en vitamine D ou en fluor.
Pour éviter tout surdosage, tenir compte des doses totales de vitamine D quelle qu’en soit la source telles que des sources nutritionnelles, des compléments alimentaires de vitamine D, des médicaments contenant déjà cette vitamine, ou en cas d'utilisation de lait supplémenté en vitamine D.
Toxicité de la vitamine D en situation d’hypervitaminose D :
Le risque de toxicité de la vitamine D est augmenté si vous présentez une maladie et/ou des troubles entraînant un excès de calcium dans le sang et/ou dans les urines, et si vous présentez une sensibilité accrue à la vitamine D, d’origine génétique, donnant lieu à une hypervitaminose D.
La dose indiquée ne doit pas être dépassée ; une fluorose dentaire peut apparaître après ingestion continue de grandes quantités de fluor.
Avant de prendre ce médicament, il faut :
· s’assurer que l’enfant ne reçoit pas d’autres sources de fluor : sels fluorés, eau embouteillée, eau du robinet (il est recommandé de s’enquérir à la mairie ou auprès de la DDASS de sa teneur en fluor) ; Chez le nourrisson, n’utilisez pas pour la préparation des biberons une eau minérale qui contient plus de 0,3 mg de fluor par litre d’eau si vous donnez à votre enfant un médicament apportant du fluor. Vérifiez le taux de fluor mentionné sur la bouteille.
· contrôler régulièrement les dents pour vérifier l’absence de développement d’une fluorose.
Donner un médicament fluoré à votre enfant ne dispense pas d’une bonne hygiène alimentaire.
· Limitez les sucres, en particulier les grignotages et les boissons sucrées entre les repas
· Ne le laissez pas s’endormir avec un biberon contenant autre chose que de l’eau pure.
Veillez également à son hygiène bucco-dentaire :
· Brossez-lui les dents au moins une fois par jour avec un dentifrice fluoré contenant moins de 500 PPM de fluor.
· Emmenez-le régulièrement en consultation chez le chirurgien-dentiste.
En cas de doute, ne pas hésiter à demander l’avis de votre médecin ou de votre pharmacien.
Autres médicaments et ZYMADUO 300 UI, solution buvable
Si vous prenez ou avez pris récemment un autre médicament, y compris un médicament obtenu sans ordonnance, parlez-en à votre médecin ou à votre pharmacien.
Aliments et boissons
Sans objet.
Grossesse et allaitement
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Conduite de véhicules et utilisation de machines
Sans objet.
ZYMADUO 300 UI, solution buvable en gouttes contient du parahydroxybenzoate de méthyle sodé, du parahydroxybenzoate de propyle sodé, du sodium, de l’huile de ricin hydrogénée polyoxyéthylénée (Crémophor RH 40), du sirop de maltitol, de l’éthanol et de l’alcool benzylique.
Ce médicament contient du parahydroxybenzoate de méthyle sodé et du parahydroxybenzoate de propyle sodé et peut provoquer des réactions allergiques (éventuellement retardées).
Ce médicament contient moins de 1 mmol de sodium (23 mg) par goutte, c’est-à-dire qu’il est essentiellement « sans sodium ».
Ce médicament contient de l’huile de ricin et peut causer des maux d’estomac et la diarrhée.
Ce médicament contient du sirop de maltitol (maltitol liquide). Si votre médecin vous a informé(e) d’une intolérance à certains sucres, contactez-le avant de prendre ce médicament.
Ce médicament contient 2,85 mg d'alcool (éthanol) par prise de 4 gouttes équivalent à 5,50 mg/ml ou 0,055% p/v. La quantité pour 4 gouttes de ce médicament équivaut à moins de 1 ml de bière ou 1 ml de vin.
La faible quantité d'alcool contenue dans ce médicament n'est pas susceptible d'entraîner d’effets notables.
Ce médicament contient 0,031 mg d’alcool benzylique par prise de 4 gouttes équivalent à 0,06 mg/ml. L’alcool benzylique peut provoquer des réactions allergiques.
L’alcool benzylique est associé à un risque d’effets secondaires graves y compris des problèmes respiratoires (appelés « syndrome de suffocation ») chez les jeunes enfants.
Ne pas utiliser chez le nouveau-né (jusqu’à 4 semaines) sauf recommandation contraire de votre médecin.
Ne pas utiliser plus d’une semaine chez les jeunes enfants (moins de 3 ans), sauf avis contraire de votre médecin ou de votre pharmacien.
Demandez conseil à votre médecin ou à votre pharmacien si vous êtes enceinte ou si vous allaitez. De grandes quantités d’alcool benzylique peuvent s’accumuler dans votre corps et entraîner des effets secondaires (appelés « acidose métabolique »).
Demandez conseil à votre médecin ou à votre pharmacien si vous souffrez d’une maladie du foie ou du rein. De grandes quantités d’alcool benzylique peuvent s’accumuler dans votre corps et entraîner des effets secondaires (appelés « acidose métabolique »).
3. COMMENT PRENDRE ZYMADUO 300 UI, solution buvable en gouttes?
4 gouttes par jour.
Mode et voie d’administration
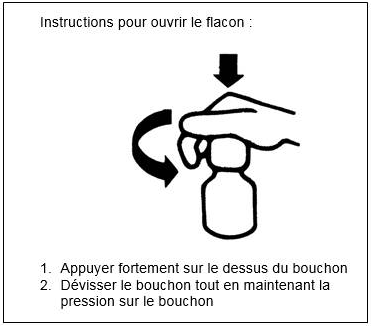
Ce flacon compte-gouttes est équipé d’un bouchon de sécurité.
|
|
|
Après utilisation, bien revisser jusqu’au bout le bouchon afin d’enclencher le système de sécurité.
Voie orale.
Les gouttes peuvent être administrées pures ou diluées dans un peu d’eau ou de jus de fruit (éviter les boissons lactées), en une seule prise quotidienne.
Si vous avez pris plus de ZYMADUO 300 UI, solution buvable en gouttes que vous n’auriez dû :
En cas de surdosage, il faut arrêter le traitement et consulter un médecin.
Si vous oubliez de prendre ZYMADUO 300 UI, solution buvable en gouttes :
Ne pas modifier la posologie habituelle.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Effets indésirables très rares (pouvant survenir chez jusqu'à 1 personne sur 10 000) :
· Réactions cutanées telles que éruption prurigineuse, eczéma, urticaire ;
· Réactions digestives telles que régurgitation, nausées, vomissement notamment en cas de surdosage ;
· Hypercalcémies (augmentation du taux de calcium dans le sang) notamment en cas de surdosage.
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) :
· Hypercalciurie (augmentation du taux de calcium dans les urines).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER ZYMADUO 300 UI, solution buvable en gouttes ?
Tenir hors de la vue et de la portée des enfants.
Ne pas utiliser ZYMADUO 300 UI, solution buvable en gouttes après la date de péremption mentionnée sur le flacon.
Les médicaments ne doivent pas être jetés au tout à l’égout ou avec les ordures ménagères. Demandez à votre pharmacien ce qu’il faut faire des médicaments inutilisés. Ces mesures permettront de protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient ZYMADUO 300 UI, solution buvable en gouttes
· Les substances actives sont :
Cholécalciférol (vitamine D3)............................................................................................. 300 UI
Fluorure de sodium..................................................................................................... 0,1380 mg
Quantité correspondant à fluor....................................................................................... 0,0625 mg
Pour une goutte
4 gouttes contiennent 1200 UI de vitamine D3 et 0,25 mg de fluor.
· Les autres composants sont :
· Huile de ricin hydrogénée polyoxyéthylénée (Crémophor RH 40), poloxamère 407 (Lutrol F127), sirop de maltitol, saccharine sodique, parahydroxybenzoate de méthyle sodé, parahydroxybenzoate de propyle sodé, arôme orange-caramel, Covi-Ox T 70, eau purifiée, solution tampon phosphate.
Qu’est-ce que ZYMADUO 300 UI, solution buvable en gouttes et contenu de l’emballage extérieur
Ce médicament se présente sous forme de solution buvable en gouttes - flacon de 12 ml.
Titulaire de l’autorisation de mise sur le marché
1 BIS PLACE DE LA DEFENSE – TOUR TRINITY
92400 COURBEVOIE
Exploitant de l’autorisation de mise sur le marché
VIATRIS SANTE
1 BIS PLACE DE LA DEFENSE – TOUR TRINITY
92400 COURBEVOIE
DAMASTOWN INDUSTRIAL PARK
MULHUDDART
DUBLIN 15
IRLANDE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Sans objet.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).