Dernière mise à jour le 30/06/2025
OSCILLOCOCCINUM, granules en récipient unidose
Indications thérapeutiques
Classe pharmacothérapeutique : Médicament homéopathique
OSCILLOCOCCINUM est un médicament homéopathique traditionnellement utilisé dans le traitement des états grippaux : fièvre, frissons, maux de tête, courbatures.
Présentations
> 1 boîte(s) de 1 dose(s)
Code CIP : 307 639-2 ou 34009 307 639 2 6
Déclaration de commercialisation : 19/07/1971
Cette présentation n'est pas agréée aux collectivités
> 1 boîte(s) de 6 dose(s)
Code CIP : 328 110-0 ou 34009 328 110 0 7
Déclaration de commercialisation : 19/01/1986
Cette présentation n'est pas agréée aux collectivités
> 1 boîte(s) de 30 dose(s)
Code CIP : 416 620-0 ou 34009 416 620 0 3
Déclaration de commercialisation : 01/09/2011
Cette présentation n'est pas agréée aux collectivités
> 1 boîte(s) de 12 dose(s)
Code CIP : 34009 302 620 4 7
Déclaration de commercialisation : 01/10/2024
Cette présentation n'est pas agréée aux collectivités
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 13/08/2024
OSCILLOCOCCINUM, granules en récipient unidose
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Pour 1 g de granules en récipient unidose.
Excipients : saccharose, lactose.
Pour la liste complète des excipients, voir rubrique 6.1.
Granules en récipient unidose.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Le plus tôt possible, dès l’apparition des premiers symptômes de l’état grippal, prendre une dose ou un sachet 3 fois par jour, pendant 1 à 3 jours.
Mode d’administration
Voie sublinguale.
Chez l’adulte : faire fondre le contenu entier d’une dose ou d’un sachet sous la langue ou dans un peu d’eau.
Chez l’enfant : avant 6 ans, dissoudre les granules dans un peu d’eau en raison du risque de fausse route.
4.4. Mises en garde spéciales et précautions d'emploi
OSCILLOCOCCINUM ne peut se substituer à la vaccination contre la grippe saisonnière.
Ce médicament contient du saccharose. Son utilisation est déconseillée chez les patients présentant une intolérance au fructose, un syndrome de malabsorption du glucose et du galactose ou un déficit en sucrase/isomaltase.
Ce médicament contient du lactose. Son utilisation est déconseillée chez les patients présentant une intolérance au galactose, un déficit de lactase de Lapp ou un syndrome de malabsorption du glucose ou du galactose (maladies héréditaires rares).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
4.6. Fertilité, grossesse et allaitement
Compte-tenu de la hauteur de dilution, et malgré l’absence de données expérimentales et cliniques suffisantes, OSCILLOCOCCINUM peut être pris pendant la grossesse et l’allaitement.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Médicament homéopathique
En l’absence de données scientifiques, l’indication de ce médicament repose sur l’usage homéopathique traditionnel de son composant.
5.2. Propriétés pharmacocinétiques
5.3. Données de sécurité préclinique
5 ans.
6.4. Précautions particulières de conservation
Pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
Récipient unidose (PP/PE) ou sachet.
Boîte de 1 unidose.
Boîte de 6 unidoses.
Boîte de 12 unidoses.
Boîte de 18 unidoses.
Boîte de 30 unidoses.
Boîte de 30 sachets.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
2 AVENUE DE L’OUEST LYONNAIS
69510 MESSIMY
FRANCE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 307 639 2 6 : Boîte de 1 unidose
· 34009 328 110 0 7 : Boîte de 6 unidoses
· 34009 302 620 4 7 : Boîte de 12 unidoses
· 34009 302 620 5 4 : Boîte de 18 unidoses.
· 34009 416 620 0 3 : Boîte de 30 unidoses
· 34009 303 019 4 4 : Boîte de 30 sachets.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
Première autorisation : 13/10/2016
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 13/08/2024
OSCILLOCOCCINUM, granules en récipient unidose
Veuillez lire attentivement cette notice avant de prendre ce médicament car elle contient des informations importantes pour vous.
Vous devez toujours prendre ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin ou votre pharmacien.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre pharmacien pour tout conseil ou information.
· Si vous ressentez l’un des effets indésirables, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien après 3 jours.
1. Qu'est-ce que OSCILLOCOCCINUM, granules en récipient unidose et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre OSCILLOCOCCINUM, granules en récipient unidose ?
3. Comment prendre OSCILLOCOCCINUM, granules en récipient unidose ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver OSCILLOCOCCINUM, granules en récipient unidose ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE OSCILLOCOCCINUM, granules en récipient unidose ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Médicament homéopathique
OSCILLOCOCCINUM est un médicament homéopathique traditionnellement utilisé dans le traitement des états grippaux : fièvre, frissons, maux de tête, courbatures.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE OSCILLOCOCCINUM, granules en récipient unidose ?
Ne prenez jamais OSCILLOCOCCINUM, granules en récipient unidose :
· Si vous êtes allergique (hypersensible) à la substance active ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Avertissements et précautions
Adressez-vous à votre médecin ou votre pharmacien avant de prendre OSCILLOCOCCINUM, granules en récipient unidose.
OSCILLOCOCCINUM ne peut se substituer à la vaccination contre la grippe saisonnière.
Autres médicaments et OSCILLOCOCCINUM, granules en récipient unidose
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
OSCILLOCOCCINUM, granules en récipient unidose avec des aliments, des boissons et de l’alcool
Ce médicament est à prendre à distance des repas.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou votre pharmacien avant de prendre ce médicament.
Compte-tenu de la hauteur de dilution, et malgré l’absence de données expérimentales et cliniques suffisantes, OSCILLOCOCCINUM peut être pris pendant la grossesse et l’allaitement.
Conduite de véhicules et utilisation de machines
Sans objet.
OSCILLOCOCCINUM, granules en récipient unidose contient du saccharose et du lactose.
Ce médicament contient du saccharose. Son utilisation est déconseillée chez les patients présentant une intolérance au fructose, un syndrome de malabsorption du glucose et du galactose ou un déficit en sucrase/isomaltase (maladies héréditaires rares).
Ce médicament contient du lactose. Son utilisation est déconseillée chez les patients présentant une intolérance au galactose, un déficit en lactase de Lapp ou un syndrome de malabsorption du glucose ou du galactose (maladies héréditaires rares).
Si votre médecin vous a informé(e) d’une intolérance à certains sucres, contactez-le avant de prendre ce médicament.
3. COMMENT PRENDRE OSCILLOCOCCINUM, granules en récipient unidose ?
Veillez à toujours prendre ce médicament en suivant exactement les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
Le plus tôt possible, dès l’apparition des premiers symptômes de l’état grippal, prendre 1 dose ou 1 sachet 3 fois par jour, pendant 1 à 3 jours.
Si les symptômes persistent au-delà de 3 jours, consultez votre médecin.
Mode d’administration
Voie sublinguale.
Chez l’adulte : faire fondre le contenu entier d’une dose ou d’un sachet sous la langue ou dans un peu d’eau.
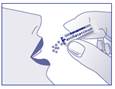

Chez l’enfant : avant 6 ans, dissoudre les granules dans un peu d’eau en raison du risque de fausse route.
Si vous avez pris plus d’OSCILLOCOCCINUM, granules en récipient unidose que vous n’auriez dû
Consultez immédiatement votre médecin ou votre pharmacien.
Si vous oubliez de prendre OSCILLOCOCCINUM, granules en récipient unidose
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez de prendre OSCILLOCOCCINUM, granules en récipient unidose
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER OSCILLOCOCCINUM, granules en récipient unidose ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte. La date de péremption fait référence au dernier jour de ce mois.
Ce médicament ne nécessite pas de précautions particulières de conservation.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient OSCILLOCOCCINUM, granules en récipient unidose :
· La substance active est :
Extrait fluide peptoné de foie et de cœur d’Anas barbariae dynamisé à la 200e K.
· Les autres composants sont :
Saccharose, lactose.
Qu’est-ce que OSCILLOCOCCINUM, granules en récipient unidose et contenu de l’emballage extérieur
OSCILLOCOCCINUM se présente sous la forme de granules en récipient unidose. Ils sont conditionnés dans une boîte de 1, 6, 12, 18 ou 30 unidoses ou une boîte de 30 sachets.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
2 AVENUE DE L’OUEST LYONNAIS
69510 MESSIMY
FRANCE
Exploitant de l’autorisation de mise sur le marché
2 AVENUE DE L’OUEST LYONNAIS
69510 MESSIMY
FRANCE
2 AVENUE DE L’OUEST LYONNAIS
69510 MESSIMY
FRANCE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).