Dernière mise à jour le 30/06/2025
EUPHRASIA 3 DH WELEDA, collyre en solution en récipient unidose
Présentations
> 10 récipient(s) unidose(s) polyéthylène basse densité (PEBD) de 0,4 ml
Code CIP : 344 160-9 ou 34009 344 160 9 5
Déclaration de commercialisation : 07/12/2012
Cette présentation n'est pas agréée aux collectivités
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 14/06/2024
EUPHRASIA 3 DH WELEDA, collyre en solution en récipient unidose
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Euphrasia 3 DH..................................................................................................................... 0,4 ml
Pour un récipient unidose de 0,4 ml.
Le composant de la formule est conforme à la monographie de la Pharmacopée Homéopathique allemande.
Pour la liste complète des excipients, voir rubrique 6.1.
Collyre en solution en récipient unidose de 0,4 ml.
4.1. Indications thérapeutiques
Fatigue ou surmenage oculaire : travail sur écran, jeux vidéo, télévision
Bain en piscine ou en eau de mer
Exposition au vent, pollens, atmosphère polluée, fumée, poussière
4.2. Posologie et mode d'administration
Médicament réservé à l’adulte et à l’enfant de plus de 1 an.
1 goutte dans chaque œil 3 fois par jour.
Mode d’administration
Voie ophtalmique.
Se laver soigneusement les mains avant chaque utilisation. Détacher un récipient unidose de la barrette. Ouvrir l’unidose en tournant l’embout. Tirer la paupière inférieure vers le bas en regardant vers le haut et laisser tomber une goutte de collyre dans le cul de sac conjonctival inférieur (entre la paupière et l’œil). Ne pas toucher les paupières ou les cils ou la surface de l'œil avec l'embout de l'unidose. Cligner plusieurs fois des yeux pour s'assurer d'une bonne diffusion de la solution sur toute la surface de l'œil.
La durée du traitement ne doit pas dépasser 10 jours.
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
· Pour les porteurs de lentilles de contact : instiller le collyre 15 minutes avant la pose des lentilles.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d’interaction n’a été réalisée.
4.6. Fertilité, grossesse et allaitement
En l’absence de données expérimentales et cliniques, et par mesures de précaution, l’utilisation de ce médicament est à éviter pendant la grossesse et l’allaitement.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Des réactions d’irritations oculaires telles que sensation de brûlure, hyperémie, démangeaisons, gonflements ou augmentation de la sécrétion lacrymale ont été rapportées.
Leur fréquence d’apparition n’est pas connue.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Aucun cas de surdosage n’a été rapporté.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : MEDICAMENT HOMEOPATHIQUE.
L’indication de ce médicament repose sur l’usage homéopathique traditionnel de ses composants.
5.2. Propriétés pharmacocinétiques
5.3. Données de sécurité préclinique
Chlorure de sodium, citrate de sodium, acide citrique monohydraté, eau pour préparations injectables
30 mois.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 30°C.
6.5. Nature et contenu de l'emballage extérieur
Boîte en carton contenant 2 barrettes de 5 récipients unidoses de 0,4 ml en polyéthylène basse densité.
6.6. Précautions particulières d’élimination et de manipulation
Un même récipient unidose peut être utilisé pour les deux yeux.
Ne pas conserver un récipient unidose après ouverture. Le récipient unidose doit être jeté après usage.
Pas d’exigences particulières d’élimination. Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
9 RUE EUGENE JUNG
68330 HUNINGUE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 344 160-9 OU 34009 344 160 9 5 : Boîte de 10 unidoses (2 barrettes de 5 unidoses).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 14/06/2024
EUPHRASIA 3DH Weleda, collyre en solution en récipient unidose
Vous devez toujours utiliser ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin ou votre pharmacien.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre pharmacien pour tout conseil ou information.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien après 2 jours.
1. Qu'est-ce que Euphrasia 3 DH WELEDA, collyre en solution en récipient unidose et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser Euphrasia 3 DH WELEDA, collyre en solution en récipient unidose ?
3. Comment utiliser Euphrasia 3 DH WELEDA, collyre en solution en récipient unidose ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver Euphrasia 3 DH WELEDA, collyre en solution en récipient unidose ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE EUPHRASIA 3 DH WELEDA, COLLYRE EN SOLUTION EN RECIPIENT UNIDOSE ET DANS QUELS CAS EST-IL UTILISE ?
Fatigue ou surmenage oculaire : travail sur écran, jeux vidéo, télévision
Bain en piscine ou en eau de mer
Exposition au vent, pollens, atmosphère polluée, fumée, poussière
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER EUPHRASIA 3 DH WELEDA, COLLYRE EN SOLUTION EN RECIPIENT UNIDOSE ?
N’utilisez jamais EUPHRASIA 3 DH WELEDA, collyre en solution en récipient unidose :
· Chez l’enfant de moins d’un an
· si vous êtes allergique à EUPHRASIA ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser EUPHRASIA 3 DH WELEDA, collyre en solution en récipient unidose.
· A réserver aux affections mineures. Si les symptômes augmentent ou persistent plus de deux jours, consulter un médecin.
· Pour les porteurs de lentilles de contact : instiller le collyre 15 minutes avant la pose des lentilles.
Enfants
Sans objet.
Autres médicaments et EUPHRASIA 3 DH WELEDA, collyre en solution en récipient unidose
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
EUPHRASIA 3 DH WELEDA, collyre en solution en récipient unidose avec les aliments et les boissons
Sans objet.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
En l’absence de données expérimentales et cliniques, et par mesures de précaution, l’utilisation de ce médicament est à éviter pendant la grossesse et l’allaitement.
Conduite de véhicules et utilisation de machines
Les effets sur l’aptitude à conduire des véhicules et à utiliser des machines n’ont pas été étudiés. Toutefois, en cas d’effets indésirables oculaires pouvant gêner la conduite ou l’utilisation de machines, il convient d’attendre que les symptômes régressent avant de conduire ou d’utiliser des machines.
EUPHRASIA 3 DH WELEDA, collyre en solution en récipient unidose contient :
Sans objet.
3. COMMENT UTILISER EUPHRASIA 3 DH WELEDA, COLLYRE EN SOLUTION EN RECIPIENT UNIDOSE ?
Médicament réservé à l’adulte et à l’enfant de plus de 1 an.
1 goutte dans chaque œil 3 fois par jour.
Mode d’administration
Voie ophtalmique.
Se laver soigneusement les mains avant chaque utilisation. Détacher un récipient unidose de la barrette. Ouvrir l’unidose en tournant l’embout. Tirer la paupière inférieure vers le bas en regardant vers le haut et laisser tomber une goutte de collyre dans le cul de sac conjonctival inférieur (entre la paupière et l’œil). Ne pas toucher les paupières ou les cils ou la surface de l’œil avec l’embout de l’unidose. Clignez plusieurs fois des yeux pour s’assurer d’une bonne diffusion de la solution sur toute la surface de l’œil. Un même récipient peut être utilisé pour les deux yeux.
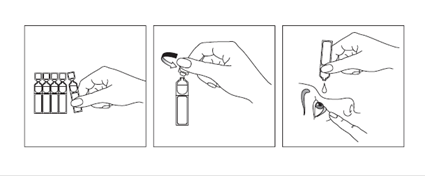
Utiliser le récipient unidose immédiatement après ouverture. Jeter le récipient unidose après usage.
Durée du traitement
La durée du traitement ne doit pas dépasser 10 jours.
Si vous avez utilisé plus de EUPHRASIA 3 DH WELEDA, collyre en solution en récipient unidose que vous n’auriez dû
Sans objet.
Si vous oubliez d’utiliser EUPHRASIA 3 DH WELEDA, collyre en solution en récipient unidose
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre
Si vous arrêtez d’utiliser EUPHRASIA 3 DH WELEDA, collyre en solution en récipient unidose
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Des réactions d’irritations oculaires telles que sensation de brûlures, œil rouge, démangeaisons, gonflement ou augmentation de la sécrétion lacrymale ont été rapportées.
Leur fréquence d’apparition n’est pas connue.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER EUPHRASIA 3 DH WELEDA, COLLYRE EN SOLUTION EN RECIPIENT UNIDOSE ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte et le récipient unidose.
A conserver à une température ne dépassant pas 30°C.
Ne pas conserver un récipient unidose après ouverture.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient EUPHRASIA 3 DH WELEDA, collyre en solution en récipient unidose
· La substance active est :
Euphrasia 3 DH............................................................................................................... 0,4 ml
· Les autres composants sont :
Chlorure de sodium, citrate de sodium, acide citrique monohydraté, eau pour préparations injectables
L’emballage contient 2 barrettes de 5 récipients unidoses de 0,4 ml d’Euphrasia 3 DH WELEDA, collyre en solution
Titulaire de l’autorisation de mise sur le marché
9 RUE EUGENE JUNG
68330 HUNINGUE
Exploitant de l’autorisation de mise sur le marché
LABORATOIRE WELEDA
9 RUE EUGENE JUNG
68330 HUNINGUE
MÖHLERSTR. 3-5
73525 SCHWÄBISCH GMÜND
GERMANY
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).