
ANSM - Mis à jour le : 20/03/2025
PASSEDYL ENFANTS ET NOURRISSONS, sirop
2. COMPOSITION QUALITATIVE ET QUANTITATIVE 
Sulfogaïacol........................................................................................................................ 1,174 g
Benzoate de sodium............................................................................................................. 2,268 g
Pour 100 mL de sirop.
Excipients à effet notoire : parahydroxybenzoate de méthyle sodé (E219) (6,3 mg pour une dose de 5 mL), saccharose (3,1 g pour une dose de 5 mL), éthanol (150 mg pour une dose de 5 mL), propylène glycol (E1520).
Pour la liste complète des excipients, voir rubrique 6.1.
4.1. Indications thérapeutiques 
Traitement d’appoint des troubles de la sécrétion bronchique.
4.2. Posologie et mode d'administration 
Nourrisson et enfant de moins de 5 ans : 1 seringue pour administration orale remplie jusqu’à la graduation 5 mL, 2 à 3 fois par jour.
Enfant de plus de 5 ans : 1 seringue pour administration orale remplie jusqu’à la graduation 5 mL, 3 à 5 fois par jour.
4.4. Mises en garde spéciales et précautions d'emploi 
En cas d'expectoration grasse et purulente, en cas de fièvre ou en cas de maladie chronique des bronches et des poumons, procéder à un réexamen de la situation clinique.
Les toux productives, qui représentent un élément fondamental de la défense broncho-pulmonaire, sont à respecter.
L'association de mucomodificateurs bronchiques avec des antitussifs et/ou des substances asséchant les sécrétions (atropiniques) est irrationnelle.
L'indication ne justifie pas de traitement prolongé.
Précautions d'emploi
La prudence est recommandée chez les sujets atteints d'ulcère gastroduodénal.
Ce médicament contient du parahydroxybenzoate de méthyle sodé (E219) qui peut provoquer des réactions allergiques (éventuellement retardées).
Ce médicament contient 3,1 g de saccharose pour 5 mL de sirop. Ceci est à prendre en compte pour les patients atteints de diabète sucré.
Les patients présentant une intolérance au fructose, un syndrome de malabsorption du glucose et du galactose ou un déficit en sucrase/isomaltase (maladies héréditaires rares) ne doivent pas prendre ce médicament.
Ce médicament contient 150 mg d’alcool (éthanol) pour 5 mL de sirop. La quantité pour 5 mL de ce médicament est équivalente à 4 mL de bière ou 2 mL de vin.
Une dose de 5 prises de 5 mL de ce médicament administrée à un enfant de plus de 5 ans pesant 20 kg entraînerait une exposition à 37,5 mg/kg d'éthanol susceptible de provoquer une augmentation de l'alcoolémie d’environ 2 mg/100 mL. A titre de comparaison, pour un adulte buvant un verre de vin ou 500 mL de bière, le taux d'alcoolémie devrait être d'environ 50 mg/100 mL.
La co-administration de médicaments contenant par exemple du propylène glycol ou de l’éthanol peut entraîner une accumulation d’éthanol et induire des effets indésirables, en particulier chez les jeunes enfants ayant une capacité métabolique faible ou immature.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions 
4.6. Fertilité, grossesse et allaitement 
A utiliser avec prudence chez la femme enceinte ou qui allaite, faute de données cliniques exploitables.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines 
Aucun effet sur l'aptitude à conduire des véhicules et à utiliser des machines n'a été observé.
Possibilité de troubles digestifs (nausées, vomissements).
Réactions d'hypersensibilité.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Sans objet.
5. PROPRIETES PHARMACOLOGIQUES 
5.1. Propriétés pharmacodynamiques 
Classe pharmacothérapeutique : expectorants, code ATC : R : système respiratoire.
5.2. Propriétés pharmacocinétiques 
5.3. Données de sécurité préclinique 
*Composition de l'arôme naturel de fleur d'oranger : Huile essentielle de Néroli, eau de fleur d'oranger, éthanol, linalol.
**Composition de l'arôme caramel : préparations aromatisantes, substances aromatisantes, substances aromatisantes naturelles, propylène glycol (E1520), éthanol.
3 ans.
6.4. Précautions particulières de conservation 
A conserver à une température inférieure à 25°C.
6.5. Nature et contenu de l'emballage extérieur 
125 mL, 150 mL ou 180 mL en flacon (verre brun de type III), bouchon (polypropylène) et joint (polyéthylène).
125 mL en flacon (verre brun de type III), 1 seringue pour administration orale (polyéthylène/polystyrène) avec 1 bouchon sécurité enfant.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation 
Pour ouvrir le flacon, Appuyer fermement sur les côtés du bouchon tout en le tournant.
Le flacon doit être refermé après chaque utilisation.
La dose à administrer pour une prise est obtenue en tirant le piston jusqu’à la graduation 5 mL. La dose se lit au niveau de la collerette de la seringue.
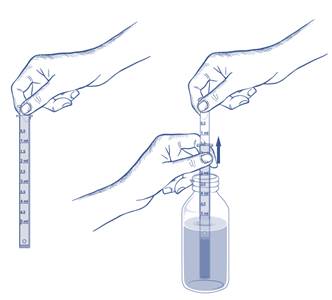
L’usage de la seringue pour administration orale est strictement réservé à l’administration du sirop PASSEDYL ENFANTS ET NOURRISSONS.
La seringue pour administration orale doit être rincée après chaque utilisation. Il ne faut pas la laisser tremper dans le flacon.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE 
42 RUE DE LONGVIC
21300 CHENOVE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE 
· 34009 341 104 0 5 : 125 mL en flacon (verre brun).
· 34009 341 105 7 3 : 150 mL en flacon (verre brun).
· 34009 341 106 3 4 : 180 mL en flacon (verre brun).
· 34009 303 110 8 0 : 125 mL en flacon en verre brun, 1 seringue pour administration orale (polyéthylène/polystyrène) avec un bouchon sécurité enfant en PP et joint en PE.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION 
Date de première autorisation : 2 juillet 1996.
Date de dernier renouvellement : 2 juillet 2011 (durée illimitée)
10. DATE DE MISE A JOUR DU TEXTE 
[à compléter ultérieurement par le titulaire]
<{JJ mois AAAA}>
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES 
Médicament non soumis à prescription médicale.
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |