Dernière mise à jour le 30/06/2025
FLECTOREFFIGEL 1 %, gel
Indications thérapeutiques
Classe pharmacothérapeutique : ANTI-INFLAMMATOIRE NON STEROÏDIEN A USAGE TOPIQUE, code ATC : M02AA15.
Ce médicament est indiqué comme traitement local de courte durée, chez l'adulte et l’enfant de plus de 15 ans, en cas de traumatisme bénin : entorses (foulure), contusion.
Présentations
> 1 tube(s) aluminium verni de 60 g
Code CIP : 277 213-2 ou 34009 277 213 2 8
Déclaration de commercialisation : 02/06/2014
Cette présentation n'est pas agréée aux collectivités
> 1 flacon(s) aluminium de 50 g
Code CIP : 277 215-5 ou 34009 277 215 5 7
Déclaration de commercialisation : 02/06/2014
Cette présentation n'est pas agréée aux collectivités
> 1 tube(s) polyéthylène avec applicateur à billes de 100 g
Code CIP : 34009 302 477 0 9
Déclaration de commercialisation : 02/01/2023
Cette présentation n'est pas agréée aux collectivités
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 08/03/2022
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Quantité correspondante en diclofénac sodique..................................................................... 1,000 g
Pour 100 g de gel
Excipients à effet notoire : huile de ricin hydrogénée polyoxyéthylénée, lécithine de soja soja (2,4 g pour 100 g de gel), et parfum Floral PH contenant du benzoate de méthyle, hydroxycitronellal, alcool cinnamique, amyl cinnamal et salicylate de benzyle.
Pour la liste complète des excipients, voir rubrique 6.1.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
1 application, 3 fois par jour.
Durée de traitement
La durée de traitement est limitée à 4 jours.
Mode d’administration
Voie locale – Réservé à l’adulte et à l’enfant de plus de 15 ans.
USAGE EXTERNE
Faire pénétrer le gel par un massage doux et prolongé sur la région douloureuse ou inflammatoire.
Bien se laver les mains après chaque utilisation.
Ce médicament est contre-indiqué dans les cas suivants :
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
· grossesse, à partir du début du 6ème mois (au-delà de 24 semaines d’aménorrhée) (voir rubrique 4.6),
· peau lésée, quelle que soit la lésion : dermatoses suintantes, eczéma, lésion infectée, brûlure ou plaie.
· L’utilisation chez les patients allergiques à l’arachide au ou soja est contre-indiquée.
4.4. Mises en garde spéciales et précautions d'emploi
· l’apparition d’une éruption cutanée après application impose l’arrêt immédiat du traitement ;
· Ce médicament contient de l’huile de ricin et peut provoquer des réactions cutanées.
· Ce médicament contient du benzoate de méthyle pouvant provoquer une irritation locale.
· Ce médicament contient un parfum contenant les allergènes suivants pouvant provoquer des réactions allergiques : hydroxycitronellal, alcool cinnamique, amyl cinnamal, benzoate de méthyle et salicylate de benzyle.
· Ce médicament ne doit pas être utilisé sous pansement occlusif.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
En raison du faible passage systémique lors d’un usage normal du gel, les interactions médicamenteuses signalées pour le diclofénac en per os sont peu probables.
4.6. Fertilité, grossesse et allaitement
Grossesse
L’inhibition de la synthèse des prostaglandines par les AINS peut affecter le déroulement de la grossesse et/ou le développement de l’embryon ou du fœtus.
Risques associés à l’utilisation au cours du 1er trimestre
Les données des études épidémiologiques suggèrent une augmentation du risque de fausse-couche, de malformations cardiaques et de gastroschisis, après traitement par un inhibiteur de la synthèse des prostaglandines en début de grossesse. Le risque absolu de malformation cardiovasculaire est passé de moins de 1% dans la population générale, à approximativement 1,5 % chez les personnes exposées aux AINS. Le risque paraît augmenter en fonction de la dose et de la durée du traitement. Chez l’animal, il a été montré que l’administration d’un inhibiteur de la synthèse des prostaglandines provoquait une perte pré et post-implantatoire accrue et une augmentation de la létalité embryo-foetale. De plus, une incidence supérieure de certaines malformations, y compris cardiovasculaires, a été rapportée chez des animaux ayant reçu un inhibiteur de la synthèse des prostaglandines au cours de la phase d’organogénèse de la gestation.
Risques associés à l’utilisation à partir de la 12ème semaine d’aménorrhée et jusqu’à la naissance :
· A partir de la 12ème semaine d’aménorrhée et jusqu’à la naissance, tous les AINS, par l’inhibition de la synthèse des prostaglandines, peuvent exposer le fœtus à une atteinte fonctionnelle rénale :
o in utero pouvant s'observer dès 12 semaines d'aménorrhée (mise en route de la diurèse fœtale) : oligoamnios (le plus souvent réversible à l'arrêt du traitement), voire anamnios en particulier lors d'une exposition prolongée.
o à la naissance, une insuffisance rénale (réversible ou non) peut persister en particulier en cas d'exposition tardive et prolongée (avec un risque d'hyperkaliémie sévère retardée).
Risques associés à l’utilisation au-delà de la 24ème semaine d’aménorrhée et jusqu’à la naissance:
Au-delà de la 24ème semaine d’aménorrhée, les AINS peuvent exposer le fœtus à une toxicité cardio-pulmonaire (fermeture prématurée du canal artériel et hypertension artérielle pulmonaire). La constriction du canal artériel peut survenir à partir du début du 6ème mois (au-delà de la 24ème semaine d’aménorrhée) et peut conduire à une insuffisance cardiaque droite fœtale ou néonatale voire à une mort fœtale in utero. Ce risque est d'autant plus important que la prise est proche du terme (moindre réversibilité). Cet effet existe même pour une prise ponctuelle.
En fin de grossesse, la mère et le nouveau-né peuvent présenter :
- un allongement du temps de saignement du fait d’une action anti-agrégante pouvant survenir même après administration de très faibles doses de médicament ;
- une inhibition des contractions utérines entraînant un retard de terme ou un accouchement prolongé.
En conséquence :
Sauf nécessité absolue, ce médicament ne doit pas être prescrit chez une femme qui envisage une grossesse ou au cours des 5 premiers mois de grossesse (24 premières semaines d’aménorrhée). Si ce médicament est administré chez une femme souhaitant être enceinte ou enceinte de moins de 6 mois, la dose devra être la plus faible possible et la durée du traitement la plus courte possible. Une prise prolongée est fortement déconseillée.
A partir du début du 6ème mois (au-delà de 24 semaines d'aménorrhée): toute prise de ce médicament, même ponctuelle, est contre-indiquée. Une prise par mégarde à partir de cette date justifie une surveillance cardiaque et rénale, fœtale et/ou néonatale selon le terme d'exposition. La durée de cette surveillance sera adaptée à la demi-vie d'élimination de la molécule
Les A.I.N.S. passant dans le lait maternel, ce médicament est déconseillé chez la femme qui allaite.
En cas d'allaitement, ce médicament ne doit en aucun cas être appliqué sur la poitrine.
Fertilité
Comme tous les AINS, l'utilisation de ce médicament peut temporairement altérer la fertilité féminine en agissant sur l’ovulation ; il est donc déconseillé chez les femmes souhaitant concevoir un enfant. Chez les femmes rencontrant des difficultés pour concevoir ou réalisant des tests de fertilité, l'arrêt du traitement doit être envisagé.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Fréquents :
Réactions cutanées : éruptions, eczéma ; érythèmes, dermatites (incluant les dermatites de contact).
Rares :
Réactions cutanées : dermatose bulleuse. Un prurit associé est parfois observé.
Très rares et cas isolés :
Réactions cutanées : éruption pustuleuse, urticaire, purpura, ulcérations locales.
Réactions d'hypersensibilité ; œdème angioneurotique (œdème de Quincke).
Problèmes respiratoires : la survenue de crise d'asthme peut être liée chez certains sujets à une allergie à l'aspirine ou à un AINS. Dans ce cas, ce médicament est contre-indiqué.
Autres réactions cutanées : cas isolés de photosensibilité.
Fréquence inconnue :
Sensation de brûlure au niveau du site d’application, sécheresse cutanée.
Autres effets systémiques des AINS :
Ils sont fonction du passage transdermique du principe actif et donc de la quantité de gel appliquée, de la surface traitée, du degré d'intégrité cutanée, de la durée du traitement et de l'utilisation ou non d'un pansement occlusif (effets digestifs, rénaux).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
En cas de surdosage, rincer abondamment à l’eau.
En cas d’ingestion accidentelle, des effets similaires à ceux observés en cas de surdosage de diclofénac par voie orale et ayant pour conséquence des effets indésirables peuvent survenir. Les mesures thérapeutiques qui s’imposent sont celles généralement adoptées en cas d’intoxication avec les AINS. Le lavage gastrique et l’administration de charbon actif doivent être envisagés, surtout lorsque l’ingestion est récente
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : ANTI-INFLAMMATOIRE NON STEROÏDIEN A USAGE TOPIQUE, code ATC : M02AA15.
Le diclofénac est un anti-inflammatoire non stéroïdien, dérivé de l’acide phénylacétique du groupe des acides arylcarboxyliques.
Sous forme de gel, il possède une activité locale anti-inflammatoire et antalgique.
5.2. Propriétés pharmacocinétiques
Appliqué localement sous forme de gel, le diclofénac est absorbé à travers la peau.
Le passage systémique du gel, par rapport à celui des formes orales de diclofénac chez les volontaires sains, est de l'ordre de 6 %, par estimation d'après son excrétion urinaire et celle de ses métabolites hydroxylés, après administration unique.
Le passage systémique du gel, par rapport à celui des formes orales de diclofénac chez les volontaires sains, est de l'ordre de 13,9 % après administration réitérée.
Les concentrations mesurées dans le liquide synovial, de même que dans le tissu synovial, sont 40 fois supérieures aux concentrations plasmatiques.
5.3. Données de sécurité préclinique
Chez l’animal, l’administration d’un inhibiteur de la synthèse de la prostaglandine a montré une augmentation des pertes pré- et post-implantatoires ainsi qu’une létalité embryo-fœtale. De plus, une augmentation de l’incidence de diverses malformations, dont cardiovasculaires, a été rapportée chez l’animal après administration d’un inhibiteur de la synthèse de la prostaglandine durant l’organogenèse.
* Principaux composants du parfum floral PH :
Acétate de benzyle, phényléthyl alcool, hydroxycitronellal, petit grain oil paraguay, alcool cinnamique, propylèneglycol, amyl cinnamal, salicylate de benzyle, benzoate de méthyle.
3 ans.
Tube
Avant ouverture : 3 ans.
Après ouverture : 18 mois.
Tube avec applicateur à billes :
Avant ouverture : 3 ans
Après ouverture : 12 mois
6.4. Précautions particulières de conservation
Pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
50 g (tube en aluminium verni)
60 g (tube en aluminium verni)
100 g (tube en aluminium verni)
100 g (tube polyéthylène basse densité linéaire / polyéthylène à haute densité, copolymère d’éthylène et d’alcool vinylique), applicateur en polypropylène avec trois billes en acier.
50 g en flacon (aluminium) consistant à 50 g de gel dans un « sac » laminé constitué de 4 couches (polyester – aluminium – polyamide – polyéthylène basse densité linéaire) contenu sous pression d’air dans un flacon en aluminium muni d’une tête de distribution en polypropylène.
60 g en flacon (aluminium) consistant à 60 g de gel dans un « sac » laminé constitué de 4 couches (polyester – aluminium – polyamide – polyéthylène basse densité linéaire) contenu sous pression d’air dans un flacon en aluminium muni d’une tête de distribution en polypropylène.
100 g en flacon (aluminium) consistant à 100 g de gel dans un « sac » laminé constitué de 4 couches (polyester – aluminium – polyamide – polyéthylène basse densité linéaire) contenu sous pression d’air dans un flacon en aluminium muni d’une tête de distribution en polypropylène.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
parc de sophia-antipolis
LES TROIS MOULINS, 280 RUE DE GOA
06600 ANTIBES
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 277 212-6 ou 34009 277 212 6 7 : 1 tube aluminium verni de 50 g.
· 277 213-2 ou 34009 277 213 2 8 : 1 tube aluminium verni de 60 g.
· 277 214-9 ou 34009 277 214 9 6 : 1 tube aluminium verni de 100 g.
· 277 215-5 ou 34009 277 215 5 7 : 1 flacon aluminium de 50 g.
· 277 216-1 ou 34009 277 216 1 8 : 1 flacon aluminium de 60 g.
· 277 217-8 ou 34009 277 217 8 6 : 1 flacon aluminium de 100 g
· 34009 302 477 0 9 : 1 tube polyéthylène avec applicateur à billes de 100 g
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
Date de première autorisation:17 avril 2014
10. DATE DE MISE A JOUR DU TEXTE
<{JJ mois AAAA}>
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 08/03/2022
Diclofénac épolamine
Vous devez toujours utiliser ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin ou votre pharmacien.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre pharmacien pour tout conseil ou information.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien.
1. Qu'est-ce que FLECTOREFFIGEL 1%, gel et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser FLECTOREFFIGEL 1%, gel ?
3. Comment utiliser FLECTOREFFIGEL 1%, gel ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver FLECTOREFFIGEL 1%, gel ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE FLECTOREFFIGEL 1%, gel ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : ANTI-INFLAMMATOIRE NON STEROÏDIEN A USAGE TOPIQUE, code ATC : M02AA15.
Ce médicament est indiqué comme traitement local de courte durée, chez l'adulte et l’enfant de plus de 15 ans, en cas de traumatisme bénin : entorses (foulure), contusion.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER FLECTOREFFIGEL 1%, gel ?
N’utilisez jamais FLECTOREFFIGEL 1%, gel :
· si vous êtes allergique à la substance active ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· en cas d’allergie à l’un des excipients,
· si vous êtes enceinte, à partir du début du 6ème mois de grossesse (au-delà de 24 semaines d’aménorrhée),
· sur peau lésée, quelle que soit la lésion : lésions suintantes, eczéma, lésion infectée, brûlure ou plaie.
· Ce médicament contient de la lécithine de soja. Si vous êtes allergique à l’arachide ou au soja, ne pas utiliser ce médicament.
EN CAS DE DOUTE, IL EST INDISPENSABLE DE DEMANDER L’AVIS DE VOTRE MEDECIN OU DE VOTRE PHARMACIEN
Faites attention avec FLECTOREFFIGEL 1%, gel :
Mises en garde
· Ne pas appliquer sur les muqueuses, ni sur les yeux.
· L'apparition d'une éruption cutanée après application impose l'arrêt immédiat du traitement.
· Ce médicament contient de l’huile de ricin et peut provoquer des réactions cutanées.
· Ce médicament contient un parfum contenant les allergènes suivants pouvant provoquer des réactions allergiques : hydroxycitronellal, alcool cinnamique, amyl cinnamal et salicylate de benzyle.
· Ce médicament contient du benzoate de méthyle et peut provoquer une irritation locale.
Précautions d’emploi
Ce médicament ne doit pas être utilisé sous pansement occlusif.
EN L'ABSENCE D'AMELIORATION au bout de 4 jours de traitement, CONSULTEZ votre MEDECIN.
Si vous êtes enceinte ou si vous allaitez : n’utilisez pas ce médicament de votre propre initiative. Demandez l’avis de votre médecin ou de votre pharmacien.
N’utilisez pas ce gel chez l’enfant (moins de 15 ans).
Enfants
Sans objet.
Autres médicaments et FLECTOREFFIGEL 1%, gel
Veuillez indiquer à votre médecin ou à votre pharmacien si vous prenez ou avez pris récemment un autre médicament, même s’il s’agit d’un médicament obtenu sans ordonnance.
Ce médicament contient du Diclofénac. D’autres médicaments en contiennent et notamment certains médicaments pris par voie orale Ne les associez pas, afin de ne pas dépasser les doses maximales conseillées (voir Posologie et Mode d’administration).
FLECTOREFFIGEL 1%, gel avec des aliments et boissons
Sans objet.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre tout médicament.
Grossesse
Avant le début du 6ème mois de grossesse (jusqu’à la 24ème semaine d’aménorrhée), vous ne devez pas prendre ce médicament, sauf en cas d’absolue nécessité déterminée par votre médecin, en raison du risque potentiel de fausses couches ou de malformations. Dans ce cas, la dose devra être la plus faible possible et la durée du traitement la plus courte possible.
A partir du début du 6ème mois jusqu’à la fin de la grossesse (au-delà de la 24ème semaine d’aménorrhée), ce médicament est contre-indiqué, vous ne devez EN AUCUN CAS prendre ce médicament, car ses effets sur votre enfant peuvent avoir des conséquences graves voire fatales, notamment sur le cœur, les poumons et/ou les reins, et cela même avec une seule prise.
Si vous avez pris ce médicament alors que vous étiez enceinte, parlez-en immédiatement à votre gynécologue obstétricien, afin qu’une surveillance adaptée vous soit proposée si nécessaire.
Allaitement
Ce médicament passant dans le lait maternel, il est déconseillé de l'utiliser pendant l'allaitement.
En cas d'allaitement, ce médicament ne doit en aucun cas être appliqué sur les seins.
Fertilité
Ce médicament, comme tous les anti-inflammatoires non stéroïdiens (AINS), peut altérer la fertilité des femmes et entraîner des difficultés pour devenir enceinte, de façon réversible à l’arrêt du traitement. Informez votre médecin si vous planifiez une grossesse ou si vous avez des difficultés à concevoir.
Conduite de véhicules et utilisation de machines
Bien que cela soit peu probable lors de l’utilisation d’un AINS topique, FLECTOREFFIGEL 1%, gel peut provoquer des vertiges. Si cela vous arrive, abstenez-vous de conduire des véhicules ou d’utiliser des machines.
FLECTOREFFIGEL 1%, gel contient de l’huile de ricin hydrogénée polyoxyéthylénée, lécithine de soja et un parfum Floral PH contenant du benzoate de méthyle, hydroxycitronellal, alcool cinnamique, amyl cinnamal et salicylate de benzyle.
3. COMMENT UTILISER FLECTOREFFIGEL 1%, gel ?
1 application 3 fois par jour.
Mode d’administration
Voie cutanée.
USAGE EXTERNE.
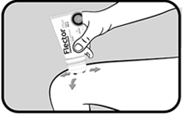
Faire pénétrer le gel par un massage doux et prolongé sur la région douloureuse ou inflammatoire.
Bien se laver les mains après chaque utilisation.
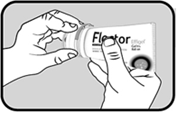
Pour le tube avec applicateur à billes voir figure 1 :
Figure 1 :
|
|
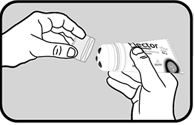
Dévisser et retirer le bouchon transparent. |
|
|
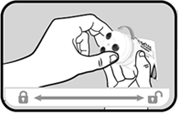
Débloquer le système de verrouillage du tube en tournant le système applicateur dans le sens inverse des aiguilles d’une montre (encoche « cadenas fermé » vers l’encoche « cadenas ouvert » jusqu’à entendre un clic). |
|
|
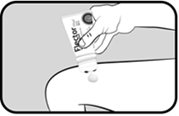
Appuyer sur le corps du tube pour faire sortir la quantité de gel nécessaire sur la zone douloureuse ou inflammatoire grâce à l’orifice situé au centre de l’applicateur. |
|
|
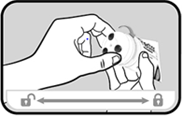
Refermer le système de verrouillage en tournant le système applicateur dans le sens des aiguilles d’une montre (encoche « cadenas ouvert » vers « cadenas fermé ») jusqu’à entendre un clic. |
|
|
Masser la zone douloureuse ou inflammatoire avec l’applicateur à billes pour faire pénétrer le gel. |
|
|
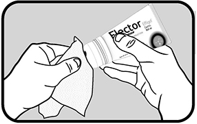
Nettoyer les billes à l’aide d’un tissu sec ou d’un papier absorbant afin que les billes soient sèches et propres. Ne pas utiliser d’eau ou tout autre produit pour le nettoyage. Le papier doit être jeté dans une poubelle ou le tissu nettoyé avant toute autre utilisation. |
|
|
Revisser le bouchon transparent. |
Durée du traitement
La durée du traitement est limitée à 4 jours
Si vous avez utilisé plus de FLECTOREFFIGEL 1%, gel que vous n’auriez dû
En cas de surdosage, rincer abondamment à l’eau et appliquer éventuellement un traitement symptomatique
Si vous oubliez d’utiliser FLECTOREFFIGEL 1%, gel
Si vous arrêtez d’utiliser FLECTOREFFIGEL 1%, gel
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Exceptionnellement peuvent survenir des réactions pouvant être sévères :
· réactions allergiques cutanées : éruption (boutons), urticaire, bulles,
· problèmes respiratoires de type crise d'asthme (souffle bruyant et court, impression de capacité respiratoire diminuée),
· manifestations générales de type anaphylaxie (gonflement de la face, des lèvres, de la langue, de la gorge).
Il faut immédiatement interrompre le traitement et avertir votre médecin ou votre pharmacien.
Plus fréquemment, peuvent survenir des effets indésirables, généralement légers et passagers :
· des effets locaux cutanés de type rougeur, démangeaisons, irritation cutanée, érosion ou ulcérations locales,
· très exceptionnellement, une augmentation de la sensibilité au soleil,
· d’autres effets généraux des anti-inflammatoires non stéroïdiens, fonction de la quantité de gel appliquée, de la surface traitée et de son état, de la durée du traitement et de l’utilisation ou non d’un pansement occlusif (fermé).
A une fréquence inconnue, peuvent survenir : une sensation de brûlure au site d’application et de la sécheresse cutanée.
Il faut en avertir votre médecin ou votre pharmacien.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER FLECTOREFFIGEL 1%, gel ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte.
Tube :
FLECTOREFFIGEL 1% gel en tube doit être utilisé dans les 18 mois suivant sa première ouverture.
Tube avec applicateurs à billes :
FLECTOREFFIGEL 1% gel en tube avec applicateur à billes doit être utilisé dans les 12 mois suivant sa première ouverture.
Flacon pressurisé :
Après ouverture, FLECTOREFFIGEL 1% gel en flacon pressurisé doit être utilisé avant la date mentionnée sur l’emballage extérieur.
Pas de précautions particulières de conservation.
Les médicaments ne doivent pas être jetés au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien ce qu’il faut faire des médicaments inutilisés. Ces mesures permettront de protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient FLECTOREFFIGEL 1%, gel
· La substance active est :
Diclofénac épolamine..................................................................................................... 1,293 g
Quantité correspondante en diclofénac sodique............................................................... 1,000 g
Pour 100 g de gel.
· Les autres composants sont :
huile de ricin hydrogénée polyoxyéthylénée, stéarate de macrogol, lécithine de soja, acide acrylique polymérisé, hydroxyde de sodium, isopropanol, parfum Floral PH*, eau purifiée.
*Principaux composants du parfum floral PH :
Pour les excipients à effet notoire, se reporter à la section 2.
Qu’est-ce que FLECTOREFFIGEL 1%, gel et contenu de l’emballage extérieur
Ce médicament se présente sous forme de gel. Boîte de 1 tube de 50 g, 60 g ou 100 g ou 1 tube avec applicateur à billes de 100 g ou boîte de 1 flacon pressurisé de 50 g, de 60 g ou 100 g. Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
parc de sophia-ANTIPOLIS
LES TROIS MOULINS, 280 RUE DE GOA
06600 ANTIBES
Exploitant de l’autorisation de mise sur le marché
parc de sophia-ANTIPOLIS
LES TROIS MOULINS, 280 RUE DE GOA
06600 ANTIBES
VIA MARTIRI DI CEFALONIA 2
26900 LODI (LO)
ITALIE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Conseil d’éducation sanitaire
Vous venez d’avoir un traumatisme ou une contusion, vous pouvez utiliser le gel pour soulager votre douleur, mais :
En cas d'entorse de la cheville :
· si vous ne pouvez absolument pas vous mettre en appui sur la jambe pour faire quelques pas,
· ou si un hématome (bleu) apparaît dans les 24h à 48h ou s'il existe une déformation ou un œdème (gonflement) très important,
Vous devez consulter votre médecin qui seul jugera de la nécessité d'une radiographie et d'un traitement orthopédique ;
En cas de lésion du genou :
· En cas de gonflement important du genou avec ou sans hématome et/ou d'impossibilité d'appui,
Vous devez aussi consulter votre médecin ;
Dans tous les cas :
· S'il existe une impotence fonctionnelle complète, c'est à dire si vous ne pouvez-vous servir du membre supérieur ou du membre inférieur et en cas d'hématome ("bleu") important,
Vous devez aussi consulter sans tarder votre médecin.