Dernière mise à jour le 30/06/2025
FLUOSTEROL 0,25 mg/800 U.I./dose, solution buvable
Indications thérapeutiques
Ce médicament est une association de vitamine D3 et de fluor.
Chez le nourrisson de 6 à 18 mois, administration de fluor et de vitamine D dans le cadre de la prophylaxie conjointe:
· de la carie dentaire chez les enfants particulièrement exposés à ce risque et lorsque l'apport total en fluor est inférieur à 0,3 mg/j;
· ainsi que des états de carences vitaminiques D, en cas d'utilisation d'un lait supplémenté en vitamine D.
Présentations
> 1 flacon(s) polyéthylène avec fermeture de sécurité enfant de 22,5 ml avec seringue(s) pour administration orale polyéthylène polystyrène
Code CIP : 357 184-9 ou 34009 357 184 9 5
Déclaration de commercialisation : 01/08/2003
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 2,54 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 3,56 €
- Taux de remboursement :30%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Modéré | Avis du 20/11/2013 | Renouvellement d'inscription (CT) | Le service médical rendu par la spécialité FLUOSTEROL reste modéré dans l’indication de son AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 12/11/2003 | Inscription (CT) | Absence d’amélioration du service médical rendu par rapport à ZYMADUO 150 UI, solution buvable en gouttes. |
ANSM - Mis à jour le : 03/05/2021
FLUOSTEROL 0,25 mg/800 U.I./dose, solution buvable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Fluor.................................................................................................................................. 0,1000 g
Sous forme de fluorure de sodium...................................................................................... 0,2212 g
Cholécalciférol (Vitamine D3)............................................................................................ 320 000 UI
Sous forme de concentrat de cholécalciférol, forme pulvérulente.......................................... 0,0080 g
Pour 100 ml.
Excipients à effet notoire : huile de ricin hydrogénée polyoxyéthylénée, maltitol, parahydroxybenzoate de propyle sodique, parahydroxybenzoate de méthyle sodique.
Pour la liste complète des excipients, voir rubrique 6.1.
4.1. Indications thérapeutiques
Chez le nourrisson de 6 à 18 mois, administration de fluor et de vitamine D dans le cadre de la prophylaxie conjointe:
· de la carie dentaire chez les enfants particulièrement exposés à ce risque et lorsque l'apport total en fluor est inférieur à 0,3 mg/j;
· ainsi que des états de carences vitaminiques D, en cas d'utilisation d'un lait supplémenté en vitamine D.
4.2. Posologie et mode d'administration
Une dose (1/4 ml) par jour soit 0,553 mg, de fluorure de sodium (0,25 mg fluor) et 800 UI de Vitamine D3.
Mode d'administration
Voie orale.
Le produit peut être avalé dans un peu d'eau ou de jus de fruit.
Une seringue doseuse facilite la prescription et l'administration orale de Fluostérol.
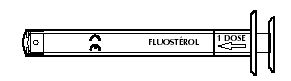
Pour délivrer une dose de produit (0,25 ml), tirer doucement le piston jusqu'à la butée pour faire coïncider le trait 1 dose avec la butée de la seringue pour administration orale.

Dans le cas de dépassement de la butée, le piston n'aspire plus le produit, évitant ainsi un surdosage.

Après utilisation, rincer à l'eau claire et essuyer la seringue pour administration orale, ne pas la stériliser.
· Hypersensibilité connue à l'un des constituants,
· Hypercalcémie, hypercalciurie, lithiase calcique.
· Dans les régions où la teneur en fluor dans l'eau de distribution est supérieure à 0,3 mg/l.
En France, 85% de la population vit dans des régions où la teneur en fluor est inférieure ou égale à 0,3 mg/l. En cas de doute, il est conseillé de s'enquérir auprès de la mairie ou de la DDASS du taux local de fluor dans l'eau de distribution.
4.4. Mises en garde spéciales et précautions d'emploi
Ce médicament contient de l’huile de ricin et peut provoquer des troubles digestifs (effet laxatif léger, diarrhée).
Ce médicament contient du maltitol. Son utilisation est déconseillée chez les patients présentant une intolérance au fructose.
Ce médicament contient du parahydroxybenzoate de méthyle sodé, du parahydroxybenzoate de propyle sodé et peut provoquer des réactions allergiques (éventuellement retardées).
La supplémentation fluorée médicamenteuse chez les nourrissons de plus de 6 mois doit être adaptée à l’âge et aux autres sources potentielles : sel fluoré, eaux de distribution ou minérales, dentifrices fluorés.
La supplémentation fluorée ne dispense pas d'une bonne hygiène bucco-dentaire et alimentaire: limitation des sucres, tout particulièrement sous forme de grignotages et de boissons sucrées entre les repas, éducation précoce du brossage des dents après chaque repas avec un dentifrice fluoré adapté à l'âge, consultation régulière chez le dentiste.
L'apport non contrôlé de fluor pendant plusieurs mois ou années peut être à l'origine d'une fluorose. Afin d'éviter les cumuls, il est indispensable d'établir un bilan personnalisé des apports en fluor (eaux de distribution et minérales, sel fluoré, médicaments sous forme de comprimés, de gouttes, de gommes à mâcher ou de dentifrices fluorés) avant toute prescription fluorée.
Il convient de prendre en compte avec précision la teneur en fluor des eaux embouteillées.
Les eaux minéralisées qui comportent un taux de fluor supérieur à 0,3 mg/l ne doivent pas être utilisées pour la préparation des biberons, en association à une supplémentation fluorée.
Pour éviter tout surdosage, tenir compte des doses totales de vitamine D en cas d'association de plusieurs traitements contenant déjà cette vitamine.
En cas d'apport en calcium, un contrôle régulier de la calciurie est indispensable.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
L'ingestion simultanée de lait ou de produit laitier, de même que d'antiacides à base de sels de magnésium ou d'aluminium doit être évitée.
4.6. Fertilité, grossesse et allaitement
Sans objet.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.ansm.sante.fr.
Surdosage dû au fluor
· Intoxication aiguë :
Chez l'adulte ou l'enfant, la dose toxique est de 5 mg de fluor/kg (dose minimale pouvant induire les symptômes d'intoxication).
Elle se manifeste par des troubles digestifs: vomissements, diarrhée, douleurs abdominales et peut mener exceptionnellement au décès.
Lors d'ingestion importante accidentelle, le traitement immédiat consiste en lavage d'estomac ou vomissements provoqués, ingestion de calcium (importante quantité de lait) et surveillance médicale de plusieurs heures.
· Intoxication chronique: la fluorose :
Aspect tacheté ou moucheté de l'émail dentaire pouvant apparaître à partir d'une absorption quotidienne d'une dose de fluor supérieure à 1,5mg/j (0,10 mg de fluor/kg/j chez l'enfant jusqu'à 6 ans), pendant plusieurs mois ou années selon l'importance du surdosage. Elle s'accompagne d'une fragilité de l'émail dans les formes sévères.
La fluorose osseuse ne s'observe qu'avec de fortes absorptions chroniques (supérieures à 8 mg/j).
Surdosage dû à la vitamine D
Signes cliniques :
· céphalées, asthénie, anorexie, amaigrissement, arrêt de croissance,
· nausées, vomissements,
· polyurie, polydipsie, déshydratation,
· hypertension artérielle,
· lithiase calcique, calcifications tissulaires, en particulier rénales et vasculaires,
· insuffisance rénale.
Signes biologiques : Hypercalcémie, hypercalciurie, hyperphosphatémie, hyperphosphaturie.
Conduite à tenir :
Cesser l'administration de vitamine D, réduire les apports calciques, augmenter la diurèse, boissons abondantes.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
AUTRES SUPPLEMENTS MINERAUX, Code ATC: A12CD51.
(A: Appareil digestif et métabolisme).
Les fluorures jouent un rôle essentiel dans la prévention des caries dentaires.
Ils exercent un effet systémique pendant la période de minéralisation des dents, complété d'un effet topique après l'éruption dentaire.
Ces deux voies sont interdépendantes et complémentaires. En effet, lors de l'ingestion d'un produit fluoré, le fluor est en contact avec les surfaces dentaires au cours de son passage dans la cavité buccale, exerçant ainsi une action topique.
A l'inverse, le fluor topique peut être partiellement ingéré et s'intègre alors à la voie systémique.
Les effets du fluor sont de trois types:
· un effet bactéricide sur les germes de la plaque dentaire. Les conséquences sont une inhibition de la prolifération bactérienne de la plaque dentaire et une inhibition de la formation des acides cariogènes,
· une diminution du seuil de la solubilité de l'émail en milieu acide,
· une reminéralisation des lésions carieuses initiales de l'émail.
(Le fluor ne saurait toutefois suffire à l'élimination de la plaque bactérienne ou au traitement des caries).
Le rôle essentiel de la vitamine D s'exerce sur l'intestin dont elle augmente la capacité à absorber le calcium et les phosphates et sur le squelette, dont elle favorise la minéralisation (grâce à ses actions directes sur l'os en formation et à ses actions indirectes impliquant l'intestin, les parathyroïdes et l'os déjà minéralisé).
5.2. Propriétés pharmacocinétiques
Les fluorures sont bien absorbés au niveau gastro-intestinal.
Le pic de concentration est obtenu entre 30 minutes et une heure après la prise. Les ions fluorures se concentrent dans les tissus durs de l'organisme: dents et os. Ils sont éliminés par voie urinaire.
La vitamine D est absorbée dans l'intestin grêle de façon passive, puis rejoint la circulation générale par voie lymphatique, incorporée aux chylomicrons.
Après absorption, elle se lie à une protéine porteuse spécifique et est transportée jusqu'au foie pour y être convertie en 25-hydroxyvitamine D.
Cette dernière se lie à son tour à la même protéine porteuse et est transportée jusqu'aux reins où elle est transformée en sa forme active, la 1,25-dihydroxyvitamine D.
Ses sites de stockage essentiels sont le tissu adipeux, les muscles, mais aussi le sang. La 25-hydroxyvitamine D liée à sa protéine porteuse est la forme majeure de réserve circulante de la vitamine D. Sa demi-vie dans le sang est de 15 à 40 jours.
L'élimination de la vitamine D et de ses métabolites se fait par voie fécale, sous forme non transformée ou sous forme hydrosoluble (acide calcitroïque, dérivés glycuroconjugués).
5.3. Données de sécurité préclinique
2 ans.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas + 25°C.
6.5. Nature et contenu de l'emballage extérieur
22,5 ml en flacon (PE) muni d’un bouchon sécurité enfant avec seringue pour administration orale (PE/Polystyrène).
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
1 Bis rue René Anjolvy
94250 GENTILLY
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 357 184-95: 22,5 ml en flacon (PE) avec seringue pour administration orale (PE/Polystyrène).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 03/05/2021
FLUOSTEROL 0,25 mg/800 U.I./dose, solution buvable
Cholécalciférol / Fluorure de sodium
Si vous avez d’autres questions, si vous avez un doute, demandez plus d’informations à votre médecin ou à votre pharmacien.
· Gardez cette notice, vous pourriez avoir besoin de la relire.
· Si vous avez besoin de plus d'informations et de conseils, adressez-vous à votre pharmacien.
· Si les symptômes s'aggravent ou persistent, consultez un médecin.
· Si vous remarquez des effets indésirables non mentionnés dans cette notice, ou si vous ressentez un des effets mentionnés comme étant grave, veuillez en informer votre médecin ou votre pharmacien.
1. Qu'est-ce que FLUOSTEROL 0,25 mg/800 U.I./dose, solution buvable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre FLUOSTEROL 0,25 mg/800 U.I./dose, solution buvable ?
3. Comment prendre FLUOSTEROL 0,25 mg/800 U.I./dose, solution buvable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver FLUOSTEROL 0,25 mg/800 U.I./dose, solution buvable ?
6. Informations supplémentaires.
1. QU’EST-CE QUE FLUOSTEROL 0,25 mg/800 U.I./dose, solution buvable ET DANS QUELS CAS EST-IL UTILISE ?
Ce médicament est une association de vitamine D3 et de fluor.
Chez le nourrisson de 6 à 18 mois, administration de fluor et de vitamine D dans le cadre de la prophylaxie conjointe:
· de la carie dentaire chez les enfants particulièrement exposés à ce risque et lorsque l'apport total en fluor est inférieur à 0,3 mg/j;
· ainsi que des états de carences vitaminiques D, en cas d'utilisation d'un lait supplémenté en vitamine D.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE FLUOSTEROL 0,25 mg/800 U.I./dose, solution buvable ?
Ne prenez jamais FLUOSTEROL 0,25 mg/800 U.I./dose, solution buvable dans les cas suivants :
· allergie à la vitamine D,
· augmentation du taux de calcium dans le sang ou les urines, calcul rénal,
· allergie à l'un des constituants tel que huile de ricin hydrogénée polyoxyéthylénée (crémophor RH 40),
· dans les régions où la teneur en fluor dans l'eau de distribution est supérieure à 0,3 mg/l. En France, 85% de la population vit dans des régions où la teneur en fluor est inférieure ou égale à 0,3 mg/l. En cas de doute, il est conseillé de s'enquérir auprès de la mairie ou de la DDASS du taux local de fluor dans l'eau de distribution.
Faites attention avec FLUOSTEROL 0,25 mg/800 U.I./dose, solution buvable:
Ce médicament contient de l’huile de ricin et peut provoquer des troubles digestifs (effet laxatif léger, diarrhée).
Ce médicament contient du maltitol. Son utilisation est déconseillée chez les patients présentant une intolérance au fructose (maladies héréditaires rares).
Ce médicament contient du parahydroxybenzoate de méthyle sodé, du parahydroxybenzoate de propyle sodé et peut provoquer des réactions allergiques.
La supplémentation fluorée médicamenteuse chez les nourrissons de plus de 6 mois doit être adaptée à l’âge et aux autres sources potentielles : sel fluoré, eaux de distribution ou minérales, dentifrices fluorés.
La supplémentation fluorée ne dispense pas d'une bonne hygiène bucco-dentaire et alimentaire: limitation des sucres, tout particulièrement sous forme de grignotages et de boissons sucrées entre les repas, éducation précoce du brossage des dents après chaque repas avec un dentifrice fluoré adapté à l'âge, consultation régulière chez le dentiste.
L'apport non contrôlé de fluor pendant plusieurs mois ou années peut être à l'origine d'une fluorose. Afin d'éviter les cumuls, il est indispensable d'établir un bilan personnalisé des apports en fluor (eaux de distribution et minérales, sel fluoré, médicaments sous forme de comprimés, de gouttes, de gomme à mâcher ou de dentifrices fluorés) avant toute prescription fluorée.
Il convient de prendre en compte avec précision la teneur en fluor des eaux embouteillées.
Les eaux minéralisées qui comportent un taux de fluor supérieur à 0,3 mg/l ne doivent pas être utilisées pour la préparation des biberons, en association à une supplémentation fluorée.
Afin d'éviter tout surdosage, tenir compte des doses totales de vitamine D en cas d'association avec un traitement contenant déjà cette vitamine.
Prise ou utilisation d'autres médicaments
Ne pas administrer simultanément des antiacides à base de sels de magnésium ou d'aluminium, de même que certains minéraux tels que calcium, magnésium ou fer pouvant diminuer l'absorption du produit.
Veuillez indiquer à votre médecin ou à votre pharmacien si vous prenez ou avez pris récemment un autre médicament, même s'il s'agit d'un médicament obtenu sans ordonnance.
FLUOSTEROL 0,25 mg/800 U.I./dose, solution buvable avec des aliments et, boissons et de l’alcool
Sans objet.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Sportifs
Sans objet.
Conduite de véhicules et utilisation de machines
Sans objet.
Liste des excipients à effet notoire : huile de ricin hydrogénée polyoxyéthylénée, maltitol, parahydroxybenzoate de propyle sodique, parahydroxybenzoate de méthyle sodique.
3. COMMENT PRENDRE FLUOSTEROL 0,25 mg/800 U.I./dose, solution buvable ?
Posologie
La posologie doit être strictement respectée.
Nourrisson de 6 à 18 mois:
Une dose (0,25 ml) par jour soit 0,553 mg de fluorure de sodium (0,25 mg de fluor) et 800 UI de vitamine D3.
Mode d’administration
Voie orale.
Le produit peut être avalé dans un peu d'eau ou de jus de fruit.
Il convient d'espacer l'administration de ce produit de la prise de lait ou de produit laitier.
Prélever la dose à administrer avec la seringue pour administration orale fournie avec le flacon.
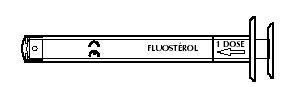
Pour délivrer une dose de produit (0,25 ml), tirer doucement le piston jusqu'à la butée pour faire coïncider le trait 1 dose avec la butée de la seringue pour administration orale.

Dans le cas de dépassement de la butée, le piston n'aspire plus le produit, évitant ainsi un surdosage.

Après utilisation, rincer à l'eau claire et essuyer la seringue pour administration orale, ne pas la stériliser.
Si vous avez pris FLUOSTEROL 0,25 mg/800 UI/dose, solution buvable plus que vous n'auriez dû :
Consultez immédiatement votre médecin ou votre pharmacien.
Si vous oubliez de prendre FLUOSTEROL 0,25 mg/800 UI/dose, solution buvable :
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Si vous remarquez des effets indésirables non mentionnés dans cette notice, ou si certains effets indésirables deviennent graves, veuillez en informer votre médecin ou votre pharmacien.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.ansm.sante.fr.
5. COMMENT CONSERVER FLUOSTEROL 0,25 mg/800 U.I./dose, solution buvable ?
Tenir hors de la portée et de la vue des enfants.
Ne pas utiliser FLUOSTEROL 0,25 mg/800 U.I./dose, solution buvable après la date de péremption mentionnée sur la boite.
A conserver à une température ne dépassant pas +25°C.
Les médicaments ne doivent pas être jetés au tout à l’égout ou avec les ordures ménagères.
Demandez à votre pharmacien ce qu’il faut faire des médicaments inutilisés. Ces mesures permettront de protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient FLUOSTEROL 0,25 mg/800 U.I./dose, solution buvable ?
· La substance active est :
Fluor.................................................................................................................................. 0,1000 g
Sous forme de fluorure de sodium...................................................................................... 0,2212 g
Cholécalciférol (Vitamine D3)............................................................................................ 320 000 UI
Sous forme de concentrat de cholécalciférol, forme pulvérulente.......................................... 0,0080 g
Pour 100 ml.
· Les autres composants sont :
Alpha-tocophérol (COVIOX T 70), parahydroxybenzoate de propyle sodique, parahydroxybenzoate de méthyle sodique, arôme fruits rouges, saccharine sodique, huile de ricin hydrogénée polyoxyéthylénée (CREMOPHOR RH 40), maltitol liquide, eau purifiée, phosphate disodique dodécahydraté, acide citrique anhydre.
Qu’est-ce que FLUOSTEROL 0,25 mg/800 U.I./dose, solution buvable et contenu de l’emballage extérieur
Ce médicament se présente sous forme de solution buvable. Flacon muni d’un bouchon sécurisé enfant avec seringue pour administration orale.
Titulaire de l’autorisation de mise sur le marché
1 Bis rue René Anjolvy
94250 GENTILLY
Exploitant de l’autorisation de mise sur le marché
1 Bis rue René Anjolvy
94250 GENTILLY
1 Bis rue René Anjolvy
94250 GENTILLY
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’Ansm (www.ansm.sante.fr).