Dernière mise à jour le 06/11/2025
LORAMYC 50 mg, comprimé buccogingival muco-adhésif
Indications thérapeutiques
Classe pharmacothérapeutique - code ATC : Anti-infectieux pour traitement oral local - A01AB09.
Ce médicament est indiqué dans le traitement des infections dues à des champignons ou des levures microscopiques (Candida) de la cavité buccale (la bouche et la gorge) chez des personnes immunodéprimées (dont les mécanismes de défense de l'organisme sont diminués).
Présentations
> flacon(s) polyéthylène haute densité (PEHD) de 14 comprimé(s)
Code CIP : 377 236-4 ou 34009 377 236 4 0
Déclaration de commercialisation : 03/09/2007
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 64,69 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 65,71 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 07/06/2017 | Renouvellement d'inscription (CT) | Le service médical rendu par LORAMYC 50 mg reste important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 28/03/2007 | Inscription (CT) | LORAMYC, comprimé gingival muco-adhésif de miconazole, n'apporte pas d'amélioration du service médical rendu par rapport au miconazole gel buccal (ASMR V). Néanmoins, la commission souligne que cette nouvelle forme galénique représente un moyen thérapeutique utile pour les patients. |
ANSM - Mis à jour le : 17/01/2022
LORAMYC 50 mg, comprimé buccogingival muco-adhésif
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque comprimé muco-adhésif contient 50 mg de miconazole.
Excipients : lactose monohydraté, concentré de protéines de lait, laurylsulfate de sodium
Pour la liste complète des excipients, voir rubrique 6.1.
Comprimé buccogingival muco-adhésif.
Comprimé blanc à légèrement jaune avec une face bombée et une face plate gravée « L ».
4.1. Indications thérapeutiques
Loramyc est indiqué dans le traitement des candidoses oropharyngées chez les patients immunodéprimés (voir rubrique 5.1).
4.2. Posologie et mode d'administration
Voie gingivale.
Réservé à l’Adulte :
Application d’un comprimé buccal muco-adhésif une fois par jour, pendant 7 à 14 jours en fonction de la réponse clinique. Il est préférable d’appliquer le comprimé le matin, après le brossage des dents, le flux salivaire étant moins important la nuit.
LORAMYC peut être administré avec les aliments et les boissons.
En cas de guérison clinique (c'est-à-dire la disparition complète des signes et des symptômes de la maladie) après 7 jours de traitement, la prise de LORAMYC peut être interrompue.
Lorsque les lésions de la candidose oropharyngée sont étendues ou confluentes, le traitement doit être poursuivi jusqu'à guérison clinique ou jusqu'à 14 jours.
Mode d’administration
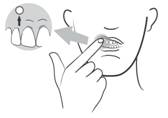
LORAMYC doit être appliqué sur la gencive supérieure, juste au-dessus de l’incisive :
· Une fois le comprimé sorti du flacon, il doit être utilisé immédiatement. Il est à noter que le comprimé a une face bombée et une face plate.
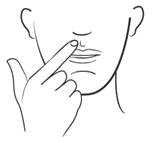
· La face bombée du comprimé doit être appliquée sur la gencive supérieure au-dessus d’une incisive. Maintenir le comprimé en place pendant 30 secondes en appliquant une légère pression du doigt à l’extérieur de la lèvre supérieure.
· Si le comprimé ne colle pas, il doit être repositionné.
· Si le comprimé tombe mais n’est pas avalé dans les 6 premières heures, il doit être remplacé immédiatement.
· Si LORAMYC est avalé accidentellement, il est recommandé de boire un verre d’eau. S’il est avalé dans les 6 premières heures après son application, le comprimé ne doit être remplacé qu’une seule fois.
· A chaque nouvelle application de LORAMYC, le comprimé doit être appliqué sur le côté opposé de la gencive supérieure par rapport à l’application précédente.
Personne âgée :
LORAMYC peut être administré aux personnes âgées.
Population pédiatrique :
Il n’y a pas d’expérience chez l’enfant.
Ce médicament NE DOIT PAS ETRE UTILISE dans les cas suivants :
· Hypersensibilité à la substance active, à d’autres dérivés imidazolés ou à l’un des excipients mentionnés dans la rubrique 6.1.
· Hypersensibilité au lait ou produits dérivés.
· Insuffisance hépatique.
· En association avec les antivitamines K, les sulfamides hypoglycémiants, le cisapride, le pimozide et les alcaloïdes de l’ergot : ergotamine, dihydroergotamine (voir rubrique 4.5).
4.4. Mises en garde spéciales et précautions d'emploi
L’association de LORAMYC avec l’halofantrine est déconseillée (voir rubrique 4.5).
L’association de LORAMYC avec la phénytoine ou la fosphenytoïne.nécessite des précautions particulières.
Ce médicament est contre-indiqué chez les patients présentant une intolérance au galactose, un déficit total en lactase ou un syndrome de malabsorption du glucose et du galactose (maladies héréditaires rares).
Une irritation locale a rarement été observée après l’application de LORAMYC.
Ce médicament contient 5.18 mg de laurylsulfate de sodium dans un comprimé buccogingival mucoadhésif.
Le laurylsulfate de sodium peut provoquer des réactions cutanées locales (comme une sensation de piqûre ou de brûlure) ou augmenter les réactions cutanées causées par d’autres produits lorsqu’ils sont appliqués sur la même zone.
Des réactions sévères d’hypersensibilité, incluant une anaphylaxie et un angioedème, ont été rapportées pendant le traitement avec les formes à base de miconazole. Si une réaction suggérant une hypersensibilité ou une irritation se produit, le traitement doit être arrêté.
LORAMYC devant être appliqué sur la gencive supérieure, juste au-dessus de l’incisive :
· Toutes les situations qui pourraient perturber l’adhésion du comprimé doivent être évitées telles que toucher ou appuyer à l’endroit où le comprimé est placé. Mâcher du chewing-gum doit également être évité.
· Le comprimé ne doit pas être sucé, mâché ou avalé.
· Si le brossage des dents est effectué au cours de la journée, il convient de prendre soin de ne pas toucher le comprimé et de se rincer la bouche avec précaution.
· Si la bouche devient sèche, humidifier la gencive avant d'appliquer le comprimé buccogingival muco-adhésif.
· Si le comprimé tombe ou est avalé accidentellement dans les 6 premières heures, il doit être remplacé immédiatement.
· Une ingestion accidentelle de LORAMYC peut survenir. Si LORAMYC est avalé accidentellement il est recommandé de boire un verre d’eau.
Le taux de guérison clinique est moins élevé chez les patients ayant des candidoses oropharyngées étendues ou confluentes.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Bien que l’absorption systémique de LORAMYC ait été insuffisamment évaluée, l’administration de médicaments à marge thérapeutique étroite et qui sont métabolisés par le CYP2C9 et le CYP3A4 est contre-indiquée du fait d’une exposition accrue (voir rubrique 4.3).
Associations contre-indiquées
+ Antivitamines K
Hémorragies imprévisibles, éventuellement graves.
+ Cisapride
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
+ Pimozide
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
+ Alcaloïdes de l’ergot : ergotamine et dihydroergotamine
Risque d’ergotisme avec nécrose des extrémités.
+ Sulfamides hypoglycémiants
Augmentation de l’effet hypoglycémiant avec survenue possible de manifestations hypoglycémiques, voire de coma.
Associations déconseillées
+ Halofantrine
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Associations faisant l'objet de précautions d’emploi
+ Phénytoïne (et par extrapolation, fosphénytoïne)
Augmentation des concentrations plasmatiques de phénytoïne pouvant atteindre des valeurs toxiques. Mécanisme invoqué : inhibition du métabolisme hépatique de la phénytoïne.
Surveillance clinique étroite, dosage de la phénytoïne plasmatique et adaptation éventuelle de sa posologie pendant le traitement avec miconazole et après son arrêt.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n’y a pas de données suffisamment pertinentes sur l’utilisation du miconazole chez la femme enceinte. Les études effectuées chez l’animal n’ont pas mis en évidence d’effet tératogène, mais d’autres effets sur la reproduction ont été observés (voir rubrique 5.3). Le risque chez l’Homme est inconnu. Le miconazole ne doit être utilisé au cours de la grossesse que si nécessaire.
Il n’existe pas de données sur l’excrétion du miconazole dans le lait maternel. En conséquence la prudence s’impose en cas de prescription chez la femme en cours d’allaitement.
En cas de prise de cisapride chez le nouveau-né ou le nourrisson allaité, l’administration du miconazole à la mère est contre-indiquée par mesure de prudence, en raison du risque potentiel d’interaction chez l’enfant (torsades de pointes).
Fertilité
Il n’y a pas de données disponibles concernant l’effet du miconazole sur la fertilité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
La sécurité de LORAMYC a été évaluée chez 740 patients inclus dans cinq études cliniques. Les effets indésirables graves les plus fréquemment observés incluaient des troubles gastro-intestinaux.
Tableau des effets indésirables :
Les effets indésirables suivants ont été rapportés des 5 études cliniques conduites à la dose recommandée de 50 mg par jour pendant 7 ou 14 jours avec les fréquences correspondantes à :
(très fréquent (≥1/10); fréquent (≥1/100, <1/10); peu fréquent (≥1/1000, <1/100); rare (≥1/10000, <1/1000); très rare (<1/10000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
Classe de systèmes organes |
Fréquent |
Peu fréquent |
Indéterminée |
|
Infections et infestations |
Infections des voies respiratoires supérieures |
|
|
|
Troubles du métabolisme et de la nutrition |
|
Diminution de l’appétit |
|
|
Affections du système nerveux |
Maux de tête Dysgueusie Agueusie |
|
|
|
Troubles vasculaires |
|
Bouffées de chaleur |
|
|
Affections gastro-intestinales |
Diarrhée Vomissement Nausée Douleur abdominale Glossodynie Bouche sèche Gêne dans la bouche |
Ulcération buccale Douleur gingivale Prurit gingival |
|
|
Affections de la peau et du tissu sous-cutané |
Eruption cutanée Prurit |
|
Pustulose exanthémateuse aiguë généralisée Réactions cutanées graves* |
|
Troubles généraux et anomalies au site d’administration |
Douleur au niveau du site d’application Irritation au niveau du site d’application pouvant aller jusqu’à l’ulcère ou l’érosion Fatigue |
|
|
*Compte-tenu d’un faible passage systémique du miconazole lors de l’administration de LORAMYC 50 mg buccogingival mucoadhésif, la survenue d’effets indésirables non dose-dépendants décrits avec certains dérivés azolés tels que des réactions cutanées graves autres que celle mentionnée dans le tableau ci-dessus (syndrome de Stevens-Johnson, nécrolyse épidermique toxique) ne peut être exclue.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Symptômes
En cas de surdosage accidentel, des vomissements et des diarrhées peuvent survenir.
Traitement
Il n’existe aucun antidote connu du miconazole. Le surdosage doit être traité symptomatiquement.
En cas d'ingestion accidentelle de grande quantité de LORAMYC, une méthode adaptée de lavage gastrique peut être utilisée si nécessaire.
Aucun cas de surdosage n’a été reporté avec LORAMYC.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : ANTIINFECTIEUX POUR TRAITEMENT ORAL LOCAL, code ATC A01AB09.
Mécanisme d’action
Le miconazole exerce son activité antifongique en inhibant la biosynthèse de l’ergostérol dans la membrane cellulaire de l’organisme pathogène. A faible concentration, il interagit avec le cytochrome P450 fongique, ce qui entraîne une inhibition de la 14-α-déméthylation, une étape de la biosynthèse de l’ergostérol. La déplétion en ergostérol et l’accumulation concomitante en lanostérol conduisent à des altérations d’un certain nombre de fonctions membranaires. Le miconazole présente un effet fongistatique par l’inhibition de la synthèse de stérol membranaire et un effet fongicide par altération de la fonction de barrière de la membrane fongique.
Microbiologie
Le miconazole possède un large spectre d’activité antifongique. Il est actif sur les espèces de Candida, y compris C. albicans, et aussi les espèces non albicans telles que C. glabrata, C. krusei, C. parapsilosis, C. tropicalis, et C. pseudotropicalis.
Le miconazole possède également une activité antibactérienne contre les bactéries Gram-positif (y compris Streptococcus pyogenes, Staphylococcus aureus et Erysipelothrix insidiosa).
Les espèces de Candida les plus fréquemment rencontrées dans les candidoses buccales (C. albicans, C. glabrata, C. krusei et C. tropicalis) sont sensibles au miconazole.
Dans la plupart des études récentes, la Concentration Minimale Inhibitrice (CMI) de miconazole varie de 0,03 à 1 µg/ml pour C. albicans et de 0,03 à 4 µg/ml pour C. non-albicans, dont C. glabrata et C. krusei qui sont intrinsèquement résistant au fluconazole.
Dans les essais cliniques chez les patients VIH positifs, Candida albicans est l'espèce la plus répandue (87,5%). Chez les patients atteints de cancer de la tête et du cou, parmi les 321 isolats identifiés à l’inclusion, Candida albicans représente 62,6% des isolats et Candida non-albicans 37,4% [dont C. tropicalis (30,8%), C. krusei (22,5%), et C. glabrata (10,8%)].
La CMI90 de miconazole pour les isolats cliniques de Candida (C. albicans: 87,5%, C. tropicalis 8% et C. parapsilosis 2,1%) mesurée au cours d'un essai clinique chez 577 patients VIH positifs, était de 0,25 µg/ml avant le traitement. Après 14 jours de traitement, aucune résistance au miconazole n’a été détectée.
Résistance aux médicaments
Une résistance clinique aux agents triazolés utilisés par voie systémique peut se produire dans les espèces de Candida. La résistance est déterminée par des mécanismes multiples, principalement des modifications en acides aminés et/ou dans la régulation de l'enzyme cible et de pompes à efflux. Plusieurs mécanismes co-existent fréquemment dans le même isolat. La résistance croisée parmi les azolés n'est pas complète, même au sein de la sous-classe des triazolés. La résistance croisée est fonction d'un certain nombre de facteurs, notamment les espèces évaluées, l’histoire clinique, le composé azolé choisi comme comparateur et le type de test de sensibilité qui est effectué.
Les concentrations critiques de résistance, corrélant l’activité in vitro avec l'efficacité clinique, n'ont pas été établies pour le miconazole.
Aucune résistance primaire des espèces de Candida vis-à-vis du miconazole, un azolé appartenant à la classe des imidazolés, n’a été décrite dans la littérature, et la résistance acquise au miconazole a rarement été décrite, même chez les patients traités à plusieurs reprises. Dans des expériences in vitro avec 150 isolats cliniques récents, l'exposition répétée au miconazole n'induit pas de résistance parmi les espèces de Candida sensibles ou résistantes aux triazolés.
Toutefois, une augmentation significative de la CMI du miconazole a été observée chez 2 souches sur 6 de Candida même si les CMIs sont restées inférieures à 0,5 µg/ml.
Par conséquent, l'émergence de souches résistantes au miconazole ne doit pas être exclue après une exposition répétée à des traitements antifongiques.
Expérience clinique
Dans une étude randomisée, comparative, en aveugle pour l’investigateur, menée chez des patients atteints d’un cancer de la tête et du cou ayant été traités par radiothérapie (tous les patients avaient une mucite, une inflammation buccale ou un érythème et 96% avaient un flux salivaire réduit), le taux de réponse au jour 14 et le taux de rechute au jour 60 chez les patients ayant une réponse clinique complète (aucune lésion orale) étaient :
|
|
Loramyc 50 mg |
Gel de miconazole |
|
Population mITT |
N=141 |
N=141 |
|
Taux de réponse clinique complète |
52.48% |
45.39% |
|
Différence de traitement (IC 95%) |
+7.09 (-19.0; 4.8) |
|
|
Taux de rechute au jour 60 (95% CI) |
21.62% (13.79; 32.31) |
17.19% (9.92; 28.27) |
|
Population PP |
N=107 |
N=106 |
|
Taux de réponse clinique complète |
53.27% |
51.89% |
|
Différence de traitement (IC 95%) |
+1.38 (-15.1 ; 12.3) |
|
|
Taux de rechute au jour 60 (95% CI) |
24.56 (15.26; 37.17) |
14.55 (7.62; 26.22) |
Dans une étude comparative, randomisée, en double aveugle, menée chez des patients VIH positifs, le taux de guérison clinique (aucun signe et aucun symptôme de candidose oropharyngée) après un traitement de 14 jours (entre le jour 17 et le jour 22) et le taux de rechute au jour 35 étaient les suivants :
|
|
Loramyc 50 mg |
Pastilles de clotrimazole 10 mg |
|
Population ITT |
N=290 |
N=287 |
|
Taux de guérison clinique |
60.7% |
65.2% |
|
Différence de traitement (IC 95%) |
-4.5 (-12.4;3.4) |
|
|
Taux de rechute au jour 35 (95% IC) |
27.9% (21.3; 35.2) |
28.1% (21.8; 35.2) |
|
Population PP |
N=240 |
N=236 |
|
Taux de guérison clinique |
68.3% |
74.2% |
|
Différence de traitement (IC 95%) |
-5.9 (-14.0;2.2) |
|
|
Taux de rechute au jour 35 (95% IC) |
26.9% (20.2; 34.4) |
27.6% (21.1; 34.9) |
Dans une étude ouverte, non comparative, incluant 25 patients VIH positifs traités avec le Loramyc, le taux de réponse au jour 14 était de 84% (IC 95%: 63,9; 95,5) et le taux de rechute au jour 45 était de 38,5% (IC95: 13,8 ; 68,4) chez les patients ayant une guérison clinique (aucun signe, aucun symptôme de candidose oropharyngée).
Les patients VIH positifs inclus dans les études cliniques étaient très immunodéprimés. Plus de 50% avaient un taux de CD4+ <250/mm3, et 5% avaient un taux de CD4+ <50/mm3, la charge virale était élevée (117 000 copies/ml).
Globalement dans les essais cliniques, 94,3% des comprimés de Loramyc adhérent à la gencive pendant plus de 6 heures
5.2. Propriétés pharmacocinétiques
En cas d’insuffisance rénale, la pharmacocinétique du miconazole n’est pas altérée de façon significative. Il n’y a pas de métabolites actifs et la demi-vie d’élimination est de l’ordre de 20 heures.
Une administration unique de LORAMYC contenant 50 mg de miconazole à des sujets sains conduit à une concentration salivaire maximale moyenne de 15 µg/ml, atteinte 7 heures après l’administration du comprimé avec une aire sous la courbe (AUC0-24h) de 55,23 µg.h/ml.
Après l'application d'un seul comprimé de Loramyc 50 mg, les concentrations salivaires de miconazole supérieures à 1 µg/ml (limite supérieure de la valeur de la CMI pour les souches de C. albicans) ont été atteintes en 1 heure et ont duré en moyenne 13 heures.
Les concentrations plasmatiques du miconazole étaient indétectables car inférieures à la limite de quantification (0,4 µg/ml) chez la majorité des sujets sains confirmant la faible absorption du miconazole à travers les muqueuses buccales et dans le tractus gastro-intestinal après déglutition de la salive.
Après 7 jours de traitement chez les patients, les concentrations plasmatiques de miconazole étaient indétectables (limite de quantification : 0,2 ng/ml) chez 21,5% des patients et étaient négligeables (inférieures à 10 ng/ml) chez plus de 90% des patients.
5.3. Données de sécurité préclinique
Des effets embryotoxiques mais non tératogènes du miconazole ont été observé dans les études de reproduction.
La batterie standard de tests de génotoxicité (Ames, aberration chromosomique, micronucleus) n'a pas révélé de potentiel génotoxique.
Les études de tolérance locale (sur poche jugale de hamster et test de sensibilisation de LLNA chez la souris) n'ont pas révélé de toxicité particulière.
Aucune étude de cancérogenèse n'a été conduite avec le miconazole
6.4. Précautions particulières de conservation
Ce médicament ne nécessite pas de précautions particulières de conservation concernant la température.
Conserver le flacon soigneusement fermé, à l’abri de l’humidité.
6.5. Nature et contenu de l'emballage extérieur
14 comprimés en flacon (PEHD) avec bouchon de sécurité enfant (polypropylène) contenant un agent dessiccant.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières pour l’élimination.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
230 BUREAUX DE LA COLLINE
92213 SAINT-CLOUD CEDEX
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 377 236 4 0 : 14 comprimés en flacon (PEHD).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Liste I
Médicament soumis à prescription médicale.
ANSM - Mis à jour le : 17/01/2022
LORAMYC 50 mg, comprimé buccogingival muco-adhésif
Miconazole
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que LORAMYC 50 mg, comprimé buccogingival muco-adhésif et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser LORAMYC 50 mg, comprimé buccogingival muco-adhésif ?
3. Comment utiliser LORAMYC 50 mg, comprimé buccogingival muco-adhésif ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver LORAMYC 50 mg, comprimé buccogingival muco-adhésif ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE LORAMYC 50 mg, comprimé buccogingival muco-adhésif ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC : Anti-infectieux pour traitement oral local - A01AB09.
Ce médicament est indiqué dans le traitement des infections dues à des champignons ou des levures microscopiques (Candida) de la cavité buccale (la bouche et la gorge) chez des personnes immunodéprimées (dont les mécanismes de défense de l'organisme sont diminués).
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER LORAMYC 50 mg, comprimé buccogingival muco-adhésif ?
N’utilisez jamais LORAMYC 50 mg, comprimé buccogingival muco-adhésif :
· Si vous êtes allergique (hypersensible) à la substance active (miconazole), à d’autres médicaments antifongiques similaires ou à l’un des autres composants contenus dans LORAMYC (mentionnés dans la rubrique 6),
· Si vous êtes allergique au lait ou aux produits dérivés du lait,
· Si vous avez une insuffisance hépatique (défaillance des fonctions du foie),
· En association avec les anticoagulants oraux (médicaments destinés à ralentir la coagulation), les sulfamides hypoglycémiants (médicaments utilisés en cas de diabète), le cisapride (médicament utilisé pour le traitement du reflux gastro-oesophagien), le pimozide (médicament utilisé dans certains troubles de l’humeur), les alcaloïdes de l’ergot : ergotamine, dihydroergotamine (médicaments utilisés pour le traitement de la migraine) (voir Utilisation d’autres médicaments).
Avertissements et précautions
· Evitez toutes les situations qui pourraient perturber l’adhésion du comprimé : ne pas toucher ou appuyer à l’endroit où le comprimé est placé, évitez de mâcher du chewing-gum,
· Si vous vous brossez les dents pendant la journée, ne pas heurter le comprimé lors du brossage et se rincer la bouche avec précaution,
· Si vous avez la bouche sèche, humidifier la gencive avant d'appliquer le comprimé.
· Si le comprimé est avalé accidentellement, il est recommandé de boire un verre d’eau. S’il est avalé dans les 6 heures qui suivent son application, il ne doit être remplacé qu'une seule fois,
· Si le comprimé tombe dans les 6 heures mais n’est pas avalé, remplacez-le immédiatement.
Adressez-vous à votre médecin ou votre pharmacien avant d’utiliser LORAMYC.
Enfants et adolescents
Sans objet.
Autres médicaments et LORAMYC
N’utilisez jamais LORAMYC en association avec :
· Les anticoagulants oraux (médicaments destinés à ralentir la coagulation),
· Le cisapride (médicament utilisé dans le reflux gastro-oesophagien),
· Le pimozide (médicament utilisé dans certains troubles de l’humeur),
· Les sulfamides hypoglycémiants (médicaments utilisés en cas de diabète),
· Les alcaloïdes de l’ergot : ergotamine, dihydroergotamine (médicaments utilisés en cas de migraine).
LORAMYC est généralement déconseillé en association avec :
· L’halofantrine (médicament utilisé dans le traitement du paludisme).
L’utilisation de LORAMYC est à éviter en cas d'association avec :
· La phénytoïne (médicament utilisé dans le traitement de l’épilepsie).
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
LORAMYC avec des aliments et boissons
LORAMYC peut être pris avec les aliments et les boissons.
Grossesse et allaitement
Grossesse
Il est préférable de ne pas utiliser ce médicament pendant la grossesse.
Si vous découvrez que vous êtes enceinte pendant le traitement, consultez votre médecin car lui seul peut juger de la nécessité de le poursuivre.
Allaitement
On ne sait pas si LORAMYC passe dans le lait maternel. Demandez conseil à votre médecin avant d’utiliser ce médicament.
Si votre enfant est traité avec un médicament qui contient du cisapride, vous ne devez pas utiliser LORAMYC pendant l’allaitement.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
LORAMYC ne devrait pas avoir d’effet sur la conduite ou l’utilisation de machines.
LORAMYC 50 mg, comprimé buccogingival muco-adhésif contient du lactose, des dérivés du lait et du laurylsulfate de sodium
Si vous avez une intolérance à certains sucres, contactez votre médecin avant d’utiliser ce médicament.
N’utilisez pas LORAMYC si vous êtes allergique au lait ou aux produits dérivés du lait.
LORAMYC contient 5.18 mg de laurysulfate de sodium par comprimé. Le laurylsulfate de sodium peut provoquer des réactions cutanées locales (comme une sensation de piqûre ou de brûlure) ou augmenter les réactions cutanées causées par d’autres produits lorsqu’ils sont appliqués sur la même zone.
3. COMMENT UTILISER LORAMYC 50 mg, comprimé buccogingival muco-adhésif ?
LORAMYC doit être appliqué sur la gencive supérieure, juste au-dessus de l’incisive, le matin et de préférence après le brossage des dents.
· Avant l’application du comprimé, repérez l’endroit où le comprimé doit être appliqué sur la gencive supérieure, juste au-dessus d’une incisive.
· Ouvrez le flacon et prenez un comprimé. Appliquez le comprimé immédiatement après l’avoir sorti du flacon. Vous remarquerez que le comprimé a une face bombée et une face plate gravée « L ».
· Appliquez la face bombée sur la gencive supérieure.
|
|
· Maintenez en place le comprimé par une légère pression du doigt à l’extérieur de la lèvre supérieure pendant 30 secondes. Cela permettra au système de coller à la gencive. Evitez de toucher le comprimé avec la langue dans les minutes qui suivent.
|
|
· Ne pas sucer, mâcher ou avaler le comprimé.
· Si vous avalez un comprimé de LORAMYC accidentellement, buvez un verre d’eau.
· A chaque application, changez de côté de gencive.
· Replacez le comprimé s’il n’adhère pas correctement.
Le comprimé peut se déformer, absorbant la salive, pour s’adapter à la forme de votre gencive.
Veillez à toujours prendre ce médicament en suivant exactement les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
Ce médicament est réservé à l’adulte.
La dose recommandée est d’un comprimé de LORAMYC à appliquer une fois par jour.
La durée habituelle du traitement est de 7 à 14 jours.
Si vous avez utilisé plus de LORAMYC 50 mg, comprimé buccogingival muco-adhésif que vous n’auriez dû
En cas de surdosage, des nausées et vomissements peuvent survenir.
Consulter immédiatement votre médecin ou votre pharmacien.
Si vous oubliez d’utiliser LORAMYC 50 mg, comprimé buccogingival muco-adhésif
Ne prenez pas de dose double pour compenser la dose que vous avez oubliée de prendre.
Si vous arrêtez d’utiliser LORAMYC 50 mg, comprimé buccogingival muco-adhésif
N’arrêtez pas d’utiliser ce médicament sauf si votre médecin vous le conseille.
Arrêter le traitement prématurément peut conduire à un manque d’efficacité du traitement.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Si vous ressentez un des effets indésirables suivants, arrêtez de prendre LORAMYC 50 mg, comprimé buccogingival muco-adhésif, et consultez immédiatement votre médecin :
· Gonflement du visage, de la langue ou de la gorge ; difficultés à avaler ; urticaire et difficultés à respirer (angioedème, réactions anaphylactiques) (très rare)
· Une réaction allergique très intense avec des rashs cutanés*, généralement sous la forme d'ampoules ou de plaies dans la cavité buccale et les yeux, et d'autres muqueuses comme, par exemple, les organes génitaux (fréquence inconnue)
· Lésion étendue grave de la peau* (séparation de l'épiderme et des muqueuses superficielles) (nécrolyse épidermique toxique (NET), fréquence inconnue)
*Ces réactions cutanées sévères ont été décrites avec d'autres produits de la même classe thérapeutique que LORAMYC lors d'une administration par voie générale. Aussi, la survenue de ces effets lors de l’administration de LORAMYC en application locale ne peut être exclue, même si le passage dans le sang est beaucoup plus limité.
Si vous remarquez un des effets indésirables suivants, parlez-en à votre médecin ou pharmacien :
Effets indésirables fréquents (survenant chez plus de 1 patient sur 100 et chez moins de 1 sur 10) :
· Nausées, diarrhée, douleurs abdominales, vomissements, bouche sèche, une gêne buccale, douleur gingivale,
· Maux de tête, altération du goût,
· Démangeaisons, éruption cutanée.
· Irritation au site d’application (gencive), fatigue, douleur
· Infection du nez et de la gorge
Effets indésirables peu fréquents (survenant chez plus de 1 patient sur 1000 et chez moins de 1 sur 100) :
· Douleurs de la langue, démangeaisons de la gencive, ulcération de la bouche,
· Perte d'appétit,
· Bouffées de chaleur.
Fréquence inconnue :
· Rash avec des boutons/ampoules remplis de pus (pustulose exanthématique aiguë généralisée)
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER LORAMYC 50 mg, comprimé buccogingival muco-adhésif ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas LORAMYC 50 mg, comprimé buccogingival muco-adhésif après la date de péremption mentionnée sur la boîte et sur le flacon. La date de péremption fait référence au dernier jour de ce mois.
Ce médicament ne nécessite pas de précautions particulières de conservation concernant la température.
Conserver le flacon soigneusement fermé, à l’abri de l’humidité.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient LORAMYC 50 mg, comprimé buccogingival muco-adhésif
· La substance active est :
Chaque comprimé muco-adhésif contient .. 50 mg de miconazole.
· Les autres composants excipients sont :
Hypromellose 2208, Concentré de protéines de lait, Amidon de maïs, Lactose monohydraté, Laurilsulfate de sodium, Stéarate de magnésium, Talc.
Qu’est-ce que LORAMYC 50 mg, comprimé buccogingival muco-adhésif et contenu de l’emballage extérieur
Ce médicament se présente sous forme de comprimé buccogingival muco-adhésif.
Le comprimé est blanc à légèrement jaune avec une face bombée et une face plate gravée « L ».
14 comprimés en flacon (PEHD) avec bouchon de sécurité enfant (polypropylène) contenant un agent dessiccant.
Titulaire de l’autorisation de mise sur le marché
230 BUREAUX DE LA COLLINE
92213 SAINT-CLOUD CEDEX
FRANCE
Exploitant de l’autorisation de mise sur le marché
CENTRE SPECIALITES PHARMACEUTIQUES
76-78 AVENUE DU MIDI
63800 COURNON-D’AUVERGNE
FRANCE
CATALENT GERMANY SCHORNDORF GmbH
Steinbeisstraße 2
73614 Schorndorf
Postfach 1460
Allemagne
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
France, Angleterre, Allemagne, Italie : LORAMYC
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).