Dernière mise à jour le 02/02/2026
RECHOLAN 24,4 g/10,8 g, solution buvable
Indications thérapeutiques
Classe pharmacothérapeutique - LAXATIF OSMOTIQUE, code ATC : A06AD17
RECHOLAN est un produit pour lavage colique qui agit en augmentant le volume d'eau dans les selles. C'est une solution à boire, présentée en boîtes contenant deux flacons de 45 mL. Chaque flacon contient une dose qui doit être diluée dans de l’eau avant utilisation (voir rubrique 3).
Vous devez prendre RECHOLAN pour nettoyer votre côlon (appelé également « gros intestin ») avant un examen endoscopique ou radiologique du côlon ou une chirurgie colique. Il est important que votre côlon soit complètement vide pour que les médecins puissent le visualiser nettement.
RECHOLAN n'est pas un traitement de la constipation.
RECHOLAN est indiqué chez l’adulte
Présentations
> 2 flacon(s) polyéthylène de 45 mL
Code CIP : 345 990-5 ou 34009 345 990 5 7
Déclaration de commercialisation : 08/02/1999
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 8,00 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 9,02 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 21/09/2016 | Renouvellement d'inscription (CT) | La Commission considère que le service médical rendu par FLEET PHOSPHOSODA reste important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 12/03/2025
RECHOLAN 24,4 g/10,8 g, solution buvable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
|
|
Par flacon de 45 mL |
Par mL |
|
Dihydrogénophosphate de sodium dihydraté |
24,40 g |
0,542 g |
|
Hydrogénophosphate de sodium dodécahydraté |
10,80 g |
0,24 g |
Excipient(s) à effet notoire : Ethanol, Sodium, Benzoate de Sodium (E 211).
RECHOLAN contient 29 mg d’éthanol par dose. Chaque flacon de 45 mL contient 5,0 g de sodium et 15 mg de benzoate de sodium.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution buvable.
Solution claire, incolore avec une odeur de gingembre-citron sans précipitation ni turbidité.
4.1. Indications thérapeutiques
Le produit ne doit pas être utilisé en tant que traitement de la constipation.
RECHOLAN est indiqué chez les adultes.
4.2. Posologie et mode d'administration
Deux doses distinctes de RECHOLAN sont administrées aux adultes
Patients âgés :
RECHOLAN doit être utilisé avec précaution chez le sujet âgé.
Aucun ajustement de dose n’est nécessaire dans ce groupe de patients (voir rubrique 4.4).
Patients insuffisants rénaux :
RECHOLAN est contre-indiqué chez les patients souffrant d’insuffisance rénale (voir rubrique 4.3).
Patients insuffisants hépatiques :
La sécurité et l’efficacité de RECHOLAN n’ont pas été démontrées chez les patients insuffisants hépatiques. RECHOLAN est contre-indiqué chez les patients atteints d’ascite (voir rubrique 4.3).
Populations pédiatriques :
RECHOLAN est contre-indiqué chez l’enfant de moins de 18 ans (voir rubrique 4.3)
Mode d’administration
La prise de RECHOLAN doit commencer la veille de l’intervention ou de l’examen.
Si l'heure de l’intervention ou de l’examen est avant midi, suivre les instructions pour un rendez-vous le matin, si l'heure de l’intervention ou de l’examen est après-midi, suivre les instructions pour un rendez-vous l'après-midi.
Ne pas dépasser la dose recommandée
POUR UN RENDEZ-VOUS LE MATIN
La veille du rendez-vous:
7 heures : A la place du petit-déjeuner :
· Boire au minimum un verre plein de "liquide clair" ou d'eau, ou plus, si on le souhaite.
Le "liquide clair" peut être de l'eau, une soupe légère, des jus de fruits dilués sans pulpe, du thé ou du café noir, des sodas légers bicarbonatés ou non.
· Puis tout de suite après, absorber le 1er flacon/dose après dilution de celui-ci (45 mL) dans un demi-verre d'eau froide (120 mL). Après absorption de cette solution, boire un verre plein d'eau froide (240 ml) ou plus, si on le souhaite.
Boire le plus de liquides possible pour remplacer les fluides perdus par l'augmentation du péristaltisme intestinal.
13 heures : A la place du déjeuner :
· Boire au minimum 3 verres pleins de "liquide clair" ou d'eau (720 ml), ou plus, si on le souhaite.
19 heures : A la place du dîner :
· Boire au minimum un verre plein de "liquide clair" ou d'eau, ou plus, si on le souhaite.
· Puis absorber immédiatement le 2ème flacon/dose après dilution de celui-ci (45 mL) dans un demi-verre d'eau froide (120 mL). Après absorption de cette solution, boire un verre plein d'eau froide (240 mL) ou plus, si on le souhaite.
Un complément d'eau ou de "liquide clair" peut être absorbé jusqu'à minuit, si nécessaire.
Le fait de boire de grandes quantités de liquides clairs permet également de garantir la propreté colique au moment de l'intervention.
POUR UN RENDEZ-VOUS L'APRES-MIDI
La veille du rendez-vous :
13 heures : Au déjeuner :
· Une légère collation peut être prise.
· Aucun aliment solide ne doit être absorbé après le déjeuner jusqu'au rendez-vous à l'hôpital.
19 heures : A la place du dîner :
· Boire au minimum un verre plein de "liquide clair" ou d'eau, ou plus, si on le souhaite.
· Puis tout de suite après, absorber le 1er flacon/dose après dilution de celui-ci (45 mL) dans un demi-verre d'eau froide (120 mL). Après absorption de cette solution, boire un verre d'eau froide (240 mL) ou plus, si on le souhaite.
Boire le plus de liquides possible pour remplacer les fluides perdus par l'augmentation du péristaltisme intestinal.
Boire au minimum 3 verres pleins d'eau ou de "liquide clair" (720 mL) pendant la soirée avant d'aller se coucher.
Le jour du rendez-vous :
7 heures : A la place du petit-déjeuner :
· Boire au minimum un verre plein d'eau ou de "liquide clair", ou plus, si on le souhaite.
· Puis absorber immédiatement le 2ème flacon/dose après dilution de celui-ci (45 ml) dans un demi-verre d'eau froide (120 ml). Après absorption de cette solution, boire un verre plein d'eau froide (240 ml) ou plus, si on le souhaite.
Boire le plus de liquides possible pour remplacer les fluides perdus par l'augmentation du péristaltisme intestinal.
Le fait de boire de grandes quantités de liquides clairs permet également de garantir la propreté colique au moment de l'intervention.
Un complément d'eau ou de "liquide clair" peut être absorbé avant 8 heures du matin.
Ce produit provoque normalement une augmentation du péristaltisme intestinal dans la demi-heure suivant l'absorption et jusqu'à 6 heures après.
Après l'intervention :
Il doit être recommandé aux patients de boire de grandes quantités de liquides pour remplacer les fluides perdus pendant la préparation de l'intervention.
Ne pas utiliser dans les cas suivants:
· enfants de moins de 18 ans.
· nausées, vomissements ou douleurs abdominales.
· hypersensibilité aux substances actives ou à l'un des excipients mentionnés à la rubrique 6.1.
· insuffisance rénale,
· hyperparathyroïdie primitive associée à une hypercalcémie.
· insuffisance cardiaque symptomatique (NYHA grade III ou IV). .
· ascite.
· occlusion gastro-intestinale connue ou suspectée.
· mégacôlon (congénital ou acquis).
· perforation gastro-intestinale
· Iléus
· maladie inflammatoire évolutive de l'intestin.
RECHOLAN ne doit pas être utilisé avec d'autres laxatifs contenant du phosphate de sodium.
4.4. Mises en garde spéciales et précautions d'emploi
|
Dans de rares cas, RECHOLAN a été associé à des troubles électrolytiques sévères et potentiellement fatals chez des patients âgés. Le rapport bénéfice/risque de RECHOLAN doit donc être soigneusement évalué avant son utilisation dans cette population à risque. Avant d'initier le traitement, il est nécessaire de s'assurer de l'absence de contre-indications connues et d'insister sur l'importance d'une bonne hydratation. Pour les populations à risque, il est important de vérifier les taux d'électrolytes avant et après traitement (voir ci-dessous et rubriques 4.2 et 4.3). |
Patients à risque
RECHOLAN doit être utilisé avec précaution chez les patients ayant un risque accru d'insuffisance rénale sous-jacente, présentant des troubles électrolytiques préexistants ou un facteur de risque de troubles électrolytiques (par exemple déshydratation, rétention gastrique, colite, incapacité à boire des quantités suffisantes de liquides, hypertension ou autres affections traitées par des médicaments susceptibles d'entraîner une déshydratation, voir ci-dessous), une hypotension avec répercussions cliniques ou associée à une hypovolémie, une maladie cardiaque, un infarctus du myocarde aigu, un angor instable ou chez les patients âgés ou fragilisés. Chez ces patients à risque, le dosage des éléments suivants : sodium, potassium, calcium, chlore, bicarbonates, phosphate, urémie et créatininémie devra être réalisé avant et après traitement si cela est cliniquement indiqué.
Déshydratation
Ce produit agit habituellement entre une ½ heure à 6 heures après la prise. Prévenir le patient que s’il n’a pas eu d’augmentation du péristaltisme intestinal 6 heures après la prise de RECHOLAN, il devra interrompre son utilisation et contacter un médecin immédiatement car il existe un risque de déshydratation.
Les patients doivent être avertis qu'ils auront des selles fréquentes et liquides. Ils doivent être encouragés à boire le plus de liquide possible afin de prévenir la déshydratation. Un apport hydrique insuffisant lors de l’utilisation de laxatifs efficaces peut entrainer une perte hydrique excessive conduisant à une déshydratation et une hypovolémie.
La déshydratation et l'hypovolémie dues aux laxatifs peuvent être exacerbées par une prise insuffisante de boissons, des nausées, des vomissements, une perte d'appétit ou par l'utilisation de médicaments antihypertenseurs (exemple : Inhibiteurs de l’Enzyme de Conversion (IEC), antagonistes des récepteurs à l’angiotensine II (ARAII), inhibiteurs calciques), de diurétiques, et d'anti-inflammatoire non stéroïdien (AINS). Cette déshydratation et cette hypovolémie peuvent être associées dans de rares cas à une insuffisance rénale aiguë que ce soit avec les phosphates de sodium ou les PEG-3350.
L’état d’hydratation des patients prédisposés à une déshydratation ou prenant des médicaments susceptibles de diminuer le débit de filtration glomérulaire doit être évalué et corrigé avant d’utiliser des préparations laxatives.
Néphrocalcinose secondaire à une néphropathie aiguë au phosphate
De rares cas de néphrocalcinose associée à une insuffisance rénale aiguë et des dépôts de cristaux phosphocalciques dans les tubules rénaux ont été rapportés chez des patients utilisant des phosphates de sodium pour la préparation colique. La néphrocalcinose est un événement indésirable grave pouvant entraîner une insuffisance rénale irréversible nécessitant une dialyse chronique. La majorité de ces cas sont survenus chez des patientes âgées prenant un traitement antihypertenseur et d'autres médicaments, comme des diurétiques ou AINS pouvant entraîner une déshydratation.
RECHOLAN doit être prescrit selon les recommandations, avec une attention particulière portée aux contre-indications connues, à la bonne hydratation du patient avant, pendant et après la préparation ainsi qu’au respect de l'intervalle recommandé entre les doses
Troubles électrolytiques
La natrémie et la phosphatémie peuvent augmenter et la calcémie et la kaliémie diminuer; par conséquent, une hypernatrémie, une hyperphosphatémie, une hypocalcémie, une hypokaliémie, et une acidose peuvent survenir.
Une hyponatrémie potentiellement compliquée par des troubles neurologiques, comme une confusion, coma ou des convulsions, peut se produire.
Un léger allongement de l'intervalle QT peut rarement survenir en raison des déséquilibres électrolytiques tels qu'une hypocalcémie ou une hypokaliémie. Ces modifications n'ont pas de pertinence clinique.
Hypomotilité
RECHOLAN doit être utilisé avec prudence chez les patients présentant une hypomotilité intestinale, ayant des antécédents de chirurgie gastro-intestinale ou qui présentent d'autres pathologies prédisposant à une hypomotilité intestinale. Si le patient a eu une colostomie ou une iléostomie, ou s'il doit suivre un régime sans sel, la préparation doit être utilisée avec précaution car il peut apparaître un trouble de l'équilibre électrolytique, une déshydratation ou un trouble de l'équilibre acido-basique.
Lésions
Des lésions punctiformes aphtoïdes, isolées ou multiples, localisées au niveau de la région recto-sigmoïdienne, ont été observées par endoscopie. Il s'agit soit de follicules lymphoïdes, soit d'infiltrats inflammatoires discrets ou de congestions/altérations épithéliales observés à la suite de l'utilisation de la préparation colique. Ces anomalies n'ont pas de pertinence clinique et disparaissent à l'arrêt du traitement.
Ce médicament contient 5000 mg de sodium par dose de 45 mL équivalent à 250% de la dose maximale journalière recommandée par l’OMS, à savoir 2 g de sodium par adulte par jour Le risque d’effet délétère doit donc être pris en compte chez les patients devant suivre un régime hyposodé.
Ce médicament contient 15 mg de benzoate de sodium (E 211) par dose de 45 mL.
Ce médicament contient 29 mg d’alcool (éthanol) dans chaque dose de 45 ml. La quantité dans 45 ml de ce médicament équivaut à moins de 0,73 ml de bière ou 0,29 ml de vin.
La faible quantité d’alcool contenue dans ce médicament n’est pas susceptible d’entraîner d’effet notable
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
A utiliser avec précaution chez les patients sous médicaments antihypertenseurs (comme les inhibiteurs calciques, les inhibiteurs de l’enzyme de conversion (IEC), les antagonistes aux récepteurs à l’angiotensine II (ARAII), diurétiques, lithium ou les traitements qui peuvent affecter les taux d'électrolytes et provoquer une hyperphosphatémie, une hypocalcémie, une hypokaliémie, une déshydratation hypernatrémique ou une acidose.
Pendant l'ingestion de RECHOLAN, l'absorption des produits au niveau du tractus gastro-intestinal peut être retardée ou même complètement inhibée. L'efficacité des produits habituellement pris par voie orale (c'est-à-dire contraceptifs oraux, antiépileptiques, antidiabétiques, antibiotiques) peut être partiellement ou complètement réduite. L'attention doit aussi être portée sur la prise de médicaments connus pour allonger l'intervalle QT.
RECHOLAN doit être utilisé avec prudence chez les patients prenant des médicaments à base de parathormone.
4.6. Fertilité, grossesse et allaitement
Grossesse
Aucune donnée clinique n'est disponible sur des grossesses exposées ni même de données sur des études animales, concernant le développement embryonnaire/fœtal, l'accouchement et le développement postnatal. Le risque potentiel chez l'homme est inconnu. RECHOLAN ne doit pas être utilisé pendant la grossesse sauf en cas de nécessité.
Ne sachant pas si RECHOLAN est excrété dans le lait maternel et si par ailleurs le phosphate de sodium peut passer dans le lait maternel, il est conseillé de tirer le lait et de ne pas l'utiliser dès la première prise de RECHOLAN et ce jusqu'à 24 heures après la prise de la deuxième dose de la solution de lavage colique. En conséquence, les femmes ne devront pas allaiter leurs bébés au cours des 24 heures suivant la prise de la deuxième dose de RECHOLAN.
Fertilité
Il n’y a pas de données disponibles concernant l’effet de RECHOLAN sur la fertilité masculine ou féminine.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets indésirables ci-dessous ont été rapportés à des fréquences correspondant à : Très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1 000 à < 1/100), rare (≥ 1/10 000 à < 1/1 000), très rare (≤ 1/10 000), indéterminée (la fréquence ne peut être estimée sur la base des données disponibles) Au sein de chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
Affections du système immunitaire
Très rare :
· Hypersensibilité.
Troubles du métabolisme et de la nutrition
Peu fréquent :
· Déshydratation.
Très rare :
· Hyperphosphatémie.
· Hypocalcémie.
· Hypokaliémie.
· Hypernatrémie.
· Acidose métabolique.
· Tétanie.
Indéterminée :
· Hyponatrémie compliquée par des troubles neurologiques, comme une confusion, coma ou des convulsions
Affections du système nerveux
Très fréquent :
· Etourdissements.
Fréquent :
· Céphalée.
Très rare :
· Perte de conscience.
· Paresthésie.
Affections cardiaques
Très rare :
· Infarctus du myocarde.
· Arythmies.
Affections vasculaires
Très rare :
· Hypotension.
Affections gastro-intestinales
Très fréquent :
· Diarrhée.
· Douleurs abdominales.
· Distension abdominale.
· Nausées.
Fréquent :
· Vomissements.
· Colonoscopie anormale (lésions punctiformes simples ou multiples de type aphtoïde situées dans la région rectosigmoïde sans pertinence clinique et disparaissant spontanément sans traitement).
Affections cutanées et des tissus sous-cutanés
Très rare :
· Dermatite allergique.
Affections musculo-squelettiques et systémiques
Très rare :
· Crampes musculaires.
Affections du rein et des voies urinaires
Rare :
· Néphrocalcinose secondaire à une néphropathie aigue au phosphate
Très rare :
· Insuffisance rénale aiguë.
· Insuffisance rénale chronique.
Troubles généraux et anomalies au site de l'administration
Très fréquent :
· Frissons.
· Asthénie.
Fréquent :
· Douleur thoracique.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
Lors de prise de doses excessives de RECHOLAN, des cas mortels d'hyperphosphatémie avec hypocalcémie concomitante, hypernatrémie et acidose ont été rapportés chez des enfants ou des patients atteints d'occlusion intestinale.
Les patients en surdosage ont présenté les symptômes suivants: déshydratation, hypotension, tachycardie, bradycardie, tachypnée, arrêt cardiaque, choc, insuffisance respiratoire, dyspnée, convulsions, iléus paralytique, anxiété, douleur. Les surdosages peuvent conduire à des concentrations sériques de sodium et de phosphate élevées et à une diminution des concentrations de calcium et potassium. Dans ces cas, une hypernatrémie, hyperphosphatémie, hypocalcémie, hypokaliémie, et une acidose peuvent survenir.
Des cas de complet rétablissement après surdosage ont été également documentés tant chez des enfants après absorption accidentelle de RECHOLAN que chez des patients atteints d'occlusion intestinale, l'un ayant reçu six fois la dose préconisée.
Le traitement des accidents de surdosage consiste normalement en la réhydratation; l'administration intra-veineuse de gluconate de calcium à 10 % est parfois nécessaire.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : LAXATIF OSMOTIQUE, code ATC : A06AD17
RECHOLAN est un laxatif salin qui agit par un procédé osmotique en augmentant la rétention de liquide dans la lumière de l'intestin grêle. L'accumulation de liquide dans l'iléon produit une distension et, ainsi, favorise le péristaltisme et l'évacuation de l'intestin.
5.2. Propriétés pharmacocinétiques
Les résultats ont montré une augmentation des concentrations sériques de sodium et de phosphate mais une diminution du potassium et du calcium après chaque dose.
La concentration moyenne initiale de phosphate dans le sérum pour tous les sujets était de 3.33 mg/dL, puis un pic de concentration a été observé à 6,26 mg/dL au bout de 3 heures, la concentration est redescendue à 4,70 mg/dL juste avant la seconde dose (à la 12ème heure), puis est remontée à nouveau à 6,86 mg/dL à la 14ème heure. A la 36ème heure, la concentration sérique de phosphate était revenue à la normale chez tous les patients.
La figure ci-dessous montre l’évolution dans le temps de la concentration moyenne de phosphate sérique pour chaque sous-groupe âge-sexe. Les femmes âgées avaient les valeurs les plus altérées.
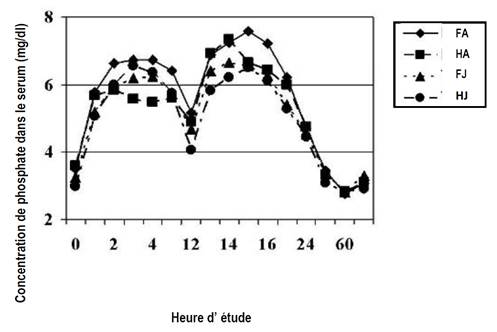
La concentration moyenne de sodium dans le sérum a fluctué tout en restant dans les normes (134-147 mmol/L), malgré des valeurs supérieures à la limite haute chez 4 sujets.
La baisse des concentrations sériques de potassium et de calcium a fluctué dans les limites de la plage individuelle normale, puis est revenue aux valeurs initiales 12 heures après l'administration de la deuxième dose. 29% des sujets ont montré des taux de calcium sérique en dessous la limite inférieure normale (8,5 mg/dL) jusqu'à 36 heures après l'administration de la première dose. Néanmoins, aucun cas clinique d'hypocalcémie n'a été noté.
En conclusion, les variations de concentration sérique en électrolytes chez les volontaires sains adultes associées à l'administration de 2 x 45 mL de solution de phosphate de sodium étaient cliniquement non significatifs, transitoires et se sont normalisées dans les 12 à 24 heures suivant la fin du régime de préparation colique. L’effet sur la pharmacocinétique de RECHOLAN chez des patients insuffisants rénaux n’a pas été étudié. Il est impossible d’extrapoler ces données des volontaires sains aux patients à risque (exemple : insuffisant rénal) (voir rubrique 4.3, 4.4).
5.3. Données de sécurité préclinique
Aucune étude animale relative à la toxicité sur la reproduction n'a été effectuée avec RECHOLAN.
3 ans.
Utiliser immédiatement après ouverture. Jeter toute solution non utilisée.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
6.5. Nature et contenu de l'emballage extérieur
45 mL (1 dose) en flacon (PE), scellé par une feuille d'aluminium et muni d'un capuchon à vis (polypropylène) ; boîte de 2 x 45 mL ou boîte de 100 x 45 mL (présentation hospitalière).
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Ce produit doit être dilué avec de l’eau avant utilisation.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
AUTOVIA DE LOGRONO KM 13,300
50180 UTEBO - ZARAGOZA
ESPAGNE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 345 990 5 7 : 45 ml en flacon (PE); boîte de 2.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Liste I
ANSM - Mis à jour le : 12/03/2025
RECHOLAN 24,4 g/10,8 g, solution buvable
Dihydrogénophosphate de sodium dihydraté /Hydrogénophosphate de sodium dodécahydraté
Vous devez toujours prendre ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin, votre pharmacien ou votre infirmier/ère.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre pharmacien pour tout conseil ou information.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien.
1. Qu'est-ce que RECHOLAN 24,4 g/10,8 g, solution buvable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre RECHOLAN 24,4 g/10,8 g, solution buvable ?
3. Comment prendre RECHOLAN 24,4 g/10,8 g, solution buvable?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver RECHOLAN 24,4 g/10,8 g, solution buvable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE RECHOLAN 24,4 g/10,8 g, solution buvable ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - LAXATIF OSMOTIQUE, code ATC : A06AD17
RECHOLAN est un produit pour lavage colique qui agit en augmentant le volume d'eau dans les selles. C'est une solution à boire, présentée en boîtes contenant deux flacons de 45 mL. Chaque flacon contient une dose qui doit être diluée dans de l’eau avant utilisation (voir rubrique 3).
Vous devez prendre RECHOLAN pour nettoyer votre côlon (appelé également « gros intestin ») avant un examen endoscopique ou radiologique du côlon ou une chirurgie colique. Il est important que votre côlon soit complètement vide pour que les médecins puissent le visualiser nettement.
RECHOLAN n'est pas un traitement de la constipation.
RECHOLAN est indiqué chez l’adulte
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE RECHOLAN 24,4 g/10,8 g, solution buvable?
Ne prenez jamais RECHOLAN 24,4 g/10,8 g, solution buvable :
· si vous êtes allergique aux substances actives ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6,
· si vous avez moins de 18 ans ;
· si vous souffrez de nausées (mal au cœur) ou de vomissements, ou de douleurs abdominales ;
· si vous présentez une maladie rénale ;
· si vous souffrez d’une maladie cardiaque symptomatique ;
· si vous présentez une accumulation anormale de liquide dans l'espace compris entre le péritoine (l'enveloppe qui tapisse la cavité abdominale) et les organes abdominaux ;
· si vous savez ou suspectez que vous avez une occlusion ou une perforation intestinale ou une paralysie de l'intestin grêle (iléus paralytique) ;
· si vous présentez un mégacôlon (dilatation du gros intestin) congénital ou acquis ;
· si vous souffrez d'une maladie inflammatoire de l'intestin active ;
· si vos glandes parathyroïdes sont hyperactives (hyperparathyroïdie).
Vous ne devez pas utiliser RECHOLAN avec d'autres laxatifs contenant du phosphate de sodium.
Si vous pensez que l'une des situations ci-dessus peut vous concerner, demandez conseil à votre médecin. Il décidera ensuite si vous pouvez utiliser RECHOLAN.
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien ou votre infirmier/ère avant de prendre RECHOLAN
24,4 g/10,8 g, solution buvable. :
· si vous êtes fragilisé(e) ou âgé(e) (65 ans et plus) ;
· si vous souffrez d'une maladie du cœur ou des reins ;
· si vous présentez des modifications des taux de sels dans l'organisme (déséquilibres électrolytiques) ou si vous avez un risque de telles modifications, par exemple si vous êtes déshydraté(e) ;
· si votre tension artérielle est basse ou si vous souffrez d'une diminution des mouvements de tout ou partie de vos intestins ;
· si vous avez subi une colostomie ou une iléostomie ;
· si vous avez subi un autre type d'intervention ou de chirurgie de l'estomac ou des intestins ;
· si vous suivez un régime hyposodé (pauvre en sel) voir également rubrique « RECHOLAN 24,4 g/10,8 g, solution buvable contient du sodium » à la fin de la section 2.
Consultez votre médecin, si vous pensez que l'une des situations mentionnées ci-dessus vous concerne actuellement ou vous a concerné(e) dans le passé. RECHOLAN pourrait modifier légèrement votre rythme cardiaque en raison du déséquilibre électrolytique et une surveillance médicale plus étroite pourrait être nécessaire durant votre traitement.
Les patients doivent être prévenus que l'administration de RECHOLAN entraîne la survenue de selles liquides et fréquentes. Vous devez boire le plus de « liquide clair » possible (voir rubrique 3) pour éviter la déshydratation.
Ce produit agit habituellement en une 1/2 heure à 6 heures après la prise. Si vous n'avez pas eu de selles dans les 6 heures suivant la prise de la première ou de la seconde dose, vous devez contacter immédiatement un médecin car il existe un risque de déshydratation.
Personnes fragiles et patients âgés (à partir de 65 ans).
Veuillez prêter une attention particulière aux conseils mentionnés aux sous-rubriques « Mises en garde et précautions d’emploi » et « Autres médicaments et RECHOLAN» (ci-dessus) ainsi qu'aux instructions figurant à la rubrique 3 ci-dessous «Comment prendre RECHOLAN», car une surveillance médicale particulière pourra être nécessaire.
Enfants
Sans objet.
Autres médicaments et RECHOLAN 24,4 g/10,8 g, solution buvable
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament, en particulier :
· des médicaments utilisés pour traiter la tension artérielle élevée (hypertension) ou l'angine de poitrine (comme les inhibiteurs calciques, les inhibiteurs de l’enzyme de conversion (IEC), les antagonistes aux récepteurs à l’angiotensine II (ARAII);
· des médicaments utilisés pour vider la vessie (diurétiques) ;
· des anti-inflammatoires non stéroïdiens (AINS), tels que l'aspirine ;
· certains médicaments utilisés pour traiter les troubles mentaux (contenant du lithium) ;
· des médicaments qui peuvent entraîner une déshydratation ou modifier les taux des différents sels (potassium, sodium, phosphate ou eau) présents dans votre organisme (équilibre hydro-électrolytique) ;
· des médicaments qui modifient le rythme cardiaque ;
· des médicaments à base de parathormone (hormone parathyroïdienne) ;
· des médicaments pris régulièrement par voie orale (par la bouche) : par exemple les contraceptifs oraux et les médicaments utilisés pour traiter l'épilepsie ou le diabète ou les antibiotiques, parce que RECHOLAN peut retarder ou empêcher totalement l'absorption de ces médicaments pris par voie orale, ce qui les rendrait moins efficaces ou inefficaces.
RECHOLAN 24,4 g/10,8 g, solution buvable avec des aliments et boissons
Veuillez-vous rapporter à la rubrique 3 de cette notice
Grossesse allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Vous ne devez pas utiliser ce médicament pendant la grossesse à moins que votre médecin considère que cela soit nécessaire.
Si vous allaitez, il est préférable que votre lait soit tiré et non utilisé dès la première prise de RECHOLAN et ce, jusqu’à 24 heures après la seconde prise. En effet, vous ne devez pas allaiter votre bébé pendant 24 heures après avoir pris la deuxième dose de RECHOLAN.
Conduite de véhicules et utilisation de machines
Vous ne devez pas conduire ni utiliser des machines ou des outils après avoir pris RECHOLAN si vous vous sentez fatigué(e) ou si vous avez des étourdissements, ou si vous pensez être déshydraté(e). Vous devez également rester près de toilettes après avoir pris le médicament.
RECHOLAN 24,4 g/10,8 g, solution buvable contient du sodium, de l’éthanol et du benzoate de sodium.
Ce médicament contient 5 000 mg de sodium (principal composant du sel de table) dans chaque dose de 45 mL. Ceci équivaut à 250% de la dose journalière maximale recommandée de sodium pour un adulte. Le risque délétère doit donc être pris en compte chez les patients devant suivre un régime hyposodé (pauvre en sel).
Ce médicament contient 29 mg d’alcool (éthanol) dans chaque dose de 45 ml. La quantité dans 45 ml de ce médicament équivaut à moins de 0,73 ml de bière ou 0,29 ml de vin.
La faible quantité d’alcool contenue dans ce médicament n’est pas susceptible d’entraîner d’effet notable.
Ce médicament contient 15 mg de benzoate de sodium (E 211) dans chaque dose de 45 mL
3. COMMENT PRENDRE RECHOLAN 24,4 g/10,8 g, solution buvable?
· Avant de prendre la première dose de RECHOLAN et jusqu'au moment de l'examen, il est important de ne boire que du « liquide clair ». Vous ne devez pas manger de nourriture solide.
· Le « liquide clair » peut être de l'eau, une soupe claire ou une soupe filtrée pour retirer tous les aliments solides, des jus de fruits dilués sans pulpe (mais pas des jus de couleur rouge ou mauve), du thé ou café noir, des sodas légers gazeux ou non, par exemple de la limonade.
· Vous devez boire autant de liquides clairs que possible pour prévenir les nausées pendant la prise de ce médicament.
· La prise de RECHOLAN peut provoquer plusieurs selles de type diarrhée. Le produit commence souvent à agir dans la demi-heure après la prise et il peut continuer à agir pendant 6 heures. Veuillez rester à proximité des toilettes jusqu'à ce que les mouvements de l'intestin s'arrêtent.
Si vous n'avez pas eu de selles dans les 6 heures suivant la prise de la première ou de la seconde dose, vous devez contacter immédiatement un médecin car il existe un risque de déshydratation.
Vous devez commencer à prendre RECHOLAN la veille de votre rendez-vous à l'hôpital.
Comment prendre la première ou la seconde dose
Diluer le contenu d'un flacon (45 ml) de RECHOLAN dans un demi-verre d'eau froide (120 ml).
Après l'avoir bu, boire au moins un plein verre d'eau froide (240 ml). Vous devez boire autant de liquides clairs que possible pour remplacer les liquides perdus dans les selles.
A quel moment prendre la première ou la seconde dose
Veuillez-vous reporter aux deux encadrés ci-dessous, en fonction du moment de votre rendez-vous à l'hôpital.
Si vous ne respectez pas intégralement ces instructions, il pourrait ne pas être possible de pratiquer l'examen ou l'intervention chirurgicale.
|
POUR UN RENDEZ-VOUS LE MATIN (8 H -12 H) LA VEILLE DU RENDEZ-VOUS : A 7 heures, boire au minimum un verre plein (240 mL) de liquide clair en guise de petit déjeuner. Vous pouvez en boire plus si vous le souhaitez. Immédiatement après, prendre la première dose (voir ci-dessus). A 13 heures, boire au moins trois verres pleins (720 mL) ou plus de liquide clair en guise de déjeuner. Vous pouvez continuer à boire des liquides clairs pendant l'après-midi pour étancher votre soif. A 19 heures, boire au moins un verre plein (240 mL) de liquide clair en guise de dîner. Vous pouvez en boire plus si vous le souhaitez. Immédiatement après, prendre la seconde dose (voir ci-dessus). Vous pouvez continuer à boire des liquides clairs jusqu'à minuit pour étancher votre soif. La consommation de liquides clairs après minuit pourrait entraîner des levées nocturnes pour aller aux toilettes, avec pour résultat un manque de sommeil. |
POUR UN RENDEZ-VOUS L'APRES-MIDI (12H – 17H) LA VEILLE DU RENDEZ-VOUS : A 13 heures, prendre une collation légère, par exemple une soupe et un sandwich en guise de déjeuner. Après le déjeuner, ne pas consommer d'autres aliments solides avant la fin de l'examen ou de l'intervention. Pendant l'après-midi, vous pouvez boire des liquides clairs pour étancher votre soif. A 19 heures, boire au minimum un verre plein (240 mL) de liquide clair en guise de dîner. Vous pouvez en boire plus si vous le souhaitez. Immédiatement après, prendre la première dose (voir ci-dessus). Pendant la soirée, boire au minimum 3 verres pleins (720 mL) d'eau ou de liquide clair avant le coucher. LE JOUR DU RENDEZ-VOUS: A 7 heures, boire au minimum un verre plein de liquide clair en guise de petit déjeuner. Vous pouvez en boire plus si vous le souhaitez. Immédiatement après, prendre la seconde dose (voir ci-dessus). Vous pouvez continuer à boire des liquides clairs jusqu'à 8 heures si vous avez soif. La consommation de liquides clairs après 8 heures pourrait entraîner des besoins d'aller aux toilettes, et vous pourriez éprouver des difficultés pour vous rendre à l'hôpital pour votre rendez-vous. |
Après l'examen ou l'intervention, veillez à boire de grandes quantités de liquides pour remplacer les liquides perdus en prenant RECHOLAN.
Si vous avez pris plus de RECHOLAN 24,4 g/10,8 g, solution buvable que vous n’auriez dû
Consultez immédiatement un médecin ou un pharmacien, car vous pouvez être déshydraté(e), avoir des problèmes cardiaques et de circulation, avoir des difficultés à respirer, vous sentir anxieux ou avoir des douleurs de type colique
Si vous oubliez de prendre RECHOLAN 24,4 g/10,8 g, solution buvable
Demandez conseil à votre médecin. Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez de prendre RECHOLAN 24,4 g/10,8 g, solution buvable
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien ou à votre infirmier/ère
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Dans de très rares cas, RECHOLAN peut entraîner des réactions allergiques accompagnées ou non d'une éruption cutanée. Si vos mains, votre visage, vos lèvres, votre gorge ou votre langue commence à gonfler, ou si vous avez des difficultés pour respirer ou avaler, contactez immédiatement votre médecin ou le service d'urgences de l'hôpital le plus proche.
Autres effets indésirables possibles de RECHOLAN :
Très fréquent (pouvant affecter plus de 1 patient sur 10) :
Nausées, douleurs abdominales, ballonnement et diarrhée, frissons, faiblesse et vertiges.
Fréquent (pouvant affecter jusqu’à 1 personne sur 10) :
Vomissements, douleur thoracique et maux de tête.
Peu fréquent (pouvant affecter jusqu’à 1 personne sur 100) :
Déshydratation.
Rare (pouvant affecter jusqu’à 1 personne sur 1000) :
Accumulation de calcium dans le rein
Très rare (pouvant affecter jusqu’à 1 personne sur 10 000) :
Infarctus du myocarde, palpitations, baisse de la tension artérielle, modifications des taux de sels (électrolytes) dans le sang (ce qui peut entraîner des contractions et des spasmes musculaires), crampes musculaires, sensations de fourmillements et de picotements, perte de conscience et insuffisance rénale.
Indéterminée (la fréquence ne peut être estimée au vu des données disponibles).
Hyponatrémies (faible concentration de sodium dans le sang pouvant entrainer des troubles neurologiques tels qu’une confusion, un coma ou des convulsions).
Si l'un des effets secondaires s'aggrave ou si vous remarquez des effets secondaires qui ne figurent pas dans cette notice, veuillez en informer votre médecin ou votre pharmacien.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER RECHOLAN 24,4 g/10,8 g, solution buvable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur le flacon après EXP. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas 25°C.
Utiliser immédiatement après ouverture. Jeter toute solution non utilisée.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient RECHOLAN 24,4 g/10,8 g, solution buvable
· Les substances actives sont :
Dihydrogénophosphate de sodium dihydraté .................................................................. 24,40 g
Hydrogénophosphate de sodium dodécahydraté............................................................. 10,80 g
Pour un flacon de 45 ml.
· Les autres composants sont :
Benzoate de sodium (E211), saccharine sodique, glycérol, eau purifiée et arôme citron gingembre composé de : oléorésine de gingembre, alcool, huile essentielle de citron, huile essentielle de citron partiellement déterpénée, acide citrique et eau purifiée.
Qu’est-ce que RECHOLAN 24,4 g/10,8 g, solution buvable et contenu de l’emballage extérieur
RECHOLAN est une solution buvable, incolore, limpide à l'arôme citron gingembre, présentée en boîtes contenant 2 ou 100 flacons de 45 ml avec bouchon à vis. Chaque flacon contient une dose.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
AUTOVIA DE LOGRONO KM 13,300
50180 UTEBO - ZARAGOZA
ESPAGNE
Exploitant de l’autorisation de mise sur le marché
LABORATOIRES BOUCHARA-RECORDATI
TOUR HEKLA
52 AVENUE DU GENERAL DE GAULLE
92800 PUTEAUX
AUTOVIA DE LOGRONO KM 13,300
50180 UTEBO - ZARAGOZA
Espagne
Si vous avez des questions ou des commentaires sur ce produit, veuillez nous contacter sur : info@casenrecordati.com
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen et le Royaume-Uni (Irlande du nord) sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).