
ANSM - Mis à jour le : 26/08/2024
LETYBO 50 unités, poudre pour solution injectable
Toxine botulinique de type A
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que LETYBO 50 unités, poudre pour solution injectable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser LETYBO 50 unités, poudre pour solution injectable ?
3. Comment utiliser LETYBO 50 unités, poudre pour solution injectable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver LETYBO 50 unités, poudre pour solution injectable ?
6. Contenu de l’emballage et autres informations.

Classe pharmacothérapeutique : autres myorelaxants à action périphérique - code ATC : M03AX01.
Letybo contient la substance active « toxine botulinique de type A », qui agit en bloquant les impulsions nerveuses vers les muscles dans lesquels il a été injecté. Cela empêche la contraction des muscles, entraînant une paralysie temporaire.
Letybo est utilisé chez les adultes de moins de 75 ans pour l’amélioration temporaire de l’apparence des rides verticales intersourcilières modérées à sévères lorsque leur présence entraîne chez eux un retentissement psychologique important.

N’utilisez jamais LETYBO 50 unités, poudre pour solution injectable :
· si vous êtes allergique à la toxine botulinique de type A ou à l’un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6) ;
· si vous présentez des troubles de l’activité musculaire, par exemple une myasthénie grave, un syndrome de Lambert-Eaton ou une sclérose latérale amyotrophique ;
· si vous présentez une infection ou une inflammation aiguë au niveau des sites d’injection proposés.
Avertissements et précautions
Adressez-vous à votre médecin avant d’utiliser Letybo si vous présentez :
· tout trouble affectant les muscles et/ou leur contrôle direct par le système nerveux ;
· des difficultés à avaler ou à respirer, présentes ou passées ;
· un trouble de la coagulation.
Si vous avez des antécédents de ces pathologies, Letybo n’est pas recommandé dans votre cas.
La douleur liée aux aiguilles et/ou la peur des injections peuvent entraîner une syncope due à une chute soudaine de la pression artérielle.
Des cas très rares d’effets secondaires dus à la diffusion de la toxine botulinique hors du site d’injection, par exemple une faiblesse musculaire excessive, ont été signalés. Les difficultés à avaler et à respirer sont graves et peuvent entraîner la mort.
Si vous avez des problèmes pour avaler, parler ou respirer, consultez immédiatement un médecin.
Enfants et adolescents
L’utilisation de Letybo n’est pas recommandée chez les enfants et les adolescents de moins de 18 ans.
Autres médicaments et LETYBO 50 unités, poudre pour solution injectable
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
Les médicaments suivants peuvent affecter ou être affectés par Letybo :
· les médicaments interférant avec la transmission des impulsions nerveuses aux muscles ;
· certains médicaments utilisés pour traiter les infections bactériennes, comme la spectinomycine ou les antibiotiques du groupe des aminosides ;
· tout autre médicament contenant une toxine botulinique.
Grossesse et allaitement
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin avant d’utiliser ce médicament.
Letybo n’est pas recommandé pendant la grossesse ou l’allaitement ni chez les femmes en âge de procréer n’utilisant pas de contraception.
Conduite de véhicules et utilisation de machines
La toxine botulinique de type A peut provoquer faiblesse, vertiges et troubles de la vision. Ne conduisez pas de véhicule et n’utilisez pas de machine si votre capacité de réaction est réduite.
LETYBO 50 unités, poudre pour solution injectable contient du sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose, c.-à-d. qu’il est essentiellement « sans sodium ».

Letybo ne vous est administré que par un médecin dûment qualifié qui dispose des équipements nécessaires. La description détaillée de la préparation de la solution et du mode d’emploi figure à la rubrique « Les informations suivantes sont destinées exclusivement aux professionnels de la santé » à la fin de cette notice.
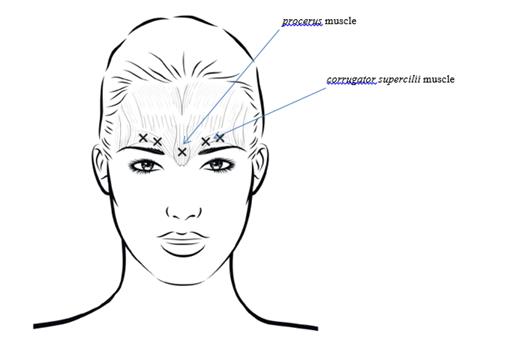
La dose recommandée est de
20 unités réparties en cinq injections de 0,1 mL (4 unités). Chaque injection est pratiquée dans les muscles situés au-dessus ou entre les sourcils.
Letybo est injecté par voie intramusculaire (IM).
Après reconstitution de la solution, le flacon ne doit être utilisé que pour une seule séance par patient. Toute solution non administrée doit être éliminée comme indiqué après la rubrique 6 dans les informations destinées aux professionnels de santé.
Un intervalle minimum de 3 mois est recommandé entre deux traitements par Letybo.
Si vous avez utilisé plus de LETYBO 50 unités, poudre pour solution injectable que vous n’auriez dû
Un surdosage peut entraîner une paralysie des muscles et/ou des nerfs. Les signes de surdosage peuvent ne pas être visibles immédiatement après l’injection.
En cas de surdosage, le médecin surveillera vos symptômes éventuels, comme une faiblesse générale ou une paralysie musculaire. Vous serez hospitalisé(e) si les symptômes d’une intoxication à la toxine botulinique de type A se manifestent, par exemple :
· faiblesse généralisée ;
· paupière supérieure tombante ou vision double ;
· troubles de la déglutition et de la parole ;
· paralysie partielle des muscles contrôlant la respiration.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.

La plupart des effets indésirables sont d’intensité légère à modérée. Ils surviennent dans les premiers jours suivant l’injection et sont temporaires.
Certains effets indésirables pourraient être très graves. Si vous présentez l’un des effets indésirables suivants, informez-en immédiatement votre médecin ou demandez à vos proches de l’informer et rendez-vous au service des urgences le plus proche :
Peu fréquent, peut affecter jusqu’à 1 personne sur 100
· Paupière supérieure tombante, spasme de la paupière
Rare, peut affecter jusqu’à 1 personne sur 1 000
· Trouble de la sensibilité des paupières, sourcils tombants
· Saignement conjonctival
· Douleur oculaire, sécheresse oculaire, défaut du champ visuel, vision trouble
· Sensations diminuées dans la gorge
· Constipation
· Altération de phonème.
Très rare, peut affecter jusqu’à 1 personne sur 10 000
· Faiblesse musculaire
· Difficultés à avaler
· Infection causée par l’inhalation d’aliments ou de liquide dans les voies aériennes ou les poumons
· Difficultés à respirer.
Outre ces effets indésirables possibles, une réaction allergique grave peut entraîner les symptômes suivants :
· Difficultés à avaler, à respirer ou à parler en raison d’un gonflement du visage, des lèvres, de la bouche ou de la gorge. Outre ces symptômes, une éruption urticarienne peut survenir (voir rubrique 2).
D’autres effets indésirables connus peuvent survenir selon les catégories de fréquence suivantes. Informez votre médecin ou pharmacien s’ils deviennent graves :
Fréquent, peut affecter jusqu’à 1 personne sur 10
· Céphalée
· Réactions au site d’injection.
Peu fréquent, peut affecter jusqu’à 1 personne sur 100
· Gêne au niveau de la tête
· Gonflement localisé, par exemple de la paupière, du visage ou du contour des yeux
· Site d’injection : douleur, bleus, gonflement, démangeaisons, masse, pression
· Bleus, par exemple autour des yeux
· Infection, par exemple une infection virale des voies aériennes supérieures telle qu’un rhume
· Effet Mephisto (élévation de la partie externe des sourcils).
Rare, peut affecter jusqu’à 1 personne sur 1 000
· Migraine
· Inflammation des follicules pileux
· Vertiges
· Sensations anormales, par exemple picotements, fourmillements et démangeaisons
· Nausée
· Peau sèche, urticaire, démangeaisons
· Douleur du visage
· Fièvre
· Herpès buccal
· Potassium sanguin augmenté
· Syndrome grippal.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.

Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette et l’emballage après EXP. La date de péremption fait référence au dernier jour de ce mois.
À conserver et transporter réfrigéré (entre 2 °C et 8 °C).
Solution reconstituée
La stabilité physico-chimique en cours d’utilisation a été démontrée pendant 24 heures à 2 °C.
D’un point de vue microbiologique, le produit doit être utilisé immédiatement. En cas d’utilisation non immédiate, les durées et conditions de conservation en cours d’utilisation relèvent de la responsabilité de l’utilisateur et ne devraient pas dépasser 24 heures à une température comprise entre 2 °C et 8 °C, sauf en cas de reconstitution/dilution (etc.) réalisées en conditions d’asepsie dûment contrôlées et validées.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.

Ce que contient LETYBO 50 unités, poudre pour solution injectable 
· La substance active est : Toxine botulinique de type A.
Chaque flacon contient 50 unités de toxine botulinique de type A produit par Clostridium botulinum.
Après reconstitution, chaque 0,1 mL de solution contient 4 unités
· Les autres composants sont : albumine humaine et chlorure de sodium.
Qu’est-ce que LETYBO 50 unités, poudre pour solution injectable et contenu de l’emballage extérieur 
Letybo se présente sous forme d’une poudre pour solution injectable blanche dans un flacon en verre transparent muni d’un bouchon en caoutchouc et d’un opercule inviolable en aluminium.
Une boîte contient un ou deux flacons.
Conditionnement multiple contenant 2 boîtes, chaque boîte contient un flacon.
Conditionnement multiple contenant 6 boîtes, chaque boîte contient un flacon.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché 
Industriezeile 6
2100 Leobendorf
Autriche
Exploitant de l’autorisation de mise sur le marché 
Industriezeile 6
2100 Leobendorf
Autriche
Industriezeile 6
2100 Leobendorf
Autriche
Noms du médicament dans les Etats membres de l'Espace Economique Européen 
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen et au Royaume-Uni (Irlande du Nord) sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est : 
[à compléter ultérieurement par le titulaire]
{mois AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑
Les informations suivantes sont destinées exclusivement aux professionnels de la santé :
Les unités de toxine botulinique ne sont pas interchangeables d’un produit à l’autre. Les doses recommandées (exprimées en unités) diffèrent des autres préparations de toxine botulinique.
Les instructions d’utilisation, de manipulation et d’élimination doivent être strictement respectées.
Préparation de la solution
La reconstitution doit être effectuée conformément aux bonnes pratiques cliniques, notamment en ce qui concerne les techniques d’asepsie.
Pour reconstituer Letybo, utiliser 1,25 mL d’une solution injectable de chlorure de sodium à 9 mg/mL (0,9 %) comme diluant.
Il est recommandé de reconstituer le contenu du flacon et de préparer la seringue au-dessus de serviettes en papier à doublure en plastique pour récupérer tout déversement éventuel. Aspirer la solution injectable de chlorure de sodium à 9 mg/mL (0,9 %) dans une seringue et l’injecter délicatement dans le flacon pour éviter la formation de mousse/bulles ou toute agitation vigoureuse qui pourrait dénaturer le produit. Si le vide n’aspire pas le solvant dans le flacon, celui-ci doit être éliminé. Après reconstitution, Letybo se présente comme une solution limpide, incolore et pratiquement dépourvue de particules. Avant utilisation, inspecter visuellement le flacon pour s’assurer que le produit est exempt de particules étrangères.
Letybo ne doit pas être utilisé si la solution reconstituée est trouble ou contient des particules.
Solution reconstituée
La stabilité physico-chimique en cours d’utilisation a été démontrée pendant 24 heures à 2 °C.
D’un point de vue microbiologique, le produit doit être utilisé immédiatement. S’il n’est pas utilisé immédiatement, les durées et conditions de conservation en cours d’utilisation relèvent de la responsabilité de l’utilisateur et ne devraient pas dépasser 24 heures à une température comprise entre 2 °C et 8 °C, sauf en cas de reconstitution/dilution (etc.) réalisées en conditions d’asepsie dûment contrôlées et validées.
Toute solution injectable qui a été conservée plus de 24 heures doit être éliminée.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Mode d’emploi
Les injections intramusculaires doivent être réalisées à l’aide d’une seringue stérile du type utilisé pour l’insuline ou la tuberculine, avec une capacité de 1 mL, des graduations de 0,01 mL et une aiguille de calibre 30 à 31 G.
Aspirer dans la seringue stérile 0,5 mL de la solution de Letybo dûment reconstituée et expulser toute bulle d’air présente dans le cylindre. L’aiguille utilisée pour reconstituer le médicament doit être retirée et remplacée pour l’administration.
Veiller à ce que Letybo ne soit pas injecté dans un vaisseau sanguin.
Afin de réduire le risque de blépharoptose, éviter les injections à proximité du muscle levator palpebrae superioris, en particulier chez les patients présentant d’importants complexes abaisseurs des sourcils. Lors de l’injection dans deux sites pour chaque muscle corrugator supercilii, réaliser la première injection juste au-dessus du bord médial des sourcils. La seconde injection sera pratiquée à environ 1 cm au-dessus du bord supra-orbitaire (limites osseuses rigides palpables au-dessus de la marge haute de la paupière supérieure), au point de rencontre des lignes médianes des sourcils. Le site d’injection pour le muscle procerus se situe juste au-dessus de la ligne médiane de l’arête nasale, à l’endroit où se forment les rides horizontales entre les extrémités médiales des sourcils. Lors de l’administration dans les extrémités médiales des muscles corrugator supercilii et sur les lignes médianes des sourcils, les sites d’injection doivent être éloignés d’au moins 1 cm du bord supra-orbitaire (limites osseuses rigides palpables au-dessus de la marge haute de la paupière supérieure).
![]()
![]()
Lors de l’administration, agir avec prudence pour éviter toute injection intravasculaire. Avant l’injection, il est possible de placer fermement le pouce ou l’index sous le bord orbitaire pour éviter l’épanchement du médicament dans cette zone. Orienter l’aiguille vers le haut et médialement.
En cas d’échec du traitement un mois après une première séance, c’est-à-dire en l’absence d’amélioration significative par rapport à la situation initiale, les approches suivantes peuvent être envisagées :
· L’analyse des causes de l’échec, par exemple l’injection dans les mauvais muscles, une technique d’injection inappropriée, la formation d’anticorps neutralisant la toxine ou un dosage insuffisant.
· La réévaluation de la pertinence du traitement par toxine botulinique de type A.
En l’absence d’effets indésirables consécutifs à une séance de traitement, il est possible d’entamer une nouvelle séance de traitement après un délai d’au moins trois mois.
Procédure à suivre pour une élimination en toute sécurité des flacons, des seringues et des matériels utilisés
Pour une élimination en toute sécurité, la fraction de Letybo non reconstituée doit être reconstituée dans le flacon avec une petite quantité d’eau, puis autoclavée. Les flacons vides ou contenant un résidu de solution, les seringues et les déversements doivent être autoclavés. La fraction restante de Letybo peut sinon être inactivée à l’aide d’une solution diluée d’hydroxyde de sodium (0,1 N NaOH) ou d’hypochlorite de sodium (NaOCl à 0,5 % ou 1 %).
Après inactivation, les flacons, seringues et matériels usagés ne doivent pas être vidés, mais placés dans des récipients appropriés et éliminés conformément à la réglementation en vigueur.
Recommandations en cas d’accident lors de la manipulation de la toxine botulinique
· Tout déversement du produit doit être essuyé : soit à l’aide d’un matériau absorbant imprégné d’une solution d’hypochlorite de sodium dans le cas du produit en poudre, soit à l’aide d’un matériau absorbant sec dans le cas du produit reconstitué.
· Les surfaces contaminées doivent être nettoyées avec un matériau absorbant imprégné d’une solution d’hypochlorite de sodium, puis séchées.
· Si un flacon est cassé, recueillir soigneusement les morceaux de verre et essuyer le produit comme indiqué ci-dessus, en évitant toute coupure de la peau.
· En cas de contact du médicament avec la peau, laver la zone concernée avec une solution d’hypochlorite de sodium, puis rincer abondamment à l’eau.
· En cas de contact du médicament avec les yeux, rincer abondamment à l’eau ou avec une solution de rinçage oculaire.
· En cas de contact du médicament avec une plaie, une coupure ou de la peau éraflée, rincer abondamment à l’eau et prendre les mesures médicales appropriées en fonction de la dose concernée.
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |