Dernière mise à jour le 01/12/2025
PRISMASOL 2 mmol/l POTASSIUM, solution pour hémofiltration et hémodialyse
Indications thérapeutiques
Classe pharmacothérapeutique : solutions pour hemodialyse et hemofiltration. - code ATC : B05ZB.
PRISMASOL 2 mmol/l Potassium est utilisée dans le traitement de l’insuffisance rénale comme solution pour l’hémofiltration ou l’hémodiafiltration continue (en remplacement du volume de liquide éliminé du sang lorsqu’il passe au travers d’un filtre), ainsi que pour l’hémodiafiltration et l’hémodialyse continue (le sang circule d’un côté de la membrane de dialyse tandis qu’une solution d’hémodialyse circule de l’autre côté de la membrane).
La solution PRISMASOL 2 mmol/l Potassium peut également être utilisée dans le cas d’empoisonnement par des substances dialysables ou filtrables.
La solution PRISMASOL 2 mmol/l Potassium est particulièrement indiquée pour les patients ayant une tendance à l’hyperkaliémie (concentration élevée de potassium dans le sang).
Composition en substances actives
-
Compartiment A : solution d'électrolytes ( Composition pour 1000 ml )
- > chlorure de calcium dihydraté 5,145 g
- > glucose anhydre 22 g
- > acide lactique 5,4 g
- > chlorure de magnésium hexahydraté 2,033 g
-
Compartiment B : solution tampon ( Composition pour 1000 ml )
- > bicarbonate de sodium 3,09 g
- > chlorure de potassium 0,157 g
- > chlorure de sodium 6,45 g
Présentations
> 2 poche(s) polyoléfine de 5000 ml bicompartimenté(e)(s)/à 2 compartiments suremballée(s)/surpochée(s)
Code CIP : 381 286-2 ou 34009 381 286 2 8
Déclaration de commercialisation : 27/02/2009
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 17/09/2008 | Inscription (CT) | Le service médical rendu par ces spécialités est important dans les indications de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 17/09/2008 | Inscription (CT) | Ces spécialités sont un complément de gamme qui n’apporte pas d’amélioration du service médical rendu. |
ANSM - Mis à jour le : 11/09/2024
PRISMASOL 2 mmol/l POTASSIUM, solution pour hémofiltration et hémodialyse
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
La solution reconstituée prête à l’emploi est obtenue en cassant le cône sécable ou en ouvrant la soudure pelable inter-compartiment et en mélangeant les deux solutions.
AVANT RECONSTITUTION
1000 ml de solution d’électrolytes (petit compartiment A) contiennent :
Principes actifs :
Chlorure de calcium dihydraté............................................................................................... 5,145 g
Chlorure de magnésium hexahydraté .................................................................................... 2,033 g
Glucose (sous forme de glucose monohydrate) .................................................................. 22,000 g
(S) - Acide lactique (solution d’acide lactique 90% m/m) ........................................................ 5,400 g
1000 ml de solution tampon (grand compartiment B) contiennent :
Principes actifs :
Chlorure de sodium.............................................................................................................. 6,450 g
Bicarbonate de sodium......................................................................................................... 3,090 g
Chlorure de potassium.......................................................................................................... 0,157 g
A+B
Chlorure de calcium, 2 H2O ................................................................................................... 0.257 g
Chlorure de magnésium, 6 H2O ............................................................................................. 0.102 g
Glucose............................................................................................................................... 1.100 g
Acide lactique...................................................................................................................... 0.270 g
Chlorure de sodium ............................................................................................................. 6.128 g
Chlorure de potassium.......................................................................................................... 0.149 g
Bicarbonate de sodium......................................................................................................... 2.936 g
APRES RECONSTITUTION
1000 ml de solution reconstituée contiennent :
Principes actifs mmol/l mEq/l
Calcium Ca 2+ 1,75 3,50
Magnésium Mg 2+ 0,50 1,00
Sodium Na + 140,00 140,00
Chlorure Cl - 111,50 111,50
Lactate 3,00 3,00
Bicarbonate HCO 3 - 32,00 32,00
Potassium K+ 2,00 2,00
Glucose 6,10
La solution finale reconstituée de 1000 ml correspond à 50 ml de la solution d’électrolytes A et de 950 ml de la solution tampon B.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution pour hémodialyse/hémofiltration
La solution reconstituée est limpide, légèrement colorée en jaune.
Osmolarité théorique: 297 mOsm/l
pH de la solution reconstituée = 7,0 à 8,5
4.1. Indications thérapeutiques
La solution Prismasol 2 mmol/l Potassium peut aussi être utilisée dans le cas d’empoisonnement par des substances dialysables ou filtrables.
La solution Prismasol 2 mmol/l Potassium est indiquée pour les patients ayant une tendance à l’hyperkaliémie.
4.2. Posologie et mode d'administration
Le débit d’administration de Prismasol 2 mmol/l Potassium dépend de la concentration sanguine d’électrolytes, de l’équilibre acido-basique, de l’équilibre hydrique et de l’état clinique général du patient De plus, le volume de solution de substitution et/ou le volume de dialysat à administrer dépendent de l’intensité (dose) du traitement souhaitée. La prescription et l’administration de la solution (dose, débit de perfusion et volume cumulatif) doivent être définies uniquement par un médecin expérimenté dans les soins intensifs et les traitements d’épuration extra-rénale continue (EERC).
Les débits de solution de substitution pour l’hémofiltration et l’hémodiafiltration sont:
Adulte: 500 - 3000 mL/h
Les débits de solution de dialyse (dialysat) pour l’hémodialyse continue et l’hémodiafiltration continue sont :
Adulte: 500 - 2500 mL/h
Les débits usuels utilisés chez l’adulte sont approximativement de 2000 à 2500 ml/h et correspondent à un volume quotidien de liquide d’approximativement 48 à 60L.
Population âgée
Les résultats issus des études cliniques et de l’expérience suggèrent que l’utilisation dans la population âgée ne présente aucune différence en termes de sécurité ou d’efficacité.
Population pédiatrique
Les amplitudes de débits de solution de substitution pour l’hémofiltration et l’hémodiafiltration et de débits de solution de dialyse (dialysat) en hémodialyse continue sont les suivantes :
Enfants (nouveau-nés jusqu’aux enfants de moins de 18 ans) : 1 000 à 2 000 mL/h/1,73 m2.
Il pourra être nécessaire d’utiliser des débits jusqu’ à 4 000 mL/h/1,73 m2, notamment chez les jeunes enfants (≤ 10 kg). Le débit absolu (en mL/h) utilisé dans la population pédiatrique ne doit généralement pas dépasser le débit maximal utilisé chez les adultes.
Mode d’administration
Voie intraveineuse et pour hémodialyse.
La solution Prismasol 2 mmol/l Potassium lorsqu'elle est utilisée en tant que solution de substitution, est administrée dans le circuit extracorporel en amont (pré dilution) ou en aval (post dilution) de l'hémofiltre ou de l’hémodiafiltre.
Pour des informations complémentaires sur l’utilisation de ce médicament, voir rubrique 6.6. Précautions particulières d’élimination et manipulation.
Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1.*
Les contre-indications liées à la solution sont :
· hypokaliémie
· alcalose métabolique.
* Une attention doit être prise, car le glucose contenu dans Prismasol 2 mmol/l Potassium peut être produit à partir d’amidon de maïs hydrolysé, et par conséquent, la présence d’antigènes de maïs dans le produit fini, tout comme des réactions d’hypersensibilité, ne peuvent être exclues.
Les contre-indications liées à la technique d’hémofiltration/dialyse sont les suivantes :
· insuffisance rénale associée à un état d’hypercatabolisme, si les symptômes urémiques ne peuvent plus être corrigés par hémofiltration,
· pression artérielle insuffisante au niveau des accès vasculaires,
· anticoagulation systémique (risque hémorragique élevé).
4.4. Mises en garde spéciales et précautions d'emploi
Mises en garde spéciales
La solution d'électrolytes doit être mélangée avec la solution tampon avant utilisation pour obtenir la solution reconstituée prête à l’emploi pour l'hémofiltration, l’hémodiafiltration ou l’hémodialyse continue.
Utiliser la solution uniquement avec un équipement d’épuration extra-rénale extracorporel approprié.
La solution Prismasol contenant du potassium, la concentration sérique en potassium doit être surveillée avant et pendant l’hémofiltration et/ou l’hémodialyse. En fonction de la concentration sérique en potassium avant traitement, une hypo- ou hyperkaliémie peut survenir.
En cas d’apparition d’une hypokaliémie, l’ajout de potassium et/ou l’administration d’un dialysat avec une concentration élevée en potassium pourra être nécessaire.
En cas d’apparition d’une hyperkaliémie après le début du traitement, l’ajout de sources de potassium influençant les concentrations sanguines pourra être évalué. Lorsque la solution est utilisée comme solution de substitution, réduire le débit de perfusion et vérifier l'obtention de la concentration de potassium désirée. Si l'hyperkaliémie persiste, interrompre rapidement l'administration.
En cas d’apparition d’une hyperkaliémie pendant l’utilisation de Prismasol comme dialysat, l’administration d’un dialysat sans potassium pourra être nécessaire pour accroître l’élimination du potassium.
Même si aucun cas de réactions graves d’hypersensibilité au maïs n’est reporté avec Prismasol 2 mmol/l Potassium, la solution contenant du glucose dérivé d’amidon de maïs hydrolysé ne doit pas être utilisée chez les patients ayant une allergie connue au maïs ou aux produits contenant du maïs.
L’administration doit être immédiatement stoppée en cas d’apparition de signe ou symptômes d’une éventuelle réaction d’hypersensibilité. Les mesures thérapeutiques appropriées doivent être instaurées selon l’état clinique du patient.
Etant donné que la solution contient du glucose et du lactate, une hyperglycémie peut survenir, en particulier chez les patients diabétiques. La glycémie doit être régulièrement surveillée. En cas d’hyperglycémie, l’administration d’une solution de substitution / dialysat sans glucose pourra être nécessaire. D’autres mesures correctives pourront être nécessaires pour maintenir la glycémie au niveau souhaité.
Prismasol 2 mmol/l Potassium contient un hydrogénocarbonate (bicarbonate) et du lactate (un précurseur du bicarbonate), qui peuvent influencer l’équilibre acido-basique du patient. Si une alcalose métabolique se développe ou s’aggrave pendant le traitement avec la solution, il est possible que le débit de perfusion doive être réduit ou que l’administration doive être interrompue.
L’utilisation d’une solution d’hémofiltration et hémodialyse contaminée peut entraîner une septicémie avec état de choc et menacer le pronostic vital.
Précautions d’emploi
Prismasol 2 mmol/l Potassium peut être réchauffé à 37°C pour améliorer le confort du patient. Le réchauffement de la solution avant son utilisation doit être effectué avant la reconstitution, exclusivement avec une chaleur sèche. Les solutions ne doivent pas être réchauffées au bain-marie ni au four à micro-ondes. La solution doit être inspectée visuellement afin de détecter toute présence de particules ou de décoloration avant l’administration, si la solution et le contenant le permettent. N’administrer la solution que si elle est limpide et la soudure est intacte.
Avant et pendant le traitement, il convient de surveiller étroitement l’équilibre électrolytique et acido-basique.
Il est possible d’ajouter à la solution jusqu’à 1,2 mmol/L de phosphate. En cas d’ajout de phosphate de potassium, la concentration totale en potassium ne doit pas dépasser 4 mEq/L (4 mmol/L). Une substitution en phosphate inorganique pourra être nécessaire en cas d’hypophosphatémie.
L’état hémodynamique et l’équilibre hydrique du patient doivent être surveillés tout au long de la procédure et rétablis si nécessaire.
Population pédiatrique
Il n’existe aucune mise en garde ni précaution spécifique à l’utilisation de ce médicament avec des enfants.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
La concentration sanguine des médicaments filtrables/ dialysables peut être réduite au cours du traitement.
Un traitement correctif approprié doit être réalisé si nécessaire pour atteindre les concentrations sanguines souhaitées des médicaments éliminés au cours du traitement.
Des interactions avec d’autres médicaments peuvent être évitées par un dosage approprié de la solution d’hémofiltration et d’hémodialyse et une surveillance renforcée.
Cependant, les interactions suivantes peuvent se produire :
· le risque d’une arythmie cardiaque induite par les digitaliques est augmenté en cas d’hypokaliémie,
· la vitamine D et ses analogues ainsi que les médicaments contenant du calcium (ex. chlorure de calcium ou gluconate de calcium, utilisés pour le maintien de l’homéostasie calcique chez les patients recevant une EERC utilisant l’anticoagulation au citrate, et carbonate de calcium comme chélateur du phosphate) peuvent augmenter le risque d’hypercalcémie,
· un ajout de bicarbonate de sodium (ou d’une autre source tampon) contenu dans les liquides d’EERC ou d’autres liquides administrés pendant le traitement, peut augmenter le risque d’alcalose métabolique.
· lorsque du citrate est utilisé comme anticoagulant, il est inclus dans le volume total de tampon et peut réduire les concentrations plasmatiques de calcium.
4.6. Fertilité, grossesse et allaitement
Grossesse et allaitement
Aucune information n’est disponible sur l’utilisation de Prismasol 2 mmol/l Potassium chez la femme enceinte ou qui allaite. Le médecin prescripteur doit évaluer le rapport bénéfice/risque avant d’administrer Prismasol 2 mmol/l Potassium à la femme enceinte ou qui allaite.
Fertilité
Il n’existe pas de donnée clinique concernant les effets sur la fertilité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
|
Classe de système d'organe |
Terme préféré |
Fréquence |
|
Trouble du métabolisme et de la nutrition |
Déséquilibres électrolytiques, p. ex. hypophosphatémie, hypokaliémie |
Indéterminée |
|
Troubles de l’équilibre acido-basique (ex : acidose métabolique) |
Indéterminée |
|
|
Déséquilibre hydrique (ex : rétention liquidienne, déshydratation) |
Indéterminée |
|
|
Hyperglycémie |
Indéterminée |
|
|
Affections vasculaires |
Hypotension |
Indéterminée |
|
Affections gastro-intestinales |
Nausées |
Indéterminée |
|
Vomissement |
Indéterminée |
|
|
Affections musculo-squelettiques et systémiques |
Contractures musculaires |
Indéterminée |
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Cependant, un surdosage peut avoir des conséquences graves, comme une insuffisance cardiaque congestive, des troubles électrolytiques ou acido-basiques.
En cas d’hypervolémie ou d’hypovolémie, des mesures correctives doivent être immédiatement prises.
En cas de déséquilibres électrolytiques et de déséquilibres acido-basiques (p. ex. alcalose métabolique, hypophosphatémie, hypokaliémie ), interrompre immédiatement l’administration. Il n’existe aucun antidote spécifique au surdosage. Le risque peut être limité par une surveillance étroite et une supplémentation appropriée pendant le traitement (voir rubrique 4.4).
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Solutions pour hémodialyse et hémofiltration, code ATC : B05ZB.
Effets pharmacodynamiques
La solution Prismasol 2 mmol/l Potassium, solution pour hémofiltration et hémodialyse est inactive sur le plan pharmacologique.
En effet, les ions sodium, calcium, magnésium, potassium, chlorure ainsi que le glucose sont présents à des concentrations similaires aux concentrations physiologiques du plasma.
Mécanisme d’action
La solution est utilisée pour remplacer l'eau et les électrolytes éliminés durant l'hémofiltration et l’hémodiafiltration ou pour servir de milieu d'échange approprié au cours de l’hémodiafiltration continue ou de l'hémodialyse continue.
Le bicarbonate est utilisé en tant que tampon alcalinisant.
5.2. Propriétés pharmacocinétiques
5.3. Données de sécurité préclinique
Solution d’électrolytes (petit compartiment A) :
Eau pour préparations injectables
Solution tampon (grand compartiment B) :
Eau pour préparations injectables
Dioxyde de carbone (E290)
En l’absence d’étude de compatibilité, la solution ne doit pas être mélangée à d’autres médicaments.
Il est de la responsabilité du médecin prescripteur de juger de l’incompatibilité de l’ajout d’un autre médicament à Prismasol 2 mmol/l Potassium. Il doit vérifier le changement éventuel de couleur et/ou une éventuelle précipitation, la présence de complexes insolubles ou de cristaux. La notice d’utilisation relative au médicament à ajouter doit être consultée.
Avant d’ajouter un médicament, il convient de vérifier sa solubilité et sa stabilité dans une eau au pH du Prismasol 2 mmol/l Potassium (le pH des solutions reconstituées est de 7,0 à 8,5).
Le médicament compatible doit être ajouté à la solution reconstituée et la solution obtenue doit être immédiatement administrée.
PVC : 1 an dans son conditionnement d’origine.
Polyoléfine : 18 mois dans son conditionnement d’origine.
La stabilité physico-chimique de la solution reconstituée a été démontrée pendant 24 heures à +22°C.
Si la solution n’est pas utilisée immédiatement, tout autre délai et conditions de conservation avant utilisation sont sous la responsabilité de l’utilisateur et le délai ne doit pas être normalement supérieur à 24 heures incluant la durée du traitement.
6.4. Précautions particulières de conservation
Ne pas conserver à une température inférieure à +4° C.
Pour les conditions de conservation du médicament après reconstitution, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
L’emballage en polychlorure de vinyle (PVC) ou en polyoléfine se présente sous la forme d’une poche à deux compartiments. La poche de 5000 ml se compose d’un petit compartiment (250 ml) et d’un grand compartiment (4750 ml). Les deux compartiments sont séparés par un cône sécable ou une soudure pelable.
Le grand compartiment B comporte un connecteur d'injection (ou site d’injection trocardable) en polycarbonate (PC), avec une gomme en caoutchouc recouverte d'un bouchon, ainsi que d’un connecteur luer (PC) muni d’un cône sécable (PC) ou d'une valve en caoutchouc de silicone permettant de connecter la poche à la ligne de réinjection ou de dialyse adaptée.
La poche est suremballée dans un emballage transparent en copolymère multicouches.
Chaque poche à deux compartiments contient 5000 ml.
Conditionnement : 2 poches de 5000 ml par carton.
6.6. Précautions particulières d’élimination et de manipulation
La solution d'électrolytes (petit compartiment A) est ajoutée à la solution tampon (grand compartiment B), après rupture du cône sécable ou ouverture de la soudure pelable inter-compartiment, immédiatement avant son utilisation pour obtenir la solution reconstituée.
Une notice d'information destinée aux patients détaillant les conditions d'utilisation est jointe dans le carton.
Une technique aseptique rigoureuse doit être respectée tout au long de la manipulation de la solution et de son administration au patient. N’ouvrir le suremballage qu’immédiatement avant l’utilisation de la poche.
Utiliser la solution uniquement si le suremballage n’est pas endommagé, toutes les soudures sont intactes, le cône sécable n’est pas cassé, la soudure pelable n’est pas ouverte et la solution est limpide. Appuyer fermement sur la poche pour vérifier l’absence de fuite. En cas de fuite, jeter immédiatement la solution puisque sa stérilité ne peut plus être garantie.
Le grand compartiment comporte un site d’injection pour l’ajout éventuel d’autres médicaments nécessaires après la reconstitution de la solution.
Avant d’ajouter une substance ou un médicament, vérifier sa solubilité et sa stabilité dans Prismasol 2 mmol/L Potassium et s’assurer de l’adéquation du pH (le pH de la solution reconstituée est compris entre 7,0 et 8,5).
Il est possible que les additifs soient incompatibles. La notice d’utilisation et les autres documents de littérature relatifs au médicament à ajouter doivent être consultés. Après l’ajout, en cas de changement de la coloration et/ou de l’apparition de précipités, de complexes insolubles ou de cristaux, ne pas utiliser la solution.
Bien mélanger la solution après l’ajout d’additifs. L’ajout et le mélange d’additifs doit toujours être effectué avant de connecter la poche de solution au circuit extracorporel.
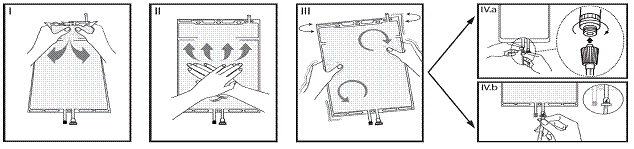
Si les deux compartiments de la poche sont séparés par un cône sécable et qu’un cône sécable est situé dans le connecteur luer, suivre les instructions d’utilisation suivantes :
I Enlevez l’emballage de protection de la poche et retirez la feuille située entre les compartiments repliés. Cassez le cône sécable séparant les deux compartiments de la poche. Le cône sécable reste dans la poche.
II Vérifiez que toute la solution du petit compartiment A s’écoule dans le grand compartiment B.
III Rincez le petit compartiment A par deux fois en refoulant par pression la solution mélangée dans le petit compartiment puis à nouveau dans le grand compartiment B.
IV Quand le petit compartiment A est vide : agitez le grand compartiment B afin de parfaire le mélange.
La solution est alors prête à l’emploi.
V La ligne de solution de réinjection ou de dialyse peut être connectée à l’un des deux connecteurs de la poche.
V.a Si le connecteur luer de la poche est utilisé, ôter le bouchon, visser le connecteur luer lock mâle de la ligne de dialyse ou de solution de réinjection sur le luer femelle de la poche et serrer. Avec le pouce et les autres doigts, casser le cône sécable bleu à sa base avec un mouvement de va-et-vient. Ne pas utiliser d’instrument. Vérifier que le cône est complètement séparé et que le liquide s’écoule librement. Le cône sécable reste dans le connecteur luer pendant tout le traitement (cf. figure V.a ci-dessous).
V.b Si le port d’injection est utilisé, retirer d’abord la capsule amovible. Le port d’injection est désinfectable. Introduire le perforateur à travers la gomme en caoutchouc. Vérifier que la solution s’écoule librement.
Si les deux compartiments de la poche sont séparés par un cône sécable et qu'une valve est située dans le connecteur luer, suivre les instructions d’utilisation suivantes:
I Retirez l’emballage de protection de la poche immédiatement avant usage et jetez tout autre emballage. Cassez le cône sécable séparant les deux compartiments de la poche. Le cône sécable reste dans la poche.
II Vérifiez que toute la solution du petit compartiment A s'écoule correctement dans le grand compartiment B.
III Rincez le petit compartiment A à deux reprises en refoulant par pression la solution mélangée dans le petit compartiment A, puis à nouveau dans le grand compartiment B.
IV Lorsque le petit compartiment A est vide, agitez le grand compartiment B afin de parfaire le mélange. La solution est alors prête à l'emploi et la poche peut être suspendue à l’équipement.
V La ligne de solution de réinjection ou de dialyse peut être connectée à l’un des deux connecteurs de la poche.
Va Si le connecteur luer de la poche est utilisé, retirez le bouchon du luer en le tournant et en le tirant et vissez le connecteur luer lock mâle de la ligne de dialyse ou de solution de réinjection sur le luer femelle de la poche en poussant et en tournant. Vérifiez que la connexion est solide et serrez. Le connecteur est désormais ouvert. Vérifiez que la solution s'écoule librement.
Lorsque la ligne de dialyse ou de solution de réinjection est déconnectée du connecteur luer, ce dernier se ferme et le flux de solution s'arrête. Le port luer est un port sans aiguille et désinfectable.
Vb Si le port d’injection est utilisé, ôtez d’abord la capsule le protégeant. Le port d’injection est désinfectable. Introduisez ensuite le perforateur à travers la gomme en caoutchouc. Vérifiez que la solution s’écoule librement.
Si les deux compartiments de la poche sont séparés par une soudure pelable et qu'une valve est située dans le connecteur luer, suivre les instructions d’utilisation suivantes:
I Retirez l’emballage de protection de la poche immédiatement avant usage et jetez tout autre emballage. Ouvrez la soudure en tenant le petit compartiment des deux mains et en le pressant jusqu'à ce qu'une ouverture se crée dans la soudure pelable située entre les deux compartiments.
II Appuyez à l’aide de vos deux mains sur le grand compartiment jusqu’à ce que la soudure pelable située entre les deux compartiments soit complètement ouverte.
III Agitez délicatement la poche pour parfaire le mélange de la solution. La solution est alors prête à l'emploi et la poche peut être suspendue à l’équipement.
IV La ligne de solution de réinjection ou de dialyse peut être connectée à l’un des deux connecteurs de la poche.
IVa Si le connecteur luer de la poche est utilisé, retirez le bouchon du luer en le tournant et en le tirant et vissez le connecteur luer lock mâle de la ligne de dialyse ou de solution de réinjection sur le luer femelle de la poche en poussant et en tournant. Vérifiez que la connexion est solide et serrez. Le connecteur est désormais ouvert. Vérifiez que la solution s'écoule librement.
Lorsque la ligne de dialyse ou de solution de réinjection est déconnectée du connecteur luer, ce dernier se ferme et le flux de solution s'arrête. Le port luer est un port sans aiguille et désinfectable.
IVb Si le port d’injection est utilisé, ôtez d’abord la capsule le protégeant. Le port d’injection est désinfectable. Introduisez ensuite le perforateur à travers la gomme en caoutchouc. Vérifiez que la solution s’écoule librement.
La solution reconstituée doit être utilisée immédiatement. Si elle n’est pas utilisée immédiatement, la solution reconstituée doit être utilisée dans les 24 heures qui suivent l’addition de la solution d’électrolytes à la solution tampon et qui incluent la durée du traitement.
La solution reconstituée est un produit à usage unique.
Ne pas utiliser si l'emballage est endommagé ou si la solution n'est pas limpide.
Les quantités de solution non utilisées doivent être jetées.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
BOULEVARD D'ANGLETERRE 2
1420 BRAINE-L'ALLEUD
BELGIQUE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 359 560 8 8: 5000 ml en poche (PVC) ; boîte de 2
· 34009 381 286 2 8 : 5000 ml en poche (polyoléfine) ; boîte de 2
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I. Médicament soumis à prescription médicale.
ANSM - Mis à jour le : 11/09/2024
PRISMASOL 2 mmol/l POTASSIUM, solution pour hémofiltration et hémodialyse
Chlorure de calcium dihydraté, Chlorure de magnésium hexahydraté, Glucose monohydrate, solution d’acide lactique 90% m/m, Chlorure de sodium, Chlorure de potassium, Bicarbonate de sodium
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que PRISMASOL 2 mmol/l POTASSIUM solution pour hémofiltration et hémodialyse et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser PRISMASOL 2 mmol/l POTASSIUM solution pour hémofiltration et hémodialyse ?
3. Comment utiliser PRISMASOL 2 mmol/l POTASSIUM, solution pour hémofiltration et hémodialyse ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver PRISMASOL 2 mmol/l POTASSIUM, solution pour hémofiltration et hémodialyse ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE PRISMASOL 2 mmol/l POTASSIUM, solution pour hémofiltration et hémodialyse ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : solutions pour hemodialyse et hemofiltration. - code ATC : B05ZB.
PRISMASOL 2 mmol/l Potassium est utilisée dans le traitement de l’insuffisance rénale comme solution pour l’hémofiltration ou l’hémodiafiltration continue (en remplacement du volume de liquide éliminé du sang lorsqu’il passe au travers d’un filtre), ainsi que pour l’hémodiafiltration et l’hémodialyse continue (le sang circule d’un côté de la membrane de dialyse tandis qu’une solution d’hémodialyse circule de l’autre côté de la membrane).
La solution PRISMASOL 2 mmol/l Potassium peut également être utilisée dans le cas d’empoisonnement par des substances dialysables ou filtrables.
La solution PRISMASOL 2 mmol/l Potassium est particulièrement indiquée pour les patients ayant une tendance à l’hyperkaliémie (concentration élevée de potassium dans le sang).
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER PRISMASOL 2 mmol/l POTASSIUM, solution pour hémofiltration et hémodialyse ?
N’utilisez jamais PRISMASOL 2 mmol/l POTASSIUM, solution pour hémofiltration et hémodialyse dans les cas suivants:
· allergie à l’une des substances actives ou à l’un des autres composants contenus dans ce médicament mentionnés dans la rubrique 6
· faible concentration de potassium dans votre sang (hypokaliémie).
· concentration élevée de bicarbonate dans le sang (alcalose métabolique).
La présence d’antigène de maïs dans PRISMASOL 2 mmol/l POTASSIUM ne peut être exclue.
N’utilisez pas la technique d’hémofiltration/dialyse dans les cas suivants :
· Insuffisance rénale associée à un état d’hypercatabolisme prononcé (augmentation anormale du catabolisme), si les symptômes urémiques (symptômes causés par une concentration d’urée élevée dans le sang) ne peuvent plus être corrigés par hémofiltration.
· Pression artérielle insuffisante au niveau des accès vasculaires.
· Anticoagulation systémique (coagulation sanguine réduite), si le risque d’hémorragie (saignement) est élevé.
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien ou infirmier/ère avant d’utiliser ce médicament.
Ce médicament doit seulement être utilisé par ou sous la responsabilité d’un médecin qualifié dans le traitement de l’insuffisance rénale utilisant les techniques d’hémofiltration, d’hémodiafiltration ou d’hémodialyse continue.
Avant et pendant le traitement, la composition de votre sang sera contrôlée dont notamment l'équilibre acido-basique et la concentration des électrolytes (sels dans le sang), ainsi que tous les liquides que vous recevez (par perfusion intraveineuse) et ceux que vous produisez (urine), même s’ils ne sont pas directement liés au traitement.
Votre concentration de sucre dans le sang doit faire l’objet d’une surveillance attentive, en particulier si vous êtes diabétique.
Autres médicaments et PRISMASOL 2 mmol/l POTASSIUM, solution pour hémofiltration et hémodialyse
Informez votre médecin ou pharmacien si vous recevez, avez récemment reçu ou pourriez recevoir un autre médicament.
La concentration sanguine de certains de vos médicaments peut être réduite au cours du traitement. Il appartiendra à votre médecin de déterminer si votre prescription doit être modifiée.
En particulier, informez votre médecin dans les cas suivants :
· Médicaments à base de digitaline (pour le traitement de certains troubles cardiaques) étant donné que le risque d’arythmie cardiaque (battements de coeur irréguliers ou rapides) causé par la digitaline est accru en cas d'hypokaliémie (faible taux de potassium dans le sang).
· La vitamine D et les médicaments contenant du calcium car ils peuvent accroître le risque d'hypercalcémie (taux élevé de calcium dans le sang).
· Tout ajout de bicarbonate de sodium (ou une autre source tampon) car il peut accroître le risque d'alcalose métabolique (excès de bicarbonate dans le sang).
· En cas d’utilisation de citrate comme anticoagulant (comme additif protecteur dans les équipements de dialyse), car il peut réduire les concentrations plasmatiques de calcium.
PRISMASOL 2 mmol/l POTASSIUM, solution pour hémofiltration et hémodialyse avec des aliments, boissons et de l’alcool
Sans objet.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Votre médecin prescripteur déterminera la nécessité d’un traitement par PRISMASOL 2 mmol/l Potassium si vous êtes enceinte ou allaitez.
Conduite de véhicules et utilisation de machines
PRISMASOL n’est pas connu pour affecter l’aptitude à conduire un véhicule ou à utiliser des machines.
PRISMASOL 2 mmol/l POTASSIUM, solution pour hémofiltration et hémodialyse contient
Sans objet.
3. COMMENT UTILISER PRISMASOL 2 mmol/l POTASSIUM, solution pour hémofiltration et hémodialyse ?
Posologie et administration
Le volume de solution PRISMASOL 2 mmol/l Potassium à administrer dépend de votre état clinique et de l’équilibre liquidien souhaité. Par conséquent, le volume à administrer est à l’appréciation du médecin traitant.
Voie d’administration : Voie intraveineuse et pour hémodialyse.
Si vous pensez avoir utilisé plus de PRISMASOL 2 mmol/l POTASSIUM solution pour hémofiltration et hémodialyse que vous n’auriez dû :
Votre balance hydro-électrolytique et votre équilibre acido-basique seront surveillés attentivement.
Dans le cas peu probable d’un surdosage, votre médecin prendra les mesures correctives qui s’imposent et ajustera votre traitement.
Un surdosage peut causer :
· une surcharge hydrique dans votre sang,
· une augmentation de la concentration en bicarbonate dans le sang (alcalose métabolique), et/ou une diminution des concentrations de sels dans le sang (hypophosphatémie, hypokaliémie).
Un surdosage peut avoir des conséquences graves, comme une insuffisance cardiaque congestive, des troubles électrolytiques ou acido-basiques.
Pour le mode d’emploi, veuillez-vous reporter à la rubrique « Les informations suivantes sont destinées exclusivement aux professionnels de santé ».
Si vous oubliez d’utiliser PRISMASOL 2 mmol/l POTASSIUM, solution pour hémofiltration et hémodialyse :
Si vous arrêtez d’utiliser PRISMASOL 2 mmol/l POTASSIUM, solution pour hémofiltration et hémodialyse :
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
· des changements des concentrations de sel dans le sang (déséquilibres électrolytiques, comme une hypophosphatémie ou une hypokaliémie) ;
· une augmentation de la concentration plasmatique en bicarbonate (alcalose métabolique) ou une diminution de la concentration plasmatique en bicarbonate (acidose métabolique) ;
· un volume d’eau anormalement élevé ou faible dans l’organisme (hyper ou hypovolémie) ;
· une concentration en glucose anormalement élevée dans le sang (hyperglycémie) ;
· des nausées ;
· des vomissements ;
· des crampes musculaires ;
· une hypotension (tension artérielle basse).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER PRISMASOL 2 mmol/l POTASSIUM, solution pour hémofiltration et hémodialyse ?
Tenir ce médicament hors de la vue et de la portée des enfants.
Ne pas conserver à une température inférieure à +4°C.
N’utilisez pas ce médicament après la date de péremption indiquée sur la poche et sur l’emballage. La date de péremption fait référence au dernier jour de ce mois.
La stabilité physico-chimique de la solution reconstituée a été démontrée pendant 24 heures à 22°C. Si la solution n’est pas utilisée immédiatement, les durées et conditions de conservation avant utilisation relèvent de la seule responsabilité de l’utilisateur et ne devraient pas dépasser 24 heures, incluant la durée du traitement.
Ne jetez aucun médicament au tout-à-l'égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l'environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient PRISMASOL 2 mmol/l POTASSIUM, solution pour hémofiltration et hémodialyse
· Les substances actives sont :
AVANT RECONSTITUTION
1000 ml de solution d'électrolytes (petit compartiment A) contiennent :
Chlorure de calcium dihydraté ..................................................................................................... 5,145 g
Chlorure de magnésium hexahydraté ......................................................................................... 2,033 g
Glucose ..................................................................................................................................... 22,000 g
(S)-Acide lactique ........................................................................................................................ 5,400 g
1000 ml de solution tampon (grand compartiment B) contiennent :
Chlorure de sodium ..................................................................................................................... 6,450 g
Bicarbonate de sodium ................................................................................................................ 3,090 g
Chlorure de potassium ................................................................................................................. 0,157 g
APRES RECONSTITUTION
Les solutions des compartiments A (250 ml) et B (4750 ml) sont mélangées pour former la solution reconstituée (5000 ml) dont la formule est:
|
mmol/l |
mEq/l |
|
|
Calcium - Ca2+ |
1,75 |
3,50 |
|
Magnésium - Mg2+ |
0,50 |
1,00 |
|
Sodium - Na+ |
140,00 |
140,00 |
|
Chlorure - Cl- |
111,50 |
111,50 |
|
Lactate |
3,00 |
3,00 |
|
Bicarbonate - HCO3 - |
32,00 |
32,00 |
|
Potassium- K+ |
2,00 |
2,00 |
|
Glucose |
6,10 |
Osmolarité théorique: 297 mOsm/l
· Les autres composants sont:
Dioxyde de carbone (E 290), eau pour préparations injectables.
pH de la solution reconstituée: 7.0 – 8.5.
PRISMASOL 2 mmol/l POTASSIUM se présente sous la forme d'une poche à deux compartiments. Le petit compartiment A contient la solution électrolytique et le grand compartiment B contient la solution tampon. La solution reconstituée finale est obtenue après avoir cassé le cône ou ouvert la soudure pelable inter-compartiment et mélangé les deux solutions. La solution reconstituée est limpide, légèrement colorée en jaune. Chaque poche (A+B) contient 5 000 ml de solution pour hémofiltration et hémodialyse. La poche est suremballée dans un emballage transparent.
Chaque carton contient deux poches et une notice.
Titulaire de l’autorisation de mise sur le marché
BOULEVARD D'ANGLETERRE 2
1420 BRAINE-L'ALLEUD
BELGIQUE
Exploitant de l’autorisation de mise sur le marché
IMMEUBLE BERLIOZ
4 BIS RUE DE LA REDOUTE
78280 GUYANCOURT
FRANCE
BIEFFE MEDITAL S.P.A.
VIA STELVIO, 94
23035 SONDALO (SO)
ITALIE
Ou
VANTIVE MANUFACTURING LIMITED
MONEEN ROAD,
CASTLEBAR
COUNTY MAYO
F23 XR63
IRLANDE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen et au Royaume-Uni (Irlande du Nord) sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé :
PRISMASOL 2 mmol/l POTASSIUM, solution pour hémofiltration et hémodialyse
Précautions
Il convient de suivre rigoureusement les instructions d’utilisation/de manipulation de PRISMASOL 2 mmol/l POTASSIUM.
Les solutions dans les deux compartiments doivent être mélangées avant utilisation.
L’utilisation d’une solution pour hémofiltration et hémodialyse contaminée peut entraîner une septicémie avec état de choc et menacer le pronostic vital.
Prismasol peut être réchauffé à 37 C pour améliorer le confort du patient. Le réchauffement de la solution avant son utilisation doit être effectué avant la reconstitution, exclusivement avec une chaleur sèche. Les solutions ne doivent pas être réchauffées au bain-marie ni au four à micro-ondes. La solution doit être inspectée visuellement afin de détecter toute présence de particules ou de décoloration avant l’administration, si la solution et le contenant le permettent. N’administrer la solution que si elle est limpide et la soudure est intacte.
La solution contient du potassium. La concentration sérique de potassium doit être surveillée avant et pendant l’hémofiltration et/ou l’hémodialyse. En fonction de la concentration plasmatique de potassium avant le traitement, une hypo- ou hyperkaliémie peut survenir.
En cas d’apparition d’une hypokaliémie, l’ajout de potassium et /ou l’administration d’une solution de dialysat avec une concentration élevée en potassium pourra être nécessaire.
En cas d’apparition d’une hyperkaliémie après le début du traitement, l’ajout de sources de potassium influençant les concentrations sanguines pourra être évaluée. Lorsque la solution est utilisée comme solution de substitution, réduire le débit de perfusion et vérifier l'obtention de la concentration de potassium désirée. Si l'hyperkaliémie persiste, interrompre rapidement l'administration.
En cas d’apparition d’une hyperkaliémie pendant l’utilisation de Prismasol comme dialysat, l’administration d’un dialysat sans potassium pourra être nécessaire pour accroître l’élimination du potassium.
La concentration de phosphate inorganique doit être mesurée régulièrement. Le phosphate inorganique doit être substitué en cas de faible taux de phosphate dans le sang. Il est possible d’ajouter à la solution jusqu’à 1,2 mmol/L de phosphate. En cas d’ajout de phosphate de potassium, la concentration totale en potassium ne doit pas dépasser 4 mEq/L (4 mmol/L).
Même si aucun cas de réactions graves d’hypersensibilité au maïs n’est reporté avec PRISMASOL 2 mmol/L POTASSIUM ; la solution, contenant du glucose dérivé d’amidon de maïs hydrolysé, ne doit pas être utilisée chez les patients ayant une allergie connue au maïs ou aux produits contenant du maïs.
L’administration doit être immédiatement stoppée en cas d’apparition de signe ou symptômes d’une éventuelle réaction d’hypersensibilité. Les mesures thérapeutiques appropriées doivent être instaurées selon l’état clinique du patient.
Etant donné que la solution contient du glucose et du lactate, une hyperglycémie peut survenir, en particulier chez les patients diabétiques. La glycémie doit être régulièrement surveillée. En cas d’hyperglycémie, l’administration d’une solution de substitution / dialysat sans glucose pourra être nécessaire. D’autres mesures correctives pourront être nécessaires pour maintenir la glycémie au niveau souhaité.
PRISMASOL 2 mmol/L POTASSIUM contient un hydrogénocarbonate (bicarbonate) et du lactate (un précurseur du bicarbonate), qui peuvent influencer l’équilibre acido-basique du patient. Si une alcalose métabolique se développe ou s’aggrave pendant le traitement avec la solution, il est possible que le débit de perfusion doive être réduit ou que l’administration doive être interrompue.
Avant et pendant toute la durée du traitement, l’équilibre électrolytique et l’équilibre acido-basique du patient doivent être étroitement surveillés.
En cas de déséquilibre hydrique, l’état clinique doit être surveillé attentivement et l’équilibre hydrique doit être rétabli au besoin.
Mode d’administration
Voie intraveineuse et pour hémodialyse.
La solution PRISMASOL 2 mmol/L POTASSIUM lorsqu'elle est utilisée en tant que solution de substitution, est administrée dans le circuit extracorporel en amont (pré dilution) ou en aval de l’hémofiltre (post dilution).
Posologie
Le volume et le débit de PRISMASOL 2 mmol/L POTASSIUM à administrer dépendent de la concentration sanguine d’électrolytes, de l’équilibre acido-basique et de l’état clinique général du patient. L’administration de la solution PRISMASOL 2 mmol/L POTASSIUM (dose, débit de perfusion et volume cumulatif) doit être définie par un médecin.
Les débits usuels de solution de substitution en hémofiltration et hémodiafiltration sont les suivants :
Adultes : 500 – 3 000 mL/h
Les débits usuels de solution de dialyse (dialysat) en hémodialyse continue et hémodiafiltration continue sont les suivants :
Adultes : 500 – 2 500 mL/h
Le débit généralement utilisé chez l’adulte est d’approximativement 2 000 à 2 500 ml/h, ce qui correspond à un volume quotidien de liquide d’approximativement 48 à 60 L.
Population pédiatrique
Les débits de solution de substitution en hémofiltration et en hémodiafiltration et les débits de solution de dialyse (dialysat) en hémodialyse continue sont les suivants :
Enfants (de nouveau-nés jusqu’aux enfants de moins de 18 ans) : 1 000 à 2 000 ml/h/1,73 m2.
Il pourra être nécessaire d’utiliser des débits jusqu’à 4 000 mL/h/1,73 m2, notamment chez les jeunes enfants (≤ 10 kg). Le débit absolu (en mL/h) utilisé dans la population pédiatrique ne doit généralement pas dépasser le débit maximal utilisé chez les adultes.
Instructions d’utilisation / de manipulation
La solution d’électrolytes (petit compartiment A) est ajoutée à la solution tampon (grand compartiment B), après ouverture de la soudure pelable ou cassure du cône sécable et immédiatement avant son utilisation pour obtenir la solution reconstituée.
Utiliser la solution uniquement avec un équipement d’épuration extra-rénale extracorporel approprié.
Une technique aseptique doit être respectée tout au long de la manipulation et l’administration de la solution au patient.
Utiliser uniquement si le suremballage n’est pas endommagé, toutes les soudures sont intactes, la soudure pelable n’est pas ouverte ou le cône sécable n’est pas cassé et la solution est limpide. Appuyer fermement sur la poche pour vérifier l’absence de fuite. En cas de fuite, jetez immédiatement la solution car il est impossible d’en garantir la stérilité.
Le grand compartiment B est muni d’un site d’injection pour l’ajout éventuel d’autres médicaments, une fois la solution reconstituée. Il est de la responsabilité du médecin de juger de la compatibilité en cas d’ajout d’un autre médicament à PRISMASOL 2 mmol/L POTASSIUM. Il doit vérifier le changement éventuel de couleur et/ou une éventuelle précipitation, la présence de complexes insolubles ou de cristaux.
Avant d’ajouter un médicament, il convient de vérifier sa solubilité et sa stabilité dans une eau au pH correspondant à celui de PRISMASOL 2 mmol/L POTASSIUM (le pH de la solution reconstituée est compris entre 7 et 8,5). Il est possible que les additifs soient incompatibles. La notice d’utilisation relative au médicament à ajouter doit être consultée.
Éliminer tout liquide du site d’injection, maintenir la poche de haut en bas, injecter le médicament par le site d’injection et mélanger vigoureusement. La solution doit être administrée immédiatement. L’introduction et le mélange des additifs doit toujours être effectué avant de connecter la poche au circuit extracorporel.
Si les deux compartiments de la poche sont séparés par un cône sécable et qu’un cône sécable est situé dans le connecteur luer, suivre les instructions pour l’utilisation suivantes
I Retirez le suremballage de la poche immédiatement avant usage. Cassez le cône sécable séparant les deux compartiments de la poche. Le cône restera dans la poche (cf. figure I ci-dessous).
II Assurez-vous que toute la solution du petit compartiment A s’écoule dans le grand compartiment B (cf. figure II ci-dessous).
III Rincez deux fois le petit compartiment A en pressant la poche pour refouler la solution mélangée dans le petit compartiment A puis de nouveau dans le grand compartiment B (cf. figure III ci-dessous).
IV Lorsque le petit compartiment A est vide, agitez le grand compartiment B afin que le contenu soit bien mélangé. La solution est désormais prête à l’emploi et la poche peut être suspendue au moniteur (cf. figure IV ci-dessous).
V. La ligne de solution de réinjection ou de dialyse peut être connectée à l’un ou l’autre des deux connecteurs de la poche.
V. a Si le connecteur luer lock est utilisé, ôter le bouchon, visser le luer lock mâle de la ligne de dialysat ou de réinjection sur le luer lock femelle de la poche et serrer. Avec le pouce et les autres doigts, casser le cône sécable bleu à sa base avec un mouvement de va-et-vient. Ne pas utiliser d’instrument. Vérifier que le cône est complètement séparé et que le liquide s’écoule librement. Le cône sécable reste dans le luer pendant tout le traitement (cf. figure V.a ci-dessous).
V. b Si le port d’injection est utilisé, retirer d’abord la capsule amovible. Le port d’injection est désinfectable. Introduire le perforateur à travers la gomme en caoutchouc. Vérifier que la solution s’écoule librement. (cf. figure V.b ci-dessous).
La solution doit être utilisée immédiatement après le retrait du suremballage. Si elle n’est pas utilisée immédiatement, la solution reconstituée doit être utilisée dans les 24 heures, durée de traitement comprise, après l’ajout de la solution d’électrolytes à la solution tampon.
La solution reconstituée est un produit à usage unique. Les quantités de solution non utilisées doivent être jetées immédiatement après emploi.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
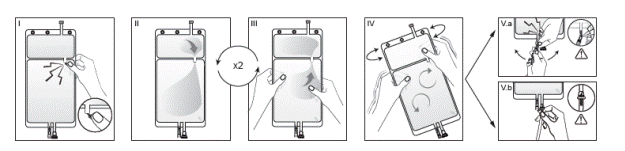
Si les deux compartiments de la poche sont séparés par un cône sécable et qu’une valve est situé dans le connecteur luer, suivre les instructions pour l’utilisation suivantes
I Retirez le suremballage de la poche immédiatement avant usage. Cassez le cône sécable séparant les deux compartiments de la poche. Le cône restera dans la poche (cf. figure I ci-dessous).
II Assurez-vous que toute la solution du petit compartiment A s’écoule dans le grand compartiment B (cf. figure II ci-dessous).
III Rincez deux fois le petit compartiment A en pressant la poche pour refouler la solution mélangée dans le petit compartiment A puis de nouveau dans le grand compartiment B (cf. figure III ci-dessous).
IV Lorsque le petit compartiment A est vide, agitez le grand compartiment B afin que le contenu soit bien mélangé. La solution est désormais prête à l’emploi et la poche peut être suspendue au moniteur (cf. figure IV ci-dessous).
V La ligne de solution de réinjection ou de dialyse peut être connectée à l’un ou l’autre des deux connecteurs de la poche.
V. a Si le connecteur luer de la poche est utilisé, retirez le bouchon du luer en le tirant et en le tournant et vissez le connecteur luer lock mâle de la ligne de dialyse ou de solution de réinjection sur le luer femelle de la poche en poussant et en tournant. Vérifiez que la connexion est sure et serrez. Le connecteur est désormais ouvert. Vérifiez que la solution s’écoule librement. (Voir l’illustration V.a ci-dessous)
Lorsque la ligne de dialyse ou de solution de réinjection est déconnectée du connecteur luer, ce dernier se ferme et l’écoulement de solution s'arrête. Le connecteur luer ne nécessite pas d’aiguille et est désinfectable.
V. b Si le port d’injection est utilisé : ôter la capsule. Le port d’injection est désinfectable. Puis introduire le perforateur à travers la gomme du site d’injection. Vérifier que la solution s’écoule librement (cf. figure V.b ci-dessous).
La solution doit être utilisée immédiatement après le retrait du suremballage. Si elle n’est pas utilisée immédiatement, la solution reconstituée doit être utilisée dans les 24 heures, durée de traitement comprise, après l’ajout de la solution d’électrolytes à la solution tampon.
La solution reconstituée est un produit à usage unique. Les quantités de solution non utilisées doivent être jetées immédiatement après emploi.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
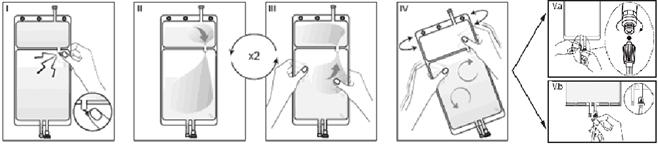
Si les deux compartiments de la poche sont séparés par une soudure pelable et qu’une valve est située dans le connecteur luer, suivre les instructions pour l’utilisation suivantes :
I Retirez le suremballage de la poche immédiatement avant usage. Mélangez les solutions des 2 compartiments. Ouvrez la soudure pelable en maintenant le petit compartiment des deux mains et en le pressant jusqu'à ce qu'une ouverture se crée dans la soudure pelable située entre les deux compartiments (cf. figure I ci-dessous).
II Appuyez des deux mains sur le grand compartiment jusqu'à ce que la soudure pelable inter-compartiments soit entièrement ouverte (cf. figure II ci-dessous).
III Mélangez bien la solution en secouant délicatement la poche. La solution est désormais prête à l’emploi et la poche peut être suspendue au moniteur (cf. figure III ci-dessous)
IV La ligne de solution de réinjection ou de dialyse peut être connectée à l’un ou l’autre des deux connecteurs de la poche.
IV. a Si le connecteur luer de la poche est utilisé, retirez le bouchon du luer en le tournant et en le tirant et vissez le connecteur luer lock mâle de la ligne de dialyse ou de solution de réinjection sur le connecteur luer femelle de la poche en poussant et en tournant. Vérifiez que la connexion est sure et serrez. Le connecteur est désormais ouvert. Vérifiez que la solution s’écoule librement. (Voir l’illustration IV.a ci-dessous)
Lorsque la ligne de dialyse ou de solution de réinjection est déconnectée du connecteur luer, ce dernier se ferme et l’écoulement de solution s'arrête. Le connecteur luer ne nécessite pas d’aiguille et est désinfectable.
IV. b Si le port d’injection est utilisé : ôter la capsule. Le port d’injection est désinfectable. Puis introduire le perforateur à travers la gomme du site d’injection. Vérifier que la solution s’écoule librement (cf. figure IV.b ci-dessous).
La solution doit être utilisée immédiatement après le retrait du suremballage. Si elle n’est pas utilisée immédiatement, la solution reconstituée doit être utilisée dans les 24 heures, durée de traitement comprise, après l’ajout de la solution d’électrolytes à la solution tampon.
La solution reconstituée est un produit à usage unique. Les quantités de solution non utilisées doivent être jetées immédiatement après emploi.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.