Dernière mise à jour le 01/12/2025
DORZOLAMIDE EG 20 mg/mL, collyre en solution
Indications thérapeutiques
Classe pharmacothérapeutique - code ATC : S01EC03
DORZOLAMIDE EG 20 mg/ml, collyre en solution est une solution stérile sous forme de gouttes ophtalmiques. DORZOLAMIDE EG 20 mg/ml, collyre en solution contient comme une substance active de la famille des sulfamides, le dorzolamide.
DORZOLAMIDE EG 20 mg/ml, collyre en solution est un inhibiteur ophtalmique de l'anhydrase carbonique qui fait baisser la pression oculaire élevée.
Il est indiqué pour faire baisser la pression oculaire chez les patients atteints d'hypertension oculaire ou de glaucomes (glaucome à ouverture d'angle, glaucome pseudo-exfoliatif).
DORZOLAMIDE EG 20 mg/ml, collyre en solution peut être utilise seul ou en association avec d'autres médicaments qui font baisser la pression de l'œil (appelés béta-bloquants).
Présentations
> 1 flacon(s) polyéthylène de 5 ml
Code CIP : 498 775-3 ou 34009 498 775 3 9
Déclaration de commercialisation : 26/10/2011
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 4,41 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 5,43 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Amélioration du service médical rendu (ASMR)
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
ANSM - Mis à jour le : 13/04/2023
DORZOLAMIDE EG 20 mg/ml, collyre en solution
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Dorzolamide......................................................................................................................... 20 mg
Équivalent à 22,3 mg de chlorhydrate de dorzolamide.
Pour un mL de collyre en solution
Excipient(s) à effet notoire : chaque millilitre de collyre en solution contient 0,075 mg de chlorure de benzalkonium.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution aqueuse transparente, incolore, isotonique, tamponnée, légèrement visqueuse.
4.1. Indications thérapeutiques
DORZOLAMIDE EG 20 mg/ml, collyre en solution est indiqué:
· comme traitement d'appoint en association à un traitement par bêta-bloquant,
· en monothérapie chez les patients ne répondant pas aux bêta-bloquants ou chez les patients pour lesquels les bêta-bloquants sont contre-indiqués,
Dans le traitement de la pression intraoculaire élevée chez les patients présentant:
· une hypertonie oculaire,
· un glaucome à angle ouvert,
· un glaucome pseudo-exfoliatif.
4.2. Posologie et mode d'administration
En monothérapie, la dose est d'une goutte de dorzolamide dans le cul-de-sac conjonctival de l'œil (les yeux) atteint(s), trois fois par jour.
En traitement d'appoint en association à un bêta-bloquant à usage ophtalmique, la dose est d'une goutte de dorzolamide dans le cul-de-sac conjonctival de l'œil (les yeux) atteint(s), deux fois par jour.
En cas de remplacement d'un autre traitement antiglaucomateux par le dorzolamide, interrompre l'autre médicament après la dernière prise de la journée à la dose appropriée puis commencer le dorzolamide le jour suivant.
En cas d'utilisation concomitante de plusieurs collyres, les médicaments doivent être administrés à au moins 10 minutes d'intervalle.
Les patients doivent être avertis de laver leurs mains avant utilisation et d'éviter de mettre en contact l'embout du flacon avec l'œil ou les parties avoisinantes.
Les patients doivent aussi être informés que les solutions ophtalmiques, incorrectement manipulées, peuvent être contaminées par des bactéries communes, connues pour entraîner des infections oculaires. L'usage de solutions contaminées peut provoquer des lésions importantes graves et une baisse de la vision.
Les patients doivent être informés sur la manipulation exacte des flacons.
Population pédiatrique
Chez l'enfant, des données cliniques limitées sont disponibles après administration du dorzolamide trois fois par jour (pour plus d'informations voir rubrique 5.1).Mode d’administration
1. Avant la première utilisation, vérifiez que la bague d'inviolabilité située au niveau du col du flacon n'est pas rompue. La présence d'un espace entre le bouchon et le flacon non entamé est normale;
2. Retirez le capuchon du flacon.
3. Inclinez la tête vers l'arrière et tirez légèrement la paupière inférieure vers le bas pour pouvoir instiller les gouttes entre la paupière et l'œil.
4. Renversez le flacon et pressez légèrement entre le pouce et l'index jusqu'à ce qu'une seule goutte tombe dans l'œil comme indiqué par votre médecin. NE TOUCHEZ PAS L'ŒIL OU LA PAUPIERE AVEC L'EMBOUT DU FLACON.
5. Fermez votre oeil et appuyez sur le coin intérieur de l’oeil avec votre doigt pendant environ deux minutes. Cela aide à stopper la propagation du médicament dans le reste du corps.
6. Répétez les étapes 2 et 3 pour l'autre œil si votre médecin vous l'a prescrit.
7. Remettez le capuchon en place et fermez le flacon aussitôt après usage.
Le passage systémique est réduit par une occlusion nasolacrymale ou la fermeture des paupières pendant 2 minutes. Cette technique peut permettre une diminution des effets indésirables systémiques et une augmentation de l’efficacité locale.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
Le dorzolamide n'a pas été étudié chez les patients présentant une insuffisance rénale sévère (clairance de la créatinine < 30 ml/min.) ou une acidose hyperchlorémique. Le dorzolamide et ses métabolites étant excrétés principalement par le rein, le dorzolamide est, en conséquence, contre-indiqué chez de tels patients.
4.4. Mises en garde spéciales et précautions d'emploi
Le traitement des patients présentant un glaucome aigu par fermeture de l'angle nécessite des interventions thérapeutiques en plus des agents hypotensifs oculaires. Le dorzolamide n'a pas été étudié chez les patients présentant un glaucome aigu par fermeture de l'angle.
Le dorzolamide contient un groupe sulfonamide qui existe également chez les sulfamideset bien qu'administré localement, celui-ci passe dans la circulation générale. Par conséquent, des effets indésirables, du même type que ceux imputables aux sulfamides pris par voie générale, peuvent se produire avec une administration locale, y compris des réactions sévères telles que le syndrome de Stevens-Johnson et la nécrolyse épidermique toxique. En cas de réactions graves ou d'hypersensibilité, le médicament doit être arrêté.
Le traitement par des inhibiteurs de l'anhydrase carbonique oraux, a été associé à des lithiases urinaires secondaires, à des modifications de l'équilibre acido-basique, spécialement chez les patients ayant des antécédents de calculs rénaux. Bien qu'il n'ait pas été observé de perturbation de l'équilibre acido-basique avec le dorzolamide, des lithiases urinaires ont été rapportées rarement. Parce que le dorzolamide est un inhibiteur de l'anhydrase carbonique qui, même administré localement, passe dans la circulation générale, les patients ayant des antécédents de calculs rénaux peuvent avoir un risque plus élevé de lithiase urinaire lorsqu'ils sont traités par le dorzolamide.
Si des réactions allergiques (par exemple conjonctives et réactions palpébrales) sont observées, l'arrêt du traitement doit être envisagé.
Il existe une possibilité d'addition des effets systémiques connus dus à l'inhibition de l'anhydrase carbonique chez les patients recevant simultanément un inhibiteur de l'anhydrase carbonique par voie orale et du dorzolamide. L'administration simultanée de dorzolamide et d'un inhibiteur de l'anhydrase carbonique par voie orale n'est pas recommandée.
Des œdèmes cornéens et des décompensations irréversibles de la cornée ont été rapportés chez des patients ayant des anomalies chroniques de la cornée préexistantes et/ou des antécédents de chirurgie intraoculaire, alors qu'ils étaient traités par DORZOLAMIDE EG 20 mg/ml, collyre en solution. Le dorzolamide par voie locale doit être utilisé avec prudence chez de tels patients.
Des décollements de la choroïde concomitants d'hypotonie oculaire ont été rapportés après chirurgie filtrante lors de l'administration de traitements diminuant la sécrétion de l'humeur aqueuse.
Population pédiatrique
Le dorzolamide n'a pas été étudié chez les nourrissons nés avant la 36ème semaine de gestation et âgés de moins d'une semaine. En raison du risque d'acidose métabolique, le rapport bénéfice risque doit être soigneusement étudié avant administration du dorzolamide chez les patients présentant une immaturité tubulaire rénale significative.
Excipients :
DORZOLAMIDE EG 20 mg/ml, collyre en solution, contient du chlorure de benzalkonium comme conservateur. Les lentilles de contact doivent être retirées avant instillation et il est nécessaire d’attendre au moins 15 minutes avant de les remettre. Le chlorure de benzalkonium est connu pour changer la couleur des lentilles de contact souples.
Le chlorure de benzalkonium peut provoquer une irritation des yeux, entrainer une sécheresse occulaire ou de troubles de la cornée (couche transparente à l’avant de l’oeil).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude spécifique d'interactions médicamenteuses n'a été faite avec le dorzolamide.
Dans les études cliniques, le dorzolamide a été utilisé simultanément, sans effets indésirables patents, avec les médicaments suivants: solution ophtalmique de timolol, solution ophtalmique de bétaxolol et médicaments systémiques comprenant des inhibiteurs de l'enzyme de conversion, des inhibiteurs calciques, des diurétiques, des anti-inflammatoires non stéroïdiens dont l'aspirine et des hormones (par exemple œstrogènes, insuline, thyroxine).
L'association du dorzolamide avec des myotiques et des agonistes adrénergiques n'a pas été pleinement évaluée dans le traitement du glaucome.
4.6. Fertilité, grossesse et allaitement
Grossesse
Le dorzolamide ne doit pas être utilisé pendant la grossesse.
Il n'existe pas de données suffisamment pertinentes sur l'utilisation de ce médicament chez la femme enceinte. Chez des lapins, le dorzolamide administré à des doses materno-toxiques a produit des effets tératogènes (voir rubrique 5.3)
On ne sait pas si le dorzolamide est excrété dans le lait maternel. Les données pharmacodynamiques/toxicologiques chez l’animal ont montré l’excrétion de dorzolamide/métabolites dans le lait. Une décision doit être faite quant à l’arrêt de l’allaitement ou l’arrêt/l’abstention du traitement de dorzolamide prenant en compte ls bénéfice de l’allaitement pour l’enfant et le bénéfice de la thérapie chez la femme. Un risque pour le nouveau-né / l’enfant ne peut être exclu.
Fertilité
Les données chez l’animal ne suggèrent pas d’effet du traitement par dorzolamide sur la fertilité male ou femelle. Aucune donnée n’est disponible chez l’humain.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Dorzolamide a été évalué dans des études cliniques contrôlées et non contrôlées chez plus de 1400 sujets. Dans des études au long cours portant sur 1108 patients traités par DORZOLAMIDE EG 20 mg/ml, collyre en solution, en monothérapie ou en traitement d'appoint avec un bêta-bloquant à usage ophtalmique, la cause la plus fréquente d'arrêts de traitement avec le dorzolamide a été des effets indésirables oculaires imputés au médicament (environ 3 % des patients), essentiellement des conjonctivites et réactions palpébrales avec dorzolamide.
Les effets indésirables suivants ont été rapportés soit au cours des études cliniques, soit depuis la mise sur le marché.
La fréquence des effets indésirables énumérés ci-dessous est définie selon la convention suivante:
Très fréquent: (≥1/10) (≥1/10);
Fréquent: (≥1/100 to <1/10);
Peu fréquent: (≥1/1 000 to <1/100);
Rare: (≥1/10 000 to <1/1 000).
Très rare (<1/10 000)
Non connu (ne peut être estimé à partir des données disponibles).
Troubles du système nerveux:
Fréquent: céphalées
Rare: étourdissements, paresthésies
Troubles oculaires :
Très fréquent: brûlures et picotements des yeux
Fréquent: kératite ponctuée superficielle, augmentation des larmes, conjonctivite, blépharite, prurit oculaire, irritation palpébrale, vision trouble.
Peu fréquent: iridocyclite
Rare: irritation de l’œil incluant hyperémie oculaire, douleur, lésions croûteuses palpébrales, myopie transitoire (qui a disparu à l'arrêt du traitement), œdème cornéen, hypotonie de l’œil, décollement choroïdien à la suite d’un chirurgie de filtration.
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) : sensation de corps étranger dans l’œil.
Troubles cardiaques
Fréquence indéterminée : palpitations, tachycardie
Affections vasculaires
Fréquence indéterminée : hypertension
Troubles respiratoires, thoraciques et médiastinaux:
Rare: épistaxis
Fréquence indéterminée : dyspnée
Troubles gastro-intestinaux:
Fréquent: nausées, goût amer
Rare: irritation de la gorge, sécheresse de la bouche
Troubles cutanés et des tissus sous-cutanés:
Rare: dermatite de contact, syndrome de Stevens-Johnson, nécrolyse épidermique toxiqueTroubles rénaux et urinaires:
Rare: lithiase urinaire
Troubles généraux et accidents liés au site d'administration
Fréquent: asthénie/fatigue
Rare: Hypersensibilité: signes et symptômes de réactions locales (réactions palpébrales) et réactions allergiques systémiques incluant angio-œdème, urticaire et prurit, rash, difficultés à respirer, rarement bronchospasme.
Examens biologiques:
Aucun trouble hydroélectrolytique, cliniquement significatif, n'a été associé au dorzolamide.
Chez l'enfant: voir rubrique 5.1.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
Il n'existe qu'un nombre limité de données disponibles chez l'homme concernant un surdosage par ingestion accidentelle ou volontaire du chlorhydrate de dorzolamide.
Symptômes :
Les effets suivants ont été rapportés à la suite d'une ingestion orale: somnolence; en application locale: nausées, étourdissements, céphalées, fatigue, rêves anormaux et dysphagie.
Traitement :
Le traitement devra être symptomatique de soutien des fonctions vitales. Un déséquilibre hydroélectrolytique, le développement d'une acidose et d'éventuels effets sur le système nerveux central peuvent survenir. Les taux d'électrolytes sériques (en particulier le potassium) et le pH sanguin doivent être surveillés.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : inhibiteurs de l'anhydrase carbonique, code ATC : S01EC03.
Mécanisme d’action
L'anhydrase carbonique (AC) est une enzyme retrouvée dans de nombreux tissus de l'organisme y compris dans l'œil. Chez l'homme, l'anhydrase carbonique existe sous forme de nombreuses isoenzymes, la plus active étant l'anhydrase carbonique II (AC II), présente principalement dans les globules rouges (GR) mais également dans d'autres tissus.
L'inhibition de l'anhydrase carbonique dans les procès ciliaires de l'œil diminue la sécrétion d'humeur aqueuse. Le résultat est une diminution de la pression intraoculaire (PIO).
DORZOLAMIDE EG 20 mg/ml, collyre en solution contient du chlorhydrate de dorzolamide, un puissant inhibiteur de l'anhydrase carbonique II chez l'homme. Après administration locale au niveau oculaire, le dorzolamide diminue la pression intraoculaire élevée, qu'elle soit associée ou non à un glaucome. Une pression intraoculaire élevée est un facteur de risque majeur dans la pathogénie des altérations de la tête du nerf optique et de la perte du champ visuel. Le dorzolamide ne provoque pas de constriction pupillaire et réduit la pression intraoculaire sans effets secondaires tels que la cécité nocturne et les spasmes d'accommodation. Le dorzolamide a peu ou pas d'effet sur la fréquence cardiaque et la pression artérielle.
Utilisés par voie locale, les bêta-bloquants diminuent également la PIO en réduisant la sécrétion d'humeur aqueuse par un mécanisme d'action différent. Les études ont montré que, lorsque le dorzolamide est ajouté à un bêta-bloquant à usage ophtalmique, une réduction supplémentaire de la PIO est observée; cette constatation est cohérente avec les effets additifs connus des bêta-bloquants et des inhibiteurs de l'anhydrase carbonique administrés par voie orale.
Efficacité et sécurité clinique
Chez les patients ayant un glaucome ou une hypertension oculaire, l'efficacité du dorzolamide administré trois fois par jour en monothérapie (PIO initiale ≥ 23 mmHg) ou deux fois par jour en en traitement d'appoint en association avec des bêta-bloquants à usage ophtalmique (PIO initiale ≥ 22 mmHg) a été démontrée dans des études cliniques à grande échelle jusqu'à un an. L'effet de diminution de la PIO par le dorzolamide en monothérapie ou en association a été démontré sur l'ensemble de la journée et cet effet persiste pendant l'administration au long cours. L'efficacité en monothérapie au long cours a été similaire à celle du bétaxolol et légèrement inférieure à celle du timolol. En association avec les bêta-bloquants à usage ophtalmique, le dorzolamide a entraîné une diminution supplémentaire de la PIO similaire à celle observée avec la pilocarpine 2 % quatre fois par jour.
Population pédiatrique
Une étude clinique, d'une durée de 3 mois, multicentrique, en double aveugle, contrôlée versus traitement actif, a été menée chez 184 enfants (dont 122 sous dorzolamide) âgés d'1 semaine à moins de 6 ans, atteints d'un glaucome ou souffrant d'une pression intra-oculaire élevée (PIO initiale ≥ 22 mmHg) pour évaluer la sécurité d'emploi de DORZOLAMIDE EG 20 mg/ml, collyre en solution administré localement 3 fois par jour. Dans les deux groupes, environ la moitié des patients avaient un diagnostic de glaucome congénital; les autres étiologies les plus fréquentes étaient le syndrome de Sturge Weber, une dysgénésie irido-cornéale mésenchymateuse ou l'aphaquie. La distribution par âge et par traitement lors de la phase de monothérapie était la suivante:
|
|
Dorzolamide 2 %
|
Timolol
|
|
Cohorte d'âge < 2 ans |
N=56 Tranche d'âge: 1 à 23 mois |
Timolol GS 0.25 % N=27 Tranche d'âge: 0,25 à 22 mois |
|
Cohorte d'âge ≥ 2 - < 6 ans |
N=66 Tranche d'âge: 2 à 6 ans |
Timolol 0.50 % N=35 Tranche d'âge: 2 à 6 ans |
Pour les deux cohortes d'âge, environ 70 patients ont reçu le traitement pendant au moins 61 jours et environ 50 patients ont reçu entre 81 et 100 jours de traitement.
Si la PIO n'était pas contrôlée de façon appropriée par le dorzolamide ou Timolol en gel ophtalmique en monothérapie, une modification du traitement avec levée de l'aveugle était effectuée de la façon suivante: 30 patients de < 2 ans sont passés à une bithérapie avec Timolol en gel ophtalmique 0,25 % une fois par jour et dorzolamide 2 % trois fois par jour, 30 patients de > 2 ans sont passés à une association fixe de dorzolamide 2 %/Timolol 0,5 % deux fois par jour.
Au total, cette étude n'a pas mis en exergue de problème supplémentaire de sécurité d'emploi chez l'enfant: environ 26 % des patients (20 % chez les patients sous dorzolamide en monothérapie) ont eu des effets secondaires liés au traitement dont la majorité étaient observés au niveau de l'œil et non graves comme une sensation brûlante et cuisante, une douleur et une sensation de piqûre. Un faible pourcentage (< 4 %) a eu un œdème de la cornée ou une vue brouillée. Les réactions locales semblent aussi fréquentes avec le produit de comparaison. Depuis la mise sur le marché, des cas d'acidose métabolique ont été rapportés chez les patients très jeunes particulièrement chez ceux atteints d'immaturité ou d'insuffisance rénale.
Les données d'efficacité en pédiatrie suggèrent que la baisse moyenne de la PIO observée dans le groupe dorzolamide était comparable à la baisse moyenne de la PIO observée dans le groupe Timolol bien qu'une baisse numérique légèrement plus importante ait été observée dans le groupe Timolol.
Aucune étude d'efficacité au long cours (plus de 12 semaines) n'est disponible.
5.2. Propriétés pharmacocinétiques
Contrairement aux inhibiteurs de l'anhydrase carbonique par voie orale, l'administration locale du chlorhydrate de dorzolamide permet une action directe de la substance active sur l'œil à des doses nettement plus basses et donc avec une exposition systémique plus faible. Dans les essais cliniques, la conséquence a été une réduction de la PIO sans les perturbations de l'équilibre acido-basique ni les troubles hydroélectrolytiques caractéristiques des inhibiteurs de l'anhydrase carbonique administrés par voie orale.
Par voie locale, le dorzolamide passe dans la circulation générale. Pour évaluer la possibilité d'une inhibition de l'anhydrase carbonique systémique après administration locale, on a mesuré les concentrations de la substance active et de ses métabolites dans les globules rouges et le plasma ainsi que l'inhibition de l'anhydrase carbonique. Lors d'une administration chronique, le dorzolamide s'accumule dans les globules rouges par suite d'une liaison sélective à l'AC-II alors que des concentrations très faibles de la substance active sous forme libre sont maintenues dans le plasma. La substance active initiale est transformée en métabolite N-desethyl qui inhibe l'AC-II de façon moins puissante mais inhibe aussi une isoenzyme moins active (l'AC-I). Ce métabolite s'accumule également dans les globules rouges où il se lie surtout avec l'AC-I. Le dorzolamide se fixe assez peu aux protéines plasmatiques (environ 33 %). Le dorzolamide est surtout excrété sous forme inchangée dans les urines; son métabolite est aussi éliminé dans les urines. Une fois le traitement arrêté, le dorzolamide se libère des globules rouges de façon non linéaire, ce qui entraîne une diminution rapide de la concentration initiale de la substance active suivie d'une phase d'élimination plus lente avec une demi-vie d'environ quatre mois.
Lorsque le dorzolamide a été administré par voie orale pour simuler une exposition systémique maximale consécutive à une administration oculaire au long cours, un état d'équilibre a été atteint en 13 semaines. A l'état d'équilibre, il n'y avait pratiquement pas de substance active sous forme libre ni de métabolite dans le plasma; l'inhibition de l'AC dans les globules rouges a été inférieure à celle prévue pour être nécessaire à l'obtention d'un effet pharmacologique sur la fonction rénale ou la respiration. Des résultats pharmacocinétiques semblables ont été observés après administration locale prolongée du dorzolamide.
Néanmoins, quelques patients âgés présentant une insuffisance rénale (clairance de la créatinine estimée à 30-60 ml/min.) avaient des concentrations du métabolite plus élevées dans les globules rouges, mais aucune différence significative sur l'inhibition de l'anhydrase carbonique et aucun effet secondaire systémique cliniquement significatif n'ont été imputés directement à ces données.
5.3. Données de sécurité préclinique
Dans les études cliniques, les patients n'ont présenté aucun signe d'acidose métabolique ou de troubles hydroélectrolytiques sériques qui sont les témoins de l'inhibition systémique de l'AC. Par conséquent, les effets observés dans les études animales ne sont pas attendus chez les patients recevant des doses thérapeutiques de dorzolamide
2 ans.
Après première ouverture du flacon: 28 jours maximum.
6.4. Précautions particulières de conservation
Conserver le flacon dans l'emballage extérieur, à l'abri de la lumière.
A conserver à une température ne dépassant pas 30°C.
6.5. Nature et contenu de l'emballage extérieur
Flacon blanc opaque en polyéthylène moyenne densité muni d'un embout compte-gouttes scellé et un système de capuchon à vis en 2 parties. Chaque flacon contient 5 ml de solution.
Boîte de 1, 3 ou 6 flacons.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières. Voir section 4.2.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
EG LABO - LABORATOIRES EUROGENERICS
CENTRAL PARK
9-15 RUE MAURICE MALLET
92130 ISSY LES MOULINEAUX
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 498 775 3 9: Boîte de 1 flacon de 5 ml (Polyéthylène).
· 34009 498 777 6 8: Boîte de 3 flacons de 5 ml (Polyéthylène).
· 34009 498 778 2 9: Boîte de 6 flacons de 5 ml (Polyéthylène).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 13/04/2023
DORZOLAMIDE EG 20 mg/ml, collyre en solution
Dorzolamide
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que DORZOLAMIDE EG et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d’utiliser DORZOLAMIDE EG ?
3. Comment utiliser DORZOLAMIDE EG ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver DORZOLAMIDE EG ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE DORZOLAMIDE EG 20 mg/ml, collyre en solution ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC : S01EC03
DORZOLAMIDE EG 20 mg/ml, collyre en solution est une solution stérile sous forme de gouttes ophtalmiques. DORZOLAMIDE EG 20 mg/ml, collyre en solution contient comme une substance active de la famille des sulfamides, le dorzolamide.
DORZOLAMIDE EG 20 mg/ml, collyre en solution est un inhibiteur ophtalmique de l'anhydrase carbonique qui fait baisser la pression oculaire élevée.
Il est indiqué pour faire baisser la pression oculaire chez les patients atteints d'hypertension oculaire ou de glaucomes (glaucome à ouverture d'angle, glaucome pseudo-exfoliatif).
DORZOLAMIDE EG 20 mg/ml, collyre en solution peut être utilise seul ou en association avec d'autres médicaments qui font baisser la pression de l'œil (appelés béta-bloquants).
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT d’utiliser DORZOLAMIDE EG 20 mg/ml, collyre en solution ?
N’utilisez jamais DORZOLAMIDE EG :
· Si vous êtes allergique (hypersensible) à la dorzolamide ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· Si vous avez des problèmes rénaux sévères.
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien ou votre infirmier/ère avant d’utiliser DORZOLAMIDE EG.
Faites attention avec DORZOLAMIDE EG 20 mg/ml, collyre en solution:
Avant de débuter le traitement par DORZOLAMIDE EG 20 mg/ml, collyre en solution, prévenez votre médecin
· si vous avez une maladie du foie ou des antécédents de maladie du foie
· s'il vous a été indiqué que vous étiez atteint d'une anomalie de la cornée
· si vous avez déjà eu des allergies à des médicaments
· si vous avez subi ou êtes sur le point de subir une intervention chirurgicale
· en cas de blessure oculaire antérieure ou en cas d'infection oculaire
· en cas d'antécédents de calculs biliaires
· si vous prenez un autre inhibiteur de l'anhydrase carbonique par voie orale
· si vous portez des lentilles de contact (voir la rubrique « Informations importantes concernant certains composants de DORZOLAMIDE EG 20 mg/ml, collyre en solution).
Consultez immédiatement votre médecin en cas d'irritation oculaire ou d'apparition de tout autre symptôme oculaire tel que rougeur de l'œil ou gonflement de la surface oculaire ou des paupières
Si vous pensez que DORZOLAMIDE EG 20 mg/ml, collyre en solution provoque chez vous une réaction allergique (par exemple éruption cutanée, démangeaisons, inflammation oculaire), arrêtez de l'utiliser et contactez immédiatement votre médecin.
Utilisation chez l'enfant
DORZOLAMIDE EG 20 mg/ml, collyre en solution a été étudié chez le nourrisson et l'enfant de moins de 6 ans chez lesquels une hypertension oculaire ou un glaucome avait été diagnostiqué. Pour plus d'information, prenez contact avec votre médecin.
Autres médicaments et DORZOLAMIDE EG
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament. Veuillez indiquer en particulier à votre médecin si vous prenez d'autres inhibiteurs de l'anhydrase carbonique comme l'acétazolamide, que vous les preniez par voie orale (par la bouche) en gouttes oculaires (collyre) ou par toute autre voie.
DORZOLAMIDE EG avec des aliments et boissons
Sans objet.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament. Si vous êtes enceinte ou si vous prévoyez d'être enceinte, parlez-en à votre médecin. Vous ne devez pas utiliser DORZOLAMIDE EG 20 mg/ml, collyre en solution pendant la grossesse sauf si votre médecin vous l'a quand même conseillé.
Vous ne devez pas utiliser DORZOLAMIDE EG 20 mg/ml, collyre en solution pendant l'allaitement.
Conduite de véhicules et utilisation de machines
DORZOLAMIDE EG 20 mg/ml, collyre en solution peut entraîner des vertiges et des troubles de la vue chez certains patients. Ne conduisez pas et n'utilisez pas de machines tant que vous ne vous sentez pas bien et que vos symptômes n'ont pas disparu.
DORZOLAMIDE EG contient un conservateur appelé chlorure de benzalkonium
Ce médicament contient 0,075 mg de chlorure de benzalkonium pour chaque mL de solution oculaire.
Le chlorure de benzalkonium peut être absorbé. Le chlorure de benzalkonium peut être absorbé par les lentilles de contact souples et changer leur couleur. Retirer les lentilles de contact avant application et attendre au moins 15 minutes avant de les remettre. Le chlorure de benzalkonium peut également provoquer une irritation des yeux, surtout si vous souffrez du syndrome de l’œil sec ou de troubles de la cornée (couche transparente à l’avant de l’oeil). En cas de sensation anormale, de picotements ou de douleur dans les yeux après avoir utilisé ce médicament, contactez votre médecin.
3. COMMENT UTILISER DORZOLAMIDE EG 20 mg/ml, collyre en solution ?
La dose et la durée de traitement appropriées seront établies par votre médecin.
Lorsque DORZOLAMIDE EG 20 mg/ml, collyre en solution est utilisé seul, la dose habituelle est d'une goutte dans l'œil (les yeux) atteint(s) trois fois par jour, par exemple le matin, l'après-midi et le soir.
Si votre médecin vous a recommandé d'utiliser DORZOLAMIDE EG 20 mg/ml, collyre en solution avec un béta-bloquant en collyre (médicaments qui diminuent la pression oculaire), la dose habituelle est d'une goutte de DORZOLAMIDE EG 20 mg/ml, collyre en solution dans l'œil (les yeux) atteint(s) deux fois par jour, par exemple le matin et le soir.
Si vous utilisez DORZOLAMIDE EG 20 mg/ml, collyre en solution, avec un autre collyre, attendez au moins 10 minutes entre l'instillation de DORZOLAMIDE EG 20 mg/ml, collyre en solution et celle de l'autre médicament. Autrement, si vous devez utiliser DORZOLAMIDE EG 20 mg/ml, collyre en solution en remplacement d'un autre médicament sous forme de collyre en vue de réduire la pression intraoculaire, vous devez arrêter l'utilisation de l'autre médicament après la prise du jour et commencer l'application de DORZOLAMIDE EG 20 mg/ml, collyre en solution, le lendemain.
Ne modifiez pas de votre propre initiative la posologie prescrite sans avoir consulté votre médecin. Si vous devez impérativement arrêter votre traitement, consultez immédiatement votre médecin.
Eviter tout contact de l'extrémité du flacon avec l'œil ou les parties avoisinantes. Il pourrait en effet se contaminer par des bactéries qui peuvent entraîner des infections de l'œil conduisant à des lésions graves de l'œil, voire la perte de la vision. Pour éviter toute contamination possible du flacon, tenez l'extrémité du flacon à l'écart de tout contact.
Comment utiliser correctement ce médicament:
Il est recommandé de se laver les mains avant de mettre votre collyre.
Il peut être plus simple d'appliquer votre collyre devant un miroir.
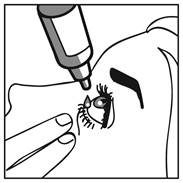
1. Avant d'utiliser le médicament pour la première fois, assurez-vous que la bague d'inviolabilité située sur le col du flacon n'est pas rompue. Un espace entre le flacon et le bouchon est normal lorsque le flacon n'est pas ouvert.
2. Retirez le capuchon du flacon.
3. Inclinez la tête vers l'arrière et tirez légèrement la paupière inférieure vers le bas pour pouvoir instiller les gouttes entre la paupière et l'œil.
4. Renversez le flacon et pressez jusqu'à ce qu'une seule goutte tombe dans l'œil comme indiqué par votre médecin. NE TOUCHEZ PAS L'ŒIL OU LA PAUPIERE AVEC L'EXTREMITE DU FLACON.
5. Répétez les étapes 2 et 3 pour l'autre œil si votre médecin vous l'a prescrit.
6. Remettez le capuchon en place et fermez le flacon aussitôt après usage.
Fermez votre œil et appuyez sur le coin intérieur de l’œil avec votre doigt pendant environ deux minutes. Cela aide à stopper la propagation du médicament dans le reste du corps.
Si vous avez utilisé plus de DORZOLAMIDE EG que vous n’auriez dû :
Si vous instillez trop de gouttes ou si une partie ou tout le contenu du flacon est avalé, consultez immédiatement votre médecin.
Si vous oubliez d’utiliser DORZOLAMIDE EG :
Si vous avez oublié une instillation, instillez-la le plus tôt possible après l'oubli. Cependant, s'il est presque l'heure de l'instillation suivante, sautez l'instillation oubliée et reprenez votre médicament normalement à l'heure habituelle suivante.
N'instillez-pas une dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez d’utiliser DORZOLAMIDE EG :
Si vous arrêtez d'utiliser DORZOLAMIDE EG 20 mg/ml, collyre en solution:
DORZOLAMIDE EG 20 mg/ml, collyre en solution doit être utilisé chaque jour pour agir correctement. Si vous devez arrêter le traitement, contactez immédiatement votre médecin.
Si vous avez d'autres questions à propos de l'utilisation de ce médicament, consultez votre médecin ou votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Arrêtez de prendre ce médicament et consultez immédiatement un médecin si vous développez une réaction allergique. Les symptômes de réactions allergiques incluent :
· gonflement du visage, des lèvres, de la langue et / ou de la gorge qui peut causer des difficultés à respirer ou avaler.
· Urticaire, démangeaisons, éruption cutanée
· Réactions sévères de la peau telles que l’apparition de cloques sur la bouche, les yeux et les organes génitaux.
· Inflammation de l’œil et réaction locale de l’œil affectant la paupière (réaction palpébrale)
· Dyspnée et plus rarement sifflement (bronchospasme)
La probabilité de développer un effet indésirable donné est décrite en utilisant les catégories suivantes :
Les effets indésirables suivants peuvent être observés avec DORZOLAMIDE EG 20 mg/ml, collyre en solution.
Très fréquent (affecte plus de 1 patient sur 10)
· brûlures et picotements
Fréquent (affecte 1 à 10 patients sur 100)
· troubles de la cornée avec douleur oculaire et vision trouble (kératite ponctuée superficielle),
· inflammation ou gonflement de la surface oculaire et inflammation possible de la/des paupière(s) et/ou de la peau entourant l'œil,
· œil larmoyant ou démangeaison de(s) œil (des yeux),
· vision trouble,
· effets sur la surface de l'œil (des yeux).
· nausée
· gout amer
· fatigue
· mal de tête
Peu fréquent (affecte 1 à 10 patients sur 1 000 patients)
· inflammation de l'enveloppe moyenne de l'œil (choroïde)
Rare:(peut affecter 1 à 10 patients sur 10 000)
· gonflement de la membrane superficielle de l'œil (des yeux), décollement de la choroïde pouvant s'accompagner de modifications/troubles de la vue, pression oculaire basse, rougeur de l'œil (des yeux), douleur oculaire, lésions croûteuses palpébrales (de la paupière/des paupières), myopie transitoire (qui cesse à l'arrêt du traitement).
· Irritation de la gorge, bouche sèche
· étourdissement, sensation d’engourdissement ou de picotement
· formation de calculs urinaires
· saignements du nez
· réactions cutanées sévères, inflammation de la peau, éruption cutanée localisée (dermatite de contact)
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
· essoufflement
· sensation de corps étranger dans l’œil (sensation d’avoir quelque chose dans l’œil)
· battements du cœur puissants pouvant être rapides ou irréguliers (palpitations)
· augmentation de la fréquence cardiaque
· augmentation de la pression artérielle
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER DORZOLAMIDE EG 20 mg/ml, collyre en solution ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur le flacon après EXP. La date de péremption fait référence au dernier jour de ce mois.
Conserver le flacon dans l'emballage extérieur, à l'abri de la lumière. A conserver à une température ne dépassant pas 30°C.
DORZOLAMIDE EG 20 mg/ml, collyre en solution doit être utilisé dans les 28 jours suivant la première ouverture du flacon. Vous devez donc jeter le flacon 4 semaines après sa première ouverture, même s'il reste de la solution. Pour vous en souvenir, inscrivez la date à laquelle vous l'avez ouvert à l'emplacement réservé à cet effet sur l'étui.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient DORZOLAMIDE EG 20 mg/ml, collyre en solution
· La substance active est :
Dorzolamide.................................................................................................................... 20 mg
(Sous forme de chlorhydrate de dorzolamide)
Pour un mL de collyre en solution
· Les autres composants sont :
Mannitol.......................................................................................................................... 125,00 mg
Citrate de sodium.............................................................................................................. 14,70 mg
Hydroxyethylcellulose........................................................................................................ 20,94 mg
Hydroxyde de sodium.................................................................................................. qs pH = 5,65
Chlorure de benzalkonium................................................................................................... 0,375mg
Eau pour préparations injectables....................................................................................... qsp 5 mL
Pour un flacon de 5 mL.
Qu’est-ce que DORZOLAMIDE EG 20 mg/ml, collyre en solution et contenu de l’emballage extérieur
DORZOLAMIDE EG 20 mg/ml, collyre en solution est une solution stérile, transparente, incolore, isotonique, tamponnée, légèrement visqueuse, présentée dans un flacon en polyéthylène blanc moyenne densité opaque muni d'un embout compte-gouttes scellé et d'un capuchon formé de deux parties. Chaque flacon contient 5 ml de collyre en solution.
DORZOLAMIDE EG 20 mg/ml, collyre en solution est disponible en boîte de 1, 3 ou 6 flacons.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
EG LABO - LABORATOIRES EUROGENERICS
CENTRAL PARK
9-15 RUE MAURICE MALLET
92130 ISSY LES MOULINEAUX
Exploitant de l’autorisation de mise sur le marché
EG LABO - LABORATOIRES EUROGENERICS
CENTRAL PARK
9-15 RUE MAURICE MALLET
92130 ISSY LES MOULINEAUX
6 DERVANEKION STR.
15351 PALLINI ATTIKI
GRECE
ou
FAMAR SA, PLANT A
63 AGIOU DIMITRIOU STREET
174 56 ALIMOS
GRECE
ou
STADA ARZNEIMITTEL AG
STADASTRASSE 2-18
61118 BAD VILBEL
ALLEMAGNE
ou
CENTRAFARM SERVICES B.V
VAN DE REIJTSTRAAT 31-E
4814 NE BREDA
PAYS BAS
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Sans objet.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).