Dernière mise à jour le 01/12/2025
OROBUPRE 8 mg, lyophilisat oral
Indications thérapeutiques
OROBUPRE lyophilisat oral est un comprimé lyophilisé qui se dissout rapidement sur la langue.
OROBUPRE est utilisé chez les adultes et les adolescents de plus de 15 ans, dans le cadre d'un programme de suivi médical, social et psychologique pour traiter la dépendance aux opioïdes.
OROBUPRE contient de la buprénorphine, un analgésique opioïde (stupéfiant). Lorsqu'il est utilisé pour le traitement de patients dépendants aux opioïdes (stupéfiants), comme la morphine ou l'héroïne, il agit en tant que traitement de substitution et, par conséquent, aide le patient à traiter sa dépendance sur une période de temps donnée.
Si le traitement est arrêté soudainement, des symptômes de sevrage peuvent apparaître.
Présentations
> 7 plaquette(s) PVC OPA : polyamide orienté aluminium polytéréphtalate (PET) papier de 1 lyophilisat(s)
Code CIP : 34009 301 238 7 4
Déclaration de commercialisation : 08/11/2018
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 9,38 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 10,40 €
- Taux de remboursement :30%
Documents de bon usage du médicament
- Prévenir le risque de surdose d’opioïdes
Auteur : Haute autorité de santé
Type : Fiche Bon Usage du Médicament
Date de mise à jour :Avril 2023
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
Autres informations
- Titulaire de l'autorisation : ETHYPHARM
- Conditions de prescription et de délivrance :
- délivrance fractionnée de 7 jours
- liste I
- prescription en toutes lettres sur ordonnance sécurisée
- prescription limitée à 4 semaines
- Statut de l'autorisation : Valide
- Type de procédure : Procédure décentralisée
- Code CIS : 6 978 223 3
ANSM - Mis à jour le : 06/03/2025
OROBUPRE 8 mg, lyophilisat oral
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Sous forme de chlorhydrate de buprénorphine
Pour un lyophilisat oral
Excipient à effet notoire : chaque lyophilisat oral contient 2,0 mg d’aspartam
Pour la liste complète des excipients, voir rubrique 6.1.
Lyophilisat oral blanc à blanc cassé, rond, de 16,2 mm de diamètre, gravé « M8 » sur une face.
4.1. Indications thérapeutiques
Le traitement par OROBUPRE lyophilisat oral est réservé aux adultes et adolescents âgés de 15 ans ou plus, ayant accepté d’être traités pour leur dépendance aux opioïdes.
4.2. Posologie et mode d'administration
Le traitement doit se faire sous le contrôle d’un médecin spécialisé dans la prise en charge de la dépendance/addiction aux opioïdes.
OROBUPRE s’administre sur la langue et non par voie sublinguale (sous la langue)
OROBUPRE n’est pas interchangeable avec d’autres médicaments contenant de la buprénorphine. Ces différents médicaments ont une biodisponibilité différente. Par conséquent, la dose en mg peut varier entre les produits. Une fois que la dose appropriée a été identifiée pour un patient donné avec un médicament donnée, celui-ci ne peut pas être échangé avec une autre forme de buprénorphine.
Adultes et adolescents âgés de 15 ans ou plus
Précautions à prendre avant l’induction du traitement
Avant l’instauration du traitement, le médecin doit tenir compte du type de dépendance aux opioïdes (c'est-à-dire : opioïdes à durée d’action longue ou courte), l’intervalle de temps écoulé depuis la dernière prise d’opioïdes et le niveau de dépendance aux opioïdes. Afin d’éviter de précipiter l’apparition d’un syndrome de sevrage, l’instauration du traitement doit être effectuée dès l’apparition des signes objectifs et évidents de sevrage (démontré par exemple par un score indiquant un sevrage léger à modéré sur l’échelle clinique validée des symptômes de sevrage des opioïdes (COWS)).
Chez les patients dépendants aux opioïdes qui n’ont pas subi de sevrage, la première dose d’OROBUPRE doit être prise lors de l’apparition des signes de sevrage, mais pas moins de 6 heures après la dernière prise d'opioïdes (par exemple, l'héroïne, opioïdes à durée d’action courte).
Chez les patients recevant de la méthadone, la dose de méthadone doit être diminuée à une posologie maximum de 30 mg/jour avant de commencer le traitement par OROBUPRE. La longue demi-vie de la méthadone doit être prise en compte lors de l’instauration du traitement par buprénorphine. La première dose d’OROBUPRE ne doit être prise que lorsque des signes de sevrage apparaissent, mais pas moins de 24 heures après la dernière prise de méthadone. La buprénorphine peut précipiter les symptômes de sevrage chez les patients dépendants à la méthadone.
En raison du profil agoniste partiel de la buprénorphine, le patient doit être averti que pendant les 24 premières heures de traitement de substitution par la buprénorphine, il peut se sentir mal à l'aise avec des symptômes de sevrage légers aux opiacés.
Objectifs et arrêt du traitement
Avant de commencer le traitement par OROBUPRE, une stratégie de traitement comprenant la durée du traitement et les objectifs du traitement doit être convenue avec le patient. Pendant le traitement, des contacts fréquents doivent être établis entre le médecin et le patient pour évaluer la nécessité de poursuivre le traitement, envisager son arrêt et ajuster les posologies si nécessaire. Lorsqu’un patient n’a plus besoin d’un traitement par OROBUPRE, il peut être conseillé de réduire progressivement la dose pour prévenir les symptômes de sevrage (voir rubrique 4.4).
Mise en place du traitement (induction)
La dose initiale recommandée est 2 mg d’OROBUPRE (1 lyophilisat oral OROBUPRE 2 mg). 1 à 2 lyophilisats oraux de OROBUPRE 2 mg, supplémentaires peuvent être administrés le premier jour en fonction du besoin individuel du patient.
Pendant la phase d’instauration du traitement, il est recommandé de contrôler quotidiennement son administration afin de s’assurer que le lyophilisat est placé correctement sur la langue et d’observer la réponse du patient au traitement, ce qui permettra d’adapter efficacement la dose administrée en fonction de l’effet clinique obtenu.
Adaptation posologique et traitement d’entretien :
La posologie d'OROBUPRE doit alors être ajustée en fonction de l'effet clinique dans le but de stabiliser rapidement le patient. La posologie peut être ajustée vers le haut ou vers le bas en fonction de l'évaluation de l'état clinique et psychologique du patient par palier de 2 à 6 mg, jusqu'à ce que la dose d'entretien efficace minimale soit atteinte, mais sans dépasser la posologie maximale de 18 mg par jour.
Une délivrance quotidienne de buprénorphine est recommandée, notamment pendant la période d’instauration du traitement. Après stabilisation, des quantités de médicament d’OROBUPRE pour plusieurs jours de traitement pourront être remises au patient. Il est recommandé de limiter la quantité de médicament délivrée en une fois à 7 jours au maximum.
Administration non quotidienne :
Après obtention d’une stabilisation satisfaisante, la fréquence d’administration d'OROBUPRE peut être réduite à une administration tous les deux jours en doublant la dose quotidienne ajustée individuellement. Par exemple, un patient stabilisé recevant une dose quotidienne de 8 mg peut recevoir 16 mg un jour sur deux, sans traitement les jours intermédiaires. Chez certains patients, après une stabilisation satisfaisante, la posologie d'OROBUPRE peut être réduite à 3 fois par semaine (par exemple le lundi, le mercredi et le vendredi).
La dose du lundi et du mercredi doit être égale à deux fois la dose quotidienne du patient, et la dose du vendredi doit être égale à trois fois la dose quotidienne du patient, sans traitement les jours intermédiaires. Cependant, la dose ne doit pas dépasser 18 mg par jour. Cette posologie peut ne pas convenir aux patients nécessitant une dose quotidienne > 8 mg/jour.
Réduction de doses et arrêt progressif du traitement
Après l’obtention d’une stabilisation satisfaisante évaluée cliniquement et si le patient l’accepte, la posologie peut être réduite progressivement jusqu'à parvenir à une dose d'entretien plus faible. Dans certains cas favorables, le traitement peut être arrêté. La décision d’arrêter le traitement par OROBUPRE après une période d’entretien ou de stabilisation doit se faire dans le cadre d’une prise en charge globale. La mise à disposition d'OROBUPRE à des doses de 2 mg et 8 mg permet un ajustement de posologie vers le bas. Pour les patients qui ont besoin d’une dose plus faible de buprénorphine, Buprénorphine 1 mg ou 0,4 mg en comprimé sublingual peuvent être administrés. Durant la période d’arrêt du traitement, une attention particulière sera portée au patient en raison du risque de rechute.
Insuffisance hépatique
Un bilan hépatique et la recherche d’une hépatite virale sont recommandés avant d’instaurer le traitement. Les patients présentant une hépatite virale, sous traitement médical concomitant (voir rubrique 4.5) et/ou souffrant d’un dysfonctionnement hépatique ont un risque d’atteinte majorée du foie. Une surveillance régulière de la fonction hépatique est recommandée (voir rubrique 4.4).
L'effet de l'insuffisance hépatique sur la pharmacocinétique de la buprénorphine est inconnu. Comme la buprénorphine est fortement métabolisée par le foie, on s'attend à ce que les taux plasmatiques soient plus élevés chez les patients présentant une insuffisance hépatique modérée ou sévère.
Comme la pharmacocinétique d'OROBUPRE peut être modifiée chez les patients atteints d'insuffisance hépatique, il est recommandé d’instaurer le traitement avec une dose plus faible et d’adapter la posologie avec précaution chez les patients atteints d’une insuffisance hépatique légère à modérée (voir rubrique 5.2). La buprénorphine est contre-indiquée chez les patients présentant une insuffisance hépatique sévère (voir rubrique 4.3).
Insuffisance rénale
Une modification de la posologie d'OROBUPRE n'est généralement pas nécessaire chez les patients atteints d'insuffisance rénale. La prudence est recommandée chez les patients atteints d'insuffisance rénale sévère (clairance de la créatinine <30 mL/min) (voir rubriques 4.4 et 5.2).
Sujets âgés
La sécurité et l’efficacité de la buprénorphine chez les patients âgés de plus de 65 ans n’ont pas été établies. Aucune recommandation posologique ne peut être donnée.
Population pédiatrique
La sécurité et l’efficacité de la buprénorphine chez les enfants âgés de moins de 15 ans n’ont pas été établies. Aucune donnée n'est disponible.
Mode d’administration
Les médecins doivent avertir les patients que la voie d'administration par la muqueuse buccale est la seule voie efficace et sûre pour ce médicament (voir rubrique 4.4). Le lyophilisat oral doit être placé sur la langue jusqu'à dissolution complète. Les patients ne doivent pas avaler ni consommer de nourriture ou de boisson jusqu'à ce que le lyophilisat soit complètement dissous. Si le lyophilisat oral ou la salive contenant de la buprénorphine sont avalés, la buprénorphine sera métabolisée et excrétée et aura un effet minimal. Pour plus d'informations, voir les directives nationales pour le traitement par la buprénorphine.
L’administration se fait par la muqueuse buccale. Le lyophilisat oral doit être extrait de l’alvéole de la plaquette avec des doigts secs et déposé en entier sur la langue jusqu'à dissolution. La dissolution du lyophilisat se produit habituellement en 15 secondes, puis la buprénorphine est absorbée par la muqueuse buccale. La déglutition doit être évitée pendant 2 minutes. Le lyophilisat oral doit être pris immédiatement après avoir ouvert la plaquette. Les patients ne doivent pas consommer d’aliments ou boire durant les 5 minutes qui suivent l’administration.
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
· Insuffisance respiratoire sévère.
· Insuffisance hépatique sévère.
· Intoxication alcoolique aiguë ou delirium tremens.
· Utilisation pendant une crise d'asthme aiguë.
· Traumatisme crânien et augmentation de la pression intracrânienne.
· Allaitement maternel.
4.4. Mises en garde spéciales et précautions d'emploi
OROBUPRE lyophilisat oral est exclusivement réservé au traitement de la pharmacodépendance aux opioïdes. Il est recommandé que ce traitement soit prescrit par un médecin assurant une prise en charge thérapeutique globale de la dépendance aux opioïdes.
Le clinicien doit tenir compte du risque d'abus et de mésusage (par exemple l'administration par voie intraveineuse) en particulier au début du traitement.
Mésusage, abus et usage détourné
La buprénorphine peut être mal utilisée ou utilisée de manière abusive comme d'autres opioïdes, licites ou illicites. Parmi les risques de mésusage et d'abus figurent le surdosage, la propagation d'infections virales ou d'infections localisées et systémiques transmises par voir sanguine, la dépression respiratoire et l’atteinte hépatique. Le mésusage de la buprénorphine par une personne autre que le patient à qui le produit est destiné risque également de créer des nouveaux individus primodépendants à cette substance ; ce type d’utilisation peut aussi apparaître lorsque le médicament est distribué à des fins illicites directement par le patient ou lorsque le médicament est volé, n’étant pas conservé en lieu sûr.
Un traitement sous-optimal par la buprénorphine peut indiquer un mauvais usage du médicament par le patient, pouvant entraîner un surdosage ou l’abandon du traitement. Un patient sous-dosé en buprénorphine peut continuer à gérer ses symptômes de sevrage incontrôlés par la prise en automédication d’opioïdes, d’alcool ou d'autres hypnotiques sédatifs tels que les benzodiazépines.
Afin de réduire le risque de mésusage, d'abus et d’usage détourné, les médecins doivent prendre les mesures qui s’imposent lorsque ils prescrivent et administrent de la buprénorphine, par exemple éviter de donner des ordonnances pour de multiples renouvellements dès le début du traitement; d’autre part, ils doivent effectuer des visites de suivi du patient tout en mettant en place un contrôle clinique adapté aux besoins du patient.
Enlever un lyophilisat d’OROBUPRE de la bouche après administration surveillée est pratiquement impossible en raison de sa dissolution rapide sur la langue.
Troubles de tolérance et d’usage d’opioïdes (abus et dépendance)
La buprénorphine est un agoniste partiel agissant sur le récepteur opiacé µ (mu). Des études chez l’animal, ainsi que des données cliniques, ont démontré que la buprénorphine peut provoquer une dépendance, celle-ci étant toutefois moindre que celle provoquée par un agoniste complet tel que la morphine.
Une tolérance, une dépendance physique et psychologique et un trouble lié à l’usage des opioïdes peuvent se développer lors de l’administration répétée d’opioïdes tels que OROBUPRE. L’abus ou le mésusage de OROBUPRE peut entraîner un surdosage et/ou la mort. Le risque de développer un trouble lié à l’usage des opioïdes est accru chez les patients ayant des antécédents personnels ou familiaux (parents ou fratrie) de troubles liés à l’usage de substances (y compris les troubles liés à la consommation d’alcool), chez les fumeurs ou chez les patients ayant des antécédents personnels d’autres troubles de santé mentale (par ex. dépression majeure, anxiété et troubles de la personnalité).
Avant de commencer le traitement par OROBUPRE et pendant le traitement, les objectifs du traitement et un plan d’arrêt doivent être convenus avec le patient (voir rubrique 4.2).
Les patients devront être surveillés pour détecter tout signe de comportement de recherche de médicaments (par exemple, demandes de renouvellement trop précoces). Cela comprend la surveillance de la prise concomitante d’opioïdes et de médicaments psychoactifs (comme les benzodiazépines). Pour les patients présentant des signes et symptômes du trouble lié à l’usage des opioïdes, une consultation avec un spécialiste en addictologie doit être envisagée.
Précipitation du syndrome de sevrage aux opioïdes
Lors de l'instauration du traitement par la buprénorphine, le médecin doit prendre en compte le profil agoniste partiel de la buprénorphine et être conscient que le traitement peut précipiter l’apparition d’un syndrome de sevrage chez les patients dépendants aux opioïdes, particulièrement si le traitement est administré moins de 6 heures après la dernière utilisation d’héroïne ou d’un autre opioïde à courte durée d’action, ou s’il est administré moins de 24 heures après la dernière prise de méthadone. Afin d’éviter de précipiter l’apparition d’un syndrome de sevrage, l’induction du traitement par buprénorphine doit être effectuée dès l’apparition des signes objectifs de sevrage (voir rubrique 4.2). Les symptômes de sevrage peuvent aussi être associés à un sous-dosage.
Le risque d'effets indésirables graves tels que l'overdose ou l'abandon du traitement est plus élevé si un patient est sous-traité par OROBUPRE et continue de prendre en automédication des opioïdes, de l'alcool ou d'autres hypnotiques-sédatifs, en particulier les benzodiazépines.
Dépression respiratoire
Des cas de décès par dépression respiratoire ont été observés, particulièrement lorsque la buprénorphine avait été utilisée en association avec des benzodiazépines (voir rubrique 4.5) ou lorsque la buprénorphine n’avait pas été utilisée conformément aux informations posologiques. Des décès ont également été rapportés après la prise concomitante de buprénorphine et d’autres dépresseurs du système nerveux central tels que l’alcool ou d’autres opioïdes. L’administration de buprénorphine à des personnes non dépendantes aux opioïdes, qui ne sont pas tolérantes aux effets des opioïdes, peut entraîner une dépression respiratoire potentiellement mortelle.
OROBUPRE doit être utilisé avec précaution chez les patients atteints d’asthme ou d’insuffisance respiratoire telle qu'une maladie pulmonaire obstructive chronique, un cœur pulmonaire, une diminution de la capacité respiratoire, une hypoxie, une hypercapnie, une dépression respiratoire préexistante ou une cyphoscoliose (déformation de la colonne vertébrale pouvant entraîner une dyspnée).
La buprénorphine peut provoquer une dépression respiratoire sévère potentiellement mortelle chez les enfants et les personnes non dépendantes qui l’ingèrent accidentellement ou de manière délibérée. Les patients doivent être avertis de conserver les plaquettes en sûreté, de ne jamais ouvrir la plaquette à l’avance, de les tenir hors de la vue et de la portée des enfants et des autres membres de la famille et de ne pas prendre ce médicament devant les enfants. Un service d’urgence doit être immédiatement contacté en cas d’ingestion accidentelle ou de suspicion d’ingestion.
Hépatite, atteintes hépatiques
Des cas d’atteintes hépatiques aiguës ont été rapportés chez des toxicomanes dépendants aux opioïdes à la fois dans les essais cliniques et dans les rapports sur les effets indésirables survenus après commercialisation. Les anomalies observées vont d’élévations transitoires asymptomatiques des transaminases hépatiques à des cas d'insuffisance hépatique.
Dans de nombreux cas, la présence d’anomalies préexistantes des enzymes hépatiques, l'infection par le virus de l'hépatite B ou le virus de l'hépatite C, l'utilisation concomitante d'autres médicaments potentiellement hépatotoxiques et l’’injection de drogues peuvent être responsables de l’atteinte hépatique ou y contribuer. Ces facteurs sous-jacents doivent être pris en considération avant de prescrire OROBUPRE, et pendant le traitement.
En cas de suspicion d’atteinte hépatique, un bilan biologique et étiologique approfondi est nécessaire. En fonction des résultats obtenus, le traitement peut être arrêté avec précaution afin de prévenir les symptômes de sevrage et d'empêcher le retour à l'usage de drogues illicites. En cas de poursuite du traitement, il faudra surveiller étroitement la fonction hépatique.
Insuffisance hépatique
Le métabolisme hépatique de la buprénorphine peut être altéré chez les patients atteints d'insuffisance hépatique, ce qui peut causer une augmentation des concentrations plasmatiques de buprénorphine. Il peut être nécessaire de réduire la dose de buprénorphine (voir rubrique 4.2).
Insuffisance rénale
L'élimination rénale peut être prolongée, car 30 % de la dose administrée est éliminée par voie rénale. Les métabolites de la buprénorphine s'accumulent chez les patients atteints d'insuffisance rénale. La prudence est recommandée chez les patients présentant une insuffisance rénale sévère (clairance de la créatinine < 30 mL/min) (voir rubriques 4.2 et 5.2).
Dépression du SNC
La buprénorphine peut provoquer une somnolence, qui peut être augmentée par la prise concomitante d’autres produits qui agissent sur le système nerveux central (tels que alcool, tranquillisants, sédatifs ou hypnotiques) (voir rubrique 4.5).
L'utilisation concomitante d’OROBUPRE et de médicaments sédatifs tels que les benzodiazépines ou les médicaments apparentés peut entraîner une sédation, une dépression respiratoire, un coma et le décès. En raison de ces risques, la prescription concomitante avec ces médicaments sédatifs doit être réservée aux patients pour lesquels les autres options thérapeutiques ne sont pas possibles. S'il est décidé de prescrire OROBUPRE en concomitance avec des médicaments sédatifs, la dose efficace la plus faible des médicaments sédatifs doit être utilisée, et la durée du traitement doit être la plus courte possible. Les patients doivent être suivis de près pour détecter les signes et symptômes de dépression respiratoire et de sédation. A cet égard, il est fortement recommandé d'informer les patients et leurs soignants afin qu'ils soient conscients de ces symptômes (voir rubrique 4.5).
Inhibiteurs du CYP3A4
Les médicaments qui inhibent l'enzyme CYP3A4 peuvent augmenter les concentrations de la buprénorphine. Une diminution de la posologie de buprénorphine peut être nécessaire. Chez les patients déjà traités par des inhibiteurs de CYP3A4, la posologie de la buprénorphine doit être ajustée avec soin car une dose réduite peut être suffisante chez ces patients (voir rubrique 4.5).
Mises en garde générales relatives à l'administration d'opioïdes
Les opioïdes peuvent provoquer une hypotension orthostatique chez les patients ambulatoires.
Les opioïdes peuvent augmenter la pression du liquide céphalo-rachidien, ce qui peut être à l’origine de crises épileptiques. Les opioïdes doivent être donc être utilisés avec prudence chez les patients atteints de traumatisme crânien, de lésions intracrâniennes, et d’autres pathologies pouvant induire une augmentation de la pression du liquide céphalo-rachidien ou chez les patients qui ont des antécédents de crises épileptiques.
Un myosis induit par les opioïdes, des altérations du niveau de conscience ou de la perception de la douleur en tant que symptôme de la maladie peuvent interférer avec l’évaluation du patient ou compliquer le diagnostic ou le traitement clinique d’une maladie concomitante.
Les opioïdes doivent être utilisés avec précaution chez les patients atteints de myxœdème, d’hypothyroïdie ou d’insuffisance corticosurrénale (par exemple maladie d’Addison).
Les opioïdes peuvent être responsables d’une augmentation de la pression intra-cholédocienne et doivent donc être utilisés avec précaution chez les patients présentant un dysfonctionnement des voies biliaires.
Les opioïdes doivent être administrés avec précaution chez les patients âgés ou affaiblis.
Syndrome sérotoninergique
L’administration concomitante de OROBUPRE et d’autres agents sérotoninergiques, tels que les inhibiteurs de la MAO, les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS), les inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN) ou les antidépresseurs tricycliques, peut engendrer un syndrome sérotoninergique, qui est une maladie potentiellement mortelle (voir rubrique 4.5).
Si un traitement concomitant avec d’autres agents sérotoninergiques est justifié sur le plan clinique, il est conseillé d’observer attentivement le patient, tout particulièrement pendant l’instauration du traitement et les augmentations de dose.
Les symptômes du syndrome sérotoninergique peuvent comprendre des modifications de l’état mental, une instabilité autonome, des anomalies neuromusculaires et/ou des symptômes gastro-intestinaux.
En cas de suspicion de syndrome sérotoninergique, une réduction de dose ou un arrêt du traitement devra être envisagé(e) en fonction de la gravité des symptômes.
Troubles respiratoires liés au sommeil
Les opioïdes peuvent provoquer des troubles respiratoires liés au sommeil, notamment l’apnée centrale du sommeil (ACS) et l’hypoxémie liée au sommeil. Le risque d’ACS augmente en fonction de la dose d’opioïdes utilisée. Chez les patients présentant une ACS, une diminution de la dose totale d’opioïdes doit être envisagée.
OROBUPRE contient de l’aspartam
Ce produit contient de l'aspartam (voir la rubrique 2 pour la composition quantitative). L'aspartam est une source de phénylalanine qui peut être nocive pour les personnes atteintes de phénylcétonurie.
Population pédiatrique
La sécurité et l'efficacité de la buprénorphine chez les enfants âgés de moins de 15 ans en raison du manque de données sur la sécurité et l'efficacité.
En raison de l'absence de données chez les adolescents (âgés de 15 à 18 ans), ces patients doivent être surveillés plus étroitement pendant le traitement.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
OROBUPRE doit être utilisé avec précaution lors d’une administration concomitante avec :
· Gabapentinoïdes (gabapentine ou prégabaline) : L’administration concomitante de OROBUPRE avec des gabapentinoïdes (gabapentine et prégabaline) peut entraîner une dépression respiratoire, une hypotension, une sédation profonde, un coma ou la mort (voir rubrique 4.4).
· Autres dérivés opioïdes (par exemple méthadone, les analgésiques et les antitussifs), certains antidépresseurs, antihistaminiques H1 sédatifs, barbituriques, benzodiazépines, anxiolytiques autres que benzodiazépines, neuroleptiques, clonidine et substances apparentées administrés en association avec la buprénorphine majorent la dépression du système nerveux central. L'altération de la vigilance peut rendre dangereuses la conduite de véhicules et l'utilisation de machines.
· Les anticholinergiques ou les médicaments ayant une activité anticholinergique : L’administration concomitante de buprénorphine avec des anticholinergiques ou de médicaments ayant une activité anticholinergique (par exemple, antidépresseurs tricycliques, antihistaminiques, antipsychotiques, myorelaxants, médicaments antiparkinsoniens) peut entraîner une augmentation des effets indésirables anticholinergiques.
· Analgésiques opioïdes : Une analgésie adéquate peut être difficile à réaliser lorsqu'on administre un agoniste opioïde complet chez les patients recevant de la buprénorphine. Il existe un risque de surdosage également avec un agoniste complet, en particulier lorsqu'il s'agit de maîtriser les effets de l'agoniste partiel de la buprénorphine, ou lorsque les taux plasmatiques de buprénorphine diminuent. Les patients ayant besoin d'un traitement analgésique et d'un traitement de la dépendance aux opiacés peuvent être mieux pris en charge par des équipes multidisciplinaires comprenant des spécialistes de la douleur et du traitement de la dépendance aux opiacés.
· La naltrexone est un antagoniste des opioïdes susceptibles de bloquer les effets pharmacologiques de la buprénorphine. Pour les patients recevant un traitement par buprénorphine, la co-administration de naltrexone doit être fortement évitée à cause d’une interaction potentiellement dangereuse pouvant précipiter l'apparition brutale de symptômes de sevrage aux opioïdes prolongés et intenses. Chez les patients recevant actuellement un traitement à la naltrexone, les effets thérapeutiques attendus de l'administration de buprénorphine peuvent être bloqués par la naltrexone.
· Inhibiteurs du CYP3A4 : Une étude d'interaction entre la buprénorphine et le kétoconazole (inhibiteur puissant du CYP3A4) a montré une augmentation des Cmax et ASC (aire sous la courbe) de la buprénorphine (d’environ 50 % et 70 % respectivement) et, dans une moindre mesure, de la norbuprénorphine. Les patients traités par la buprénorphine doivent être étroitement surveillés et une diminution de la posologie peut s'avérer nécessaire en cas d’association avec un inhibiteur puissant du CYP3A4 (par exemple les inhibiteurs de la protéase tels que ritonavir, nelfinavir ou indinavir ou les antifongiques azolés tels que kétoconazole, antibiotiques macrolides ou itraconazole).
· Inducteurs du CYP3A4 : L'administration concomitante d'inducteurs du CYP3A4 avec la buprénorphine peut réduire les concentrations plasmatiques de buprénorphine et rendre potentiellement sous-optimal le traitement de la dépendance aux opioïdes par buprénorphine. Une surveillance étroite est recommandée chez les patients traités par buprénorphine si des inducteurs (par exemple phénobarbital, carbamazépine, phénytoïne, rifampicine) sont co‑administrés. Il peut être nécessaire d’ajuster la posologie de buprénorphine ou des inducteurs du CYP3A4 en conséquence.
· Utilisation concomitante des inhibiteurs de la monoamine oxydase (IMAO) : Une exacerbation des effets des opioïdes est possible, basée sur l'expérience de la morphine.
· Des médicaments sérotoninergiques, tels que les inhibiteurs de la MAO, les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS), les inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN) ou les antidépresseurs tricycliques, car le risque de syndrome sérotoninergique, qui est une maladie potentiellement mortelle, est accru (voir rubrique 4.4).
La buprénorphine est un inhibiteur du CYP3A4 in vitro. Le risque d’inhibition in vivo aux concentrations thérapeutiques semble être faible, mais n’est pas exclu. Lorsque la buprénorphine est associée à des substrats du CYP3A4, les taux plasmatiques de ces substrats peuvent augmenter et des effets secondaires dose-dépendants peuvent apparaître.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n’existe aucune donnée adéquate sur l'utilisation de la buprénorphine chez la femme enceinte. Des études chez l'animal ont montré une toxicité sur la reproduction (voir rubrique 5.3). Le risque potentiel pour l'homme est inconnu.
En fin de la grossesse, des doses élevées, même pendant une courte durée, peuvent induire une dépression respiratoire chez le nouveau-né. Au cours des trois derniers mois de grossesse, la prise chronique de buprénorphine peut provoquer un syndrome de sevrage chez le nouveau-né (hypertonie, tremblement du nouveau-né, agitation du nouveau-né, myoclonies ou convulsions). Le syndrome est généralement retardé de plusieurs heures à plusieurs jours après la naissance.
En raison de la longue demi-vie de la buprénorphine, la surveillance néonatale pendant plusieurs jours doit être envisagée à la fin de la grossesse, afin d’éviter le risque de dépression respiratoire ou de syndrome de sevrage chez le nouveau-né. En outre, l'utilisation de buprénorphine pendant la grossesse doit être évaluée par le médecin. La buprénorphine ne doit être utilisée pendant la grossesse que si le bénéfice potentiel est supérieur au risque potentiel pour le fœtus.
La buprénorphine et ses métabolites sont excrétés dans le lait maternel. Par conséquent, l'allaitement doit être interrompu pendant le traitement par OROBUPRE.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profile de sécurité
Liste tabulée des effets indésirables
- les effets indésirables rapportés lors des études cliniques pivots. La fréquence des effets indésirables éventuels répertoriés ci-dessous est définie selon la convention suivante : Très fréquent (>1//10), fréquent (>1/100 à <1/10).
- les effets indésirables les plus fréquemment identifiés au cours de la surveillance du produit post-commercialisation. Les événements survenant dans au moins 1% des rapports des professionnels de la santé et considérés comme attendus sont inclus. La fréquence des événements non rapportés dans les études pivots ne peut être estimée et est indiquée comme indéterminée.
Tableau 1: Effets indésirables observés dans les études cliniques pivots et/ou dans le cadre de la surveillance post-commercialisation, énumérés par système d’organes.
|
Classe de systèmes d’organes |
Très fréquent (≥1/10) |
Fréquent (≥1/100 to <1/10) |
Fréquence indéterminée |
|
Infections et infestations |
|
Bronchite Infection Grippe Pharyngite Rhinite |
|
|
Affections hématologiques et du système lymphatique |
|
Lymphadénopathie |
|
|
Troubles du métabolisme et de la nutrition |
|
Diminution de l’appétit |
|
|
Troubles psychiatriques |
Insomnie |
Agitation Anxiété Dépression Hostilité Nervosité Paranoïa Pensées anormales |
Pharmacodépendance |
|
Affections du système nerveux |
Céphalée |
Vertige Hypertonie Migraine Paresthésie Somnolence Syncope Tremblement |
|
|
Affections oculaires |
|
Trouble lacrymal Mydriase |
|
|
Affections cardiaques |
|
Palpitations |
|
|
Affections vasculaires |
|
Vasodilatation |
|
|
Affections respiratoires, thoraciques et médiastinales |
|
Toux Dyspnée Bâillements |
|
|
Affections gastro-intestinales |
Nausée |
Douleurs abdominales Constipation Diarrhée Sécheresse buccale Dyspepsie Troubles gastro-intestinaux Flatulence Troubles dentaires Vomissements |
Caries dentaires |
|
Affections de la peau et du tissu sous-cutané |
Hyperhidrose |
Rash |
|
|
Affections musculo-squelettiques et systémiques |
|
Arthralgie Douleurs dorsales Douleurs osseuses Spasmes musculaires Myalgie Douleur dans le cou |
|
|
Affections des organes reproducteurs et du sein |
|
Dysménorrhée |
|
|
Troubles généraux et anomalies au site d’administration |
Syndrome de sevrage Douleur |
Asthénie Douleur thoracique Frissons Malaise Œdème périphérique Pyrexie |
Syndrome de sevrage médicamenteux néonatal |
Les effets indésirables les plus fréquemment rapportés depuis la commercialisation figurent dans le Tableau 1.
Description des autres effets indésirables observés depuis la commercialisation
Ci-après un résumé d’autres événements indésirables rapportés depuis la commercialisation considérés comme sérieux ou qui méritent d’être mentionnés, dont certains peuvent avoir été observés avec la buprénorphine seule dans le traitement de la dépendance aux opioïdes :
· En cas d'usage détourné par voie intraveineuse, des réactions locales, parfois septiques (abcès, cellulite infectieuse), des hépatites aiguës potentiellement graves, ainsi que d'autres infections aiguës comme des pneumonies et des endocardites ont été rapportées (voir rubrique 4.4).
· Chez les patients présentant une pharmacodépendance manifeste, l'administration initiale de buprénorphine peut produire un syndrome de sevrage médicamenteux similaire à celui induit par la naloxone.
· Les signes et symptômes les plus fréquents d'hypersensibilité sont les éruptions cutanées, l'urticaire et le prurit. Des cas de bronchospasme, de dépression respiratoire, d'angio-œdème et de choc anaphylactique ont été rapportés (voir rubrique 4.8).
· Des cas d’augmentation des transaminases hépatiques, d’hépatite, d’hépatite aiguë, d’hépatite cytolytique, d’ictère, de syndrome hépatorénal, ainsi des cas d’encéphalopathie hépatique et de nécrose hépatique (voir rubrique 4.4).
· Des cas de syndrome de sevrage néonatal ont été signalés chez les nouveau-nés de femmes ayant reçu de la buprénorphine pendant la grossesse. Le syndrome peut ne pas être sévère et plus durable que celui des agonistes μ-opioïdes à action courte. La nature du syndrome peut varier selon les antécédents de consommation de la mère (voir rubrique 4.6).
· Des cas d'hallucination, d'hypotension orthostatique, rétention urinaire, de syncope et de vertige ont été rapportés.
Dépendance aux drogues
L’utilisation répétée de OROBUPRE peut entraîner une pharmacodépendance, même à des doses thérapeutiques. Le risque de dépendance aux médicaments peut varier en fonction des facteurs de risque individuels du patient, de la posologie et de la durée du traitement aux opioïdes (voir rubrique 4.4).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
Le principal symptôme nécessitant une intervention médicale en cas de surdosage est la dépression respiratoire, consécutive à une dépression du système nerveux central, car elle peut conduire à un arrêt respiratoire et à la mort. Les autres signes de surdosage sont notamment la somnolence, l’amblyopie, le myosis, l’hypotension, les nausées et les vomissements. Les signes de surdosage peuvent également inclure la somnolence, l'amblyopie, le myosis, l'hypotension, les nausées, les vomissements et / ou les troubles de la parole.
Prise en charge
D’une façon générale, une prise en charge globale du patient, comprenant une surveillance étroite de l’état respiratoire et cardiaque du patient, doit être instituée.
Un traitement symptomatique de la dépression respiratoire et des mesures standard de soins intensifs, doivent être mis en place. La liberté des voies aériennes supérieures et une ventilation assistée ou contrôlée doivent être assurées. Le patient doit être transféré dans une unité disposant de tous les moyens de réanimation nécessaires. Si le patient vomit, des précautions doivent être prises afin d’éviter qu’il inhale son vomi.
L'utilisation d'un antagoniste opioïde (par exemple la naloxone) est recommandée, malgré l'effet modeste qu'il peut exercer dans la suppression des symptômes respiratoires induits par la buprénorphine comparé à ses effets sur les agonistes opioïdes complets. Des doses de chlorhydrate de naloxone supérieures à 10 mg peuvent avoir une valeur limitée et ne sont pas recommandées dans la prise en charge des surdoses de buprénorphine. Comme la plupart des cas de surdosage rapportés avec la buprénorphine étaient associés à l'abus concomitant d'autres dépresseurs du SNC (par exemple, benzodiazépines, certains antidépresseurs, barbituriques, neuroleptiques), il convient de prendre les mesures appropriées pour le surdosage de tout médicament concomitant.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
La forme pharmaceutique d'OROBUPRE, lyophilisat oral, est conçue pour se disperser rapidement sur la langue habituellement en moins de 15 secondes.
La buprénorphine est un agoniste-antagoniste d’opioïde partiel qui se fixe aux récepteurs opioïdes cérébraux μ (mu) et κ (kappa). Son activité dans le traitement de substitution aux opioïdes est attribuée à sa liaison lentement réversible avec les récepteurs μ qui, sur une période prolongée, minimiserait le besoin en drogues chez les patients usagers de drogues. Au cours des études pharmacologiques cliniques chez des sujets dépendants aux opioïdes, la buprénorphine a démontré un effet plafond sur un certain nombre de paramètres, notamment l'humeur positive, le « bon effet » et la dépression respiratoire.
5.2. Propriétés pharmacocinétiques
Par voie orale, la buprénorphine subit un effet de premier passage hépatique avec une N-désalkylation et une glucuroconjugaison dans l'intestin grêle et dans le foie. L'administration de ce médicament par voie orale est donc inappropriée.
Les concentrations plasmatiques maximales sont atteintes environ 70 minutes après l'administration par la muqueuse buccale et la relation dose-concentration maximale est linéaire, entre 2 mg et 8 mg.
Distribution
L'absorption de la buprénorphine est suivie d'une phase de distribution rapide. La demi-vie de distribution est de 2 à 5 heures.
Biotransformation et Élimination
La buprénorphine est métabolisée par 14-N-désalkylation et glucuroconjugaison de la molécule-mère et du métabolite désalkylé. Des données cliniques confirment que le CYP3A4 est responsable de la N-désalkylation de la buprénorphine. La N-désalkylbuprénorphine est un agoniste opioïde μ (mu) de faible activité intrinsèque.
L'élimination de la buprénorphine est bi- ou tri-exponentielle et a une demi-vie d'élimination plasmatique moyenne de 32 heures.
La buprénorphine est éliminée dans les fèces par excrétion biliaire des métabolites glucuroconjugués (70 %), le reste étant éliminé dans l'urine.
5.3. Données de sécurité préclinique
La toxicité chronique étudiée chez quatre espèces (rongeurs et non rongeurs) par quatre voies d'administration différentes n'a pas montré d'élément cliniquement pertinent. Dans une étude orale d'un an chez le chien, une toxicité hépatique a été observée à très forte dose (75 mg/kg).
Les études de tératogénèse réalisées chez le rat et le lapin permettent de conclure que la buprénorphine n'est ni embryotoxique ni fœtotoxique, et elles n'ont pas d'effets marqués sur le potentiel de sevrage.
Aucun effet indésirable sur la fertilité ou la fonction générale de reproduction n'a été observé chez les rats, mais à la dose intramusculaire la plus élevée (5 mg/kg/jour), les mères ont éprouvé des difficultés de parturition et une mortalité néonatale élevée.
Dans une série standard de tests, aucune preuve de potentiel génotoxique n'a été mise en évidence.
Les études de cancérogénicité chez les souris et les rats montrent qu'il n'y a pas de différence dans l'incidence des différents types de tumeurs entre les animaux témoins et les animaux traités par la buprénorphine. Cependant, dans une étude menée avec des doses pharmacologiques chez la souris, une atrophie et une minéralisation tubulaire des testicules ont été mises en évidence chez les animaux traités.
Mannitol
Aspartam (E951)
Arôme menthe (051296 TP0551)
Acide citrique anhydre
3 ans
6.4. Précautions particulières de conservation
6.5. Nature et contenu de l'emballage extérieur
7 x 1 ou 28 x 1 lyophilisats oraux sous plaquettes prédécoupées unitaires (film PVC/OPA/Al/OPA/PVC avec Alu/PET/papier) dans un emballage extérieur en carton.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
BATIMENT D
92213 SAINT-CLOUD CEDEX
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 238 7 4 : 7 lyophilisats oraux sous plaquettes unitaires (PVC/OPA/Aluminium//PET/papier)
· 34009 301 238 8 1: 28 lyophilisats oraux sous plaquettes unitaires (PVC/OPA/Aluminium//PET/papier)
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
Prescription sur ordonnances sécurisées.
Prescription limitée à 28 jours.
Délivrance fractionnée par périodes de 7 jours.
ANSM - Mis à jour le : 06/03/2025
OROBUPRE 8 mg, lyophilisat oral
buprénorphine
Veuillez lire attentivement cette notice avant de prendre ce médicament car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que OROBUPRE et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre OROBUPRE ?
3. Comment prendre OROBUPRE ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver OROBUPRE ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE OROBUPRE ET DANS QUELS CAS EST-IL UTILISE ?
OROBUPRE lyophilisat oral est un comprimé lyophilisé qui se dissout rapidement sur la langue.
OROBUPRE est utilisé chez les adultes et les adolescents de plus de 15 ans, dans le cadre d'un programme de suivi médical, social et psychologique pour traiter la dépendance aux opioïdes.
OROBUPRE contient de la buprénorphine, un analgésique opioïde (stupéfiant). Lorsqu'il est utilisé pour le traitement de patients dépendants aux opioïdes (stupéfiants), comme la morphine ou l'héroïne, il agit en tant que traitement de substitution et, par conséquent, aide le patient à traiter sa dépendance sur une période de temps donnée.
Si le traitement est arrêté soudainement, des symptômes de sevrage peuvent apparaître.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE OROBUPRE ?
OROBUPRE n’est pas interchangeable avec d’autres produits qui contiennent de la buprénorphine.
La dose d’OROBUPRE peut varier entre les produits qui contiennent de la buprénorphine.
Ne prenez jamais OROBUPRE :
· si vous êtes allergique (hypersensible) à la buprénorphine ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· si vous avez une insuffisance respiratoire grave ou avez une crise d’asthme aiguë.
· si vous avez une maladie du foie grave.
· si vous êtes dépendant à l’alcool ou si vous présentez une intoxication alcoolique aiguë avec des tremblements ou des hallucinations.
· si vous êtes enceinte (à moins que votre médecin vous le prescrive)
· si vous allaitez un enfant.
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien ou votre infirmier/ère avant de prendre OROBUPRE :
· si vous souffrez de problèmes respiratoires comme l’asthme
· si vous avez une maladie du foie
· si vous avez des problèmes aux reins
· si vous avez une tension artérielle basse
· si vous avez une affection des voies urinaires (en particulier si elle est liée à une hypertrophie de la prostate chez l’homme)
· si vous avez des problèmes thyroïdiens
· si vous souffrez d’une insuffisance surrénalienne (par exemple la maladie d’Addison)
· si vous souffrez d’une dépression ou d’une autre maladie traitée par des antidépresseurs. L’utilisation concomitante de ces médicaments avec OROBUPRE peut provoquer un syndrome sérotoninergique, une maladie potentiellement mortelle (voir « Autres médicaments et OROBUPRE »)
Si l'une des situations ci-dessus s'applique à vous, veuillez en informer votre médecin avant de prendre OROBUPRE car votre médecin peut avoir besoin de réduire la dose d'OROBUPRE ou vous pouvez avoir besoin de traitement supplémentaire pour le contrôler.
Tolérance, dépendance et addiction
Ce médicament contient de la buprénorphine qui est un médicament opioïde. L’utilisation répétée d’opioïdes peut rendre le médicament moins efficace (on s’y habitue, c’est ce qu’on appelle la tolérance). L’utilisation répétée de OROBUPRE peut également entraîner une dépendance, un abus et une addiction, qui peuvent se traduire par une overdose potentiellement mortelle.
La dépendance ou l’addiction peuvent vous donner l’impression que vous ne contrôlez plus la quantité de médicaments que vous devez prendre ni la fréquence à laquelle vous devez les prendre.
Le risque de dépendance ou d’addiction varie d’une personne à l’autre. Ce risque de dépendance ou d’addiction à la buprénorphine peut être plus élevé si :
- Vous ou un membre de votre famille avez déjà consommé abusivement de l’alcool ou avez été dépendant de l’alcool, de médicaments sur ordonnance ou de drogues illégales (« addiction »).
- Vous êtes fumeur,
- Vous avez déjà des problèmes d’humeur (dépression, anxiété ou trouble de la personnalité) ou avez été traité par un psychiatre pour d’autres maladies mentales.
Si vous remarquez l’un des signes suivants pendant que vous prenez OROBUPRE, cela peut être le signe d’une dépendance ou d’une addiction :
- Vous devez prendre le médicament plus longtemps que ce que vous a conseillé votre médecin.
- Vous devez dépasser la dose recommandée
- Vous utilisez le médicament pour des raisons autres que celles prescrites, par exemple « pour rester calme » ou « pour vous aider à dormir ».
- Vous avez fait des tentatives répétées et infructueuses pour arrêter ou contrôler l’utilisation du médicament.
- Lorsque vous arrêtez de prendre le médicament, vous vous sentez mal et vous vous sentez mieux lorsque vous reprenez le médicament (« effets de sevrage »).
Si vous remarquez l’un de ces signes, parlez-en à votre médecin pour discuter de la meilleure voie de traitement pour vous, y compris quand il est approprié d’arrêter et comment arrêter en toute sécurité (voir la Section 3, Si vous arrêtez de prendre OROBUPRE).
Informations importantes à prendre en compte :
Surveillance supplémentaire
Vous pouvez être étroitement surveillé par votre médecin si vous avez moins de 18 ans. Vous ne devez pas prendre ce médicament si vous avez moins de 15 ans.
Mauvais usage, abus et usage détourné
Ce médicament peut être convoité par les individus qui utilisent de manière abusive des médicaments délivrés sur ordonnance et doit être conservé en un lieu sûr afin d'éviter tout vol. Ne donnez pas ce médicament à d'autres personnes. Il peut entraîner leur décès ou leur être nocif.
Symptômes de sevrage
Ce produit peut entraîner l'apparition de symptômes de sevrage si vous le prenez moins de 6 heures après la prise d'un opioïde à courte durée d'action (par ex., la morphine, l'héroïne) ou moins de 24 heures après la prise d'un opioïde à longue durée d'action, telle la méthadone.
Ce médicament peut également provoquer des symptômes de sevrage si vous arrêtez de le prendre brutalement.
Problèmes respiratoires
Certaines personnes sont décédées suite à une défaillance respiratoire (difficulté à respirer) lors d'une mauvaise utilisation de ce médicament ou lors de la prise concomitante d'autres dépresseurs du système nerveux central, tels que l'alcool, les benzodiazépines (tranquillisants) ou d'autres opioïdes.
Troubles respiratoires liés au sommeil
OROBUPRE peut provoquer des troubles respiratoires liés au sommeil, tels que l’apnée du sommeil (pause respiratoire pendant le sommeil) et l’hypoxémie liée au sommeil (faible taux d’oxygène dans le sang). Les symptômes peuvent inclure des pauses respiratoires pendant le sommeil, un réveil nocturne dû à un essoufflement, des difficultés à maintenir le sommeil ou une somnolence excessive pendant la journée. Si vous ou une autre personne observez ces symptômes, contactez votre médecin. Une réduction de dose peut être envisagée par votre médecin.
Lésion du foie
Des cas de lésions du foie ont été signalés suite à la prise de ce médicament, notamment lors d'un mauvais usage du médicament. Celles-ci peuvent aussi découler d’infections virales (hépatite C chronique), d'un abus d’alcool, d'une anorexie ou de la prise d’autres médicaments présentant un risque pour votre foie (voir rubrique 4). Votre médecin peut faire pratiquer des tests sanguins réguliers pour surveiller l’état de votre foie. Prévenez votre médecin si vous souffrez de problèmes hépatiques avant de commencer un traitement par OROBUPRE.
Tension artérielle
Ce produit peut provoquer une baisse soudaine de la tension artérielle, provoquant une sensation de vertige lors du passage trop rapide de la position assise ou couchée à la position debout.
Diagnostic des affections médicales non apparentées
Ce médicament peut masquer les symptômes de douleur susceptibles de contribuer au diagnostic de certaines maladies. N'oubliez pas d'informer votre médecin si vous prenez ce médicament.
Autres médicaments et OROBUPRE
Informez votre médecin ou votre pharmacien si vous prenez, avez récemment pris ou si vous comptez prendre d'autres médicaments.
Certains médicaments peuvent intensifier les effets indésirables de OROBUPRE et parfois provoquer de très graves réactions. Ne prenez aucun autre médicament pendant que vous prenez OROBUPRE sans en avoir parlé au préalable à votre médecin, notamment :
· Cependant, si votre médecin vous prescrit OROBUPRE en même temps que des médicaments sédatifs, il doit limiter la dose et la durée du traitement concomitant. Veuillez informer votre médecin de tous les médicaments sédatifs que vous prenez et suivez scrupuleusement les recommandations de dosage de votre médecin. Il peut être utile d'informer vos amis ou vos proches des signes et symptômes mentionnés ci-dessus. Contactez votre médecin lorsque vous ressentez de tels symptômes.
· Des antidépresseurs tels que le moclobémide, la tranylcypromine, le citalopram, l’escitalopram, la fluoxétine, la fluvoxamine, la paroxétine, la sertraline, la duloxétine, la venlafaxine, l’amitriptyline, la doxépine, ou la trimipramine. Ces médicaments peuvent interagir avec OROBUPRE et vous pouvez présenter des symptômes tels que des contractions rythmiques involontaires des muscles, y compris des muscles qui contrôlent les mouvements de l'œil, une agitation, des hallucinations, un coma, une transpiration excessive, des tremblements, une exagération des réflexes, une augmentation de la tension musculaire, une température corporelle supérieure à 38 °C. Contactez votre médecin si vous ressentez ces symptômes.
· Gabapentine ou prégabaline pour traiter l’épilepsie ou les douleurs dues à des problèmes nerveux (douleurs neuropathiques).
- Les antidépresseurs (utilisés pour traiter la dépression) tels que l'isocarboxazide et le valproate peuvent augmenter les effets de ce médicament.
- les antagonistes sédatifs des récepteurs H1 (utilisés pour traiter les réactions allergiques) tels que la diphénhydramine et la chlorphénamine.
- barbituriques (utilisés pour provoquer le sommeil ou la sédation) tels que le phénobarbital, le sécobarbital.
- les tranquillisants (utilisés pour provoquer le sommeil ou la sédation) tels que l'hydrate de chloral.
· La naltrexone peut empêcher OROBUPRE d'agir. Si vous prenez de la naltrexone pendant que vous prenez OROBUPRE, vous risquez de voir apparaître soudainement des symptômes de sevrage prolongés et intenses
· La clonidine utilisée pour traiter l'hypertension artérielle) peut prolonger les effets de ce médicament.
· Les antirétroviraux (utilisés pour traiter le SIDA) tels que le ritonavir, le nelfinavir, l'indinavir peuvent augmenter les effets de ce médicament.
· Certains antifongiques (utilisés pour traiter les infections fongiques) tels que le kétoconazole et l'itraconazole et certains antibiotiques (macrolides) peuvent prolonger les effets de ce médicament.
· Certains médicaments peuvent diminuer l'effet d’OROBUPRE. Il s'agit notamment des médicaments utilisés pour traiter l'épilepsie (tels que la carbamazépine et la phénytoïne) et des médicaments utilisés pour traiter la tuberculose (rifampicine).
· Médicaments utilisés pour traiter les allergies, le mal des transports ou les nausées (antihistaminiques ou antiémétiques).
· Médicaments destinés au traitement des troubles psychiatriques (antipsychotiques ou neuroleptiques).
· Relaxants musculaires.
· Médicaments pour traiter la maladie de Parkinson.
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament, y compris un médicament obtenu sans ordonnance.
OROBUPRE avec des aliments, des boissons et de l'alcool
OROBUPRE ne doit pas être pris en même temps que des aliments ou des boissons.
Vous ne devez pas boire d'alcool ni prendre des médicaments contenant de l'alcool tout en prenant OROBUPRE. Cela peut augmenter le risque de somnolence, de dépression respiratoire et de surdosage fatal.
Grossesse, allaitement et fertilité
Informez votre médecin si vous êtes enceinte ou si vous avez l'intention de le devenir.
Lorsqu'ils sont pris pendant la grossesse, en particulier en fin de grossesse, les médicaments comme OROBUPRE peuvent provoquer des symptômes de sevrage médicamenteux, notamment des problèmes respiratoires chez le nouveau-né. Ces symptômes peuvent survenir plusieurs jours après la naissance.
Ne nourrissez pas votre bébé au sein pendant que vous prenez ce médicament car OROBUPRE passe dans le lait maternel.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Conduite de véhicules et utilisation de machines
Ce médicament peut provoquer une somnolence qui peut être aggravée si vous buvez de l’alcool, si vous prenez des tranquillisants ou des médicaments contre l’anxiété. Si vous êtes somnolent, ne conduisez pas et n'utilisez pas de machines.
OROBUPRE contient de l’aspartam
Ce médicament contient 2,0 mg d’aspartam dans chaque 8 mg lyophilisat oral
L’aspartam contient une source de phénylalanine. Peut être dangereux pour les personnes atteintes de phénylcétonurie (PCU), une maladie génétique rare caractérisée par l’accumulation de phénylalanine ne pouvant être éliminée correctement.
Démarrage du traitement par OROBUPRE
· Démarrage du traitement par OROBUPRE si vous êtes dépendant à l'héroïne ou à un opioïde à action courte.
Votre première dose d'OROBUPRE doit être prise au moins 6 heures après la dernière utilisation d'opioïde ou lorsque des signes de sevrage apparaissent.
· Démarrage du traitement par OROBUPRE si vous êtes dépendants à la méthadone ou à un opioïde à action prolongée.
Vous ne commencerez pas le traitement par ce médicament tant que votre dose de méthadone n’est pas de 30 mg par jour ou moins. La première dose d'OROBUPRE doit être prise lorsque des signes de sevrage apparaissent, mais pas moins de 24 heures après la dernière utilisation de la méthadone.
Pendant les premières 24 heures de traitement, vous pouvez vous sentir mal à l'aise avec certains symptômes légers de sevrage aux opiacés, tels que transpiration, malaise (voir rubrique 4 : Les effets indésirables éventuels).
Combien en prendre
Votre médecin décidera de la dose à laquelle vous devez commencer votre traitement.
Pendant le traitement, votre médecin ajustera votre dose en fonction de votre réponse. La dose maximale est de 18 mg par jour. Après une période de succès du traitement, votre médecin peut réduire progressivement votre dose et en fonction de votre état, peut l’arrêter complètement.
N'arrêtez pas brutalement de prendre OROBUPRE car cela peut conduire à des symptômes de sevrage.
Mode d'emploi
Placez OROBUPRE sur votre langue, pas sous votre langue.
OROBUPRE est sensible à l'humidité. Assurez-vous que vos mains sont sèches avant de manipuler la plaquette. Prenez le comprimé en suivant les instructions ci-dessous :
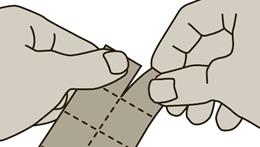
1. Détacher un carré de l'emballage le long des lignes perforées.
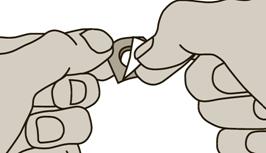
2. Le film de la plaquette est facilement pelable. Ne forcez pas le comprimé à travers la coque car il est fragile et peut facilement se casser. Mais plutôt, repliez le film, puis détachez-le.
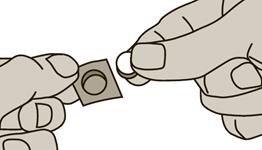
3. Retirez le comprimé soigneusement et sortez-le de l'emballage immédiatement.
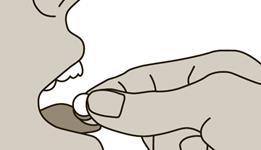
4. Placez le comprimé sur la langue et fermez la bouche. Laissez-le fondre quelques secondes jusqu'à ce qu'il se soit dissout. Evitez d'avaler pendant les 2 premières minutes. Ne pas manger ni boire pendant au moins 5 minutes.
Si vous avez pris plus d’OROBUPRE que vous n’auriez dû :
Informez votre médecin immédiatement ou contactez le service hospitalier le plus proche.
N'oubliez pas de prendre la boite et les plaquettes restantes avec vous.
Si vous oubliez de prendre OROBUPRE :
Vous devez en informer votre médecin et suivre ses instructions. Ne prenez pas une double dose pour rattraper la dose oubliée.
Si vous arrêtez de prendre OROBUPRE :
N'arrêtez pas de prendre ce médicament brutalement, sauf si votre médecin vous le demande, car cela peut causer des symptômes de sevrage.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Parlez-en immédiatement à votre médecin et consultez les urgences médicales si vous présentez l’un des effets graves suivants, tels que :
· si vous commencez à respirer plus lentement ou faiblement que prévu (dépression respiratoire).
· si vous commencez à vous sentir faible, car cela peut être un signe d'hypotension artérielle.
· si vous ressentez une fatigue importante (lassitude), si vous n'avez pas d'appétit ou si votre peau ou vos yeux sont jaunes. Ces symptômes peuvent être ceux d'une atteinte du foie.
Les autres effets secondaires peuvent inclure :
Les effets indésirables très fréquents (pouvant affecter jusqu’à 1 patient sur 10) sont :
Insomnie (incapacité à dormir), nausée, transpiration excessive, maux de tête, syndrome de sevrage, douleur.
Les effets indésirables fréquents (pouvant affecter 1 patient à 10 sur 100) sont :
Gonflement des bras ou des jambes, fatigue, somnolence, anxiété, nervosité, picotements, dépression, pensées anormales, larmes excessives (larmoiement) ou autre trouble des larmes, vision trouble, bouffées de chaleur, palpitations, dilatation des vaisseaux sanguins, migraines, maux de gorge et douleur en avalant, toux, problèmes d'estomac ou autres troubles gastriques, diarrhée, flatulences, vomissements, démangeaisons, douleurs musculaires, spasmes musculaires, douleurs abdominales, mal au dos, infection, frissons, douleurs thoraciques, fièvre, sensation d'inconfort général, faiblesse et étourdissements, douleurs osseuses, bronchite, constipation, diminution de l'appétit, sécheresse de la bouche, crampes menstruelles/menstruations douloureuses, dyspnée, hostilité, hypertonie (augmentation de la tension musculaire), grippe, gonflement des glandes (ganglions lymphatiques), augmentation de la taille des pupilles, douleurs au cou, paranoïa, changement de couleur, d'apparence ou de texture de la peau, troubles dentaires, tremblements, bâillements, agitation, troubles gastro-intestinaux.
Les effets secondaires dont la fréquence est indéterminée (la fréquence ne peut être estimée sur la base des données disponibles) sont :
Si l'un des effets indésirables devient grave, ou si vous remarquez des effets indésirables non mentionnés dans cette notice, veuillez en informer votre médecin ou votre pharmacien.
Si vous ne comprenez pas certain des effets secondaires mentionnés, demandez à votre médecin de vous les expliquer.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou à votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER OROBUPRE ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage après EXP. La date de péremption fait référence au dernier jour du mois.
Conservez votre médicament dans l'emballage d'origine à l’abri de la lumière et de l'humidité.
Ce médicament ne nécessite pas de précautions particulières de conservation concernant la température.
Conservez ce médicament dans un endroit sûr et sécurisé, où d'autres personnes ne peuvent pas y accéder. Il peut causer des dommages graves, voire mortels, aux personnes qui pourraient prendre ce médicament par accident ou intentionnellement alors qu'il ne leur a pas été prescrit.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
· La substance active est la buprénorphine. Chaque lyophilisat contient 8 mg de buprénorphine (sous forme de chlorhydrate).
· Les autres composants sont: gélatine, mannitol, aspartam, arôme menthe et acide citrique.
Qu’est-ce que OROBUPRE et contenu de l’emballage extérieur
OROBUPRE 8 mg lyophilisat oral se présente sous forme de lyophilisat oral, rond, blanc à blanc cassé gravé avec "M8" sur une face.
Ce médicament est disponible sous plaquettes contenant 7 x 1 ou 28 x 1 lyophilisats dans un emballage carton.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
194, BUREAUX DE LA COLLINE,
BATIMENT D
92213 SAINT-CLOUD CEDEX
Exploitant de l’autorisation de mise sur le marché
179 BUREAUX DE LA COLLINE
92210 SAINT CLOUD
MACARTHYS LABORATORIES (T/A MARTINDALE PHARMACEUTICALS)
BAMPTON ROAD, HAROLD HILL
ROMFORD
ESSEX
RM3 8UG
ROYAUME UNI
OU
ETHYPHARM
CHEMIN DE LA POUDRIERE
76120 LE GRAND QUEVILLY
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
OROBUPRE 8 mg, lyophilisat oral
OROBUPRE 8 mg, lyophilisat oral
(buprénorphine)
Guide pratique d’utilisation
Recommandations de bon usage destinées aux patients
Information destinée aux professionnels de santé à donner aux patients lors de la prescription d’OROBUPRE.
Date de préparation: Mars 2017
Introduction
Cette brochure s'adresse uniquement aux personnes qui ont une prescription sur ordonnance d’OROBUPRE.
OROBUPRE lyophilisat oral est un comprimé lyophilisé qui se dissout très rapidement sur votre langue.
C’est un traitement de substitution de la dépendance aux opioïdes et il doit être utilisé en même temps qu’une prise en charge médicale, sociale et psychologique que vous suivez pour vous aider à surmonter la dépendance aux opioïdes.
La substance active d’OROBUPRE est la buprénorphine. La buprénorphine est un médicament opioïde (parfois appelé narcotique).
Le but de ce guide est de vous fournir des informations importantes sur OROBUPRE; comment il est diffèrent de la buprénorphine «sublinguale» avec laquelle vous êtes peut être familier, ainsi que les risques et les signes de surdosage, et ce qu'il faut faire si un surdosage se produit.
Ce guide est uniquement destiné à compléter (et non pas remplacer) les informations que vous trouverez dans la notice d'information du patient insérée dans la boite de votre médicament.
Pour obtenir la liste complète des effets secondaires et d'autres renseignements importants, veuillez consulter la notice d'information du patient ou demander à votre professionnel de santé une copie du résumé des caractéristiques du produit (RCP).
|
OROBUPRE est très différent de la buprénorphine «sublinguale» sur certains aspects importants :
1. Vous devez prendre le comprimé OROBUPRE en le mettant sur votre langue, où il se dissout et est absorbé par la surface de votre langue très rapidement - en général en moins de 15 secondes - et passe ensuite dans votre circulation sanguine. Ceci est différent d’un comprimé «sublingual» de buprénorphine que vous mettez sous votre langue où ils se dissout en environ 5 à 10 minutes. Prenez toujours OROBUPRE en le mettant sur votre langue, pas sous elle.
2. Il se peut que la quantité de buprénorphine que vous avez prise soit trop importante pour vous si vous avez pris OROBUPRE comme un comprimé «sublingual».
3. La quantité d'OROBUPRE que vous prenez peut être différente de la quantité de buprénorphine «sublinguale» que vous avez pu prendre. Suivez toujours les conseils de votre professionnel de santé.
4. Vous ne devez pas échanger OROBUPRE par de la buprénorphine «sublinguale», ou l'inverse, sans les conseils de votre professionnel de santé.
|
Surdosage
Vous – le patient
Parce qu’OROBUPRE délivre plus de buprénorphine dans votre organisme que la buprénorphine «sublinguale», il peut y avoir un risque accru de dépression respiratoire et de surdosage, en particulier si vous prenez également d'autres médicaments/substances qui agissent sur votre système nerveux central (SNC). D'autres médicaments/substances qui agissent de cette façon incluent l'alcool, les sédatifs comme les benzodiazépines ou les barbituriques, la gabapentine et la prégabaline.
Il est extrêmement important que vous preniez OROBUPRE exactement comme indiqué par votre médecin. Toutefois, si pour une raison quelconque, vous pensez avoir pris trop d'OROBUPRE (plus que la dose prescrite), demandez conseil à votre médecin ou pharmacien.
De graves problèmes respiratoires et même la mort peuvent se produire si OROBUPRE est pris avec de l'alcool et/ou d'autres médicaments qui agissent sur votre système nerveux central.
Les symptômes que vous pourriez ressentir si vous avez pris trop d'OROBUPRE, ou si vous avez accidentellement associé OROBUPRE avec l'alcool et/ou d'autres médicaments qui agissent sur votre système nerveux central (SNC) incluent :
· Se sentir ou être malade
· Évanouissement et étourdissements
· Se sentir faible en se levant
· Mal de tête
· Confusion
· Se sentir très fatigué ou somnolent / luttant pour rester éveillé
· Respiration faible ou superficielle
· Teinte bleutée sur les lèvres, la pointe du nez, la zone autour des yeux, les doigts ou les ongles
· Fréquence cardiaque rapide ou lente
Si vous ressentez l'un des symptômes ci-dessus, consultez immédiatement votre médecin.
Surdosage
Vous – le témoin
Si vous suspectez un surdosage chez quelqu'un, vous pouvez agir pour aider à sauver sa vie.
Signes et symptômes de surdosage :
· Pas de réponse au bruit (quand vous criez à quelqu’un que vous suspectez être la victime d’un surdosage et vous n’obtenez pas de réponse).
· Pas de réponse au toucher (quand vous secouez ses épaules).
· Perte de conscience, c'est-à-dire la victime suspectée de surdosage, ne peut pas être réveillée.
· Problèmes respiratoires
o Respiration lente / peu profonde ou peu fréquente
o Ronflements / Sons râpants
o Pas de respiration du tout
o Peau bleuâtre, grisâtre ou pâle
o Teinte bleuâtre aux lèvres, pointe du nez, cernes, doigts ou ongles.
Que faire si vous trouvez quelqu'un victime d’un surdosage ?
Si une trousse de Naloxone à emporter est disponible sur les lieux, suivez attentivement les conseils d'utilisation. (Adressez-vous à votre professionnel de santé pour obtenir de plus amples renseignements au sujet des trousses de Naloxone à emporter).
Si une trousse de Naloxone est disponible sur les lieux :
· Déplacez la victime afin qu'elle repose sur une surface plane.
· Ouvrez doucement sa bouche et regardez à l'intérieur, vérifier s’il y a quelque chose qui bloque les voies respiratoires.
· Libérez les voies respiratoires en inclinant doucement sa tête en arrière et en ouvrant sa bouche.
· Regardez, écoutez et ressentez des signes de respiration pendant pas plus de 10 secondes.
· Déclenchez l'alarme en appelant immédiatement les urgences et en demandant une ambulance, indiquez à l'opérateur que la victime est inconsciente et l’informer si oui ou non elle respire.
· Suivez toutes autres instructions que vous recevez de l'opérateur de service d’urgence jusqu'à l'arrivée de l'ambulance.
OROBUPRE 8 mg, lyophilisat oral
OROBUPRE 8 mg, lyophilisat oral
(buprénorphine)
Guide des Professionnels de Santé
Il doit être lu conjointement avec le résumé des caractéristiques du produit (RCP) pour obtenir des renseignements complets sur la prescription.
Date de préparation: Mars 2017
Lettre aux Professionnels de la Santé
OROBUPRE lyophilisat oral est un comprimé de buprénorphine lyophilisé qui se disperse très rapidement sur la langue et est un traitement de substitution de la dépendance aux opioïdes dans le cadre d'une prise en charge médicale, sociale et psychologique.
L’objectif de ce guide est de fournir des informations supplémentaires sur la prescription sûre et appropriée d'OROBUPRE dans la mesure où OROBUPRE diffère des produits traditionnels qui contiennent de la buprénorphine administrée par voie sublinguale que vous connaissez peut-être.
OROBUPRE est différent des comprimés sublinguaux de buprénorphine
De nombreux professionnels de santé et des patients sont familiers avec les comprimés sublinguaux de buprénorphine. Cependant, OROBUPRE est différent de ceux-ci sur plusieurs points importants :
A. Avec OROBUPRE, l'administration est par la voie buccale, elle n’est pas sublinguale. OROBUPRE doit être placé sur la langue, où il se dissout et est absorbé dans la circulation sanguine à travers la surface de la langue très rapidement - en général en moins de 15 secondes. Ceci est très différent des comprimés sublinguaux de buprénorphine qui sont placés sous la langue où ils se dissolvent en environ 5 à 10 minutes. Vous devez vous assurer que votre patient comprend qu’OROBUPRE ne doit être pris qu'en le plaçant sur la langue, et non pas sous la langue.
B. Différents médicaments contenant de la buprénorphine ont des biodisponibilités différentes, et pour OROBUPRE, la biodisponibilité de la buprénorphine s'est révélée être 30% supérieure à celle des spécialités de buprénorphine en comprimés sublinguaux. Donc :
a. Les doses initiales et maximales d’OROBUPRE sont différentes de celles des comprimés sublinguaux de buprénorphine (voir ci-dessous).
b. La dose de buprénorphine administrée à un patient sous la forme sublinguale peut être excessive si elle est administrée au même patient en tant que OROBUPRE. Les doses administrées aux patients doivent être ajustées individuellement pour une meilleure efficacité.
c. OROBUPRE n'est pas interchangeable avec des comprimés sublinguaux de buprénorphine.
|
Jour |
Dose d’OROBUPRE |
|
Jour 1 |
La dose initiale recommandée est de 2 mg.
Un à deux lyophilisats oraux supplémentaires d’OROBUPRE 2 mg peuvent être administrés le premier jour en fonction des besoins spécifiques à chaque patient. |
|
Ajustement de la dose |
Ajustez la dose vers le haut ou vers le bas jusqu’à l’obtention de l'effet clinique par paliers de 2-6 mg. La dose quotidienne maximale est de 18 mg. |
Surdosage
Les opioïdes, y compris la buprénorphine, peuvent provoquer une dépression respiratoire et un surdosage, en particulier lorsqu'ils sont pris conjointement avec d'autres dépresseurs du système nerveux central tels que les autres opioïdes, l'alcool, les benzodiazépines ou les barbituriques.
Les patients doivent être alertés sur le risque de surdosage, les signes et symptômes d'un surdosage et sur que faire en cas de surdosage, ainsi que sur les risques encourus en cas de prise concomitante de leur traitement avec d'autres dépresseurs du système nerveux central.
En cas de surdosage, une prise en charge globale, comprenant une surveillance étroite de l’état respiratoire et cardiaque du patient, doit être instituée. Le symptôme majeur nécessitant une intervention est la dépression respiratoire, qui peut conduire à un arrêt respiratoire et même à la mort. Si le patient vomit, il faut veiller à ce que les voies aériennes soient dégagées.
Le traitement symptomatique de la dépression respiratoire doit suivre les mesures standard de soins intensifs. Il faut s’assurer que les voies aériennes sont dégagées et utiliser une ventilation assistée ou contrôlée Le patient doit être transféré dans une unité disposant de tous les moyens de réanimation nécessaires. L'utilisation d'un antagoniste des opioïdes (par exemple la naloxone) est recommandée, malgré l'effet modeste qu'il peut exercer dans la suppression des symptômes respiratoires induits par la buprénorphine comparé à ses effets sur les opioïdes agonistes complets.
La longue durée d’action doit être prise en compte afin de déterminer la durée de traitement et la surveillance médicale nécessaires pour supprimer les effets du surdosage.