Dernière mise à jour le 01/12/2025
MOTILIUM 1 mg/ml, suspension buvable
Ce médicament n'est ou ne sera bientôt plus disponible sur le marché.
Si vous prenez actuellement ce médicament, il vous est recommandé d'en parler avec votre médecin
ou avec votre pharmacien qui pourra vous orienter vers un autre traitement.
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Faible | Avis du 22/07/2015 | Renouvellement d'inscription (CT) | Chez l’adulte dans l’indication de l’AMM et sous réserve du respect des mesures de minimisation des risques cardio-vasculaires, le service médical rendu par les spécialités à base de dompéridone est faible. |
| Insuffisant | Avis du 22/07/2015 | Renouvellement d'inscription (CT) | Chez l’enfant dans l’indication de l’AMM, le service médical rendu par les spécialités à base de dompéridone est insuffisant pour une prise en charge par la solidarité nationale. |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 22/01/2025
MOTILIUM 1 mg/ml, suspension buvable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Dompéridone........................................................................................................................... 1 mg
Pour 1 ml de suspension buvable.
Excipient à effet notoire : Chaque ml de la suspension buvable contient 455 mg de sorbitol liquide non cristallisable, 1,8 mg de parahydroxybenzoate de méthyle, 0,2 mg de parahydroxybenzoate de propyle et moins de 1 mmol de sodium (23 mg), ce qui signifie qu’il est essentiellement "sans sodium".
Pour la liste complète des excipients, voir rubrique 6.1.
Suspension buvable.
Suspension homogène blanche.
4.1. Indications thérapeutiques
MOTILIUM est indiqué pour le soulagement des symptômes de type nausées et vomissements.
4.2. Posologie et mode d'administration
Posologie
MOTILIUM doit être utilisé à la dose minimale efficace pour la durée la plus courte nécessaire pour contrôler les nausées et les vomissements.
Il est recommandé de prendre MOTILIUM avant les repas. Si le médicament est pris après les repas, son absorption est quelque peu retardée.
Les patients doivent s'efforcer de prendre chaque dose à l'heure prévue. Si une dose prévue est oubliée, cette dose ne doit pas être prise et le schéma d'administration habituel doit être poursuivi. La dose ne doit pas être doublée pour compenser une dose omise.
Habituellement, la durée maximale du traitement ne doit pas dépasser une semaine.
Adultes et adolescents (à partir de 12 ans et de 35 kg)
10 ml (de la suspension buvable 1 mg/ml) jusqu’à 3 fois par jour, la dose quotidienne maximale étant de 30 ml.
Insuffisance hépatique
MOTILIUM est contre-indiqué en cas d’insuffisance hépatique modérée ou sévère (voir rubrique 4.3).
Une modification de la dose n’est cependant pas nécessaire en cas d’insuffisance hépatique légère (voir rubrique 5.2).
Insuffisance rénale
Etant donné que la demi-vie d’élimination de la dompéridone est allongée en cas d’insuffisance rénale sévère, en cas d’administrations répétées, la fréquence d’administration de MOTILIUM doit être réduite à une ou deux prise(s) par jour en fonction du degré de sévérité de l’insuffisance rénale. Une diminution de la dose peut s’avérer nécessaire.
Population pédiatrique
L’efficacité de MOTILIUM chez les enfants âgés de moins de 12 ans n’a pas été établie (voir rubrique 5.1).
L’efficacité de MOTILIUM chez les adolescents âgés de plus de 12 ans et pesant moins de 35 kg n’a pas été établie.
MOTILIUM est contre-indiqué dans les situations suivantes :
· hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
· tumeur hypophysaire à prolactine (prolactinome) ;
· lorsque la stimulation de la motricité gastrique peut s’avérer nocive, par exemple chez les patients présentant une hémorragie gastro-intestinale, une obstruction mécanique ou une perforation.
· chez les patients atteints d’une insuffisance hépatique modérée ou sévère (voir rubrique 5.2).
· chez les patients ayant un allongement connu des intervalles de conduction cardiaque, notamment de l'intervalle QTc, les patients présentant des troubles électrolytiques importants ou des maladies cardiaques sous-jacentes telles qu'une insuffisance cardiaque congestive (voir rubrique 4.4).
· administration concomitante avec les médicaments qui allongent l'intervalle QT, à l’exception de l’apomorphine (voir les rubriques 4.4 et 4.5).
· administration concomitante avec les inhibiteurs puissants du CYP3A4 (quels que soient leurs effets d'allongement de l'intervalle QT) (voir rubrique 4.5).
4.4. Mises en garde spéciales et précautions d'emploi
Insuffisance rénale
La demi-vie d'élimination de la dompéridone est allongée en cas d'insuffisance rénale sévère. En conséquence, en cas d'administrations répétées, la fréquence d'administration de la dompéridone doit être réduite à une ou deux prises par jour en fonction du degré de sévérité de l'insuffisance rénale. Une diminution de la dose peut s'avérer nécessaire.
Effets cardiovasculaires
La dompéridone a été associée à un allongement de l'intervalle QT à l'électrocardiogramme. Au cours de la surveillance après commercialisation, de très rares cas d'allongement de l'intervalle QT et de torsades de pointes ont été rapportés chez des patients traités par la dompéridone. Ces cas concernent des patients avec des facteurs de risque, des anomalies électrolytiques et des traitements associés qui ont pu être des facteurs contributifs (voir rubrique 4.8).
Des études épidémiologiques ont mis en évidence que la dompéridone est associée à un risque accru d'arythmies ventriculaires graves ou de mort subite (voir rubrique 4.8). Un risque plus élevé a été observé chez les patients de plus de 60 ans, les patients traités par des doses quotidiennes supérieures à 30 mg et les patients traités simultanément par des médicaments qui allongent l'intervalle QT ou des inhibiteurs du CYP3A4.
La dompéridone doit être utilisée à la dose efficace la plus faible.
La dompéridone est contre-indiquée chez les patients ayant un allongement connu des intervalles de conduction cardiaque, notamment de l'intervalle QTc, les patients présentant des troubles électrolytiques importants (hypokaliémie, hyperkaliémie, hypomagnésémie) ou une bradycardie, ou les patients présentant des maladies cardiaques sous-jacentes telles qu'une insuffisance cardiaque congestive en raison du risque accru d'arythmies ventriculaires (voir rubrique 4.3.). Les troubles électrolytiques (hypokaliémie, hyperkaliémie, hypomagnésémie) et la bradycardie sont connus pour augmenter le risque pro-arythmique.
Le traitement par la dompéridone doit être arrêté en cas de survenue de signes ou symptômes pouvant être associés à une arythmie cardiaque et les patients doivent consulter leur médecin.
Les patients doivent être invités à rapporter immédiatement tout symptôme cardiaque.
Utilisation avec l’apomorphine
La dompéridone est contre-indiquée avec les médicaments qui allongent l’intervalle QT, notamment l’apomorphine, sauf si le bénéfice de l’administration concomitante avec l’apomorphine est supérieur aux risques, et uniquement si les précautions recommandées pour l’administration concomitante mentionnées dans le RCP de l'apomorphine sont strictement respectées. Veuillez-vous reporter au RCP de l’apomorphine.
Précautions d’emploi
La suspension buvable contient du sorbitol qui peut causer une gêne gastro-intestinale et un effet laxatif léger. Le sorbitol est une source de fructose et les patients présentant une intolérance héréditaire au fructose (IHF) ne doivent pas recevoir ce médicament. Il contient également du parahydroxybenzoate de méthyle et du parahydroxybenzoate de propyle qui peuvent provoquer des réactions allergiques (éventuellement retardées), et exceptionnellement, des bronchospasmes.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Si des médicaments antiacides ou antisécrétoires sont également prescrits, ils ne doivent pas être pris en même temps que MOTILIUM (dompéridone base). Ainsi, ils devront être pris après le repas et non avant.
Association avec la lévodopa
Bien qu’un ajustement posologique de la lévodopa ne soit pas jugé nécessaire, une augmentation de la concentration plasmatique (de 30 à 40% maximum) a été observée lorsque la dompéridone est prise de façon concomitante à la lévodopa.
La voie métabolique principale de la dompéridone implique le CYP3A4. Les données in vitro suggèrent que l’administration concomitante de médicaments qui inhibent le CYP3A4 de façon importante peut entraîner l’augmentation des concentrations plasmatiques de dompéridone.
Risque accru d’allongement de l’intervalle QT en raison d’interactions pharmacodynamiques et/ou pharmacocinétiques.
Associations contre-indiquées
Médicaments qui allongent l'intervalle QTc (risque de torsades de pointes)
· antiarythmiques de classe IA (par exemple disopyramide, hydroquinidine, quinidine)
· antiarythmiques de classe III (par exemple amiodarone, dofétilide, dronédarone, ibutilide, sotalol)
· certains antipsychotiques (par exemple halopéridol, pimozide, sertindole)
· certains antidépresseurs (par exemple citalopram, escitalopram)
· certains antibiotiques (par exemple érythromycine, lévofloxacine, moxifloxacine, spiramycine)
· certains antifongiques (par exemple fluconazole, pentamidine)
· certains antipaludéens (en particulier halofantrine, lumefantrine)
· certains médicaments à visée digestive (par exemple cisapride, dolasétron, prucalopride)
· certains antihistaminiques (par exemple méquitazine, mizolastine)
· certains anticancéreux (par exemple torémifène, vandétanib, vincamine)
· certains autres médicaments (par exemple bépridil, diphémanil, méthadone)
· apomorphine, sauf si le bénéfice de l’administration concomitante est supérieur aux risques, et uniquement si les précautions recommandées pour l’administration concomitante sont strictement respectées. Veuillez-vous reporter au RCP de l’apomorphine.
(voir rubrique 4.3).
Inhibiteurs puissants du CYP3A4 (quels que soient leurs effets d'allongement de l'intervalle QT), c’est-à-dire :
· anti-protéases (par exemple, ritonavir, saquinavir et télaprévir)
· antifongiques azolés systémiques (par exemple, itraconazole, kétoconazole, posaconazole, voriconazole)
· certains antibiotiques de la classe des macrolides (par exemple, clarithromycine et télithromycine)
(voir rubrique 4.3).
Associations déconseillées
Inhibiteurs modérés du CYP3A4, c’est-à-dire diltiazem, vérapamil et certains macrolides.
Associations faisant l'objet de précautions d’emploi
La prudence est de rigueur avec les médicaments qui induisent une bradycardie et une hypokaliémie ainsi qu'avec les macrolides suivants, qui allongent l'intervalle QT : azithromycine et roxithromycine (la clarithromycine est contre-indiquée car elle est un inhibiteur puissant du CYP3A4).
La liste de substances citées ci-dessus est représentative et non exhaustive.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il existe peu de données après commercialisation sur l’utilisation de la dompéridone chez les femmes enceintes. Une étude chez le rat a montré un effet toxique sur la reproduction en cas de dose élevée, toxique pour la mère. Le risque éventuel chez l’homme est inconnu. De ce fait, MOTILIUM ne doit être utilisé pendant la grossesse que lorsque le bénéfice thérapeutique attendu le justifie.
Allaitement
La dompéridone est excrétée dans le lait maternel humain et les enfants allaités reçoivent moins de 0,1 % de la dose maternelle ajustée selon le poids. La survenue d'effets indésirables, en particulier des effets cardiaques, ne peut être exclue après l'exposition via le lait maternel. Une décision doit être prise d'arrêter l'allaitement ou d'interrompre/de s’abstenir du traitement par la dompéridone en tenant compte du bénéfice de l'allaitement pour l'enfant et du bénéfice du traitement pour la mère. La prudence est de rigueur en présence de facteurs de risque d'allongement de l'intervalle QTc chez les enfants allaités.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Une somnolence et des sensations vertigineuses ont été observées suite à l’utilisation de dompéridone (voir rubrique 4.8). En conséquence, les patients doivent être informés qu’ils ne doivent pas conduire ni utiliser de machines, ni se livrer à d’autres activités nécessitant de la vigilance et de la coordination, avant de connaître l’effet que MOTILIUM produit sur eux.
La sécurité d’emploi de la dompéridone a été évaluée au cours d’essais cliniques et lors de l’expérience après commercialisation. Les essais cliniques (31 études en double-aveugle, contrôlées versus placebo) ont inclus 1 275 patients présentant une dyspepsie, un reflux gastro-œsophagien (RGO), un syndrome du côlon irritable, des nausées et des vomissements ou d’autres pathologies similaires.
Tous les patients étaient âgés d’au moins 15 ans et ont reçu au moins une dose de MOTILIUM (dompéridone base). La dose quotidienne totale médiane était de 30 mg (intervalle de 10 à 80 mg). La durée médiane d’exposition était de 28 jours (intervalle de 1 à 28 jours).
Les études réalisées chez des patients présentant des gastroparésies diabétiques, des symptômes secondaires à des chimiothérapies ou une maladie de Parkinson ont été exclues.
Les effets indésirables sont classés selon leur fréquence, selon la convention suivante : très fréquent (≥1/10), fréquent (≥1/100 à <1/10), peu fréquent (≥1/1 000 à <1/100), rare (≥1/10 000 à <1/1 000), très rare (<1/10 000).
Lorsque la fréquence n’a pas pu être estimée sur la base des données cliniques, elle est indiquée comme « indéterminée ».
|
Système Organe Classe |
Effet indésirable Fréquence |
||
|
Fréquent |
Peu fréquent |
Indéterminée |
|
|
Affections du système immunitaire |
|
|
Réaction anaphylactique (incluant choc anaphylactique) |
|
Affections Psychiatriques |
|
Perte de la libido Anxiété Agitation Nervosité |
|
|
Affections du système nerveux |
|
Sensations vertigineuses Somnolence Céphalées Troubles extrapyramidaux |
Convulsions Syndrome des jambes sans repos* |
|
Affections oculaires |
|
|
Crise oculogyre |
|
Affections cardiaques |
|
|
Arythmies ventriculaires Allongement de l’intervalle QTc Torsade de pointes Mort subite (voir rubrique 4.4) |
|
Affections Gastro-intestinales |
Bouche sèche |
Diarrhées |
|
|
Affections de la peau et du tissu sous-cutané |
|
Eruption cutanée Prurit Urticaire |
Angioedème |
|
Affections du rein et des voies urinaires |
|
|
Rétention urinaire |
|
Affections des organes de reproduction et du sein |
|
Galactorrhée Douleur mammaire Hypersensibilité mammaire |
Gynécomastie Aménorrhée |
|
Troubles généraux et anomalies au site d’administration |
|
Asthénie |
|
|
Investigations |
|
|
Anomalies des tests de la fonction hépatique Augmentation de la prolactinémie |
* exacerbation du syndrome des jambes sans repos chez les patients atteints de maladie de Parkinson
La dompéridone a été utilisée à des doses plus élevées dans 45 études cliniques de plus longue durée et dans des indications telles que les gastroparésies diabétiques. Dans ces études, la fréquence des évènements indésirables (excepté la bouche sèche) était considérablement plus élevée, en particulier les effets pharmacologiques connus et liés à l’augmentation de la prolactine. En plus des effets listés ci-dessus, ont également été observés les effets suivants : akathisie, écoulement mammaire, augmentation du volume des seins, gonflement des seins, dépression, hypersensibilité, troubles de la lactation et irrégularité des règles.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Symptômes
Les cas de surdosage ont été rapportés essentiellement chez les nourrissons et les enfants. Les symptômes de surdosage peuvent inclure agitation, troubles de la conscience, convulsions, désorientation, somnolence et réactions extrapyramidales.
Traitement
Il n’existe pas d’antidote spécifique à la dompéridone. En cas de surdosage, un traitement symptomatique standard doit être administré immédiatement. Une surveillance ECG est recommandée en raison de la possibilité d'allongement de l'intervalle QT. Une surveillance médicale étroite et un traitement symptomatique sont recommandés.
Les médicaments anti-cholinergiques ou anti-parkinsoniens peuvent être utiles pour contrôler les troubles extrapyramidaux.
Il est conseillé de contacter un centre antipoison afin d’obtenir les dernières recommandations dans la prise en charge du surdosage.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Stimulants de la motricité intestinale, code ATC : A03FA03.
La dompéridone est un antagoniste de la dopamine aux propriétés antiémétiques qui ne traverse pas facilement la barrière hémato-encéphalique. Chez les utilisateurs de dompéridone, en particulier chez les adultes, les troubles extrapyramidaux sont très rares, mais la dompéridone entraîne la libération de prolactine par l’hypophyse. Son effet antiémétique semble dû à une combinaison d’effets périphériques (motilité gastrique) et à un antagonisme des récepteurs dopaminergiques dans la zone de stimulation des chimiorécepteurs, située hors de la barrière hémato-encéphalique, dans l’area postrema. Les études chez l’animal, ainsi que les faibles concentrations trouvées dans le cerveau, indiquent un effet périphérique prédominant de la dompéridone sur les récepteurs dopaminergiques. Les études chez l’homme ont montré que la dompéridone per os augmente le tonus du sphincter inférieur de l’œsophage, améliore la motilité antroduodénale et accélère la vidange gastrique. Il n’y a pas d’effet sur la sécrétion gastrique.
Conformément à la directive ICHE14, une étude approfondie de l'intervalle QT a été réalisée. Cette étude comportait un placebo, un comparateur actif et un témoin positif et elle a été conduite chez des sujets sains à une dose de 10 ou 20 mg de dompéridone administrée 4 fois par jour jusqu'à une dose quotidienne maximale de 80 mg. Cette étude a mis en évidence une différence maximale de l'intervalle QTc entre la dompéridone et le placebo (d'après la méthode des moindres carrés pour la variation par rapport à l'inclusion) de 3,4 ms avec 20 mg de dompéridone administrés 4 fois par jour au Jour 4. L'IC bilatéral à 90 % (1,0 à 5,9 ms) n'a pas dépassé 10 ms. Aucun effet cliniquement pertinent sur l'intervalle QTc n'a été observé dans cette étude lorsque la dompéridone a été administrée jusqu'à une dose de 80 mg/jour (c’est-à-dire, plus de deux fois la dose maximale recommandée).
Toutefois, deux études antérieures d'interactions médicamenteuses ont montré un certain allongement de l'intervalle QTc en cas d'administration de la dompéridone en monothérapie (10 mg 4 fois par jour). La différence moyenne la plus importante de l'intervalle QTcF, ajustée en fonction du temps, entre la dompéridone et le placebo a été respectivement de 5,4 ms (IC à 95 % : -1,7 à 12,4) et 7,5 ms (IC à 95 % : 0,6 à 14,4).
Les études cliniques chez le nourrisson et chez l’enfant de 12 ans et moins
Une étude prospective multicentrique, en double aveugle, randomisée, contrôlée versus placebo et en groupes parallèles a été menée pour évaluer la sécurité et l'efficacité de dompéridone chez 292 enfants âgés de 6 mois à 12 ans atteints de gastro-entérite aiguë (âge médian 7 ans). En plus du traitement par réhydratation orale (TRO), les sujets randomisés ont reçu une suspension orale de dompéridone à raison de 0,25 mg / kg (jusqu'à un maximum de 30 mg de dompéridone / jour), ou un placebo, 3 fois par jour pendant 7 jours au maximum. Dans cette étude, le critère principal n’a pas été atteint : la suspension de dompéridone associée au TRO n’a pas démontré une efficacité supérieure au placebo associé au TRO pour réduire les vomissements au cours des premières 48 heures après la première administration du traitement (voir rubrique 4.2).
5.2. Propriétés pharmacocinétiques
Absorption
La dompéridone est rapidement absorbée après administration orale, avec un pic de concentration plasmatique atteint en 1 h environ. Les valeurs de la Cmax et de l'aire sous la courbe (ASC) de la dompéridone augmentent proportionnellement à la dose dans l'intervalle de doses comprises entre 10 mg et 20 mg. Une augmentation de 2 à 3 fois de l'ASC de la dompéridone a été observée en cas d'administrations répétées quatre fois par jour (toutes les 5 h) de dompéridone pendant 4 jours.
Bien que la biodisponibilité de la dompéridone soit plus élevée chez les sujets sains en cas de prise après un repas, les patients ayant des troubles gastro-intestinaux doivent prendre la dompéridone 15 à 30 minutes avant le repas. Une acidité gastrique réduite diminue l’absorption de la dompéridone.
La biodisponibilité orale diminue en cas d’administration concomitante préalable de cimétidine et de bicarbonate de sodium.
Distribution
La dompéridone se lie entre 91 et 93 % aux protéines plasmatiques. Des études de distribution chez l’animal avec des médicaments radiomarqués ont montré une large distribution dans les tissus, mais une faible concentration dans le cerveau. De faibles quantités de produit actif traversent le placenta chez la rate.
Biotransformation
La dompéridone subit un métabolisme hépatique rapide et important par hydroxylation et N-désalkylation. Les études de métabolisme in vitro utilisant des inhibiteurs diagnostiques ont révélé que le CYP3A4 est une forme majeure du cytochrome P-450 jouant un rôle dans la N-désalkylation de la dompéridone, alors que le CYP3A4, le CYP1A2 et le CYP2E1 interviennent dans l’hydroxylation aromatique de la dompéridone.
Élimination
Les excrétions urinaires et fécales représentent respectivement 31 et 66 % de la dose orale. La proportion de produit excrété sous forme inchangée est faible (10 % des excrétions fécales et environ 1 % des excrétions urinaires). La demi-vie plasmatique après une dose orale unique est de 7 à 9 heures chez les sujets sains, mais est prolongée chez les patients souffrant d’insuffisance rénale sévère.
Insuffisance hépatique
Chez les sujets présentant une insuffisance hépatique modérée (score de Pugh de 7 à 9, classification B de Child-Pugh), l’ASC et la Cmax de la dompéridone sont respectivement 2,9 et 1,5 fois supérieures à celles de sujets sains. La fraction libre est augmentée de 25% et la demi-vie d’élimination terminale est prolongée, passant de 15 à 23 heures. Les sujets atteints d’une légère insuffisance hépatique montrent, sur la base de la Cmax et de l'ASC, une exposition systémique légèrement inférieure à celle des sujets sains, sans qu'il y ait de changement dans la liaison aux protéines ni dans la demi-vie terminale. Aucune étude n'a été menée chez des sujets atteints d'insuffisance hépatique sévère. MOTILIUM est contre-indiqué chez les patients atteints d'une insuffisance hépatique modérée ou sévère (voir rubrique 4.3).
Insuffisance rénale
Chez les sujets présentant une insuffisance rénale sévère (clairance de la créatinine < 30 ml/min/1,73 m2), la demi-vie de la dompéridone a été augmentée, passant de 7,4 à 20,8 heures, mais les taux plasmatiques du médicament sont inférieurs à ceux observés chez des sujets sains. Étant donné que la dompéridone n'est que très faiblement excrétée sous forme inchangée (environ 1 %) via les reins, il est peu probable que, lors d'une administration unique, la dose doive être ajustée chez les patients atteints d’insuffisance rénale. Cependant, en cas d'administrations répétées, la fréquence d'administration doit être réduite à une ou deux prises par jour en fonction du degré de l'insuffisance rénale et une diminution de la dose peut s'avérer nécessaire.
5.3. Données de sécurité préclinique
Des études électrophysiologiques réalisées in vitro et in vivo indiquent que chez l'être humain, la dompéridone induit un risque global modéré d'allongement de l'intervalle QTc. Lors d'études réalisées in vitro sur des cellules isolées ayant subi une transfection du gène hERG et sur des myocytes isolés de cobayes, les rapports d'exposition variaient entre 26 et 47 fois, sur la base des IC 50 inhibant la conduction à travers les canaux ioniques IKr, par rapport aux concentrations plasmatiques libres observées chez l'être humain après l'administration de la dose quotidienne maximale de 10 mg trois fois par jour. Au cours d'études in vitro réalisées sur des tissus cardiaques isolés, les marges de sécurité pour l'allongement de la durée du potentiel d'action étaient 45 fois supérieures aux concentrations plasmatiques libres observées chez l'être humain en cas d'administration de la dose quotidienne maximale (10 mg trois fois par jour). Dans les modèles pro-arythmiques in vitro (cœur isolé perfusé selon la méthode de Langendorff), les marges de sécurité étaient entre 9 et 45 fois supérieures aux concentrations plasmatiques libres observées chez l'être humain en cas d'administration de la dose quotidienne maximale (10 mg trois fois par jour). Dans des modèles in vivo, les doses sans effet sur l'allongement de l'intervalle QTc chez le chien et sur l'induction d'arythmies dans un modèle de lapin sensibilisé aux torsades de pointe étaient respectivement 22 fois et 435 fois supérieures aux concentrations plasmatiques libres observées chez l'être humain en cas d'administration de la dose quotidienne maximale (10 mg trois fois par jour).
Dans le modèle de cobaye anesthésié après des perfusions intraveineuses lentes, aucun effet sur l'intervalle QTc n'a été observé à des concentrations plasmatiques totales de 45,4 ng/ml, qui sont 3 fois supérieures aux concentrations plasmatiques totales observées chez l'être humain en cas d'administration de la dose quotidienne maximale (10 mg trois fois par jour). La pertinence de cette dernière étude pour l'être humain après l'exposition à la dompéridone administrée par voie orale est incertaine.
En cas d'inhibition du métabolisme dépendant du CYP3A4, les concentrations plasmatiques libres de dompéridone peuvent être multipliées jusqu'à 3 fois.
Chez le rat, en cas d'administration de doses toxiques élevées à la mère (plus de 40 fois la posologie recommandée chez l'être humain), on a observé la survenue d'effets tératogènes. Chez la souris et le lapin, aucune tératogénicité n'a été observée.
Polysorbate 20, solution d’hydroxyde de sodium, cellulose microcristalline et carmellose sodique, sorbitol liquide à 70 pour cent (non cristallisable) (E420), parahydroxybenzoate de méthyle (E218), parahydroxybenzoate de propyle (E216), saccharine sodique, eau purifiée.
Sans objet.
Avant ouverture : 3 ans.
Après première ouverture du flacon, le médicament doit être conservé maximum 3 mois.
6.4. Précautions particulières de conservation
Ce médicament ne nécessite aucune condition de conservations particulières.
6.5. Nature et contenu de l'emballage extérieur
Flacon de 100 ou 200 ml (verre brun) muni d’une capsule sécurité-enfant avec :
· bouchon doseur de 10 ml (pour l’utilisation chez l’adulte et l’adolescent à partir de 12 ans et de 35 kg).
6.6. Précautions particulières d’élimination et de manipulation
Agiter doucement le flacon en l’inclinant pour bien mélanger le contenu sans former de mousse.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
JANSSEN CILAG
167 QUAI DE LA BATAILLE DE STALINGRAD
92130 ISSY-LES-MOULINEAUX
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 323 409 8 9 : 200 ml en flacon (verre brun) et bouchon doseur.
· 34009 300 591 1 1 : 100 ml en flacon (verre brun) et bouchon doseur.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Liste II.
ANSM - Mis à jour le : 22/01/2025
MOTILIUM 1 mg/ml, suspension buvable
Dompéridone
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que MOTILIUM 1 mg/ml, suspension buvable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre MOTILIUM 1 mg/ml, suspension buvable ?
3. Comment prendre MOTILIUM 1 mg/ml, suspension buvable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver MOTILIUM 1 mg/ml, suspension buvable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE MOTILIUM 1 mg/ml, suspension buvable ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Stimulants de la motricité intestinale - code ATC : A03FA03
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE MOTILIUM 1 mg/ml, suspension buvable ?
Ne prenez jamais MOTILIUM 1 mg/ml, suspension buvable :
· si vous êtes allergique à la dompéridone ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· si vous avez des saignements de l’estomac ou si vous avez régulièrement des douleurs abdominales sévères ou des selles noires persistantes ;
· si vous avez les intestins obstrués ou perforés ;
· si vous avez une tumeur de la glande pituitaire (prolactinome) ;
· si vous souffrez d’une maladie modérée ou sévère du foie ;
· si votre ECG (électrocardiogramme) montre un problème cardiaque appelé allongement de l'intervalle QT corrigé ;
· si vous avez ou avez eu un problème qui fait que votre cœur ne peut pas pomper le sang dans l'ensemble de votre corps aussi bien qu'il le devrait (affection appelée insuffisance cardiaque) ;
· si vous avez un problème qui entraîne une diminution du taux de potassium ou de magnésium ou une augmentation du taux de potassium dans votre sang ;
· si vous prenez certains médicaments (voir « Autres médicaments et MOTILIUM 1 mg/ml, suspension buvable »).
Avertissements et précautions
Adressez-vous à votre médecin avant de prendre MOTILIUM si vous :
· souffrez de problèmes au foie (défaillance des fonctions du foie ou insuffisance hépatique) (voir rubrique « Ne prenez jamais MOTILIUM 1 mg/ml, suspension buvable ») ;
· souffrez de problèmes aux reins (défaillance des fonctions du rein ou insuffisance rénale). Vous devez demander conseil à votre médecin en cas de traitement prolongé car vous devrez peut-être prendre une dose plus faible ou prendre ce médicament moins souvent et votre médecin pourra être amené à vous examiner régulièrement.
La dompéridone peut être associée à un risque accru de trouble du rythme cardiaque et d’arrêt cardiaque. Ce risque peut être plus élevé chez les patients de plus de 60 ans ou chez ceux prenant des doses supérieures à 30 mg par jour. Le risque est également plus élevé lorsque la dompéridone est administrée avec certains médicaments. Prévenez votre médecin ou votre pharmacien si vous prenez des médicaments pour traiter des infections (infections fongiques ou bactériennes) et/ou si vous avez des problèmes au cœur ou le SIDA (voir rubrique « Autres médicaments et MOTILIUM 1 mg/ml, suspension buvable »).
MOTILIUM doit être utilisé à la dose efficace la plus faible.
Pendant le traitement par MOTILIUM, contactez votre médecin si vous présentez des troubles du rythme cardiaque, tels que des palpitations, des difficultés à respirer, une perte de conscience. Le traitement par MOTILIUM devra alors être arrêté.
Enfants et adolescents pesant moins de 35 kg
MOTILIUM ne doit pas être donné aux adolescents âgés de plus 12 ans et pesant moins de 35 kg, ni aux enfants âgés de moins de 12 ans car il n’est pas efficace pour ces tranches d’âge.
Autres médicaments et MOTILIUM 1 mg/ml, suspension buvable
Ne prenez jamais MOTILIUM si vous prenez des médicaments pour traiter les pathologies suivantes :
· infections fongiques, par exemple la pentamidine ou les antifongiques azolés, en particulier l’itraconazole, le kétoconazole oral, le fluconazole, le posaconazole ou le voriconazole ;
· infections bactériennes, en particulier l’érythromycine, la clarithromycine, la télithromycine, la lévofloxacine, la moxifloxacine, la spiramycine (ce sont des antibiotiques) ;
· problèmes cardiaques ou une hypertension artérielle (par exemple l’amiodarone, la dronédarone, l’ibutilide, la disopyramide, le dofétilide, le sotalol, l’hydroquinidine, la quinidine) ;
· psychose (par exemple l’halopéridol, le pimozide, le sertindole) ;
· dépression (par exemple le citalopram, l’escitalopram) ;
· troubles gastro-intestinaux (par exemple le cisapride, le dolasetron, le prucalopride) ;
· allergie (par exemple la méquitazine, la mizolastine) ;
· paludisme (en particulier l’halofantrine, la luméfantrine) ;
· VIH/SIDA tels que le ritonavir ou le saquinavir (ce sont des inhibiteurs de protéase) ;
· hépatite C (par exemple le télaprévir) ;
· cancer (par exemple le torémifène, le vandétanib, la vincamine).
Ne prenez pas MOTILIUM si vous prenez certains autres médicaments (par exemple le bépridil, le diphémanil, la méthadone).
Prévenez votre médecin ou votre pharmacien si vous prenez des médicaments pour traiter une infection, des problèmes cardiaques, le VIH/SIDA ou la maladie de Parkinson.
Avant que vous n’utilisiez MOTILIUM et l’apomorphine, votre médecin s’assurera que vous tolérez les deux médicaments lorsqu'ils sont utilisés simultanément. Interrogez votre médecin ou votre spécialiste pour obtenir un conseil personnalisé. Veuillez-vous reporter à la notice de l’apomorphine.
Il est important de demander à votre médecin ou à votre pharmacien si MOTILIUM est sûr pour vous lorsque vous prenez d’autres médicaments, y compris des médicaments délivrés sans ordonnance.
MOTILIUM 1 mg/ml, suspension buvable avec des aliments et boissons
Prenez MOTILIUM avant les repas. S’il est pris après les repas, son absorption est quelque peu retardée.
Le risque associé à la prise de MOTILIUM pendant la grossesse n’est pas connu.
Si vous êtes enceinte ou pensez que vous pouvez l’être, consultez votre médecin qui décidera si vous pouvez prendre MOTILIUM.
De petites quantités de dompéridone ont été détectées dans le lait maternel. MOTILIUM peut entraîner des effets indésirables sur le cœur du nourrisson allaité. MOTILIUM doit être utilisé au cours de l’allaitement uniquement si votre médecin le juge absolument nécessaire. Demandez conseil à votre médecin avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
Certains patients ont rapporté des sensations vertigineuses ou une somnolence après la prise de MOTILIUM. Ne conduisez pas ou n’utilisez pas de machines lorsque vous prenez MOTILIUM, avant de connaître l’effet que MOTILIUM produit sur vous.
MOTILIUM 1 mg/ml, suspension buvable contient du sorbitol (E 420), du parahydroxybenzoate de méthyle (E 218) et du parahydroxybenzoate de propyle (E 216)
MOTILIUM contient moins de 1 mmol de sodium (23 mg) dans chaque ml, ce qui signifie qu’il est essentiellement "sans sodium".
MOTILIUM contient 445 mg de sorbitol (E 420) dans chaque ml, qui peut causer une gêne gastro-intestinale et un effet laxatif léger. Le sorbitol est aussi une source de fructose. Si votre médecin vous a informé(e) que vous (ou votre enfant) présentiez une intolérance à certains sucres ou si vous avez été diagnostiqué(e) avec une intolérance héréditaire au fructose (IHF), un trouble génétique rare caractérisé par l'incapacité à décomposer le fructose, parlez-en à votre médecin avant que vous ne preniez ce médicament.
MOTILIUM contient également du parahydroxybenzoate de méthyle (E 218) et du parahydroxybenzoate de propyle (E 216). Ces substances peuvent provoquer des réactions allergiques (éventuellement retardées), et exceptionnellement, des bronchospasmes.
3. COMMENT PRENDRE MOTILIUM 1 mg/ml, suspension buvable ?
Respectez strictement ces instructions sauf en cas d'indication contraire de votre médecin.
Prenez MOTILIUM avant les repas. S’il est pris après les repas, son absorption est quelque peu retardée.
Durée du traitement
Les symptômes disparaissent habituellement en 3 à 4 jours de prise du médicament. Ne prenez pas MOTILIUM au-delà de 7 jours sans consulter votre médecin.
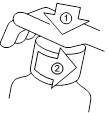
Le flacon est protégé par un bouchon de sécurité enfant. Pour ouvrir le flacon, appuyez sur le bouchon en plastique, tout en tournant dans le sens inverse des aiguilles d’une montre, comme indiqué ci-dessous.
|
|
Agiter doucement le flacon avec un léger mouvement d’inclinaison afin d’éviter la formation de mousse.
Adultes et adolescents à partir de 12 ans et de 35 kg
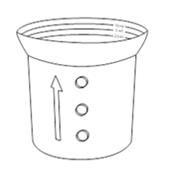
· Un bouchon doseur est fourni avec ce médicament. Ce bouchon comporte 3 traits correspondant à 2,5 ml, 5 ml et 10 ml (ainsi, le bouchon doseur contiendra 10 ml de suspension buvable lorsqu’il sera rempli jusqu’au trait du haut)
· Utilisez le bouchon doseur dans le sens où il est posé sur le flacon. Assurez-vous que le côté avec les graduations (le côté avec le plus petit contenant) soit en haut ; c’est le côté que vous devez remplir. Si la flèche sur le côté pointe vers le haut, le bouchon doseur est dans le bon sens
|
|
· Mesurez la quantité nécessaire avec le bouchon doseur
· Ne diluez pas MOTILIUM et ne le mélangez pas à d’autres liquides
· La dose habituelle est de 10 ml jusqu’à trois fois par jour si possible avant les repas. Ne prenez pas plus de 30 ml par jour (cela équivaut à 3 bouchons doseurs remplis jusqu’au trait du haut)
· Nettoyez le bouchon doseur après utilisation.
Si vous avez pris plus de MOTILIUM 1 mg/ml, suspension buvable que vous n’auriez dû
Si vous avez utilisé ou pris trop de MOTILIUM, contactez immédiatement votre médecin, votre pharmacien ou un centre antipoison. En cas de surdosage, un traitement symptomatique peut être administré. Une surveillance électrocardiographique peut être instaurée en raison de la possibilité de survenue d'un problème cardiaque appelé allongement de l'intervalle QT.
Informations pour le médecin : une surveillance attentive et un traitement symptomatique sont recommandés. Un traitement anti-parkinsonien anti-cholinergique peut aider à neutraliser les troubles extrapyramidaux.
Si vous oubliez de prendre MOTILIUM 1 mg/ml, suspension buvable
Si vous arrêtez de prendre MOTILIUM 1 mg/ml, suspension buvable
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Peu fréquent (peut toucher jusqu’à 1 personne sur 100) :
· Mouvements involontaires de la face ou des bras et des jambes, tremblements excessifs, raideur musculaire excessive ou spasmes musculaires
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
· Convulsions
· Réaction pouvant survenir rapidement après l’administration et se traduisant par une éruption cutanée, des démangeaisons, un essoufflement, et/ou un gonflement du visage
· Réaction d’hypersensibilité sévère pouvant survenir rapidement après l’administration, caractérisée par de l’urticaire, des démangeaisons, des rougeurs, un évanouissement et des difficultés respiratoires, entre autres symptômes possibles.
· Affections du système cardiovasculaire : des troubles du rythme cardiaque (battements cardiaques rapides ou irréguliers) ont été rapportés ; si tel est le cas, vous devez arrêter immédiatement le traitement. La dompéridone peut être associée à un risque accru de troubles du rythme cardiaque et d'arrêt cardiaque. Ce risque peut être plus élevé chez les patients de plus de 60 ans ou chez ceux prenant des doses supérieures à 30 mg par jour. La dompéridone doit être utilisée à la dose efficace la plus faible.
Arrêtez le traitement par MOTILIUM et contactez immédiatement votre médecin si vous présentez un des évènements indésirables décrits ci-dessus.
D’autres effets indésirables observés avec MOTILIUM sont listés ci-dessous :
Fréquent (peut toucher jusqu’à 1 personne sur 10) :
· Bouche sèche.
Peu fréquent (peut toucher jusqu’à 1 personne sur 100) :
· Anxiété
· Agitation
· Nervosité
· Perte ou diminution de l’intérêt pour le sexe
· Maux de tête
· Somnolence
· Diarrhée
· Eruption cutanée
· Démangeaisons
· Urticaire
· Seins douloureux ou sensibles
· Ecoulement de lait par le mamelon
· Sensation générale de faiblesse
· Sensations vertigineuses.
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
· Mouvements incontrôlés des yeux, les fixant vers le haut
· Arrêt des règles chez la femme.
· Augmentation du volume des seins chez l’homme
· Incapacité d'uriner
· Changements de certains résultats d’analyses de laboratoire
· Syndrome des jambes sans repos (sensation d’inconfort avec un besoin irrésistible de bouger les jambes, et parfois les bras et d’autres parties de votre corps).
Certains patients qui ont utilisé MOTILIUM dans des conditions et à des posologies nécessitant une surveillance médicale ont subi les effets indésirables suivants :
Agitation, gonflement ou augmentation du volume des seins, écoulement inhabituel des seins, règles irrégulières chez la femme, difficultés à allaiter, dépression, hypersensibilité.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER MOTILIUM 1 mg/ml, suspension buvable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte. La date d’expiration « EXP » fait référence au dernier jour du mois indiqué. Les deux premiers chiffres indiquent le mois, les suivants l’année.
Après première ouverture du flacon, le médicament doit être conservé maximum 3 mois.
Ce médicament ne nécessite aucune condition de conservations particulières.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient MOTILIUM 1 mg/ml, suspension buvable
· La substance active est :
Dompéridone..................................................................................................................... 1 mg
Pour 1 ml de suspension buvable.
· Les autres composants sont :
Polysorbate 20, solution d’hydroxyde de sodium, cellulose microcristalline et carmellose sodique, sorbitol liquide à 70 pour cent (non cristallisable) (E420), parahydroxybenzoate de méthyle (E218), parahydroxybenzoate de propyle (E216), saccharine sodique, eau purifiée.
Qu’est-ce que MOTILIUM 1 mg/ml, suspension buvable et contenu de l’emballage extérieur
Ce médicament se présente sous forme d’une suspension buvable en flacon de 100 ou 200 ml et un bouchon doseur.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
167 QUAI DE LA BATAILLE DE STALINGRAD
92130 ISSY-LES-MOULINEAUX
Exploitant de l’autorisation de mise sur le marché
167 QUAI DE LA BATAILLE DE STALINGRAD
92130 ISSY-LES-MOULINEAUX
TURNHOUTSEWEG 30
2340 BEERSE
BELGIQUE
ou
JOHNSON & JOHNSON CONSUMER NV/SA
Michel De Braeystraat 52
2000 Antwerpen
BELGIQUE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
[1] Indiquer le libellé détaillé qui figure dans l’application form avec le code de la modification selon les lignes directrices https://ec.europa.eu/health//sites/health/files/files/eudralex/vol-2/c_2013_2008/c_2013_2008_pdf/c_2013_2804_fr.pdf