Dernière mise à jour le 08/01/2026
TADALAFIL TEVA 20 mg, comprimé pelliculé sécable
Indications thérapeutiques
Classe pharmacothérapeutique - code ATC : G04BE08
TADALAFIL TEVA est un traitement pour les hommes adultes ayant un dysfonction érectile, c’est-à-dire quand un homme ne peut atteindre ou conserver une érection suffisante pour une activité sexuelle. Il a été montré que TADALAFIL TEVA améliorait significativement la capacité à obtenir une érection ferme du pénis nécessaire à une activité sexuelle.
TADALAFIL TEVA contient une substance active le tadalafil, qui appartient à un groupe de médicament appelés inhibiteurs de la phosphodiestérase de type 5.A la suite d’une stimulation sexuelle, TADALAFIL TEVA agit en aidant la relaxation des vaisseaux sanguins de votre pénis, favorisant ainsi l’afflux sanguin. Il en résulte une amélioration de l’érection. TADALAFIL TEVA ne vous aidera pas si vous n’avez pas de problème d’érection.
Il est important de savoir que TADALAFIL TEVA, n’agit pas s'il n’y a pas de stimulation sexuelle. Vous et votre partenaire devrez engager les préliminaires comme vous le feriez si vous ne preniez pas de médicament pour votre problème d’érection.
Présentations
> 4 plaquette(s) PVC PVDC aluminium de 1 comprimé(s)
Code CIP : 34009 302 930 3 4
Déclaration de commercialisation : 18/03/2025
Cette présentation est agréée aux collectivités
> 8 plaquette(s) PVC PVDC aluminium de 1 comprimé(s)
Code CIP : 34009 302 930 4 1
Déclaration de commercialisation : 19/08/2024
Cette présentation est agréée aux collectivités
> 24 plaquette(s) PVC PVDC aluminium de 1 comprimé(s)
Code CIP : 34009 302 930 5 8
Déclaration de commercialisation : 26/07/2024
Cette présentation est agréée aux collectivités
> 4 plaquette(s) PVC (ACLAR RX) polytrifluorochloroéthylène PVC-Aluminium de 1 comprimé(s)
Code CIP : 34009 300 946 3 1
Déclaration d'arrêt de commercialisation : 29/04/2025
Cette présentation n'est pas agréée aux collectivités
> 24 plaquette(s) PVC (ACLAR RX) polytrifluorochloroéthylène PVC-Aluminium de 1 comprimé(s)
Code CIP : 34009 300 946 5 5
Déclaration d'arrêt de commercialisation : 03/10/2024
Cette présentation n'est pas agréée aux collectivités
> 8 plaquette(s) PVC (ACLAR RX) polytrifluorochloroéthylène PVC-Aluminium de 1 comprimé(s)
Code CIP : 34009 301 024 8 0
Déclaration d'arrêt de commercialisation : 03/10/2024
Cette présentation n'est pas agréée aux collectivités
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 23/11/2022 | Inscription (CT) | le service médical rendu par les spécialités TADALAFIL TEVA 2,5 mg, 5 mg, 10 mg, 20 mg, en comprimés pelliculés est important uniquement chez les hommes adultes ayant des troubles de l’érection liés à l’une des pathologies suivantes : • Paraplégie et tétraplégie quelle qu’en soit l’origine . • Traumatismes du bassin compliqués de troubles urinaires . • Séquelles de la chirurgie (anévrisme de l’aorte . prostatectomie radicale, cystectomie totale et exérèse colorectale) ou de la radiothérapie abdominopelvienne . • Séquelles de priapisme . • Neuropathie diabétique . • Sclérose en plaques . • Et chez ceux ayant un trouble de l’érection dû à un traitement au long cours par un antipsychotique. |
| Insuffisant | Avis du 23/11/2022 | Inscription (CT) | Dans les autres situations de l’AMM, le service médical rendu par TADALAFIL TEVA (tadalafil) est insuffisant pour une prise en charge par la solidarité nationale. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 23/11/2022 | Inscription (CT) | Les spécialités TADALAFIL TEVA (tadalafil) 2,5 mg, 5 mg, 10 mg et 20 mg, comprimés pelliculés, n’apportent pas d’amélioration du service médical rendu (ASMR V) par rapport aux autres spécialités à base de tadalafil déjà disponibles. |
ANSM - Mis à jour le : 11/10/2024
TADALAFIL TEVA 20 mg, comprimé pelliculé sécable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Tadalafil................................................................................................................................. 20 mg
Pour un comprimé pelliculé.
Excipient à effet notoire :
Chaque comprimé pelliculé de 20 mg contient environ 353 mg de lactose (sous forme monohydratée).
Pour la liste complète des excipients, voir rubrique 6.1.
Les comprimés sont ovales, de couleur ocre à jaune. Une face du comprimé est quadrisécable. L’autre face du comprimé comporte la mention « 20 » gravée en creux. Longueur : 15,0 mm. Largeur : 9,0 mm.
Le comprimé peut être divisé en deux ou quatre doses égales.
4.1. Indications thérapeutiques
Traitement de la dysfonction érectile chez l’homme adulte.
Une stimulation sexuelle est requise pour que tadalafil soit efficace dans le traitement de la dysfonction érectile.
Traitement des signes et symptômes de l'hypertrophie bénigne de la prostate chez l’homme adulte.
TADALAFIL TEVA n’est pas indiqué chez la femme.
4.2. Posologie et mode d'administration
Dysfonction érectile chez les hommes adultes
D’une manière générale, la dose recommandée de TADALAFIL TEVA est de 10 mg à prendre avant toute activité sexuelle prévue, pendant ou à distance des repas.
Chez les patients pour lesquels une dose de 10 mg de tadalafil ne produit pas un effet suffisant, une dose de 20 mg peut être préconisée. TADALAFIL TEVA peut être pris au moins 30 minutes avant toute activité sexuelle.
La fréquence d'administration maximale est d'une prise par jour.
Le tadalafil 10 mg et le tadalafil 20 mg sont indiqués en prévision d’un rapport sexuel mais ils ne sont pas recommandés pour une utilisation quotidienne prolongée.
Chez les patients qui prévoient un usage fréquent de TADALAFIL TEVA (au moins deux fois par semaine), la prise d’un comprimé par jour, avec des doses plus faibles de TADALAFIL TEVA peut être considérée comme adéquate, la décision dépendant du choix du patient et de l’avis du médecin.
Chez ces patients, la posologie recommandée est de 5 mg en prise quotidienne, approximativement au même moment de la journée. La dose peut être réduite à 2,5 mg en prise quotidienne, en fonction de la tolérance individuelle.
Le choix de la posologie quotidienne doit être réévalué périodiquement.
Hypertrophie bénigne de la prostate chez les hommes adultes
La dose recommandée est de 5 mg à prendre approximativement au même moment de la journée, avec ou sans nourriture. Chez les hommes adultes traités à la fois pour une hypertrophie bénigne de la prostate et une dysfonction érectile, la dose recommandée est également de 5 mg à prendre approximativement au même moment de la journée.
Les patients qui ne tolèrent pas 5 mg de tadalafil pour traiter une hypertrophie bénigne de la prostate doivent envisager de prendre un autre traitement. En effet, l'efficacité de 2,5 mg de tadalafil dans l'hypertrophie bénigne de la prostate n'a pas été démontrée.
Populations particulières
Hommes âgés
Aucun ajustement posologique n'est nécessaire chez les hommes âgés.
Hommes atteints d’insuffisance rénale
Aucun ajustement posologique n'est nécessaire chez les patients atteints d’insuffisance rénale légère à modérée. Chez les patients atteints d'insuffisance rénale sévère, la dose maximale recommandée est 10 mg en traitement à la demande. Une prise quotidienne de 2,5 ou 5 mg de tadalafil pour le traitement de la dysfonction érectile et de l’hypertrophie bénigne de la prostate n’est pas recommandée chez les patients présentant une insuffisance rénale sévère (voir rubriques 4.4 et 5.2).
Hommes atteints d’insuffisance hépatique
Pour le traitement de la dysfonction érectile en administration à la demande, la dose recommandée de tadalafil est de 10 mg à prendre avant toute activité sexuelle prévue, pendant ou en dehors des repas. Chez les patients présentant une insuffisance hépatique sévère (classe C de Child-Pugh), les données cliniques de tolérance sont limitées ; de ce fait, en cas de prescription de tadalafil, une évaluation individuelle attentive du rapport bénéfice/risque devra être effectuée par le médecin prescripteur. Chez les patients atteints d’insuffisance hépatique, aucune donnée n’est disponible sur l'administration de doses supérieures à 10 mg de tadalafil.
La prise quotidienne de tadalafil pour le traitement de la dysfonction érectile et de l’hypertrophie bénigne de la prostate n'a pas été évaluée chez les patients atteints d'insuffisance hépatique ; par conséquent, le médecin devra procéder à une évaluation individuelle attentive du rapport bénéfice/risque après la prescription (voir rubriques 4.4 et 5.2).
Hommes atteints de diabète
Aucun ajustement posologique n'est nécessaire chez les patients diabétiques.
Population pédiatrique
L’utilisation de tadalafil dans le traitement de la dysfonction érectile dans la population pédiatrique n’est pas justifiée.
Mode d’administration
TADALAFIL TEVA est disponible en comprimés pelliculés dosés à 20 mg pour une utilisation par voie orale.
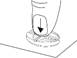
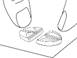
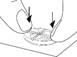
Diviser le comprimé en quatre (avec 5 mg de tadalafil pour une administration une fois par jour)
|
Placer le comprimé avec les barres de sécabilité vers le haut sur une surface dure et plane (p. ex., le plateau d’une table). |
|
|
Appuyer avec force pendant un court instant avec le pouce (ou l'index) sur la face supérieure du comprimé comportant les barres de sécabilité jusqu’à ce qu'il se brise en quatre parties égales. |
|
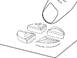
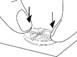
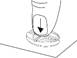
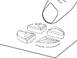
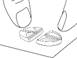
Diviser le comprimé en deux (avec 10 mg de tadalafil pour une administration à la demande)
|
Placer le comprimé avec les barres de sécabilité vers le haut sur une surface dure et plane (p. ex., le plateau d’une table). |
|
|
Placer les pouces (ou les index) des deux mains en même temps sur les côtés gauche et droit de la barre de sécabilité la plus courte du comprimé. Appuyer avec force pendant un court instant avec les deux pouces (ou index) sur les côtés gauche et droit de l'extérieur du comprimé jusqu'à ce qu'il se brise en deux parties égales. |
|
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
Lors des essais cliniques, il a été montré que le tadalafil potentialisait l'effet hypotenseur des dérivés nitrés. Cela résulterait des effets conjugués des dérivés nitrés et du tadalafil sur la voie monoxyde d’azote/GMPc. Le tadalafil est donc contre-indiqué chez les patients qui reçoivent des dérivés nitrés sous n’importe quelle forme (voir rubrique 4.5).
Le tadalafil ne doit pas être utilisé chez les hommes atteints de maladie cardiaque et pour qui l'activité sexuelle est déconseillée. Les médecins doivent évaluer le risque cardiaque potentiel de l’activité sexuelle chez les patients ayant des antécédents cardiovasculaires.
Les groupes de patients présentant les antécédents cardiovasculaires suivants n'ayant pas été inclus dans les essais cliniques, l'utilisation du tadalafil est donc contre-indiquée chez :
· les patients ayant présenté un infarctus du myocarde au cours des 90 derniers jours,
· les patients souffrant d'angor instable ou présentant des douleurs angineuses pendant les rapports sexuels,
· les patients ayant présenté une insuffisance cardiaque supérieure ou égale à la classe 2 de la classification NYHA (New York Heart Association) au cours des 6 derniers mois,
· les patients présentant des troubles du rythme non contrôlés, une hypotension artérielle (< 90/50 mmHg) ou une hypertension artérielle non contrôlée,
· les patients ayant eu un accident vasculaire cérébral au cours des 6 derniers mois.
Le tadalafil est contre-indiqué chez les patients ayant une perte de la vision d’un œil due à une neuropathie optique ischémique antérieure non artéritique (NOIAN), que cet événement ait été associé ou non à une exposition antérieure à un inhibiteur de la PDE5 (voir rubrique 4.4).
L’administration concomitante d’inhibiteurs de PDE5, tels que le tadalafil, avec les stimulateurs de la guanylate cyclase, tels que le riociguat, est contre-indiquée en raison du risque d’hypotension symptomatique (voir rubrique 4.5).
4.4. Mises en garde spéciales et précautions d'emploi
Avant traitement par TADALAFIL TEVA
Le recueil des antécédents médicaux et un examen clinique doivent être réalisés afin de diagnostiquer une dysfonction érectile ou une hypertrophie bénigne de la prostate et d'en déterminer les causes sous-jacentes potentielles avant d'envisager un traitement pharmacologique.
Avant d’instaurer tout traitement de la dysfonction érectile, les médecins doivent prendre en compte l'état cardiovasculaire de leurs patients, l'activité sexuelle s'accompagnant d'un certain risque cardiaque. Le tadalafil est doté de propriétés vasodilatatrices, à l'origine de baisses légères et transitoires de la pression artérielle (voir rubrique 5.1) et, à ce titre, il potentialise l'effet hypotenseur des dérivés nitrés (voir rubrique 4.3).
Avant d’instaurer tout traitement de l'hypertrophie bénigne de la prostate avec le tadalafil, les patients doivent être examinés afin d’exclure la présence d'un cancer de la prostate. Une évaluation de l’état cardiovasculaire doit être effectuée avec soin (voir rubrique 4.3).
L'évaluation de la dysfonction érectile doit comporter la recherche d’éventuelles causes sous-jacentes et l’identification d’un traitement adéquat après un examen médical approprié. L’efficacité du tadalafil chez les patients ayant subi une intervention chirurgicale pelvienne ou une prostatectomie radicale sans préservation des bandelettes nerveuses n’est pas connue.
Atteintes cardiovasculaires
Des événements cardiovasculaires graves, tels qu’infarctus du myocarde, mort subite d’origine cardiaque, angor instable, arythmie ventriculaire, accidents ischémiques cérébraux et accidents ischémiques transitoires, douleur thoracique, palpitations et tachycardie ont été rapportés après la commercialisation et/ou lors des essais cliniques. La plupart des patients chez qui ces événements ont été observés présentaient des facteurs de risque cardiovasculaire préexistants. Cependant, il n’est pas possible de déterminer avec certitude si ces événements sont directement liés à ces facteurs de risque, au tadalafil, à l’activité sexuelle, à une association de ces facteurs, ou à d’autres facteurs.
Chez les patients recevant des médicaments antihypertenseurs, l’administration concomitante de tadalafil peut entraîner une baisse de la pression artérielle. Le médecin devra envisager une adaptation éventuelle de la posologie du traitement antihypertenseur, lors de l’initiation du traitement quotidien par tadalafil.
Chez certains patients recevant des alpha1-bloquants, l’administration concomitante de tadalafil peut conduire à une hypotension symptomatique (voir rubrique 4.5). L’administration simultanée de tadalafil et de doxazosine n’est donc pas recommandée.
Atteintes ophtalmiques
Des anomalies visuelles, incluant la choriorétinopathie séreuse centrale (CRSC) et des cas de NOIAN (neuropathie optique ischémique antérieure non artéritique) ont été rapportés à la suite de la prise de tadalafil et d’autres inhibiteurs de la PDE5. Dans la plupart des cas, CRSC s’est résolue spontanément après l’arrêt du tadalafil. Concernant la NOIAN, les analyses des données observationnelles suggèrent une augmentation du risque de NOIAN aiguë après administration de tadalafil ou d’autres inhibiteurs de la PDE5 chez les hommes présentant une dysfonction érectile. Ce risque peut concerner tous les patients exposés au tadalafil. Par conséquent, les patients doivent être avertis que, en cas d’anomalie visuelle soudaine, de diminution de l’acuité visuelle et/ou de distorsion visuelle, ils doivent arrêter la prise de TADALAFIL TEVA et consulter immédiatement un médecin (voir rubrique 4.3).
Diminution ou perte soudaine de l’audition
Des cas de perte soudaine de l’audition ont été rapportés suivant l’utilisation de tadalafil. Bien que des facteurs de risque associés étaient présents dans certains cas (tels que l’âge, un diabète, une hypertension ou des antécédents de diminution de l’audition), les patients doivent être avertis qu’ils doivent arrêter la prise de tadalafil et consulter rapidement un médecin en cas de diminution ou de perte soudaine de l’audition.
Insuffisances rénale et hépatique
En raison d’une augmentation de l'exposition au tadalafil (ASC), d’une expérience clinique limitée et de l'impossibilité de modifier la clairance par une dialyse, la prise quotidienne de tadalafil n’est pas recommandée chez les patients atteints d'insuffisance rénale sévère.
Les données cliniques concernant la sécurité d'emploi du tadalafil à dose unique chez les patients atteints d'insuffisance hépatique sévère (classe C de Child-Pugh) sont limitées. La prise quotidienne pour le traitement de la dysfonction érectile ou de l’hypertrophie bénigne de la prostate n'a pas été évaluée chez l'insuffisant hépatique. Si TADALAFIL TEVA est prescrit, le médecin prescripteur devra procéder à une évaluation individuelle du rapport bénéfice/risque.
Priapisme et malformation anatomique du pénis
Les patients ayant des érections d’une durée de 4 heures ou plus doivent être informés qu’il faut chercher une assistance médicale immédiate. Si le priapisme n’est pas traité immédiatement, des lésions du tissu pénien et une impuissance permanente peuvent en résulter.
Le tadalafil doit être utilisé avec prudence chez les patients présentant une malformation anatomique du pénis (comme une angulation, une sclérose des corps caverneux ou la maladie de La Peyronie) ou chez les patients présentant des pathologies susceptibles de les prédisposer au priapisme (comme une drépanocytose, un myélome multiple ou une leucémie).
Utilisation avec des inhibiteurs du CYP3A4
TADALAFIL TEVA doit être prescrit avec prudence chez les patients utilisant des inhibiteurs sélectifs du CYP3A4 (ritonavir, saquinavir, kétoconazole, itraconazole et érythromycine), une augmentation de l’exposition (ASC) au tadalafil ayant été observée en association avec ces médicaments (voir rubrique 4.5).
TADALAFIL TEVA et autres traitements de la dysfonction érectile
L'efficacité et la sécurité d'emploi de l’association du tadalafil à d'autres inhibiteurs de la PDE5 ou à d’autres traitements de la dysfonction érectile n'ont pas été étudiées. Les patients devront être informés de ne pas recourir à de telles associations.
Excipients
Lactose
Les patients présentant une intolérance au galactose, un déficit en lactase ou un syndrome de malabsorption du glucose et du galactose (maladies héréditaires rares) ne doivent pas prendre ce médicament.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par comprimé pelliculé, c.-à-d. qu’il est essentiellement « sans sodium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Effets d'autres substances sur le tadalafil
Inhibiteurs du cytochrome P450
Le tadalafil est principalement métabolisé par le CYP3A4. En présence d’un inhibiteur sélectif du CYP3A4, le kétoconazole (200 mg par jour), l’exposition (ASC) au tadalafil (10 mg) est multipliée par 2 et la Cmax majorée de 15 % par rapport aux valeurs de l’ASC et de la Cmax observées sous tadalafil seul. A la dose de 400 mg par jour, le kétoconazole multiplie par 4 l’exposition (ASC) au tadalafil (20 mg) et augmente la Cmax de 22 %. Le ritonavir, antiprotéase inhibiteur du CYP3A4, CYP2C9, CYP2C19 et du CYP2D6 (200 mg deux fois par jour), multiplie par 2 l’exposition (ASC) au tadalafil (20 mg), sans modification de la Cmax. Bien que les interactions spécifiques n'aient pas été étudiées, d’autres antiprotéases, comme le saquinavir, et d'autres inhibiteurs du CYP3A4, comme l'érythromycine, la clarithromycine, l'itraconazole et le jus de pamplemousse, doivent être co-administrés avec prudence car ils sont susceptibles d'augmenter les concentrations plasmatiques de tadalafil (voir rubrique 4.4).
L'incidence des effets indésirables mentionnés à la rubrique 4.8 pourrait par conséquent être augmentée.
Transporteurs
Le rôle des transporteurs (comme la glycoprotéine P) dans la phase de distribution du tadalafil n'est pas connu. Ainsi, il existe donc un risque potentiel d'interactions médicamenteuses dues à l'inhibition des transporteurs.
Inducteurs du cytochrome P450
La rifampicine, inducteur du CYP3A4, diminue de 88 % l’ASC du tadalafil par rapport aux ASC déterminées pour le tadalafil seul (10 mg). Cette diminution peut réduire l'efficacité du tadalafil ; la valeur de cette réduction n’est pas connue. Une diminution des concentrations plasmatiques du tadalafil ne peut être écartée lors de l’association à d’autres inducteurs du CYP3A4, tels que le phénobarbital, la phénytoïne et la carbamazépine.
Effets du tadalafil sur d’autres médicaments
Dérivés nitrés
Les études cliniques ont montré que le tadalafil (5, 10 et 20 mg) majorait les effets hypotenseurs des dérivés nitrés. L’administration de tadalafil à des patients qui reçoivent des dérivés nitrés sous n’importe quelle forme est donc contre-indiquée (voir rubrique 4.3). Les résultats d’une étude clinique réalisée chez 150 patients ayant reçu des doses quotidiennes de 20 mg de tadalafil pendant 7 jours, et 0,4 mg de trinitrine sublinguale à des moments variés ont montré que cette interaction a duré plus de 24 heures et n’était plus détectable 48 heures après la dernière prise de tadalafil.
Ainsi, chez un patient prenant du tadalafil quelle que soit la dose (2,5 mg - 20 mg), et chez qui l’administration d’un dérivé nitré est jugée nécessaire pour le pronostic vital, un délai minimum de 48 heures après la dernière prise de tadalafil doit être respecté, avant d’administrer un dérivé nitré. Dans ce cas, les dérivés nitrés ne doivent être administrés que sous un contrôle médical strict comprenant une surveillance hémodynamique appropriée.
Antihypertenseurs (y compris les inhibiteurs calciques)
L’administration concomitante de doxazosine (4 mg et 8 mg par jour) et de tadalafil (5 mg en dose quotidienne et 20 mg en dose unique) augmente de manière significative l’effet hypotenseur de cet alpha-bloquant. Cet effet peut se prolonger pendant au moins douze heures et se manifester par des symptômes tels que des syncopes. Par conséquent, cette association n’est pas recommandée (voir rubrique 4.4).
Dans des études d’interaction réalisées chez un nombre limité de volontaires sains, ces effets n’ont pas été rapportés avec l’alfuzosine et la tamsulosine. Cependant, chez des patients traités par des alpha-bloquants, et notamment chez les personnes âgées, l’utilisation du tadalafil se fera avec prudence. Les traitements doivent être débutés à la dose minimale ; et l’ajustement posologique devra se faire progressivement.
La possibilité que le tadalafil puisse augmenter les effets hypotenseurs des médicaments antihypertenseurs a été évaluée dans des études de pharmacologie clinique. Les classes majeures de médicaments antihypertenseurs ont été étudiées, incluant les inhibiteurs calciques (amlodipine), les inhibiteurs de l’enzyme de conversion de l’angiotensine (IEC) (énalapril), les bêta-bloquants (métoprolol), les diurétiques thiazidiques (bendrofluméthiazide) et les antagonistes des récepteurs de l’angiotensine II (de type et posologie variés, seuls ou en association avec des diurétiques thiazidiques, des inhibiteurs calciques, des bêta-bloquants et/ou des alpha-bloquants). Aucun effet cliniquement significatif n’a été observé après la prise de tadalafil (10 mg à l’exception des études réalisées avec des antagonistes des récepteurs de l’angiotensine II et l’amlodipine, dans lesquelles une dose de 20 mg a été utilisée) en association avec un traitement de l’une ou l’autre de ces classes. Dans une autre étude de pharmacologie clinique, le tadalafil (20 mg) a été étudié en association avec jusqu’à 4 classes d’antihypertenseurs. Chez les sujets prenant plusieurs antihypertenseurs, les modifications de la pression artérielle en ambulatoire semblent être corrélées au degré de contrôle de la pression artérielle. A cet égard, chez les patients de cette étude ayant une pression artérielle correctement contrôlée, la diminution était minime et similaire à celle observée chez le volontaire sain. Chez les patients dont la pression artérielle n’était pas contrôlée, la diminution était plus importante bien qu’elle n’ait pas été associée à une symptomatologie hypotensive chez la majorité d’entre eux. Chez les patients traités simultanément par des médicaments antihypertenseurs, le tadalafil 20 mg peut induire une baisse de la pression artérielle (à l’exception des alpha-bloquants, voir ci-dessus), généralement mineure et vraisemblablement sans conséquence clinique. L’analyse des données des essais cliniques de phase III n’a pas montré de différence concernant les événements indésirables survenus chez les patients prenant du tadalafil avec ou sans traitement antihypertenseur. Cependant, des conseils cliniques appropriés doivent être donnés aux patients concernant la possibilité d'une diminution de la pression artérielle en cas de traitement concomitant par des médicaments antihypertenseurs.
Riociguat
Les études précliniques ont montré une majoration de l’effet hypotenseur systémique lorsque les inhibiteurs des PDE5 étaient associés avec le riociguat. Dans les études cliniques, il a été démontré que le riociguat augmentait les effets hypotenseurs des inhibiteurs des PDE5. Il n’a pas été mis en évidence de bénéfice de l’association dans la population étudiée. L’utilisation concomitante du riociguat avec les inhibiteurs des PDE5, tels que le tadalafil, est contre-indiquée (voir rubrique 4.3).
Inhibiteurs de la 5-alpha réductase
Dans un essai clinique comparant l’administration simultanée de 5 mg de tadalafil et 5 mg de finastéride à un placebo et 5 mg de finastéride pour soulager les symptômes de l’hypertrophie bénigne de la prostate, aucun nouvel effet indésirable n'a été identifié. Aucune étude d'interaction médicamenteuse évaluant les effets du tadalafil et des inhibiteurs de la 5-alpha réductase (5-ARI) n’ayant été effectuée, il conviendra d’être prudent en cas d’administration concomitante de tadalafil et de 5-ARI.
Substrats du CYP1A2 (par exemple la théophylline)
Une étude de pharmacologie clinique d’administration concomitante de tadalafil 10 mg et de théophylline (un inhibiteur non sélectif de la phosphodiestérase) n'a montré aucune interaction pharmacocinétique.
Le seul effet pharmacodynamique rapporté a été une légère augmentation (3,5 battements/min) de la fréquence cardiaque. Même si dans cette étude cet effet a été considéré comme mineur et sans signification clinique, cet effet devra être cependant pris en considération en cas d'administration concomitante de ces médicaments.
Ethinylestradiol et terbutaline
Il a été montré que le tadalafil entraînait une augmentation de la biodisponibilité orale de l'éthinylestradiol ; une augmentation similaire est prévisible en cas d'administration orale de terbutaline, même si la conséquence clinique de cette augmentation est incertaine.
Alcool
Les concentrations en alcool (concentration sanguine maximale moyenne de 0,08 %) n'ont pas été affectées par l'administration concomitante de tadalafil (10 ou 20 mg). En particulier, aucune modification des concentrations de tadalafil n'a été observée trois heures après l'administration concomitante d'alcool, l’alcool étant administré de manière à favoriser son absorption (jeûne pendant une nuit et absence d’alimentation jusqu’à 2 heures après la prise d’alcool).
Le tadalafil (20 mg) n’augmente pas la baisse moyenne de la pression artérielle due à l’alcool (à la dose de 0,7 g/kg soit approximativement 180 ml d’alcool à 40 % [vodka] chez un homme de 80 kg). Chez certains sujets, des sensations de vertiges et une hypotension orthostatique ont été observées. Lorsque le tadalafil était administré avec de plus faibles doses d’alcool (0,6 g/kg), aucune hypotension n’était observée. De même, les sensations de vertiges étaient aussi fréquentes que lors de la prise d’alcool seul. Le tadalafil (10 mg) n’augmente pas l’effet de l'alcool sur les fonctions cognitives.
Médicaments métabolisés par le cytochrome P450
Le tadalafil ne devrait pas entraîner d'inhibition ou d'induction cliniquement significative de la clairance des médicaments métabolisés par les isoformes du CYP450. Des études ont confirmé que le tadalafil n'est pas un inhibiteur ou un inducteur des isoformes du CYP450, dont le CYP3A4, CYP1A2, CYP2D6, CYP2E1, CYP2C9 et CYP2C19.
Substrats du CYP2C9 (par exemple la warfarine-R)
Le tadalafil (10 mg et 20 mg) n'a pas d'effet cliniquement significatif sur l'exposition (ASC) à la warfarine-S ou à la warfarine-R (substrat du CYP2C9), et n'affecte pas les changements du taux de prothrombine induits par la warfarine.
Acide acétylsalicylique
Le tadalafil (10 mg et 20 mg) ne potentialise pas l'augmentation du temps de saignement provoquée par l'acide acétylsalicylique.
Médicaments antidiabétiques
Aucune étude d'interaction spécifique avec les traitements antidiabétiques n'a été conduite.
4.6. Fertilité, grossesse et allaitement
TADALAFIL TEVA n'est pas indiqué chez la femme.
Grossesse
Les données existantes de l'utilisation du tadalafil chez la femme enceinte sont limitées. Les études chez l'animal ne révèlent pas d'effets nocifs, directs ou indirects, sur le déroulement de la grossesse, le développement de l'embryon/du fœtus, l’accouchement et le développement postnatal (voir rubrique 5.3). Par mesure de précaution, il est préférable d’éviter l’utilisation de tadalafil pendant la grossesse.
Allaitement
Les données pharmacodynamiques/toxicologiques disponibles chez l’animal ont mis en évidence l’excrétion de tadalafil dans le lait. Un risque pour les enfants allaités ne peut être exclu. Le tadalafil ne doit pas être utilisé pendant l’allaitement.
Fertilité
Des effets pouvant être un indicateur d’une altération de la fertilité ont été observés chez des chiens. De plus, deux études cliniques suggèrent que ces effets sont peu probables chez l’Homme, malgré une diminution de la concentration du sperme observée chez certains hommes (voir rubriques 5.1 et 5.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil de sécurité
Les effets indésirables les plus fréquemment rapportés chez les patients prenant du tadalafil pour le traitement de la dysfonction érectile ou de l’hypertrophie bénigne de la prostate sont les suivants : céphalées, dyspepsie, douleurs dorsales et myalgies dont les incidences augmentent avec l’augmentation de la dose de tadalafil. Les effets indésirables rapportés étaient transitoires et, généralement d'intensité légère ou modérée. La majorité des céphalées rapportées avec le tadalafil en prise quotidienne surviennent dans les 10 à 30 premiers jours suivant le début du traitement.
Tableau récapitulatif des effets indésirables
Le tableau ci-dessous présente les effets indésirables observés à partir de déclarations spontanées et dans les essais cliniques contrôlés versus placebo (portant sur un total de 8 022 patients traités par tadalafil et de 4 422 patients sous placebo) pour un traitement à la demande et en prise quotidienne de la dysfonction érectile et un traitement en prise quotidienne de l’hypertrophie bénigne de la prostate.
Convention en matière de fréquence : très fréquent (≥ 1/10), fréquent (≥ 1/100, < 1/10), peu fréquent (≥ 1/1 000, < 1/100), rare (≥ 1/10 000, < 1/1 000), très rare (< 1/10 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
Très fréquent |
Fréquent |
Peu fréquent |
Rare |
Fréquence indéterminée |
|
Affections du système immunitaire |
|
|||
|
|
|
Réactions d’hypersensibilité |
Œdème de Quincke2 |
|
|
Affections du système nerveux |
|
|||
|
|
Céphalées |
Sensations vertigineuses |
Accident vasculaire cérébral1 (y compris évènements hémorragiques), Syncope, Accidents ischémiques transitoires1, Migraine2, Convulsions, Amnésie transitoire |
|
|
Affections oculaires |
|
|||
|
|
|
Vision trouble, Sensations décrites comme des douleurs oculaires |
Anomalie du champ visuel, Œdème des paupières, Hyperhémie conjonctivale, Neuropathie optique ischémique antérieure non-artéritique (NOIAN)2, Occlusion vasculaire rétinienne2 |
Choriorétinopathie séreuse centrale |
|
Affections de l’oreille et du labyrinthe |
|
|||
|
|
|
Acouphènes |
Perte soudaine de l’audition |
|
|
Affections cardiaques1 |
|
|||
|
|
|
Tachycardie, Palpitations |
Infarctus du myocarde, Angor instable2, Arythmie ventriculaire2 |
|
|
Affections vasculaires |
|
|||
|
|
Bouffées vasomotrices |
Hypotension3, Hypertension |
|
|
|
Affections respiratoires, thoraciques et médiastinales |
|
|||
|
|
Congestion nasale |
Dyspnée, Epistaxis |
|
|
|
Affections gastro-intestinales |
|
|||
|
|
Dyspepsie |
Douleur abdominale, Vomissements, Nausées, Reflux gastro-œsophagien |
|
|
|
Affections de la peau et du tissu sous-cutané |
|
|||
|
|
|
Rash |
Urticaire, Syndrome de Stevens-Johnson2, Dermatite exfoliative2, Hyperhidrose (transpiration excessive) |
|
|
Affections musculo-squelettiques et systémiques |
|
|||
|
|
Douleurs dorsales, Myalgies, Douleurs des extrémités |
|
|
|
|
Affections du rein et des voies urinaires |
|
|||
|
|
|
Hématurie |
|
|
|
Affections des organes de reproduction et du sein |
|
|||
|
|
|
Erections prolongées |
Priapisme, Hémorragie pénienne, Hémospermie |
|
|
Troubles généraux et anomalies au site d'administration |
|
|||
|
|
|
Douleur thoracique1, Œdème périphérique, Fatigue |
Œdème facial2, Mort subite d’origine cardiaque1,2 |
|
(1) La plupart des patients présentaient des facteurs de risque cardiovasculaires préexistants (voir rubrique 4.4).
(2) Des effets indésirables non observés dans les essais cliniques contrôlés versus placebo ont été rapportés lors de la surveillance après commercialisation.
(3) Plus souvent rapportée chez les patients prenant du tadalafil et déjà traités par des antihypertenseurs.
Description d’effets indésirables spécifiques
Une légère augmentation de l'incidence des anomalies de l'ECG, principalement une bradycardie sinusale, a été rapportée chez les patients traités par tadalafil en prise quotidienne, par rapport au placebo. La plupart de ces anomalies de l'ECG n'ont pas été associées à des effets indésirables.
Autres populations particulières
Les données issues des essais cliniques réalisés chez des patients de plus de 65 ans traités par tadalafil pour une dysfonction érectile ou une hypertrophie bénigne de la prostate sont limitées. Dans les essais cliniques réalisés chez des patients traités par du tadalafil à la demande pour une dysfonction érectile, des diarrhées ont été signalées plus fréquemment chez les patients de plus de 65 ans. Dans les essais cliniques réalisés chez des patients traités par 5 mg de tadalafil en prise quotidienne pour une hypertrophie bénigne de la prostate, des sensations vertigineuses et des diarrhées ont été signalées plus fréquemment chez les patients de plus de 75 ans.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Des doses uniques allant jusqu'à 500 mg ont été données à des sujets sains et des doses multiples allant jusqu’à 100 mg par jour ont été données à des patients. Les événements indésirables ont été similaires à ceux observés avec des doses plus faibles.
En cas de surdosage, les mesures habituelles de traitement symptomatique doivent être mises en œuvre selon les besoins. L’élimination du tadalafil par hémodialyse est négligeable.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
Le tadalafil est un inhibiteur sélectif et réversible de la phosphodiestérase de type 5 (PDE5), spécifique de la guanosine monophosphate cyclique (GMPc). Lorsque la stimulation sexuelle provoque la libération locale de monoxyde d’azote, l'inhibition de la PDE5 par le tadalafil entraîne une augmentation du taux de GMPc dans les corps caverneux. Il en résulte un relâchement des muscles lisses et l’afflux sanguin dans les tissus péniens, permettant ainsi l’obtention d’une érection. Le tadalafil n’a pas d’effet dans le traitement de la dysfonction érectile en l’absence de stimulation sexuelle.
L'effet de l'inhibition de la PDE5 sur la concentration de GMPc dans les corps caverneux s’observe également dans les muscles lisses de la prostate et de la vessie ainsi que sur leur vascularisation. Il en résulte une relaxation vasculaire, entraînant une augmentation de la perfusion sanguine, qui pourrait être le mécanisme par lequel s’opère la réduction des symptômes de l'hypertrophie bénigne de la prostate. A ces effets vasculaires pourraient s’ajouter l'inhibition de l'activité nerveuse afférente de la vessie et la relaxation des muscles lisses de la prostate et de la vessie.
Effets pharmacodynamiques
Des études in vitro ont montré que le tadalafil était un inhibiteur sélectif de la PDE5. La PDE5 est une enzyme présente dans les muscles lisses des corps caverneux, les muscles lisses vasculaires et viscéraux, les muscles squelettiques, les plaquettes, les reins, les poumons et le cervelet. L'effet du tadalafil est plus important sur la PDE5 que sur les autres phosphodiestérases. L’effet du tadalafil est > 10 000 fois plus puissant sur la PDE5 que sur la PDE1, la PDE2 et la PDE4, enzymes présentes dans le cœur, le cerveau, les vaisseaux sanguins, le foie et d'autres organes. L’effet du tadalafil est > 10 000 fois plus puissant sur la PDE5 que sur la PDE3, enzyme présente dans le cœur et les vaisseaux sanguins. Cette sélectivité pour la PDE5 par rapport à la PDE3 est importante car la PDE3 intervient dans la contractilité cardiaque. Par ailleurs, le tadalafil est environ 700 fois plus puissant sur la PDE5 que sur la PDE6, une enzyme présente dans la rétine qui est responsable de la phototransduction. Le tadalafil est également > 10 000 fois plus puissant sur la PDE5 que sur les enzymes PDE7 à PDE10.
Efficacité et sécurité clinique
Le tadalafil administré à des sujets sains n’a pas entraîné de différence significative, par rapport au placebo, de la pression artérielle systolique et diastolique en position allongée (baisse maximale moyenne de 1,6/0,8 mmHg, respectivement), de la pression artérielle systolique et diastolique en position debout (baisse maximale moyenne de 0,2/4,6 mmHg, respectivement), ni significativement modifié la fréquence cardiaque.
Dans une étude destinée à évaluer les effets du tadalafil sur la vision, aucune altération de la distinction entre les couleurs (bleu/vert) n'a été détectée par le test des 100 couleurs de Farnsworth-Munsell. Ce résultat est compatible avec la faible affinité du tadalafil pour la PDE6 par rapport à la PDE5. Au cours de toutes les études cliniques, des modifications de la vision des couleurs ont été rarement rapportées (< 0,1 %).
Trois études ont été conduites chez des hommes pour évaluer l’effet potentiel du tadalafil 10 mg (une étude de 6 mois) et 20 mg (une étude de 6 mois et une de 9 mois), administrés quotidiennement, sur la spermatogenèse. Dans deux de ces études, il a été observé une diminution du nombre des spermatozoïdes ainsi qu’une diminution de la concentration du sperme, en relation avec le traitement par tadalafil mais de signification clinique peu probable. Ces effets n’ont pas été associés à la modification des autres paramètres, tels que la mobilité et la morphologie des spermatozoïdes, ainsi que le taux de FSH (hormone folliculo-stimulante).
Dysfonction érectile
Trois études cliniques ont évalué en ambulatoire chez 1 054 patients la période de réponse au tadalafil à la demande. Le tadalafil améliore de façon statistiquement significative la fonction érectile et la possibilité d’avoir un rapport sexuel réussi jusqu’à 36 heures après la prise, ainsi que la possibilité pour les patients d’obtenir et de maintenir des érections suffisantes pour des rapports sexuels réussis, dès la 16e minute après la prise de la dose par rapport au placebo.
Le tadalafil a été évalué au cours de 16 essais cliniques à des doses variant de 2 à 100 mg, chez 3 250 patients atteints de dysfonction érectile de sévérité légère, modérée ou sévère et d’étiologies variées, d’âges (extrêmes 21-86 ans) et d’origines ethniques différents. La plupart des patients présentaient une dysfonction érectile depuis au moins un an. Dans les études sur la population générale où l’efficacité était le critère principal, 81 % des patients ont rapporté que le tadalafil améliorait leurs érections par comparaison à 35 % sous placebo. De même, les patients atteints de dysfonction érectile, quelle qu’en soit la sévérité, ont rapporté une amélioration des érections sous tadalafil (86 %, 83 % et 72 % pour les formes légères, modérées et sévères respectivement, par comparaison à 45 %, 42 % et 19 % sous placebo). Dans les études où l’efficacité était le critère principal, 75 % des tentatives de rapport sexuel ont été réussies chez les patients traités par tadalafil, par comparaison à 32 % sous placebo.
Dans une étude de 12 semaines réalisée chez 186 patients (142 sous tadalafil et 44 sous placebo) présentant une dysfonction érectile secondaire à une lésion de la moelle épinière, le tadalafil a amélioré de façon significative la fonction érectile conduisant à un pourcentage moyen de rapports sexuels réussis par sujet traité par tadalafil 10 ou 20 mg (dose flexible, à la demande) de 48 % chez les patients prenant du tadalafil par rapport à 17 % chez les patients traités par placebo.
Pour l’évaluation du tadalafil aux doses de 2,5, 5 et 10 mg en prise quotidienne, trois essais cliniques ont été menés initialement chez 853 patients atteints de dysfonction érectile de sévérité légère, modérée ou sévère, d’étiologies variées, d’âges (extrêmes 21– 82 ans) et d’origines ethniques différents. Dans les deux études d’efficacité sur la population générale, le pourcentage moyen des tentatives de rapport sexuel réussies était de 57 % et 67 % dans le groupe de patients traités par le tadalafil 5 mg, de 50 % dans le groupe de patients traités par le tadalafil 2,5 mg, par comparaison à 31 % et 37 % sous placebo. Dans l'étude menée chez des patients atteints de dysfonction érectile secondaire à un diabète, le pourcentage moyen des tentatives de rapport sexuel réussies était de 41 % et 46 % dans le groupe de patients traités respectivement par le tadalafil 5 mg et 2,5 mg, par comparaison à 28 % sous placebo. La plupart des patients de ces trois études étaient répondeurs à un précédent traitement à la demande par des inhibiteurs de la PDE5. Dans une étude ultérieure, 217 patients qui n’avaient jamais été traités par des inhibiteurs de la PDE5 ont été randomisés avec le tadalafil 5 mg en prise quotidienne versus placebo. Le pourcentage moyen des tentatives de rapport sexuel réussies était de 68 % pour les patients sous tadalafil par comparaison à 52 % pour les patients sous placebo.
Hypertrophie bénigne de la prostate
Le tadalafil a été étudié dans 4 études cliniques d’une durée de 12 semaines portant sur plus de 1 500 patients présentant des signes et symptômes d'hypertrophie bénigne de la prostate. L’amélioration avec le tadalafil 5 mg du score total du questionnaire IPSS (International Prostate Symptom Score) dans les quatre études était de -4,8, -5,6, -6,1 et de -6,3 comparativement à -2,2, -3,6, -3,8 et -4,2 avec le placebo. Les améliorations du score total du questionnaire IPSS se sont produites dès la première semaine. Dans l'une des études, qui comprenait également l’administration de tamsulosine 0,4 mg à titre de médicament comparateur actif, les améliorations du score total du questionnaire IPSS avec le tadalafil 5 mg, la tamsulosine et le placebo étaient respectivement de -6,3, -5,7 et -4,2.
L'une de ces études a évalué l'amélioration de la dysfonction érectile ainsi que des signes et symptômes de l'hypertrophie bénigne de la prostate chez les patients présentant les deux pathologies. Les améliorations du score du domaine de la fonction érectile du questionnaire IIEF (International Index of Erectile Function) et du score total du questionnaire IPSS dans cette étude étaient de 6,5 et -6,1 avec le tadalafil 5 mg, comparativement à 1,8 et -3,8 avec le placebo. Le pourcentage moyen de rapports sexuels réussis par sujet était de 71,9 % avec le tadalafil 5 mg comparativement à 48,3 % avec le placebo.
Le maintien de l'effet a été évalué en ouvert dans la phase de prolongation de l'une des études dans laquelle il a pu être démontré que l'amélioration du score total du questionnaire IPSS observé à 12 semaines était maintenue jusqu’à 1 année supplémentaire de traitement par tadalafil 5 mg.
Population pédiatrique
Une seule étude a été réalisée dans la population pédiatrique chez des enfants présentant une myopathie de Duchenne et dans laquelle aucune preuve d’efficacité n’a été constatée. L’étude était randomisée en 3 groupes parallèles, en double aveugle, contrôlée contre placebo, incluant 331 garçons âgés de 7 à 14 ans atteints de myopathie de Duchenne recevant simultanément un traitement par corticostéroïdes. L’étude comportait une période de 48 semaines en double-aveugle pendant laquelle les patients étaient randomisés pour recevoir quotidiennement du tadalafil 0,3 mg/kg, du tadalafil 0,6 mg/kg ou un placebo. Il n'a pas été mis en évidence d’efficacité du tadalafil en termes de réduction du déclin de la capacité à l’exercice mesurée par la distance de marche parcourue en 6 minutes qui était le critère principal. La variation moyenne de la distance de marche parcourue en 6 minutes à 48 semaines de traitement (méthode des moindres carrés) était de -51,0 mètres (m) dans le groupe placebo, comparé à -64,7 m dans le groupe tadalafil 0,3 mg/kg (p = 0,307) et -59,1 m dans le groupe tadalafil 0,6 mg/kg (p = 0,538). De plus, l’analyse des critères secondaires n’a pas mis en évidence d’efficacité. Les résultats de sécurité globale dans cette étude étaient dans l’ensemble cohérents avec le profil de sécurité connu du tadalafil et avec les effets indésirables attendus dans une population pédiatrique atteinte de myopathie de Duchenne recevant des corticostéroïdes.
L’Agence européenne des médicaments a accordé une dérogation à l’obligation de soumettre les résultats d’études réalisées dans tous les sous-groupes de la population pédiatrique dans le traitement de la dysfonction érectile. Voir rubrique 4.2 pour les informations concernant l’usage pédiatrique.
5.2. Propriétés pharmacocinétiques
Le tadalafil est facilement absorbé et les concentrations plasmatiques maximales (Cmax) moyennes observées sont atteintes en moyenne 2 heures après administration par voie orale. La biodisponibilité absolue du tadalafil après administration orale n'a pas été déterminée.
La vitesse et le taux d'absorption du tadalafil ne sont pas influencés par l'alimentation et TADALAFIL TEVA peut donc être pris pendant ou en dehors des repas. L'heure des prises (matin ou soir) n'a aucun effet cliniquement significatif sur la vitesse ou l'importance de l'absorption.
Distribution
Le volume moyen de distribution est d'environ 63 l, ce qui suggère que le tadalafil est distribué dans les tissus. Aux concentrations thérapeutiques, le tadalafil est lié à 94 % aux protéines plasmatiques. La liaison aux protéines n'est pas modifiée par l'insuffisance rénale.
Moins de 0,0005 % de la dose administrée se retrouvait dans le sperme des sujets sains.
Biotransformation
Le tadalafil est essentiellement métabolisé par l’iso-enzyme 3A4 du cytochrome P450 (CYP). Le principal métabolite circulant est le dérivé méthylcatéchol glucuronide. Ce métabolite est au moins 13 000 fois moins puissant que le tadalafil sur la PDE5. En conséquence, il ne devrait pas être cliniquement actif aux concentrations observées.
Elimination
La clairance moyenne du tadalafil est d'environ 2,5 l/h après administration par voie orale et la demi-vie moyenne est de 17,5 heures chez les sujets sains. Le tadalafil est essentiellement excrété sous forme de métabolites inactifs, principalement dans les selles (environ 61 % de la dose) et, à un moindre degré, dans les urines (environ 36 % de la dose).
Linéarité/non-linéarité
La pharmacocinétique du tadalafil chez les sujets sains est linéaire en termes de temps et de dose. Pour des doses comprises entre 2,5 et 20 mg, l’exposition systémique (ASC) augmente proportionnellement à la dose. Les concentrations plasmatiques à l'état d'équilibre sont atteintes dans les 5 jours qui suivent une prise unitaire quotidienne.
La pharmacocinétique déterminée chez des patients atteints de dysfonction érectile est semblable à la pharmacocinétique déterminée chez le sujet sain.
Populations particulières
Sujets âgés
Les sujets âgés sains (65 ans ou plus) avaient une clairance inférieure après administration orale de tadalafil, entraînant une exposition systémique (ASC) supérieure de 25 % à celle des sujets sains âgés de 19 à 45 ans. Cet effet lié à l'âge n'est pas cliniquement significatif et ne justifie pas d’ajustement posologique.
Insuffisance rénale
Des études de pharmacologie clinique utilisant des doses uniques de tadalafil (5 mg à 20 mg), ont montré que l’exposition au tadalafil (ASC) était approximativement doublée chez les sujets atteints d’insuffisance rénale légère (clairance de la créatinine 51 à 80 ml/min) ou modérée (clairance de la créatinine 31 à 50 ml/min), ainsi que chez les sujets présentant une insuffisance rénale terminale traités par hémodialyse. Chez les patients hémodialysés, la Cmax était supérieure de 41 % à celle observée chez des sujets sains.
L’élimination du tadalafil par hémodialyse est négligeable.
Insuffisance hépatique
L'exposition systémique (ASC) au tadalafil, chez les sujets présentant une insuffisance hépatique légère à modérée (classes A et B de Child-Pugh), est comparable à l'exposition systémique observée chez des sujets sains après administration d’une dose de 10 mg. Peu de données cliniques de tolérance sont disponibles chez les patients atteints d’insuffisance hépatique sévère (classe C de Child-Pugh). Aucune donnée n’est disponible sur l'administration en prise quotidienne de tadalafil chez les patients atteints d’insuffisance hépatique. Si TADALAFIL TEVA est prescrit, le médecin prescripteur devra procéder à une évaluation individuelle du rapport bénéfice/risque. Aucune donnée n'est disponible sur l'administration de doses supérieures à 10 mg de tadalafil chez les patients atteints d'insuffisance hépatique.
Patients diabétiques
L'exposition systémique (ASC) du tadalafil chez les sujets diabétiques est environ 19 % plus faible que l'ASC déterminée chez des sujets sains. Cette différence d'exposition ne nécessite pas d’ajustement posologique.
5.3. Données de sécurité préclinique
Aucun signe de tératogénicité, d'embryotoxicité ni de fœtotoxicité n'a été observé chez des rates ou des souris recevant jusqu'à 1 000 mg/kg/jour de tadalafil. Dans des études de développement prénatal et postnatal effectuées chez le rat, la dose sans effet était de 30 mg/kg/jour.
Chez la rate gestante, l'ASC correspondant au produit sous forme libre à cette dose était environ 18 fois plus élevée que l'ASC déterminée pour une dose de 20 mg chez l’homme.
Aucune altération de la fertilité n'a été observée chez les rats mâles et femelles. Chez les chiens ayant reçu quotidiennement du tadalafil pendant 6 à 12 mois à des doses de 25 mg/kg/jour (représentant une exposition au moins 3 fois supérieure [de 3,7 à 18,6] à celle observée chez l’homme à la dose unique de 20 mg) et plus, une régression de l'épithélium des tubes séminifères a été observée, entraînant une diminution de la spermatogenèse chez certains chiens. Voir également rubrique 5.1.
Lactose monohydraté, laurilsulfate de sodium, povidone K12, crospovidone, fumarate de stéaryle sodique.
Pelliculage
Poly(alcool vinylique), macrogol, dioxyde de titane (E171), talc, oxyde de fer jaune (E172).
3 ans.
6.4. Précautions particulières de conservation
Ce médicament ne nécessite pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
Plaquettes en (OPA/Aluminium/PVC/Aluminium).
Plaquettes en (PVC/ACLAR/PVC/Aluminium).
Plaquettes en (PVC/ACLAR/PVDC/PVC/Aluminium).
Plaquettes en (PVC/PVdC/Aluminium).
Boîtes de 2, 4, 5, 8, 10, 12, 15, 18, 24, 28, 36, 48 ou 56 comprimés pelliculés sous plaquettes ou de 2 x 1, 4 x 1, 8 x 1, 12 x 1, 24 x 1 ou 36 x 1 comprimé(s) pelliculé(s) sous plaquette prédécoupée unitaire.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
100-110 ESPLANADE DU GENERAL DE GAULLE
92931 PARIS LA DEFENSE CEDEX
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 300 943 3 4 : 2 comprimés pelliculés sous plaquettes (OPA/aluminium-PVC/aluminium).
· 34009 300 943 4 1 : 4 comprimés pelliculés sous plaquettes (OPA/aluminium-PVC/aluminium).
· 34009 300 943 5 8 : 5 comprimés pelliculés sous plaquettes (OPA/aluminium-PVC/aluminium).
· 34009 300 943 6 5 : 8 comprimés pelliculés sous plaquettes (OPA/aluminium-PVC/aluminium).
· 34009 300 943 7 2 : 10 comprimés pelliculés sous plaquettes (OPA/aluminium-PVC/aluminium).
· 34009 300 943 9 6 : 12 comprimés pelliculés sous plaquettes (OPA/aluminium-PVC/aluminium).
· 34009 300 944 0 2 : 15 comprimés pelliculés sous plaquettes (OPA/aluminium-PVC/aluminium).
· 34009 301 023 4 3: 18 comprimés pelliculés sous plaquettes (OPA/Aluminium-PVC/Aluminium).
· 34009 301 023 5 0: 24 comprimés pelliculés sous plaquettes (OPA/Aluminium-PVC/Aluminium).
· 34009 300 944 1 9 : 28 comprimés pelliculés sous plaquettes (OPA/aluminium-PVC/aluminium).
· 34009 550 360 4 3: 36 comprimés pelliculés sous plaquettes (OPA/Aluminium-PVC/Aluminium).
· 34009 550 360 5 0: 48 comprimés pelliculés sous plaquettes (OPA/Aluminium-PVC/Aluminium).
· 34009 300 944 2 6 : 2 comprimés pelliculés sous plaquettes (PVC/ACLAR/PVC/Aluminium).
· 34009 300 944 3 3 : 4 comprimés pelliculés sous plaquettes (PVC/ACLAR/PVC/Aluminium).
· 34009 300 944 5 7 : 5 comprimés pelliculés sous plaquettes (PVC/ACLAR/PVC/Aluminium).
· 34009 300 944 6 4 : 8 comprimés pelliculés sous plaquettes (PVC/ACLAR/PVC/Aluminium).
· 34009 300 944 7 1 : 10 comprimés pelliculés sous plaquettes (PVC/ACLAR/PVC/Aluminium).
· 34009 300 944 8 8 : 12 comprimés pelliculés sous plaquettes (PVC/ACLAR/PVC/Aluminium).
· 34009 300 944 9 5 : 15 comprimés pelliculés sous plaquettes (PVC/ACLAR/PVC/Aluminium).
· 34009 301 023 6 7: 18 comprimés pelliculés sous plaquettes (PVC/ACLAR/PVC/Aluminium).
· 34009 301 023 7 4: 24 comprimés pelliculés sous plaquettes (PVC/ACLAR/PVC/Aluminium).
· 34009 300 945 1 8 : 28 comprimés pelliculés sous plaquettes (PVC/ACLAR/PVC/Aluminium).
· 34009 550 360 6 7: 36 comprimés pelliculés sous plaquettes (PVC/ACLAR/PVC/Aluminium).
· 34009 550 360 7 4: 48 comprimés pelliculés sous plaquettes (PVC/ACLAR/PVC/Aluminium).
· 34009 300 945 2 5 : 2 comprimés pelliculés sous plaquettes (PVC/ACLAR/PVDC/PVC/Aluminium).
· 34009 300 945 3 2 : 4 comprimés pelliculés sous plaquettes (PVC/ACLAR/PVDC/PVC/Aluminium).
· 34009 300 945 4 9 : 5 comprimés pelliculés sous plaquettes (PVC/ACLAR/PVDC/PVC/Aluminium).
· 34009 300 945 5 6 : 8 comprimés pelliculés sous plaquettes (PVC/ACLAR/PVDC/PVC/Aluminium).
· 34009 300 945 6 3 : 10 comprimés pelliculés sous plaquettes (PVC/ACLAR/PVDC/PVC/Aluminium).
· 34009 300 945 7 0 : 12 comprimés pelliculés sous plaquettes (PVC/ACLAR/PVDC/PVC/Aluminium).
· 34009 300 945 8 7 : 15 comprimés pelliculés sous plaquettes (PVC/ACLAR/PVDC/PVC/Aluminium).
· 34009 301 023 8 1: 18 comprimés pelliculés sous plaquettes (PVC/ACLAR/PVDC/PVC/Aluminium).
· 34009 301 023 9 8: 24 comprimés pelliculés sous plaquettes (PVC/ACLAR/PVDC/PVC/Aluminium).
· 34009 300 945 9 4 : 28 comprimés pelliculés sous plaquettes (PVC/ACLAR/PVDC/PVC/Aluminium).
· 34009 550 360 8 1: 36 comprimés pelliculés sous plaquettes (PVC/ACLAR/PVDC/PVC/Aluminium).
· 34009 550 360 9 8: 48 comprimés pelliculés sous plaquettes (PVC/ACLAR/PVDC/PVC/Aluminium).
· 34009 301 024 3 5: 2 x 1 comprimé(s) pelliculé(s) sous plaquette prédécoupée unitaire (OPA/Aluminium/PVC/Aluminium).
· 34009 300 946 0 0 : 4 x 1 comprimé(s) pelliculé(s) sous plaquette prédécoupée unitaire (OPA/Aluminium/PVC/Aluminium).
· 34009 301 024 4 2: 8 x 1 comprimé(s) pelliculé(s) sous plaquette prédécoupée unitaire (OPA/Aluminium/PVC/Aluminium).
· 34009 300 946 1 7 : 12 x 1 comprimé(s) pelliculé(s) sous plaquette prédécoupée unitaire (OPA/Aluminium/PVC/Aluminium).
· 34009 300 946 2 4 : 24 x 1 comprimé(s) pelliculé(s) sous plaquette prédécoupée unitaire (OPA/Aluminium/PVC/Aluminium).
· 34009 550 361 3 5: 36 x 1 comprimé(s) pelliculé(s) sous plaquette prédécoupée unitaire (OPA/Aluminium/PVC/Aluminium).
· 34009 301 024 5 9: 2 x 1 comprimé(s) pelliculé(s) sous plaquette prédécoupée unitaire (PVC/ACLAR/PVC/Aluminium).
· 34009 300 946 3 1 : 4 x 1 comprimé(s) pelliculé(s) sous plaquette prédécoupée unitaire (PVC/ACLAR/PVC/Aluminium).
· 34009 301 024 8 0 : 8 x 1 comprimé(s) pelliculé(s) sous plaquette prédécoupée unitaire (PVC/ACLAR/PVC/Aluminium).
· 34009 300 946 4 8 : 12 x 1 comprimé(s) pelliculé(s) sous plaquette prédécoupée unitaire (PVC/ACLAR/PVC/Aluminium).
· 34009 300 946 5 5 : 24 x 1 comprimé(s) pelliculé(s) sous plaquette prédécoupée unitaire (PVC/ACLAR/PVC/Aluminium).
· 34009 550 361 4 2: 36 x 1 comprimé(s) pelliculé(s) sous plaquette prédécoupée unitaire (PVC/ACLAR/PVC/Aluminium).
· 34009 301 025 1 0: 2 x 1 comprimé(s) pelliculé(s) sous plaquette prédécoupée unitaire (PVC/ACLAR/PVDC/PVC/Aluminium).
· 34009 300 946 6 2 : 4 x 1 comprimé(s) pelliculé(s) sous plaquette prédécoupée unitaire (PVC/ACLAR/PVDC/PVC/Aluminium).
· 34009 301 025 3 4: 8 x 1 comprimé(s) pelliculé(s) sous plaquette prédécoupée unitaire (PVC/ACLAR/PVDC/PVC/Aluminium).
· 34009 300 946 8 6 : 12 x 1 comprimé(s) pelliculé(s) sous plaquette prédécoupée unitaire (PVC/ACLAR/PVDC/PVC/Aluminium).
· 34009 300 946 9 3 : 24 x 1 comprimé(s) pelliculé(s) sous plaquette prédécoupée unitaire (PVC/ACLAR/PVDC/PVC/Aluminium).
· 34009 550 361 8 0: 36 x 1 comprimé(s) pelliculé(s) sous plaquette prédécoupée unitaire (PVC/ACLAR/PVDC/PVC/Aluminium).
· 34009 550 334 1 7 : 56 comprimés pelliculés sous plaquettes (OPA/aluminium-PVC/aluminium).
· 34009 550 334 2 4 : 56 comprimés pelliculés sous plaquettes (PVC/ACLAR/PVC/Aluminium).
· 34009 550 334 3 1 : 56 comprimés pelliculés sous plaquettes (PVC/ACLAR/PVDC/PVC/Aluminium).
· 34009 302 930 3 4 : 4 x 1 comprimé(s) pelliculé(s) sous plaquette prédécoupée unitaire (PVC/PVdC/Aluminium).
· 34009 302 930 4 1 : 8 x 1 comprimé(s) pelliculé(s) sous plaquette prédécoupée unitaire (PVC/PVdC/Aluminium).
· 34009 302 930 5 8 : 24 x 1 comprimé(s) pelliculé(s) sous plaquette prédécoupée unitaire (PVC/PVdC/Aluminium).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
ANSM - Mis à jour le : 11/10/2024
TADALAFIL TEVA 20 mg, comprimé pelliculé sécable
Tadalafil
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que TADALAFIL TEVA 20 mg, comprimé pelliculé sécable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre TADALAFIL TEVA 20 mg, comprimé pelliculé sécable ?
3. Comment prendre TADALAFIL TEVA 20 mg, comprimé pelliculé sécable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver TADALAFIL TEVA 20 mg, comprimé pelliculé sécable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE TADALAFIL TEVA 20 mg, comprimé pelliculé sécable ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC : G04BE08
TADALAFIL TEVA est un traitement pour les hommes adultes ayant un dysfonction érectile, c’est-à-dire quand un homme ne peut atteindre ou conserver une érection suffisante pour une activité sexuelle. Il a été montré que TADALAFIL TEVA améliorait significativement la capacité à obtenir une érection ferme du pénis nécessaire à une activité sexuelle.
TADALAFIL TEVA contient une substance active le tadalafil, qui appartient à un groupe de médicament appelés inhibiteurs de la phosphodiestérase de type 5.A la suite d’une stimulation sexuelle, TADALAFIL TEVA agit en aidant la relaxation des vaisseaux sanguins de votre pénis, favorisant ainsi l’afflux sanguin. Il en résulte une amélioration de l’érection. TADALAFIL TEVA ne vous aidera pas si vous n’avez pas de problème d’érection.
Il est important de savoir que TADALAFIL TEVA, n’agit pas s'il n’y a pas de stimulation sexuelle. Vous et votre partenaire devrez engager les préliminaires comme vous le feriez si vous ne preniez pas de médicament pour votre problème d’érection.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE TADALAFIL TEVA 20 mg, comprimé pelliculé sécable ?
Ne prenez jamais TADALAFIL TEVA 20 mg, comprimé pelliculé sécable si vous :
· êtes allergique au tadalafil ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6 ;
· prenez des médicaments qui contiennent comme substances des dérivés nitrés ou des donneurs de monoxyde d’azote comme le nitrite d’amyle sous quelque forme que ce soit. Ce groupe de médicaments (« les dérivés nitrés ») est utilisé dans le traitement des crises d’angine de poitrine (« douleurs thoraciques »). Il a été montré que TADALAFIL TEVA augmentait les effets de ces médicaments. Si vous prenez des dérivés nitrés sous n’importe quelle forme ou si vous avez des doutes, prévenez votre médecin (voir rubrique « Autres médicaments et TADALAFIL TEVA 20 mg, comprimé pelliculé sécable ») ;
· avez une maladie cardiaque grave ou avez récemment eu une crise cardiaque au cours des 90 derniers jours ;
· avez récemment eu un accident vasculaire cérébral au cours des six derniers mois ;
· souffrez d’hypotension artérielle ou d’hypertension artérielle non contrôlée ;
· avez déjà présenté une perte de la vision due à une neuropathie optique ischémique antérieure non artéritique (NOIAN), affection décrite comme « accidents vasculaires oculaires ».
· prenez du riociguat. Ce médicament est utilisé pour traiter l’hypertension artérielle pulmonaire (HTAP) (c’est-à-dire une pression sanguine élevée dans les artères pulmonaires) et l’hypertension pulmonaire thromboembolique chronique (HTPC) (c’est-à-dire une pression sanguine élevée dans les artères pulmonaires due à la présence de caillots sanguins persistants). Il a été démontré que les inhibiteurs des PDE5, tels que TADALAFIL TEVA, augmentent les effets hypotenseurs de ce médicament. Si vous prenez du riociguat ou si vous avez un doute parlez-en à votre médecin.
Avertissements et précautions
Adressez-vous à votre médecin avant de prendre TADALAFIL TEVA.
Attention, l’activité sexuelle comporte un risque potentiel chez les patients ayant une maladie cardiaque, en raison du surcroît d’effort entraîné au niveau du cœur. Si vous avez un problème cardiaque, parlez-en à votre médecin.
Avant de prendre TADALAFIL TEVA, informez votre médecin si vous avez :
· une drépanocytose (malformation des globules rouges) ;
· un myélome multiple (cancer de la moelle osseuse) ;
· une leucémie (cancer des cellules sanguines) ;
· une déformation du pénis ;
· un grave problème de foie ;
· un grave problème de reins.
L’efficacité de TADALAFIL TEVA n’est pas connue chez les patients ayant subi :
· une intervention chirurgicale pelvienne ;
· une ablation partielle ou totale de la prostate avec section des bandelettes nerveuses de la prostate (prostatectomie radicale sans conservation des bandelettes nerveuses).
En cas de diminution ou de perte soudaine de la vision, ou si votre vision est déformée ou altérée pendant que vous prenez TADALAFIL TEVA vous devez arrêter votre traitement par TADALAFIL TEVA et contacter immédiatement votre médecin.
Une diminution ou une perte soudaine de l’audition ont été observées chez des patients prenant du tadalafil. Même s’il n’a pas été déterminé si l’évènement est directement lié au tadalafil, si vous ressentez une diminution ou une perte soudaine de l’audition, vous devez arrêter votre traitement par TADALAFIL TEVA et contacter immédiatement votre médecin.
TADALAFIL TEVA n’est pas indiqué chez les femmes.
Enfants et adolescents
TADALAFIL TEVA n’est pas indiqué chez les enfants et les adolescents de moins de 18 ans.
Autres médicaments et TADALAFIL TEVA 20 mg, comprimé pelliculé sécable
Informez votre médecin si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Ne prenez pas TADALAFIL TEVA si vous prenez un traitement à base de dérivés nitrés (voir rubrique « Ne prenez jamais TADALAFIL TEVA 20 mg, comprimé pelliculé sécable ».
L’activité de certains médicaments peut être altérée par TADALAFIL TEVA, ou ces médicaments peuvent altérer l’efficacité de TADALAFIL TEVA. Parlez-en à votre médecin ou votre pharmacien si vous êtes déjà traités par :
· un alpha-bloquant (médicament utilisé pour traiter l’hypertension artérielle ou les symptômes urinaires associés à une hypertrophie bénigne de la prostate) ;
· d’autres médicaments pour traiter l’hypertension artérielle ;
· du riociguat ;
· un inhibiteur de la 5-alpha réductase (utilisé pour traiter l’hypertrophie bénigne de la prostate) ;
· des médicaments tels que le kétoconazole en comprimés (pour traiter les mycoses) et des inhibiteurs de protéases pour le traitement du SIDA ou du VIH ;
· du phénobarbital, de la phénytoïne et de la carbamazépine (médicaments anticonvulsivants) ;
· de la rifampicine, de l’érythromycine, de la clarithromycine ou de l’itraconazole ;
· d’autres traitements de la dysfonction érectile.
TADALAFIL TEVA 20 mg, comprimé pelliculé sécable avec des boissons et de l’alcool
Les informations sur les effets de l’alcool sont à la rubrique 3. Le jus de pamplemousse peut altérer l’efficacité de TADALAFIL TEVA et doit donc être pris avec précaution. Si vous souhaitez plus d’informations, parlez-en avec votre médecin.
Une diminution de la production de sperme a été observée chez des chiens traités. Cette diminution a été observée chez certains hommes. Il est peu probable que ces effets entraînent une baisse de la fertilité.
Conduite de véhicules et utilisation de machines
Des sensations vertigineuses ont été rapportées au cours des études cliniques chez des hommes prenant TADALAFIL TEVA. Vérifiez attentivement la façon dont vous réagissez sous TADALAFIL TEVA avant de conduire un véhicule ou d’utiliser des machines.
TADALAFIL TEVA 20 mg, comprimé pelliculé sécable contient du lactose et du sodium
Si votre médecin vous a informé(e) d’une intolérance à certains sucres, contactez-le avant de prendre ce médicament.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par comprimé pelliculé, c.-à-d. qu’il est essentiellement « sans sodium ».
3. COMMENT PRENDRE TADALAFIL TEVA 20 mg, comprimé pelliculé sécable ?
Les comprimés de TADALAFIL TEVA sont destinés à être utilisés par voie orale chez l’homme uniquement.
Administration une fois par jour
La dose recommandée est d'un comprimé de 5 mg en prise quotidienne (correspond à un quart du comprimé), approximativement au même moment de la journée. Votre médecin pourra adapter la dose à 2,5 mg en fonction des résultats obtenus avec TADALAFIL TEVA. Dans ce cas, vous prendrez des comprimés de 2,5 mg. Ne prenez pas TADALAFIL TEVA plus d’une fois par jour.
La prise quotidienne de TADALAFIL TEVA peut être appropriée chez les hommes qui envisagent d'avoir des rapports sexuels au moins deux fois par semaine. Lorsqu'il est pris une fois par jour, TADALAFIL TEVA vous permet d'obtenir une érection, après une stimulation sexuelle, à tout moment de la journée.
Administration à la demande
La dose initiale recommandée est d'un comprimé de 10 mg (correspond à une moitié du comprimé) à prendre avant l’activité sexuelle. Si l’effet de cette dose est trop faible, votre médecin pourra augmenter la dose à 20 mg (correspond à un comprimé).
Vous pouvez prendre la dose au moins 30 minutes avant l'activité sexuelle. TADALAFIL TEVA peut rester efficace jusqu'à 36 heures après la prise de la dose.
Ne prenez pas de doses de 10 mg et 20 mg plus d’une fois par jour. Leur prise se fait avant l’activité sexuelle. L’utilisation quotidienne prolongée de TADALAFIL TEVA 10 mg et 20 mg est déconseillée.
Il est important de savoir que TADALAFIL TEVA n’agit pas s'il n’y a pas de stimulation sexuelle. Vous et votre partenaire devrez engager les préliminaires comme vous le feriez si vous ne preniez pas de médicament pour les troubles de l’érection.
La prise d’alcool peut affecter votre capacité à obtenir une érection et diminuer temporairement votre pression artérielle. Si vous avez pris ou si vous envisagez de prendre TADALAFIL TEVA, évitez de boire de l’alcool de façon excessive (concentration alcoolique sanguine de 0,08% ou plus), ceci pouvant augmenter le risque de sensations de vertiges lors du passage à la position debout.
Mode d’administration
Selon votre régime posologique (une fois par jour ou à la demande), les comprimés peuvent être divisés en quatre (une fois par jour) ou en deux (à la demande).
TADALAFIL TEVA doit être administré par voie orale et peut être pris pendant ou en dehors des repas.
Avalez le comprimé ou une partie du comprimé avec un peu d'eau.
Diviser le comprimé en quatre (avec 5 mg de tadalafil pour une administration une fois par jour)
|
Placer le comprimé avec les barres de sécabilité vers le haut sur une surface dure et plane (p. ex., le plateau d’une table). |
|
|
Appuyer avec force pendant un court instant avec le pouce (ou l'index) sur la face supérieure du comprimé comportant les barres de sécabilité jusqu’à ce qu'il se brise en quatre parties égales. |
|
Diviser le comprimé en deux (avec 10 mg de tadalafil pour une administration à la demande)
|
Placer le comprimé avec les barres de sécabilité vers le haut sur une surface dure et plane (p. ex., le plateau d’une table). |
|
|
Placer les pouces (ou les index) des deux mains en même temps sur les côtés gauche et droit de la barre de sécabilité la plus courte du comprimé. Appuyer avec force pendant un court instant avec les deux pouces (ou index) sur les côtés gauche et droit de l'extérieur du comprimé jusqu'à ce qu'il se brise en deux parties égales. |
|
Si vous avez pris plus de TADALAFIL TEVA 20 mg, comprimé pelliculé sécable que vous n’auriez dû :
Contactez votre médecin. Vous pourriez ressentir des effets indésirables décrits dans la rubrique 4.
Si vous oubliez de prendre TADALAFIL TEVA 20 mg, comprimé pelliculé sécable :
Si vous arrêtez de prendre TADALAFIL TEVA 20 mg, comprimé pelliculé sécable :
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Si vous ressentez l’un des effets indésirables suivants, ARRÊTEZ de prendre le médicament et consultez immédiatement votre médecin :
· réactions allergiques, y compris éruptions cutanées (peu fréquent) ;
· douleur thoracique – n’utilisez pas de dérivés nitrés mais consultez immédiatement votre médecin (peu fréquent) ;
· priapisme, une érection prolongée et parfois douloureuse après la prise de TADALAFIL TEVA (rare). Si vous avez une telle érection qui persiste de manière continue pendant plus de 4 heures, vous devez contacter immédiatement un médecin ;
· perte soudaine de la vision (rare), vision centrale déformée, altérée, floue ou diminution soudaine de la vision (fréquence indéterminée).
D’autres effets indésirables ont été rapportés :
Fréquent (observé chez 1 à 10 patients sur 100)
· maux de tête ;
· douleurs dorsales ;
· douleurs musculaires ;
· douleurs dans les bras et les jambes ;
· bouffées vasomotrices ;
· congestion nasale ;
· indigestions.
Peu fréquent (observé chez 1 à 10 patients sur 1 000)
· sensations de vertige ;
· maux d’estomac ;
· nausées ;
· vomissements ;
· reflux gastro-œsophagien ;
· vision trouble ;
· douleurs oculaires ;
· difficulté à respirer ;
· présence de sang dans les urines ;
· érection prolongée ;
· sensations de palpitations, battements de cœur rapides, pression artérielle élevée, pression artérielle basse ;
· saignements de nez et bourdonnement des oreilles ;
· gonflement des mains, des pieds ou des chevilles et sensation de fatigue.
Rare (observé chez 1 à 10 patients sur 10 000)
· évanouissements ;
· convulsions ;
· pertes passagères de la mémoire ;
· gonflement des paupières, yeux rouges, baisse ou perte soudaine de l’audition et urticaire (plaques rouges accompagnées de démangeaisons sur la surface de la peau) ;
· saignements du pénis ;
· présence de sang dans le sperme ;
· augmentation de la sudation.
De rares cas de crise cardiaque et d’accident vasculaire cérébral ont également été rapportés chez des hommes prenant TADALAFIL TEVA. La plupart de ces hommes avaient des problèmes cardiaques connus avant de prendre ce médicament.
Une perte ou une diminution de la vision, partielle, temporaire ou permanente, d’un ou des deux yeux a été rarement rapportée.
Quelques effets indésirables rares supplémentaires ont été rapportés chez les hommes prenant du TADALAFIL TEVA et qui n’avaient pas été observés lors des essais cliniques. Ces effets indésirables sont les suivants :
· des migraines ;
· un gonflement du visage ;
· des réactions allergiques graves se manifestant par un gonflement du visage ou de la gorge ;
· des rashs cutanés importants ;
· quelques troubles qui affectent le flux sanguin au niveau des yeux ;
· des battements de cœur irréguliers ;
· une angine de poitrine ;
· une mort subite d’origine cardiaque ;
L’effet indésirable de type sensation de vertige a été rapporté plus fréquemment chez les hommes de plus de 75 ans prenant du TADALAFIL TEVA. Des diarrhées ont été rapportées plus fréquemment chez les hommes de plus de 65 ans prenant du TADALAFIL TEVA.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER TADALAFIL TEVA 20 mg, comprimé pelliculé sécable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte et la plaquette après EXP. La date de péremption fait référence au dernier jour de ce mois.
Ce médicament ne nécessite pas de précautions particulières de conservation.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient TADALAFIL TEVA 20 mg, comprimé pelliculé sécable
· La substance active est :
Tadalafil........................................................................................................................... 20 mg
Pour un comprimé pelliculé.
· Les autres composants sont :
Noyau du comprimé : lactose monohydraté, laurilsulfate de sodium, povidone, crospovidone et fumarate de stéaryle sodique.
Pelliculage : poly(alcool vinylique), macrogol, dioxyde de titane (E171), talc et oxyde de fer jaune (E172).
Qu’est-ce que TADALAFIL TEVA 20 mg, comprimé pelliculé sécable et contenu de l’emballage extérieur
TADALAFIL TEVA 20 mg se présente sous forme de comprimés pelliculés ovales, de couleur ocre à jaune. Une face du comprimé est quadrisécable. L’autre face du comprimé comporte la mention « 20 » gravée en creux. Longueur : 15,0 mm, largeur : 9,0 mm.
Le comprimé peut être divisé en deux ou quatre doses égales.
TADALAFIL TEVA 20 mg est disponible en boîtes de 2, 4, 5, 8, 10, 12, 15, 18, 24, 28, 36, 48 ou 56 comprimés pelliculés sous plaquettes ou de 2 x 1, 4 x 1, 8 x 1, 12 x 1, 24 x 1 ou 36 x 1 comprimé(s) pelliculé(s) sous plaquette prédécoupée unitaire.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
100-110 ESPLANADE DU GENERAL DE GAULLE
92931 PARIS LA DEFENSE CEDEX
Exploitant de l’autorisation de mise sur le marché
100-110 ESPLANADE DU GENERAL DE GAULLE
92931 PARIS LA DEFENSE CEDEX
TEVA PHARMACEUTICAL WORKS PRIVATE LIMITED COMPANY
PALLAGI ÚT 13
4042 DEBRECEN
HONGRIE
OU
TEVA OPERATIONS POLAND SP. Z.O.O.
UL. MOGILSKA 80
31-546 KRAKOW
POLOGNE
OU
TEVA PHARMA S.L.U
C/C, N.4, POLIGONO INDUSTRIAL MALPICA
50016 ZARAGOZA
ESPAGNE
OU
MERCKLE GMBH
LUDWIG-MERCKLE-STRAßE 3
89143 BLAUBEUREN
ALLEMAGNE
OU
MERCKLE GMBH
GRAF-ARCO-STRAßE 3
89079 ULM
ALLEMAGNE
OU
PLIVA HRVATSKA D.O.O. (PLIVA CROATIA LTD.)
PRILAZ BARUNA FILIPOVICA 25
10000 ZAGREB
CROATIE
OU
Balkanpharma-Dupnitsa AD.
3 Samokovsko Shosse Str.,
Dupnitsa 2600
BULGARIE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).