Dernière mise à jour le 02/02/2026
ATROPINE (SULFATE) AGUETTANT 0,25 mg/mL, solution injectable
Indications thérapeutiques
Classe pharmacothérapeutique : alcaloïdes de la belladone : amines tertiaires, code ATC : A03BA01
L’atropine appartient à un groupe de médicaments appelé les anticholinergiques. Un anticholinergique est une substance qui bloque le neurotransmetteur acétylcholine dans le système nerveux central et périphérique. Il est utilisé en cas d’urgence lorsque le coeur bat trop lentement, en tant qu’antidote aux insecticides organophosphorés par exemple, à l’empoisonnement aux gaz neurotoxiques ou à l’empoisonnement par champignons.
Il peut être utilisé dans le cadre d’une prémédication avant une anesthésie générale. Il peut également être utilisé pour prévenir les effets indésirables des autres médicaments utilisés pour annuler les effets des curares myorelaxants après une intervention chirurgicale.
Présentations
> 10 ampoule(s) bouteille en verre de 1 ml
Code CIP : 370 134-1 ou 34009 370 134 1 3
Déclaration de commercialisation : 01/03/2006
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 19/09/2022
ATROPINE (SULFATE) AGUETTANT 0,25 mg/mL, solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Sulfate d’Atropine................................................................................................................ 0,25 mg
Pour une ampoule de 1 mL.
Un mL de solution injectable contient 0,25 mg de monohydrate de sulfate d’atropine, équivalant à 0.208 mg d’atropine.
Une ampoule de 1 mL contient 0,25 mg de monohydrate de sulfate d’atropine, équivalant à 0.208 mg d’atropine.
Excipient(s) à effet notoire : sodium
Une ampoule de 1 mL contient 3,5 mg de sodium, équivalent à 0,154 mmol de sodium.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution limpide et incolore
pH 3.2- 4.5
4.1. Indications thérapeutiques
· Médicament pré-anesthésique pour prévenir les réactions vagales associées à l’intubation trachéale et à la manipulation chirurgicale.
· Limitation des effets muscariniques de la néostigmine utilisée après la chirurgie pour la neutralisation des curares non dépolarisants.
· Traitement de la bradycardie compromettant l’hémodynamique et/ou du bloc auriculo-ventriculaire dû à un tonus vagal excessif en cas d’urgence.
· Réanimation cardio-pulmonaire : traitement de la bradycardie symptomatique et du bloc auriculo-ventriculaire.
· Antidote suite à un surdosage ou une intoxication par les inhibiteurs de l’acétylcholinestérase, p. ex. anticholinestérasiques, organophosphorés, carbamates et champignons muscariniques.
4.2. Posologie et mode d'administration
Le sulfate d’atropine Aguettant 0,25 mg/mL solution injectable doit être administré sous surveillance médicale
Médication pré-anesthésique
Administration intraveineuse ou sous cutanée immédiatement avant une intervention chirurgicale ; si nécessaire, une injection intramusculaire ou sous cutanée 30 à 60 minutes avant la chirurgie est possible.
· Adultes :
0,3– 0,6 mg IV (1,2– 2,4 mL)
· Population pédiatrique :
La dose habituelle chez les enfants est de 0,01-0,02 mg/kg de poids corporel (maximum de 0,6 mg par dose) ; le dosage doit être ajusté selon la réponse et la tolérance du patient.
En association à la néostigmine pour limiter ses effets muscariniques
· Adultes :
0,6-1,2 mg IV (2,4 à 4,8 mL)
· Population pédiatrique :
0,02 mg/kg IV
Traitement de la bradycardie compromettant l’hémodynamique, du bloc auriculo-ventriculaire, réanimation cardiopulmonaire :
· Adultes :
Bradycardie sinusale : 0,5 mg IV (1 mL), toutes les 2 à 5 minutes jusqu’à l’obtention de la fréquence cardiaque désirée.
Bloc AV : 0,5 mg IV (1 mL), toutes les 3 à 5 minutes (maximum 3 mg)
· Population pédiatrique :
0,02 mg/kg IV en une seule dose (dose maximale de 0,6 mg).
Comme antidote aux organophosphates (pesticides, gaz neurotoxiques), aux inhibiteurs de la cholinestérase et dans l’intoxication aux champignons muscariniques :
Voie intraveineuse.
· Adultes :
0,5-2 mg de sulfate d’atropine (2-8 mL), peut être répétée après 5 minutes et toutes les 10 à 15 minutes par la suite au besoin, jusqu’à ce que les signes et symptômes disparaissent (cette dose peut être dépassée plusieurs fois).
· Population pédiatrique :
0,02 mg de sulfate d’atropine/kg de poids corporel, éventuellement répétée plusieurs fois jusqu’à ce que les signes et symptômes disparaissent.
Ajustements posologiques :
· En général, la posologie doit être ajustée selon la réponse et la tolérance du patient.
· La posologie jusqu’à une dose maximale totale de 3 mg chez les adultes et 0,6 mg chez les enfants est habituellement augmentée jusqu’à ce que les effets indésirables deviennent intolérables ; une légère réduction de la posologie donne alors la posologie maximale tolérée par le patient.
· Population pédiatrique :
Les intervalles posologiques pour les groupes de poids pédiatrique comme indiqué ci-dessous sont des valeurs indicatives. La dose habituelle chez les enfants est de 0,01-0,02 mg/kg de poids corporel (maximum de 0,6 mg par dose) ; le dosage doit être ajusté selon la réponse et la tolérance du patient.
|
Poids corporel |
Dose de 0,01 mg/kg de poids corporel |
Dose de 0,02 mg/kg de poids corporel Atropine (sulfate) Aguettant 0,25 mg/mL, solution injectable |
|
< 5 |
< 0,2 mL |
< 0,4 mL |
|
5-10 |
0,2-0,4 mL |
0,4-0,8 mL |
|
10-15 |
0,4-0,6 mL |
0,8-1,2 mL |
|
15-20 |
0,6-0,8 mL |
1,2-1,6 mL |
|
20-30 |
0,8-1,2 mL |
1,6-2,4 mL |
|
30-50 |
1,2-2,0 mL |
2,4-4,0 mL |
Chez les nourrissons, il est recommandé d’utiliser la plus faible concentration disponible (Atropine (sulfate) Aguettant 0,25 mg/mL, solution injectable) afin d’assurer une précision de dosage maximale.
Populations particulières :
· La prudence est de mise pour les patients souffrant d’insuffisance rénale ou hépatique et les personnes âgées (voir rubrique 4.4).
Mode d’administration
· L’atropine est administrée par injection intraveineuse, injection intramusculaire ou sous-cutanée.
Ce médicament ne doit pas être administré en cas de :
· Hypersensibilité au principe actif ou à l’un des excipients mentionnés à la rubrique 6.1.
· Glaucome à angle fermé,
· Risque de rétention urinaire lié à des troubles urétro-prostatiques,
· Achalasie de l’œsophage, iléus paralytique et mégacôlon toxique.
Toutes ces contre-indications ne s’appliquent toutefois pas aux situations d’urgence engageant le pronostic vital (comme les situations de bradyarythmie ou d’intoxication).
4.4. Mises en garde spéciales et précautions d'emploi
Utiliser avec prudence en cas de :
· Hypertrophie de la prostate,
· Insuffisance rénale et/ou hépatique,
· Insuffisance cardiaque, arythmies, hyperthyroïdie,
· Bronchopneumopathie chronique obstructive, car une réduction des sécrétions bronchiques pourrait entraîner la formation de bouchons bronchiques.
· Atonie intestinale chez les sujets âgés,
· Sténose du pylore,
· Fièvre, ou lorsque la température ambiante est élevée.
· Chez les personnes âgées et les enfants qui peuvent être plus sensibles aux effets indésirables de l’atropine.
En cas d’œsophagite par reflux, car l’atropine peut retarder la vidange gastrique, diminuer la motilité gastrique et relâcher le sphincter œsophagien.
L’atropine ne doit pas être administrée à des patients présentant une myasthénie à moins qu’elle ne soit administrée en association à un traitement anticholinestérasique.
L’administration d’atropine ne doit pas retarder la mise en place d’une stimulation externe pour les patients instables, en particulier ceux présentant un bloc de haut grade (second degré de type Mobitz II ou troisième degré).
Les antimuscariniques bloquent l’inhibition vagale de la stimulation du nœud sinusal et doivent donc être utilisés avec prudence chez les patients présentant des tachyarythmies, une insuffisance cardiaque congestive ou une coronaropathie.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par ampoule, c.-à-d. qu’il est essentiellement « sans sodium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Associations à prendre en compte
Autres médicaments ayant une activité anticholinergique, comme les antidépresseurs tricycliques, certains antihistaminiques H1, des médicaments antiparkinsoniens, le disopyramide, la méquitazine, les phénothiazines, les neuroleptiques, les antispasmodiques atropiniques, la clozapine et la quinidine en raison du risque de potentialisation des effets indésirables atropiniques (rétention urinaire, constipation, sécheresse buccale).
4.6. Fertilité, grossesse et allaitement
Grossesse
Les données sur un nombre limité de grossesses exposées n’indiquent aucun effet indésirable de l’atropine sur la grossesse ou sur la santé du foetus/du nouveau-né.
Les études effectuées chez l’animal n’ont pas mis en évidence d’effets délétères directs ou indirects sur la reproduction (voir rubrique 5.3).
Les études portant sur la pharmacocinétique de l’atropine chez la mère et le foetus en fin de grossesse ont indiqué que l’atropine franchit rapidement la barrière placentaire. L’administration intraveineuse d’atropine pendant la grossesse ou à terme peut entraîner une tachycardie chez le foetus et la mère.
L’atropine ne doit pas être utilisée pendant la grossesse à moins que cela ne soit absolument nécessaire.
Allaitement
De faibles quantités d’atropine peuvent passer dans le lait maternel. Les nourrissons ont une sensibilité accrue aux effets anticholinergiques de l’atropine. L’atropine pourrait inhiber la production de lait, en particulier en cas d’utilisation répétée. Il doit être décidé d’arrêter ou non l’allaitement ou d’arrêter/de s’abstenir de suivre le traitement en prenant en compte le bénéfice de l’allaitement pour l’enfant et le bénéfice du traitement pour la femme. S’il est décidé durant le traitement de poursuivre l’allaitement, l’enfant doit être surveillé pour déceler la survenue d’effets anticholinergiques.
Fertilité
Il n’existe pas de données concernant les effets de ce sulfate d’atropine sur la fertilité chez les êtres humains. Le sulfate d’atropine réduit la fertilité chez les rats mâles, en raison probablement d’un effet inhibiteur sur le transport du sperme et de la semence lors du processus d’émission.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Le profil des effets indésirables observés avec l’atropine est essentiellement lié à ses actions pharmacologiques au niveau des récepteurs muscariniques et, à doses élevées, au niveau des récepteurs nicotiniques. Les effets indésirables sont dose-dépendants et sont généralement réversibles à l’arrêt du traitement. Les effets les plus fréquents survenant à des doses relativement faibles sont les troubles visuels, une diminution des sécrétions bronchiques, une sécheresse buccale, une constipation, un reflux, des bouffées vasomotrices, une dysurie et une sécheresse cutanée. Une bradycardie transitoire peut apparaître, suivie d’une tachycardie accompagnée de palpitations et d’arythmies.
L’évaluation des effets indésirables est basée sur la définition suivante des fréquences :
· Très fréquent : ≥1/10 ;
· Fréquent : ≥1/100, <1/10 ;
· Peu fréquent : ≥1/1 000, <1/100 ;
· Rare : ≥1/10 000, <1/1 000 ;
· Très rare : <1/10 000 ;
· Fréquence indéterminée : ne peut être estimée sur la base des données disponibles
|
Fréquence
de systèmes d’organes |
Très fréquent |
Fréquent |
Peu fréquent |
Rare |
Très rare |
Fréquence indéterminée |
|
Affections du système immunitaire |
Réactions allergiques |
Anaphylaxie |
||||
|
Affections du système nerveux |
Excitation, troubles de la coordination, confusion mentale, et/ou hallucinations (en particulier avec des doses plus élevées), hyperthermie |
Réactions psychotiques |
Crises convulsives, somnolence |
Céphalées agitation, ataxie, insomnie |
||
|
Affections oculaires |
Troubles visuels (mydriase, inhibition de l’accommodation, vision trouble, photophobie) |
|||||
|
Affections cardiaques |
Tachycardie (arythmies, exacerbation transitoire de la bradycardie) |
Arythmies auriculaires, fibrillation ventriculaire, angine, crise hypertensive |
||||
|
Affections vasculaires |
Bouffées vasomotrices |
|||||
|
Affections respiratoires, thoraciques et médiastinales |
Diminution des sécrétions bronchiques |
|||||
|
Affections gastro‑intestinales |
Sécheresse de la bouche (difficulté à avaler et à parler, soif), inhibition parasympathique du tractus gastro‑intestinal (constipation et reflux), inhibition de la sécrétion gastrique, perte du goût, nausées, vomissements, sensation de ballonnement |
|||||
|
Affections de la peau et du tissus sous-cutané |
Anhidrose, urticaire, éruption cutanée |
|||||
|
Affections du rein et des voies urinaires |
Inhibition du contrôle parasympathique de la vessie, rétention urinaire |
Population pédiatrique
Les nourrissons, les enfants et les enfants atteints de paralysie spastique ou présentant des lésions cérébrales peuvent être plus sensibles aux effets antimuscariniques.
Populations particulières
L’atropine peut induire de l’excitation, des troubles de la coordination, un état confusionnel et/ou des hallucinations, en particulier chez les personnes âgées. Une étude épidémiologique a également indiqué une altération des performances cognitives chez les sujets âgés recevant des antimuscariniques.
Les patients atteints de trisomie 21 peuvent être plus sensibles aux effets antimuscariniques.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr
Symptômes :
Bouffées vasomotrices et sécheresse cutanée, dilatation des pupilles s’accompagnant de photophobie, sécheresse de la bouche et de la langue accompagnée d’une sensation de brûlure, difficultés à avaler, tachycardie, respiration rapide, hyperpyrexie, nausées, vomissements, hypertension, éruption cutanée et excitation.
Les symptômes de la stimulation du système nerveux central (SNC) comprennent : agitation, confusion, hallucinations, réactions psychotiques et paranoïaques, troubles de la coordination, délire et occasionnellement des convulsions.
En cas de surdosage grave, une somnolence, une stupeur et une dépression du SNC peuvent survenir ainsi qu’un coma, une insuffisance circulatoire et respiratoire et le décès
Traitement :
Instaurer un traitement symptomatique. Maintenir les voies respiratoires dégagées.
L’administration de diazépam peut être envisagée pour contrôler l’excitation et les convulsions, mais le risque de dépression du SNC doit alors être pris en compte.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique ALCALOÏDES DE LA BELLADONE : AMINES TERTIAIRES
Code ATC : A03BA01
L’atropine est un agent antimuscarinique, qui antagonise de manière compétitive l’acétylcholine au niveau des terminaisons nerveuses post-ganglionnaires, affectant ainsi les récepteurs situés dans les glandes exocrines, le muscle lisse, du muscle cardiaque et du système nerveux central.
Les effets périphériques comprennent une réduction de la production des secrétions salivaires, sudorales, nasales, lacrymales et gastriques, une motilité intestinale réduite et une inhibition de la miction.
L’atropine accroît la fréquence sinusale et, la conduction sino-auriculaire et auriculo-ventriculaire. La fréquence cardiaque est généralement augmentée mais une bradycardie peut survenir au début.
L’atropine inhibe les sécrétions tout au long des voies respiratoires et relâche le muscle lisse bronchique, ce qui entraîne une bronchodilatation.
5.2. Propriétés pharmacocinétiques
Après une administration par voie intraveineuse, l’augmentation maximale de la fréquence cardiaque survient dans les 2 à 4 minutes. Les concentrations plasmatiques maximales de l’atropine suite à une administration intramusculaire sont atteintes dans les 30 minutes, bien que des effets maximaux sur le coeur, la transpiration et la salivation puissent survenir 1 heure après une administration intramusculaire.
Distribution
Les niveaux plasmatiques après une injection intramusculaire et intraveineuse sont comparables après 1 heure. L’atropine est largement distribuée dans le corps entier et franchit la barrière hémato-encéphalique ainsi que la barrière placentaire.
Biotransformation
L’atropine est métabolisée de façon incomplète dans le foie et est excrétée dans l’urine sous forme inchangée du médicament et de métabolites. Environ 50 % de la dose est excrétée dans les 4 heures et 90 % dans les 24 heures.
Élimination
La demi-vie d’élimination est d’environ 2 à 5 heures. Jusqu’à 50 % de la dose est liée aux protéines.
Population pédiatrique
Les enfants, en particulier ceux de moins de 2 ans, peuvent être plus sensibles aux actions de l’atropine. La demi-vie d’élimination est plus que doublée chez les enfants de moins de 2 ans par rapport aux adultes.
Personnes âgées
La demi-vie d’élimination de l’atropine est plus que doublée chez les personnes âgées (plus de 65 ans) par rapport aux adultes.
5.3. Données de sécurité préclinique
Le sulfate d’atropine a réduit la fertilité chez les rats mâles, en raison probablement d’un effet inhibiteur sur le transport du sperme et de la semence lors du processus d’émission.
2 ans.
Après ouverture : le produit doit être utilisé immédiatement.
6.4. Précautions particulières de conservation
Ce médicament ne nécessite pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
Ampoule bouteille en verre incolore de type I de 1 mL. Boîte de 10 ou 100.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
1 RUE ALEXANDER FLEMING
69007 LYON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 370 134 1 3 : 1 mL en ampoule bouteille (verre incolore) de 1 mL. Boîte de 10.
· 34009 370 135 8 1 : 1 mL en ampoule bouteille (verre incolore) de 1 mL. Boîte de 100.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 19/09/2022
ATROPINE (SULFATE) AGUETTANT 0,25 mg/mL, solution injectable
Sulfate d’atropine
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que ATROPINE (SULFATE) AGUETTANT 0,25 mg/mL, solution injectable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser ATROPINE (SULFATE) AGUETTANT 0,25 mg/mL, solution injectable ?
3. Comment utiliser ATROPINE (SULFATE) AGUETTANT 0,25 mg/mL, solution injectable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver ATROPINE (SULFATE) AGUETTANT 0,25 mg/mL, solution injectable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE ATROPINE (SULFATE) AGUETTANT 0,25 mg/mL, solution injectable ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : alcaloïdes de la belladone : amines tertiaires, code ATC : A03BA01
L’atropine appartient à un groupe de médicaments appelé les anticholinergiques. Un anticholinergique est une substance qui bloque le neurotransmetteur acétylcholine dans le système nerveux central et périphérique. Il est utilisé en cas d’urgence lorsque le coeur bat trop lentement, en tant qu’antidote aux insecticides organophosphorés par exemple, à l’empoisonnement aux gaz neurotoxiques ou à l’empoisonnement par champignons.
Il peut être utilisé dans le cadre d’une prémédication avant une anesthésie générale. Il peut également être utilisé pour prévenir les effets indésirables des autres médicaments utilisés pour annuler les effets des curares myorelaxants après une intervention chirurgicale.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER ATROPINE (SULFATE) AGUETTANT 0,25 mg/mL, solution injectable ?
N’utilisez jamais ATROPINE (SULFATE) AGUETTANT 0,25 mg/mL, solution injectable si vous :
· êtes allergique (hypersensible) à l’atropine ou à l’un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6),
· avez des difficultés à uriner,
· présentez une pression oculaire élevée (glaucome),
· avez une maladie de l’oesophage (achalasie de l’oesophage), un blocage dans votre intestin (iléus paralytique), ou une forme aiguë de distension du côlon (mégacôlon toxique).
Ces contre-indications ne s’appliquent pas aux situations d’urgence engageant le pronostic vital.
Avertissements et précautions
Ce médicament doit être utilisé sous surveillance médicale.
Adressez-vous à votre médecin avant d’utiliser ATROPINE SULFATE AGUETTANT si vous avez :
· de l’hyperthyroïdie,
· une maladie prostatique,
· une insuffisance cardiaque,
· une maladie hépatique ou rénale,
· certaines maladies cardiaques,
· une maladie de l’estomac telle qu’un resserrement pylorique,
· une bronchite chronique,
· de la fièvre,
· si vous êtes un enfant ou une personne âgée,
· une myasthénie grave (faiblesse musculaire grave),
· des brûlures d’estomac (reflux).
Autres médicaments et ATROPINE (SULFATE) AGUETTANT 0,25 mg/mL, solution injectable
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
· antidépresseurs tricycliques,
· certains antihistaminiques,
· médicaments pour la maladie de Parkinson,
· phénothiazine, clozapine ou neuroleptiques (pour les maladies mentales),
· quinidine ou disopyramide (pour les maladies cardiaques),
· médicaments antispasmodiques (pour le syndrome de l’intestin irritable).
ATROPINE (SULFATE) AGUETTANT 0,25 mg/mL, solution injectable avec des aliments et boissons
Sans objet.
Grossesse et allaitement
Grossesse
Les données limitées sur l’utilisation d’atropine chez la femme enceinte n’indiquent aucun effet indésirable sur la grossesse ou la santé du foetus. L’atropine franchit le placenta. L’administration intraveineuse de l’atropine pendant la grossesse ou à terme peut entraîner une fréquence cardiaque plus élevée chez le foetus et la mère. Ce médicament ne doit être administré pendant la grossesse qu’après un examen approfondi des bénéfices et des risques du traitement.
Allaitement
De faibles quantités d’atropine peuvent passer dans le lait maternel et avoir des effets sur le nourrisson. L’atropine peut inhiber la production de lait maternel. Votre médecin examinera le bénéfice de l’allaitement au regard du bénéfice du traitement. Il est recommandé d’interrompre l’allaitement si la décision d’utiliser le traitement est maintenue. Toutefois, s’il est décidé pendant le traitement de continuer l’allaitement, votre médecin effectuera des examens supplémentaires sur le nourrisson. Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
L’injection d’atropine peut provoquer un état de confusion ou une vision trouble. Vous ne devez pas conduire ni utiliser de machines après avoir reçu une injection.
ATROPINE (SULFATE) AGUETTANT 0,25 mg/mL, solution injectable contient du sodium
Ce médicament contient moins de 1 mmol de sodium (23 mg) par ampoule, c'est-à-dire qu’il est essentiellement « sans sodium ».
3. COMMENT UTILISER ATROPINE (SULFATE) AGUETTANT 0,25 mg/mL, solution injectable ?
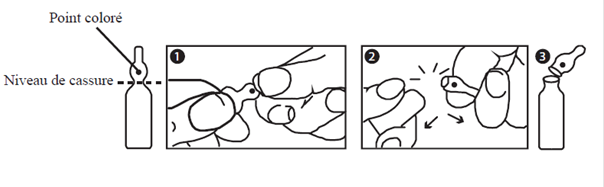
Mode d’emploi pour l’ouverture des ampoules bouteilles
L’ampoule est prélimée en un point de l’étranglement. La tache colorée permet l’orientation de celle-ci. Saisir l’ampoule, le point coloré dirigé vers soi. L’ampoule s’ouvre facilement en plaçant le pouce sur le point coloré et en exerçant une flexion du haut vers le bas comme indiqué sur le dessin.
|
|
Posologie
Votre médecin décidera de la posologie adéquate pour vous, de la manière dont l’injection sera administrée et du moment de cette dernière.
Les posologies habituelles sont :
Comme prémédication avant une anesthésie
Adultes : 0,3 0,6 mg IV immédiatement avant l’induction de l’anesthésie ou 0,3 – 0,6 mg IM, 30 à 60 minutes avant l’anesthésie.
Enfants : 0,01-0,02 mg/kg, dose ajustée selon la réponse et la tolérance du patient (maximum de 0,6 mg par dose).
Pour annuler les effets des curares myorelaxants :
Adultes : 0,6 1,2 mg par intraveineuse (IV) avec de la néostigmine.
Enfants : 0,02 mg/kg IV
en cas de battement cardiaque faible, de bloc cardiaque ou d’arrêt cardiaque :
Adultes :
Bradycardie sinusale (battement cardiaque faible) : 0,5 mg IV, toutes les 2 à 5 minutes jusqu’à l’obtention de la fréquence cardiaque désirée.
Bloc Auriculo-Ventriculaire (bloque la transmission de la contraction entre l’oreillette et le ventricule) : 0,5 mg IV, toutes les 3 à 5 minutes (maximum de 3 mg).
Enfants : 0,02 mg/kg IV en une seule dose (dose maximale de 0,6 mg).
Comme antidote à une intoxication aux organophosphorés (insecticides, ou gaz neurotoxiques), aux anticholinestérases et pour l’empoisonnement par champignons muscariniques :
Adultes : 0,5 - 2 mg selon les caractéristiques et la réponse du patient, peut être répété après 5 minutes par la suite au besoin.
Enfants : 0,02 mg/kg éventuellement répétée plusieurs fois jusqu’à ce que les signes et symptômes disparaissent.
Les autres formes de ce médicament peuvent être plus appropriées lorsqu’une dose supérieure à 0,5 mg est requise.
Utilisation chez les enfants :
L’atropine est utilisée pour traiter les enfants.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
Cette injection vous sera administrée par un docteur ou un(e) infimier/ère, il est donc peu probable que vous receviez une trop grande quantité d’atropine. Si vous pensez que vous avez reçu une trop grande quantité d’atropine, si vous ressentez que votre battement cardiaque est très rapide, que vous respirez rapidement, que vous avez une température élevée, que vous vous sentez agité(e), confus(e), que vous avez des hallucinations ou que vous perdez votre coordination, vous devez l’indiquer à la personne vous administrant l’injection.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les effets indésirables dépendent de la dose qui vous est administrée et disparaissent généralement lorsque le traitement est interrompu.
Une réaction allergique peut, de manière rare, survenir. Cela pourrait provoquer des éruptions cutanées, des démangeaisons graves, une desquamation de la peau, un gonflement du visage (en particulier autour des lèvres et des yeux), un resserrement de la gorge et des difficultés à respirer ou à avaler, de la fièvre, une déshydratation, un choc et un évanouissement. Ce sont tous des effets indésirables graves. Informez immédiatement votre médecin si vous ressentez l’un de ces effets indésirables. Vous pourriez avoir besoin d’une prise en charge médicale d’urgence.
Effets indésirables très fréquents (peuvent toucher plus de 1 personne sur 10)
· troubles visuels (dilatation des pupilles, difficultés à voir net, vision trouble, incapacité à tolérer la lumière),
· sécrétions bronchiques réduites,
· sécheresse buccale (difficulté à avaler et à parler, sensation de soif),
· constipation et brûlures d’estomac (reflux),
· diminution de la sécrétion d’acide gastrique,
· perte du goût,
· nausées,
· vomissements,
· sensation de ballonnement,
· absence de transpiration,
· sécheresse de la peau,
· urticaire,
· éruption cutanée.
Effets secondaires fréquents (peuvent toucher jusqu’à 1 personne sur 10)
· excitation (en particulier à des doses plus élevées),
· perte de coordination (en particulier à des doses plus élevées),
· confusion (en particulier à des doses plus élevées),
· hallucinations (en particulier à des doses plus élevées),
· température du corps élevée,
· certaines pathologies cardiaques (battements cardiaques rapides, battements cardiaques irréguliers, ralentissement temporaire accru des battements cardiaques),
· bouffées vasomotrices,
· difficulté à uriner.
Effets indésirables peu fréquents (peuvent toucher jusqu’à 1 personne sur 100)
· réactions psychotiques.
Effets indésirables rares (peuvent toucher jusqu’à 1 personne sur 1 000)
· réactions allergiques,
· crises épileptiques (crises convulsives),
· somnolence.
Effets indésirables très rares (peuvent toucher jusqu’à 1 personne sur 10 000)
· réaction d’hypersensibilité grave,
· battement cardiaque irrégulier dont fibrillation ventriculaire,
· douleurs thoraciques,
· hausse rapide de la tension artérielle.
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
· maux de tête,
· agitation,
· démarche instable et problèmes d’équilibre,
· insomnie.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER ATROPINE (SULFATE) AGUETTANT 0,25 mg/mL, solution injectable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte. La date de péremption fait référence au dernier jour de ce mois.
Après ouverture : le produit doit être utilisé immédiatement.
Ce médicament ne nécessite pas de précautions particulières de conservation.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient ATROPINE (SULFATE) AGUETTANT 0,25 mg/mL, solution injectable
· La substance active est :
Sulfate d’atropine................................................................................................................ 0,25 mg
Pour une ampoule de 1 mL.
Un mL de solution injectable contient 0,25 mg de monohydrate de sulfate d’atropine, équivalant à 0.208 mg d’atropine.
Une ampoule de 1 mL contient 0,25 mg de monohydrate de sulfate d’atropine, équivalant à 0.208 mg d’atropine.
· Les autres composants sont : chlorure de sodium, acide chlorhydrique concentré, eau pour préparations injectables.
Ce médicament se présente sous forme de solution injectable en ampoule de 1 mL. Boîte de 10 ou 100 ampoules.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
1 RUE ALEXANDER FLEMING
69007 LYON
Exploitant de l’autorisation de mise sur le marché
1 RUE ALEXANDER FLEMING
69007 LYON
1 RUE ALEXANDER FLEMING
69007 LYON
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
{MM/AAAA}
Sans objet.