Dernière mise à jour le 02/02/2026
OTIPAX, solution pour instillation auriculaire
Présentations
> 1 flacon(s) en verre jaune(brun) de 16 g avec embout(s) avec compte-gouttes polyéthylène acétate de polyvinyle
Code CIP : 327 906-6 ou 34009 327 906 6 1
Déclaration de commercialisation : 19/03/1986
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 1,88 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 2,90 €
- Taux de remboursement :15%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Faible | Avis du 07/03/2018 | Renouvellement d'inscription (CT) | Le service médical rendu par OTIPAX reste faible dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 05/08/2024
OTIPAX, solution pour instillation auriculaire
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Phénazone............................................................................................................................. 4,00 g
Chlorhydrate de lidocaïne....................................................................................................... 1,00 g
Pour 100 g de solution pour instillation auriculaire.
Excipients à effet notoire : Glycérol, éthanol.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution pour instillation auriculaire.
4.1. Indications thérapeutiques
Traitement symptomatique local de certains états douloureux de l'oreille moyenne à tympan fermé :
- Otite moyenne aiguë congestive,
- Otite grippale dite phlycténulaire,
- Otite barotraumatique.
4.2. Posologie et mode d'administration
4 gouttes 2 à 3 fois par jour dans l'oreille douloureuse.
Mode d’administration
Voie auriculaire.
Flacon compte-gouttes : verser 4 gouttes dans le conduit auditif en exerçant une légère pression sur la partie souple du compte-gouttes.
Afin d'éviter le contact désagréable de la solution froide dans l'oreille, réchauffer le flacon entre les mains avant emploi.
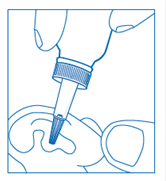
Ce médicament NE DOIT JAMAIS ETRE UTILISE en cas de :
- Perforation tympanique d'origine infectieuse ou traumatique (voir rubrique 4.4),
- Hypersensibilité aux substances actives, notamment à la lidocaïne, ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
Par mesure de précaution, S'ASSURER DE L'INTEGRITE TYMPANIQUE AVANT TOUTE ADMINISTRATION.
En cas de destruction tympanique, l'administration intra-auriculaire risque de mettre en contact le produit avec les structures de l'oreille moyenne et d'être à l'origine d'effets indésirables à leur niveau.
L'attention des sportifs est attirée sur le fait que cette spécialité contient un principe actif pouvant induire une réaction positive des tests pratiqués lors des contrôles anti-dopage.
Précautions d'emploi
Limiter la durée de traitement à 10 jours. Au-delà, la conduite thérapeutique devra être réévaluée.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Les données disponibles à ce jour ne laissent pas supposer l'existence d'interactions cliniquement significatives.
4.6. Fertilité, grossesse et allaitement
Le passage systémique en l'absence de brèche tympanique est peu probable.
En conséquence, dans les conditions normales d'utilisation, ce médicament peut en cas de besoin, être administré au cours de la grossesse ou en cas d'allaitement.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Risque de réactions locales de type allergie, irritation ou hyperhémie du conduit auditif.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.ansm.sante.fr.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Phénazone : dérivé pyrazole possédant des propriétés analgésiques et anti-inflammatoires.
Lidocaïne : anesthésique local du groupe amide.
5.2. Propriétés pharmacocinétiques
Il n'y a pas de passage systémique sauf en cas de brèche tympanique.
5.3. Données de sécurité préclinique
Thiosulfate de sodium, éthanol, glycérol, eau purifiée.
Flacon de verre et tube : 3 ans.
Flacon de verre après première ouverture : 30 jours.
Tube après première ouverture : 10 jours.
6.4. Précautions particulières de conservation
A conserver à une température inférieure à 30°C.
6.5. Nature et contenu de l'emballage extérieur
Flacon (verre jaune de type III) de 15 ml (contenant 16 g de solution) fermé par un bouchon (PEBD) doté d'un joint (PEBD) muni d'un embout compte-gouttes (PE/acétate de vinyle) et d'un bouchon (PEBD), boîte de 1.
Tube (aluminium verni) contenant 5 g de solution, fermé par un compte-gouttes en PEHD, lui-même fermé par un bouchon à vis en PEHD, boîte de 1.
6.6. Précautions particulières d’élimination et de manipulation
Pas d'exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
22 RUE DES AQUEDUCS
94250 GENTILLY
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 000 5 9 : 5 g en tube (aluminium verni) + embout compte-gouttes (PEHD)
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 05/08/2024
OTIPAX, solution pour instillation auriculaire
Phénazone / Chlorhydrate de lidocaïne
Veuillez lire attentivement cette notice avant d’utiliser ce médicament car elle contient des informations importantes pour vous.
Vous devez toujours utiliser ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin ou votre pharmacien.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre pharmacien pour tout conseil ou information.
· Si vous ressentez l’un des effets indésirables, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien.
1. Qu'est-ce que OTIPAX, solution pour instillation auriculaire et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser OTIPAX, solution pour instillation auriculaire ?
3. Comment utiliser OTIPAX, solution pour instillation auriculaire ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver OTIPAX, solution pour instillation auriculaire ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE OTIPAX, solution pour instillation auriculaire ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : ANTALGIQUE LOCAL /ANTI-INFLAMMATOIRE A USAGE OTOLOGIQUE (S : Organe des sens), Code ATC : S02DC
Traitement local des douleurs dues à certaines otites à tympan fermé :
· Otite moyenne aiguë congestive,
· Otite grippale dite phlycténulaire,
· Otite barotraumatique.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D'UTILISER OTIPAX, solution pour instillation auriculaire ?
N’utilisez jamais OTIPAX, solution pour instillation auriculaire dans les cas suivants :
· Si vous êtes allergiques aux substances actives ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· Si vous avez une perforation du tympan,
EN CAS DE DOUTE, IL EST INDISPENSABLE DE DEMANDER L'AVIS DE VOTRE MEDECIN OU DE VOTRE PHARMACIEN.
Avertissements et précautions
Mises en garde spéciales
Si le tympan est ouvert, ce médicament peut être à l'origine d'effets indésirables au niveau de l'oreille moyenne.
PAR MESURE DE PRECAUTION, avant toute administration, il convient de faire vérifier l'intégrité de votre tympan par UN MEDECIN.
Précautions d'emploi
La durée de traitement ne doit pas dépasser 10 jours. Si les symptômes persistent, CONSULTEZ VOTRE MEDECIN.
EN CAS DE DOUTE NE PAS HESITER A DEMANDER L'AVIS DE VOTRE MEDECIN OU DE VOTRE PHARMACIEN
Enfants
Sans objet.
Autres médicaments et OTIPAX, solution pour instillation auriculaire
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris, ou pourriez prendre tout autre médicament.
OTIPAX, solution pour instillation auriculaire avec des aliments, boissons et de l’alcool
Dans les conditions normales d'utilisation, ce médicament peut, en cas de besoin, être administré au cours de la grossesse ou en cas d'allaitement.
D'une façon générale, il convient, au cours de la grossesse et de l'allaitement de toujours demander l'avis de votre médecin ou de votre pharmacien avant d'utiliser un médicament
Sportifs
L'attention des sportifs est attirée sur le fait que cette spécialité contient un principe actif pouvant induire une réaction positive des tests pratiqués lors des contrôles anti-dopage.
Conduite de véhicules et utilisation de machines
Sans objet.
OTIPAX, solution pour instillation auriculaire contient du glycérol et de l’éthanol.
3. COMMENT UTILISER OTIPAX, solution pour instillation auriculaire ?
Instructions pour un bon usage
Posologie
· Flacon compte-gouttes ou tube : verser 4 gouttes dans le conduit auditif en exerçant une légère pression sur la partie souple du compte-gouttes, 2 à 3 fois par jour dans l’oreille douloureuse.
Mode et voie d'administration
Voie auriculaire.
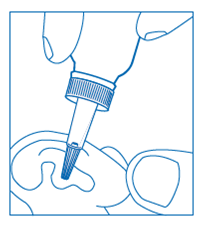
Comment utiliser le flacon compte-gouttes :
· Dévisser le bouchon du flacon,
· Visser le compte-gouttes sur le flacon,
· Retirer le bouchon du compte-gouttes,
· Retourner le flacon et presser doucement l'embout pour obtenir 1 goutte,
· Presser à nouveau jusqu'à l'obtention de 4 gouttes,
· Reboucher le capuchon sur l'embout après utilisation.
Réchauffer entre les mains le flacon pour éviter la sensation désagréable de la solution froide dans l'oreille.
Durée du traitement
Ne pas dépasser 10 jours de traitement. Si les symptômes persistent, CONSULTEZ VOTRE MEDECIN.
Si vous avez utilisé plus de OTIPAX, solution pour instillation auriculaire que vous n’auriez dû
Sans objet.
Si vous oubliez d’utiliser OTIPAX, solution pour instillation auriculaire
Si vous arrêtez d’utiliser OTIPAX, solution pour instillation auricalaire
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
· Risque de réactions locales de type allergie, irritation ou rougeur du conduit auditif. Déclaration des effets secondaires
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.ansm.sante.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER OTIPAX, solution pour instillation auriculaire ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption mentionnée sur le conditionnement extérieur. La date de péremption fait référence au dernier jour de ce mois.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
Durée d’utilisation du flacon après première ouverture : 30 jours.
Durée d’utilisation du tube après ouverture : 10 jours.
Conditions de conservation
A conserver à une température ne dépassant pas 30°C.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient OTIPAX, solution pour instillation auriculaire
Les substances actives sont :
Phénazone ................................................................................................................................ 4 g
Chlorhydrate de lidocaïne ........................................................................................................... 1 g
Pour 100 g de solution pour instillation auriculaire.
Les autres composants sont :
Thiosulfate de sodium, éthanol, glycérol, eau purifiée.
Qu’est-ce que OTIPAX, solution pour instillation auriculaire et contenu de l’emballage extérieur
Ce médicament se présente sous la forme d’une solution pour instillation auriculaire en flacon de 16 g ou tube de 5 g.
Titulaire de l’autorisation de mise sur le marché
22 RUE DES AQUEDUCS
94250 GENTILLY
Exploitant de l’autorisation de mise sur le marché
22 RUE DES AQUEDUCS
94250 GENTILLY
1, AVENUE BLAISE PASCAL
60000 BEAUVAIS
FRANCE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Sans objet.