Dernière mise à jour le 01/12/2025
Ca-DTPA 250 mg/mL, solution injectable
Indications thérapeutiques
Classe pharmacothérapeutique - code ATC : V03AB
Indications thérapeutiques
Ca-DTPA 250 mg/mL, solution injectable est utilisé localement dans le traitement des plaies contaminées et en nébulisation dans le traitement des contaminations pulmonaires par les radionucléides des éléments suivants : le plutonium, l’américium, le curium, le fer et le cobalt, pour favoriser leur élimination. Ce médicament est également utilisé par voie intraveineuse dans un but thérapeutique en cas d’autres voies de pénétration ou d’incorporation, ou dans un but de recueil pour diagnostic en cas de suspicion de contamination interne.
Présentations
> 10 ampoule(s) en verre de 4 ml
Code CIP : 571 438-8 ou 34009 571 438 8 6
Déclaration de commercialisation : 30/11/2008
Cette présentation n'est pas agréée aux collectivités
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 02/04/2024
Ca-DTPA 250 mg/mL, solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Pentétate de calcium trisodique............................................................................................. 250 mg
Pour 1 mL
1 ampoule de 4 mL contient 1 g de pentétate de calcium trisodique.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution limpide, incolore à jaune.
pH : 7,3 à 7,7
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Posologie
· Voie intraveineuse
o la posologie recommandée chez l’adulte et chez l’adolescent est de 0,5 g par jour, (soit ½ ampoule), sans dépasser 1 g par jour.
o chez les enfants de moins de 12 ans, la posologie est déterminée en fonction de la masse corporelle (14 mg/Kg) sans dépasser 0,5 g par jour.
o en cas de nécessité de traitement prolongé, le schéma suivant peut être proposé :
§ 1 injection par jour pendant 3 à 5 jours
§ 2 à 3 injections par semaine pendant 3 semaines
§ 1 injection par semaine pendant 3 mois
§ à poursuivre au-delà de 3 mois, en fonction des résultats de la mesure de l’excrétion urinaire. La posologie peut alors être réduite à 0,25 g par jour.
· Voie cutanée :
En traitement local, cette voie peut être utilisée en complément de la voie IV :
o une à plusieurs ampoules versées directement sur la peau saine, en associant les autres méthodes de décontamination
o une à plusieurs ampoules sur les plaies contaminées.
· Voie inhalée
En traitement des contaminations internes par inhalation dans les 24h suivant l’exposition, cette voie peut être utilisée en complément de la voie IV:
o 1 g en prise unique en nébulisation (1 ampoule de 4 mL).
Population pédiatrique
La sécurité et l’efficacité de la voie injectable et de la voie inhalée par administration par nébulisation n’ont pas été établies dans la population pédiatrique.
Mode d’administration
La voie injectable est uniquement pour administration intraveineuse. Le Ca-DTPA 250 mg/mL, solution injectable doit être administré en injection intraveineuse lente ou par perfusion d’un quart d’heure environ, en diluant le traitement dans 100 à 200 mL de solution saline ou de glucose à 50 g/L.
La voie inhalée est uniquement pour administration par nébulisation.
Réaction allergique lors d’une précédente administration.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
Le Ca-DTPA 250 mg/mL, solution injectable est un agent chélateur qui peut entraîner la déplétion de métaux endogènes présents dans l’organisme à l’état de traces tels que zinc, manganèse, magnésium, fer ou cobalt. Cette déplétion augmente avec la quantité de chélateur administré, avec la fréquence des administrations et avec la durée du traitement. Une seule dose initiale journalière est recommandée. Si le traitement par Ca-DTPA 250 mg/mL, solution injectable, est poursuivi, on associera éventuellement un apport de zinc, de façon concomitante et appropriée.
Patients atteints d’hémochromatose sévère
Le traitement prolongé par Ca-DTPA doit être évité chez les patients atteints d’hémochromatose sévère. La posologie maximale ne doit en aucun cas dépasser 1 g/jour de Ca-DTPA.
Patients asthmatiques
L’inhalation de Ca-DTPA peut potentiellement déclencher des crises d’asthme ou une allergie cutanée chez les sujets prédisposés, et doit être utilisée avec précaution dans cette population.
Précautions d’emploi
Chez les individus ayant subi une exposition interne par le plutonium, l’américium ou le curium, le Ca-DTPA augmente l’excrétion de la radioactivité dans les urines. Ces radionucléides sont connus pour être excrétés dans les urines, et les selles et passent dans le lait.
En cas de contamination majeure par les radionucléides, des précautions concernant les excrétas des patients doivent être mises en œuvre, après avis d’une personne compétente en radioprotection.
Durant le traitement, il convient :
· d’évaluer le niveau de contamination par des mesures pratiquées sur les urines, et éventuellement, les selles, le sang, et par anthroporadiamétrie.
· de surveiller les concentrations sériques et urinaires des électrolytes. Si l’individu reçoit un traitement prolongé par le Ca-DTPA 250 mg/mL, solution injectable, ces dosages doivent permettre de prévoir une éventuelle supplémentation minérale.
· d’enregistrer tout effet indésirable provenant de Ca-DTPA 250 mg/mL, solution injectable.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d’interaction n’a été réalisée.
En cas de contamination concomitante par des radionucléides de l’iode ou du césium, le traitement par voie orale par iodure de potassium ou sel de ferrocyanure peut être également mis en route.
4.6. Fertilité, grossesse et allaitement
Grossesse
Les données nécessaires à l’évaluation du risque de la prise du Ca-DTPA 250 mg/mL, solution injectable, sur le développement fœtal ne sont pas disponibles. C’est pourquoi, le traitement n’est pas recommandé durant la grossesse hormis dans les cas de contamination importante et avérée, y compris par inhalation. Dans ces cas, la toxicité pour la mère et le fœtus induite par le Ca-DTPA doit être considérée en comparaison à la toxicité induite par la radiation.
Les études pour évaluer l’excrétion du Ca-DTPA dans le lait n’ont pas été conduites. Mais les radionucléides sont généralement connus pour être excrétés dans le lait maternel.
Il convient donc chez la femme allaitant d’interrompre l’allaitement dès la suspicion de contamination, qu’elle ait ou non reçu le traitement.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil de sécurité
De rares effets indésirables non spécifiques ont été décrits dans la littérature : céphalées, nausées, vomissements, diarrhées, fièvre, asthénie, prurit, crampes musculaires, réaction au site d’injection.
Ces symptômes diminueraient au cours du traitement.
Une réaction allergique (angioedème, urticaire) peut également avoir lieu qui contre indique la poursuite du traitement. Des cas d’intolérance pulmonaire (toux, gêne respiratoire) ont été décrits chez des individus ayant reçu du Ca-DTPA par voie inhalée, dont certains concernaient des sujets asthmatiques. En ce qui concerne les paramètres urinaires et sanguins, des hématuries microscopiques asymptomatiques ont été observées chez certains sujets traités par Ca-DTPA. Si un rôle du traitement n’est pas exclu dans ces observations, elles peuvent également être la conséquence d’un effet toxique des radionucléides sur le rein. Le lien de causalité avec le traitement est donc difficile à établir. Ces hématuries microscopiques ne sont pas associées à des altérations de la fonction rénale à long-terme, comme le montrent les valeurs normales de créatininémie et d’azotémie mesurées chez les sujets exposés au Ca-DTPA.
Tableau récapitulatif des effets indésirables
Les effets indésirables sont listés ci-dessous par classe d'organe et par fréquence (nombre de patients attendus pour cette réaction) selon les catégories suivantes :
Convention en matière de fréquence : très fréquent (1/10), fréquent (1/100, <1/10), peu fréquent (1/1000, <1/100), rare (1/10 000, <1/1000), très rare (<1/10 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Affections du système immunitaire
Rare: prurit
Fréquence indéterminée: angioedème, urticaire
Affections du système nerveux
Rare: céphalées
Affections respiratoires, thoraciques et médiastinales
Fréquence indéterminée: toux, gêne respiratoire (uniquement en cas d'administration par voie inhalée)
Affections gastro-intestinales
Rare: nausées, vomissements, diarrhées
Affections musculo-squelettiques et systémiques
Rare: crampes musculaires
Affections du rein et des voies urinaires
Fréquence indéterminée: hématuries microscopiques asymptomatiques
Troubles généraux et anomalies au site d'administration
Rare: asthénie, fièvre, réaction au site d'injection
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/ .
Aucun cas de surdosage n’a été rapporté.
5. PROPRIETES PHARMACOLOGIQUES
Depuis plus de 40 ans, la forme injectable du Ca-DTPA est utilisée dans la prise en charge médicale d’une exposition interne (par inhalation accidentelle, par passage cutané ou plus rarement par ingestion) par les radionucléides transuraniens sous forme soluble (transférable), principalement le plutonium, l’américium ou le curium. Les autres radionucléides transuraniens ont une demi-vie beaucoup plus courte et sont plus rares (californium, einsteinium, fermium, mendélévium ). Ca-DTPA favorise l’excrétion urinaire des radionucléides du plutonium, américium et curium. Ce traitement n’est pas efficace à la suite d’une contamination par l’uranium ou le neptunium, pour des raisons en partie biocinétiques.
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : antidote, code ATC : V03AB.
Mécanisme d’action
Le Ca-DTPA forme des chélates stables avec les ions métalliques par échange avec les ions calcium, formant ainsi des complexes plus stables.
Le Ca-DTPA a une forte affinité pour certains éléments transuraniens comme le plutonium (valence IV), l’américium (valence III) et le curium (valence III).
Le Ca-DTPA est efficace pour des formes solubles de plutonium comme le nitrate ou le chlorure mais très peu efficace pour des formes insolubles comme les oxydes ou les complexes organiques type TBP (tributylphosphate).
Le Ca-DTPA complexe également les métaux de transition, tels que le fer, le cobalt et le zinc.
Effets pharmacodynamiques
Le Ca-DTPA est donc utilisé pour augmenter l’élimination spontanée des éléments transuraniens comme le plutonium (valence IV), l’américium (valence III) et le curium (valence III). Lors d’une intoxication par un radionucléide, les chélates ainsi formés sont éliminés par filtration glomérulaire dans l’urine.
Dans son action de complexation, le Ca-DTPA se trouve, en milieu biologique, en compétition avec des complexants endogènes du plutonium tels que la transferrine et les acides organiques (carbonates, citrates). Le Ca-DTPA n’agit pas sur les agrégats que le plutonium (IV) forme par hydrolyse dans le sang.
Les connaissances acquises conduisent à employer, le plus tôt possible après une contamination, un excès volontaire de Ca-DTPA pour en obtenir une concentration suffisante dans le sang, face aux enchaînements métaboliques multiples de cette phase.
Au cours de son séjour dans l’organisme, le Ca-DTPA n’est pas métabolisé et est excrété tel quel (Durbin 1989).
5.2. Propriétés pharmacocinétiques
Propriétés pharmacocinétiques du plutonium
La disponibilité plasmatique du plutonium diminue assez rapidement selon une somme d’exponentielles ; une partie importante correspond à la charge des organes cibles (squelette, foie), avec des périodes biologiques de l’ordre de 20 minutes et de 24 heures. C’est pourquoi la chélation est d’autant plus efficace qu’elle est commencée tôt après la contamination par le radionucléide, avant que celui-ci soit réparti dans les tissus cibles. La répartition décrite initialement pour ces deux organes a été révisée récemment (Leggett 2003) avec 60% pour le foie et 30 % pour le squelette.
Propriétés pharmacocinétiques du Ca-DTPA
· Le Ca-DTPA est très faiblement absorbé par voie orale.
· Après inhalation, une part non négligeable de DTPA est éliminée par voie fécale (environ 30%), correspondant à la déglutition des remontées trachéales de produit.
· Chez l’animal, l’absorption intestinale est d’environ 5% (FDA, 2004).
· Le Ca-DTPA se répartit rapidement dans les fluides extracellulaires. Il ne traverse pas les membranes cellulaires ; la chélation intervient donc principalement dans le sang.
De plus, la période biologique du Ca-DTPA est courte : 12 heures après son administration, il est presque entièrement excrété (Gusev I.A. et al., 2001 – REAC/TS, 2002), plus de 95% de la dose injectée est excrétée en moins de 6h (Durbin et al., 1989). Une étude sur deux volontaires sains a permis de mettre en évidence qu’en 24 heures plus de 99% du Ca-DTPA injecté est excrété dans les urines et moins de 0,5% reste dans le plasma (Stather, 1983).
· Cette même étude s’est appliquée à déterminer la rétention corporelle du Ca-DTPA-(14C). La rétention plasmatique a été suivie jusqu’à 7 heures après injection intraveineuse, elle est décrite par la somme de 3 exponentielles dont les périodes biologiques sont : 1,4 minutes, 14,3 minutes et 95 minutes. Les fractions concernées correspondent respectivement à 60, 20 et 20 % environ de la quantité injectée initialement.
· Après inhalation, en moyenne 23% de la dose de Ca-DTPA délivrée par nébulisation est absorbée dans le sang. Pour une quantité de 1 g délivrée par nébuliseur, on peut donc estimer que le patient recevra environ 230 mg de Ca-DTPA. Les vitesses d’absorption pulmonaire sont relativement lentes, comprises entre 74 min et 109 min chez le sujet non-fumeur. Cette vitesse d’absorption pulmonaire est étroitement liée à l’intégrité de la barrière alvéolo-capillaire : chez le fumeur, chez qui cette barrière est altérée, les demi-vies sont réduites à 24 min.
Modèle pharmacocinétique
· Le modèle compartimental du Ca-DTPA dans l’organisme a été décrit dans le cadre du projet CONRAD (European COordinated Network on RAdiation Dosimetry), en intégrant un compartiment lymphatique au modèle initial (Breustedt, 2010).
Figure 1. Modèle compartimental du comportement du 14Ca-DTPA après injection IV selon CONRAD
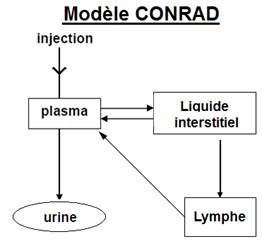
· Sur les données humaines précédentes, la modélisation conduit aux taux de transfert du plasma vers les liquides extracellulaires LEC et des LEC vers le plasma ; ils sont très courts avec des périodes biologiques respectives de 2,5 et 6,3 minutes. La demi-vie de clairance plasmatique du Ca-DTPA est de 19 minutes environ, similaire à celle de l’inuline (17 minutes) ce qui est en faveur d’une excrétion par filtration glomérulaire (figure 1).
· La clairance du Ca-DTPA à partir du plasma, dans les premières heures est le reflet non seulement de l’excrétion urinaire mais aussi indicative d’un transfert important du plasma dans les liquides extracellulaires rapidement après l’injection (CDER/FDA, 2004).
Propriétés pharmacocinétiques du complexe Pu-DTPA
· L’élimination urinaire du complexe Pu-DTPA apparaît se dérouler de manière biphasique : une phase rapide pour 25% de la quantité produite, avec une période biologique de 12 heures et une phase lente pour la quantité restante avec une période de 7 jours (Jolly LJr, 1972).
La période biologique courte du Ca-DTPA et son action limitée au sang, ne permet donc pas de chélater le plutonium dès lors qu’il est fixé dans ses organes de dépôt. Ceci justifie une administration thérapeutique la plus précoce possible, avant la fixation du contaminant dans les organes de dépôt et par la suite la répétition éventuelle des injections pour piéger la fraction circulante du contaminant.
5.3. Données de sécurité préclinique
L’administration chronique de Ca-DTPA par voie systémique chez le rongeur (2 injections i.p. par semaine, 44 semaines) est bien tolérée, avec notamment une absence de modification des concentrations tissulaires en oligo-éléments.
Chez le rat l’instillation intratrachéale d’une solution de Ca-DTPA (3 à 4 instillations tous les 2 jours aux doses de 170 à 390 mg/kg) entraine une inflammation des tissus pulmonaires croissante avec les doses, l’effet étant réversible dans les 2 à 4 semaines après l’arrêt des traitements.
Les études de génotoxicité in vitro et in vivo permettent de conclure en l’absence de potentiel génotoxique du Ca-DTPA. Aucune donnée n’est disponible sur le potentiel carcinogène du Ca-DTPA.
Les études de fertilité chez le rat concluent à l’absence d’effet néfaste à la dose de 50 mg/kg, 2 injections/semaine/26 semaines.
Le Ca-DTPA est embryo-toxique chez le rat et le chien. Le mécanisme probable à l’origine de cet effet est la déplétion en oligo-éléments (Cu et Zn) chez le fœtus due à l’activité chélatrice du produit. La NOAEL est de 180 mg/kg chez le rat, par injection s.c.
Acide chlorhydrique, eau pour préparations injectables.
4 ans
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
Conserver les ampoules dans l’emballage extérieur.
6.5. Nature et contenu de l'emballage extérieur
4 mL en ampoule (verre incolore de type I) ; boîte de 10.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
TSA 30004
45404 FLEURY LES AUBRAIS CEDEX
FRANCE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· CIP 34009 571 438 8 6 : 4 mL en ampoule (verre) ; boîte de 10.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 02/04/2024
Ca-DTPA 250 mg/mL, solution injectable
Pentétate de calcium trisodique
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que Ca-DTPA 250 mg/mL, solution injectable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser Ca-DTPA 250 mg/mL, solution injectable?
3. Comment utiliser Ca-DTPA 250 mg/mL, solution injectable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver Ca-DTPA 250 mg/mL, solution injectable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE Ca-DTPA 250 mg/mL, solution injectable ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC : V03AB
Indications thérapeutiques
Ca-DTPA 250 mg/mL, solution injectable est utilisé localement dans le traitement des plaies contaminées et en nébulisation dans le traitement des contaminations pulmonaires par les radionucléides des éléments suivants : le plutonium, l’américium, le curium, le fer et le cobalt, pour favoriser leur élimination. Ce médicament est également utilisé par voie intraveineuse dans un but thérapeutique en cas d’autres voies de pénétration ou d’incorporation, ou dans un but de recueil pour diagnostic en cas de suspicion de contamination interne.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER Ca-DTPA 250 mg/mL, solution injectable ?
N’utilisez jamais Ca-DTPA 250 mg/mL, solution injectable :
· Réaction allergique lors d’une précédente injection.
· Si vous êtes allergique au pentétate de calcium trisodique ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser Ca-DTPA 250 mg/mL.
Mises en garde
Le Ca-DTPA est un agent chélateur qui peut entraîner la déplétion de métaux endogènes à l’état de traces tels que zinc, manganèse, magnésium, fer ou cobalt. Cette déplétion augmente avec la quantité de chélateur administré, avec la fréquence des administrations et avec la durée du traitement. Une seule dose initiale journalière est recommandée.
Le médecin accompagnera le traitement d’une surveillance clinique, biologique et radiotoxicologique adaptée à son utilisation. Une supplémentation en minéraux contenant du zinc peut être entreprise si cela est nécessaire.
L’élimination des radionucléides sera suivie par analyses radiotoxicologiques urinaires et fécales. En cas de contamination importante des mesures sur le sang peuvent être effectuées. Des examens anthroporadiamétriques seront également réalisés. Cela permet d’évaluer l’efficacité du traitement et d’estimer la quantité de radioéléments présents dans l’organisme.
Durant le traitement, il convient d’enregistrer tout effet indésirable du Ca-DTPA 250 mg/mL, solution injectable.
Le traitement prolongé par Ca-DTPA doit être évité chez les patients présentant des troubles du métabolisme du fer comme l’hémochromatose sévère. La posologie maximale ne doit en aucun cas dépasser 1 g/jour de Ca-DTPA.
Voie inhalée
L’inhalation de Ca-DTPA peut potentiellement déclencher des crises d’asthme ou une allergie cutanée chez les sujets prédisposés, et doit être utilisée avec précaution dans cette population.
Précaution d’emploi
· En cas de contamination majeure, des précautions concernant les excréta des patients pourront être mises en œuvre après avis d’une personne compétente en radioprotection.
· Les données des études de carcinogenèse, mutagenèse et effet sur la fertilité ne sont pas disponibles à ce jour.
EN CAS DE DOUTE NE PAS HESITER A DEMANDER L’AVIS DE VOTRE MEDECIN OU DE VOTRE PHARMACIEN
Enfants
Sans objet.
Autres médicaments et Ca-DTPA 250 mg/mL, solution injectable
Aucune étude d’interaction avec d’autres médicaments n’est disponible dans la littérature.
En cas de contamination concomitante par l’iode ou le césium radioactifs, un traitement par voie orale par de l’iodure de potassium ou sel de ferrocyanure peut être également mis en route.
Ca-DTPA 250 mg/mL, solution injectable avec des aliments et boissons
Sans objet.
Grossesse, allaitement et fertilité
L’utilisation n’est pas recommandée pendant la grossesse et l’allaitement.
Les données nécessaires à l’évaluation du risque de la prise du Ca-DTPA sur le développement fœtal ne sont pas disponibles. C’est pourquoi, hormis les cas de contamination importante et avérée, le traitement n’est pas recommandé durant la grossesse.
Les études pour évaluer l’excrétion du Ca-DTPA dans le lait n’ont pas été conduites.
Il convient chez la femme allaitant d’interrompre l’allaitement dès la suspicion de contamination qu’elle ait ou non reçu le traitement.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Conduite de véhicules et utilisation de machines
Sans objet.
Ca-DTPA 250 mg/mL, solution injectable contient de l’acide chlorhydrique et de l’eau pour préparations injectables.
3. COMMENT UTILISER Ca-DTPA 250 mg/mL, solution injectable ?
Le traitement agit par chélation et est d’autant plus efficace qu’il est administré précocement. Le traitement doit être débuté dès que possible après toute contamination, même si elle n’est que suspectée. Cependant, même si le traitement ne peut être initié dès la contamination, il doit être effectué dès que possible ; les résultats des examens de radiotoxicologie urinaire guident ensuite la poursuite du traitement.
· Voie intraveineuse
o la posologie recommandée chez l’adulte et chez l’adolescent est de 0,5 g par jour, (soit ½ ampoule), sans dépasser 1 g par jour.
o chez les enfants de moins de 12 ans, la posologie est déterminée en fonction de la masse corporelle (14 mg/Kg) sans dépasser 0,5 g par jour.
o en cas de nécessité de traitement prolongé, le schéma suivant peut être proposé :
§ 1 injection par jour pendant 3 à 5 jours
§ 2 à 3 injections par semaine pendant 3 semaines
§ 1 injection par semaine pendant 3 mois
§ à poursuivre au-delà de 3 mois, en fonction des résultats de la mesure de l’excrétion urinaire. La posologie peut alors être réduite à 0,25 g par jour.
· Voie cutanée :
o En traitement local, cette voie peut être utilisée en complément de la voie IV ;
§ une à plusieurs ampoules versées directement sur la peau saine, en associant les autres méthodes de décontamination,
§ une à plusieurs ampoules sur les plaies contaminées.
· Voie inhalée
o En traitement des contaminations internes par inhalation dans les 24h suivant l’exposition cette voie peut être utilisée en complément de la voie IV:
§ 1g en prise unique par nébulisation (1 ampoule de 4mL).
Mode d’administration
La voie injectable est uniquement pour administration intraveineuse. Le Ca-DTPA 250 mg/mL, solution injectable doit être administré en injection intraveineuse lente ou par perfusion d’un quart d’heure environ, en diluant le traitement dans 100 à 200 mL de solution saline ou de glucose 50 g/L.
La voie inhalée est uniquement pour administration par nébulisation.
Fréquence d’administration
Voie intraveineuse
Les résultats des analyses radiotoxicologiques des urines de 24 heures, pratiquées avant et après injection du Ca-DTPA permettent d’évaluer l’efficacité du traitement et la nécessité de le poursuivre.
Le schéma suivant peut être proposé :
· une injection par jour pendant 3 à 5 jours
· 2 à 3 injections par semaine pendant 3 semaines
· une injection par semaine pendant 3 mois.
Voie cutanée ou inhalée
Administration unique
Durée du traitement
La durée du traitement dépend de l’importance de la contamination initiale et de la réponse du patient au traitement.
Utilisation chez les enfants
Chez les enfants de moins de 12 ans, la posologie est déterminée en fonction de la masse corporelle (14 mg/kg) sans dépasser 0,5 g par jour.
Si vous avez utilisé plus de Ca-DTPA 250 mg/mL, solution injectable que vous n’auriez dû
CONSULTEZ IMMEDIATEMENT VOTRE MEDECIN OU VOTRE PHARMACIEN.
Si vous oubliez d’utiliser Ca-DTPA 250 mg/mL, solution injectable
Si vous arrêtez d’utiliser Ca-DTPA 250 mg/mL, solution injectable
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
De rares effets indésirables non spécifiques ont été décrits dans la littérature :
· céphalées, nausées, vomissements, diarrhées, fièvre, asthénie, prurit, crampes musculaires,
· réaction au site d’injection.
Ces symptômes diminueraient au cours du traitement.
Autres effets indésirables pour lesquels la fréquence est indéterminée pouvant survenir lors de l’utilisation de Ca-DTPA 250 mg/mL, solution injectable
· Réaction allergique à type d’angioedème ou d’urticaire (éruption cutanée provoquant des démangeaisons) qui contre indique la poursuite du traitement.
· Cas d’intolérance pulmonaire (toux, gêne respiratoire) chez des individus ayant reçu du Ca-DTPA par voie inhalée en particulier chez des sujets asthmatiques.
· Présence de sang (invisible) dans les urines (hématurie microscopique asymptomatique)
Si vous remarquez des effets indésirables non mentionnés dans cette notice, ou si certains effets indésirables deviennent graves, veuillez en informer votre médecin ou votre pharmacien.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER Ca-DTPA 250 mg/mL, solution injectable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’ampoule.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient Ca-DTPA 250 mg/mL, solution injectable
· La substance active est :
Pentétate de calcium trisodique....................................................................................... 250 mg
Pour 1 mL
1 ampoule de 4 mL contient 1 g de pentétate de calcium trisodique.
· Les autres composants sont : acide chlorhydrique, eau pour préparations injectables.
Qu’est-ce que Ca-DTPA 250 mg/mL, solution injectable et contenu de l’emballage extérieur
Ce médicament se présente sous forme de solution injectable, la solution est limpide, incolore à jaune. Boîte de 10 ampoules de 4 mL.
Titulaire de l’autorisation de mise sur le marché
TSA 30004
45404 FLEURY LES AUBRAIS CEDEX
FRANCE
Exploitant de l’autorisation de mise sur le marché
PHARMACIE CENTRALE DES ARMEES
TSA 30004
45404 FLEURY LES AUBRAIS CEDEX
FRANCE
TSA 30004
45404 FLEURY LES AUBRAIS CEDEX
FRANCE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Sans objet.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).