Dernière mise à jour le 01/12/2025
EMERADE 300 microgrammes, solution injectable en stylo prérempli
Indications thérapeutiques
EMERADE est un auto-injecteur contenant de l'adrénaline en solution pour injection intramusculaire (dans le muscle).
L'adrénaline améliore la chute de la pression artérielle observée dans les réactions anaphylactiques. Elle stimule également le cœur et facilite la respiration.
EMERADE est utilisé pour le traitement d'urgence des réactions allergiques sévères (choc anaphylactique) provoquées par des allergènes contenus dans les aliments, les médicaments, les piqûres ou les morsures d'insectes ainsi que par d'autres allergènes ou déclenchées par l'effort ou par des causes inconnues.
Présentations
> 2 stylos préremplis en verre de 0,3 mL
Code CIP : 34009 300 272 7 1
Déclaration de commercialisation : 09/05/2017
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 60,55 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 61,57 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 19/10/2016 | Inscription (CT) | Le service médical rendu par EMERADE 150 microgrammes et EMERADE 300 microgrammes est important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 19/10/2016 | Inscription (CT) | Ces spécialités n’apportent pas d’amélioration du service médical rendu (ASMR V) par rapport à EPIPEN. |
ANSM - Mis à jour le : 20/04/2024
EMERADE 300 microgrammes, solution injectable en stylo prérempli
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Le stylo prérempli contient 0,5 ml de solution d’adrénaline à 1 mg/ml.
EMERADE 300 microgrammes délivre une dose unique de 0,3 ml contenant 300 microgrammes d’adrénaline (sous forme de tartrate).
Une dose unique de 0,3 ml (300 microgrammes) contient 0,15 mg de métabisulfite de sodium (E223).
Pour la liste complète des excipients, voir rubrique 6.1.
Solution injectable en stylo prérempli (auto-injecteur).
Solution limpide et incolore.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
La dose efficace est habituellement comprise entre 5 - 10 microgrammes par kg de poids corporel, mais des doses supérieures peuvent être nécessaires dans certains cas.
Population pédiatrique
Utilisation chez l’enfant : l’utilisation d’EMERADE 500 microgrammes n’est pas recommandée chez l’enfant.
Enfant pesant moins de 15 kg
Une dose inférieure à 150 microgrammes ne peut pas être administrée avec suffisamment de précision chez l’enfant pesant moins de 15 kg et son utilisation, par conséquent, n’est pas recommandée excepté en cas de risque vital et après avis médical.
Enfants pesant entre 15 et 30 kg
La dose recommandée est de 150 microgrammes.
Enfants pesant plus de 30 kg
La dose recommandée est de 300 microgrammes.
Adolescents de plus de 30 kg
Suivre la dose recommandée pour les adultes.
Adultes
La dose recommandée est de 300 microgrammes pour des individus de poids inférieur à 60 kg.
La dose recommandée est de 300 à 500 microgrammes pour des individus de poids supérieur à 60 kg, en fonction du diagnostic clinique.
Une dose initiale doit être administrée dès que les symptômes de l’anaphylaxie sont reconnus.
Mode d’administration
EMERADE est destiné à l’administration intramusculaire d’adrénaline.
A usage unique.
EMERADE doit être administré rapidement dès les premiers signes de l’anaphylaxie. Une administration tardive d’adrénaline est associée à une issue défavorable de l’anaphylaxie.
EMERADE doit être injecté sur la face externe de la cuisse.
Masser la zone autour du site d’injection permet d’accélérer l’absorption.
L’injection peut être réalisée à travers les vêtements.
Le patient/soignant doit être informé qu’après chaque utilisation d’EMERADE :
· Il doit appeler les secours pour demander une assistance médicale immédiate et une ambulance, et indiquer qu’il s’agit d’un choc anaphylactique, même si les symptômes semblent s’améliorer (voir rubrique 4.4).
· S’il est conscient, le patient doit de préférence s’allonger avec les pieds surélevés, ou rester assis s’il présente des difficultés respiratoires. Le patient inconscient doit être allongé sur le côté en position de sécurité.
· Si possible, le patient doit rester sous la surveillance d’une autre personne jusqu’à l’arrivée des secours.
· Si le patient ne se sent toujours pas bien après la première injection, une deuxième injection peut être administrée 5 à 15 minutes après la première injection.
· Il est recommandé de prescrire aux patients 2 stylos EMERADE qu’ils devront porter sur eux en permanence.
Pour un mode d’emploi détaillé, voir la rubrique 6.6.
Il n’existe aucune contre-indication absolue à l’utilisation d’EMERADE en cas d’urgence allergique.
4.4. Mises en garde spéciales et précautions d'emploi
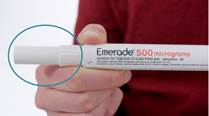
Retirer le capuchon juste avant l’utilisation.
EMERADE doit être administré uniquement dans la partie antérolatérale de la cuisse.
L’injection est délivrée immédiatement après que le cylindre de déclenchement ait été appuyé contre la peau. Les patients doivent être informés de ne pas injecter EMERADE dans le muscle grand glutéal en raison du risque d’injection accidentelle dans une veine.
EMERADE doit être utilisé en cas d’urgence en tant que traitement vital.
Après l’utilisation d’EMERADE, le patient doit rechercher une aide médicale afin de poursuivre le traitement.
Il est nécessaire d’informer de manière détaillée les patients auxquels EMERADE a été prescrit afin qu’ils comprennent correctement les conditions d’utilisation et le mode d’administration (voir rubrique 6.6). Il est aussi vivement conseillé d’éduquer les proches du patient (parents, soignants, enseignants) pour une utilisation correcte d’EMERADE dans le cas où leur aide s’avère nécessaire, dans les situations d’urgence.
Le patient/soignant doit être informé de la possibilité d’une anaphylaxie bi phasique, qui se caractérise par une résolution des symptômes suivie d’une réapparition des symptômes quelques heures plus tard.
Les patients souffrant simultanément d’asthme sont susceptibles de présenter un risque accru de réaction anaphylactique sévère.
Utiliser EMERADE avec précaution chez les patients présentant des pathologies cardiaques, notamment une angine de poitrine, une arythmie cardiaque, un cœur pulmonaire, une cardiomyopathie obstructive et de l’athérosclérose. Il existe également un risque de réactions indésirables après l’administration d’adrénaline à des patients souffrant d’hyperthyroïdie, d’hypertension, d’un phéochromocytome, d’un glaucome, d’une insuffisance rénale sévère, d’un adénome prostatique, d’hypercalcémie, d’hypokaliémie, ou de diabète, ainsi que chez les patients âgés et les femmes enceintes.
Chez les patients présentant une épaisse couche de graisse sous-cutanée, il y a un risque que l'adrénaline soit administrée dans le tissu sous-cutané, ce qui peut entraîner un ralentissement de l'absorption de l'adrénaline (voir rubrique 5.2) et un effet sous-optimal. Cela peut augmenter la nécessité d'une deuxième injection d'EMERADE (voir rubrique 4.2).
Une injection accidentelle dans la main ou le pied peut entrainer une ischémie périphérique susceptible de nécessiter un traitement.
Les patients doivent être avertis de l’existence d’allergènes associés et doivent subir des examens dès que possible afin que l’on puisse caractériser leurs allergènes spécifiques.
EMERADE contient du métabisulfite de sodium
Le métabisulfite de sodium peut rarement provoquer des réactions d’hypersensibilité sévères et un bronchospasme chez les patients sensibilisés, en particulier chez les patients asthmatiques. Ces patients doivent être soigneusement informés des circonstances dans lesquelles EMERADE doit être utilisé.
EMERADE contient du sodium
Ce médicament contient moins de 1 mmol de sodium (23 mg) par dose et peut être considéré « sans sodium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Associations faisant l'objet de précautions d’emploi
Certains médicaments peuvent augmenter l’effet de l’adrénaline : antidépresseurs tricycliques, inhibiteurs de la monoamine-oxydase (MAO) et inhibiteurs de la catéchol-O-méthyltransférase (COMT). L’adrénaline doit être utilisée avec précaution chez les patients recevant des hydrocarbures halogénés et des médicaments associés, ainsi que des médicaments susceptibles de favoriser des arythmies, tels que les digitaliques, la quinidine et les anesthésiques halogénés.
Associations à prendre en compte
L’administration de vasodilatateurs à action rapide ou d’alpha-bloquants peut contrer les effets de l’adrénaline sur la pression artérielle. Les bêta-bloquants peuvent inhiber l’effet stimulateur de l’adrénaline.
En raison de l’effet hyperglycémiant de l’adrénaline, il peut être nécessaire d’augmenter le traitement par insuline ou par hypoglycémiants oraux chez les patients diabétiques.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n’existe aucune étude appropriée et rigoureuse portant sur l’utilisation de l’adrénaline au cours de la grossesse. L’adrénaline ne doit être utilisée pendant la grossesse que si le bénéfice potentiel pour la mère est plus important que le risque éventuel pour le fœtus.
En raison de la faible biodisponibilité orale de l’adrénaline et de sa demi-vie courte, il est peu probable que toute dose d’adrénaline passée dans le lait maternel affecte le nourrisson.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets indésirables de l’adrénaline sont généralement associés à l’activité de celle-ci sur les récepteurs alpha- et bêta-adrénergiques.
Le tableau suivant est basé sur l’expérience de l’utilisation d’adrénaline.
Les effets indésirables sont catégorisés par fréquence comme suit : Très fréquents (≥ 1/10), Fréquents (≥ 1/100 à < 1/10), Peu fréquents (≥ 1/1 000 à < 1/100), Rares (≥ 1/10 000 à < 1/1 000), Très rares (< 1/10 000), ou Fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
Classes de systèmes d'organes |
Fréquence |
Réactions indésirables |
|
Troubles du métabolisme et de la nutrition |
Fréquence indéterminée |
Hyperglycémie, hypokaliémie, acidose |
|
Affections psychiatriques |
Fréquence indéterminée |
Anxiété, hallucinations |
|
Affections du système nerveux central |
Fréquence indéterminée |
Céphalées, sensations vertigineuses, tremblements, syncope |
|
Affections cardiaques |
Fréquence indéterminée |
Tachycardie, arythmie, palpitations, angine de poitrine, cardiomyopathie de stress |
|
Affections vasculaires |
Fréquence indéterminée |
Hypertension, vasoconstriction, ischémie périphérique |
|
Affections respiratoires, thoraciques et médiastinales |
Fréquence indéterminée |
Bronchospasme |
|
Affections gastro-intestinales |
Fréquence indéterminée |
Nausées, vomissements |
|
Troubles généraux et anomalies au site d’administration |
Fréquence indéterminée |
Hyperhidrose, asthénie |
EMERADE contient du métabisulfite de sodium qui est susceptible, dans de rares cas, de provoquer des réactions d'hypersensibilité sévères (voir rubrique 4.4).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
Un surdosage ou une injection intravasculaire accidentelle d'adrénaline peut provoquer une augmentation soudaine de la pression artérielle, susceptible d'entraîner une hémorragie cérébrale. Un œdème pulmonaire grave provoqué par une vasoconstriction périphérique accompagnée d'une stimulation cardiaque peut entraîner le décès. Un œdème pulmonaire grave accompagné de difficultés respiratoires peut être traité à l'aide d'alpha-bloquants à action rapide. Des arythmies menaçant le pronostic vital peuvent être traitées par bêta-bloquants.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
L'adrénaline est l'hormone sympathomimétique active naturelle sécrétée par la médullosurrénale. Elle stimule aussi bien les récepteurs alpha- que bêta-adrénergiques. L'adrénaline constitue le premier choix pour le traitement d'urgence des réactions allergiques sévères et de l'anaphylaxie idiopathique ou induite par l'effort.
Effets pharmacodynamiques
L'adrénaline a un effet vasoconstricteur puissant grâce à sa stimulation alpha-adrénergique. Cet effet combat la vasodilatation et l'augmentation de la perfusion vasculaire menant à un faible flux intravasculaire et à une hypotension, qui constituent les principaux effets pharmacotoxicologiques du choc anaphylactique.
En stimulant les récepteurs bêta-adrénergiques présents dans les poumons, l'adrénaline produit un effet bronchodilatateur puissant, qui diminue le sifflement respiratoire et la dyspnée. L'adrénaline soulage également le prurit, l'urticaire et l'angio-œdème associés à l'anaphylaxie.
5.2. Propriétés pharmacocinétiques
L'adrénaline circulante est métabolisée dans le foie et d'autres tissus par les enzymes COMT et MAO.
Élimination
Les métabolites inactifs sont excrétés par voie urinaire.
Relations pharmacocinétique/pharmacodynamique
La demi-vie plasmatique de l'adrénaline est d'environ 2 à 3 minutes. Cependant, lorsque l'adrénaline est injectée par voie sous-cutanée ou intramusculaire, son absorption est retardée par la vasoconstriction locale et les effets peuvent donc durer plus longtemps que ne le suggère la demi-vie. Il est conseillé de masser la zone autour du site d'injection afin d'accélérer l'absorption.
Une étude de pharmacocinétique/pharmacodynamique sur des sujets sains qui comparait EMERADE 300 microgrammes avec d’autres auto-injecteurs à la même dose, mais avec des aiguilles plus courtes et une force propulsive plus élevée, a montré l’influence de la force propulsive sur les concentrations plasmatiques en adrénaline. Malgré la haute variabilité des concentrations plasmatiques en adrénaline, les dispositifs avec des aiguilles plus courtes ont montré une tendance à une biodisponibilité de l’adrénaline plus importante pendant les 30 premières minutes les plus critiques suivant l’injection, comparé à EMERADE.
Ainsi, malgré une aiguille plus longue, les concentrations plasmatiques en adrénaline apparaissent plus basses après l’injection d’EMERADE comparées aux dispositifs à aiguille plus courte et force propulsive plus élevée. . Les raisons de ce phénomène ne sont pas comprises mais cela souligne l’importance d’avoir 2 stylos EMERADE en permanence sur soi.
Une analyse comparative des produits EMERADE a été conduite sur des sujets sains avec différentes distances peau-muscle (Skin To Muscle Depth = STDM).
Dans la cohorte 1 (STDM ≥ 10, ˂15 mm), les concentrations en adrénaline montraient 2 pics. Un pic initial précoce était observé dans les 5 premières minutes et un second pic apparaissait entre 40 et 60 minutes.
Les concentrations du pic initial étaient généralement plus basses que celles du deuxième pic.
Un pic précoce similaire pouvait être observé pour les concentrations d’adrénaline avec EMERADE 300 microgrammes ou EMERADE 500 microgrammes dans les cohortes 2 (STDM ≥ 15, ≤ 20 mm) et 3 (STDM ≥ 20 mm) bien que le pic initial soit moins marqué que dans la première cohorte.
Après injection d’EMERADE 500 microgrammes, les concentrations en adrénaline avaient rapidement augmenté dans la cohorte 2 jusqu’à atteindre un plateau aux alentours de 8 minutes. Ces concentrations étaient restées stables au niveau de cette valeur pendant 30 minutes environ et avaient baissé sur le reste des points de mesure.
La variabilité des concentrations plasmatiques en adrénaline observée sur les études de pharmacocinétique/pharmacodynamique étant élevée, il est impossible de tirer des conclusions robustes.
La biodisponibilité de l’adrénaline chez les sujets sains avec un tissu sous-cutané bien perfusé ne peut pas être extrapolée obligatoirement aux patients en état de choc anaphylactique chez qui il peut y avoir un arrêt de la circulation périphérique.
Ceci souligne l’importance d’une injection d’adrénaline précoce dès les premiers signes d’anaphylaxie, lorsque les tissus superficiels sont encore bien perfusés afin de maximiser l’absorption de l’adrénaline dans la circulation systémique.
5.3. Données de sécurité préclinique
2 ans.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
Ne pas congeler.
6.5. Nature et contenu de l'emballage extérieur
Seringue en verre préremplie munie d'un piston en caoutchouc polyisoprène et contenue dans un auto-injecteur. Ne contient pas de latex.
Longueur de l’aiguille visible :
EMERADE 300 microgrammes : 23 mm
Emballage : emballage extérieur ainsi qu’un étui en plastique pour conserver l'auto-injecteur.
Présentations : 1 ou 2 stylo(s) prérempli(s).
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Il est très important que le patient reçoive des informations détaillées sur la manière d'utiliser EMERADE.
Exclusivement à usage unique.
La date de péremption est indiquée sur l'étiquette et sur l’emballage extérieur, et EMERADE ne doit pas être utilisé après cette date.
Jeter et remplacer l'auto-injecteur une fois la date de péremption dépassée.
Examiner régulièrement la solution à travers la fenêtre de contrôle du stylo en soulevant l'étiquette afin de vérifier que la solution est limpide et incolore. Jeter et remplacer EMERADE si la solution est colorée ou contient des particules.
Si le patient présente un risque d'anaphylaxie, il doit toujours avoir EMERADE sur lui.
Mode d'administration
Il est nécessaire de suivre rigoureusement le mode d'emploi afin d'éviter toute injection accidentelle.
Il est recommandé que les membres de la famille, soignants ou enseignants soient aussi formés à l’utilisation correcte d’EMERADE.
EMERADE est conçu pour une utilisation facile et doit être considéré comme un médicament de premiers secours. EMERADE doit être administré tôt, dès les premiers signes d'anaphylaxie. EMERADE est destiné à l'administration intramusculaire d'adrénaline. EMERADE doit être injecté sur la face externe de la cuisse et l'injection se produit lorsque le cylindre de déclenchement est fermement appuyé contre la cuisse. L'injection peut être administrée à travers les vêtements. Le massage autour de la zone d'injection accélère l'absorption.
EMERADE dispose d'une ouverture uniquement à l'extrémité où se trouve l'aiguille. L'extrémité opposée ne présente pas d'ouverture.
|
|
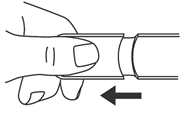
Mode d’utilisation 1. Retirer le capuchon. |
|
|
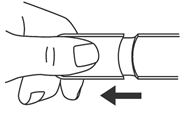
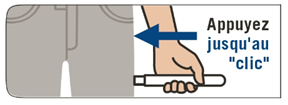
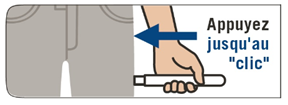
2. Appliquer EMERADE contre la face externe de la cuisse avec un angle de 90° puis appuyer fermement jusqu’à ce que le manchon de protection de l’aiguille soit rétracté. On entend un bruit sec au moment où le dispositif s’active et que l'aiguille pénètre dans la cuisse. |
|
|
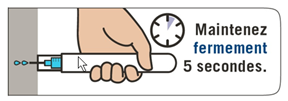
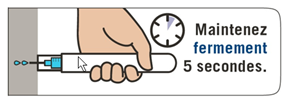
Puis maintenir EMERADE fermement contre la cuisse pendant 5 secondes. Masser ensuite légèrement autour du site d’injection. 3. Composer le 15 (pour la France) ou le 112, demander une ambulance et dire que vous avez un choc anaphylactique. |
L'aiguille contenue dans EMERADE est protégée avant, pendant et après l'injection.
Une fois l'injection réalisée, le manchon de protection de l’aiguille du stylo EMERADE est visiblement déployé et il est possible de voir le piston dans la fenêtre de contrôle en soulevant l'étiquette.
Suite à l’utilisation du stylo EMERADE en suivant les instructions, le patient peut vérifier si le stylo a correctement été activé. Les photos ci-dessous (Fig. 1 et 2) s’appliquent à tous les stylos EMERADE indépendamment du dosage (150, 300 et 500 microgrammes).
|
|
Fig. 1 - Stylo EMERADE non utilisé (avant toute activation) avec le manchon de protection de l’aiguille en position normale |
|
|
Fig. 2 - Stylo EMERADE avec le manchon de protection de l’aiguille déployé. Si le manchon de protection de l’aiguille n’est pas déployé, le stylo n’a pas été activé. |
|
Un stylo EMERADE activé et ayant correctement administré une dose d’adrénaline aura la fenêtre de contrôle (révélée en décollant l'étiquette du stylo) colorée et le piston visible (Fig. 3 à 5). |
|
|
|
Fig. 3 - EMERADE 150 microgrammes Après activation du stylo et injection d’adrénaline, la fenêtre de contrôle apparait jaune. |
|
|
Fig. 4 - EMERADE 300 microgrammes Après activation du stylo et injection d’adrénaline, la fenêtre de contrôle apparait verte. |
|
|
Fig. 5 - EMERADE 500 microgrammes Après activation du stylo et injection d’adrénaline, la fenêtre de contrôle apparait bleue. |
|
Si la fenêtre de contrôle laisse apparaitre une solution incolore (solution d’adrénaline), le stylo n’a pas délivré correctement une dose d’adrénaline. La flèche sur l'étiquette du stylo indique où l'étiquette peut être soulevée afin de révéler la fenêtre de contrôle. Si un stylo d’adrénaline EMERADE ne s’active pas immédiatement, une nouvelle tentative doit être faite en appliquant une force supérieure en repositionnant le stylo contre le site d’injection prévu. En cas d'échec, utilisez immédiatement votre deuxième stylo. |
|
Dans certains cas, une seule dose d'adrénaline ne suffit pas pour soulager une réaction anaphylactique sévère. Pour cette raison, votre médecin est susceptible de vous prescrire deux stylos EMERADE. Si les symptômes ne s’améliorent pas ou s’ils s’aggravent dans les 5 à 15 minutes après la première injection, vous devez ou la personne à proximité doit vous administrer une seconde injection. Pour cette raison, il est recommandé d’avoir en permanence avec vous deux stylos EMERADE.
EMERADE est conçu uniquement comme un traitement d'urgence. Vous devez toujours contacter votre médecin ou vous rendre à l'hôpital le plus proche afin de poursuivre le traitement. Signalez à votre médecin que vous avez effectué une injection d'adrénaline. Apportez l'auto-injecteur utilisé.
Voir rubrique 4.2 pour les instructions à donner au patient/soignant concernant les mesures à prendre après chaque utilisation d'EMERADE.
Ne pas retirer le capuchon, à moins qu'une injection ne soit nécessaire.
Après l'injection, une petite quantité de liquide reste dans l'auto-injecteur. Celui-ci ne peut pas être réutilisé.
Jeter EMERADE en respectant la réglementation locale.
Le mode d'emploi figure sur l'étiquette, l'emballage ainsi que dans la notice.
Des auto-injecteurs sans aiguille sont disponibles à des fins de formation.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
3013 LAKE DRIVE
CITYWEST BUSINESS CAMPUS
DUBLIN 24, D24PPT3
IRLANDE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 300 272 5 7 : 0,30 ml en stylo prérempli (verre) ; boite de 1
· 34009 300 272 7 1 : 0,30 ml en stylo prérempli (verre) ; boite de 2
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 20/04/2024
EMERADE 300 microgrammes, solution injectable en stylo prérempli
Adrénaline
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que EMERADE 300 microgrammes, solution injectable en stylo prérempli et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser EMERADE 300 microgrammes, solution injectable en stylo prérempli ?
3. Comment utiliser EMERADE 300 microgrammes, solution injectable en stylo prérempli ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver EMERADE 300 microgrammes, solution injectable en stylo prérempli ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE EMERADE 300 microgrammes, solution injectable en stylo prérempli ET DANS QUELS CAS EST-IL UTILISE ?
EMERADE est un auto-injecteur contenant de l'adrénaline en solution pour injection intramusculaire (dans le muscle).
L'adrénaline améliore la chute de la pression artérielle observée dans les réactions anaphylactiques. Elle stimule également le cœur et facilite la respiration.
EMERADE est utilisé pour le traitement d'urgence des réactions allergiques sévères (choc anaphylactique) provoquées par des allergènes contenus dans les aliments, les médicaments, les piqûres ou les morsures d'insectes ainsi que par d'autres allergènes ou déclenchées par l'effort ou par des causes inconnues.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER EMERADE 300 microgrammes, solution injectable en stylo prérempli ?
Votre médecin doit vous avoir expliqué quand et comment utiliser EMERADE. Si vous n'êtes pas totalement sûr(e) ou avez des questions, vous devez contacter votre médecin.
EMERADE peut toujours être utilisé en cas d'urgence allergique. Si vous êtes allergique (hypersensible) au métabisulfite de sodium ou à tout autre ingrédient d'EMERADE, votre médecin devra vous informer des circonstances dans lesquelles EMERADE doit être utilisé.
Adressez-vous à votre médecin ou pharmacien avant d’utiliser EMERADE.
Avant d'utiliser EMERADE, informez votre médecin si vous présentez :
· une maladie cardiaque,
· de l'hypertension,
· une hyperthyroïdie,
· du diabète,
· une tumeur de la glande surrénale,
· une pression oculaire accrue,
· une fonction rénale réduite,
· une maladie de la prostate,
· des taux bas de potassium ou des taux élevés de calcium dans le sang.
Si vous souffrez d'asthme, vous êtes susceptible de présenter un risque accru de réaction allergique sévère.
Toute personne présentant un épisode anaphylactique doit consulter son médecin afin de tester les substances auxquelles elle est susceptible d'être allergique, afin que celles-ci puissent être à l'avenir strictement évitées. Il est important de savoir qu'une allergie à une substance peut mener à des allergies à un certain nombre de substances proches.
Si vous présentez des allergies alimentaires, il est important que vous vérifiiez les ingrédients contenus dans tout ce que vous ingérez (y compris les médicaments), car même de petites quantités peuvent provoquer des réactions sévères.
Le risque de présenter des effets indésirables est également plus important si vous êtes âgé(e) ou enceinte.
Il est nécessaire de suivre rigoureusement le mode d'emploi afin d'éviter toute injection accidentelle.
EMERADE doit être administré par voie intramusculaire dans la face externe de la cuisse. Il ne doit pas être injecté dans la fesse en raison du risque d'injection accidentelle dans une veine.
Mises en garde
Une injection accidentelle dans les mains ou les pieds peut entraîner une interruption de l’irrigation sanguine de l’extrémité du membre concerné. En cas d'injection accidentelle dans ces zones, consultez immédiatement le service des urgences de l'hôpital le plus proche pour recevoir un traitement.
Si vous avez une épaisse couche de graisse sous-cutanée, il y a un risque qu’une seule dose d’EMERADE ne soit pas suffisante. Cela peut augmenter la nécessité d’une deuxième injection d’EMERADE. Suivez attentivement les instructions d’utilisation données à la rubrique 3.
Enfants
EMERADE ne doit pas être utilisé chez l'enfant pesant moins de 15 kg.
Une dose inférieure à 150 microgrammes ne peut être administrée avec suffisamment de précision chez l’enfant pesant moins de 15 kg et son utilisation, par conséquent, n’est pas recommandée excepté en cas de risque vital et après avis médical.
Autres médicaments et EMERADE 300 microgrammes, solution injectable en stylo prérempli
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Ceci est particulièrement important si vous prenez :
· des antidépresseurs, tels que les antidépresseurs tricycliques ou les inhibiteurs de la monoamine-oxydase (MAO), car les effets de l'adrénaline peuvent être accrus ;
· des médicaments pour le traitement de la maladie de Parkinson, tels que les inhibiteurs de la catéchol-O-méthyltransférase (COMT), car les effets de l'adrénaline peuvent être accrus ;
· des médicaments rendant votre cœur sensible aux battements irréguliers (arythmies), tels que les digitaliques ou la quinidine ;
· des médicaments contre les maladies cardiaques ou des médicaments pour traiter les troubles du système nerveux central appelés alpha-bloquants et bêta-bloquants, car ils peuvent réduire les effets de l'adrénaline.
· Les patients diabétiques doivent surveiller attentivement leur glycémie après l'utilisation d'EMERADE, car l'adrénaline peut entraîner une augmentation du taux de glucose dans le sang.
EMERADE 300 microgrammes, solution injectable en stylo prérempli avec des aliments et boissons
Sans objet.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin avant de prendre ce médicament.
L'expérience de l'utilisation de l'adrénaline au cours de la grossesse est limitée. Si vous êtes enceinte, vous ne devez cependant pas éviter l'utilisation d'EMERADE en cas d'urgence, car votre vie peut être en danger.
Vous pouvez allaiter après avoir utilisé EMERADE.
Conduite de véhicules et utilisation de machines
Il est peu probable que l'aptitude à conduire des véhicules et à utiliser des machines soit affectée par l'administration d'une injection d'adrénaline. En revanche, elle peut être affectée par une réaction allergique sévère. Si c'est le cas, ne conduisez pas.
EMERADE 300 microgrammes, solution injectable en stylo prérempli contient du métabisulfite de sodium.
Le métabisulfite de sodium est susceptible de provoquer, dans de rares cas, des réactions d’hypersensibilité sévères et des difficultés respiratoires (bronchospasme). Si vous êtes allergique (hypersensible) au métabisulfite de sodium, votre médecin doit vous informer des circonstances dans lesquelles EMERADE doit être utilisé.
EMERADE contient du sodium.
3. COMMENT UTILISER EMERADE 300 microgrammes, solution injectable en stylo prérempli ?
Assurez-vous toujours que vous avez été formé à l'utilisation d'EMERADE et veillez à utiliser EMERADE en suivant exactement les indications de votre médecin. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
Vérifiez la date de péremption de vos auto-injecteurs d'adrénaline et demandez à votre médecin ou infirmier de vous en prescrire de nouveaux avant leur péremption. Les injecteurs périmés peuvent ne pas fonctionner.
Utilisez EMERADE immédiatement en cas de début de signes ou de symptômes d'une réaction allergique aiguë (anaphylaxie). Les réactions peuvent apparaître en quelques minutes après le contact avec l'allergène et les symptômes peuvent être, par exemple, une éruption cutanée, une rougeur de la face et du cou ou un gonflement. Des réactions plus sévères peuvent également affecter la circulation sanguine et la respiration.
Avant d'avoir à utiliser EMERADE, assurez-vous que vous comprenez dans quelles situations vous devez l'utiliser. Si vous présentez un risque d'anaphylaxie, il est important que vous ayez toujours deux stylos d’adrénaline sur vous en permanence. Vous devez conserver EMERADE dans son emballage extérieur d’origine, même s’il reste possible pour le patient/soignant de le conserver dans l’étui spécialement conçu. Le stylo doit toujours rester dans cet étui afin de protéger le stylo et la notice expliquant comment utiliser le stylo en cas d'urgence. Conservez toujours cette notice dans l’étui.
Posologie
Le médecin déterminera la dose en fonction de votre poids corporel.
Adultes de poids inférieur à 60 kg
La dose recommandée est de 300 microgrammes.
Adultes de poids supérieur à 60 kg
La dose recommandée est de 300 à 500 microgrammes.
Enfants et adolescents
L’utilisation d’EMERADE 500 microgrammes n’est pas recommandée chez l’enfant.
Enfants pesant entre 15 kg et 30 kg
La dose recommandée est de 150 microgrammes.
Enfants de plus de 30 kg
La dose recommandée est de 300 microgrammes.
Adolescents de plus de 30 kg
Suivre la dose recommandée pour les adultes.
Mode d’administration
Il est nécessaire de suivre rigoureusement le mode d'emploi afin d'éviter toute injection accidentelle.
Il est recommandé que les membres de votre famille, soignants ou enseignants soient aussi formés à l’utilisation correcte d’EMERADE.
EMERADE doit être utilisé uniquement en injection dans la partie externe de la cuisse dès les premiers signes d’une réaction allergique sévère. L'injection se produit lorsqu'EMERADE est appuyé contre la cuisse. Elle peut se faire à travers les vêtements. EMERADE ne doit pas être injecté dans la fesse.
Si votre injection échoue, vous devez utiliser immédiatement un deuxième stylo.
|
|
Mode d’utilisation 1. Retirez le capuchon. |
|
|
2. Appliquez EMERADE contre la face externe de la cuisse avec un angle de 90° puis appuyez fermement jusqu’à ce que le manchon de protection de l’aiguille soit rétracté. On entend un bruit sec au moment où le dispositif s’active et que l'aiguille pénètre dans la cuisse. |
|
|
Puis maintenez EMERADE fermement contre la cuisse pendant 5 secondes. Massez ensuite légèrement autour du site d’injection. 3. Composez le 15 (pour la France) ou le 112, demandez une ambulance et dîtes que vous avez un choc anaphylactique. |
L'aiguille contenue dans EMERADE est protégée avant, pendant et après l'injection.
Une fois l'injection réalisée, le manchon de protection de l’aiguille du stylo EMERADE est visiblement déployé et il est possible de voir le piston dans la fenêtre de contrôle en soulevant l'étiquette.
Message important à destination des patients
|
· Dans certains cas, une seule dose d'adrénaline ne suffit pas pour soulager une réaction anaphylactique sévère. Pour cette raison, votre médecin est susceptible de vous prescrire deux stylos EMERADE. · Si vos symptômes ne s’améliorent pas ou s’ils s’aggravent dans les 5 à 15 minutes après la première injection, vous devez ou la personne à proximité doit vous administrer une seconde injection. Pour cette raison, il est recommandé d’avoir en permanence avec vous deux stylos EMERADE. · EMERADE est un traitement d'urgence. Vous devez toujours contacter un service médical immédiatement après avoir utilisé EMERADE. Demandez à quelqu’un de rester à vos côtés jusqu’à l’arrivée de l’ambulance au cas où vous vous sentiriez de nouveau mal. · Composez le 15 (pour la France) ou le 112, demandez une ambulance et indiquez que vous avez eu un choc anaphylactique (prononcer « anna-fill-actique », même si vous commencez à vous sentir mieux. Vous devrez vous rendre à l'hôpital pour une observation et un traitement complémentaire si nécessaire. Il existe en effet un risque de récidive de la réaction quelque temps plus tard. Apportez le stylo utilisé. · En attendant l’ambulance, vous devez rester allongé(e) avec les pieds surélevés, sauf si cela entraîne un essoufflement ; dans ce cas, vous devez rester assis(e). · Le patient inconscient doit être allongé sur le côté en position de sécurité. |
Suite à l’utilisation du stylo EMERADE en suivant les instructions, vous pouvez vérifier si le stylo a correctement été activé. Les photos ci-dessous (Fig. 1 et 2) s’appliquent à tous les stylos EMERADE indépendamment du dosage (150, 300 et 500 microgrammes).
|
|
Fig. 1 - Stylo EMERADE non utilisé (avant toute activation) avec le manchon de protection de l’aiguille en position normale |
|
|
Fig. 2 - Stylo EMERADE après utilisation avec le manchon de protection de l’aiguille déployé.
Si le manchon de protection de l’aiguille n’est pas déployé, le stylo n’a pas été activé. |
|
Un stylo EMERADE activé et ayant correctement administré une dose d’adrénaline aura la fenêtre de contrôle (révélée en décollant l'étiquette du stylo) colorée et le piston visible (Fig. 3 à 5).
|
|
|
|
Fig. 3 - EMERADE 150 microgrammes Après activation du stylo et injection d’adrénaline, la fenêtre de contrôle apparait jaune. |
|
|
Fig. 4 - EMERADE 300 microgrammes Après activation du stylo et injection d’adrénaline, la fenêtre de contrôle apparait verte. |
|
|
Fig. 5 - EMERADE 500 microgrammes Après activation du stylo et injection d’adrénaline, la fenêtre de contrôle apparait bleue. |
|
Si la fenêtre de contrôle laisse apparaitre une solution incolore (solution d’adrénaline), le stylo n’a pas délivré correctement une dose d’adrénaline. La flèche sur l'étiquette du stylo indique où l'étiquette peut être soulevée afin de révéler la fenêtre de contrôle. |
|
Ne retirez pas le capuchon, à moins qu'une injection ne soit nécessaire.
Après l'injection, une petite quantité de liquide reste dans l'auto-injecteur. Celui-ci ne peut pas être réutilisé.
Si vous avez utilisé plus de EMERADE 300 microgrammes, solution injectable en stylo prérempli que vous n’auriez dû
Si vous avez pris une dose trop importante ou si vous avez accidentellement injecté EMERADE dans un vaisseau sanguin ou dans votre main, vous devez immédiatement rechercher une aide médicale.
Votre pression artérielle est susceptible d'augmenter brutalement. Un surdosage peut provoquer une augmentation soudaine de la pression artérielle, des battements cardiaques irréguliers et une accumulation de liquide dans les poumons pouvant entraîner des difficultés respiratoires.
Si vous oubliez de prendre EMERADE 300 microgrammes, solution injectable en stylo prérempli
Si vous arrêtez de prendre EMERADE 300 microgrammes, solution injectable en stylo prérempli
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les effets indésirables suivants sont basés sur l'expérience de l'utilisation de l'adrénaline, mais leur fréquence ne peut pas être estimée :
· problèmes cardiaques tels que des battements cardiaques irréguliers et rapides, douleurs thoraciques,
· hypertension, rétrécissement des vaisseaux sanguins,
· sueurs,
· nausées, vomissements,
· difficultés respiratoires,
· maux de tête, sensations de vertige,
· faiblesse, tremblements,
· anxiété, hallucinations,
· malaise,
· modifications de vos valeurs sanguines, telles qu'une augmentation de la glycémie (taux de sucre dans le sang), une diminution du potassium et une augmentation de l'acidité.
EMERADE contient du métabisulfite de sodium qui peut, dans de rares cas, provoquer des réactions d’hypersensibilité sévères et des bronchospasmes.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER EMERADE 300 microgrammes, solution injectable en stylo prérempli ?
Tenir ce médicament hors de la vue et de la portée des enfants.
A conserver dans l’étui de protection en plastique spécialement conçu. L’étui de protection en plastique contenant le(s) stylo(s) peut rester dans l’emballage extérieur en carton.
A conserver à une température ne dépassant pas 25°C.
Ne pas congeler.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette et sur l’emballage extérieur. La date de péremption fait référence au dernier jour de ce mois. Jetez et remplacez EMERADE une fois la date de péremption dépassée.
Examinez régulièrement la solution à travers la fenêtre de contrôle du stylo en soulevant l'étiquette afin de vérifier que la solution est limpide et incolore. N’utilisez pas ce médicament si la solution est colorée ou contient un précipité.
En cas de chute de l'auto-injecteur, inspectez-le. Remplacez-le si vous constatez qu'il est endommagé ou qu'il présente une fuite.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient EMERADE 300 microgrammes, solution injectable en stylo prérempli
· La substance active est l’adrénaline sous forme de tartrate :
EMERADE 300 microgrammes délivre une dose unique de 0,3 ml contenant 300 microgrammes d'adrénaline (sous forme de tartrate).
· Les autres composants : sont le chlorure de sodium, le métabisulfite de sodium (E223), l'édétate disodique, l'acide chlorhydrique et l'eau pour préparation injectable.
EMERADE est un auto-injecteur délivrant une dose unique d'adrénaline. EMERADE est une solution injectable limpide et incolore contenue dans une seringue en verre. EMERADE ne contient pas de latex.
Le dispositif consiste en un cylindre blanc muni d'une protection recouvrant l'aiguille et le mécanisme de déclenchement.
Longueur de l’aiguille visible
EMERADE 300 microgrammes : 23 mm
Présentations : 1 ou 2 stylo(s) prérempli(s).
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
3013 LAKE DRIVE
CITYWEST BUSINESS CAMPUS
DUBLIN 24, D24PPT3
IRLANDE
Exploitant de l’autorisation de mise sur le marché
ZENTIVA FRANCE
35 RUE DU VAL DE MARNE
75013 PARIS
SOLDATTORPSVÄGEN 5
21613 LIMHAMN
SUEDE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Sans objet.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).