Dernière mise à jour le 01/12/2025
INFANRIXQUINTA, poudre et suspension pour suspension injectable. Vaccin diphtérique (D), tétanique (T), coquelucheux (acellulaire, multicomposé) (Ca), poliomyélitique (inactivé) (P) et conjugué de l’Haemophilus influenzae type b (Hib), adsorbé
Indications thérapeutiques
INFANRIXQUINTA est un vaccin utilisé pour protéger votre enfant contre cinq maladies :
Diphtérie : une infection bactérienne grave qui affecte principalement les voies respiratoires et parfois la peau. Les voies respiratoires gonflent, entraînant de graves difficultés respiratoires et parfois une suffocation. La bactérie produit également un poison, qui peut entraîner des lésions du système nerveux, des problèmes cardiaques et même la mort.
Tétanos : la bactérie du tétanos pénètre dans le corps par des coupures, égratignures ou blessures cutanées. Les blessures risquant particulièrement d’entraîner une infection sont les brûlures, les fractures, les plaies profondes ou les plaies ayant été contaminées par de la terre, de la poussière, du fumier, de l’engrais de cheval ou des échardes de bois. La bactérie produit un poison, qui peut entraîner une raideur des muscles, des spasmes musculaires douloureux, des convulsions et même la mort. Les spasmes musculaires peuvent être suffisamment violents pour entraîner des fractures osseuses de la colonne vertébrale.
Coqueluche : une maladie hautement contagieuse qui affecte les voies respiratoires. Elle provoque des quintes de toux sévères qui peuvent gêner la respiration normale. La toux est souvent accompagnée d’un son « caverneux ». La toux peut durer 1 à 2 mois, voire plus. La coqueluche peut aussi entraîner des infections des oreilles, une infection des bronches (bronchite) qui peut se prolonger sur une longue période, une infection des poumons (pneumonie), des convulsions, une lésion cérébrale et même la mort.
Poliomyélite (Polio) : une infection virale. La polio est souvent une maladie bénigne. Cependant, elle peut parfois être très grave et provoquer des lésions permanentes, voire même la mort. La polio peut entraîner une paralysie des muscles (ceux-ci ne peuvent plus bouger). Ceci inclut les muscles nécessaires à la respiration et à la marche. Les bras ou les jambes affectés par la maladie peuvent être douloureusement déformés.
Haemophilus influenzae type b (Hib) : peut provoquer une inflammation (gonflement) du cerveau. Ceci peut conduire à des complications graves telles que : retard mental, paralysie cérébrale, surdité, épilepsie ou cécité partielle. Il peut provoquer également un gonflement de la gorge. Cela peut entraîner la mort par suffocation. Plus rarement, la bactérie peut aussi infecter le sang, le cœur, les poumons, les os, les articulations, et les tissus des yeux et de la bouche.
Comment le vaccin agit-il ?
· INFANRIXQUINTA aide l’organisme de votre enfant à faire sa propre protection (anticorps). Cela protègera votre enfant contre ces maladies.
· Comme tous les vaccins, INFANRIXQUINTA peut ne pas protéger complètement tous les enfants vaccinés.
· Le vaccin ne peut pas provoquer les maladies contre lesquelles il protège.
Composition en substances actives
-
Poudre ( Composition pour une dose de 0,5 ml après reconstitution )
- > polyoside Haemophilus influenzae type b conjugué à l'anatoxine tétanique 10 microgrammes
-
Suspension ( Composition pour une dose de 0,5 ml après reconstitution )
- > anatoxine tétanique supérieure ou égale à 40 UI (10 Lf)
- > anatoxine diphtérique supérieure ou égale à 30 UI (25Lf)
- > antigène coquelucheux : hémagglutinine filamenteuse 25 microgrammes
- > antigène de Bordetella pertussis : pertactine 8 microgrammes
- > virus poliomyelitique souche Mahoney de type 1 inactivé 40 Unités antigènes D
- > virus poliomyélitique souche MEF-1 de type 2 inactivé 8 Unités antigènes D
- > virus poliomyélitique souche Saukett de type 3 inactivé 32 Unités antigènes D
- > antigène coquelucheux : anatoxine 25 microgrammes
Présentations
> 1 flacon(s) en verre - 1 seringue(s) préremplie(s) en verre de 0,5 ml avec aiguille(s) séparée(s)
Code CIP : 355 247-3 ou 34009 355 247 3 7
Déclaration de commercialisation : 28/09/2001
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 23,58 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 24,60 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 20/01/2016 | Renouvellement d'inscription (CT) | Le service médical rendu par INFANRIXQUINTA reste important dans l’indication et la population recommandée. |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 14/09/2023
INFANRIXQUINTA, poudre et suspension pour suspension injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
· Composition de la suspension de la seringue préremplie :
Anatoxine diphtérique1 ......................................................... ³ 30 Unités Internationales (UI) (25Lf)
Anatoxine tétanique1 ............................................................... ³ 40 Unités Internationales (UI) (10Lf)
Antigènes de Bordetella pertussis :
- anatoxine pertussique (PT)1 .............................................................................. 25 microgrammes
- hémagglutinine filamenteuse (FHA)1 .................................................................... 25 microgrammes
- pertactine (PRN)1 ................................................................................................ 8 microgrammes
Virus de la poliomyélite (inactivés) (P)
type 1 (souche Mahoney)².............................................................................. 40 Unités antigènes D
type 2 (souche MEF-1)²..................................................................................... 8 Unités antigènes D
type 3 (souche Saukett)².................................................................................. 32 Unités antigènes D
· Composition de la poudre du flacon :
Polyoside d’Haemophilus influenzae type b (Hib).................................................... 10 microgrammes
(phosphate de polyribosylribitol) (PRP)
Conjugué à l’anatoxine tétanique en tant que protéine vectrice..................... environ 25 microgrammes
1adsorbé sur hydroxyde d’aluminium hydraté (Al(OH)3)....................................... 0,5 milligrammes Al3+
² produit sur des cellules VERO
Le vaccin peut contenir des traces de formaldéhyde, de néomycine et de polymyxine utilisés au cours du procédé de fabrication (voir rubrique 4.3).
Excipients à effet notoire
Le vaccin contient moins de 0,07 nanogramme d’acide para-aminobenzoïque par dose et 0,036 microgramme de phénylalanine par dose (voir rubrique 4.4).
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre et suspension pour suspension injectable.
La suspension est blanche et trouble.
La poudre est blanche.
4.1. Indications thérapeutiques
Ce vaccin ne protège pas contre les infections dues aux autres types d’Haemophilus influenzae, ni contre les méningites dues à d’autres micro-organismes.
Ce vaccin n’a été étudié que chez les enfants de moins de 3 ans.
4.2. Posologie et mode d'administration
INFANRIXQUINTA doit être administré selon les recommandations officielles en vigueur.
Posologie
Primovaccination : 2 injections à l’âge de 2 et 4 mois.
Rappel : 1 injection à l’âge de 11 mois.
Mode d’administration
Administrer par voie intramusculaire.
L’administration se fera de préférence dans la face antérolatérale de la cuisse (tiers moyen), en des sites distincts à chaque injection.
Ne pas injecter par voie intravasculaire.
INFANRIXQUINTA doit être administré avec précaution chez les sujets présentant une thrombocytopénie ou un trouble de la coagulation en raison du risque de saignement qui peut survenir lors de l’administration intramusculaire du vaccin chez ces sujets.
Modalités de reconstitution (voir rubrique 6.6)
Antécédent d'hypersensibilité suivant une vaccination antérieure par des vaccins contre la diphtérie, le tétanos, la coqueluche, la poliomyélite ou Hib, aux substances actives, ou à l'un des excipients de la rubrique 6.1 ou au formaldéhyde, à la néomycine ou à la polymyxine.
INFANRIXQUINTA est contre-indiqué chez les nourrissons ayant présenté une encéphalopathie d’étiologie inconnue, survenue dans les 7 jours suivant une vaccination antérieure par un vaccin contenant la valence coquelucheuse. Dans ce cas, la vaccination anticoquelucheuse doit être suspendue et la vaccination doit être poursuivie avec des vaccins diphtérique-tétanique, poliomyélitique et Hib.
Comme pour les autres vaccins, l’administration d’INFANRIXQUINTA doit être différée chez les sujets atteints d’infections fébriles sévères aiguës. La présence d’une infection bénigne n’est pas une contre-indication.
4.4. Mises en garde spéciales et précautions d'emploi
Si la survenue de l’un des événements suivants est chronologiquement liée à l’administration d’un vaccin contenant la valence coquelucheuse, la décision d’administrer d’autres doses de vaccins contenant la valence coquelucheuse doit être soigneusement évaluée :
· fièvre ³ 40,0°C, dans les 48 heures, sans autre cause identifiable;
· collapsus ou état de choc (syndrome d’hypotonie-hyporéactivité) dans les 48 heures après la vaccination;
· cris persistants, inconsolables pendant une durée ³ 3 heures, survenant dans les 48 heures après la vaccination;
· convulsions, avec ou sans fièvre, survenant dans les 3 jours après la vaccination.
Il peut exister certaines circonstances, notamment en cas d’incidence élevée de coqueluche, où les bénéfices potentiels de la vaccination dépassent les risques éventuels.
Comme pour toute vaccination, le rapport bénéfice risque de réaliser une vaccination par INFANRIXQUINTA ou de la reporter, chez un nourrisson ou un enfant souffrant d’une maladie neurologique sévère qu’elle soit nouvelle ou évolutive doit être évalué avec attention.
En cas de réactions œdémateuses des membres inférieurs survenues dans les suites d’une injection d’un vaccin contenant la valence Haemophilus Influenzae type b, l’administration du vaccin diphtérique-tétanique-coquelucheux-poliomyélitique et du vaccin Haemophilus Influenzae type b conjugué devra être effectuée en deux sites d’injection séparés et sur deux jours différents.
Comme avec tous les vaccins injectables, il est recommandé de toujours disposer d’un traitement médical approprié et d’assurer une surveillance pour le cas rare où surviendrait une réaction anaphylactique suivant l’administration du vaccin.
INFANRIXQUINTA doit être administré avec précaution chez les sujets présentant une thrombocytopénie ou un trouble de la coagulation en raison du risque de saignement qui peut survenir lors de l’administration intramusculaire du vaccin chez ces sujets.
INFANRIXQUINTA ne doit en aucun cas être administré par voie intravasculaire.
Des antécédents de convulsions fébriles nécessitent une attention particulière. Des antécédents familiaux de convulsions ou de syndrome de mort subite du nourrisson ne sont pas des contre-indications.
L’infection par le VIH n’est pas considérée comme une contre-indication. La réponse immunitaire attendue risque de ne pas être obtenue après vaccination chez les patients immunodéprimés.
Chez les enfants traités par des immunodépresseurs (corticothérapie, chimiothérapie antimitotique, etc....), il est recommandé d’attendre la fin du traitement pour vacciner.
Le risque potentiel d'apnée avec nécessité de surveillance respiratoire pendant 48-72 h doit être soigneusement pris en compte lors de l'administration des doses de primovaccination chez les grands prématurés (nés à 28 semaines de grossesse ou moins) et particulièrement chez ceux ayant des antécédents d'immaturité respiratoire. En raison du bénéfice élevé de la vaccination chez ces nourrissons, l'administration ne doit pas être suspendue ou reportée.
L’élimination urinaire de l’antigène polysaccharidique capsulaire a été décrite après administration du vaccin Hib et, par conséquent, la détection d’antigène 1 à 2 semaines après la vaccination ne permet pas le diagnostic d’une éventuelle infection.
Excipients à effet notoire
INFANRIXQUINTA contient de l'acide para-aminobenzoïque. Il peut provoquer des réactions allergiques (éventuellement retardées), et exceptionnellement, des bronchospasmes.
Ce vaccin contient 0,036 microgramme de phénylalanine dans chaque dose. La phénylalanine peut être dangereuse pour les personnes atteintes de phénylcétonurie (PCU), une maladie génétique rare caractérisée par l’accumulation de phénylalanine ne pouvant être éliminée correctement.
Ce vaccin contient moins de 1 mmol (23 mg) de sodium par dose, c'est-à-dire qu’il est essentiellement « sans sodium ».
Ce vaccin contient moins de 1 mmol (39 mg) de potassium par dose, c'est-à-dire qu’il est essentiellement « sans potassium ».
Traçabilité
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
INFANRIXQUINTA peut être administré en même temps que le vaccin contre l'hépatite B, si les sites d'injection sont différents.
Comme avec les autres vaccins, l'immunogénicité peut être diminuée chez les patients traités par des immunosuppresseurs ou présentant un déficit immunitaire.
4.6. Fertilité, grossesse et allaitement
Grossesse
INFANRIXQUINTA n'étant pas destiné à l'adulte, les données de tolérance concernant l'utilisation du vaccin chez la femme durant la grossesse ne sont pas disponibles.
INFANRIXQUINTA n'étant pas destiné à l'adulte, les données de tolérance concernant l'utilisation du vaccin chez la femme allaitante ne sont pas disponibles.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Données d’essais cliniques
Résumé du profil de tolérance
Le profil de tolérance présenté ci-dessous est basé sur des données issues de plus de 3500 sujets (plus de 4400 doses en primovaccination et plus de 2000 doses en rappel).
Liste des effets indésirables
Les effets indésirables rapportés sont classés selon les fréquences suivantes :
Très fréquent : ³ 1/10
Fréquent : ³ 1/100 à < 1/10
Peu fréquent : ³ 1/1000 à < 1/100
Rare : ³ 1/10000 à < 1/1000
Très rare : < 1/10000
Infections et infestations :
Peu fréquent : infection des voies respiratoires hautes.
Affections hématologiques et du système lymphatique :
Peu fréquent : lymphadénopathie.
Troubles du métabolisme et de la nutrition :
Très fréquent : perte d'appétit.
Affections psychiatriques :
Très fréquents : irritabilité, cris inhabituels, agitation.
Affections du système nerveux :
Très fréquent : somnolence.
Affections respiratoires, thoraciques et médiastinales :
Peu fréquent : toux, bronchite, rhinorrhée.
Affections gastro intestinales :
Fréquents : diarrhée, vomissements.
Affections de la peau et du tissu sous-cutané :
Peu fréquent : éruption cutanée, urticaire.
Rare : prurit.
Troubles généraux et anomalies au site d’administration :
Très fréquents : réactions au site d’injection telles que douleur, rougeur, érythème gonflement (£ 50 mm), fièvre (³ 38°C).
Fréquents : réactions au site d’injection telles que induration, et gonflement (> 50 mm)1
Peu fréquent : fièvre2 > 39.5°C, fatigue, gonflement diffus du membre vacciné, se propageant parfois à l’articulation adjacente1.
Une augmentation de la réactogénicité locale et de la fièvre a été rapportée après la dose de rappel d’INFANRIXQUINTA comparée aux doses de primovaccination, comme cela a été observé avec les vaccins combinés contenant les valences diphtérique-tétanique-coquelucheuse acellulaire.
Données de surveillance post commercialisation
Affections respiratoires, thoraciques et médiastinales :
Apnée3 (voir rubrique 4.4. pour l’apnée chez les grands prématurés nés à 28 semaines de grossesse ou moins).
Affections du système immunitaire :
Réactions allergiques (incluant des réactions anaphylactiques3 et anaphylactoïdes).
Affections du système nerveux :
Convulsions3 (avec ou sans fièvre), épisodes d’hypotonie-hyporéactivité.
Affections de la peau et du tissu sous-cutané :
Œdème de Quincke3
Troubles généraux et anomalies au site d’administration :
Lors de l'administration de vaccins contenant la valence Haemophilus type b, des réactions œdémateuses des membres inférieurs ont été rapportées. Il s'agit d'un œdème avec cyanose ou purpura fugace atteignant tout le membre vacciné et quelquefois le membre controlatéral, apparaissant dans les heures suivant la vaccination, pouvant durer plusieurs heures et disparaissant spontanément sans séquelles. Ces réactions s'accompagnent quelquefois de fièvre, de douleur et de pleurs.
Gonflement du membre vacciné dans sa totalité1, vésicules au site d’injection4.
1 Les enfants ayant reçu une primo-vaccination par des vaccins coquelucheux acellulaires développent plus fréquemment une réaction locale de gonflement après l’administration d’une dose de rappel comparé à ceux ayant reçu une primo-vaccination par des vaccins coquelucheux à germes entiers.
Ces réactions surviennent généralement dans les 48 heures et disparaissent spontanément sans séquelle en 4 jours en moyenne.
2Fréquent lors du rappel.
3Observés aussi avec les vaccins GSK contenant les valences diphtérique, tétanique, coquelucheuse acellulaire.
4Observée aussi avec les vaccins GSK contenant les valences diphtérique, tétanique, coquelucheuse acellulaire, poliomyélitique.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
Des cas de surdosage ont été rapportés pendant la surveillance après commercialisation. Les effets indésirables suite à un surdosage, quand ils ont été rapportés, sont similaires à ceux rapportés après une administration recommandée d’INFANRIXQUINTA.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : J: Anti-infectieux ; code ATC : J07CA06
Les résultats obtenus dans les études cliniques pour chacun des composés sont résumés dans le tableau ci-dessous :
Pourcentage de sujets avec des titres en anticorps ³ au seuil défini dans l’étude, 1 mois après primovaccination avec INFANRIXQUINTA :
|
Anticorps (seuil)
|
3-5 mois N= 86 (1 essai) %
|
1,5-3,5-6 mois N= 62 (1 essai) %
|
2-3-4 mois N= 337 (3 essais) %
|
2-4-6 mois N= 624 (6 essais) %
|
3-4-5 mois N= 127 (2 essais) %
|
3-4,5-6 mois N=198 (1 essai) %
|
|
Anti-diphtérique (0,1 UI/ml)* |
94,1 |
100 |
98,8 |
99,3 |
94,4 |
99,5 |
|
Anti-tétanique (0,1 UI/ml)* |
100,0** |
100 |
99,7 |
99,8 |
99,2 |
100 |
|
Anti-toxine pertussique (5 U.EL/ml) |
99,5** |
100 |
99,4 |
100 |
98,4 |
100 |
|
Anti-hémagglutinine filamenteuse (5 U.EL/ml) |
99,7** |
100 |
100 |
100 |
100 |
100 |
|
Anti-pertactine (5 U.EL/ml) |
99,0** |
100 |
100 |
100 |
100 |
100 |
|
Anti-poliomyélitique type 1 (1/8 dilution)* |
93,0 |
ND |
99,1 |
99,5 |
100 |
100 |
|
Anti-poliomyélitique type 2 (1/8 dilution)* |
95,3 |
ND |
95,7 |
99,0 |
99,2 |
100 |
|
Anti-poliomyélitique type 3 (1/8 dilution)* |
98,8 |
ND |
100 |
100 |
99,2 |
99,4 |
|
Anti-PRP (Hib) (0,15 μg/ml)* |
83,7 |
100 |
98,5 |
98,5 |
100 |
98,4 |
|
Anti-PRP (Hib) (1,0 μg/ml) |
51,2 |
87,1 |
68,5 |
76,0 |
97,6 |
81,2 |
* seuil considéré comme indicateur de protection
** résultats après 2 doses, issus d’une étude dans laquelle le vaccin DTCa-P-HepB+Hib était administré à 3, 5 et 11 mois.
N = nombre de sujets
ND = non déterminé
Pourcentage de sujets avec des titres en anticorps ³ au seuil défini dans l’étude, 1 mois après rappel avec INFANRIXQUINTA :
|
Anticorps (seuil)
|
Rappel à 11/12 mois, après une primovaccination à 3-5 mois N=184 (1 essai) % |
Rappel durant la 2ème année de vie, après une primovaccination en 3 doses N=1326 (9 essais) % |
|
Anti-diphtérique (0,1 UI/ml)* |
100 |
99,8 |
|
Anti-tétanique (0,1 UI/ml)* |
99,9** |
99,9 |
|
Anti-toxine pertussique (5 U.EL/ml) |
99,9** |
99,7 |
|
Anti-hémagglutinine filamenteuse (5 U.EL/ml) |
99,9** |
100 |
|
Anti-pertactine (5 U.EL/ml) |
99,5** |
99,9 |
|
Anti-poliomyélitique type 1 (1/8 dilution)* |
99,4 |
99,9 |
|
Anti-poliomyélitique type 2 (1/8 dilution)* |
100 |
100 |
|
Anti-poliomyélitique type 3 (1/8 dilution)* |
99,4 |
100 |
|
Anti-PRP (Hib) (0,15 μg/ml)* |
100 |
100 |
|
Anti-PRP (Hib) (1,0 μg/ml) |
96,7 |
99,2 |
* seuil considéré comme indicateur de protection
** résultats après 3 doses, issus d’une étude dans laquelle le vaccin DTCa-P-HepB+Hib était administré à 3, 5 et 11 mois.
N = nombre de sujets
L’efficacité du composant Hib (lorsqu’il est associé à DTCa, DTCa-P ou DTCa-P-HepB) a été étudiée dans le cadre d’une étude de surveillance post-commercialisation réalisée en Allemagne. Après une période de suivi de 4,5 ans, l’efficacité des vaccins DTCa+Hib ou DTCa-P+Hib était de 96,7% après un schéma complet de primovaccination et de 98,5% après un rappel (quel que soit le nombre de doses reçues en primovaccination). Après une période de suivi de sept ans, l’efficacité du composant Hib de deux vaccins hexavalents était de 89,6% après un schéma complet de primovaccination et de 100% après un schéma complet de primovaccination plus rappel (quelque soit le vaccin Hib utilisé pour la primovaccination).
5.2. Propriétés pharmacocinétiques
L’évaluation des propriétés pharmacocinétiques n’est pas requise pour les vaccins.
5.3. Données de sécurité préclinique
Lactose anhydre
Suspension DTCa-P
Chlorure de sodium
Eau pour préparations injectables
Pour les adjuvants, voir rubrique 2.
3 ans.
Après reconstitution, le vaccin doit être utilisé immédiatement.
6.4. Précautions particulières de conservation
A conserver au réfrigérateur (entre +2°C et +8°C).
Ne pas congeler.
A conserver dans l’emballage extérieur d’origine à l’abri de la lumière.
6.5. Nature et contenu de l'emballage extérieur
La suspension DTCa-P est présentée en seringue préremplie.
La poudre Hib est présentée en flacon de verre.
Poudre en flacon (verre de type I) contenant 1 dose muni d’un bouchon (caoutchouc butyle) + 0,5 ml de suspension en seringue préremplie (verre de type I) munie d’un bouchon-piston (caoutchouc butyle) et d’un embout protecteur en caoutchouc, avec aiguilles séparées - boîte de 1.
Poudre en flacon (verre de type I) contenant 1 dose muni d’un bouchon (caoutchouc butyle) + 0,5 ml de suspension en seringue préremplie (verre de type I) munie d’un bouchon-piston (caoutchouc butyle) et d’un embout protecteur en caoutchouc, sans aiguille - boîte de 1.
L’embout protecteur et le bouchon-piston en caoutchouc de la seringue préremplie ainsi que le bouchon du flacon sont fabriqués avec du caoutchouc synthétique.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Durant la conservation, un dépôt blanc avec un surnageant limpide peut être observé dans la seringue préremplie. Ceci n’est pas un signe de détérioration.
Avant reconstitution :
Un dépôt blanc pouvant se former durant le stockage, la seringue préremplie doit être bien agitée afin d’obtenir une suspension opalescente blanche homogène.
La poudre Hib contenue dans le flacon, la suspension DTCa-P contenue dans la seringue préremplie et le vaccin reconstitué doivent être inspectés visuellement pour mettre en évidence la présence de toute particule étrangère et/ou altération de l’aspect physique. Dans l’un ou l’autre de ces cas, le vaccin ne doit pas être utilisé.
Reconstitution :
Le vaccin est reconstitué en ajoutant la totalité du contenu de la seringue préremplie au flacon contenant la poudre Hib. Agiter jusqu’à dissolution complète de la poudre. Le vaccin reconstitué se présente comme une suspension légèrement plus trouble que le composant liquide seul. Ceci est normal et n’a aucune conséquence sur la qualité du vaccin. Dans les autres cas, le vaccin ne doit pas être utilisé.
Le vaccin doit être administré immédiatement après reconstitution. Prélever la totalité du flacon.
Instructions d’utilisation de la seringue préremplie
|
|
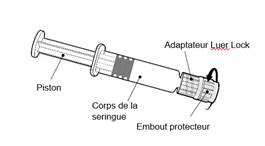
Tenir la seringue par le corps de la seringue et non par le piston. Dévisser l’embout protecteur de la seringue en le tournant dans le sens inverse des aiguilles d’une montre.
|
|
|
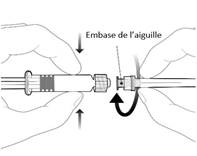
Pour fixer l’aiguille, connecter l’embase de l’aiguille sur l’adaptateur Luer Lock et tourner d’un quart de tour dans le sens des aiguilles d’une montre jusqu’à sentir un blocage. Reconstituer le vaccin comme décrit ci-dessus. Ne pas tirer le piston en dehors du corps de la seringue. Si cela se produit, ne pas administrer le vaccin. |
Instructions d’élimination
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
23 RUE FRANÇOIS JACOB
92500 RUEIL-MALMAISON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 355 247 3 7 : Poudre en flacon (verre de type I) muni d’un bouchon (caoutchouc butyle) + 0,5 ml de suspension en seringue préremplie (verre de type I) munie d’un bouchon-piston (caoutchouc butyle) avec aiguilles séparées- boîte de 1.
· 34009 300 957 2 0 : Poudre en flacon (verre de type I) muni d’un bouchon (caoutchouc butyle) + 0,5 ml de suspension en seringue préremplie (verre de type I) munie d’un bouchon-piston (caoutchouc butyle) sans aiguille – boîte de 1.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 14/09/2023
INFANRIXQUINTA, poudre et suspension pour suspension injectable.
Vaccin diphtérique (D), tétanique (T), coquelucheux (acellulaire, multicomposé) (Ca), poliomyélitique (inactivé) (P) et conjugué de l’Haemophilus influenzae type b (Hib), adsorbé
Veuillez lire attentivement cette notice avant de faire vacciner votre enfant car elle contient des informations importantes pour vous et votre enfant.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament a été personnellement prescrit à votre enfant. Ne le donnez pas à d’autres personnes.
· Si votre enfant ressent un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que INFANRIXQUINTA et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser INFANRIXQUINTA ?
3. Comment utiliser INFANRIXQUINTA ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver INFANRIXQUINTA ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE INFANRIXQUINTA, poudre et suspension pour suspension injectable ET DANS QUELS CAS EST-IL UTILISE ?
INFANRIXQUINTA est un vaccin utilisé pour protéger votre enfant contre cinq maladies :
Diphtérie : une infection bactérienne grave qui affecte principalement les voies respiratoires et parfois la peau. Les voies respiratoires gonflent, entraînant de graves difficultés respiratoires et parfois une suffocation. La bactérie produit également un poison, qui peut entraîner des lésions du système nerveux, des problèmes cardiaques et même la mort.
Tétanos : la bactérie du tétanos pénètre dans le corps par des coupures, égratignures ou blessures cutanées. Les blessures risquant particulièrement d’entraîner une infection sont les brûlures, les fractures, les plaies profondes ou les plaies ayant été contaminées par de la terre, de la poussière, du fumier, de l’engrais de cheval ou des échardes de bois. La bactérie produit un poison, qui peut entraîner une raideur des muscles, des spasmes musculaires douloureux, des convulsions et même la mort. Les spasmes musculaires peuvent être suffisamment violents pour entraîner des fractures osseuses de la colonne vertébrale.
Coqueluche : une maladie hautement contagieuse qui affecte les voies respiratoires. Elle provoque des quintes de toux sévères qui peuvent gêner la respiration normale. La toux est souvent accompagnée d’un son « caverneux ». La toux peut durer 1 à 2 mois, voire plus. La coqueluche peut aussi entraîner des infections des oreilles, une infection des bronches (bronchite) qui peut se prolonger sur une longue période, une infection des poumons (pneumonie), des convulsions, une lésion cérébrale et même la mort.
Poliomyélite (Polio) : une infection virale. La polio est souvent une maladie bénigne. Cependant, elle peut parfois être très grave et provoquer des lésions permanentes, voire même la mort. La polio peut entraîner une paralysie des muscles (ceux-ci ne peuvent plus bouger). Ceci inclut les muscles nécessaires à la respiration et à la marche. Les bras ou les jambes affectés par la maladie peuvent être douloureusement déformés.
Haemophilus influenzae type b (Hib) : peut provoquer une inflammation (gonflement) du cerveau. Ceci peut conduire à des complications graves telles que : retard mental, paralysie cérébrale, surdité, épilepsie ou cécité partielle. Il peut provoquer également un gonflement de la gorge. Cela peut entraîner la mort par suffocation. Plus rarement, la bactérie peut aussi infecter le sang, le cœur, les poumons, les os, les articulations, et les tissus des yeux et de la bouche.
Comment le vaccin agit-il ?
· INFANRIXQUINTA aide l’organisme de votre enfant à faire sa propre protection (anticorps). Cela protègera votre enfant contre ces maladies.
· Comme tous les vaccins, INFANRIXQUINTA peut ne pas protéger complètement tous les enfants vaccinés.
· Le vaccin ne peut pas provoquer les maladies contre lesquelles il protège.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER INFANRIXQUINTA, poudre et suspension pour suspension injectable ?
N’utilisez jamais INFANRIXQUINTA :
· Si votre enfant est allergique à INFANRIXQUINTA ou à l’un des composants contenus dans INFANRIXQUINTA (listés en rubrique 6) ou à la néomycine, à la polymyxine (antibiotiques) ou au formaldéhyde. Les signes de réaction allergique peuvent prendre la forme d’une éruption cutanée avec démangeaisons, d’une difficulté respiratoire et d’un gonflement du visage ou de la langue.
· Si votre enfant a précédemment présenté une réaction allergique à un autre vaccin contenant les valences diphtérique, tétanique, coquelucheuse, poliomyélitique, Haemophilus influenzae type b.
· Si votre enfant a présenté des troubles neurologiques dans les 7 jours suivant une précédente vaccination par un vaccin contre la coqueluche.
· Si votre enfant a une infection sévère avec une forte fièvre (supérieure à 38°C). Une infection bénigne comme un rhume ne devrait pas être un problème, mais informez-en d’abord votre médecin.
DANS LES CAS CITES CI-DESSUS INFANRIXQUINTA NE DOIT PAS ETRE ADMINISTRE A VOTRE ENFANT. Si vous pensez que l’un des cas ci-dessus concerne votre enfant, parlez-en à votre médecin ou à votre pharmacien, avant que votre enfant ne reçoive INFANRIXQUINTA.
Avertissements et précautions
Prévenez également votre médecin :
· Si votre enfant a eu des problèmes de santé à la suite d’une administration précédente d’INFANRIXQUINTA ou d’un autre vaccin contre la coqueluche, en particulier :
o une fièvre (supérieure ou égale à 40°C) apparaissant dans les 48 heures suivant la vaccination,
o un malaise ou pseudo-état de choc apparaissant dans les 48 heures suivant la vaccination,
o des cris persistants pendant une durée de 3 heures ou plus, apparaissant dans les 48 heures suivant la vaccination,
o des convulsions avec ou sans fièvre apparaissant dans les 3 jours suivant la vaccination.
· Des réactions œdémateuses (gonflement) des membres inférieurs survenues dans les suites d’une injection d’un vaccin contenant la valence Haemophilus influenzae type b. L’administration du vaccin diphtérique-tétanique-coquelucheux-poliomyélitique et du vaccin Haemophilus influenzae type b conjugué devra être effectuée en deux sites d’injection séparés et sur deux jours différents.
· Si votre enfant a des problèmes hémorragiques ou s’il se fait des ecchymoses (bleus) facilement.
· Si votre enfant a une prédisposition ou des antécédents familiaux de convulsions fébriles.
· Si votre enfant est atteint de troubles neurologiques incluant des spasmes infantiles, des crises d’épilepsie non stabilisées ou une encéphalopathie progressive (une maladie cérébrale).
· Si votre enfant a des difficultés à respirer, veuillez contacter votre médecin. Ceci est plus fréquent dans les 3 jours suivant la vaccination si votre enfant est né prématuré (28 semaines de grossesse ou moins).
Les enfants ayant un système immunitaire affaibli, dû par exemple à une infection par le VIH ou à des médicaments supprimant les défenses immunitaires, peuvent avoir une efficacité diminuée.
Dans ces cas, votre médecin pourra définir le moment de vaccination adapté à votre enfant.
Enfants et adolescents
Sans objet.
Autres médicaments et INFANRIXQUINTA
Si votre enfant prend ou a pris récemment un autre médicament, y compris un médicament obtenu sans ordonnance ou des vaccins, parlez-en à votre médecin ou à votre pharmacien.
INFANRIXQUINTA avec des aliments, des boissons et de l’alcool
Sans objet.
Grossesse, allaitement et fertilité
Sans objet.
Conduite de véhicules et utilisation de machines
Sans objet.
INFANRIXQUINTA contient de l’acide para-aminobenzoïque, de la phénylalanine, du sodium et du potassium
INFANRIXQUINTA contient de l'acide para-aminobenzoïque. Il peut provoquer des réactions allergiques (éventuellement retardées), et exceptionnellement, des bronchospasmes.
Ce vaccin contient 0,036 microgramme de phénylalanine dans chaque dose. La phénylalanine peut être dangereuse pour les personnes atteintes de phénylcétonurie (PCU), une maladie génétique rare caractérisée par l’accumulation de phénylalanine ne pouvant être éliminée correctement.
Ce vaccin contient moins de 1 mmol (23 mg) de sodium par dose, c’est-à-dire qu’il est essentiellement « sans sodium ».
Ce vaccin contient moins de 1 mmol (39 mg) de potassium par dose, c'est-à-dire qu’il est essentiellement « sans potassium ».
3. COMMENT UTILISER INFANRIXQUINTA, poudre et suspension pour suspension injectable ?
Deux injections d’une dose de 0,5 ml à l’âge de 2 et 4 mois pour la primovaccination, suivies d’une injection à l’âge de 11 mois, pour le rappel.
Si votre enfant manque une vaccination prévue, informez-en votre médecin et demandez-lui une nouvelle consultation.
Assurez-vous que votre enfant reçoive une vaccination complète. Dans le cas contraire, votre enfant pourrait ne pas être complètement protégé contre les maladies.
Mode d’administration
Administrer par voie intramusculaire.
L’administration se fera de préférence dans la face antérolatérale de la cuisse (tiers moyen).
INFANRIXQUINTA doit être administré avec précaution chez les sujets présentant une thrombocytopénie (quantité insuffisante de certains éléments du sang, les plaquettes ayant un rôle important dans la coagulation sanguine) ou un trouble de la coagulation en raison du risque de saignement qui peut survenir lors de l’administration intramusculaire du vaccin chez ces sujets.
Ne jamais injecter par voie intravasculaire.
Si vous avez utilisé plus de INFANRIXQUINTA que vous n’auriez dû
Sans objet.
Si vous oubliez d’utiliser INFANRIXQUINTA
Si vous arrêtez d’utiliser INFANRIXQUINTA
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les effets indésirables pouvant apparaître sont les suivants :
Réactions allergiques
Comme avec tous les vaccins injectables, il existe un risque extrêmement faible de réactions allergiques sévères. Celles-ci peuvent être identifiées par :
· des éruptions cutanées avec démangeaisons aux mains et aux pieds,
· un gonflement des yeux et du visage,
· une difficulté à respirer ou à avaler,
· une baisse soudaine de la tension artérielle et perte de connaissance.
Ces réactions se produisent habituellement avant de quitter le cabinet du médecin. Mais dans tous les cas elles nécessitent un traitement immédiat.
Consultez immédiatement votre médecin si votre enfant présente l’un des effets indésirables graves suivants
· malaise,
· perte de connaissance ou trouble de la vigilance,
· convulsions (pouvant être causées par une fièvre importante).
Ces effets indésirables ont été rapportés très rarement avec les autres vaccins contre la coqueluche. Ils surviennent habituellement dans les 2 à 3 jours suivant la vaccination.
Des réactions œdémateuses (gonflement) des membres inférieurs lors de l’administration de vaccins contenant la valence Haemophilus influenzae type b, peuvent apparaître. Ces réactions s’accompagnent quelquefois de fièvre, de douleurs et de pleurs.
Autres effets indésirables
· Très fréquents (plus de 1 pour 10 doses de vaccin) : perte d’appétit, irritabilité ou agitation, cris inhabituels, somnolence, douleur, rougeur et gonflement (£ 5 cm) au site d’injection, fièvre supérieure ou égale à 38°C.
· Fréquents (moins de 1 pour 10 doses de vaccin) : diarrhée, vomissements, induration et gonflement (> 5 cm) au site d’injection.
· Peu fréquents (moins de 1 pour 100 doses de vaccin) : infection des voies respiratoires hautes, gonflement des ganglions au niveau cervical, axillaire ou inguinal (aine) (lymphadénopathie), toux, bronchite, écoulement nasal (rhinorrhée), éruption cutanée, urticaire, fièvre supérieure à 39,5°C, fatigue, gonflement diffus du membre vacciné se propageant parfois à l’articulation adjacente*.
*Ces réactions surviennent généralement dans les 48 heures et disparaîtront spontanément sans séquelle en 4 jours en moyenne.
· Rares (moins de 1 sur 1000 doses de vaccin) : démangeaisons.
Les autres effets indésirables rapportés avec ce vaccin ou des vaccins contenant les valences diphtérique, tétanique et/ou coquelucheuse incluent : arrêt temporaire de la respiration (apnée), chez les grands prématurés (nés à 28 semaines de grossesse ou moins), des pauses respiratoires plus longues qu’habituellement peuvent survenir pendant 2 à 3 jours suivant la vaccination, taux anormalement bas des plaquettes, élément du sang impliqué dans la coagulation sanguine (thrombocytopénie), d’où saignements et bleus plus faciles qu’en temps normal gonflement du visage, des lèvres, de la bouche, de la langue ou de la gorge pouvant entraîner des difficultés à avaler ou à respirer (œdème de Quincke), vésicules au site d’injection.
Déclaration des effets secondaires
Si votre enfant ressent un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER INFANRIXQUINTA, poudre et suspension pour suspension injectable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette et la boîte. La date de péremption fait référence au dernier jour de ce mois.
A conserver au réfrigérateur (entre +2°C et +8°C). Ne pas congeler
A conserver dans l’emballage extérieur d’origine à l’abri de la lumière.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient INFANRIXQUINTA ?
· Les substances actives sont :
Après reconstitution, une dose (0,5 ml) contient la totalité de la suspension de la seringue préremplie (valences diphtérique, tétanique, coquelucheuse acellulaire, poliomyélitique) et la poudre du flacon (valence Haemophilus influenzae type b) :
· Composition de la suspension de la seringue préremplie :
Anatoxine diphtérique1 .............................................................. ³ 30 Unités Internationales (UI) (25Lf)
Anatoxine tétanique1 ..................................................................³ 40 Unités Internationales (UI) (10Lf)
Antigènes de Bordetella pertussis :
- anatoxine pertussique1 ....................25 microgrammes
- hémagglutinine filamenteuse1 ..25 microgrammes
- pertactine1.................................................................................................................... 8 microgrammes
Virus de la poliomyélite (inactivés)
type 1 (souche Mahoney)² ..40 Unités antigènes D
type 2 (souche MEF-1)² ....8 Unités antigènes D
type 3 (souche Saukett)² .32 Unités antigènes D
· Composition de la poudre du flacon :
Polyoside d’Haemophilus influenzae type b (Hib) ...10 microgrammes
(phosphate de polyribosylribitol)
Conjugué à l’anatoxine tétanique en tant que protéine vectrice ....................environ 25 microgrammes
1 adsorbé sur hydroxyde d’aluminium hydraté (Al(OH)3) 0,5 milligrammes Al3+
² produit sur des cellules VERO
· Les autres composants sont :
Pour la suspension : chlorure de sodium (voir rubrique 2., INFANRIXQUINTA contient de l’acide para-aminobenzoïque, de la phénylalanine, du sodium et du potassium), Milieu 199 (contenant des acides aminés (dont la phénylalanine), des sels minéraux (dont le sodium et le potassium), des vitamines (dont l'acide para-aminobenzoïque) et d'autres substances) et eau pour préparations injectables.
Pour la poudre : lactose anhydre.
Qu’est-ce que INFANRIXQUINTA et contenu de l’emballage extérieur
La suspension présentée en seringue préremplie est un liquide blanc trouble.
La poudre présentée en flacon est blanche.
Les deux composants sont mélangés avant injection à votre enfant.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
23 RUE FRANÇOIS JACOB
92500 RUEIL-MALMAISON
Exploitant de l’autorisation de mise sur le marché
23 RUE FRANÇOIS JACOB
92500 RUEIL-MALMAISON
GLAXOSMITHKLINE BIOLOGICALS SA
RUE DE L’INSTITUT, 89
1330 RIXENSART
BELGIQUE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes concernent uniquement les professionnels de la santé :
· Avant reconstitution :
La suspension DTCa-P contenue dans la seringue préremplie, la poudre Hib contenue dans le flacon et le vaccin reconstitué doivent être inspectés visuellement pour mettre en évidence la présence de toute particule étrangère et/ou altération de l'aspect physique. Dans l’un ou l’autre de ces cas, le vaccin ne doit pas être utilisé.
Un dépôt blanc pouvant se former durant le stockage, la suspension DTCa-P doit être agitée avant reconstitution.
· Reconstitution :
Le vaccin est reconstitué en injectant l’ensemble de la seringue préremplie contenant la suspension DTCa-P dans le flacon contenant la poudre Hib. Seuls les composants de ce vaccin peuvent être mélangés ensemble, ils ne peuvent pas être mélangés à d’autres vaccins ou à d’autres composants de vaccin. Après reconstitution, le mélange doit être bien agité.
Le vaccin reconstitué se présente comme une suspension légèrement plus trouble que le composant liquide seul. Ceci est normal et n’a aucune conséquence sur la qualité du vaccin. Dans les autres cas, le vaccin ne doit pas être utilisé.
Le vaccin doit être administré immédiatement après reconstitution. Prélever la totalité du flacon.
Instructions d’utilisation de la seringue préremplie
|
|
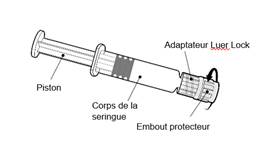
Tenir la seringue par le corps de la seringue et non par le piston. Dévisser l’embout protecteur de la seringue en le tournant dans le sens inverse des aiguilles d’une montre.
|
|
|
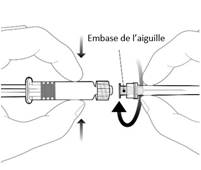
Pour fixer l’aiguille, connecter l’embase de l’aiguille sur l’adaptateur Luer Lock et tourner d’un quart de tour dans le sens des aiguilles d’une montre jusqu’à sentir un blocage. Reconstituer le vaccin comme décrit ci-dessus. Ne pas tirer le piston en dehors du corps de la seringue. Si cela se produit, ne pas administrer le vaccin. |
Instructions d’élimination
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.