Dernière mise à jour le 01/12/2025
HELIKIT 75 mg, poudre pour solution buvable
Indications thérapeutiques
Ce médicament est utilisé pour savoir si votre estomac a une infection par une bactérie appelée Helicobacter pylori.
Votre médecin vous a recommandé de faire ce test pour les raisons suivantes :
· Votre médecin souhaite vérifier si vous avez contracté une infection due à Helicobacter pylori pour établir plus facilement un diagnostic sur votre état de santé.
· Un diagnostic d’infection à Helicobacter pylori a déjà été posé et vous avez pris des médicaments destinés à éliminer cette infection. À présent, votre médecin souhaite vérifier l’efficacité du traitement.
Ce médicament est réservé à l’adulte.
Le test respiratoire doit être réalisé sous la supervision de professionnels de santé qualifiés et formés dans des établissements appropriés.
Présentations
> 1 flacon(s) en verre de 75 mg - 1 sachet(s) papier polyéthylène aluminium polyéthylène de 1,4 g avec kit de contrôle (4 tubes étiquetés (verre), 2 pailles (PP))
Code CIP : 343 132-1 ou 34009 343 132 1 9
Déclaration de commercialisation : 15/06/2000
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 29,64 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 30,66 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 13/09/2017 | Renouvellement d'inscription (CT) | Le service médical rendu par HELIKIT reste important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 13/12/2006 | Extension d'indication | Dans cette extension d'indication, HELI-KIT® n'apporte pas d'amélioration du service médical rendu (ASMR V) par rapport aux autres tests respiratoires à l'urée marquée au 13C disponibles. |
ANSM - Mis à jour le : 14/08/2025
HELIKIT 75 mg, poudre pour solution buvable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Un flacon contient 75 mg d’urée 13C.
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre blanche.
4.1. Indications thérapeutiques
Ce médicament est à usage diagnostique uniquement.
Diagnostic in vivo de l’infection à Helicobacter pylori, notamment le contrôle de l’éradication.
Chez l’adulte.
Se référer aux recommandations officielles nationales pour le traitement des infections à Helicobacter pylori.
4.2. Posologie et mode d'administration
HELIKIT est un test respiratoire à administration unique. Les patients adultes doivent prendre le contenu d’un flacon contenant 75 mg d’urée marquée au 13C, poudre pour solution buvable.
Mode d’administration
Voie orale.
Le test respiratoire doit être réalisé sous la supervision de professionnels de santé qualifiés et formés dans des établissements appropriés (voir rubrique 6.6).
Réaliser le test respiratoire chez le sujet à jeun durant toute la nuit (sans boire, ni manger ou fumer depuis la veille).
Si le test doit être répété, il ne doit pas l’être avant le lendemain.
Pour réaliser le test, 200 ml d’eau sont nécessaires. Le test dure environ 30 minutes.
Il est important de suivre convenablement l’ensemble des instructions d’utilisation (voir rubrique 6.6), sans quoi la fiabilité du résultat sera incertaine.
L’éradication d’Helicobacter pylori pourrait donner des résultats faussement négatifs. C’est pourquoi le test ne doit être effectué qu’après une durée minimale de quatre semaines sans traitement antibactérien systémique et qu’au terme de deux semaines après la dernière dose d’agents antisécrétoires acides. Ces deux traitements pourraient interférer avec le statut de Helicobacter pylori. Cela est particulièrement important après le traitement d’éradication d’Helicobacter (voir rubrique 4.4).
4.4. Mises en garde spéciales et précautions d'emploi
Précautions particulières d’emploi
Dans certains cas, le test peut être faussement négatif :
· gastrectomie (accélération de la vidange gastrique) ;
· prise d’un traitement connu pour diminuer la charge bactérienne en Helicobacter pylori au cours des 2 dernières semaines pour les inhibiteurs de la pompe à protons et au cours des 4 dernières semaines pour les antibiotiques.
Dans des cas particuliers de gastrite de type A (pathologie touchant principalement les personnes âgées), le test respiratoire peut donner des résultats faussement positifs ; par conséquent, HELIKIT est contre-indiqué (voir rubrique 4.3). D’autres tests peuvent être requis pour exclure la présence d’Helicobacter pylori. D’autre part, des infections par des germes produisant de l’uréase, autres qu’Helicobacter pylori, peuvent également donner de faux positifs.
Le test HELIKIT est un test de diagnostic in vivo de l’infection à Helicobacter pylori ; il ne peut en aucun cas préjuger de la pathologie associée à l’infection à Helicobacter pylori.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
4.6. Fertilité, grossesse et allaitement
Rien ne laisse présager d’une quelconque nocivité de ce test durant la grossesse ou l’allaitement.
Il est recommandé de tenir compte de la notice d’information des traitements d’éradication quant à leur administration pendant la grossesse ou l’allaitement.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Aucun effet indésirable connu.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
Aucun surdosage n’est attendu puisqu’il n’est délivré que 75 mg d’urée 13C.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : TEST D’EXPLORATION FONCTIONNELLE, Code ATC : V04CX05.
L’uréase bactérienne produite dans l’estomac par Helicobacter pylori hydrolyse l’urée en ammonium et bicarbonate. Sous l’influence de l’acidité gastrique, les bicarbonates vont être transformés en majeure partie en gaz carbonique qui sera absorbé, transporté aux poumons, puis expiré.
L’ingestion d’urée marquée chez un patient présentant une infection par Helicobacter pylori permet de mesurer cet isotope stable dans le gaz carbonique expiré.
La différence de proportion 13C/12C (traduisant l’enrichissement isotopique de l’air expiré) avant et après absorption d’urée marquée permet d’établir le seuil de positivité, au-dessus duquel on conclut à la présence d’Helicobacter pylori.
Ce seuil limite permettant de distinguer les tests négatifs et les tests positifs à Helicobacter pylori est déterminé par une valeur de 4 pour mille (), ce qui signifie qu’il y a une infection quand la valeur est supérieure à 4 . Par rapport aux diagnostics par biopsie d’une infection à Helicobacter pylori, la sensibilité du test respiratoire (75 mg d’urée en poudre pour solution buvable) a atteint 95,4 % (IC à 95 % : 93 % - 97,2 %) et sa spécificité 98,6 % (IC à 95 % : 97,1 % - 99,4 %) dans une méta-analyse réalisée à partir d’études cliniques portant sur 939 patients adultes.
L’ingestion d’acide citrique, en ralentissant la vidange gastrique, permet l’allongement du temps d’interaction uréase bactérienne/urée 13C.
En l’absence d’uréase bactérienne, la quantité totale d’urée administrée, après absorption par le tractus gastro-intestinal, est métabolisée comme l’urée endogène. L’ammoniaque libérée par l’hydrolyse bactérienne, comme décrit ci-dessus, est métabolisée sous forme de NH4+.
5.2. Propriétés pharmacocinétiques
L’absorption et la distribution du 13CO2 sont plus rapides que l’action de l’uréase. Ainsi, le clivage de l’urée 13C par l’uréase de l’Helicobacter pylori est l’étape limitante du processus complet.
L’administration de 75 mg d’urée provoque une augmentation significative du 13CO2 dans l’échantillon respiratoire, dans les 30 premières minutes, uniquement chez les patients positifs à une bactérie sécrétant l’uréase, telle qu’Helicobacter pylori.
5.3. Données de sécurité préclinique
3 ans
6.4. Précautions particulières de conservation
À conserver à une température ne dépassant pas 30 °C.
À conserver dans l’emballage extérieur, à l’abri de l’humidité.
6.5. Nature et contenu de l'emballage extérieur
75 mg d’urée 13C en flacon (verre blanc) fermé par un bouchon (caoutchouc chlorobutyle) + 1,4 g d’acide citrique anhydre en sachet (papier/PE/Aluminium/PE) avec un kit de contrôle.
Le kit de contrôle comprend :
· 4 tubes de prélèvement étiquetés en verre,
· 2 pailles flexibles en polypropylène.
75 mg d’urée 13C en flacon (verre blanc) fermé par un bouchon (caoutchouc chlorobutyle) + 1,4 g d’acide citrique anhydre en sachet (papier/PE/Aluminium/PE).
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Réaliser l’examen sous la supervision de professionnels de santé qualifiés et formés dans des établissements appropriés chez le sujet à jeun, au repos, sans boire, ni manger, ni fumer.
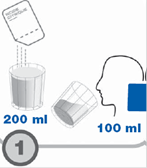
Dissoudre l’acide citrique dans 200 ml d’eau. Demander au sujet de boire la moitié (100 ml) de la solution juste avant le premier prélèvement d’air expiré (T 0).
Posez votre pouce à la base du triangle sur le côté de la capsule grise. Poussez la capsule grise vers le haut. Une fois la capsule perpendiculaire à la jupe en aluminium, faites tourner la capsule grise dans le sens inverse des aiguilles d’une montre.
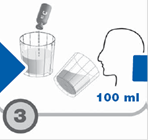
Dissoudre l’urée 13C dans les 100 ml de solution restante et demander au sujet de les boire en totalité en déclenchant le chronomètre (T 0).
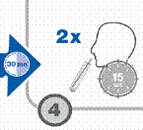
Faire le 2e prélèvement d’air expiré 30 minutes après (T 30).
Technique de prélèvement d’air expiré :
Tube en verre de 10 ml :
· retirer le bouchon du tube ;
· placer le bout de la paille au fond du tube ;
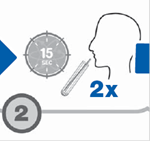
· après avoir demandé au patient d’inspirer profondément, faites-le souffler dans la paille pendant environ 15 secondes jusqu’à ce qu’une condensation apparaisse au fond du tube ;
· retirer alors la paille tout en demandant au patient de continuer à souffler et reboucher immédiatement le tube ;
· refaire un 2e prélèvement d’air expiré à chaque temps (2 tubes à T 0 et 2 tubes à T 30).
Sac-réservoir gonflable de 1,3 l :
· retirer le bouchon du sac ;
· après avoir demandé au patient d’inspirer profondément, le faire souffler dans le sac jusqu’à ce qu’il soit complètement rempli ; reboucher immédiatement le sac ;
· faire un prélèvement d’air expiré à chaque temps (1 sac à T 0 et 1 sac à T 30).
Les échantillons respiratoires peuvent être analysés par des appareils permettant la mesure du rapport isotopique 13C/12C dans un échantillon respiratoire. Cette analyse peut être réalisée par spectrométrie de masse isotopique ou par une autre méthode dûment validée. L’analyse des échantillons doit être réalisée dans un laboratoire qualifié.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
3 PLACE RENAULT
92500 RUEIL-MALMAISON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 343 132 1 9 : 75 mg d’urée 13C en flacon (verre) + 1,4 g d’acide citrique anhydre en sachet (papier/PE/Aluminium/PE) + kit de contrôle (4 tubes étiquetés (verre), 2 pailles (PP)).
· 34009 300 535 0 8 : 75 mg d'urée 13C en flacon (verre) + 1,4 g d'acide citrique anhydre en sachet (papier/PE/Aluminium/PE).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 14/08/2025
HELIKIT 75 mg, poudre pour solution buvable
Urée 13C
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu’est-ce que HELIKIT 75 mg, poudre pour solution buvable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d’utiliser HELIKIT ?
3. Comment utiliser HELIKIT 75 mg, poudre pour solution buvable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver HELIKIT 75 mg, poudre pour solution buvable ?
6. Contenu de l’emballage et autres informations
1. QU’EST-CE QUE HELIKIT 75 mg, poudre pour solution buvable ET DANS QUELS CAS EST-IL UTILISE ?
Ce médicament est utilisé pour savoir si votre estomac a une infection par une bactérie appelée Helicobacter pylori.
Votre médecin vous a recommandé de faire ce test pour les raisons suivantes :
· Votre médecin souhaite vérifier si vous avez contracté une infection due à Helicobacter pylori pour établir plus facilement un diagnostic sur votre état de santé.
· Un diagnostic d’infection à Helicobacter pylori a déjà été posé et vous avez pris des médicaments destinés à éliminer cette infection. À présent, votre médecin souhaite vérifier l’efficacité du traitement.
Ce médicament est réservé à l’adulte.
Le test respiratoire doit être réalisé sous la supervision de professionnels de santé qualifiés et formés dans des établissements appropriés.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER HELIKIT 75 mg, poudre pour solution buvable ?
N’utilisez jamais HELIKIT 75 mg, poudre pour solution buvable :
· Si vous avez, ou si l’on suspecte que vous avez une infection de l’estomac (autre que par Helicobacter pylori) ou une certaine inflammation de la paroi de l’estomac (gastrite atrophique).
Cette inflammation de la paroi de l’estomac peut être à l’origine de résultats positifs erronés lors de votre test respiratoire. D’autres tests peuvent s’avérer nécessaires pour confirmer la présence d’Helicobacter pylori.
Avertissements et précautions
Faites attention avec HELIKIT :
· Ce médicament ne permet pas de déterminer si vous avez une maladie associée à l’infection par la bactérie Helicobacter pylori.
· Si vous avez fait l’objet d’une intervention chirurgicale ayant supprimé totalement ou partiellement votre estomac, prévenez votre médecin car, dans ce cas, ce médicament ne permet pas de déterminer avec certitude si votre estomac a une infection par Helicobacter pylori.
En cas de vomissements pendant le déroulement du test, il est nécessaire de renouveler le test.
Le test devra être effectué à jeun et pas avant le lendemain.
Enfants
Sans objet.
Autres médicaments et HELIKIT 75 mg, poudre pour solution buvable
Certains traitements peuvent perturber les résultats du test réalisé avec HELIKIT. Vous devez donc prévenir votre médecin, votre pharmacien ou le laboratoire d’analyses médicales si vous prenez ou avez pris :
· des médicaments qui réduisent la production d’acide dans l’estomac (les inhibiteurs de la pompe à protons) au cours des 2 dernières semaines,
· des antibiotiques au cours des 4 dernières semaines,
· des médicaments ayant un effet sur l’enzyme uréase qui stimule la réduction de la quantité d’urée.
Informez votre médecin, votre pharmacien ou le laboratoire d’analyses médicales si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
HELIKIT 75 mg, poudre pour solution buvable avec des aliments, boissons et de l’alcool
Vous ne devez pas avoir bu, ni mangé, ni fumé depuis la veille au soir.
Grossesse et allaitement
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
HELIKIT n’a aucun effet sur l’aptitude à conduire des véhicules et à utiliser des machines.
HELIKIT 75 mg, poudre pour solution buvable contient de l’acide citrique anhydre.
3. COMMENT UTILISER HELIKIT 75 mg, poudre pour solution buvable ?
Le test par HELIKIT sera réalisé sous la supervision de professionnels de santé qualifiés et formés dans des établissements appropriés.
Vous ne devez pas avoir bu, ni mangé, ni fumé depuis la veille au soir.
Le test se déroulera de la façon suivante :
· Vous devrez boire la moitié d’une solution d’acide citrique. Le volume de cette solution est inférieur à ¼ de litre. Son goût est proche de celui d’un jus de citron.
· L’air que vous expirez sera recueilli pendant 15 secondes dans 2 tubes identiques.
· Le contenu d’un flacon d’urée marquée au 13C (non radioactif) sera dissout dans la solution d’acide citrique restante, que vous devrez boire en totalité.
· Vous devrez ensuite attendre 30 minutes dans la salle d’attente.
· L’air que vous expirez sera ensuite recueilli pendant 15 secondes dans 2 nouveaux tubes identiques, 30 minutes plus tard.
Sans le kit de contrôle
Se référer aux consignes de votre médecin ou du laboratoire d’analyses médicales pour utiliser le test.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien ou au laboratoire d’analyses médicales.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER HELIKIT 75 mg, poudre pour solution buvable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage après EXP. La date de péremption fait référence au dernier jour de ce mois.
À conserver à une température ne dépassant pas 30 °C.
À conserver dans l’emballage extérieur, à l’abri de l’humidité.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient HELIKIT 75 mg, poudre pour solution buvable
· La substance active est : urée 13C
Un flacon contient 75 mg d’urée 13C.
· L’autre composant est : Acide citrique anhydre.
Qu’est-ce que HELIKIT 75 mg, poudre pour solution buvable et contenu de l’emballage extérieur
Ce médicament se présente sous forme de poudre pour solution buvable.
La poudre est blanche.
Ce médicament est disponible en :
· Flacon (verre) + sachet (papier/PE/Aluminium/PE) + kit de contrôle (4 tubes étiquetés [verre], 2 pailles [PP]) ;
Ou
· Flacon (verre) + sachet (papier/PE/Aluminium/PE).
Toutes les présentations peuvent ne pas être commercialisées
Titulaire de l’autorisation de mise sur le marché
3 PLACE RENAULT
92500 RUEIL-MALMAISON
Exploitant de l’autorisation de mise sur le marché
6, AVENUE DE L’EUROPE - BP 51
78401 CHATOU CEDEX
6, AVENUE DE L’EUROPE - BP 51
78401 CHATOU CEDEX
OU
CREAPHARM INDUSTRY
29 RUE LEON FAUCHER
51100 REIMS
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants :
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Site internet : www.ansm.sante.fr
Les informations suivantes sont destinées exclusivement aux professionnels de santé:
Informations destinées à la personne qui administre ce médicament
Protocole de prélèvement avec HELIKIT (avec kit de contrôle)
|
|
Ouvrir le sachet d’acide citrique et le dissoudre dans 200 ml d’eau. Demander au patient de boire 100 ml de cette solution et conserver le reste. |
|
|
Recueillir l’air expiré dans 2 tubes identiques identifiés T 0 (bouchon bleu) : Retirer le bouchon de l’un des tubes T 0 et placer le bout de la paille au fond du tube. Après avoir demandé au patient d’inspirer profondément, faites-le souffler dans la paille pendant 15 secondes jusqu’à ce qu’une condensation apparaisse au fond du tube. Demander au patient de continuer à souffler et retirer la paille. Reboucher rapidement le tube jusqu’à ressentir une légère résistance. Ne pas serrer trop fortement, l’opercule ne doit pas être déformé. Renouveler l’opération dans l’autre tube T 0. |
|
|
Posez votre pouce à la base du triangle sur le côté de la capsule grise. Poussez la capsule grise vers le haut. Une fois la capsule perpendiculaire à la jupe en aluminium, faites tourner la capsule grise dans le sens inverse des aiguilles d’une montre. Dissoudre l’urée 13C dans les 100 ml de solution d’acide citrique restante et demander au patient de les boire en totalité. Puis déclencher le chronomètre.
|
|
|
30 minutes après ingestion de la solution d’urée 13C, recueillir de nouveau l’air expiré dans 2 tubes identiques et identifiés POST (bouchon rouge), selon le même protocole qu’à T 0. |