Dernière mise à jour le 02/02/2026
ALOPEXY 50 mg/ml, solution pour application cutanée
Indications thérapeutiques
Classe pharmacothérapeutique : AUTRES DERMATOLOGIQUES,
code ATC : D11AX01.
Ce médicament est indiqué chez le sujet de sexe masculin en cas de chute de cheveux modérée (alopécie androgénétique).
Il ne doit pas être utilisé chez la femme en raison de la fréquence importante des hypertrichoses (développement anormal du système pileux) à distance des sites d'application.
Présentations
> 3 flacon(s) polytéréphtalate (PET) jaune(brun) de 60 ml avec fermeture de sécurité enfant avec pipette(s) graduée(s) polystyrène polyéthylène avec pompe(s) doseuse(s) avec applicateur(s)
Code CIP : 384 404-6 ou 34009 384 404 6 1
Déclaration de commercialisation : 29/07/2008
Cette présentation n'est pas agréée aux collectivités
Service médical rendu (SMR)
Amélioration du service médical rendu (ASMR)
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
ANSM - Mis à jour le : 20/08/2025
ALOPEXY 50 mg/ml, solution pour application cutanée
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Minoxidil................................................................................................................................ 50 mg
Pour 1 ml.
Excipient à effet notoire : propylène glycol (E1520) 240 mg, éthanol à 96% 520 mg.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution pour application cutanée.
Solution limpide, légèrement jaune.
4.1. Indications thérapeutiques
Remarque : Ce médicament n’est pas indiqué chez la femme en raison de sa faible efficacité et de la fréquence importante des hypertrichoses (37% des cas) à distance des sites d’application.
4.2. Posologie et mode d'administration
Appliquer 2 fois par jour une dose de 1 ml sur le cuir chevelu en prenant pour point de départ le centre de la zone à traiter. Cette dose doit être respectée quelle que soit l’étendue de la zone concernée.
La dose quotidienne ne doit pas dépasser 2 ml.
Durée d'utilisation
Un traitement continu est nécessaire pour augmenter et maintenir la repousse des cheveux. Les premiers résultats peuvent apparaître après 2 à 4 mois d'application deux fois par jour. Le délai et le degré de réponse varient d’un patient à l’autre. Si aucune amélioration des symptômes n'est observée après 4 mois de traitement, les patients doivent arrêter d’utiliser ALOPEXY.
Une augmentation temporaire de la perte de cheveux peut survenir au cours des 2 à 6 premières semaines de traitement. Si la perte de cheveux persiste au-delà de 6 semaines, le patient doit arrêter d'utiliser ALOPEXY et consulter son médecin (voir rubrique 4.4).
Le début et le degré de la réponse sont variables d’un patient à l’autre. Toutefois certaines données suggèrent que les utilisateurs les plus jeunes dont la calvitie a débuté plus récemment ou dont la calvitie sur le sommet du crâne est moins étendue, répondent mieux au traitement. Les réponses individuelles au traitement ne sont pas prévisibles.
Selon certaines observations, un retour à l’état initial apparaîtrait en 3 ou 4 mois en cas d’arrêt du traitement.
Population spéciale
Personnes âgées
ALOPEXY n’est pas recommandé chez les patients de plus de 65 ans compte-tenu de l’absence de données concernant la sécurité et l’efficacité.
Population pédiatrique
La sécurité et l'efficacité d’ALOPEXY chez les enfants de moins de 18 ans n'ont pas été établies. Aucune donnée n'est disponible. Par conséquent, ALOPEXY n’est pas recommandé chez les enfants de moins de 18 ans.
Mode d’administration
Voie cutanée.
Ne pas avaler.
Utiliser l'un des systèmes d'administration (voir ci-dessous) pour appliquer ALOPEXY.
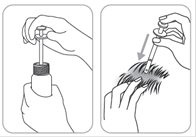
Répartir le produit avec le bout des doigts de façon à couvrir l’ensemble de la zone à traiter.
Avant et après application de la solution, se laver soigneusement les mains.
Appliquer sur des cheveux et un cuir chevelu parfaitement secs.
Ne pas appliquer sur une autre partie du corps.
Mode d’application
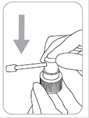
Le bouchon sécurité-enfant doit être retiré en appuyant sur le bouchon tout en le tournant dans le sens contraire des aiguilles d'une montre (vers la gauche). Il ne doit rester sur le flacon que le témoin d’inviolabilité.
En fonction du système de délivrance utilisé :
Utilisation de la pipette
Une pipette permet de prélever avec précision 1 ml de solution à répartir sur l’ensemble de la zone à traiter.
Utilisation de la pompe avec applicateur
Adapter par vissage la pompe doseuse au flacon.
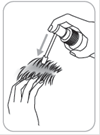
Pour l’application : diriger la pompe vers le centre de la zone à traiter, presser une seule fois et répartir le produit avec le bout des doigts de façon à couvrir l’ensemble de la zone à traiter. 6 pulvérisations sont nécessaires pour appliquer une dose de 1 ml.
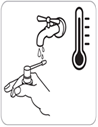
Rincer la canule à l’eau chaude après chaque utilisation.
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
· Affections du cuir chevelu.
· Mauvaise tolérance à la forme à 2 % quelle que soit la symptomatologie.
4.4. Mises en garde spéciales et précautions d'emploi
Chez le sujet présentant une dermatose du cuir chevelu, une absorption percutanée accrue du minoxidil est possible (voir rubrique 4.3.)
Bien que la survenue d’effets systémiques liés au minoxidil n’ait pas été observée lors de l’utilisation de la solution, la possibilité d’apparition de tels effets ne peut être exclue.
Les patients doivent être avertis des effets indésirables potentiels.
Les patients présentant une maladie cardiovasculaire avérée, une hypotension ou des arythmies cardiaques doivent contacter un médecin avant d'utiliser le minoxidil par voie topique. Chez ces sujets, le bénéfice du traitement doit être évalué. Un suivi doit être réalisé au début du traitement et régulièrement par la suite. Ils doivent en particulier être informés des effets indésirables potentiels (tachycardie, rétention hydrosodée, ou prise de poids ou autres effets systémiques), afin d’arrêter le traitement dès la survenue de l’un d’entre eux.
Pour les autres patients, en cas d'effets systémiques ou de réactions dermatologiques sévères : ils doivent arrêter d'utiliser le produit et consulter un médecin en cas de suspicion d’une hypotension, en cas de douleur thoracique, de rythme cardiaque rapide, d’évanouissement ou d’étourdissements, de prise de poids subite inexpliquée, d’œdème des mains ou des pieds ou de rougeur ou d’irritation persistante du cuir chevelu.
Si la chute de cheveux persiste ou s’aggrave au-delà de 6 semaines de traitement par minoxidil, ou si de nouveaux symptômes apparaissent, les patients doivent interrompre le traitement et demander un avis médical. Le risque d’hypertrichose à distance justifie de ne pas utiliser cette spécialité chez les femmes.
Le minoxidil ne doit pas être appliqué sur une autre partie du corps.
Le minoxidil n’est pas indiqué en l’absence d’antécédents familiaux d’alopécie, en cas de chute de cheveux subite et/ou en plaques, de chute de cheveux à la suite d’un accouchement ou de chute de cheveux due à une cause inconnue.
Hypertrichose chez l’enfant suite à une exposition topique involontaire au minoxidil :
Des cas d’hypertrichose ont été rapportés chez des nourrissons après contact cutané au niveau des sites d’application du minoxidil de patients (soignants) utilisant du minoxidil topique. L'hypertrichose était réversible, en quelques mois, lorsque les nourrissons n'étaient plus exposés au minoxidil. Le contact entre les enfants et les sites d’application du minoxidil doit donc être évité.
Précautions d’emploi
Le minoxidil ne doit être utilisé que sur un cuir chevelu normal et sain. Il ne doit pas être utilisé si le cuir chevelu présente une rougeur, une inflammation, une infection, une irritation ou s’il est douloureux, ou si d’autres traitements sont appliqués sur le cuir chevelu.
Un traitement continu est nécessaire pour augmenter et maintenir la repousse des cheveux. Une augmentation temporaire de la perte de cheveux peut se produire au cours des 2 à 6 premières semaines de traitement. Si la perte de cheveux persiste au-delà de 6 semaines, le patient doit arrêter d'utiliser le minoxidil et consulter son médecin (voir rubrique 4.2).
En cas de contact avec l’œil, le médicament (contenant de l’éthanol) peut provoquer une sensation de brûlure et une irritation. En cas de contact accidentel avec les surfaces sensibles (œil, peau lésée et muqueuses), la zone atteinte doit être lavée abondamment avec une grande quantité d’eau courante froide.
L’inhalation de la brume pulvérisée doit être évitée.
L’ingestion accidentelle est susceptible d’entraîner des effets indésirables cardiaques graves (voir rubrique 4.9). Par conséquent, ce médicament doit être tenu hors de la portée des enfants.
Ce médicament contient 520 mg d’alcool (éthanol) par ml. Cela peut provoquer une sensation de brûlure sur une peau endommagée.
Des patients ont constaté une modification de la couleur et/ou de la texture de leurs cheveux.
L’exposition au soleil n’est pas recommandée lors de l’application de minoxidil.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Les études d’interactions pharmacocinétiques chez l’homme ont montré que l’absorption percutanée du minoxidil est augmentée par la trétinoïne et l’anthraline en raison de l’augmentation de la perméabilité de la couche cornée ; le dipropionate de bétaméthasone augmente les concentrations tissulaires locales du minoxidil et diminue son absorption systémique.
Bien que non cliniquement prouvé, on ne peut exclure le risque d’apparition d’une hypotension orthostatique chez des patients traités par ailleurs par des vasodilatateurs périphériques.
Par voie cutanée, la résorption du minoxidil est contrôlée et limitée par le Stratum corneum. L’utilisation concomitante de médicaments d’application cutanée ayant un impact sur la barrière constituée par le Stratum corneum peut entraîner une augmentation de la résorption du minoxidil appliqué. Par conséquent l’utilisation concomitante d’ALOPEXY et d’autres médicaments par voie cutanée n’est pas recommandée.
4.6. Fertilité, grossesse et allaitement
Ce médicament n'est pas indiqué chez les femmes en âge de procréer. Il ne doit pas être utilisé chez les femmes qui sont enceintes ou qui pourraient l’être ou qui allaitent (voir rubrique 4.1).
Grossesse
Il n’a pas été mené d’études contrôlées adéquates chez la femme enceinte. Les études chez l’animal ont mis en évidence un risque pour le fœtus à des niveaux d’exposition très supérieurs à ceux attendus chez l’Homme. Un risque faible, bien que peu probable, d’effets délétères sur le fœtus est possible chez l’Homme (voir rubrique 5.3 Données de sécurité préclinique). Ce médicament n’est pas indiqué chez la femme (voir rubrique 4.1) notamment chez la femme en âge de procréer et chez la femme enceinte.
Le minoxidil absorbé au niveau systémique est excrété dans le lait maternel.
Ce médicament n’est pas indiqué chez la femme (voir rubrique 4.1) notamment chez la femme allaitante.
Fertilité
Dans une étude de fertilité sur des rats mâles et femelles, une réduction dose-dépendante du taux de conception a été mise en évidence (voir rubrique 5.3). Le risque potentiel chez l'Homme est inconnu.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
ALOPEXY n’a aucun effet ou un effet négligeable sur l’aptitude à conduire des véhicules et à utiliser des machines.
Les effets indésirables ainsi que leur fréquence ont été déterminés à partir d’une étude clinique randomisée, en double aveugle contrôlée par un placebo, portant sur 393 patients comparant le minoxidil 5% (157 patients) au minoxidil 2% (158 patients) à un placebo (78 patients).
Les fréquences des effets indésirables rapportés au cours de la commercialisation du minoxidil en application cutanée sont inconnues.
Les effets indésirables ainsi que leur fréquence sont listés ci-dessous selon la base de données MedDRA par classes de systèmes d’organes et par fréquence. Les fréquences sont définies en utilisant la classification suivante : Très fréquent (≥ 1/10) ; fréquent (≥ 1/100 ; < 1/10) ; peu fréquent (≥ 1/1 000 ; < 1/100) ; rare (≥ 1/10 000 ; < 1/1 000), très rare (< 1/10 000), indéterminée (ne peut être estimée sur la base des données disponibles).
Les réactions les plus fréquemment observées consistent en des réactions cutanées mineures.
Une application cutanée fréquente peut provoquer des irritations et une sécheresse de la peau, en raison de la présence d’éthanol.
|
Classes de systèmes d’organes |
Effets indésirables – Terme MedDRA préféré Fréquence |
||
|
Très fréquent |
Fréquent |
Indéterminée |
|
|
Infections et Infestations |
|
|
Infection de l’oreille Otite externe Rhinite |
|
Affections du système immunitaire |
|
|
Hypersensibilité Réactions allergiques, y compris angioedème |
|
Affections psychiatriques |
|
Dépression |
|
|
Affections du système nerveux |
Céphalées |
|
Névrite Sensation de picotements Dysgueusie Sensation de brûlure Sensation vertigineuse |
|
Affections oculaires |
|
|
Vision trouble Irritation oculaire |
|
Affections cardiaques |
|
|
Tachycardie Douleur thoracique Palpitations |
|
Affections vasculaires |
|
|
Hypotension |
|
Affections respiratoires, thoraciques et médiastinales |
|
Dyspnée |
|
|
Affections hépato-biliaires |
|
|
Hépatite |
|
Affections de la peau et du tissu sous-cutané |
Hypertrichose (à distance du site d’application) |
Dermatite de contact Prurit Dermatose inflammatoire Eruption cutanée acnéiforme
|
Érythème généralisé Alopécie Répartition irrégulière des cheveux Modifications de la texture des cheveux Modifications de la couleur des cheveux
|
|
Affections musculo-squelettiques et systémiques |
|
Douleurs musculo‑squelettiques |
|
|
Affections du rein et des voies urinaires |
|
|
Calculs rénaux |
|
Troubles généraux et anomalies au site d’administration
|
|
Réaction au site d’application : irritation, exfoliation cutanée, dermatite, érythème, sécheresse, prurit Œdème périphérique Douleur |
Œdème de la face Œdème Asthénie |
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Il n’existe pas de données indiquant que le minoxidil appliqué localement est absorbé en quantité suffisante pour entraîner des effets systémiques. Un surdosage est peu probable lorsque le médicament est utilisé conformément aux instructions.
Si ce médicament est appliqué sur une zone où l’intégrité de la barrière cutanée est diminuée en raison d’un traumatisme, d’une inflammation ou d’une pathologie de la peau, des effets systémiques de surdosage sont possibles.
Les effets indésirables ci‑dessous, très rares, peuvent survenir en raison des effets systémiques du minoxidil :
|
Classes de systèmes d’organes |
Effets indésirables |
|
Affections du système nerveux Très rare |
Sensation vertigineuse |
|
Troubles généraux et anomalies au site d’administration Très rare |
Rétention hydrique entraînant une prise de poids |
|
Affections cardiaques Très rare |
Fréquence cardiaque augmentée Hypotension |
L’ingestion accidentelle peut provoquer des effets systémiques dus à l’action vasodilatatrice du minoxidil (5 ml de solution contiennent 250 mg de minoxidil, soit 2,5 fois la dose maximale utilisée pour une administration par voie orale chez l’adulte traité pour hypertension artérielle).
Traitement
En cas de surdosage de minoxidil, un traitement symptomatique ainsi que des mesures complémentaires doivent être mis en place.
Une rétention hydrosodée peut être traitée par une thérapeutique diurétique appropriée, une tachycardie et un angor par un agent bêtabloqueur ou un autre inhibiteur du système nerveux sympathique. Une hypotension symptomatique pourrait être traitée par administration intraveineuse de solution isotonique de chlorure de sodium. Il convient d’éviter l’utilisation de sympathomimétiques telles que la noradrénaline et l’adrénaline en raison d’une trop grande stimulation cardiaque.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : AUTRES DERMATOLOGIQUES,
code ATC : D11AX01
Mécanisme d’action
Appliqué par voie topique, le minoxidil stimule la croissance des kératinocytes in vitro et in vivo et la pousse des cheveux chez certains sujets présentant une alopécie androgénétique. L’apparition de ce phénomène a lieu après environ 2 mois d’utilisation du produit et varie en fonction des sujets. A l’arrêt du traitement, la repousse cesse et un retour à l’état initial est prévisible sous 3 ou 4 mois. Le mécanisme précis d’action n’est pas connu.
Efficacité et sécurité clinique
L’application topique de minoxidil au cours des essais cliniques contrôlés chez des patients normotendus ou hypertendus non traités n’a pas donné lieu à l’observation de manifestations systémiques liées à une absorption du minoxidil.
5.2. Propriétés pharmacocinétiques
Le minoxidil lorsqu’il est appliqué par voie topique, n’est que faiblement absorbé : une quantité moyenne de 1,7 % (pour des valeurs allant de 0,3 à 4,5 %) de la dose appliquée parvient à la circulation générale.
A titre de comparaison, lorsqu’il est administré par voie orale sous forme de comprimés (dans le traitement de certaines hypertensions), le minoxidil est pratiquement complètement absorbé au niveau du tractus gastro-intestinal.
Une dose de 1 ml de solution correspondante à une application sur la peau de 50 mg de minoxidil, résulterait donc en une absorption d’environ 0,85 mg de minoxidil.
L’influence d’affections dermiques concomitantes sur l’absorption de minoxidil n’a pas été déterminée.
Les taux sériques de minoxidil consécutifs à une administration topique sont dépendants du taux d’absorption percutanée.
Biotransformation
La biotransformation du minoxidil absorbé après application topique n’est pas entièrement connue.
Elimination
Après arrêt de l’application topique, environ 95 % du minoxidil absorbé est éliminé en 4 jours.
5.3. Données de sécurité préclinique
Des effets cardiaques chez le chien ont été observés à de faibles doses, entraînant des effets hémodynamiques significatifs associés à des modifications cardiaques après administration orale dans les études de toxicité par administrations répétées.
Dans une étude de fertilité orale menée chez le rat, une réduction dose-dépendante du taux de conception a été rapportée à partir de la dose de 3 mg/kg/jour (au moins 5 fois l'exposition humaine). Dans une étude sous-cutanée, des doses de minoxidil supérieures à 9 mg/kg/jour (au moins 14,4 fois l'exposition humaine) ont été associées à une réduction des taux de conception et d'implantation ainsi qu'à une réduction du nombre de chiots vivants.
Le minoxidil était dépourvu de tout potentiel tératogène chez le rat et le lapin a des doses orales allant jusqu'à 10 mg/kg/jour, et chez le rat a des doses sous-cutanées allant jusqu'à 11 mg/kg/jour, (au moins 16 fois l'exposition humaine). Néanmoins, une toxicité pour le développement (y compris des résorptions fœtales accrues chez les deux espèces, des anomalies squelettiques, une mortinatalité et une survie réduite des petits chez le rat) n'a été observée qu'a des expositions considérées comme suffisamment supérieures à l'exposition humaine maximale, ce qui indique peu de pertinence pour l'utilisation clinique.
Propylène glycol, éthanol à 96%, eau purifiée.
Après ouverture : 1 mois.
6.4. Précautions particulières de conservation
Tenir à l’écart de la chaleur, des surfaces chaudes, des étincelles, des flammes nues et de toute autre source d’inflammation. Ne pas fumer.
6.5. Nature et contenu de l'emballage extérieur
Flacon (PET ambré) de 60 ml fermé par un bouchon sécurité-enfant avec pipette graduée (Polystyrène/PE) et pompe doseuse avec applicateur ; boîte de 1 ou 3 flacon(s).
Flacon (PET ambré) de 60 ml fermé par un bouchon sécurité-enfant avec pipette graduée (Polystyrène/PE) ; boîte de 1.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
LES CAUQUILLOUS
81500 LAVAUR
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 303 091 5 5 : 60 ml en flacon (PET ambré) fermé par un bouchon sécurité-enfant avec pipette graduée (polystyrène/PE). Boîte de 1 flacon.
· 34009 384 404 6 1 : 60 ml en flacon (PET ambré) fermé par un bouchon sécurité-enfant avec pipette graduée (polystyrène/PE) et pompe doseuse avec applicateur. Boîte de 3 flacons.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 20/08/2025
ALOPEXY 50 mg/ml, solution pour application cutanée
Minoxidil
Vous devez toujours utiliser ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin ou votre pharmacien.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre pharmacien pour tout conseil ou information.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous devez vous adresser à votre médecin si votre chute de cheveux persiste au-delà de 6 semaines.
1. Qu'est-ce que ALOPEXY 50 mg/ml, solution pour application cutanée et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser ALOPEXY 50 mg/ml, solution pour application cutanée ?
3. Comment utiliser ALOPEXY 50 mg/ml, solution pour application cutanée ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver ALOPEXY 50 mg/ml, solution pour application cutanée ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE ALOPEXY 50 mg/ml, solution pour application cutanée ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : AUTRES DERMATOLOGIQUES,
code ATC : D11AX01.
Ce médicament est indiqué chez le sujet de sexe masculin en cas de chute de cheveux modérée (alopécie androgénétique).
Il ne doit pas être utilisé chez la femme en raison de la fréquence importante des hypertrichoses (développement anormal du système pileux) à distance des sites d'application.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER ALOPEXY 50 mg/ml, solution pour application cutanée ?
N’utilisez jamais ALOPEXY 50 mg/ml, solution pour application cutanée :
· Si vous êtes allergique au minoxidil ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· Si vous avez présenté une intolérance lors de l’utilisation de la solution contenant 20 mg/ml de minoxidil.
· Si vous présentez des lésions du cuir chevelu.
Enfants et adolescents
La sécurité et l'efficacité d’ALOPEXY chez les enfants de moins de 18 ans n'ont pas été établies. Aucune donnée n'est disponible. Par conséquent, ALOPEXY n’est pas recommandé chez les enfants de moins de 18 ans.
Personnes âgées
Ce médicament n’est pas recommandé chez les patients de plus de 65 ans parce que l’efficacité et la sécurité n’ont pas été étudiées.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser ALOPEXY.
Faites attention si vous avez ou avez eu une diminution de la pression artérielle (hypotension), ou une maladie cardiovasculaire ou une arythmie cardiaque comme une tachycardie, des douleurs thoraciques, des évanouissements, des étourdissements, une prise de poids inexpliquée ou des signes de rétention hydrosodée (gonflement des mains ou des pieds).
Dans ces conditions, vous devez consulter un médecin avant d'utiliser ce médicament. La surveillance doit être effectuée au début du traitement, puis de manière régulière.
· Le risque d’hypertrichose (développement anormal du système pileux) à distance des sites d’application justifie que ce médicament ne soit pas recommandé chez la femme.
· Des cas de pilosité excessive sur le corps de nourrissons ont été rapportés après contact cutané au niveau des sites d’application du minoxidil de patients (soignants) utilisant du minoxidil topique. La croissance des poils est revenue à la normale en quelques mois lorsque les nourrissons n'étaient plus exposés au minoxidil. Veiller à ce que les enfants n’entrent pas en contact avec des zones de votre corps où vous avez appliqué le minoxidil par voie topique.
Consultez un médecin si vous remarquez une pilosité excessive sur le corps de votre enfant pendant la période où vous utilisez des produits topiques contenant du minoxidil.
Vous ne devez pas appliquer ce médicament :
· Si vous n’avez pas d’antécédents familiaux d’alopécie, si vous avez une chute des cheveux brutale et/ou en plaques, une chute de cheveux consécutive à un accouchement, ou une chute de cheveux de cause inconnue. Dans ces cas, vous devez consulter votre médecin avant de prendre ALOPEXY car ce traitement peut ne pas être efficace sur ces types de chutes de cheveux.
· Si votre cuir chevelu présente une rougeur, est inflammé, infecté, irrité ou douloureux. Ce médicament doit être uniquement appliqué sur le cuir chevelu sain (voir rubrique : « Comment utiliser ALOPEXY 50 mg/ml »). Chez les sujets présentant des lésions du cuir chevelu, une augmentation du passage dans le sang de la substance active (minoxidil) est possible (voir rubrique : « N’utilisez jamais ALOPEXY 50 mg/ml »).
· N’appliquez pas ce médicament en même temps que d’autres médicaments dermatologiques appliqués sur le cuir chevelu.
· Ne pas appliquer sur aucune autre partie de votre corps.
Pendant le traitement
· En cas de contact accidentel avec l’œil, une plaie, une peau irritée, une muqueuse, ce médicament qui contient de l’éthanol (alcool) peut provoquer une sensation de brûlure ou une irritation : rincer abondamment avec de l’eau courante froide. En cas de signes persistants, consultez un médecin.
· Une augmentation temporaire de la perte de cheveux peut survenir au cours des 2 à 6 premières semaines de traitement. Si la perte de cheveux persiste ou s’aggrave au-delà de 6 semaines, vous devez arrêter d'utiliser ALOPEXY et consulter votre médecin.
· N’exposez pas le cuir chevelu traité au soleil, une protection est nécessaire (chapeau).
· Ne pas avaler. L’ingestion accidentelle peut provoquer des effets dus à l’action cardio-vasculaire du minoxidil. Par conséquent, le produit doit être tenu hors de la vue et de la portée des enfants. CONSULTEZ RAPIDEMENT UN MEDECIN.
· Ne pas inhaler le médicament pulvérisé.
· Une modification de la couleur et/ou la texture des cheveux a été constatée chez quelques patients.
Vous devez arrêter le traitement immédiatement et consulter un médecin :
· Si vous ressentez une baisse de la tension artérielle, des douleurs dans la poitrine ou une accélération du pouls
· En cas de faiblesse ou de vertiges
· En cas de prise de poids soudaine et inexpliquée, de gonflement des mains ou des pieds (œdème)
· En cas de rougeur ou d’irritation persistante du cuir chevelu.
Autres médicaments et ALOPEXY 50 mg/ml, solution pour application cutanée
N’appliquez pas ce médicament en même temps que d’autres produits dermatologiques, comme l’anthraline, la trétinoïne, le dipropionate de bétaméthasone, car ces produits sont susceptibles de modifier la quantité de minoxidil passant dans le sang.
Informez votre médecin ou votre pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament, y compris un médicament obtenu sans ordonnance.
ALOPEXY 50 mg/ml, solution pour application cutanée avec des aliments et boissons
Sans objet.
Grossesse et allaitement
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Ce médicament ne doit pas être utilisé chez la femme.
Ne pas utiliser ce médicament chez la femme en âge de procréer, pendant la grossesse ou l’allaitement.
Conduite de véhicules et utilisation de machines
ALOPEXY n'a aucun effet ou un effet négligeable sur l'aptitude à conduire des véhicules et à utiliser des machines.
ALOPEXY 50 mg/ml, solution pour application cutanée contient du propylène glycol et de l’éthanol.
Ce médicament contient 240 mg de propylène glycol dans chaque dose, équivalent à 240 mg/ml.
Ce médicament contient 520 mg d’alcool (éthanol) dans chaque dose, équivalent à 520 mg/ml.
Cela peut provoquer une sensation de brûlure sur une peau endommagée.
Ce médicament contient de l’éthanol et est donc inflammable.
3. COMMENT UTILISER ALOPEXY 50 mg/ml, solution pour application cutanée ?
Produit inflammable.
Tenir à l’écart de la chaleur, des surfaces chaudes, des étincelles, des flammes nues et de toute autre source d’inflammation.
Ne pas fumer pendant l’utilisation ou la manipulation du tube.
Veillez à toujours utiliser ce médicament en suivant exactement les instructions de cette notice ou les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
Posologie
La dose recommandée est de 1 ml à appliquer deux fois par jour sur la zone de cuir chevelu à traiter.
La dose quotidienne ne doit pas dépasser 2 ml, quelle que soit l’étendue de la zone à traiter.
Une application de 1 ml le matin et de 1 ml le soir.
N’augmentez pas les doses, ni les fréquences d’application.
Dans tous les cas, respectez strictement la dose.
Mode d’administration
Voie cutanée. Usage externe.
Avant et après application de la solution, se laver soigneusement les mains.
Appliquer sur des cheveux et un cuir chevelu parfaitement secs.
Etendre le produit avec le bout des doigts de façon à couvrir l’ensemble de la zone à traiter, en prenant pour point de départ le centre de la zone à traiter.
Ne pas appliquer le produit sur une autre partie du corps.
Mode d’application
Ouvrir le flacon : Le flacon est muni d'un bouchon sécurité-enfant. Voici comment l'ouvrir : appuyer sur le bouchon en plastique tout en le tournant dans le sens contraire des aiguilles d'une montre (vers la gauche). Il ne doit rester sur le flacon que le témoin d’inviolabilité.
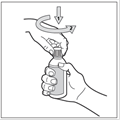
En fonction du système de délivrance utilisé : pipette doseuse ou pulvérisateur
Pipette graduée à 1ml
|
|
La pipette permet de prélever avec précision 1 ml de solution à répartir sur l’ensemble de la zone à traiter, en prenant pour point de départ le centre de la zone à traiter.
|
Pompe doseuse avec applicateur
Ce système est adapté à l’application sur de faibles surfaces ou sous les cheveux.
|
|
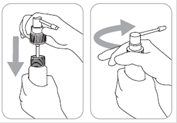
1. Encliqueter la canule dans la pompe : tenir fermement le corps de la pompe en appuyant sur la partie poussoir de la canule
|
|
|
2. Insérer le pulvérisateur muni de la canule dans le flacon et le visser fermement
|
|
|
3. Amorcer la pompe : le système de distribution est prêt à l’emploi
|
|
|
4. Pour l’application : diriger le pulvérisateur vers le centre de la surface à traiter ou sous les cheveux, presser une fois et étaler le produit avec le bout des doigts. Six (6) pulvérisations sont nécessaires pour appliquer une dose d’1 ml. |
|
|
5. Rincer la canule à l’eau chaude après chaque utilisation. |
Durée du traitement
Le résultat n'est pas immédiat ; l'arrêt de la chute des cheveux et/ou la reprise de la pousse des cheveux nécessite un certain temps après le début du traitement. Un traitement continu est nécessaire pour augmenter et maintenir la repousse des cheveux. Les premiers résultats peuvent apparaître après 2 à 4 mois d'application deux fois par jour. Le délai et le degré de réponse varient d'un patient à l'autre.
Si aucune amélioration des symptômes n’est observée 4 mois après le début du traitement, vous devez contacter votre médecin et envisager d’arrêter le traitement.
Si vous avez utilisé plus de ALOPEXY 50 mg/ml, solution pour application cutanée que vous n’auriez dû
Le surdosage est peu probable en cas d’utilisation conforme aux recommandations. En cas d’application sur un cuir chevelu endommagé, l’absorption de la substance active peut être augmentée, et des effets indésirables peuvent survenir (voir la rubrique 2 QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER ALOPEXY 50 mg/ml, solution pour application cutanée)
Si vous oubliez d’utiliser ALOPEXY 50 mg/ml, solution pour application cutanée.
N’utilisez pas de dose double pour compenser la dose que vous avez oublié d’appliquer.
Reprendre à la fréquence habituelle : 1 application le matin et 1 application le soir.
Si vous arrêtez d’utiliser ALOPEXY 50 mg/ml, solution pour application cutanée :
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Informez immédiatement votre médecin si vous remarquez l'un des symptômes suivants, car vous pourriez avoir besoin d'un traitement médical en urgence.
· Gonflement du visage, des lèvres ou de la gorge entraînant des difficultés à avaler ou à respirer. Ces symptômes pourraient être le signe d'une réaction allergique grave (fréquence indéterminée, ne pouvant être estimée à partir des données disponibles).
Les réactions les plus fréquemment observées consistent en des réactions cutanées mineures.
Des applications cutanées fréquentes peuvent provoquer des irritations et une sécheresse de la peau en raison de la présence d'alcool.
Les effets indésirables suivants ont été rapportés et sont classés par fréquences :
Très fréquents : peuvent affecter plus d’une personne sur 10
Hypertrichose (poussée excessive des poils) à distance du site d’application, notamment si le produit est utilisé chez la femme.
Maux de tête.
Fréquents : peuvent affecter jusqu’à une personne sur 10
Réactions cutanées locales au site d’application du produit : irritation locale avec desquamation (élimination des cellules mortes de la peau), démangeaison, rougeur de la peau, dermatite, sécheresse de la peau, réaction allergique de la peau, réaction inflammatoire de la peau, éruptions sur la peau pouvant ressembler à de l’acné, douleurs musculosquelettiques, œdèmes périphériques (infiltration de liquides dans les tissus), difficultés à respirer dépression et douleur.
Fréquence indéterminée (ne pouvant être estimée sur la base des données disponibles)
Infection de l’oreille, otites externes, rhinite, hypersensibilité, névrite, sensation de picotements, altération du goût, sensation de brûlure, troubles de la vision, irritation oculaire, étourdissement, baisse de la tension artérielle, accélération du rythme cardiaque, palpitations, douleur thoracique, faiblesse, gonflement du visage (infiltration de liquides dans les tissus), rougeur généralisée, chute de cheveux et répartition irrégulière des cheveux, changement de la couleur ou de la texture des cheveux, hépatite, et calculs rénaux.
Dans tous ces cas, il faut arrêter votre traitement et prévenir rapidement votre médecin.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/.En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER ALOPEXY 50 mg/ml, solution pour application cutanée ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur le flacon après EXP. La date de péremption fait référence au dernier jour de ce mois.
Produit inflammable. Tenir à l’écart de la chaleur, des surfaces chaudes, des étincelles, des flammes nues et de toute autre source d’inflammation. Ne pas fumer.
La solution doit être utilisée 1 mois maximum après première ouverture.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient ALOPEXY 50 mg/ml, solution pour application cutanée
· La substance active est :
Minoxidil......................................................................................................................... 50 mg
Pour 1 ml
· Les autres composants sont : Propylène glycol*, éthanol à 96%*, eau purifiée.
*Voir rubrique 2 « ALOPEXY contient »
Ce médicament se présente sous forme d’une solution limpide, légèrement jaune. Solution pour application cutanée.
Flacon de 60 ml fermé par un bouchon sécurité-enfant avec pipette graduée à 1 ml et pompe doseuse avec applicateur. Boîte de 1 ou 3 flacon(s).
Flacon de 60 ml fermé par un bouchon sécurité-enfant avec pipette graduée à 1 ml. Boîte de 1 flacon.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
LES CAUQUILLOUS
81500 LAVAUR
Exploitant de l’autorisation de mise sur le marché
PIERRE FABRE MEDICAMENT
PARC INDUSTRIEL DE LA CHARTREUSE
81100 CASTRES
PIERRE FABRE MEDICAMENT PRODUCTION
SITE PROGIPHARM
RUE DU LYCEE
45500 GIEN
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Conseil d’éducation sanitaire :
Qu’appelle-t-on alopécie androgénétique ?
Normalement les cheveux ont une durée de vie de 3 à 6 ans et il tombe par jour 50 à 100 cheveux.
Une chute de cheveux plus importante peut survenir de façon saisonnière (à l’automne) ou après un accouchement : cette chute est normale, transitoire et il n’y a pas lieu de débuter un traitement.
L’alopécie se définit par une chute de cheveux supérieure à 100 cheveux par jour.
On distingue deux types d’alopécies :
· Les alopécies aiguës,
· Les alopécies chroniques.
Les alopécies aiguës (chute des cheveux soudaine sur une courte période) peuvent être diffuses ou par plaques (pelades) et sont le plus souvent de cause connue (soins capillaires agressifs, mauvais état général, cure d’amaigrissement mal équilibrée, certains médicaments, choc psychique, stress ).
Ces alopécies aiguës ne doivent pas être traitées par ce médicament.
Les alopécies chroniques (au long cours) sont presque toujours diffuses.
Elles sont parfois dues à une maladie précise (thyroïde, métabolique ) et elles ne doivent pas être traitées par ce médicament.
Dans la grande majorité, ces alopécies chroniques sont d’origine mal connue, le plus souvent à caractère héréditaire : il s’agit de l’alopécie androgénétique. Seul ce type d’alopécie peut être traité par le minoxidil.
Comment reconnaître une alopécie androgénétique ?
|
Chez la femme |
Chez l’homme |
|
|
|
|
L’alopécie androgénétique est diffuse : il se produit une diminution globale de la densité capillaire. La chevelure s’éclaircit progressivement à partir de la raie.
|
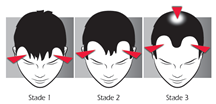
L’alopécie androgénétique débute par un dégarnissement des golfes temporaux. Puis une légère tonsure apparaît au sommet du crâne. Ces deux zones dépourvues de cheveux vont progressivement s ’agrandir : l’alopécie androgénétique évolue progressivement vers la calvitie. |
Quelques conseils d’utilisation
Utiliser un shampooing peu agressif (de préférence sans silicone).
Si vous faites votre shampooing après l’application du minoxidil, respecter une période de 4 heures après celle-ci.
Si vous appliquez le minoxidil après le shampooing, il est recommandé de le faire sur le cuir chevelu sec. Vous pouvez utiliser un sèche-cheveux après application de minoxidil de préférence en position tiède.
Vous pouvez utiliser des mousses, gels ou sprays coiffants en respectant un délai minimum de 1 heure entre les applications.
Il n’y a pas d’interaction entre votre traitement par le minoxidil et vos permanentes ou soin colorants mais il est préférable de les limiter du fait de leur agressivité sur les cheveux.
Si vous envisagez de vous exposer au soleil après une application de minoxidil, il est recommandé de couvrir vos cheveux.
Quelques informations complémentaires
En début de traitement, sur une courte période, il est possible que se produise une augmentation de la chute des cheveux. Ces cheveux étaient destinés à tomber et le font plus rapidement. C’est un phénomène normal, continuez le traitement.
Les premiers cheveux qui pousseront seront doux, duveteux et peu visibles. Au fur et à mesure, en poursuivant votre traitement, ils pourront changer et s’épaissir.