Dernière mise à jour le 01/12/2025
NUMETAH G16%E, émulsion pour perfusion
Indications thérapeutiques
Classe pharmacothérapeutique : solutions pour nutrition parentérale/mélanges - code ATC : B05 BA10
NUMETAH G16%E doit être utilisé exclusivement sous surveillance médicale.
Composition en substances actives
-
Compartiment des acides aminés ( Composition pour 221 ml de solution d'acides aminés )
- > alanine 1,03 g
- > arginine 1,08 g
- > acide aspartique 0,77 g
- > cystéine 0,24 g
- > acide glutamique 1,29 g
- > glycine 0,51 g
- > histidine 0,49 g
- > isoleucine 0,86 g
- > leucine 1,29 g
- lysine1,42 g
- sous forme de : lysine monohydratée1,59 g
- > méthionine 0,31 g
- ornithine0,32 g
- sous forme de : chlorhydrate d'ornithine0,41 g
- glucose anhydre77,5 g
- sous forme de : glucose monohydraté85,25 g
- > huile d'olive raffinée
- > huile de soja raffinée
Présentations
> 6 poche(s) à 3 compartiments matière plastique suremballée(s)/surpochée(s) de 500 ml
Code CIP : 416 624-6 ou 34009 416 624 6 1
Déclaration de commercialisation : 15/03/2012
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 19/10/2011 | Inscription (CT) | Le service médical rendu par ces spécialités est important. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| IV (Mineur) | Avis du 19/10/2011 | Inscription (CT) | Compte tenu des compositions de NUMETAH conformes aux recommandations, de la qualité et la sécurité pharmaceutiques plus importantes que pour les préparations hospitalières et de l'absence d'alternatives hormis ces préparations, l'amélioration du service médical rendu (ASMR) de NUMETAH G13%E, G16%E et G19%E est mineure (de niveau IV) dans la prise en charge respectivement des prématurés, des enfants de moins de 2 ans, des enfants de plus de 2 ans, lorsqu'une nutrition parentérale est nécessaire. |
ANSM - Mis à jour le : 14/05/2024
NUMETAH G16%E, émulsion pour perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
|
Volume de la poche |
Solution de glucose à 50 % |
Solution d’acides aminés à 5,9 % contenant des électrolytes |
Émulsion lipidique à 12,5 % |
|
500 mL |
155 mL |
221 mL |
124 mL |
Si l'administration de lipides n'est pas souhaitable, la conception de la poche permet d'ouvrir uniquement la soudure non permanente séparant les compartiments d'acides aminés/électrolytes et la solution de glucose, tout en gardant intacte la soudure séparant les compartiments d'acides aminés et de l'émulsion lipidique. Le contenu de la poche peut donc être perfusé avec ou sans lipides.
La composition du médicament, après avoir mélangé le contenu des deux compartiments (acides aminés et glucose, 2 compartiments, 376 mL de solution) ou trois compartiments (acides aminés, glucose et lipides, 3 compartiments, 500 mL d'émulsion) est présentée dans le tableau suivant.
|
Composition |
||
|
Substance active |
2 CP* ouverts (376 mL) |
3 CP** ouverts (500 mL) |
|
Compartiment des Acides Aminés |
||
|
Alanine |
1,03 g |
1,03 g |
|
Arginine |
1,08 g |
1,08 g |
|
Acide aspartique |
0,77 g |
0,77 g |
|
Cystéine |
0,24 g |
0,24 g |
|
Acide glutamique |
1,29 g |
1,29 g |
|
Glycine |
0,51 g |
0,51 g |
|
Histidine |
0,49 g |
0,49 g |
|
Isoleucine |
0,86 g |
0,86 g |
|
Leucine |
1,29 g |
1,29 g |
|
Lysine monohydratée équivalent à Lysine |
1,59 g (1,42 g) |
1,59 g (1,42 g) |
|
Méthionine |
0,31 g |
0,31 g |
|
Chlorhydrate d'ornithine équivalent à Ornithine |
0,41 g (0,32 g) |
0,41 g (0,32 g) |
|
Phénylalanine |
0,54 g |
0,54 g |
|
Proline |
0,39 g |
0,39 g |
|
Sérine
|
0,51 g |
0,51 g |
|
Taurine |
0,08 g |
0,08 g |
|
Thréonine |
0,48 g |
0,48 g |
|
Tryptophane |
0,26 g |
0,26 g |
|
Tyrosine |
0,10 g |
0,10 g |
|
Valine |
0,98 g |
0,98 g |
|
Chlorure de sodium |
0,30 g |
0,30 g |
|
Acétate de potassium |
1,12 g |
1,12 g |
|
Chlorure de calcium, dihydraté |
0,46 g |
0,46 g |
|
Acétate de magnésium, tétrahydraté |
0,33 g |
0,33 g |
|
Glycérophosphate de sodium hydraté |
0,98 g |
0,98 g |
|
Compartiment de la solution de glucose |
||
|
Glucose monohydrate Équivalent à glucose anhydre |
85,25 g (77,50 g) |
85,25 g (77,50 g) |
|
Compartiment de l’émulsion lipidique |
||
|
Huile d’olive raffinée (environ 80 %) + huile de soja raffinée (environ 20 %) |
- |
15,5 g |
*2 CP = deux compartiments de la poche, **3 CP = trois compartiments de la poche.
Pour la liste complète des excipients, voir rubrique 6.1.
Les apports de l’émulsion/la solution reconstituée sont les suivants :
|
Composition |
||||
|
|
2 CP ouverts |
3 CP ouverts |
||
|
Par unité de volume |
376 mL |
100 mL |
500 mL |
100 mL |
|
Azote (g) |
2,0 |
0,52 |
2,0 |
0,39 |
|
Acides aminés (g) |
13,0 |
3,5 |
13,0 |
2,6 |
|
Glucose (g) |
77,5 |
20,6 |
77,5 |
15,5 |
|
Lipides (g) |
0 |
0 |
15,5 |
3,1 |
|
Énergie |
||||
|
Calories totales (kcal) |
362 |
96 |
517 |
103 |
|
Calories non protéiques (kcal) |
310 |
82 |
465 |
93 |
|
Calories glucidiques (kcal) |
310 |
82 |
310 |
62 |
|
Calories lipidiques (kcal)a |
0 |
0 |
155 |
31 |
|
Ratio calories non protéiques/azote (kcal/g N) |
158 |
158 |
237 |
237 |
|
Ratio calories lipidiques/ calories non protéiques (%) |
- |
- |
33 |
33 |
|
Ratio calories lipidiques/ calories totales (%) |
- |
- |
30 |
30 |
|
Électrolytes |
||||
|
Sodium (mmol) |
11,6 |
3,1 |
12,0 |
2,4 |
|
Potassium (mmol) |
11,4 |
3,0 |
11,4 |
2,3 |
|
Magnésium (mmol) |
1,6 |
0,41 |
1,6 |
0,31 |
|
Calcium (mmol) |
3,1 |
0,82 |
3,1 |
0,62 |
|
Phosphate (mmol) b |
3,2 |
0,85 |
4,4 |
0,87 |
|
Acétate (mmol) |
14,5 |
3,9 |
14,5 |
2,9 |
|
Malate (mmol) |
4,3 |
1,1 |
4,3 |
0,86 |
|
Chlorure (mmol) |
13,8 |
3,7 |
13,8 |
2,8 |
|
pH (env.) |
5,5 |
5,5 |
5,5 |
5,5 |
|
Osmolarité env. (mOsm/l) |
1 585 |
1 585 |
1 230 |
1 230 |
a Incluant les calories des phospholipides d'œuf pour injection.
b Incluant les phosphates apportés par les phospholipides d'œuf pour injection de l'émulsion lipidique.
Aspect avant reconstitution :
· les solutions des compartiments d'acides aminés et de glucose sont limpides, incolores ou jaune pâle ;
· l’émulsion lipidique est homogène et d’aspect blanc laiteux.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
La posologie dépend de la dépense énergétique, du poids, de l'âge, de l'état clinique du patient, et de sa capacité à métaboliser les constituants de NUMETAH, ainsi que du supplément d'énergie ou de protéines administré par voie orale/entérale. La concentration totale en électrolytes et en macronutriments varie selon le nombre de compartiments ouverts (voir rubrique 2).
La dose journalière maximale ne doit pas être dépassée. En raison de la composition fixe de la poche tri compartimentée, la capacité à répondre simultanément à tous les besoins nutritionnels peut ne pas être possible. Il existe des situations cliniques où la composition de la poche n’est pas adaptée aux quantités de nutriments nécessaires pour les patients.
Le débit de perfusion par heure et le volume journalier maximal recommandés varient en fonction du constituant. Si les limites du débit de perfusion ou du volume sont atteintes, cela définit la dose journalière maximale. Les recommandations concernant le débit de perfusion par heure et le volume journalier maximal sont les suivantes :
|
|
2 CP ouverts (376 mL) |
3 CP ouverts (500 mL) |
|
Débit de perfusion maximal en mL/kg/h |
5,8 |
5,5 |
|
Correspondant à : |
|
|
|
Acides aminés en g/kg/h |
0,20*a |
0,14 |
|
Glucose en g/kg/h |
1,2 |
0,85 |
|
Lipides en g/kg/h |
0 |
0,17* a |
|
Volume maximal en mL/kg/jour |
72,3 |
96,2 |
|
Correspondant à : |
|
|
|
Acides aminés en g/kg/j |
2,5* a |
2,5* a |
|
Glucose en g/kg/j |
14,9 |
14,9 |
|
Lipides en g/kg/j |
0 |
3,0 |
a Limites conformément aux recommandations de l'ESPEN et de l'ESPGHAN
Mode d’administration
Pour les instructions concernant la préparation et la manipulation de l'émulsion/la solution pour perfusion, voir la rubrique 6.6.
Lorsqu’elle est utilisée chez les nouveau-nés et les enfants de moins de 2 ans, la solution (dans la poche et les kits d'administration) doit être protégée de l’exposition à la lumière jusqu’à la fin de l’administration (voir rubriques 4.4, 6.3 et 6.6).
L’utilisation d’un filtre de 1,2 micron est recommandé pour l’administration de NUMETAH G16%E.
En raison de son osmolarité élevée, NUMETAH G16%E non dilué peut être uniquement administré par une veine centrale. Néanmoins, une dilution suffisante de NUMETAH G16%E avec de l'eau pour préparations injectables réduit l'osmolarité et permet une perfusion par une veine périphérique.
La formule suivante indique l’effet de la dilution sur l'osmolarité des poches :
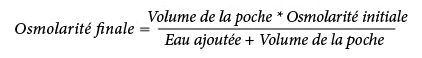
Le tableau suivant présente des exemples d'osmolarité des mélanges avec 2 CP et 3 CP ouverts après ajout d'eau pour préparations injectables :
|
|
Acides aminés et glucose (2 CP ouverts) |
Acides aminés, glucose et lipides (3 CP ouverts) |
|
Volume initial dans la poche (mL) |
376 |
500 |
|
Osmolarité initiale (mOsm/l env.) |
1 585 |
1 230 |
|
Volume d'eau ajouté (mL) |
376 |
500 |
|
Volume final après ajout (mL) |
752 |
1000 |
|
Osmolarité après ajout (mOsm/l env.) |
792,5 |
615 |
Le débit doit être augmenté progressivement au cours de la première heure. Lors de l’arrêt de NUMETAH G16%E, le débit doit être diminué progressivement au cours de la dernière heure. Le débit d'administration doit être ajusté en fonction de la dose à administrer, de l'apport volumique journalier et de la durée de la perfusion, voir rubrique 4.9.
Une même poche ne doit pas être ouverte, suspendue et administrée pendant plus de 24 heures. Les perfusions cycliques doivent être gérées en fonction de la tolérance métabolique du patient.
La nutrition parentérale peut être poursuivie aussi longtemps que l'état clinique du patient l'exige.
Ce produit contient des électrolytes et peut ensuite être supplémenté par des préparations commerciales d’électrolytes, selon l’appréciation du médecin et en fonction des besoins cliniques du patient, voir rubrique 6.6.
Des vitamines et des oligo-éléments peuvent être ajoutés selon l’appréciation du médecin et en fonction des besoins cliniques du patient, voir rubrique 6.6.
· hypersensibilité à l’œuf, aux protéines de soja ou d’arachide, à l'une des substances actives, aux excipients mentionnés à la rubrique 6.1 ou aux composants de la poche,
· anomalie congénitale du métabolisme des acides aminés,
· concentrations plasmatiques élevées et pathologiques en sodium, potassium, magnésium, calcium et/ou phosphore,
· comme pour toutes les autres solutions pour perfusion contenant du calcium, traitement concomitant par ceftriaxone chez les nouveau-nés et les nourrissons (âgés de moins de 28 jours) même si des lignes de perfusion séparées sont utilisées (risque fatal de précipitation de sels de ceftriaxone-calcium dans la circulation sanguine du nouveau-né), voir rubriques 4,4, 4.5 et 6.2,
· hyperglycémie sévère.
L'ajout de lipides (administration intraveineuse de NUMETAH G16%E, émulsion pour perfusion en poche à 3 compartiments ouverts) est contre-indiqué dans les situations cliniques supplémentaires suivantes :
· hyperlipidémie sévère ou troubles sévères du métabolisme lipidique caractérisés par une hypertriglycéridémie.
4.4. Mises en garde spéciales et précautions d'emploi
NUMETAH G16%E contient du glucose dérivé du maïs. En conséquence, NUMETAH G16%E doit être utilisé avec précaution chez les patients allergiques au maïs ou aux produits à base de maïs.
Des cas de réactions fatales avec des précipités de sels de ceftriaxone-calcium dans les poumons et les reins ont été décrits chez des nouveau-nés à terme âgés de moins d’un mois.
Quel que soit l’âge du patient, la ceftriaxone ne doit pas être mélangée ou administrée simultanément avec des solutions intraveineuses contenant du calcium, comme NUMETAH G16%E, même si des lignes de perfusion ou des sites de perfusion différents sont utilisés, en raison du risque de précipitation de sels de ceftriaxone-calcium.
Cependant, chez les patients âgés de plus de 28 jours, la ceftriaxone et les solutions contenant du calcium peuvent être administrées séquentiellement, l’une après l’autre, si les lignes de perfusion sont utilisées sur des sites différents, ou si les lignes de perfusion sont remplacées ou minutieusement rincées entre les perfusions à l’aide d’une solution de chlorure de sodium 0.9% afin d’éviter toute précipitation.
Des précipités vasculaires pulmonaires entraînant une embolie pulmonaire d’origine vasculaire et une détresse respiratoire, d’issue fatale dans certains cas, ont été rapportés chez des patients recevant une nutrition parentérale. Un ajout excessif de calcium et de phosphate augmente le risque de formation de précipités de phosphate de calcium (voir rubrique 6.2). Une formation de précipités dans la circulation sanguine a également été suspectée.
En plus de l’inspection de la solution, le dispositif de perfusion et le cathéter doivent également être régulièrement vérifiés afin de détecter toute formation de précipités.
En cas d’apparition de signes de détresse respiratoire, la perfusion doit être arrêtée et une évaluation médicale initiée.
Aucun ajout ne doit être réalisé dans la poche sans en vérifier préalablement la compatibilité, la formation de précipités ou la déstabilisation de l'émulsion lipidique pouvant entraîner une occlusion vasculaire (voir rubriques 6.2 et 6.6).
Une infection et une septicémie peuvent survenir en cas d'utilisation de cathéters intraveineux pour l'administration de formules parentérales ou en cas de défaut d’entretien des cathéters. Les effets immunosuppresseurs de certaines affections ou de certains médicaments peuvent accroître le risque d'infection et de septicémie. Une surveillance clinique étroite et la réalisation d'examens de laboratoire afin de contrôler la survenue de fièvre/frissons, de leucocytose, de complications techniques liées au dispositif d'accès et d'hyperglycémie peuvent contribuer à une détection rapide des infections. Les patients qui nécessitent une nutrition parentérale sont souvent prédisposés à des complications infectieuses dues à la malnutrition et/ou à leur état pathologique sous-jacent. Le risque de complications septiques peut être réduit en insistant particulièrement sur l'utilisation d'une technique aseptique lors du positionnement et de l'entretien du cathéter, ainsi que lors de la préparation de la formule nutritionnelle.
Un syndrome de surcharge graisseuse a été rapporté avec d’autres produits de nutrition parentérale. Une diminution de la capacité d’élimination des lipides contenus dans NUMETAH ou un surdosage peuvent conduire à un « syndrome de surcharge graisseuse » (voir rubrique 4.8 et 4.9).
La réalimentation de patients sévèrement dénutris peut entraîner l'apparition du syndrome de renutrition, caractérisé par une modification de la répartition intracellulaire du potassium, du phosphore et du magnésium lors de la phase d'anabolisme. Un déficit en thiamine et une rétention d'eau peuvent également se développer. Il est recommandé de commencer la nutrition parentérale lentement et avec précaution, en surveillant attentivement le bilan liquidien, les électrolytes, les oligo-éléments et les vitamines.
NUMETAH G16%E doit uniquement être administré par une veine centrale sauf si une dilution appropriée est effectuée (voir rubrique 4.2). En cas de supplémentation de la formulation, l'osmolarité du mélange final doit être calculée avant administration par une veine périphérique afin d'éviter toute irritation veineuse ou des lésions tissulaires en cas d'extravasation de la solution. L'administration périphérique de NUMETAH a conduit à une extravasation, entraînant des lésions des tissus mous et une nécrose de la peau.
Ne pas connecter les poches en série afin d’éviter tout risque d’embolie gazeuse due à l’air résiduel contenu dans la première poche.
Les lipides, les vitamines, les électrolytes et oligo-éléments supplémentaires doivent être administrés selon les besoins.
Précautions d’emploi
Ne pas ajouter d'autres médicaments ou substances à l’un des 3 compartiments de la poche, ou à la solution ou à l’émulsion reconstituée sans avoir au préalable vérifié la compatibilité et la stabilité de la préparation obtenue (en particulier la stabilité de l'émulsion lipidique) (voir rubriques 6.2 et 6.6).
L'exposition à la lumière de solutions pour nutrition parentérale par voie intraveineuse, notamment après l’ajout d’un mélange d’oligo-éléments et/ou de vitamines, peut avoir des effets négatifs sur les résultats cliniques chez les nouveau-nés, en raison de la production de peroxydes et d'autres produits de dégradation. Lorsqu’il est utilisé chez les nouveau-nés et les enfants de moins de 2 ans, NUMETAH G16%E doit être protégé de la lumière ambiante jusqu'à la fin de l'administration (voir rubrique 4.2, 6.3 et 6.6).
L'équilibre hydroélectrolytique, l'osmolarité sérique, les concentrations sériques en triglycérides, l'équilibre acido-basique, la glycémie, les analyses de la fonction hépatique et rénale, l'hémogramme, y compris la numération des plaquettes et les facteurs de coagulation, doivent être régulièrement contrôlés pendant toute la durée du traitement.
En cas d'états instables (par exemple, après un état post-traumatique sévère, un diabète sucré décompensé, la phase aiguë d'un choc circulatoire, la phase aiguë d'un infarctus du myocarde, une acidose métabolique sévère, une septicémie sévère et un coma hyperosmolaire), l'administration de NUMETAH G16%E doit faire l'objet d'une surveillance et d'un ajustement selon les besoins cliniques du patient.
Affections cardiovasculaires
A utiliser avec prudence chez les patients présentant un œdème pulmonaire ou une insuffisance cardiaque. Le bilan liquidien doit être surveillé attentivement chez ces patients.
Affections rénales
A utiliser avec prudence chez les patients présentant une insuffisance rénale. Le bilan hydroélectrolytique, notamment le taux de magnésium (voir Hypermagnésémie) doit être attentivement surveillé chez ces patients.
Les troubles sévères de l'équilibre hydroélectrolytique, les surcharges liquidiennes sévères et les troubles métaboliques sévères doivent être corrigés avant le début de la perfusion (voir rubrique 4.3).
Affections hépatiques/gastro-intestinales
A utiliser avec prudence chez les patients atteints d'insuffisance hépatique sévère, notamment de cholestase ou présentant une augmentation des enzymes hépatiques. La fonction hépatique doit être étroitement surveillée.
Affections endocriniennes et troubles du métabolisme
Des complications métaboliques peuvent survenir si l'apport en nutriments n'est pas adapté aux besoins du patient ou si la capacité métabolique pour un composant alimentaire donné n'a pas été évaluée avec précision. Des effets métaboliques indésirables peuvent résulter d’une administration inadéquate ou excessive de nutriments ou d’une composition inappropriée d'un mélange, compte tenu des besoins spécifiques du patient.
Les concentrations sériques en triglycérides et la capacité de l'organisme à métaboliser les lipides doivent être régulièrement surveillées. En cas de suspicion de troubles du métabolisme lipidique, il est recommandé de mesurer la concentration sérique en triglycérides si cela est cliniquement nécessaire.
En cas d'hyperglycémie, le débit de perfusion de NUMETAH G16%E doit être ajusté et/ou de l'insuline doit être administrée, voir rubrique 4.9.
Affections hématologiques
A utiliser avec prudence chez les patients souffrant de troubles sévères de la coagulation. L'hémogramme et les facteurs de coagulation doivent être étroitement surveillés.
Hypermagnésémie
NUMETAH G16%E apporte 0,3 mmol/kg/j de magnésium en cas d'administration de la dose maximale (voir rubrique 4.2). Il est possible que cela entraîne une hypermagnésémie. Les signes d'hypermagnésémie incluent une faiblesse généralisée, une hyporéflexie, des nausées, des vomissements, une hypocalcémie, une insuffisance respiratoire, une hypotension et des arythmies. Les signes d'hypermagnésémie pouvant passer inaperçus, il est recommandé de contrôler les taux de magnésium en début de traitement puis à intervalles appropriés par la suite, conformément aux pratiques cliniques habituelles et en fonction des besoins du patient. Ceci est particulièrement important chez les patients présentant un risque accru d'hypermagnésémie, notamment les patients présentant des troubles de la fonction rénale, recevant d'autres médicaments entraînant un risque d'hypermagnésémie ou recevant du magnésium provenant d'autres sources, y compris chez les nouveau-nés dont la mère a récemment reçu du magnésium pendant la période ante-partum.
Si la concentration sérique en magnésium est élevée (supérieure aux valeurs normales de référence), la perfusion de NUMETAH G16%E doit être interrompue ou sa vitesse réduite selon l'évaluation clinique et les critères de sécurité.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d'interaction pharmacodynamique n'a été réalisée avec NUMETAH G16%E.
NUMETAH G16%E ne doit pas être administré simultanément avec du sang par la même tubulure de perfusion en raison du risque de pseudo-agglutination.
Comme pour les autres solutions pour perfusion contenant du calcium, un traitement concomitant par ceftriaxone et NUMETAH G16%E est contre-indiqué chez les nouveau-nés à terme et les nourrissons (âgés de moins de 28 jours), même si des lignes de perfusion séparées sont utilisées (risque fatal de précipitation de sel calcique de ceftriaxone dans la circulation sanguine du nouveau-né).
Quel que soit l’âge du patient (y compris chez les adultes), la ceftriaxone ne doit pas être mélangée ou administrée simultanément avec des solutions intraveineuses contenant du calcium, comme NUMETAH G16%E, même si des lignes de perfusion ou des sites de perfusion différents sont utilisés, en raison du risque de précipitation de sels de ceftriaxone-calcium (voir rubrique 4.4).
Cependant, chez les patients âgés de plus de 28 jours, la ceftriaxone et les solutions contenant du calcium peuvent être administrées séquentiellement, l’une après l’autre, si les lignes de perfusion sont utilisées sur des sites différents, ou si elles sont remplacées ou minutieusement rincées entre les perfusions à l’aide d’une solution de chlorure de sodium 0.9% afin d’éviter toute précipitation.
L'huile d'olive et l'huile de soja possèdent une teneur naturelle en vitamine K1 susceptible d'entraver l'activité anticoagulante de la coumarine (ou de dérivés de la coumarine tels que la warfarine).
En raison de la teneur en potassium de NUMETAH G16%E, il convient d'être particulièrement attentif aux patients traités simultanément avec des diurétiques d'épargne potassique (amiloride, spironolactone, triamtérène), des inhibiteurs de l'enzyme de conversion (IEC), des antagonistes des récepteurs de l'angiotensine II ou des immunosuppresseurs (tacrolimus ou ciclosporine) en raison du risque d'hyperkaliémie.
Les lipides contenus dans cette émulsion peuvent interférer avec les résultats de certains examens de laboratoire (par exemple, bilirubine, lactate déshydrogénase, saturation du sang en oxygène, hémoglobine sanguine) si le prélèvement sanguin a été réalisé avant l'élimination des lipides. Ceux-ci sont normalement éliminés après une période de 5 à 6 heures sans apport de lipides.
Voir également la rubrique 6.2 « Incompatibilités ».
4.6. Fertilité, grossesse et allaitement
Sans objet.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Effets indésirables rapportés d’essai clinique et d’expérience post-commercialisation.
La sécurité d’emploi et l'administration de NUMETAH ont été évaluées dans le cadre d'une seule étude de phase III. Cent cinquante-neuf (159) patients pédiatriques ont été inclus dans l'étude et traités par NUMETAH.
Les données regroupées provenant des essais cliniques et de l'expérience post-commercialisation indiquent les réactions au médicament suivantes liées à NUMETAH:
|
|
Effets indésirables lors de l’essai clinique et l’expérience post-commercialisation |
|
|
Classes de systèmes d'organes |
Terme préférentiel MedDRA |
Fréquenceb |
|
TROUBLES DU METABOLISME ET DE LA NUTRITION |
Hypophosphatémiea Hyperglycémiea Hypercalcémiea Hypertriglycéridémiea Hyperlipidémie Hyponatrémiea |
Fréquent Fréquent Fréquent Fréquent Peu fréquent Fréquent |
|
AFFECTIONS HEPATOBILIAIRES |
Cholestase |
Peu fréquent |
|
AFFECTIONS DE LA PEAU ET DU TISSU SOUS-CUTANE |
Nécrose de la peau c |
Indéterminé |
|
Lésion des tissus mous c |
Indéterminé |
|
|
TROUBLES GENERAUX ET ANOMALIES AU SITE D’ADMINISTRATION |
Extravasation c |
Indéterminé |
a Prélèvements sanguins effectués pendant la perfusion (sans jeûne).
b Fréquence basée sur les catégories suivantes : très fréquent (≥1/10), fréquent (≥1/100 à <1/10), peu fréquent (≥1/1 000 à <1/100), rare (≥1/10 000 à <1/1 000), très rare (<1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
c Ces effets indésirables n’ont été signalés que pour NUMETAH G13%E et G16%E lorsqu’ils ont été administrés par voie périphérique avec une dilution insuffisante (voir rubrique 4.4).
Autres effets de classe.
Les effets indésirables suivants ont été rapportés avec d’autres mélanges de nutrition parentérale :
Syndrome de surcharge graisseuse : peut survenir en cas d’administration inappropriée (ex., surdosage et/ou débit de perfusion plus élevé que celui recommandé, voir rubrique 4.9) ; cependant, les signes et symptômes de ce syndrome peuvent également survenir lorsque le produit est administré conformément aux instructions. Une capacité réduite ou limitée à métaboliser les lipides contenus dans NUMETAH G16%E, associée à une clairance plasmatique prolongée, peut provoquer un « syndrome de surcharge graisseuse ». Ce syndrome s'accompagne d'une brusque détérioration de l'état clinique du patient et se caractérise par des signes tels qu’une hyperlipidémie, de la fièvre, une stéatose par infiltration graisseuse (hépatomégalie), une détérioration de la fonction hépatique, une anémie, une leucopénie, une thrombocytopénie, des troubles de la coagulation, un détresse respiratoire aigüe, une acidose métabolique et des manifestations du système nerveux central (ex., coma). Ce syndrome est généralement réversible après l'arrêt de la perfusion de l'émulsion lipidique.
Précipités vasculaires pulmonaires (embolie pulmonaire d’origine vasculaire et détresse respiratoire) (voir rubrique 4.4).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En cas d'administration inappropriée (surdosage et/ou débit de perfusion plus élevé que celui recommandé), des nausées, des vomissements, des frissons, des déséquilibres électrolytiques et des signes d'hypervolémie ou d'acidose peuvent se manifester et avoir des conséquences fatales. Dans ce cas, la perfusion doit être immédiatement arrêtée. En fonction de l’état clinique du patient, des mesures supplémentaires peuvent être indiquées.
Une hyperglycémie, une glycosurie et un syndrome hyperosmolaire peuvent se manifester si la vitesse de perfusion du glucose dépasse la clairance.
Un surdosage ou une capacité réduite ou limitée à métaboliser les lipides peut entraîner un « syndrome de surcharge graisseuse », dont les effets sont généralement réversibles après l'arrêt de la perfusion de l’émulsion lipidique, voir rubrique 4.8. Chez les nouveau-nés et les nourrissons, un syndrome de surcharge graisseuse a été associé à une acidose métabolique et une détresse respiratoire
Il n'existe pas d’antidote spécifique en cas de surdosage en NUMETAH. Les procédures d'urgence doivent être des mesures générales de soutien, principalement axées sur les systèmes respiratoire et cardiovasculaire. Dans certains cas graves, une hémodialyse, une hémofiltration ou une hémodiafiltration peuvent être nécessaires. Des cas graves de syndrome de surcharge graisseuse traités par exsanguino-transfusion ont été rapportés dans la littérature.
Une surveillance étroite des paramètres biochimiques est indispensable et les anomalies spécifiques doivent être prises en charge de façon appropriée.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : solutions pour nutrition parentérale/mélanges, code ATC : B05 BA10.
La teneur en azote (20 acides aminés de la série L, dont 8 acides aminés essentiels) et la valeur énergétique (glucose et triglycérides) de NUMETAH permettent de maintenir un équilibre azote/énergie adéquat. L'azote et l'énergie sont nécessaires au fonctionnement normal de toutes les cellules de l'organisme et jouent un rôle important dans la synthèse protéique, la croissance, la cicatrisation, la fonction immunitaire, la fonction musculaire et de nombreuses autres activités cellulaires.
Cette formule contient aussi des électrolytes.
Le profil des acides aminés se définit comme suit :
· Acides aminés essentiels/acides aminés totaux : 47,5 %
· Acides aminés à chaîne ramifiée/acides aminés totaux : 24,0 %
L'émulsion lipidique contenue dans NUMETAH est un mélange d'huile d'olive raffinée et d'huile de soja raffinée (ratio d’environ 80/20), dont la répartition relative en acides gras est la suivante :
· 15 % d'acides gras saturés (AGS)
· 65 % d’acides gras mono-insaturés (AGMI)
· 20 % d'acides gras polyinsaturés (AGPI)
Le ratio phospholipides/triglycérides est de 0,06. La teneur modérée en acides gras essentiels (AGE) améliore le statut de leurs dérivés supérieurs tout en corrigeant une déficience en AGE.
L'huile d'olive contient une quantité significative d’alpha-tocophérol qui, combiné à un apport modéré en AGPI, contribue à améliorer le statut en vitamine E et joue un rôle important pour limiter la peroxydation lipidique.
Le glucose est la source d'hydrate de carbone. Le glucose est une source d'énergie essentielle dans l'organisme.
5.2. Propriétés pharmacocinétiques
5.3. Données de sécurité préclinique
Aucune étude sur les animaux n’a été menée avec NUMETAH (deux ou trois compartiments ouverts).
|
Compartiment des acides aminés |
Compartiment de la solution de glucose |
Compartiment de l’émulsion lipidique |
|
|
Acide L maliquea |
X |
- |
- |
|
Acide chlorhydriquea |
- |
X |
- |
|
Phospolipides d’œuf pour injection |
- |
- |
X |
|
Glycérol |
- |
- |
X |
|
Oléate de Sodium |
- |
- |
X |
|
Hydroxyde de sodiuma |
- |
- |
X |
|
Eau pour préparations injectables |
X |
X |
X |
a pour l’ajustement du pH
Comme avec tous les mélanges pour nutrition parentérale, il convient de tenir compte des taux de calcium et de phosphate. Un ajout excessif de calcium et de phosphate, en particulier sous forme de sels minéraux, peut entraîner la formation de précipités de phosphate de calcium.
Comme pour les autres solutions pour perfusion contenant du calcium, un traitement concomitant par ceftriaxone et NUMETAH G16%E est contre-indiqué chez les nouveau-nés à terme et les nourrissons (âgés de moins de 28 jours), même si des lignes de perfusion séparées sont utilisées (risque de décès dû à la précipitation de sel calcique de ceftriaxone dans la circulation sanguine du nouveau-né) (voir rubrique 4.5).
Chez les patients de tout âge (y compris les adultes), la ceftriaxone ne doit pas être mélangée ou co- administrée avec des solutions intraveineuses contenant du calcium, comme NUMETAH G16%E même via des lignes de perfusion différentes ou à des sites de perfusion différents en raison du risque de précipitation de sels de calcium- ceftriaxone (voir rubrique 4.4).
En raison du risque de précipitation, NUMETAH G16%E ne doit pas être administré par la même ligne de perfusion avec l’ampicilline, la fosphénytoïne ou le furosémide.
NUMETAH G16%E ne doit pas être administré simultanément avec du sang par la même tubulure de perfusion, voir rubrique 4.5.
NUMETAH G16%E contient des ions calcium qui entraînent un risque supplémentaire de coagulation avec formation de précipité dans le sang ou des éléments anticoagulés/préservés au citrate.
Lorsqu’elle est utilisée chez les nouveau-nés et les enfants de moins de 2 ans, la solution (en poches et kits d’administration) doit être protégée de l’exposition à la lumière jusqu’à la fin de l’administration (voir les rubriques 4.2, 4.4 et 6.6).
Durée de conservation après reconstitution
Il est recommandé d'utiliser le produit immédiatement après ouverture des soudures non permanentes situées entre les deux ou trois compartiments. Toutefois, une fois reconstituée, la stabilité du mélange a été démontrée pendant 7 jours entre 2 °C et 8 °C, suivis de 48 heures à 30 °C.
Durée de conservation après supplémentation (électrolytes, oligoéléments, vitamines, eau) :
Pour des mélanges spécifiques, la stabilité en cours d’utilisation de NUMETAH a été démontrée pendant 7 jours, entre 2 °C et 8 °C, suivis de 48 heures à 30 °C.
Toutefois, du point de vue microbiologique, le produit après mélange doit être utilisé immédiatement. En cas d’utilisation non immédiate, les durées et conditions de conservation, après mélange et avant utilisation, relèvent de la seule responsabilité de l’utilisateur et ne devraient pas dépasser 24 heures à une température comprise entre 2°C et 8°C, sauf si la reconstitution/la dilution/la supplémentation a été réalisée dans des conditions d’asepsie dûment contrôlées et validées.
Voir la rubrique 4.2 «Posologie et mode d'administration» et la rubrique 6.6 «Précautions particulières d'élimination et de manipulation».
6.4. Précautions particulières de conservation
A conserver dans le suremballage.
6.5. Nature et contenu de l'emballage extérieur
La poche à trois compartiments sans PVC comporte les composants suivants :
· Une feuille en plastique multicouche.
· Un embout sur le compartiment contenant l'émulsion lipidique. Il est scellé après le remplissage pour empêcher tout ajout dans ce compartiment.
· Deux embouts sur les compartiments de solution d'acides aminés et de solution de glucose.
o Un embout de supplémentation qui ferme la sortie du compartiment de glucose.
o Un embout d'administration qui ferme la sortie du compartiment d'acides aminés.
Tous les composants sont sans latex naturel.
Pour empêcher tout contact avec l'air, la poche est conditionnée dans un suremballage étanche à l’oxygène qui contient un sachet absorbeur d'oxygène et un indicateur d'oxygène.
Présentations disponibles :
Poches de 500 mL : 6 unités par carton
1 poche de 500 mL.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
A usage unique.
Ne pas utiliser de poches endommagées.
Vérifier l'intégrité de la poche et des soudures non permanentes. Utiliser uniquement si les solutions d'acides aminés et de glucose sont limpides, incolores ou jaune pâle et exemptes de particules et si l'émulsion lipidique est homogène d'aspect laiteux.
L’utilisation d’un filtre de 1,2 micron est recommandé pour l’administration de NUMETAH G16%E.
Avant d'ouvrir le suremballage, contrôler la couleur de l'indicateur d'oxygène.
· Le comparer à la couleur de référence imprimée à côté du symbole OK et illustrée dans la zone imprimée de l'étiquette de l'indicateur.
· Ne pas utiliser le produit si la couleur de l'indicateur d'oxygène ne correspond pas à la couleur de référence imprimée à côté du symbole OK.
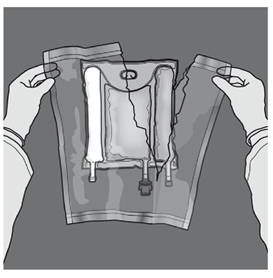
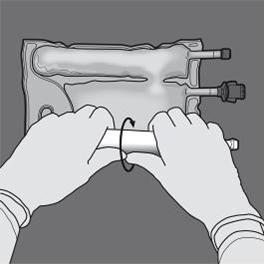
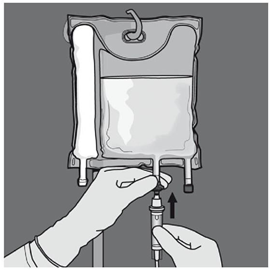
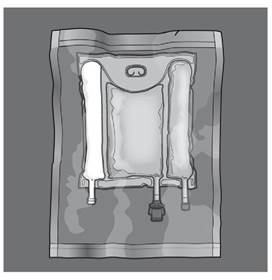
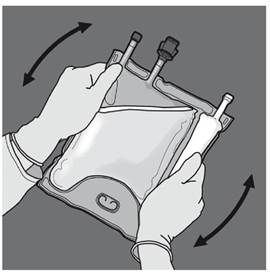
Les figures 1 et 2 illustrent comment retirer le suremballage de protection. Jeter le suremballage, l’indicateur d'oxygène et l’absorbeur d'oxygène.
|
Figure 1 Figure 2 |
|
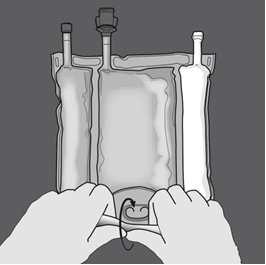
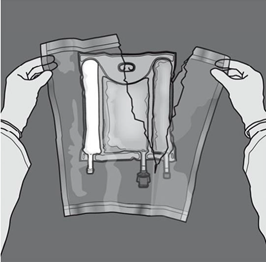
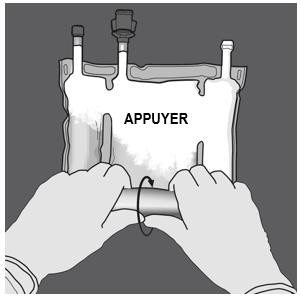
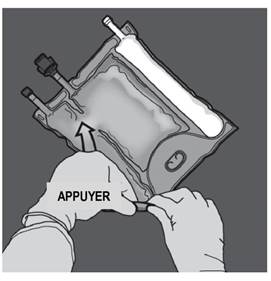
Préparation de l’émulsion mélangée. · S’assurer que le produit est à température ambiante avant de rompre les soudures non permanentes. · Placer la poche sur une surface plane et propre. Ouverture des 3 CP (ouverture des deux soudures non permanentes) Etape 1 : Enrouler la poche depuis le côté comportant l'œillet. |
|
|
|
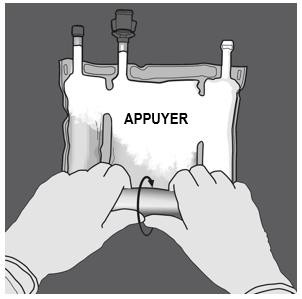
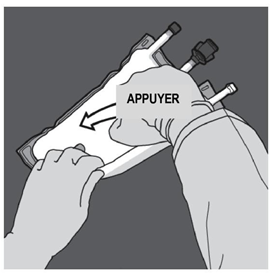
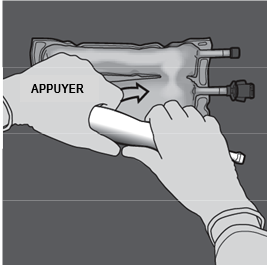
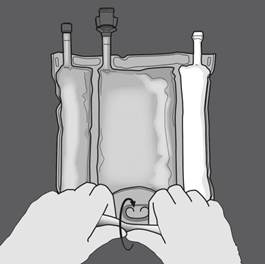
Etape 2 : Exercer une pression jusqu’à ce que les soudures s’ouvrent. |
|
|
|
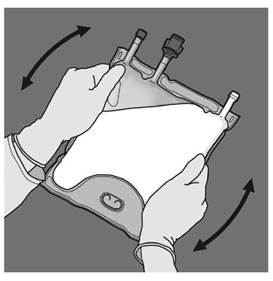
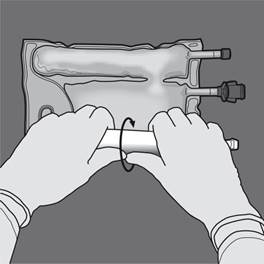
Etape 3 : Changer de direction en roulant la poche vers l’œillet. Continuer jusqu’à ce que les soudures soient complètement ouvertes. Procéder de la même manière pour finir l’ouverture de la seconde soudure. |
|
|
|
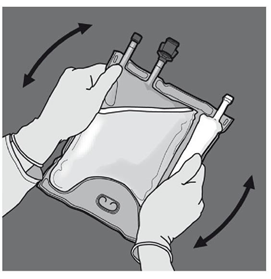
Etape 4 : Retourner la poche au moins trois fois pour bien mélanger son contenu. Le mélange doit avoir l'aspect d'une émulsion d'un blanc laiteux. |
|
|
|
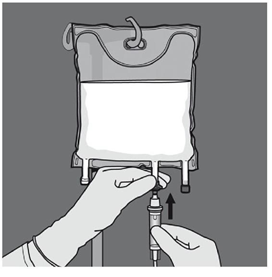
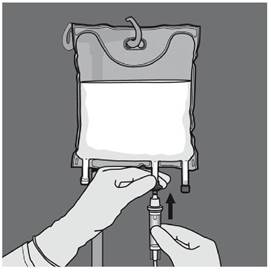
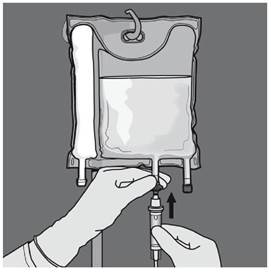
Etape 5 : Retirer le protecteur du site d’administration et insérer le dispositif d'administration intraveineux. |
|
|
|
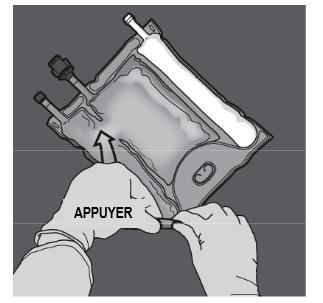
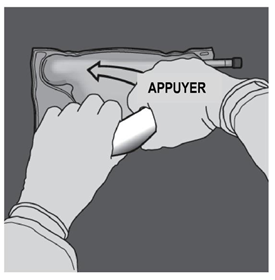
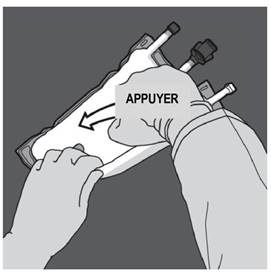
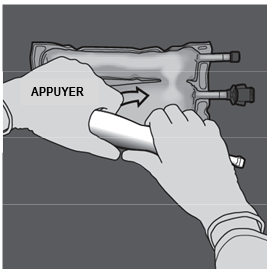
Ouverture des 2 CP (ouverture de la soudure non permanente entre les compartiments d'acides aminés et de glucose) Etape 1 : Pour n'ouvrir que la soudure pelable séparant les compartiments d'acides aminés et de glucose, enrouler la poche depuis le coin de la soudure séparant les compartiments d'acides aminés et de glucose comportant l'œillet et exercer une pression pour ouvrir cette soudure. |
|
|
|
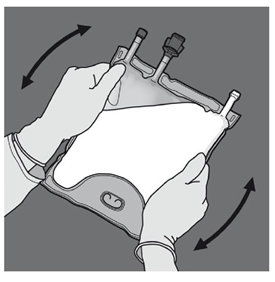
Etape 2 : Placer la poche de manière à ce que le compartiment de l'émulsion lipidique se trouve du côté de l'opérateur et l’enrouler tout en protégeant le compartiment de l'émulsion lipidique à l'aide des paumes des mains. |
|
|
|
Etape 3 : D'une main, exercer une pression en enroulant la poche vers les embouts. |
|
|
|
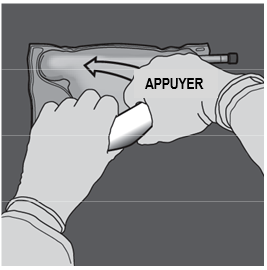
Etape 4 : Changer ensuite de direction en enroulant la poche vers l'œillet, tout en appuyant de l'autre main, jusqu'à ce que la soudure séparant les solutions d'acides aminés et de glucose soit entièrement ouverte. |
|
|
|
Etape 5 : Retourner la poche au moins trois fois pour bien mélanger son contenu. La solution mélangée doit être limpide, incolore ou jaune pâle. |
|
|
|
Etape 6 : Retirer le protecteur du site d’administration et insérer le dispositif d'administration intraveineux. |
|
|
Supplémentations :
En utilisation chez les nouveau-nés et les enfants de moins de 2 ans, protéger ce médicament de l’exposition à la lumière jusqu’à la fin de l’administration. L’exposition de NUMETAH G16%E à la lumière ambiante, notamment après l'ajout d’un mélange d’oligo-éléments et/ou de vitamines, produit des peroxydes et d’autres produits de dégradation qui peuvent être réduits en protégeant le médicament de l’exposition à la lumière (voir les rubriques 4.2, 4.4 et 6.3).
Les mélanges contenant des oligo-éléments et des vitamines, doivent être protégés de la lumière, à partir du moment du mélange jusqu’à leur administration. L'exposition à la lumière ambiante génère des peroxydes et d'autres produits de dégradation qui peuvent être réduits par photoprotection (voir rubrique 4.4).
Des additifs compatibles peuvent être ajoutés, via le site de perfusion dans le mélange reconstitué (après ouverture des soudures non permanentes et mélange du contenu des deux ou trois compartiments).
Des vitamines peuvent également être ajoutées au compartiment de glucose avant reconstitution du mélange (avant ouverture des soudures non permanentes et avant mélange des solutions et de l’émulsion).
Des supplémentations possibles de solutions d’oligo-éléments disponibles dans le commerce (identifiées par OE1, OE2 et OE4), de vitamines (identifiées par lyophilisat V1 et émulsion V2) et d'électrolytes en quantités définies sont présentées dans les tableaux 1-6.
1. Compatibilité avec OE4, V1 et V2
Tableau 1 : Compatibilité du mélange 3 en 1 (3 CP ouverts) avec et sans dilution avec de l’eau :
|
Pour 500 mL (mélange 3 en 1 avec des lipides) |
||||||
|
|
Mélange sans dilution |
Mélange avec dilution |
||||
|
Additifs |
Taux inclus |
Autre supplémentation maximale |
Taux total maximal |
Taux inclus |
Autre supplémentation maximale |
Taux total maximal |
|
Sodium (mmol) |
12,0 |
25,6 |
37,6 |
12,0 |
25,6 |
37,6 |
|
Potassium (mmol) |
11,4 |
26,2 |
37,6 |
11,4 |
26,2 |
37,6 |
|
Magnésium (mmol) |
1,6 |
3,6 |
5,2 |
1,6 |
3,6 |
5,2 |
|
Calcium (mmol) |
3,1 |
16,4 |
19,5 |
3,1 |
8,2 |
11,3 |
|
Phosphate* (mmol) |
4,4 |
6,9 |
11,3 |
4,4 |
6,9 |
11,3 |
|
Oligo-éléments et vitamines |
- |
10 mL OE4 + 1 flacon V1 + 30 mL V2 |
10 mL OE4 + 1 flacon V1 + 30 mL V2 |
- |
5 mL OE4 + ½ flacon V1+ 5 mL V2 |
5 mL OE4 + ½ flacon V1+ 5 mL V2 |
|
Eau pour préparations injectables |
- |
- |
- |
- |
350 mL |
350 mL |
* Phosphate organique
Tableau 2 : Compatibilité du mélange 2 en 1 (2 CP ouverts) avec et sans dilution avec de l’eau
|
Pour 376 mL (mélange 2 en 1 sans lipides) |
||||||
|
|
Mélange sans dilution |
Mélange avec dilution |
||||
|
Additifs |
Taux inclus |
Autre supplémentation maximale |
Taux total maximal |
Taux inclus |
Autre supplémentation maximale |
Taux total maximal |
|
Sodium (mmol) |
11,6 |
26,0 |
37,6 |
11,6 |
0,0 |
11,6 |
|
Potassium (mmol) |
11,4 |
26,2 |
37,6 |
11,4 |
0,0 |
11,4 |
|
Magnésium (mmol) |
1,6 |
3,6 |
5,2 |
1,6 |
0,0 |
1,6 |
|
Calcium (mmol) |
3,1 |
8,2 |
11,3 |
3,1 |
0,0 |
3,1 |
|
Phosphate* (mmol) |
3,2 |
8,1 |
11,3 |
3,2 |
0,0 |
3,2 |
|
Oligo-éléments et vitamines |
- |
5 mL OE4 + ½ flacon V1 |
5 mL OE4 + ½ flacon V1 |
- |
5 mL OE4 + ½ flacon V1 |
5 mL OE4 + ½ flacon V1 |
|
Eau pour préparations injectables |
- |
- |
- |
- |
450 mL |
450 mL |
* Phosphate organique
2. Compatibilité avec OE1, V1 et V2
Tableau 3 : Compatibilité du mélange 3 en 1 (3 CP ouverts) avec et sans dilution avec de l’eau
|
Pour 500 mL (mélange 3 en 1 avec des lipides) |
||||||
|
|
Mélange sans dilution |
Mélange avec dilution |
||||
|
Additifs |
Taux inclus |
Autre supplémentation maximale |
Taux total maximal |
Taux inclus |
Autre supplémentation maximale |
Taux total maximal |
|
Sodium (mmol) |
12,0 |
4,0 |
16,0 |
12,0 |
0,0 |
12,0 |
|
Potassium (mmol) |
11,4 |
6,2 |
17,6 |
11,4 |
0,0 |
11,4 |
|
Magnésium (mmol) |
1,6 |
0 |
1,6 |
1,6 |
0,0 |
1,6 |
|
Calcium (mmol) |
3,1 |
2,1 |
5,2 |
3,1 |
0,0 |
3,1 |
|
Phosphate* (mmol) |
4,4 |
2,0 |
6,4 |
4,4 |
0,0 |
4,4 |
|
Oligo-éléments et vitamines |
- |
5 mL OE1 + |
5 mL OE1 + ½ flacon V1 + 5 mL V2 |
- |
5 mL OE1 + |
5 mL OE1 + ½ flacon V1 + 5 mL V2 |
|
Eau pour préparations injectables |
- |
- |
- |
- |
350 mL |
350 mL |
* Phosphate organique
Tableau 4 : Compatibilité du mélange 2 en 1 (2 CP ouverts) avec et sans dilution avec de l’eau
|
Pour 376 mL (mélange 2 en 1 sans lipides) |
||||||
|
|
Mélange sans dilution |
Mélange avec dilution |
||||
|
Additifs |
Taux inclus |
Autre supplémentation maximale |
Taux total maximal |
Taux inclus |
Autre supplémentation maximale |
Taux total maximal |
|
Sodium (mmol) |
11,6 |
26,0 |
37,6 |
11,6 |
0,0 |
11,6 |
|
Potassium (mmol) |
11,4 |
26,2 |
37,6 |
11,4 |
0,0 |
11,4 |
|
Magnésium (mmol) |
1,6 |
3,6 |
5,2 |
1,6 |
0,0 |
1,6 |
|
Calcium (mmol) |
3,1 |
8,2 |
11,3 |
3,1 |
0,0 |
3,1 |
|
Phosphate* (mmol) |
3,2 |
8,1 |
11,3 |
3,2 |
0,0 |
3,2 |
|
Oligo-éléments et vitamines |
- |
5 mL OE1 |
5 mL OE1 |
- |
5 mL OE1 |
5 mL OE1 |
|
Eau pour préparations injectables |
- |
- |
- |
- |
450 mL |
450 mL |
* Phosphate organique
3. Compatibilité avec OE2, V1 et V2
Tableau 5 : Compatibilité du mélange 3 en 1 (3CP ouverts) avec et sans dilution avec de l’eau
|
Pour 500 mL (mélange 3 en 1 avec des lipides) |
||||||
|
|
Mélange sans dilution |
Mélange avec dilution |
||||
|
Additifs |
Taux inclus |
Autre supplémentation maximale |
Taux total maximal |
Taux inclus |
Autre supplémentation maximale |
Taux total maximal |
|
Sodium (mmol) |
12,0 |
4,0 |
16,0 |
12,0 |
0,0 |
12,0 |
|
Potassium (mmol) |
11,4 |
6,2 |
17,6 |
11,4 |
0,0 |
11,4 |
|
Magnésium (mmol) |
1,6 |
0 |
1,6 |
1,6 |
0,0 |
1,6 |
|
Calcium (mmol) |
3,1 |
2,1 |
5,2 |
3,1 |
0,0 |
3,1 |
|
Phosphate* (mmol) |
4,4 |
2,0 |
6,4 |
4,4 |
0,0 |
4,4 |
|
Oligo-éléments et vitamines |
- |
5 mL OE2 + |
5 mL OE2 + ½ flacon V1 + 5 mL V2 |
- |
5 mL OE2 + |
5 mL OE2 + ½ flacon V1 + 5 mL V2 |
|
Eau pour préparations injectables |
- |
- |
- |
- |
350 mL |
350 mL |
* Phosphate organique
Tableau 6 : Compatibilité du mélange 2 en 1 (2 CP ouverts) avec et sans dilution avec de l’eau
|
Pour 376 mL (mélange 2 en 1 sans lipides) |
||||||
|
|
Mélange sans dilution |
Mélange avec dilution |
||||
|
Additifs |
Niveau inclus |
Autre supplémentation maximale |
Niveau total maximal |
Niveau inclus |
Autre supplémentation maximale |
Niveau total maximal |
|
Sodium (mmol) |
11,6 |
26,0 |
37,6 |
11,6 |
0,0 |
11,6 |
|
Potassium (mmol) |
11,4 |
26,2 |
37,6 |
11,4 |
0,0 |
11,4 |
|
Magnésium (mmol) |
1,6 |
3,6 |
5,2 |
1,6 |
0,0 |
1,6 |
|
Calcium (mmol) |
3,1 |
8,2 |
11,3 |
3,1 |
0,0 |
3,1 |
|
Phosphate* (mmol) |
3,2 |
8,1 |
11,3 |
3,2 |
0,0 |
3,2 |
|
Oligo-éléments et vitamines |
- |
5 mL OE2 |
5 mL OE2 |
- |
5 mL OE2 |
5 mL OE2 |
|
Eau pour préparations injectables |
- |
- |
- |
- |
450 mL |
450 mL |
* Phosphate organique
La composition des vitamines et les préparations d’oligo-éléments sont illustrées dans les tableaux 7 et 8.
Tableau 7 : Composition de la préparation commerciale d'oligo-éléments utilisée
|
Composition pour 10 mL |
OE1 |
OE2 |
OE4 |
|
Fer |
- |
8,9 µmol ou 0,5 mg |
- |
|
Zinc |
38,2 µmol ou 2,5 mg |
15,3 µmol ou 1 mg |
15,3 µmol ou 1 mg |
|
Sélénium |
0,253 µmol ou 0,02 mg |
0,6 µmol ou 0,05 mg |
0,253 µmol ou 0,02 mg |
|
Cuivre |
3,15 µmol ou 0,2 mg |
4,7 µmol ou 0,3 mg |
3,15 µmol ou 0,2 mg |
|
Iode |
0,0788 µmol ou 0,01 mg |
0,4 µmol ou 0,05 mg |
0,079 µmol ou 0,01 mg |
|
Fluor |
30 µmol ou 0,57 mg |
26,3 µmol ou 0,5 mg |
- |
|
Molybdène |
- |
0,5 µmol ou 0,05 mg |
- |
|
Manganèse |
0,182 µmol ou 0,01 mg |
1,8 µmol ou 0,1 mg |
0,091 µmol ou 0,005 mg |
|
Cobalt |
- |
2,5 µmol ou 0,15 mg |
- |
|
Chrome |
- |
0,4 µmol ou 0,02 mg |
- |
Tableau 8 : Composition de la préparation commerciale de vitamines utilisée
|
Composition par flacon |
V1 |
V2 |
|
Vitamine B1 |
2,5 mg |
- |
|
Vitamine B2 |
3,6 mg |
- |
|
Nicotinamide |
40 mg |
- |
|
Vitamine B6 |
4,0 mg |
- |
|
Acide pantothénique |
15,0 mg |
- |
|
Biotine |
60 µg |
- |
|
Acide folique |
400 µg |
- |
|
Vitamine B12 |
5,0 µg |
- |
|
Vitamine C |
100 mg |
- |
|
Vitamine A |
- |
2 300 UI |
|
Vitamine D |
- |
400 UI |
|
Vitamine E |
- |
7 UI |
|
Vitamine K |
- |
200 µg |
Pour effectuer un ajout :
· Respecter des conditions d’asepsie.
· Préparer le site de supplémentation de la poche.
· Perforer le site de supplémentation et injecter les additifs à la seringue ou avec un dispositif de reconstitution.
· Mélanger le contenu de la poche et les additifs.
Préparation de la perfusion :
· Respecter des conditions d’asepsie.
· Suspendre la poche.
· Retirer le protecteur en plastique de l’embout d’administration.
· Insérer fermement le perforateur du dispositif de perfusion dans l’embout d’administration.
Administration de la perfusion :
· Le produit ne doit être administré qu'après ouverture des soudures non permanentes entre les deux ou trois compartiments et mélange du contenu de ces compartiments.
· Vérifier que l'émulsion pour perfusion finale avec 3 CP ouverts ne présente aucune séparation de phase ou que la solution pour perfusion finale avec 2 CP ouverts ne présente aucune trace de particules.
· Il est recommandé d’utiliser immédiatement le produit après l’ouverture des soudures non permanente. Ne pas conserver NUMETAH G16%E pour une perfusion ultérieure.
· Ne pas connecter de poches partiellement utilisées.
· Ne pas connecter les poches en série afin d’éviter tout risque d'embolie gazeuse due à l'air résiduel éventuellement contenu dans la première poche.
· Détruire de manière appropriée le produit restant, les déchets et les consommables inutilisés.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
IMMEUBLE BERLIOZ
4 BIS RUE DE LA REDOUTE
78280 GUYANCOURT
FRANCE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[A compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[A compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
Médicament soumis à prescription médicale.
ANSM - Mis à jour le : 14/05/2024
NUMETAH G16%E, émulsion pour perfusion
NUMETAH se présente sous forme d’une poche à 3 compartiments séparés :
· une solution de glucose à 50 %
· une solution pédiatrique d’acides aminés à 5,9 % contenant des électrolytes
· une émulsion lipidique (corps gras) à 12,5 %
Selon les besoins de votre enfant, deux ou trois de ces solutions sont mélangées dans la poche avant d’être administrées à votre enfant.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que NUMETAH G16%E, émulsion pour perfusion et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser NUMETAH G16%E, émulsion pour perfusion ?
3. Comment utiliser NUMETAH G16%E, émulsion pour perfusion ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver NUMETAH G16%E, émulsion pour perfusion ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE NUMETAH G16%E, émulsion pour perfusion ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : solutions pour nutrition parentérale/mélanges - code ATC : B05 BA10
NUMETAH G16%E doit être utilisé exclusivement sous surveillance médicale.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER NUMETAH G16%E, émulsion pour perfusion ?
N’utilisez jamais NUMETAH G16%E, émulsion pour perfusion :
En ce qui concerne les 2 solutions mélangées dans la poche (« 2 » en « 1 »)
· Si votre enfant est allergique aux protéines d’œuf, au soja, à l’arachide ou à l’un des composants des compartiments de la solution de glucose ou des acides aminés (mentionnés dans la rubrique 6).
· Si l’organisme de votre enfant a des problèmes pour utiliser les unités constituants les protéines.
· Si votre enfant présente des concentrations sanguines élevées de l’un des électrolytes présents dans NUMETAH G16%E.
· Si votre enfant est un nouveau-né (âgé de moins de 28 jours), NUMETAH (comme tout autre solution contenant du calcium) ne doit pas lui être administré en même temps que la ceftriaxone (un antibiotique), même si des lignes de perfusion séparées sont utilisées. Il existe un risque de formation de particules dans la circulation sanguine du nouveau-né qui peut être fatal.
· Si votre enfant souffre d'hyperglycémie (taux particulièrement élevé de sucre dans son sang).
En ce qui concerne les 3 solutions mélangées dans la poche (« 3 » en « 1 »)
Dans toutes les situations mentionnées ci-dessus concernant la poche « 2 » en « 1 », et dans le cas suivant :
· Si le sang de votre enfant contient un taux particulièrement élevé de graisse.
Dans tous les cas, votre médecin décidera de prescrire ce médicament à votre enfant en tenant compte de critères tels que l'âge, le poids et l'état clinique. Votre médecin prendra également en considération les résultats des examens pratiqués.
Avertissements et précautions
Adressez-vous au médecin ou à l’infirmier/ère de votre enfant avant d’utiliser NUMETAH G16%E, émulsion pour perfusion.
Lorsqu’elle est utilisée chez les nouveau-nés et les enfants de moins de 2 ans, la solution (en poches et kits d’administration) doit être protégée de l’exposition à la lumière jusqu’à la fin de l’administration. L’exposition de NUMETAH G16% E à la lumière ambiante, notamment après l'ajout d’un mélange d’oligo-éléments et/ou de vitamines, produit des peroxydes et d’autres produits de dégradation qui peuvent être réduits en protégeant le médicament de l’exposition à la lumière.
Réactions allergiques
La perfusion doit être immédiatement arrêtée si des signes ou des symptômes d'une réaction allergique (tels que fièvre, sueurs, frissons, maux de tête, éruption cutanée ou difficulté à respirer) se manifestent. Ce médicament contient de l'huile de soja, qui peut provoquer de rares réactions d'hypersensibilité.
Peu fréquemment, une allergie aux protéines de soja est aussi observée chez certaines personnes allergiques aux protéines d'arachide.
NUMETAH G16%E contient du glucose dérivé du maïs. En conséquence, NUMETAH G16%E doit être utilisé avec précaution chez les patients allergiques au maïs ou aux produits à base de maïs.
Risque de formation de particules avec la ceftriaxone (antibiotique) :
L’antibiotique appelé ceftriaxone ne doit pas être mélangé ou administré simultanément avec des solutions contenant du calcium (comme NUMETAH G16% E) qui sont administrées à votre enfant par un tube dans une veine.
Votre médecin le sait et ne les donnera pas conjointement à votre enfant, même en utilisant des lignes de perfusions ou des sites de perfusion différents.
Cependant, votre médecin peut donner à votre enfant du calcium et de la ceftriaxone de façon séquentielle, l’un après l’autre, si des lignes de perfusion sont utilisées sur des sites différents, ou si les lignes de perfusion sont changées ou ont été rincées avec une solution de sérum physiologique entre les perfusions afin d’éviter toute précipitation.
Formation de petites particules dans les vaisseaux sanguins pulmonaires :
Des difficultés à respirer peuvent aussi être le signe que de petites particules se sont formées, bloquant les vaisseaux sanguins pulmonaires (précipités vasculaires pulmonaires). Si votre enfant présente des difficultés à respirer, informez-en le médecin de votre enfant ou son infirmier/ère. Ils décideront des actions à entendre.
Infection et septicémie
Votre médecin surveillera attentivement votre enfant afin de détecter tout signe d'infection. L'utilisation d'une « technique aseptique » (technique stérile) lors de la mise en place et de l’entretien du cathéter, ainsi que lors de la préparation de la formule nutritionnelle, peut réduire le risque d'infection.
De manière occasionnelle, il est possible que les enfants développent une infection et une septicémie (présence de bactéries dans le sang) lorsqu’une tubulure est reliée à leur veine (cathéter intraveineux). Certains médicaments et certaines maladies peuvent augmenter le risque d'infection ou de septicémie. Les patients qui ont besoin d'une nutrition parentérale (alimentation effectuée par une tubulure reliée à la veine de l'enfant) sont plus exposés aux infections en raison de leur situation médicale.
Syndrome de surcharge graisseuse
Un syndrome de surcharge graisseuse a été rapporté avec des produits similaires. Une capacité réduite ou limitée à éliminer les lipides contenus dans NUMETAH G16%E, ou un surdosage peuvent entraîner un « syndrome de surcharge graisseuse » (voir rubrique 3 et 4).
Modifications des analyses sanguines
Votre médecin contrôlera et surveillera le bilan liquidien, les analyses sanguines et d’autres paramètres sanguins de votre enfant, puisqu’il arrive que, de manière occasionnelle, la réalimentation d'une personne sévèrement dénutrie entraîne des modifications des concentrations de certains paramètres sanguins.
Les tissus peuvent se gorger de liquide et un gonflement peut apparaître. Il est recommandé de commencer la nutrition parentérale lentement et avec prudence.
Taux élevé de magnésium dans le sang
Le magnésium présent dans NUMETAH G16%E peut augmenter le taux de magnésium dans le sang. Cette augmentation peut provoquer une faiblesse, des réflexes ralentis, des nausées, des vomissements, un faible taux de calcium dans le sang, des difficultés respiratoires, une hypotension et une fréquence cardiaque irrégulière. Ces signes pouvant passer inaperçus, les concentrations sanguines de votre enfant peuvent être contrôlées par son médecin, en particulier si votre enfant présente un risque d'élévation du taux de magnésium dans le sang, notamment s'il souffre de troubles de la fonction rénale. Si le taux de magnésium dans le sang est élevé, la perfusion sera ralentie ou arrêtée.
Surveillance et ajustement
Votre médecin surveillera attentivement votre enfant et ajustera la quantité de NUMETAH G16%E en fonction des besoins spécifiques de votre enfant s'il est atteint des maladies suivantes :
· États post-traumatiques sévères
· Diabète sucré sévère
· Choc
· Crise cardiaque
· Infection sévère
· Certains types de coma
Utiliser avec précaution
NUMETAH doit être utilisé avec précaution si votre enfant présente :
· Un œdème pulmonaire (liquide dans les poumons) ou une insuffisance cardiaque
· Un problème grave du foie
· Des problèmes pour utiliser les nutriments
· Un taux élevé de sucre dans le sang
· Des problèmes aux reins
· Des troubles métaboliques graves (lorsque l’organisme ne peut pas assimiler les substances de manière normale)
· Des problèmes de coagulation du sang
Le bilan liquidien, les résultats des analyses hépatiques (foie) et/ou sanguines de votre enfant seront étroitement contrôlés.
Enfants et adolescents
Sans objet.
Autres médicaments et NUMETAH G16%E, émulsion pour perfusion
Informez votre médecin si votre enfant prend ou utilise, a récemment pris ou utilisé ou pourrait prendre ou utiliser tout autre médicament.
NUMETAH ne doit pas être administré simultanément avec :
· de la ceftriaxone (un antibiotique), même dans une ligne de perfusion séparée, en raison du risque de formation de particules.
· du sang en utilisant la même tubulure de perfusion au risque d’entrainer une pseudo-agglutination (formation d'un amas de globules rouges).
· de l’ampicilline, de la fosphénytoine, du furosémide, à travers la même ligne de perfusion en raison du risque de formation de particules.
Coumarine et warfarine (Anticoagulants)
Votre médecin devra surveiller votre enfant avec attention s’il prend de la coumarine ou de la warfarine.
L'huile d'olive et l'huile de soja contiennent naturellement de la vitamine K1. La vitamine K1 peut interférer avec des médicaments tels que la coumarine et la warfarine. Ces médicaments sont des anticoagulants utilisés pour empêcher la coagulation du sang.
Tests de laboratoire
Les lipides contenus dans cette émulsion peuvent fausser les résultats de certains examens de laboratoire. Ces examens peuvent être effectués après une période de 5 à 6 heures sans apport de lipides.
Interactions entre NUMETAH G16%E et des médicaments pouvant affecter le taux/métabolisme du potassium
NUMETAH contient du potassium. Des taux élevés de potassium sanguin peuvent entraîner un rythme cardiaque anormal. Il convient d'être particulièrement prudent avec les patients sous diurétiques (médicaments augmentant la quantité de liquide excrétée par le corps) ou inhibiteurs de l'enzyme de conversion (médicaments pour l'hypertension) ou antagonistes des récepteurs de l'angiotensine II (médicaments pour l’hypertension) ou immunosuppresseurs (médicaments diminuant les réactions de défense de l'organisme). Ces types de médicaments peuvent augmenter le taux de potassium.
NUMETAH G16%E, émulsion pour perfusion avec des aliments, boissons et de l’alcool
Sans objet.
Grossesse, allaitement et fertilité
Sans objet.
Conduite de véhicules et utilisation de machines
Sans objet.
NUMETAH G16%E, émulsion pour perfusion contient
Sans objet.
3. COMMENT UTILISER NUMETAH G16%E, émulsion pour perfusion ?
Groupes d’âge
NUMETAH G16%E a été conçu pour couvrir les besoins nutritionnels des nouveau-nés à terme et des enfants jusqu’à 2 ans.
Votre médecin décidera si ce médicament est adapté à votre enfant.
Administration
Ce médicament est administré via une tubulure en plastique reliée à une veine du bras de votre enfant ou à une grosse veine de sa poitrine.
Le médecin de votre enfant peut décider de ne pas lui administrer de lipides. La conception de la poche NUMETAH G16%E permet, si besoin, de ne rompre que la soudure pelable entre le compartiment d’acides aminés/électrolytes et de glucose. Dans ce cas, la soudure pelable entre le compartiment d’acides aminés et de lipides reste intacte. Le contenu de la poche peut également être perfusé sans les lipides.
Lorsqu’elle est utilisée chez les nouveau-nés et les enfants de moins de 2 ans, la solution (en poches et kits d’administration) doit être protégée de l’exposition à la lumière jusqu’à la fin de l’administration (voir la rubrique 2).
Posologie et durée du traitement
Le médecin de votre enfant décidera de la dose et de la durée du traitement. La dose dépend des besoins nutritionnels de votre enfant. La dose sera déterminée en se basant sur le poids de l’enfant, son état médical, et sur la capacité de son corps à dégrader et à utiliser les ingrédients contenus dans NUMETAH G16%E. Des apports nutritionnels ou protéiques supplémentaires pourront également être envisagés par voie orale/entérale.
Si vous avez utilisé plus de NUMETAH G16%E, émulsion pour perfusion que vous n’auriez dû
Symptômes
Un surdosage ou un débit de perfusion plus important que celui recommandé peut entraîner ce qui suit :
· Nausées (envie de vomir)
· Vomissements
· Frissons
· Troubles électrolytiques (quantités inadéquates d'électrolytes dans le sang)
· Signes d'hypervolémie (augmentation du volume de sang circulant)
· Acidose (acidité accrue du sang)
Dans de telles situations, la perfusion doit être immédiatement arrêtée. Le médecin de votre enfant déterminera si d'autres actions sont nécessaires.
Un surdosage en graisses contenues dans NUMETAH G16%E peut entraîner un « syndrome de surcharge graisseuse », qui est généralement réversible après l’arrêt de la perfusion. Chez les nouveau-nés et les jeunes enfants (nourrissons), le syndrome de surcharge graisseuse a été associé à des troubles respiratoires entraînant une diminution de l'oxygène dans le corps (détresse respiratoire) et à des conditions entraînant une augmentation de l'acidité du sang (acidose).
Pour éviter que ces situations ne surviennent, le médecin surveillera régulièrement l'état de votre enfant et contrôlera ses paramètres sanguins au cours du traitement.
Si vous oubliez d’utiliser NUMETAH G16%E, émulsion pour perfusion
Si vous arrêtez d’utiliser NUMETAH G16%E, émulsion pour perfusion
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Si vous constatez des modifications de l'état de votre enfant pendant ou après le traitement, informez-en immédiatement votre médecin ou votre infirmier/ère.
Les examens que votre médecin effectue pendant le traitement devraient réduire le risque de survenue des effets indésirables.
Si des signes d’une réaction allergique surviennent, la perfusion doit être arrêtée et vous devez contacter immédiatement votre médecin. Cela peut être grave et les signes peuvent se manifester par:
· des sueurs
· des frissons
· des maux de tête
· une éruption cutanée
· des difficultés à respirer
D'autres effets indésirables ont été rapportés :
Fréquent : peut affecter jusqu’à 1 personne sur 10
· Faible taux de phosphate dans le sang (hypophosphatémie)
· Taux élevé de sucre dans le sang (hyperglycémie)
· Taux élevé de calcium dans le sang (hypercalcémie)
· Taux élevé de triglycérides dans le sang (hypertriglycéridémie)
· Trouble électrolytique (comme une hyponatrémie)
Peu fréquent : peut affecter jusqu’à 1 personne sur 100
· Taux élevé de lipides dans le sang (hyperlipidémie).
· Affection empêchant la bile de s'écouler du foie vers le duodénum (cholestase). Le duodénum fait partie des intestins.
Fréquence indéterminée : ne peut être estimée sur la base des données disponibles. (Ces effets indésirables n’ont été signalés que pour NUMETAH G13%E et G16%E lorsqu’ils ont été administrés par voie périphérique avec une dilution insuffisante).
· Nécrose cutanée
· Lésions des tissus mous
· Extravasation.
Les effets indésirables suivants ont été rapportés avec d’autres mélanges de nutrition parentérale :
Une capacité réduite ou limitée à éliminer les lipides contenus dans NUMETAH peut entraîner un « syndrome de surcharge graisseuse ». Les signes et symptômes suivants de ce syndrome sont généralement réversibles après l'arrêt de la perfusion de l’émulsion lipidique :
· Aggravation soudaine et brutale de l'état clinique du patient
· Taux élevés de graisses dans le sang (hyperlipidémie)
· Fièvre
· Infiltration de graisse dans le foie (hépatomégalie)
· Détérioration de la fonction hépatique
· Réduction du nombre de globules rouges, ce qui peut entraîner une pâleur de la peau et provoquer une faiblesse ou un essoufflement (anémie)
· Faible nombre de globules blancs, ce qui peut accroître le risque d'infection (leucopénie)
· Faible nombre de plaquettes, ce qui peut accroître le risque d'hématomes et/ou de saignement (thrombocytopénie)
· Troubles de coagulation du sang
· Trouble respiratoire entraînant une diminution de l'oxygène dans le corps (détresse respiratoire)
· Situations conduisant à une augmentation de l'acidité du sang (acidose)
· Coma, nécessitant une hospitalisation
Formation de petites particules pouvant entraîner un blocage des vaisseaux sanguins pulmonaires (précipités vasculaires pulmonaires) ou des difficultés à respirer.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou à votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance. Site internet: https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER NUMETAH G16%E, émulsion pour perfusion ?
Tenir ce médicament hors de la vue et de la portée des enfants lorsque le médicament n'est pas administré.
Lorsqu’elle est utilisée chez les nouveau-nés et les enfants de moins de 2 ans, la solution (en poches et kits d’administration) doit être protégée de l’exposition à la lumière jusqu’à la fin de l’administration (voir la rubrique 2).
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette après EXP. La date de péremption fait référence au dernier jour de ce mois.
Ne pas congeler.
A conserver dans le suremballage.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient NUMETAH G16%E, émulsion pour perfusion
· Les substances actives sont :
|
Composition |
||
|
Substance active |
2 compartiments activés 376 mL |
3 compartiments activés 500 mL |
|
Compartiment des acides aminés |
||
|
Alanine |
1,03 g |
1,03 g |
|
Arginine |
1,08 g |
1,08 g |
|
Acide aspartique |
0,77 g |
0,77 g |
|
Cystéine |
0,24 g |
0,24 g |
|
Acide glutamique |
1,29 g |
1,29 g |
|
Glycine |
0,51 g |
0,51 g |
|
Histidine |
0,49 g |
0,49 g |
|
Isoleucine |
0,86 g |
0,86 g |
|
Leucine |
1,29 g |
1,29 g |
|
Lysine monohydratée équivalent à Lysine |
1,59 g 1,42 g |
1,59 g 1,42 g |
|
Méthionine |
0,31 g |
0,31 g |
|
Chlorhydrate d'ornithine équivalent à Ornithine |
0,41 g 0,32 g |
0,41 g 0,32 g |
|
Phénylalanine |
0,54 g |
0,54 g |
|
Proline |
0,39 g |
0,39 g |
|
Sérine |
0,51 g |
0,51 g |
|
Taurine |
0,08 g |
0,08 g |
|
Thréonine |
0,48 g |
0,48 g |
|
Tryptophane |
0,26 g |
0,26 g |
|
Tyrosine |
0,10 g |
0,10 g |
|
Valine |
0,98 g |
0,98 g |
|
Chlorure de sodium |
0,30 g |
0,30 g |
|
Acétate de potassium |
1,12 g |
1,12 g |
|
Chlorure de calcium, dihydraté |
0,46 g |
0,46 g |
|
Acétate de magnésium, tétrahydraté |
0,33 g |
0,33 g |
|
Glycérophosphate de sodium hydraté |
0,98 g |
0,98 g |
|
Compartiment de la solution de glucose |
||
|
Glucose monohydrate équivalent à glucose anhydre |
85,25 g 77,50 g |
85,25 g 77,50 g |
|
Compartiment de l’émulsion lipidique |
||
|
Huile d’olive raffinée (environ 80 %) + huile de soja raffinée (environ 20 %) |
- |
15,5 g |
Les apports de l’émulsion/la solution reconstituée sont les suivants :
|
Composition |
||||
|
|
2 CP ouverts |
3 CP ouverts |
||
|
Par unité de volume (ml) |
376 |
100 |
500 |
100 |
|
Azote (g) |
2,0 |
0,52 |
2,0 |
0,39 |
|
Acides aminés (g) |
13,0 |
3,5 |
13,0 |
2,6 |
|
Glucose (g) |
77,5 |
20,6 |
77,5 |
15,5 |
|
Lipides (g) |
0 |
0 |
15,5 |
3,1 |
|
Énergie |
|
|
|
|
|
Calories totales (kcal) |
362 |
96 |
517 |
103 |
|
Calories non protéiques (kcal) |
310 |
82 |
465 |
93 |
|
Calories glucidiques (kcal) |
310 |
82 |
310 |
62 |
|
Calories lipidiques (kcal)a |
0 |
0 |
155 |
31 |
|
Ratio calories non protéiques/azote (kcal/g N) |
158 |
158 |
237 |
237 |
|
Calories lipidiques (% de calories non protéiques) |
- |
- |
33 |
33 |
|
Calories lipidiques (% de calories totales) |
- |
- |
30 |
30 |
|
Électrolytes |
|
|
|
|
|
Sodium (mmol) |
11,6 |
3,1 |
12,0 |
2,4 |
|
Potassium (mmol) |
11,4 |
3,0 |
11,4 |
2,3 |
|
Magnésium (mmol) |
1,6 |
0,41 |
1,6 |
0,31 |
|
Calcium (mmol) |
3,1 |
0,82 |
3,1 |
0,62 |
|
Phosphateb (mmol) |
3,2 |
0,85 |
4,4 |
0,87 |
|
Acétate (mmol) |
14,5 |
3,9 |
14,5 |
2,9 |
|
Malate (mmol) |
4,3 |
1,1 |
4,3 |
0,86 |
|
Chlorure (mmol) |
13,8 |
3,7 |
13,8 |
2,8 |
|
pH (env.) |
5,5 |
5,5 |
5,5 |
5,5 |
|
Osmolarité env. (mOsm/l) |
1585 |
1585 |
1230 |
1230 |
a Incluant les calories des phospholipides d'œuf pour injection.
b Incluant les phosphates apportés par les phospholipides d'œuf pour injection de l'émulsion lipidique.
Les autres composants sont :
|
Acide L-malique (1) |
|
Acide chlorhydrique (1) |
|
Phospholipides d’œuf pour injection |
|
Glycérol |
|
Oléate de sodium |
|
Hydroxyde de sodium (1) |
|
Eau pour préparations injectables |
(1) pour ajustement du pH
Qu’est-ce que NUMETAH G16%E, émulsion pour perfusion et contenu de l’emballage extérieur
Aspect de NUMETAH G16%E et contenu de l’emballage extérieur
NUMETAH se présente sous la forme d'une poche à trois compartiments. Chaque poche contient un mélange stérile comportant une solution de glucose, une solution d’acides aminés pour les enfants, avec des électrolytes et une émulsion lipidique, comme décrit ci-dessous.
|
Volume de la poche |
Solution de glucose à 50 % |
Solution d’acides aminés à 5,9 % contenant des électrolytes |
Émulsion lipidique à 12,5 % |
|
500 mL |
155 mL |
221 mL |
124 mL |
Aspect avant reconstitution :
· Les solutions des compartiments d'acides aminés et de glucose sont limpides, incolores ou jaune pâle.
· L'émulsion lipidique est homogène et d’aspect blanc laiteux.
Aspect après reconstitution :
· La solution « 2 en 1 » pour perfusion est limpide, incolore ou jaune pâle.
· L'émulsion « 3 en 1 » pour perfusion est homogène et d’aspect blanc laiteux.
La poche à trois compartiments est une poche en plastique multicouche.
Pour empêcher tout contact avec l'air, la poche est conditionnée dans un suremballage étanche à l’oxygène qui contient un sachet absorbeur d'oxygène et éventuellement un indicateur d'oxygène.
Présentations
Poche de 500 mL : 6 unités par carton
1 poche de 500 mL.
Toutes les présentations peuvent ne pas être commercialisées
Titulaire de l’autorisation de mise sur le marché
IMMEUBLE BERLIOZ
4 BIS RUE DE LA REDOUTE
78280 GUYANCOURT
FRANCE
Exploitant de l’autorisation de mise sur le marché
IMMEUBLE BERLIOZ
4 BIS RUE DE LA REDOUTE
78280 GUYANCOURT
FRANCE
BOULEVARD RENE BRANQUART, 80
7860 LESSINES
BELGIQUE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
La dernière date à laquelle cette notice a été révisée est :
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé:
* Veuillez noter que, dans certains cas, ce produit peut être administré à domicile par les parents ou par le personnel soignant. Dans ce cas, les parents/ personnel soignant doivent lire les informations suivantes.
Aucun ajout dans la poche ne doit être entrepris sans en avoir vérifié préalablement la compatibilité. Il pourrait en résulter une formation de particules ou une déstabilisation de l’émulsion lipidique. Ce qui peut conduire à une obstruction des vaisseaux sanguins.
NUMETAH G16%E doit être porté à température ambiante avant utilisation
Avant d’utiliser NUMETAH G16%E, la poche doit être préparée comme décrit ci-dessous.
Vérifier que la poche n'est pas endommagée. Ne l’utiliser que si elle est intacte. Une poche intacte a l'apparence suivante :
· Les soudures non permanentes sont intactes. Cela est indiqué par l'absence de mélange entre les trois compartiments.
· Les solutions d'acides aminés et de glucose sont limpides, incolores ou jaune pâle, sans particule visible.
· L'émulsion lipidique doit avoir l'aspect d'une émulsion homogène d'un blanc laiteux.
Avant d'ouvrir le suremballage, contrôler la couleur de l'indicateur d'oxygène.
· Le comparer à la couleur de référence imprimée à côté du symbole OK et illustrée dans la zone imprimée de l'étiquette de l'indicateur.
· Ne pas utiliser le produit si la couleur de l'indicateur d'oxygène ne correspond pas à la couleur de référence imprimée à côté du symbole OK.
|
Les figures 1 et 2 illustrent comment retirer le suremballage de protection. Jeter le suremballage, l’indicateur d'oxygène et l’absorbeur d'oxygène. |
|
Figure 1 Figure 2 |
|
Préparation de l’émulsion mélangée. · S’assurer que le produit est à température ambiante avant de rompre les soudures non permanentes. · Placer la poche sur une surface plane et propre. Ouverture des 3 compartiments de la poche (ouverture des deux soudures non permanentes et mélange des 3 solutions) Etape 1 : Commencer à enrouler la poche depuis le côté comportant l'œillet. |
|
|
|
Etape 2 : Exercer une pression jusqu’à ce que les soudures s’ouvrent. |
|
|
|
Etape 3 : Changer de direction en roulant la poche vers l’œillet. Continuer jusqu’à ce que les soudures soient complètement ouvertes. Procéder de la même manière pour finir l’ouverture de la seconde soudure. |
|
|
|
Etape 4 : Retourner la poche au moins trois fois pour bien mélanger son contenu. Le mélange doit avoir l'aspect d'une émulsion d'un blanc laiteux. |
|
|
|
Etape 5 : Retirer le protecteur du site d’administration et insérer le dispositif d'administration intraveineux. |
|
|
|
Ouverture des 2 compartiments de la poche (ouverture de la soudure non permanente entre les compartiments d'acides aminés et de glucose et mélange des 2 solutions) Etape 1 : Pour n'ouvrir que la soudure pelable séparant les compartiments d'acides aminés et de glucose, enrouler la poche depuis le coin de la soudure séparant les compartiments d'acides aminés et de glucose comportant l'œillet et exercer une pression pour ouvrir cette soudure. |
|
|
|
Etape 2 : Orienter la poche de manière à ce que le compartiment de l'émulsion lipidique se trouve du côté de l'opérateur et l’enrouler tout en protégeant le compartiment de l'émulsion lipidique à l'aide des paumes des mains |
|
|
|
Etape 3 : D'une main, exercer une pression en enroulant la poche vers les embouts |
|
|
|
Etape 4 : Changer ensuite de direction en enroulant la poche vers l'œillet, tout en appuyant de l'autre main, jusqu'à ce que la soudure séparant les solutions d'acides aminés et de glucose soit entièrement ouverte. |
|
|
|
Etape 5 : Retourner la poche au moins trois fois pour bien mélanger son contenu. La solution mélangée doit être limpide, incolore ou jaune pâle. |
|
|
|
Etape 6 : Retirer le protecteur du site d’administration et insérer le dispositif d'administration intraveineux. |
|
|
Le débit devra être augmenté progressivement pendant la première heure. Le débit d’administration doit être ajusté en fonction des facteurs suivants :
· la dose à administrer
· l’apport volumique journalier
· la durée de la perfusion
Mode d’administration
Lorsqu’elle est utilisée chez les nouveau-nés et les enfants de moins de 2 ans, la solution (dans la poche et les kits d'administration) doit être protégée de l’exposition à la lumière jusqu’à la fin de l’administration.
L’utilisation d’un filtre de 1,2 micron est recommandé pour l’administration de NUMETAH G16%E.
En raison de son osmolarité élevée, NUMETAH G16%E non dilué peut être uniquement administré par une veine centrale. Néanmoins, une dilution suffisante de NUMETAH G16%E avec de l'eau pour préparations injectables réduit l'osmolarité et permet une perfusion par une veine périphérique.
La formule suivante indique l’effet de la dilution sur l'osmolarité des poches :
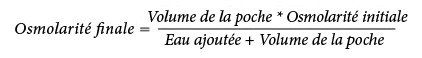
Le tableau suivant présente des exemples d'osmolarité des mélanges avec 2 CP et 3 CP ouverts après ajout d'eau pour préparations injectables :
|
|
Acides aminés et glucose (2 CP ouverts) |
Acides aminés, glucose et lipides (3 CP ouverts) |
|
Volume initial dans la poche (mL) |
376 |
500 |
|
Osmolarité initiale (mOsm/l env.) |
1 585 |
1 230 |
|
Volume d'eau ajouté (mL) |
376 |
500 |
|
Volume final après ajout (mL) |
752 |
1000 |
|
Osmolarité après ajout (mOsm/l env.) |
792,5 |
615 |
Supplémentations :
L’exposition à la lumière des solutions pour la nutrition parentérale par voie intraveineuse, notamment après l’ajout d’un mélange d’oligo-éléments et/ou de vitamines, peut avoir des effets négatifs sur les résultats cliniques chez les nouveau-nés, en raison de la production de peroxydes et d’autres produits de dégradation. Lorsqu’il est utilisé chez les nouveau-nés et les enfants de moins de 2 ans, NUMETAH G16%E doit être protégé de la lumière ambiante jusqu’à la fin de l’administration.
Les mélanges contenant des oligo-éléments et des vitamines, doivent être protégés de la lumière, à partir du moment du mélange jusqu’à leur administration. L'exposition à la lumière ambiante génère des peroxydes et d'autres produits de dégradation qui peuvent être réduits par photoprotection.
Des additifs compatibles peuvent être ajoutés, via le site de perfusion dans le mélange reconstitué (après ouverture des soudures non permanentes et mélange du contenu des deux ou trois compartiments).
Des vitamines peuvent également être ajoutées au compartiment de glucose avant reconstitution du mélange (avant ouverture des soudures non permanentes et avant mélange des solutions et de l’émulsion).
Des supplémentations possibles de solutions d’oligo-éléments disponibles dans le commerce (identifiées par OE1, OE2 et OE4), de vitamines (identifiées par lyophilisat V1 et émulsion V2) et d'électrolytes en quantités définies sont présentées dans les tableaux 1-6.
1. Compatibilité avec OE4, V1 et V2
Tableau 1 : Compatibilité du mélange 3 en 1 (3 CP ouverts) avec et sans dilution avec de l’eau :
|
Pour 500 ml (mélange 3 en 1 avec des lipides) |
||||||
|
|
Mélange sans dilution |
Mélange avec dilution |
||||
|
Additifs |
Taux inclus |
Autre supplémentation maximale |
Taux total maximal |
Taux inclus |
Autre supplémentation maximale |
Taux total maximal |
|
Sodium (mmol) |
12,0 |
25,6 |
37,6 |
12,0 |
25,6 |
37,6 |
|
Potassium (mmol) |
11,4 |
26,2 |
37,6 |
11,4 |
26,2 |
37,6 |
|
Magnésium (mmol) |
1,6 |
3,6 |
5,2 |
1,6 |
3,6 |
5,2 |
|
Calcium (mmol) |
3,1 |
16,4 |
19,5 |
3,1 |
8,2 |
11,3 |
|
Phosphate* (mmol) |
4,4 |
6,9 |
11,3 |
4,4 |
6,9 |
11,3 |
|
Oligo-éléments et vitamines |
- |
10 ml OE4 + 1 flacon V1 + 30 ml V2 b |
10 ml OE4 + 1 flacon V1 + 30 ml V2 |
- |
5 ml OE4 + ½ flacon V1+ 5 ml V2 |
5 ml OE4 + ½ flacon V1+ 5 ml V2 |
|
Eau pour préparations injectables |
- |
- |
- |
- |
350 ml |
350 ml |
* Phosphate organique
Tableau 2 : Compatibilité du mélange 2 en 1 (2 CP ouverts) avec et sans dilution avec de l’eau
|
Pour 376 ml (mélange 2 en 1 sans lipides) |
||||||
|
|
Mélange sans dilution |
Mélange avec dilution |
||||
|
Additifs |
Taux inclus |
Autre supplémentation maximale |
Taux total maximal |
Taux inclus |
Autre supplémentation maximale |
Taux total maximal |
|
Sodium (mmol) |
11,6 |
26,0 |
37,6 |
11,6 |
0,0 |
11,6 |
|
Potassium (mmol) |
11,4 |
26,2 |
37,6 |
11,4 |
0,0 |
11,4 |
|
Magnésium (mmol) |
1,6 |
3,6 |
5,2 |
1,6 |
0,0 |
1,6 |
|
Calcium (mmol) |
3,1 |
8,2 |
11,3 |
3,1 |
0,0 |
3,1 |
|
Phosphate* (mmol) |
3,2 |
8,1 |
11,3 |
3,2 |
0,0 |
3,2 |
|
Oligo-éléments et vitamines |
- |
5 ml OE4 + ½ flacon V1 |
5 ml OE4 + ½ flacon V1 |
- |
5 ml OE4 + ½ flacon V1 |
5 ml OE4 + ½ flacon V1 |
|
Eau pour préparations injectables |
- |
- |
- |
- |
450 ml |
450 ml |
* Phosphate organique
2. Compatibilité avec OE1, V1 et V2
Tableau 3 : Compatibilité du mélange 3 en 1 (3 CP ouverts) avec et sans dilution avec de l’eau
|
Pour 500 ml (mélange 3 en 1 avec des lipides) |
||||||
|
|
Mélange sans dilution |
Mélange avec dilution |
||||
|
Additifs |
Taux inclus |
Autre supplémentation maximale |
Taux total maximal |
Taux inclus |
Autre supplémentation maximale |
Taux total maximal |
|
Sodium (mmol) |
12,0 |
4,0 |
16,0 |
12,0 |
0,0 |
12,0 |
|
Potassium (mmol) |
11,4 |
6,2 |
17,6 |
11,4 |
0,0 |
11,4 |
|
Magnésium (mmol) |
1,6 |
0 |
1,6 |
1,6 |
0,0 |
1,6 |
|
Calcium (mmol) |
3,1 |
2,1 |
5,2 |
3,1 |
0,0 |
3,1 |
|
Phosphate* (mmol) |
4,4 |
2,0 |
6,4 |
4,4 |
0,0 |
4,4 |
|
Oligo-éléments et vitamines |
- |
5 ml OE1 + |
5 ml OE1 + ½ flacon V1 + 5 ml V2 |
- |
5 ml OE1 + |
5 ml OE1 + |
|
Eau pour préparations injectables |
- |
- |
- |
- |
350 ml |
350 ml |
* Phosphate organique
Tableau 4 : Compatibilité du mélange 2 en 1 (2 CP ouverts) avec et sans dilution avec de l’eau
|
Pour 376 ml (mélange 2 en 1 sans lipides) |
||||||
|
|
Mélange sans dilution |
Mélange avec dilution |
||||
|
Additifs |
Taux inclus |
Autre supplémentation maximale |
Taux total maximal |
Taux inclus |
Autre supplémentation maximale |
Taux total maximal |
|
Sodium (mmol) |
11,6 |
26,0 |
37,6 |
11,6 |
0,0 |
11,6 |
|
Potassium (mmol) |
11,4 |
26,2 |
37,6 |
11,4 |
0,0 |
11,4 |
|
Magnésium (mmol) |
1,6 |
3,6 |
5,2 |
1,6 |
0,0 |
1,6 |
|
Calcium (mmol) |
3,1 |
8,2 |
11,3 |
3,1 |
0,0 |
3,1 |
|
Phosphate* (mmol) |
3,2 |
8,1 |
11,3 |
3,2 |
0,0 |
3,2 |
|
Oligo-éléments et vitamines |
- |
5 ml OE1 |
5 ml OE1 |
- |
5 ml OE1 |
5 ml OE1 |
|
Eau pour préparations injectables |
- |
- |
- |
- |
450 ml |
450 ml |
* Phosphate organique
3. Compatibilité avec OE2, V1 et V2
Tableau 5 : Compatibilité du mélange 3 en 1 (3CP ouverts) avec et sans dilution avec de l’eau
|
Pour 500 ml (mélange 3 en 1 avec des lipides) |
||||||
|
|
Mélange sans dilution |
Mélange avec dilution |
||||
|
Additifs |
Taux inclus |
Autre supplémentation maximale |
Taux total maximal |
Taux inclus |
Autre supplémentation maximale |
Taux total maximal |
|
Sodium (mmol) |
12,0 |
4,0 |
16,0 |
12,0 |
0,0 |
12,0 |
|
Potassium (mmol) |
11,4 |
6,2 |
17,6 |
11,4 |
0,0 |
11,4 |
|
Magnésium (mmol) |
1,6 |
0 |
1,6 |
1,6 |
0,0 |
1,6 |
|
Calcium (mmol) |
3,1 |
2,1 |
5,2 |
3,1 |
0,0 |
3,1 |
|
Phosphate* (mmol) |
4,4 |
2,0 |
6,4 |
4,4 |
0,0 |
4,4 |
|
Oligo-éléments et vitamines |
- |
5 ml OE2 + |
5 ml OE2 + ½ flacon V1 + 5 ml V2 |
- |
5 ml OE2 + |
5 ml OE2 + ½ flacon V1 + 5 ml V2 |
|
Eau pour préparations injectables |
- |
- |
- |
- |
350 ml |
350 ml |
* Phosphate organique
Tableau 6 : Compatibilité du mélange 2 en 1 (2 CP ouverts) avec et sans dilution avec de l’eau
|
Pour 376 ml (mélange 2 en 1 sans lipides) |
||||||
|
|
Mélange sans dilution |
Mélange avec dilution |
||||
|
Additifs |
Niveau inclus |
Autre supplémentation maximale |
Niveau total maximal |
Niveau inclus |
Autre supplémentation maximale |
Niveau total maximal |
|
Sodium (mmol) |
11,6 |
26,0 |
37,6 |
11,6 |
0,0 |
11,6 |
|
Potassium (mmol) |
11,4 |
26,2 |
37,6 |
11,4 |
0,0 |
11,4 |
|
Magnésium (mmol) |
1,6 |
3,6 |
5,2 |
1,6 |
0,0 |
1,6 |
|
Calcium (mmol) |
3,1 |
8,2 |
11,3 |
3,1 |
0,0 |
3,1 |
|
Phosphate* (mmol) |
3,2 |
8,1 |
11,3 |
3,2 |
0,0 |
3,2 |
|
Oligo-éléments et vitamines |
- |
5 ml OE2 |
5 ml OE2 |
- |
5 ml OE2 |
5 ml OE2 |
|
Eau pour préparations injectables |
- |
- |
- |
- |
450 ml |
450 ml |
* Phosphate organique
La composition des vitamines et les préparations d’oligo-éléments sont illustrées dans les tableaux 7 et 8.
Tableau 7 : Composition de la préparation commerciale d'oligo-éléments utilisée
|
Composition pour 10 mL |
OE1 |
OE2 |
OE4 |
|
Fer |
- |
8,9 µmol ou 0,5 mg |
- |
|
Zinc |
38,2 µmol ou 2,5 mg |
15,3 µmol ou 1 mg |
15,3 µmol ou 1 mg |
|
Sélénium |
0,253 µmol ou 0,02 mg |
0,6 µmol ou 0,05 mg |
0,253 µmol ou 0,02 mg |
|
Cuivre |
3,15 µmol ou 0,2 mg |
4,7 µmol ou 0,3 mg |
3,15 µmol ou 0,2 mg |
|
Iode |
0,0788 µmol ou 0,01 mg |
0,4 µmol ou 0,05 mg |
0,079 µmol ou 0,01 mg |
|
Fluor |
30 µmol ou 0,57 mg |
26,3 µmol ou 0,5 mg |
- |
|
Molybdène |
- |
0,5 µmol ou 0,05 mg |
- |
|
Manganèse |
0,182 µmol ou 0,01 mg |
1,8 µmol ou 0,1 mg |
0,091 µmol ou 0,005 mg |
|
Cobalt |
- |
2,5 µmol ou 0,15 mg |
- |
|
Chrome |
- |
0,4 µmol ou 0,02 mg |
- |
Tableau 8 : Composition de la préparation commerciale de vitamines utilisée
|
Composition par flacon |
V1 |
V2 |
|
Vitamine B1 |
2,5 mg |
- |
|
Vitamine B2 |
3,6 mg |
- |
|
Nicotinamide |
40 mg |
- |
|
Vitamine B6 |
4,0 mg |
- |
|
Acide pantothénique |
15,0 mg |
- |
|
Biotine |
60 µg |
- |
|
Acide folique |
400 µg |
- |
|
Vitamine B12 |
5,0 µg |
- |
|
Vitamine C |
100 mg |
- |
|
Vitamine A |
- |
2 300 UI |
|
Vitamine D |
- |
400 UI |
|
Vitamine E |
- |
7 UI |
|
Vitamine K |
- |
200 µg |
Pour effectuer un ajout :
· Respecter des conditions d’asepsie.
· Préparer le site de supplémentation de la poche.
· Perforer le site de supplémentation et injecter les additifs à la seringue ou avec un dispositif de reconstitution.
· Mélanger le contenu de la poche et les additifs.
Préparation de la perfusion :
· Respecter des conditions d’asepsie.
· Suspendre la poche.
· Retirer le protecteur en plastique de l’embout d’administration.
· Insérer fermement le perforateur du dispositif de perfusion dans l’embout d’administration.
Administration de la perfusion :
· A usage unique.
· Le produit ne doit être administré qu'après ouverture des soudures non permanentes entre les deux ou trois compartiments et mélange du contenu de ces compartiments.
· Vérifier que l'émulsion pour perfusion finale avec 3 CP ouverts ne présente aucune séparation de phase ou que la solution pour perfusion finale avec 2 CP ouverts ne présente aucune trace de particules.
· Il est recommandé d’utiliser immédiatement le produit après l’ouverture des soudures non permanente. Ne pas conserver NUMETAH G16%E pour une perfusion ultérieure.
· Ne pas connecter de poches partiellement utilisées.
· Ne pas connecter les poches en série afin d’éviter tout risque d'embolie gazeuse due à l'air résiduel éventuellement contenu dans la première poche.
· L’utilisation d’un filtre de 1,2 micron est recommandé pour l’administration de NUMETAH G16%E.
· En utilisation chez les nouveau-nés et les enfants de moins de 2 ans, protéger ce médicament de l’exposition à la lumière jusqu’à la fin de l’administration. L’exposition de NUMETAH G16%E à la lumière ambiante, notamment après l'ajout d’un mélange d’oligo-éléments et/ou de vitamines, produit des peroxydes et d’autres produits de dégradation qui peuvent être réduits en protégeant le médicament de l’exposition à la lumière
· Détruire de manière appropriée le produit restant, les déchets et les consommables inutilisés.
Durée de conservation après mélange des solutions
Utiliser le produit immédiatement après ouverture des soudures non permanentes entre les deux ou trois compartiments. Des études de stabilité des mélanges ont été réalisées pendant 7 jours entre 2 °C et 8 °C, suivis de 48 heures à 30 °C.
Durée de conservation après supplémentation (électrolytes, oligoéléments, vitamines, eau) :
Pour des mélanges spécifiques, la stabilité en cours d’utilisation de NUMETAH a été démontrée pendant 7 jours, entre 2 °C et 8 °C, suivis de 48 heures à 30 °C.
D’un point de vue microbiologique, le produit doit être utilisé immédiatement. Si le produit n'est pas utilisé immédiatement, les délais et les conditions d'utilisation en cours d'utilisation sont de la responsabilité de l'utilisateur et ne devraient normalement pas dépasser 24 heures entre 2°C et 8°C, à moins que la reconstitution / dilution/ supplémentation ait eu lieu dans des conditions aseptiques contrôlées et validées.
N’utilisez jamais NUMETAH G16%E si la poche est endommagée. Une poche endommagée a l'apparence suivante :
· les soudures non permanentes sont rompues.
· l'un des compartiments contient un mélange de solutions.
· les solutions d'acides aminés et de glucose ne sont pas limpides, incolores ou jaune pâle et/ou contiennent des particules visibles.
· l'émulsion lipidique n'a pas l'aspect d'une émulsion homogène d'un blanc laiteux.
Les médicaments ne doivent pas être jetés au tout à l’égout ou avec les ordures ménagères. Demandez à votre pharmacien ce qu’il faut faire des médicaments inutilisés. Ces mesures permettront de protéger l’environnement.