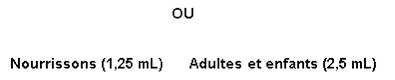Dernière mise à jour le 02/03/2026
DAKTARIN 2 %, gel buccal
Indications thérapeutiques
Classe pharmacothérapeutique - code ATC : A01AB09
Il s'agit d'un anti-infectieux pour traitement oral local. Ce médicament est indiqué dans le traitement des mycoses de la cavité buccale, chez l’adulte et chez les enfants âgés de 4 mois et plus (voir la rubrique « Avertissements et précautions »).
Présentations
> 1 tube(s) aluminium de 40 g avec cuillère-mesure polypropylène
Code CIP : 326 806-8 ou 34009 326 806 8 9
Déclaration de commercialisation : 19/09/1985
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 4,12 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 5,14 €
- Taux de remboursement :65%
> 1 tube(s) aluminium de 80 g avec cuillère-mesure polypropylène
Code CIP : 348 308-0 ou 34009 348 308 0 8
Déclaration de commercialisation : 16/03/2009
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 7,26 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 8,28 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Faible | Avis du 07/06/2017 | Renouvellement d'inscription (CT) | Le service médical rendu par DAKTARIN 2 POUR CENT, poudre pour application locale reste faible dans les autres indications. |
| Important | Avis du 07/06/2017 | Renouvellement d'inscription (CT) | Le service médical rendu par DAKTARIN 2 POUR CENT, gel buccal reste important dans l’indication de l’AMM. |
| Modéré | Avis du 07/06/2017 | Renouvellement d'inscription (CT) | Le service médical rendu par DAKTARIN 2 POUR CENT, poudre pour application locale reste modéré dans les mycoses des plis macérés. Le service médical rendu par GYNO-DAKTARIN 400 mg, capsule molle vaginale reste modéré dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 15/10/2008 | Inscription (CT) | Cette spécialité est un complément de gamme qui n'apporte pas d'amélioration du service médical rendu (ASMR V). |
ANSM - Mis à jour le : 06/11/2025
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Miconazole................................................................................................................................. 2 g
1,25 mL de gel contient 31,25 mg de miconazole.
2,5 mL de gel contient 62,5 mg de miconazole.
Excipients à effet notoire : éthanol (alcool), arôme orange (0,17 mg par gramme (contenant notamment : citral, citronellol, d-limonène, géraniol, linalool)) et arôme cacao blanc (contenant notamment : 0,00000000138 mg de benzoate de benzyle et 0,0000000023 mg d'alcool benzylique dans chaque gramme).
Titre alcoolique volumique : 1,1 % (v/v) 7,85 mg par gramme.
Pour la liste complète des excipients, voir rubrique 6.1.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Nourrissons âgés de 4 à 24 mois : 1,25 mL appliqués 4 fois par jour après les repas.
Adultes et enfants âgés de 2 ans et plus : 2,5 mL appliqués 4 fois par jour après les repas.
La durée habituelle du traitement est de 7 à 15 jours.
Le traitement doit être continué pendant au moins une semaine après que les symptômes aient disparu.
Pour les candidoses orales, les prothèses dentaires doivent être retirées la nuit et brossées avec le gel.
Mode d’administration
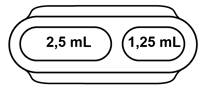
Le dispositif de mesure comprend deux cavités distinctes de 1,25 mL et 2,5 mL.
Chaque dose doit être divisée en petites portions et le gel appliqué sur la (les) zone(s) affectée(s) avec un doigt propre. Le gel ne doit pas être appliqué au fond de la gorge en raison du risque de suffocation.
Le gel ne doit pas être avalé immédiatement, mais gardé dans la bouche aussi longtemps que possible (voir rubrique 4.4).
DAKTARIN 2 %, gel buccal ne doit pas être utilisé dans les cas suivants :
· Hypersensibilité à la substance active, à d’autres dérivés imidazolés ou à l'un des excipients mentionnés dans la rubrique 6.1.
· Chez le nourrisson âgé de moins de 4 mois ou chez des patients pour qui le réflexe de déglutition n’est pas encore suffisamment développé (voir rubrique 4.4).
· Insuffisance hépatique, compte-tenu du métabolisme hépatique.
· Utilisation en association avec :
o les anti-vitamines K (warfarine, acénocoumarol, fluindione),
o les sulfamides hypoglycémiants.
(voir rubrique 4.5)
4.4. Mises en garde spéciales et précautions d'emploi
Compte-tenu d’un faible passage systémique du miconazole lors de l’administration de DAKTARIN 2%, gel buccal, la survenue de réactions cutanées graves (par exemple, nécrolyse épidermique toxique et syndrome de Stevens Johnson) décrits avec certains dérivés azolés par voie systémique ne peut être exclue (voir rubrique 4.8). Il est recommandé que les patients soient informés sur les signes des réactions cutanées graves, et que l’utilisation de DAKTARIN 2%, gel buccal soit arrêtée dès lors que de tels signes cutanés apparaissent ou sont suspectés.
DAKTARIN 2 %, gel buccal doit être administré à distance des repas ou au moins 10 minutes après.
Dans la mesure du possible, il doit être conservé dans la bouche 2 ou 3 minutes avant d'être avalé.
Dans l’indication perlèche, appliquer le gel sur les lésions à traiter avec le bout des doigts, par massage doux jusqu’à pénétration complète.
|
Risque de suffocation chez les nourrissons et les jeunes enfants · Lors de l’administration du gel de miconazole, il est important de s’assurer que le réflexe de déglutition est bien acquis, en particulier chez les nourrissons âgés de 4 à 6 mois. · La limite d’âge minimum pour l’administration du produit doit être augmentée à 5-6 mois pour les nourrissons nés prématurés ou les nourrissons présentant un retard de développement neuromusculaire. · DAKTARIN 2 %, gel buccal doit être administré avec précaution chez les nourrissons et les jeunes enfants (âgés de 4 à 24 mois). Il faut agir avec prudence pour s’assurer que le gel n’obstrue pas la gorge. Le gel ne doit donc pas être appliqué au fond de la gorge. · Chaque dose doit être divisée en petites portions et appliquée dans la bouche avec un doigt propre. Observer le patient pour détecter une éventuelle suffocation. · Le gel ne doit pas être appliqué sur le mamelon d’une femme allaitant en raison du risque d’étouffement du nourrisson. |
Excipient à effet notoire
DAKTARIN 2 %, gel buccal contient 7,85 mg d’alcool (éthanol) par gramme de gel équivalent à 0,00785 mg/mg (0,785 % p/p). La quantité dans 1 gramme de ce médicament équivaut à moins de 1 mL de bière ou 1 mL de vin.
La faible quantité d’alcool contenue dans ce médicament n’est pas susceptible d’entraîner d’effet notable.
Ce médicament contient un arôme orange (contenant notamment : citral, citronellol, linalool, géraniol, d-limonène) et un arôme cacao blanc (contenant notamment : alcool benzylique, benzoate de benzyle) qui peuvent provoquer des réactions allergiques.
DAKTARIN 2 %, gel buccal contient moins de 1 mmol (23 mg) de sodium par dose, ce qui signifie qu’il est essentiellement « sans sodium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Associations contre-indiquées (voir rubrique 4.3)
+ Anti-vitamines K (warfarine, acénocoumarol, fluindione)
Hémorragies imprévisibles, éventuellement graves. Des saignements, dont certains avec une issue fatale, ont été rapportés lors de l’utilisation concomitante de miconazole en gel buccal et de warfarine.
+ Sulfamides hypoglycémiants
Augmentation de l'effet hypoglycémiant avec survenue possible de manifestations hypoglycémiques, voire de coma.
Associations faisant l'objet de précautions d’emploi
+ Phénytoïne (et, par extrapolation, fosphénytoïne)
Augmentation des concentrations plasmatiques de phénytoïne pouvant atteindre des valeurs toxiques. Mécanisme invoqué : inhibition du métabolisme hépatique de la phénytoïne.
Surveillance clinique étroite, dosage des concentrations plasmatiques de phénytoïne et adaptation éventuelle de sa posologie pendant le traitement par le miconazole et après son arrêt.
4.6. Fertilité, grossesse et allaitement
Grossesse
Les études effectuées chez l'animal n'ont pas mis en évidence d'effet tératogène mais une foetotoxicité sur plusieurs espèces. En clinique, aucun effet malformatif ou foetotoxique n'est apparu à ce jour. Toutefois, le nombre de grossesses documentées exposées au miconazole est insuffisant pour exclure tout risque. En conséquence, l'utilisation du miconazole ne doit être envisagée au cours de la grossesse que si nécessaire.
Il n'existe pas de données sur l'excrétion du miconazole dans le lait maternel. En conséquence, la prudence s'impose en cas de prescription chez la femme en cours d'allaitement. Le gel ne doit pas être appliqué sur le mamelon d’une femme allaitante en raison du risque de suffocation du nourrisson (voir rubrique 4.4).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Le tableau suivant présente tous les effets indésirables identifiés, y compris ceux qui ont été rapportés au cours de l'expérience post-commercialisation.
Les effets indésirables sont classés en fonction de leur fréquence selon la convention suivante : très fréquent (³ 1/10), fréquent (³ 1/100 à < 1/10), peu fréquent (³ 1/1 000 à < 1/100), rare (³ 1/10 000 à < 1/1 000), très rare (< 1/10 000), indéterminée (fréquence ne pouvant être estimée à partir des données cliniques disponibles).
|
Classe de systèmes organes |
Effets indésirables |
|
Fréquence indéterminée |
|
|
Affections du système immunitaire |
Réaction anaphylactique, hypersensibilité |
|
Affections du système nerveux |
Dysgueusie |
|
Affections respiratoires, thoraciques et médiastinales |
Suffocation |
|
Affections gastro-intestinales |
Sécheresse buccale, Nausées, Gêne buccale, Vomissement, Diarrhée, Stomatite, Décoloration de la langue, Régurgitation (effet observé dans la population pédiatrique) |
|
Affections de la peau et du tissu sous-cutané |
Angioedème, Rash, Pustulose exanthémateuse aiguë généralisée* Erythème pigmenté fixe |
|
Troubles généraux et anomalies au site d’administration |
Goût du produit anormal |
|
Investigations |
Transaminases augmentées |
*Compte-tenu d’un faible passage systémique du miconazole lors de l’administration de DAKTARIN 2 %, gel buccal, la survenue d’effets indésirables non dose-dépendants décrits avec certains dérivés azolés tels que des réactions cutanées graves autres que celle mentionnée dans le tableau ci-dessus (syndrome de Stevens-Johnson, nécrolyse épidermique toxique) ne peut être exclue.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
En cas de surdosage accidentel, des vomissements et une diarrhée peuvent apparaître.
Traitement
Il n'existe pas d'antidote spécifique. Un traitement symptomatique sera mis en place.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Antifongique à large spectre et antibactérien Gram+, le miconazole est actif en particulier sur les Candida et autres levures, principaux responsables des mycoses buccales.
Le miconazole inhibe la biosynthèse de l’ergostérol dans les champignons et modifie la composition d’autres composants lipidiques constituant la membrane, ce qui entraîne une nécrose des cellules fongiques.
5.2. Propriétés pharmacocinétiques
Après application sous forme de gel buccal, le miconazole reste présent dans la cavité buccale pendant plusieurs heures ainsi que l'attestent les concentrations salivaires qui varient de 5 à 0,4 µg/mL de 30 minutes à 3 heures suivant une application de 125 mg de miconazole (6,25 g de gel buccal). Le miconazole est progressivement et modérément résorbé le long du tractus digestif. Il présente une biodisponibilité analogue, à dose équivalente, à celle de la forme orale (comprimé dosé à 125 mg).
Bien qu'administré de façon locale sous forme de gel buccal, le miconazole est absorbé systémiquement.
Distribution
Le miconazole absorbé se lie aux protéines plasmatiques (88,2%), d’abord sur la sérum-albumine et sur les globules rouges (10,6%).
Biotransformation et élimination
La portion de miconazole absorbée est largement métabolisée ; moins de 1% de la dose administrée est excrété dans les urines sous forme inchangée. L’élimination s’effectue principalement par les fèces, après biotransformation hépatique. La demi-vie terminale du miconazole plasmatique est de 20 à 25h chez la plupart des patients. La concentration plasmatique de miconazole est modérément réduite (approximativement 50%) pendant l’hémodialyse.
5.3. Données de sécurité préclinique
Avant ouverture : 3 ans.
Après première ouverture, le médicament doit être conservé maximum 3 mois.
6.4. Précautions particulières de conservation
Pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
Tube aluminium de 40 g ou 80 g avec dispositif de mesure en polypropylène de 2,5 mL. Un tube de 40 g contient approximativement l’équivalent de 12 doses de 2,5 mL, soit approximativement l’équivalent de 24 doses de 1,25 mL. Un tube de 80 g contient approximativement l’équivalent de 25 doses de 2,5 mL, soit approximativement l’équivalent de 50 doses de 1,25 mL.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pour les instructions d’utilisation, se référer à la rubrique 3 « Comment prendre DAKTARIN 2 %, gel buccal » de la notice.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
43, RUE CAMILLE DESMOULINS
92130 ISSY-LES-MOULINEAUX
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 326 806 8 9 : 40 g en tube (aluminium)
· 34009 348 308 0 8 : 80 g en tube (aluminium)
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
ANSM - Mis à jour le : 06/11/2025
Miconazole
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que DAKTARIN 2 %, gel buccal et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre DAKTARIN 2 %, gel buccal ?
3. Comment prendre DAKTARIN 2 %, gel buccal ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver DAKTARIN 2 %, gel buccal ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE DAKTARIN 2 %, gel buccal ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC : A01AB09
Il s'agit d'un anti-infectieux pour traitement oral local. Ce médicament est indiqué dans le traitement des mycoses de la cavité buccale, chez l’adulte et chez les enfants âgés de 4 mois et plus (voir la rubrique « Avertissements et précautions »).
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE DAKTARIN 2 %, gel buccal ?
N’utilisez jamais DAKTARIN 2 %, gel buccal :
· si vous êtes allergique au miconazole, à d’autres médicaments antifongiques similaires ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· chez les nourrissons âgés de moins de 4 mois ou chez les enfants pour qui le réflexe de déglutition n’est pas encore suffisamment développé à cause du risque de suffocation.
· en cas d'insuffisance hépatique (défaillance des fonctions du foie).
· en association avec :
o les anticoagulants oraux de type anti-vitamines K (médicaments destinés à ralentir la coagulation),
o les sulfamides hypoglycémiants (médicaments utilisés en cas de diabète),
Les effets et/ou effets indésirables de beaucoup de médicaments peuvent être augmentés quand ils sont pris avec DAKTARIN 2 %, gel buccal. Si vous devez prendre un autre médicament prescrit pendant que vous utilisez DAKTARIN 2 %, gel buccal, demandez conseil avant à votre médecin ou à votre pharmacien (voir « Autres médicaments et DAKTARIN 2 %, gel buccal »).
Avertissements et précautions
En cas de suspicion d’allergie ou de réaction cutanée sévère, vous devez arrêter DAKTARIN 2 %, gel buccal et contacter votre médecin (Voir rubrique « Quels sont les effets indésirables éventuels »)
DAKTARIN 2 %, gel buccal doit être administré à distance des repas ou au moins 10 minutes après.
Dans la mesure du possible, il doit être conservé dans la bouche 2 ou 3 minutes avant d'être avalé.
Dans l’indication perlèche, appliquez le gel sur les lésions à traiter avec le bout des doigts, par massage doux jusqu’à pénétration complète.
Risque de suffocation chez les nourrissons et les jeunes enfants
Ce produit doit être administré avec précaution chez les nourrissons et les jeunes enfants (âgés de 4 à 24 mois).
La limite d’âge minimum pour l’administration du produit doit être augmentée à 5-6 mois pour les nourrissons nés prématurés présentant un retard de développement neuromusculaire.
La prudence est nécessaire pour faire en sorte que le gel n’obstrue pas la gorge. Ainsi, le gel ne doit pas être appliqué au fond de la gorge. Chaque dose doit être divisée en petites portions et appliquées dans la bouche avec un doigt propre. Observez le nourrisson/enfant pour détecter une éventuelle suffocation.
Si vous allaitez, n’appliquez pas le gel sur votre mamelon pour traiter votre enfant.
Précautions particulières d'emploi
En raison de la présence d'alcool, prévenez votre médecin en cas de maladie du foie, d'épilepsie, ou de grossesse.
Mises en garde
Attention ! Ce médicament contient de petites quantités d'éthanol (alcool), inférieures à 100 mg par dose (24 mg d’alcool dans 2,5 mL de gel).
Autres médicaments et DAKTARIN 2 %, gel buccal
N’utilisez jamais DAKTARIN 2 %, gel buccal en association avec :
· les anticoagulants oraux de type anti-vitamines K (médicaments destinés à ralentir la coagulation),
· les sulfamides hypoglycémiants (médicaments utilisés en cas de diabète).
Informez votre médecin ou votre pharmacien si vous prenez, avez pris récemment ou pourriez prendre tout autre médicament.
DAKTARIN 2 %, gel buccal avec des aliments, boissons et de l’alcool
Sans objet.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Il est préférable de ne pas utiliser DAKTARIN 2 %, gel buccal pendant la grossesse. Si vous découvrez que vous êtes enceinte pendant le traitement, consultez votre médecin car lui seul peut juger de la nécessité de le poursuivre.
Si vous allaitez, n’appliquez pas le gel sur votre mamelon pour traiter votre enfant.
Conduite de véhicules et utilisation de machines
Sans objet.
DAKTARIN 2 %, gel buccal contient de l’éthanol (alcool), arôme orange, arôme cacao blanc et du sodium
Ce médicament contient un arôme orange (contenant notamment : citral, citronellol, linalool, géraniol, d-limonène) et un arôme cacao blanc (contenant notamment : alcool benzylique, benzoate de benzyle) qui peuvent provoquer des réactions allergiques.
DAKTARIN 2 %, gel buccal contient 7,85 mg d’alcool (éthanol) par gramme de gel équivalent à 0,00785 mg/mg (0,785 % p/p). La quantité dans 1 gramme de ce médicament équivaut à moins de 1 mL de bière ou 1 mL de vin.
La faible quantité d’alcool contenue dans ce médicament n’est pas susceptible d’entraîner d’effet notable.
DAKTARIN 2 %, gel buccal contient moins de 1 mmol (23 mg) de sodium par dose, ce qui signifie qu’il est essentiellement « sans sodium ».
3. COMMENT PRENDRE DAKTARIN 2 %, gel buccal ?
Dispositif de mesure
Utilisez le dispositif de mesure fourni avec le tube pour mesurer la dose prescrite.
|
Tableau posologique
|
Nourrissons Âgés de 4 à 24 mois |
Adultes et enfants Âgés de 2 ans et plus |
|
1,25 mL Appliqués 4 fois par jour après les repas. |
2,5 mL Appliqués 4 fois par jour après les repas. |
Durée du traitement
· La durée habituelle du traitement est de 7 à 15 jours.
· Le traitement doit être continué pendant au moins une semaine après la disparition des symptômes.
Comment utiliser DAKTARIN 2 %, gel buccal
· DAKTARIN 2 %, gel buccal doit être administré à distance des repas ou au moins 10 minutes après.
· N’avalez pas le gel immédiatement. Le gel doit être gardé dans la bouche aussi longtemps que possible, au moins 2 ou 3 minutes, avant d'être avalé.
Dans l'indication perlèche, appliquez le gel sur les lésions à traiter avec le bout d’un doigt propre, par massage doux jusqu'à pénétration complète, conformément aux conseils de votre médecin ou pharmacien.
Pour les candidoses orales, les prothèses dentaires doivent être retirées la nuit et brossées avec le gel.
Instructions d’utilisation :
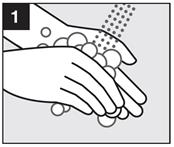
· Etape 1 : Lavez-vous les mains.
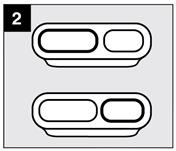
· Etape 2 : Sélectionner la cavité
|
|
Déterminer la dose requise.
Sélectionner la cavité du dispositif de mesure appropriée (voir Tableau posologique). |
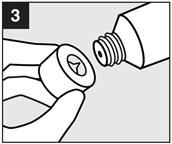
· Etape 3 : Ouvrir le tube
|
|
Dévissez le bouchon. Percez ensuite l’opercule à l’aide de la pointe située sur le dessus du bouchon.
|
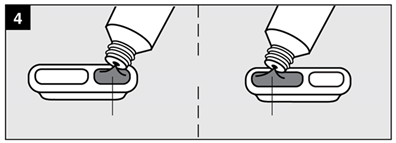
· Etape 4 : Remplir la cavité de mesure
|
|
Ne pas remplir au-delà du bord supérieur de la cavité. |
||||
|
|
|
||||
|
Nourrissons : remplir la cavité de mesure de 1,25 mL jusqu’au bord supérieur. |
Adultes et enfants : remplir la cavité de mesure de 2,5 mL jusqu’au bord supérieur. |
|
|
||
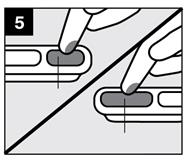
· Etape 5 : Prélever de petites portions de gel
|
|
Prélevez une petite portion du gel de la cavité de mesure. Le dispositif de mesure ne doit pas être placé dans la bouche pour appliquer le gel. |
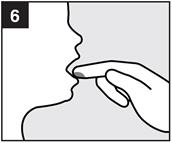
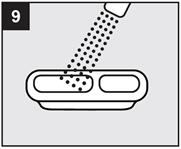
· Etape 6 : Appliquer le gel
|
· Le gel ne doit pas être appliqué au fond de la gorge. · Le gel doit être appliqué avec précaution en petites portions afin de ne pas obstruer la gorge. · Observez le nourrisson afin de vous assurer qu’il ne s’étouffe pas (voir « Avertissements et précautions »). |
|
|
|
|
Appliquez le gel sur les lésions à traiter avec le bout du doigt, conformément aux conseils de votre médecin ou pharmacien. Ne pas avaler le gel immédiatement. Le gel doit être gardé dans la bouche aussi longtemps que possible, au moins 2 ou 3 minutes, avant d'être avalé. |
|
· Chez les nourrissons et les enfants : répétez les étapes 5 et 6 jusqu’à avoir appliqué l’intégralité de la dose prescrite.
· Chez l’adulte : répétez les étapes 5 et 6 afin d’appliquer l’intégralité de la dose prescrite.
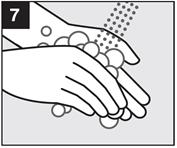
· Etape 7 : Lavez-vous les mains.
|
|
Se laver les mains après application du gel. |
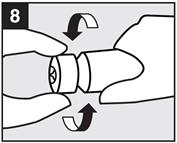
· Etape 8 : Replacer le bouchon sur le tube
|
|
Visser le bouchon sur le tube. |
· Etape 9 : Rincer le dispositif de mesure
|
|
Rincer, sécher et ranger le dispositif de mesure et le tube dans la boîte. |
Si vous avez pris plus de DAKTARIN 2 %, gel buccal que vous n’auriez dû
Des signes possibles de surdosage, incluant des vomissements et une diarrhée peuvent apparaître.
Il n'existe pas d'antidote spécifique. Un traitement symptomatique sera mis en place.
Consultez immédiatement votre médecin ou votre pharmacien.
Si vous oubliez de prendre DAKTARIN 2 %, gel buccal
Ne prenez pas de dose double pour compenser la dose simple que vous avez oublié de prendre.
Si vous arrêtez de prendre DAKTARIN 2 %, gel buccal
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Vous devez arrêter d’utiliser DAKTARIN 2%, gel buccal et consulter immédiatement votre médecin si vous présenter l’un des symptômes suivants :
· Gonflement du visage, des lèvres, de la langue ou de la gorge ; difficultés à avaler ; urticaire et difficultés à respirer (angioedème, réactions anaphylactiques).
· Elévation des transaminases (enzymes du foie) qui peut entrainer les symptômes suivants : perte d’appétit, nausées, vomissements, fatigue, douleurs abdominales, jaunisse, urines foncées, et selles décolorées (fréquence indéterminée).
· Des réactions cutanées allergiques peuvent notamment se manifester par des plaques rouges rondes ou ovales, des gonflements de la peau, des cloques et des démangeaisons (érythème pigmenté fixe). Un obscurcissement de la peau dans les zones touchées, éventuellement administré, l’érythème pigmenté fixe réapparait généralement sur le(s) même(s) site(s) cutané(s) (fréquence indéterminée).
· Une réaction allergique très intense aves des rashs cutanés*, généralement sous la forme d’ampoules ou de plaies dans la cavité buccale, le nez et les yeux, et d’autres muqueuses comme, par exemple, les organes génitaux (syndrome de Stevens-Johnson, fréquence indéterminée).
· Lésion étendue grave de la peau* (séparation de l’épiderme et des muqueuses superficielles) (nécrolyse épidermique toxique (NET), fréquence indéterminée).
*Ces réactions cutanées sévères ont été décrites avec d’autres produits de la même classe thérapeutique que DAKTARIN 2 %, gel buccal lors d’une administration par voie générale. Aussi, on ne peut exclure la survenue de ces effets lors de l’administration de DAKTARIN 2 %, gel buccal en application locale, même si le passage dans le sang est beaucoup plus limité.
Effets indésirables de fréquence indéterminée (ne pouvant être estimée à partir des données disponibles) :
· Nausées, vomissements, diarrhées, sécheresse de la bouche, gêne dans la bouche, inflammation de la bouche, décoloration de la langue, régurgitation (effet observé dans la population pédiatrique).
· Goût du produit anormal.
· Troubles du goût.
· Suffocation.
· Eruption cutanée
· Rash avec des boutons/ampoules remplis de pus, pouvant se généraliser sur le corps, parfois accompagné de fièvre (pustulose exanthémateuse aiguë généralisée).
Les nourrissons âgés de 4 à 24 mois peuvent s’étouffer si DAKTARIN 2 %, gel buccal obstrue la gorge.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER DAKTARIN 2 %, gel buccal ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur le tube et sur la boîte après {EXP}. La date de péremption fait référence au dernier jour de ce mois.
Après première ouverture, le médicament doit être conservé maximum 3 mois.
Pas de précautions particulières de conservation.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient DAKTARIN 2 %, gel buccal
· La substance active est :
Miconazole........................................................................................................................... 2 g
Pour 100 g.
· Les autres composants sont :
Amidon prégélatinisé (E954), saccharine sodique, polysorbate 20, eau purifiée, glycérol, arôme orange (contenant notamment : citral, citronellol, linalool, géraniol, d-limonène), arôme cacao blanc (contenant notamment : alcool benzylique, benzoate de benzyle), éthanol à 96 % (alcool). Voir rubrique 2.
1,25 mL de gel contient 31.25 mg de miconazole.
2,5 mL de gel contient 62,5 mg de miconazole.
Titre alcoolique volumique : 1,1 % (v/v)
Qu’est-ce que DAKTARIN 2 %, gel buccal et contenu de l’emballage extérieur
Ce médicament se présente sous forme de gel buccal. Tube de 40 g ou 80 g.
Un tube de 40 g contient approximativement l’équivalent de 12 doses de 2,5 mL, soit approximativement l’équivalent de 24 doses de 1,25 mL.
Un tube de 80 g contient approximativement l’équivalent de 25 doses de 2,5 mL, soit approximativement l’équivalent de 50 doses de 1,25mL.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
43, RUE CAMILLE DESMOULINS
92130 ISSY-LES-MOULINEAUX
Exploitant de l’autorisation de mise sur le marché
KENVUE FRANCE
43, RUE CAMILLE DESMOULINS
92130 ISSY-LES-MOULINEAUX
TURNHOUTSEWEG 30
B-2340 BEERSE
BELGIQUE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).