Dernière mise à jour le 01/12/2025
TEGELINE 50 mg/mL, poudre et solvant pour solution pour perfusion
Indications thérapeutiques
Classe pharmacothérapeutique - code ATC : J06BA02.
TEGELINE contient des anticorps.
TEGELINE appartient à la classe de médicaments appelée immunoglobulines. Ces médicaments contiennent des anticorps humains, produits par le système immunitaire.
Les anticorps humains contenus dans TEGELINE aident votre corps à lutter contre les infections ou à équilibrer votre système immunitaire.
Dans le cas où vous ne pouvez pas avoir assez d'anticorps, les anticorps fournis par TEGELINE peuvent se substituer aux anticorps manquants. Les anticorps de TEGELINE étant isolés à partir de plasma humain fonctionnent exactement comme s'il s'agissait de vos propres anticorps.
Ce type de médicament peut également être utilisé si votre système immunitaire est déséquilibré et que vous avez besoin d’anticorps supplémentaires dans le cas de certains troubles inflammatoires (maladie auto-immune). TEGELINE vous apporte ces anticorps.
TEGELINE est utilisé chez les patients n’ayant pas assez d’anticorps dans leur sang et notamment chez 3 types de patients :
1. Chez les patients qui souffrent d’un déficit congénital en anticorps, nommé déficit immunitaire primitif, avec hypogammaglobulinémie (défaut de production d’anticorps) ou atteinte fonctionnelle de l’immunité humorale (anomalie du fonctionnement des anticorps).
2. Chez les patients qui souffrent d’un déficit immunitaire secondaire (lié à une autre maladie) tel que :
· la leucémie lymphoïde chronique ou le myélome,
· l’allogreffe de cellules souches hématopoïétiques (greffe de cellules de moelle osseuse à l’origine des globules rouges, des globules blancs et des plaquettes), avec défaut de production d’anticorps (hypogammaglobulinémie) et associé à des infections à répétitions.
3. Chez les enfants qui souffrent fréquemment d’infections en raison d'une infection par le virus du SIDA.
TEGELINE est également utilisé chez les patients ayant un déséquilibre dans leur système immunitaire ou troubles inflammatoires (maladie auto-immune), comme traitement immunomodulateur notamment chez plusieurs types de patients :
1. Chez les patients n’ayant pas assez de plaquettes sanguines (purpura thrombopénique idiopathique, PTI) :
· et qui ont un risque élevé de saignement (hémorragie),
· ou qui doivent subir une opération chirurgicale dans un futur proche.
2. Chez les patients qui ont une maladie de l’œil avec des taches blanchâtres ou jaunâtres au niveau du fond d'œil (rétinochoroïdite de Birdshot).
3. Chez les patients qui souffrent d’une maladie associée à de multiples inflammations des nerfs périphériques (syndrome de Guillain Barré de l’adulte et polyradiculonévrite inflammatoire démyélinisante chronique).
4. Chez les patients qui ont une maladie des nerfs avec des crampes ou des tremblements (neuropathie motrice multifocale).
5. Chez les patients qui ont une maladie de la jonction entre les nerfs et les muscles, lors d’une poussée aiguë (poussées aiguës de myasthénie).
6. Chez les patients qui souffrent d’une maladie aiguë provoquant une inflammation touchant les vaisseaux de plusieurs organes du corps (maladie de Kawasaki).
Présentations
> 1 flacon(s) en verre de poudre - 1 flacon(s) en verre de solvant de 100 ml avec dispositif(s) de reconstitution avec matériel(s) de perfusion avec filtre(s)
Code CIP : 559 897-6 ou 34009 559 897 6 9
Déclaration de commercialisation : 19/08/1996
Cette présentation est agréée aux collectivités
Inscription sur la liste de rétrocession au titre de son AMM, selon les conditions précisées au Journal Officiel. Prix de cession publié au Journal Officiel.
> 1 flacon(s) en verre de poudre - 1 flacon(s) en verre de solvant de 100 ml avec dispositif de transfert avec matériel de perfusion muni d'un filtre
Code CIP : 559 898-2 ou 34009 559 898 2 0
Déclaration de commercialisation : 19/08/1996
Cette présentation est agréée aux collectivités
Inscription sur la liste de rétrocession au titre de son AMM, selon les conditions précisées au Journal Officiel. Prix de cession publié au Journal Officiel.
> 1 flacon(s) en verre de poudre - 1 flacon(s) en verre de solvant de 200 ml avec dispositif de transfert avec matériel de perfusion muni d'un filtre
Code CIP : 559 899-9 ou 34009 559 899 9 8
Déclaration de commercialisation : 19/08/1996
Cette présentation est agréée aux collectivités
Inscription sur la liste de rétrocession au titre de son AMM, selon les conditions précisées au Journal Officiel. Prix de cession publié au Journal Officiel.
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 20/07/2016 | Extension d'indication | Le service médical rendu par TEGELINE est important dans le traitement des poussées aigües de myasthénie. |
| Important | Avis du 27/01/2010 | Extension d'indication | Le service médical rendu par TEGELINE 50 mg/ml est important dans l’extension d’indication aux polyradiculonévrites inflammatoires démyélinisantes chroniques. |
| Important | Avis du 09/05/2007 | Extension d'indication | Le service médical rendu de TEGELINE est important dans la nouvelle indication traitement de la neuropathie motrice multifocale (NMM). |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 20/07/2016 | Extension d'indication | Considérant : • l’expérience clinique rapportée qui souligne l’utilité des immunoglobulines par voie intraveineuse (IgIV) au cours des crises myasthéniques, • les données cliniques limitées (étude de doses) étayant l’utilisation de TEGELINE dans le traitement des poussées aigües de myasthénie, • les données cliniques limitées qui suggèrent une efficacité modeste et comparable à celle des échanges plasmatiques, la Commission considère que TEGELINE n’apporte pas d’amélioration du service médical rendu (ASMR V) dans la prise en charge des poussées aigües de myasthénie. |
| IV (Mineur) | Avis du 27/01/2010 | Extension d'indication | TEGELINE apporte une amélioration du service médical rendu mineure (ASMR IV) dans la prise en charge des patients atteints de polyradiculonévrites inflammatoires démyélinisantes chroniques. |
| II (Important) | Avis du 09/05/2007 | Extension d'indication | La Commission de la Transparence considère que TEGELINE apporte une amélioration du service médical rendu importante (ASMR II) chez les patients ayant une neuropathie motrice multifocale. |
Autres informations
- Titulaire de l'autorisation : LFB-BIOMEDICAMENTS
- Conditions de prescription et de délivrance :
- liste I
- prescription hospitalière
- prescription par un médecin exerçant dans un établissement de transfusion sanguine
- Statut de l'autorisation : Valide
- Type de procédure : Procédure nationale
- Code CIS : 6 917 465 8
ANSM - Mis à jour le : 31/07/2024
TEGELINE 50 mg/mL, poudre et solvant pour solution pour perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Pour 1 mL de solution reconstituée
*correspondant à une quantité totale en protéines, dont au moins 95% sont des IgG.
La poudre a une teneur maximale en IgA de 17mg/g de protéines et contient des traces de pepsine d'origine animale.
Après reconstitution :
· un flacon de 10 mL contient 0,5 g d'immunoglobuline humaine normale,
· un flacon de 50 mL contient 2,5 g d'immunoglobuline humaine normale,
· un flacon de 100 mL contient 5 g d'immunoglobuline humaine normale,
· un flacon de 200 mL contient 10 g d'immunoglobuline humaine normale.
· Distribution des sous-classes d’IgG (valeurs usuelles) :
IgG1 : 50-68%
IgG2 : 27-43%
IgG3 : 2,6-4,2%
IgG4 : 1,7-3,3%
Produit à partir de plasma de donneurs humains.
Excipient à effet notoire : Ce médicament contient du sodium (maximum 0.635 mmol (ou 15 mg) pour 10 mL) ainsi que du saccharose (1 g pour 10 mL).
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre et solvant pour solution pour perfusion.
4.1. Indications thérapeutiques
· Traitement de substitution :
o déficits immunitaires primitifs avec hypogammaglobulinémie ou atteinte fonctionnelle de l'immunité humorale,
o infections bactériennes récidivantes chez l'enfant infecté par le VIH,
o déficits immunitaires secondaires de l’immunité humorale, en particulier :
§ la leucémie lymphoïde chronique ou le myélome, avec hypogammaglobulinémie et associés à des infections à répétition,
§ l'allogreffe de cellules souches hématopoïétiques avec hypogammaglobulinémie associée à une infection.
· Traitement immunomodulateur :
o purpura thrombopénique idiopathique (PTI) chez l'adulte et l’enfant en cas de risque hémorragique important ou avant un acte médical ou chirurgical pour corriger le taux de plaquettes,
o rétinochoroïdite de Birdshot,
o syndrome de Guillain et Barré de l'adulte,
o neuropathie motrice multifocale (NMM),
o polyradiculonévrites inflammatoires démyélinisantes chroniques (PIDC),
o poussées aiguës de myasthénie,
· Maladie de Kawasaki
4.2. Posologie et mode d'administration
La posologie et l'intervalle entre les administrations dépendent de l'usage auquel est destiné le traitement (substitution ou immunomodulation) et de la demi-vie de l’immunoglobuline humaine normale par voie intraveineuse (IgIV) in vivo chez les patients atteints de déficit immunitaire.
Chez les patients obèses ayant un indice de masse corporelle ≥ 30, la dose thérapeutique de TEGELINE administrée en cas d'immunomodulation devra être adaptée au poids maigre afin d'éviter les complications rénales aigües liées à l'augmentation de la pression oncotique et de la viscosité sanguine. Cette mesure ne dispense pas d'une étroite surveillance de la fonction rénale.
Les posologies suivantes sont données à titre indicatif :
· Traitement de substitution en cas de déficit immunitaire primitif :
Le traitement doit avoir pour but d'assurer un taux d'IgG résiduel (c'est-à-dire avant l'administration suivante d’IgIV) d'au moins 6 g/L. La persistance des infections peut amener à respecter un seuil d'IgG résiduel de 8 voire 10 g/L. Après le début d'un traitement par les IgIV, l'équilibre s'effectue en 3 à 6 mois. On peut recommander une dose de charge de 0,4 à 0,8 g/kg selon les circonstances (infection) puis une perfusion de 0,2 g/kg toutes les 3 semaines. Les doses d'IgIV nécessaires pour atteindre un taux résiduel de 6 g/L sont de l'ordre de 0,3 g/kg/mois, avec des extrêmes de 0,2 à 0,8 g/kg/mois. La fréquence de perfusion varie de 15 jours à 1 mois. La survenue d'infections peut nécessiter l'emploi temporaire de perfusions plus fréquentes.
Dans le traitement substitutif des déficits immunitaires primitifs, un dosage des concentrations sériques d'IgG avant chaque perfusion s'avère nécessaire pour contrôler l'activité du traitement et éventuellement ajuster la dose ou l'intervalle d'administration.
· Traitement de substitution en cas de déficit immunitaire secondaire :
On peut recommander une dose de 0,2 à 0,4 g/kg toutes les 3 à 4 semaines, afin d'assurer un taux d'IgG résiduel (c'est-à-dire avant l'injection suivante d'IgIV) d'au moins 4 à 6 g/L.
Le traitement de substitution dans les déficits immunitaires primitifs et secondaires peut être effectué à domicile. L'administration doit être initiée et surveillée par une infirmière ou une personne ayant satisfait à une formation spécifique par l'équipe hospitalière en charge du patient.
· Purpura thrombopénique idiopathique (PTI) :
Pour le traitement d'attaque, 0,8 à 1 g/kg/j au jour 1, éventuellement répété au jour 3, ou 0,4 g/kg/j pendant 2 à 5 jours. Ce traitement peut être renouvelé en cas de réapparition d'une thrombopénie sévère.
· Traitement de la rétinochoroïdite de Birdshot :
La posologie initiale sera de 1,6 g/kg sur 2 à 4 jours toutes les 4 semaines pendant 6 mois. En entretien, 1,2 g/kg sur 2 à 4 jours, toutes les 4 à 10 semaines.
· Syndrome de Guillain et Barré de l'adulte :
0,4 g/kg de poids corporel/jour pendant 5 jours.
· Neuropathie motrice multifocale (NMM) :
Pour le traitement d'attaque, la posologie de 2 g/kg administrée sur 2 à 5 jours et répétée toutes les 4 semaines sera maintenue pendant 6 mois.
Le traitement d'entretien est de 2 g/kg administrés sur 2 à 5 jours. L'intervalle entre les administrations de TEGELINE et la durée du traitement d'entretien seront adaptés au délai individuel de réapparition des symptômes chez les patients.
En l'absence d'effet thérapeutique, le traitement par TEGELINE pourra être arrêté après au minimum 3 mois et au maximum 6 mois de traitement.
· Polyradiculonévrites inflammatoires démyélinisantes chroniques (PIDC) :
La posologie de 2 g/kg administrée sur 5 jours et répétée toutes les 4 semaines sera maintenue
4 mois maximum, en fonction de la réponse au traitement.
L'absence d'effet thérapeutique devra être évaluée à chaque cure et l’arrêt du traitement devra être envisagé après 3 mois de traitement sans effet.
· Traitement des poussées aiguës de myasthénie :
La posologie habituellement recommandée est de 1 g/kg, administrée sur une journée.
· Maladie de Kawasaki :
1,6 à 2,0 g/kg administrés en plusieurs doses réparties sur 2 à 5 jours ou 2 g/kg en dose unique, associées à l'acide acétylsalicylique.
Posologie et mode d’administration
|
Indication |
Posologie |
Rythme des injections |
Traitement associé |
|
Traitement substitutif: |
|
|
|
|
Déficits immunitaires primitifs |
Dose de charge : |
|
|
|
Dose d'entretien : |
Toutes les 2 à 4 semaines pour obtenir un taux résiduel d'IgG d'au moins 6 g/L. La persistance des infections peut amener à respecter un seuil d'IgG résiduel de 8 voire 10 g/L |
|
|
|
Déficits immunitaires secondaires |
0,2 à 0,4 g/kg |
Toutes les 3 à 4 semaines pour obtenir un taux résiduel d'IgG d'au moins 4 à 6 g/L |
|
|
Traitement immuno modulateur : |
|
|
|
|
Purpura thrombopénique idiopathique |
0,8 à 1 g/kg Ou 0,4 g/kg/j |
A J1, éventuellement répété à J3 Pendant 2 à 5 jours |
|
|
Rétinochoroïdite de Birdshot |
Dose initiale : 1,6 g/kg sur 2 à 4 j |
Toutes les 4 semaines pendant 6 mois |
|
|
Dose d'entretien : 1,2 g/kg sur 2 à 4 j |
Toutes les 4 à 10 semaines |
|
|
|
Syndrome de Guillain et Barré de l'adulte |
0,4 g/kg/j |
Pendant 5 jours |
|
|
Neuropathie motrice multifocale (NMM) |
Dose initiale : 2 g/kg sur 2 à 5 j |
Toutes les 4 semaines pendant 6 mois |
|
|
Dose D’entretien : 2 g/kg sur 2 à 5 j |
L'intervalle entre les administrations et la durée du traitement d'entretien seront adaptés au délai individuel de réapparition des symptômes |
|
|
|
Polyradiculonévrites inflammatoires démyélinisantes chroniques (PIDC) |
2 g/kg sur 5 j |
Toutes les 4 semaines pendant 4 mois maximum, en fonction de la réponse au traitement |
|
|
Poussées aiguës de myasthénie |
1 g/kg sur 1 j |
En une dose unique |
|
|
Maladie de Kawasaki |
1,6 à 2,0 g/kg ou 2 g/kg |
En plusieurs doses réparties sur 2 à 5 jours En une dose unique |
Acide acétylsalicylique |
Mode d’administration
TEGELINE se présente sous la forme d'une poudre à reconstituer extemporanément avec de l’eau pour préparations injectables (solvant). Pour les instructions concernant la reconstitution du médicament avant administration, voir la rubrique 6.6.
Les IgIV doivent être exclusivement administrées par voie intraveineuse en une seule fois et immédiatement après reconstitution.
Le débit sera adapté en fonction de la tolérance clinique, sans dépasser un débit de 1 mL/kg/h pendant la première demi-heure, puis en augmentant progressivement sans dépasser 4 mL/kg/h.
Ne pas utiliser de solution présentant un aspect trouble ou contenant un dépôt.
Chez les patients présentant des facteurs de risque d'insuffisance rénale, la dose minimale efficace de TEGELINE devra être administrée et le débit de perfusion devra être réduit. Selon l'indication clinique, les doses de TEGELINE peuvent être fractionnées, en particulier dans les indications où les doses utilisées sont plus élevées, et une prolongation de l'intervalle entre les cures peut être envisagée (voir rubrique 4.4).
Ce médicament est contre-indiqué dans les situations suivantes :
· hypersensibilité aux immunoglobulines humaines, en particulier chez les patients présentant un déficit en IgA et avec des anticorps circulants anti-IgA ;
· hypersensibilité connue à l'un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
Pour l'établissement du diagnostic de neuropathie motrice multifocale (NMM), une expertise clinique préalable devra être réalisée auprès d'un centre de référence labellisé pour les neuropathies périphériques ou les maladies neuromusculaires.
L'initiation du traitement par TEGELINE des polyradiculonévrites inflammatoires démyélinisantes chroniques (PIDC) devra être réalisée après avis d’un centre de référence labellisé pour les neuropathies périphériques ou les maladies neuromusculaires.
Pour l’indication Traitement des poussées aiguës de myasthénie, l’avis d’un centre de référence labellisé pour les neuropathies périphériques ou les maladies neuromusculaires est recommandé, après initiation du traitement.
Certains effets indésirables peuvent être associés au débit d'administration. Le débit recommandé en rubrique 4.2 doit être scrupuleusement observé et les patients doivent rester sous surveillance pendant toute la durée de la perfusion afin de détecter d'éventuels signes d’intolérance.
Le risque de réactions anaphylactiques, voire d’état de choc, est plus fréquent :
· en cas de perfusion intraveineuse rapide (voir rubrique 4.2),
· chez les patients hypo- ou agammaglobulinémiques avec ou sans déficit en IgA et plus particulièrement lors de la première perfusion d’IgIV ou lorsque le dernier traitement par les IgIV remonte à plus de 8 semaines.
Les complications potentielles peuvent être souvent évitées. Il est souhaitable :
· de surveiller attentivement le débit des perfusions ;
· de s’assurer initialement de la tolérance de l’administration des IgIV par une perfusion lente (1 mL/kg/h) ;
· en cas de diabète latent où une glycosurie passagère peut survenir, de diabète ou de régime hypoglucidique, de tenir compte de la teneur en saccharose (2 g/g d’IgG) ;
· de garder les patients sous surveillance pendant toute la durée de la perfusion afin de détecter d’éventuels signes d’intolérance. Le patient doit être maintenu sous observation pendant au moins 20 minutes après la fin de la perfusion. En cas de première perfusion d’IgIV ou d’intervalle prolongé depuis la dernière perfusion, le patient doit être maintenu sous observation pendant au moins 1 heure après la fin de la perfusion, afin de détecter d’éventuels effets indésirables.
En cas de réactions de type allergique ou anaphylactique, il convient d’interrompre immédiatement la perfusion. Le traitement devra dépendre de la sévérité de la réaction. En cas de choc, le traitement symptomatique relatif à l’état de choc devra être instauré.
Chez tous les patients, l'administration de TEGELINE impose :
· une hydratation correcte avant l'initiation de la perfusion de TEGELINE,
· de surveiller la diurèse quotidiennement pendant la cure,
· de mesurer la créatininémie et l'urémie avant de commencer le traitement et pendant la cure,
· d'éviter l'utilisation concomitante de diurétiques de l'anse, ou de médicaments néphrotoxiques (voir rubrique 4.5).
Hypersensibilité
Les vraies réponses allergiques à ce médicament sont rares. Une intolérance aux immunoglobulines peut se développer dans les cas de déficit en IgA où le patient possède des anticorps anti‑IgA.
Les IgIV ne sont pas indiquées chez les patients présentant un déficit spécifique en IgA, lorsque le déficit en IgA est le seul dysfonctionnement à résoudre.
Rarement, les IgIV peuvent entraîner une chute brutale de la pression artérielle associée à une réaction anaphylactique même chez des patients qui ont présenté une bonne tolérance à une administration précédente d’IgIV.
Thromboembolie
Cliniquement, l’existence d’un lien entre l’administration d’IgIV et des réactions thromboemboliques comme infarctus du myocarde, accident vasculaire cérébral, embolie pulmonaire et thrombose veineuse profonde est connue. Ces événements sont probablement liés à une élévation relative de la viscosité sanguine due à un apport important en immunoglobuline chez les patients à risque. Toutes les précautions doivent être prises lors de la prescription de la perfusion d’IgIV chez les patients obèses, chez les patients présentant des facteurs de risque thrombotique préexistants (âge avancé, hypertension, diabète sucré, antécédents de maladie vasculaire ou d’épisodes thrombotiques, patients atteints de troubles thrombotiques héréditaires ou acquis, patients subissant des périodes prolongées d’immobilisation, patients sévèrement hypovolémiques et patients atteints de maladies provoquant une augmentation de la viscosité sanguine).
Chez les patients présentant un risque de réaction thromboembolique, les IgIV doivent être administrées à une dose et un débit de perfusion minimaux.
Insuffisance rénale aiguë
Des cas d'insuffisance rénale aiguë ont été rapportés chez des patients recevant des IgIV. Dans la plupart des cas, des facteurs de risque ont été identifiés, tels une insuffisance rénale pré-existante, un diabète, une hypovolémie, une obésité, la prise concomitante de médicaments néphrotoxiques ou un âge supérieur à 65 ans.
Chez les patients présentant des facteurs de risque d'insuffisance rénale, la dose minimale efficace de TEGELINE devra être administrée à un débit de perfusion minimal. Selon l'indication clinique, les doses de TEGELINE peuvent être fractionnées, en particulier dans les indications où les doses utilisées sont plus élevées, et une prolongation de l'intervalle entre les cures peut être envisagée.
En cas d’insuffisance rénale, l’arrêt de TEGELINE doit être envisagé.
Bien que ces cas de dysfonctionnement rénal et d'insuffisance rénale aiguë aient été associés à l'utilisation de nombreuses spécialités d'immunoglobuline humaine normale contenant différents excipients tels que le saccharose, le glucose et le maltose, celles contenant du saccharose comme stabilisant représentent la plus large part. Aussi, chez les patients à risque, l'utilisation de préparations d'IgIV ne contenant pas ces excipients doit être envisagée. TEGELINE contient du saccharose (voir les excipients ci-dessus).
Méningite aseptique (MA)
Des cas de méningite aseptique ont été rapportés en association avec des traitements par les IgIV.
L’arrêt des IgIV a permis une rémission de la MA, sans séquelles, en quelques jours.
Ce syndrome apparaît généralement entre plusieurs heures et 2 jours après le traitement par IgIV.
Les résultats de tests sur le liquide céphalorachidien sont souvent positifs avec une pléocytose allant jusqu’à plusieurs milliers de cellules par mm3 et composée principalement de cellules de la lignée des granulocytes,associée à une hyperprotéinorachie allant jusqu’à plusieurs centaines de mg/dl. La MA pourrait survenir plus souvent en cas d’administration de doses élevées (2g/kg) d’IgIV
Anémie hémolytique
Les IgIV peuvent contenir des anticorps dirigés contre les groupes sanguins qui pourraient agir en tant qu’hémolysines. Ces anticorps en se fixant in vivo aux érythrocytes du patient, peuvent induire une réaction positive à l’antiglobuline directe (test de Coombs) et, plus rarement, une hémolyse en raison d’une séquestration accrue des érythrocytes. Une anémie hémolytique pourrait apparaître suite à une une hémolyse importante. Une surveillance des signes et des symptômes cliniques d’hémolyse doit être effectuée chez les patients recevant des IgIV. (Voir rubrique 4.8).
Neutropénie/Leucopénie
Une diminution transitoire du nombre de neutrophiles et/ou des épisodes de neutropénie, parfois sévères, ont été rapportés après traitement par IgIV. Cela survient généralement dans les heures ou jours suivant l'administration d'IgIV, et se résorbe spontanément dans les 7 à 14 jours.
Interférence avec des tests sérologiques
Après administration d’immunoglobuline humaine normale, l'augmentation transitoire de la concentration de divers anticorps transférés peut être responsable de sérologies positives temporaires.
Ce médicament contenant des anticorps anti-érythrocytaires, son administration peut être suivie de façon transitoire d'un test de Coombs positif.
Agents transmissibles
Les mesures habituelles de prévention du risque de transmission d’agents infectieux par les médicaments préparés à partir de sang ou de plasma humain comprennent la sélection clinique des donneurs, la recherche des marqueurs spécifiques d’infection sur chaque don et sur les mélanges de plasma ainsi que la mise en oeuvre dans le procédé de fabrication d’étapes efficaces pour l’inactivation/élimination virale. Cependant, lorsque des médicaments préparés à partir de sang ou de plasma humain sont administrés, le risque de transmission d’agents infectieux ne peut pas être totalement exclu. Ceci s’applique également aux virus inconnus ou émergents ou autres types d’agents infectieux.
Les mesures prises sont considérées comme efficaces vis-à-vis des virus enveloppés tels que le VIH, le VHB et le VHC, et vis-à-vis de virus non enveloppés tel que le VHA.
Les mesures prises peuvent être d’efficacité limitée vis-à-vis des virus non-enveloppés tels que le parvovirus B19.
L’expérience clinique ne rapporte pas de transmission du virus de l’hépatite A ni du parvovirus B19 par les immunoglobulines, les anticorps présents contribuant probablement à la sécurité du produit.
Ce médicament contient du sodium et du saccharose
Ce médicament contient au maximum 0.635 mmol (ou 15 mg) de sodium pour 10 mL. A prendre en compte chez les personnes suivant un régime hyposodé strict.
Ce médicament contient 1 g de saccharose pour 10 mL, dont il faut tenir compte dans la ration journalière en cas de régime pauvre en sucre ou de diabète.
A chaque administration de TEGELINE, le nom et le numéro de lot du produit mentionnés sur le flacon doivent être enregistrés afin de maintenir un lien entre le patient et le numéro de lot du médicament.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Utilisation concomitante de médicaments néphrotoxiques
L'utilisation concomitante de médicaments présentant une toxicité rénale augmente le risque d'insuffisance rénale aiguë. Si une telle combinaison est nécessaire pendant le traitement avec l'IgIV, il faut envisager un fractionnement de la dose et un débit de perfusion minimal et il faut assurer une hydratation correcte et le suivi biologique des paramètres rénaux.
Les médicaments ayant un potentiel néphrotoxique sont représentés en particulier par les agents de contraste iodés, les anti-inflammatoires non-stéroïdiens, les aminosides, les organoplatines, de fortes doses de méthotrexate, la ciclosporine, le tacrolimus, certains antiparasitaires tels que la pentamidine ou certains antiviraux tels que le foscarnet, les « ciclovirs ».
En association avec un diurétique de l'anse, le risque d'insuffisance rénale aiguë est augmenté, en particulier lors de l'initiation ou l'augmentation de la posologie d'un traitement par un inhibiteur de l’enzyme de conversion, un antagoniste du récepteur de l'angiotensine II ou un inhibiteur direct de la rénine (voir rubrique 4.4).
Vaccins constitués de virus vivants atténués
L'administration d’immunoglobuline humaine normale peut entraver l'efficacité des vaccins constitués de virus vivants atténués tels que les vaccins contre la rougeole, la rubéole, les oreillons et la varicelle. Après perfusion de ce médicament, attendre au minimum 6 semaines (de préférence 3 mois) avant d'administrer ce type de vaccins.
Si le patient a reçu des vaccins constitués de virus vivants atténués (rougeole, rubéole, oreillons, varicelle) au cours des 2 semaines précédant la perfusion, un contrôle des anticorps protecteurs post-vaccinaux peut être nécessaire en vue d’un éventuel rappel.
4.6. Fertilité, grossesse et allaitement
Grossesse
Aucune étude de reproduction chez l'animal n'a été conduite avec TEGELINE et l'expérience chez la femme enceinte est limitée. Bien qu'aucune réaction indésirable sur le fœtus n'ait été observée, les IgIV ne doivent être administrées chez la femme enceinte qu'en cas de nécessité bien établie.
Allaitement
Les protéines contenues dans les IgIV sont des constituants normaux du plasma humain. Leur passage dans le lait maternel ne doit pas provoquer d'effets indésirables chez le nouveau-né.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil de sécurité
Lors de l’administration intraveineuse d’immunoglobuline humaine normale, des réactions d’intolérance de type frissons, céphalées, sensations vertigineuses, fièvre, vomissements, réactions allergiques, nausées, arthralgies, pression artérielle basse et lombalgies modérées peuvent survenir occasionnellement.
Rarement, les immunoglobulines humaines normales peuvent provoquer une chute brutale de la pression artérielle et, dans des cas isolés, un choc anaphylactique, même si le patient n’a pas présenté de réaction d’hypersensibilité lors d’une administration antérieure.
Des cas de méningite aseptique réversible et de rares cas de réactions cutanées transitoires (y compris de lupus érythémateux cutané - fréquence indéterminée) ont été observés avec l’immunoglobuline humaine normale. Des réactions hémolytiques réversibles ont été observées chez certains patients, en particulier, chez ceux des groupes sanguins A, B et AB. Plus rarement, une anémie hémolytique nécessitant une transfusion pourrait survenir après le traitement par des IgIV à forte dose (voir également rubrique 4.4).
Des cas d’élévation de la créatininémie et/ou d’insuffisance rénale aiguë ont été observés.
Très rarement ont été constatés des événements thromboemboliques tels que : infarctus du myocarde, accident vasculaire cérébral, embolie pulmonaire, thrombose veineuse profonde.
Pour la sécurité relative aux agents transmissibles, voir rubrique 4.4.
Tableau des effets indésirables
Le tableau présenté ci-dessous fait référence à la Classification des Systèmes d’Organes MedDRA (CSO et Terme Préféré (TP)). Ce tableau présente les effets indésirables observés lors de 8 études durant lesquels 533 patients ont été exposés à TEGELINE ainsi que les effets indésirables observés depuis la mise sur le marché.
La fréquence a été évaluée selon la convention suivante : très fréquent (≥1/10) ; fréquent (≥1/100 à <1/10); peu fréquent (≥1/1 000 à <1/100); rare (≥1/10 000 à <1/1 000); très rare (<1/10 000).
La fréquence des effets indésirables observés depuis la mise sur le marché ne peut pas être calculée et apparaît comme fréquence indéterminée.
Fréquence des Effets Indésirables rapportés avec TEGELINE
|
Classification des systèmes d’organes MedDRA CSO |
Effets indésirables (TP) |
Fréquence |
|
Affections hématologiques et du système lymphatique |
Anémie (incluant Anémie normochrome normocytaire), leucopénie, neutropénie, thrombopénie |
Peu fréquent |
|
Hémolyse |
Fréquence indéterminée |
|
|
Affections du système immunitaire |
Hypersensibilité (avec ses symptômes tels que bronchospasme) |
Fréquent |
|
Réaction anaphylactique, choc anaphylactique |
Fréquence indéterminée |
|
|
Affections psychiatriques |
Agitation, anxiété |
Peu fréquent |
|
Affections du système nerveux |
Céphalée |
Très fréquent |
|
Sensation vertigineuse, tremblement |
Peu fréquent |
|
|
Méningite aseptique |
Fréquence indéterminée |
|
|
Affections cardiaques |
Angine de poitrine, angor instable |
Peu fréquent |
|
Affections vasculaires |
Hypertension |
Fréquent |
|
Bouffée congestive, bouffée de chaleur, pâleur, phlébite, crise aiguë d’hypertension |
Peu fréquent |
|
|
Réactions thromboemboliques telles que : embolies pulmonaires, thromboses veineuses et artérielles (profondes et superficielles), accidents vasculaires cérébraux, infarctus du myocarde, coagulation intravasculaire disséminée |
Fréquence indéterminée |
|
|
Hypotension |
Fréquence indéterminée |
|
|
Affections respiratoires, thoraciques et médiastinales |
Dyspnée, sensation de gorge serrée |
Peu fréquent |
|
Affections gastro-intestinales |
Nausée, vomissement |
Fréquent |
|
Douleur abdominale haute, odeur de l’haleine |
Peu fréquent |
|
|
Affections de la peau et du tissu sous-cutané |
Réaction cutanée (incluant érythème, rash, rash érythémateux, rash maculeux, rash maculopapuleux et rash prurigineux) |
Fréquent |
|
Dermatite psoriasiforme, hyperhidrose, prurit, urticaire |
Peu fréquent |
|
|
Réaction eczémateuse* |
Fréquence indéterminée |
|
|
Affections musculo-squelettiques et du tissu conjonctif |
Arthralgie, myalgie |
Peu fréquent |
|
Dorsalgie |
Fréquence indéterminée |
|
|
Affections du rein et des voies urinaires |
Atteinte de la fonction rénale (incluant Insuffisance rénale aiguë et insuffisance rénale) |
Fréquent |
|
Nécrose tubulaire aiguë |
Fréquence indéterminée |
|
|
Troubles généraux et anomalies au site d'administration |
Frissons, hyperthermie, fièvre |
Fréquent |
|
Asthénie, douleur thoracique, dysgueusie, réactions au site d’administration** (incluant inflammation au site du cathéter et lymphangite), sensation de froid, sensation de chaud, syndrome grippal, malaise, douleur |
Peu fréquent |
|
|
Investigations |
Transaminases augmentées, alanine aminotransférase augmentée |
Fréquent |
|
Créatinine sanguine augmentée, pression artérielle augmentée |
Peu fréquent |
* MedDRA LLT
**MedDRA HLGT
Insuffisance rénale
Des cas d’élévation de la créatininémie et/ou d’insuffisance rénale aiguë, avec parfois une nécrose tubulaire aiguë, ont été rapportés, en particulier chez des patients ayant reçu de fortes doses de TEGELINE. Dans la plupart des cas, des facteurs de risque ont été identifiés, comme par exemple une insuffisance rénale préexistante, un diabète sucré, une hypovolémie, un surpoids, de l'hypertension artérielle, une administration concomitante de médicaments néphrotoxiques ou un sujet âgé de plus de 65 ans (voir rubriques 4.4 et 4.5).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Bien qu'aucun cas de surdosage n’ait été rapporté avec TEGELINE, la survenue de certains effets secondaires (voir rubrique 4.8) dose-dépendants pourrait être favorisée : méningite aseptique, insuffisance rénale, hyperviscosité sanguine.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
TEGELINE contient principalement des immunoglobulines G (IgG) présentes chez la population normale.
Ce produit est préparé à partir de pools de plasma provenant d’un minimum de 1000 dons.
Ces IgG présentent un large spectre d'anticorps dirigés contre les agents infectieux, dont les taux peuvent être mis à disposition du corps médical sur demande.
Le respect des fonctions biologiques des immunoglobulines a été validé par un test de la fonction Fc.
Le mécanisme d’action du traitement immunomodulateur des IgIV est multifactoriel, impliquant l’immunité humorale et cellulaire.
Des administrations appropriées de ce médicament sont susceptibles de ramener à une valeur normale un taux anormalement bas d’IgG.
5.2. Propriétés pharmacocinétiques
La demi-vie de TEGELINE, mesurée chez des patients présentant un déficit immunitaire primitif, est de 36,4 ± 16,5 jours. La demi-vie des IgIV est variable en fonction du statut immun du patient.
Les immunoglobulines monomériques solubles et les complexes immuns sont dégradés par le système réticulo-endothélial.
5.3. Données de sécurité préclinique
Les données précliniques ne laissent supposer aucune potentialité mutagène de TEGELINE.
Poudre : saccharose et chlorure de sodium.
Solvant : eau pour préparations injectables.
L’immunoglobuline humaine normale ne doit être mélangée avec aucun autre produit et(ou) médicament.
Après reconstitution, une administration immédiate est recommandée. Toutefois, la stabilité après reconstitution a été démontrée pendant 24 heures.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C et à l'abri de la lumière. Ne pas congeler.
Pour les conditions de conservation du médicament après reconstitution, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
TEGELINE 0,5 g/10 mL : Poudre en flacon (verre de type I) muni d'un bouchon (bromobutyle) et d'une capsule de protection + 10 mL de solvant en flacon (verre de type I) muni d'un bouchon (bromobutyle) et d'une capsule de protection avec un système de transfert et une aiguille filtre - boîte de 1.
TEGELINE 2,5 g/50 mL : Poudre en flacon (verre de type I) muni d'un bouchon (bromobutyle) et d'une capsule de protection + 100 mL de solvant en flacon (verre de type II) muni d'un bouchon (bromobutyle) et d'une capsule de protection avec un kit de reconstitution (seringue de 50 mL, une aiguille-filtre et une prise d’air) ainsi qu’un nécessaire de perfusion muni d'un filtre - boîte de 1.
TEGELINE 5 g/100 mL : Poudre en flacon (verre de type I) muni d'un bouchon (bromobutyle) et d'une capsule de protection + 100 mL de solvant en flacon (verre de type II) muni d'un bouchon (bromobutyle) et d'une capsule de protection avec un système de transfert ainsi qu’un nécessaire de perfusion muni d'un filtre - boîte de 1.
TEGELINE 10 g/200 mL : Poudre en flacon (verre de type I) muni d'un bouchon (bromobutyle) et d'une capsule de protection + 200 mL de solvant en flacon (verre de type II) muni d'un bouchon (bromobutyle) et d'une capsule de protection avec un système de transfert et un nécessaire de perfusion muni d'un filtre - boîte de 1.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Respecter les règles d’asepsie habituelles.
Mode de reconstitution :
TEGELINE 0,5 g/10 mL, 5 g/100 mL et 10 g/200 mL avec le système de transfert:
· Si nécessaire, amener les deux flacons (poudre et solvant) à température ambiante.
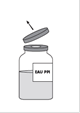
· Retirer la capsule protectrice du flacon de solvant (eau pour préparations injectables) et du flacon de poudre.
· Désinfecter la surface de chaque bouchon.
· Retirer le capuchon protecteur translucide du système de transfert et insérer à fond le biseau ainsi dégagé au centre du bouchon du flacon de solvant en opérant simultanément un mouvement de rotation.
· Retirer le deuxième capuchon protecteur de l'autre extrémité du système de transfert.
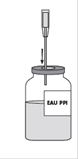
· Maintenir les deux flacons dans une position horizontale (évent vers le haut) et enfoncer rapidement l’extrémité libre du biseau au centre du bouchon du flacon de poudre. Veiller à ce que le biseau soit toujours immergé dans le solvant pour éviter un cassage précoce du vide.
· Placer immédiatement l'ensemble dans une position verticale, flacon de solvant bien au-dessus du flacon de poudre, de façon à permettre le transfert du solvant vers la poudre.
· Pendant le transfert, diriger le jet de solvant sur toute la surface de la poudre. Veiller à ce que la totalité du solvant soit transférée.
· A la fin du transfert, le vide est automatiquement cassé (air stérile).
· Agiter modérément par un mouvement de rotation doux pour éviter la formation de mousse, jusqu'à dissolution complète de la poudre.
· La mise en solution ainsi opérée doit être totale en moins de 30 minutes.
TEGELINE 2,5 g/50 mL avec le kit de reconstitution :
La reconstitution de cette présentation s’effectue avec un flacon de solvant de 100 mL. Seuls 50 mL seront prélevés et utilisés pour la reconstitution du produit à administrer.
· Si nécessaire, amener les deux flacons (poudre et solvant) à température ambiante.
· Retirer la capsule protectrice du flacon de solvant de 100 mL (eau pour préparations injectables).
· Désinfecter la surface du bouchon du flacon de solvant.
· Retirer la prise d’air de son blister puis retirer le capuchon protecteur.
· Enfoncer la prise d’air sur le bord du bouchon du flacon de solvant, en évitant le centre du bouchon.
· Retirer la seringue de 50 mL de son blister.
· Retirer avec précaution l’aiguille-filtre de son blister.
· Retirer avec précaution le capuchon protecteur de l’aiguille-filtre.
· Insérer l’aiguille-filtre sur la seringue de 50 mL.
· Enfoncer, au centre du bouchon du flacon de solvant, l’aiguille-filtre (avec la seringue de 50 mL) en faisant attention à ne pas obstruer l’arrivée de la prise d’air.
· Retourner le flacon de solvant à l’envers puis prélever 50 mL de solvant en tirant le piston de la seringue vers le bas.
· Retirer l’ensemble aiguille-filtre/seringue (remplie de solvant) du flacon de solvant.
· Retirer la capsule protectrice du flacon de poudre.
· Désinfecter la surface du bouchon du flacon de poudre.
· Enfoncer verticalement l’aiguille-filtre de la seringue de 50 mL remplie de solvant, au centre du bouchon du flacon de poudre.
· Appuyer sur le piston de la seringue pour transférer le solvant dans le flacon de poudre. Pendant le transfert, diriger le jet du solvant sur toute la surface de la poudre. Veiller à ce que la totalité du solvant soit transférée dans le flacon de poudre.
· Retirer l’ensemble seringue/aiguille-filtre puis jeter les dans un collecteur adapté aux déchets d’activités de soins à risque infectieux (DASRI).
· Agiter modérément par un mouvement de rotation doux pour éviter la formation de mousse, jusqu'à dissolution complète de la poudre.
· Jeter le flacon de solvant avec le solvant non utilisé de manière appropriée.
· La mise en solution ainsi opérée doit être totale en moins de 30 minutes.
Quel que soit le mode de reconstitution, le produit reconstitué doit être examiné visuellement afin de s'assurer qu'il ne contient pas de particules. La solution reconstituée présente une opalescence plus ou moins prononcée.
Ne pas utiliser de solution présentant un aspect trouble ou contenant un dépôt.
Administration :
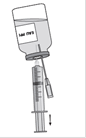
TEGELINE 0,5 g/10 mL : équiper une seringue avec l’aiguille-filtre et aspirer la solution reconstituée.
TEGELINE 2,5 g/50 mL, 5 g/100 mL et 10 g/200 mL : équiper le flacon contenant la solution reconstituée avec le nécessaire de perfusion muni d'un filtre non stérilisant de 15 µm.
Le débit sera adapté en fonction de la tolérance clinique sans dépasser un débit de 1 mL/kg/h pendant la première demi-heure, puis en augmentant progressivement sans dépasser 4 mL/kg/h.
Immédiatement après reconstitution, injecter la solution par voie intraveineuse en une seule fois.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
3, AVENUE DES TROPIQUES
ZA DE COURTABOEUF
91940 LES ULIS
Tél : + 33 (0)1 69 82 70 04
E-mail : infomed@lfb.fr
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 559 897 6 9 : poudre en flacon (verre) + 100 mL de solvant en flacon (verre) avec un kit de reconstitution et un nécessaire de perfusion muni d’un filtre - boîte de 1.
· 34009 559 898 2 0 : poudre en flacon (verre) + 100 mL de solvant en flacon (verre) avec un système de transfert et un nécessaire de perfusion muni d’un filtre - boîte de 1.
· 34009 559 899 9 8 : poudre en flacon (verre) + 200 mL de solvant en flacon (verre) avec un système de transfert et un nécessaire de perfusion muni d’un filtre - boîte de 1.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM.
Liste I.
Médicament soumis à prescription hospitalière. La prescription par un médecin exerçant dans un établissement de transfusion sanguine autorisé à dispenser des médicaments aux malades qui y sont traités est également autorisée.
Agréé collectivités.
ANSM - Mis à jour le : 31/07/2024
TEGELINE 50 mg/mL, poudre et solvant pour solution pour perfusion
Immunoglobuline humaine normale
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
2. Quelles sont les informations à connaître avant d'utiliser TEGELINE 50 mg/mL, poudre et solvant pour solution pour perfusion ?
3. Comment utiliser TEGELINE 50 mg/mL, poudre et solvant pour solution pour perfusion ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver TEGELINE 50 mg/mL, poudre et solvant pour solution pour perfusion ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE TEGELINE 50 mg/mL, poudre et solvant pour solution pour perfusion ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC : J06BA02.
TEGELINE contient des anticorps.
TEGELINE appartient à la classe de médicaments appelée immunoglobulines. Ces médicaments contiennent des anticorps humains, produits par le système immunitaire.
Les anticorps humains contenus dans TEGELINE aident votre corps à lutter contre les infections ou à équilibrer votre système immunitaire.
Dans le cas où vous ne pouvez pas avoir assez d'anticorps, les anticorps fournis par TEGELINE peuvent se substituer aux anticorps manquants. Les anticorps de TEGELINE étant isolés à partir de plasma humain fonctionnent exactement comme s'il s'agissait de vos propres anticorps.
Ce type de médicament peut également être utilisé si votre système immunitaire est déséquilibré et que vous avez besoin d’anticorps supplémentaires dans le cas de certains troubles inflammatoires (maladie auto-immune). TEGELINE vous apporte ces anticorps.
TEGELINE est utilisé chez les patients n’ayant pas assez d’anticorps dans leur sang et notamment chez 3 types de patients :
1. Chez les patients qui souffrent d’un déficit congénital en anticorps, nommé déficit immunitaire primitif, avec hypogammaglobulinémie (défaut de production d’anticorps) ou atteinte fonctionnelle de l’immunité humorale (anomalie du fonctionnement des anticorps).
2. Chez les patients qui souffrent d’un déficit immunitaire secondaire (lié à une autre maladie) tel que :
· la leucémie lymphoïde chronique ou le myélome,
· l’allogreffe de cellules souches hématopoïétiques (greffe de cellules de moelle osseuse à l’origine des globules rouges, des globules blancs et des plaquettes), avec défaut de production d’anticorps (hypogammaglobulinémie) et associé à des infections à répétitions.
3. Chez les enfants qui souffrent fréquemment d’infections en raison d'une infection par le virus du SIDA.
TEGELINE est également utilisé chez les patients ayant un déséquilibre dans leur système immunitaire ou troubles inflammatoires (maladie auto-immune), comme traitement immunomodulateur notamment chez plusieurs types de patients :
1. Chez les patients n’ayant pas assez de plaquettes sanguines (purpura thrombopénique idiopathique, PTI) :
· et qui ont un risque élevé de saignement (hémorragie),
· ou qui doivent subir une opération chirurgicale dans un futur proche.
2. Chez les patients qui ont une maladie de l’œil avec des taches blanchâtres ou jaunâtres au niveau du fond d'œil (rétinochoroïdite de Birdshot).
3. Chez les patients qui souffrent d’une maladie associée à de multiples inflammations des nerfs périphériques (syndrome de Guillain Barré de l’adulte et polyradiculonévrite inflammatoire démyélinisante chronique).
4. Chez les patients qui ont une maladie des nerfs avec des crampes ou des tremblements (neuropathie motrice multifocale).
5. Chez les patients qui ont une maladie de la jonction entre les nerfs et les muscles, lors d’une poussée aiguë (poussées aiguës de myasthénie).
6. Chez les patients qui souffrent d’une maladie aiguë provoquant une inflammation touchant les vaisseaux de plusieurs organes du corps (maladie de Kawasaki).
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER TEGELINE 50 mg/mL, poudre et solvant pour solution pour perfusion ?
N’utilisez jamais TEGELINE 50 mg/mL, poudre et solvant pour solution pour perfusion :
· si vous êtes allergique (hypersensible) à certains anticorps humains (immunoglobuline humaine) ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· si vous n’avez pas assez d’anticorps appelés Ig A dans votre sang, il se peut que votre corps produise des anticorps que l’on appelle anti-Ig A et qui s’attaquent aux anticorps Ig A. Cette attaque peut alors produire une réaction allergique. Comme TEGELINE contient une faible quantité d’Ig A, vous risquez de faire une allergie.
Afin de prévenir tout risque d’allergie, référez-vous à la rubrique intitulée Surveillance lors de l'administration de TEGELINE.
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien ou votre infirmier/ère avant d’utiliser TEGELINE.
Le médecin adaptera la posologie de TEGELINE et le débit de perfusion en fonction de votre maladie initiale mais aussi en fonction de votre poids corporel, votre état de santé (hydratation, fonction des reins, maladies concomitantes, effets indésirables éventuels) et des autres médicaments que vous prenez. Informez votre médecin de tous les médicaments pris et des maladies que vous présentez ou avez présentées.
En fonction de l’indication de ce médicament, votre médecin sera amené à demander l’avis d’un centre de référence labellisé avant de débuter le traitement (notamment si vous souffrez d’une neuropathie motrice multifocale ou d’une polyradiculonévrite inflammatoire démyélinisante chronique) ou après avoir débuté le traitement (notamment si vous avez souffert de poussées aiguës de myasthénie).
Surveillance lors de l’administration de TEGELINE :
Pour éviter le risque de réaction, le médecin contrôlera le débit de la perfusion et l’adaptera à votre cas. Durant la perfusion, votre médecin mettra en place une surveillance médicale afin de détecter d’éventuels signes d’allergie ou la survenue d’autres réactions.
Pour éviter tout risque de réaction, TEGELINE vous sera administré d’abord lentement et vous devrez rester sous la surveillance d’un médecin ou d’une infirmière :
· durant toute la perfusion et pendant au moins une heure après la fin de la perfusion, si vous possédez une faible quantité d’anticorps dans votre sang, si vous n’avez jamais reçu ce médicament auparavant ou si la dernière perfusion a été effectuée il y a plus de 8 semaines,
· durant toute la perfusion et pendant au moins 20 minutes après la fin de la perfusion si vous avez reçu ce médicament récemment.
Si des signes d’allergies apparaissent, référez-vous à la Rubrique 4. pour connaître la conduite à tenir.
En cas de doute, vous devez appeler immédiatement votre médecin ou votre infirmière.
En fonction de votre réaction allergique, le médecin pourra décider de diminuer le débit de votre perfusion ou de l’arrêter. Il pourra également mettre en place un traitement de l’allergie s’il le juge nécessaire.
Groupes particuliers de patients :
Ce médicament peut provoquer ou aggraver une maladie des reins (insuffisance rénale aiguë), ou une maladie du cœur et des vaisseaux sanguins (infarctus, accident vasculaire cérébral, embolie pulmonaire, ou thrombose veineuse profonde).
Les patients déjà atteints par une maladie ou qui présentent certains facteurs de risque doivent faire attention en utilisant ce médicament.
De ce fait, votre médecin surveillera vos reins et/ou votre cœur et vos vaisseaux sanguins:
· si vous avez déjà une maladie des reins (insuffisance rénale),
· si vous prenez certains médicaments qui peuvent être dangereux pour vos reins,
· si vous avez un taux de sucre élevé (diabète),
· si vous avez un volume de sang insuffisant dans le corps (hypovolémie),
· si vous avez un poids trop élevé (obésité),
· si vous êtes âgé(e) de plus de 65 ans,
· si vous suivez un régime hypoglucidique (régime pauvre en sucres),
· si vous avez déjà une affection cardiaque ou des vaisseaux sanguins,
· si vous avez déjà une tension élevée (hypertension artérielle),
· si vous êtes immobilisé sur une longue période,
· si vous avez une maladie augmentant la viscosité sanguine.
Si vous présentez un des facteurs de prédisposition mentionné ci-dessus, l’utilisation de ce médicament peut diminuer le fonctionnement de vos reins. Pour prévenir ce risque, le médecin devra prévoir :
· une hydratation correcte avant l'administration de TEGELINE,
· de surveiller quotidiennement la diurèse (volume d'urine émis par 24 heures),
· de doser votre taux de créatinine sérique et votre taux d’urée sanguin (mesure du fonctionnement du rein),
· d'éviter d'associer certains médicaments diurétiques et certains médicaments qui sont toxiques pour les reins.
Ce risque étant le plus souvent rencontré avec des préparations contenant du sucre (saccharose, glucose et maltose), le médecin devra également envisager d’utiliser une autre préparation ne contenant pas de sucre.
Enfants
Sans objet
Autres médicaments et TEGELINE 50 mg/mL, poudre et solvant pour solution pour perfusion
Informez votre médecin ou votre pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
Effets sur les vaccins :
L’utilisation d’immunoglobulines comme TEGELINE peut atténuer l’efficacité des vaccins constitués de virus vivants atténués tels que les vaccins contre la rougeole, la rubéole, les oreillons et la varicelle.
Après administration de TEGELINE, il convient d’attendre au minimum 6 semaines (de préférence 3 mois) avant d’administrer ces vaccins.
Si vous avez reçu ce type de vaccin au cours des 2 semaines qui précédent l’injection de TEGELINE, informez-en votre médecin, un contrôle des anticorps peut être nécessaire en vue d’un éventuel rappel de ce vaccin.
Effets sur les tests sanguins :
Certains anticorps contenus dans TEGELINE peuvent fausser les résultats des tests d’un bilan sanguin. Si votre médecin ou la personne qui prélève votre sang ne sait pas que vous avez reçu TEGELINE, prévenez le ou la avant de faire ce test sanguin.
Sans objet.
Grossesse et allaitement
Par mesure de précaution, TEGELINE devra être utilisé avec prudence durant la grossesse et uniquement en cas de nécessité.
Cependant, l’utilisation de ce médicament n’a pas montré d’effet nocif sur le déroulement de la grossesse, sur le fœtus ou le nouveau-né.
Par mesure de précaution, TEGELINE devra être utilisé avec prudence durant l’allaitement.
Cependant, les substances actives contenues dans TEGELINE sont des composants normaux du sang humain. Le passage de ces substances dans le lait maternel ne doit pas provoquer d’effets indésirables chez le nouveau-né.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
Aucun effet sur l’aptitude à conduire des véhicules et à utiliser des machines n’a été observé. Par conséquent, les mesures de prudence habituelles sont recommandées si vous devez conduire un véhicule ou utiliser une machine.
TEGELINE 50 mg/mL, poudre et solvant pour solution pour perfusion contient du sodium
Ce médicament contient au maximum 15 mg de sodium pour 10 mL. A prendre en compte chez les patients contrôlant leur apport alimentaire en sodium. Ce médicament contient 1 g de saccharose pour 10 mL, dont il faut tenir compte dans la ration journalière en cas de régime pauvre en sucre ou de diabète.
Informations sur les mesures de sécurité liées à l'origine de TEGELINE:
TEGELINE est fabriqué à partir de plasma humain (c’est la partie liquide du sang).
Lorsque des médicaments sont préparés à partir de sang ou de plasma humain, des mesures de prévention de la transmission d’agents infectieux sont mises en place. Celles-ci comprennent :
· une sélection soigneuse des donneurs de sang et de plasma de façon à exclure les donneurs risquant d’être porteurs d’infections,
· le contrôle de chaque don et des mélanges de plasma pour la présence de virus/d’infection,
· la mise en œuvre d’un procédé de fabrication comprenant des étapes capables d’éliminer ou d’inactiver les virus.
Cependant, lorsque des médicaments préparés à partir de sang ou de plasma humain sont administrés, le risque de transmission de maladies infectieuses ne peut être totalement exclu. Ceci s’applique également à tous les virus inconnus ou émergents ou autres types d’agents infectieux.
Les mesures prises sont considérées comme efficaces vis-à-vis des virus enveloppés tels que le VIH, le VHB et le VHC, et vis-à-vis de virus non enveloppés tel que le VHA.
Les mesures prises peuvent être d’efficacité limitée vis-à-vis des virus non-enveloppés tels que le parvovirus B19.
Les immunoglobulines humaines normales ne sont pas associées aux infections par le virus de l’hépatite A et le parvovirus B19, probablement grâce aux anticorps protecteurs présents dans ce produit.
A chaque administration de TEGELINE, le nom et le numéro de lot du produit mentionnés sur le flacon doivent être enregistrés afin de maintenir un lien entre le patient et le numéro de lot du médicament.
3. COMMENT UTILISER TEGELINE 50 mg/mL, poudre et solvant pour solution pour perfusion ?
A l’hôpital
TEGELINE peut être administré à l’hôpital par un médecin ou une infirmière, par une administration veineuse (perfusion dans la veine). Une surveillance sera mise en place pour éviter tout risque d’allergie ou effet indésirable (voir rubrique 2).
A votre domicile
Le traitement de substitution dans les déficits immunitaires primitifs et secondaires peut être effectué à domicile.
Dans ce cas, le traitement devra être initié par une infirmière ou une personne formée par l’équipe qui s’occupait de vous à l’hôpital.
Posologie
La dose et la fréquence d’administration sont déterminées par votre médecin en fonction de votre maladie. Elles peuvent également varier en fonction de votre état de santé actuel et de votre poids.
Mode d’administration
Avant l’injection, ce médicament est préparé par un professionnel de santé. Ce médicament est ensuite injecté dans les veines par perfusion.
Pendant la première demi-heure, le débit de la perfusion sera lent. Il pourra être augmenté progressivement si l’administration se déroule sans effet indésirable.
La préparation et la méthode d’administration de TEGELINE sont incluses à la fin de cette notice dans la partie réservée aux professionnels de santé.
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
Si vous avez utilisé plus de TEGELINE 50 mg/mL, poudre et solvant pour solution pour perfusion que vous n’auriez dû :
Bien qu'aucun cas de surdosage n'ait été rapporté avec TEGELINE, la survenue de certains effets secondaires (voir rubrique 4) dose-dépendants pourraient être favorisés : une infection (méningite), une insuffisance rénale (anomalie de la fonction rénale), une hyperviscosité sanguine (épaississement du sang).
Consultez immédiatement votre médecin ou votre pharmacien.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Risque de réactions allergiques
L’utilisation de ce médicament peut provoquer une réaction allergique. Dans certains cas, ces réactions peuvent devenir sérieuses.
Les signes d’alerte de réactions allergiques sont les suivants :
· gonflement du visage ou de la gorge,
· sensation de brûlure et de démangeaisons au site de perfusion,
· frissons,
· rougeur,
· démangeaisons et rash (éruptions de la peau),
· pression artérielle basse (hypotension),
· fatigue extrême (léthargie),
· nausées, vomissements,
· agitation,
· rythme cardiaque rapide,
· gêne thoracique,
· fourmillements,
· sifflements respiratoires (de type asthme).
Si l’une de ces réactions survient, vous devez appeler immédiatement un médecin qui, en fonction de la nature et de la sévérité de la réaction, arrêtera immédiatement le traitement avec TEGELINE et/ou mettra en place un traitement approprié.
Caillots de sang
Des caillots de sang peuvent se former dans la circulation sanguine. Cela peut se manifester par :
· une crise cardiaque. Les signes d’alerte sont une douleur soudaine à la poitrine ou un essoufflement.
· un accident vasculaire cérébral. Les signes d’alerte sont l'apparition soudaine d'une faiblesse musculaire, une perte de sensation et/ou d’équilibre, une diminution de la vigilance ou une difficulté à parler.
· une affection grave appelée embolie pulmonaire. Les signes avant-coureurs sont une douleur dans la poitrine, une difficulté à respirer ou une toux avec crachats de sang.
· un caillot dans une veine (thrombose veineuse). Les signes d’alerte sont une rougeur, une sensation de chaleur, une douleur, une sensibilité, ou un gonflement de l’une ou de deux jambes.
Si l’une de ces réactions survient, vous devez appeler immédiatement un médecin qui, en fonction de la nature et de la sévérité de la réaction, arrêtera immédiatement le traitement avec TEGELINE et/ou mettra en place un traitement approprié.
Insuffisance rénale
Chez des patients recevant une forte dose de TEGELINE, il a été observé des cas d’élévation de la créatinémie et/ou d’insuffisance rénale aiguë, avec parfois une destruction des tubules rénaux. Ces effets sont plus à même de se produire chez les patients présentant les facteurs de risques suivants : insuffisance rénale préexistante, diabète sucré, hypovolémie, surpoids, hypertension, prise dans le même temps de médicaments toxiques pour le rein, âge supérieur à 65 ans.
Les effets indésirables suivants surviennent très fréquemment (plus d’1 patient sur 10)
· Mal de tête
Les effets indésirables suivants surviennent fréquemment (chez un maximum d’1 patient sur 10)
· Hypersensibilité avec bronchospasmes (symptômes proches de l’asthme),
· Pression artérielle élevée (hypertension),
· Nausées, vomissements,
· Réactions de la peau (diverses formes de rashs),
· Maladie du rein qui peut être aiguë (Insuffisance rénale),
· Frissons, fièvre,
· Augmentation des enzymes du foie.
Les effets indésirables suivants surviennent peu fréquemment (chez un maximum d’un patient sur 100)
· Diminution du nombre de cellules sanguines (globules rouges, globules blancs, polynucléaires neutrophiles ou plaquettes),
· Agitation, anxiété,
· Vertiges, tremblements,
· Angine de poitrine,
· Bouffée de chaleur, pâleur, phlébite (formation d’un caillot dans une veine), crise aiguë d’hypertension,
· Difficultés à respirer, sensation de gorge serrée,
· Dermatite de type psoriasis, transpiration excessive, prurit, urticaire,
· Douleur aux articulations, aux muscles,
· Altération du goût (dysgueusie),
· Douleur dans différentes localisations, douleur à la poitrine,
· Fatigue, malaise, sensation de chaud ou de froid, syndrome pseudo-grippal,
· Réaction liée à la perfusion (inflammation des vaisseaux lymphatiques (lymphangite), inflammation au site du cathéter,
· Augmentation du taux de créatinine dans le sang (test sanguin montrant une altération des fonctions des reins),
· Augmentation de la pression artérielle.
Les effets indésirables suivants n’ont pas de fréquences déterminées (ne peuvent être estimées sur la base des données disponibles)
· Diminution du nombre de globules rouges dans le sang par destruction et/ou une destruction des globules rouges,
· Réaction anaphylactique ou choc anaphylactique (sensation d’étourdissement ou de malaise en vous levant, mains et pieds froids, douleurs de poitrine ou rythme cardiaque semblant anormal, vision floue),
· Caillots de sang (voir également la rubrique «caillots de sang»),
· Diminution de la tension (hypotension),
· Douleur au ventre, odeur de l’haleine,
· Réaction cutanée de type eczéma,
· Douleur au dos,
· Destruction des cellules du rein,
· Inflammation des méninges (méningite aseptique réversible).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER TEGELINE 50 mg/mL, poudre et solvant pour solution pour perfusion ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte et le flacon. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas 25°C et à l’abri de la lumière. Ne pas congeler.
Après reconstitution, une utilisation immédiate est recommandée.
Ne pas utiliser de solution présentant un aspect non homogène ou contenant un dépôt.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien ou votre infirmier/ère d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient TEGELINE 50 mg/mL, poudre et solvant pour solution pour perfusion
· La substance active est :
· Immunoglobuline humaine normale................................................................................... 50 mg*
Pour 1 mL de solution reconstituée
*correspondant à une quantité totale en protéines dont au moins 95% sont des IgG.
La poudre a une teneur maximale en IgA de 17mg/g de protéines et contient des traces de pepsine d'origine animale.
Après reconstitution :
o un flacon de 10 mL contient 0,5 g d'immunoglobuline humaine normale,
o un flacon de 50 mL contient 2,5 g d'immunoglobuline humaine normale,
o un flacon de 100 mL contient 5 g d'immunoglobuline humaine normale,
o un flacon de 200 mL contient 10 g d'immunoglobuline humaine normale.
Distribution des sous-classes d’IgG (valeurs usuelles) :
IgG1 : 50-68%
IgG2 : 27-43%
IgG3 : 2,6-4,2%
IgG4 : 1,7-3,3%
· Les autres composants sont :
Poudre : saccharose et chlorure de sodium.
Solvant : eau pour préparations injectables.
TEGELINE se présente sous forme d'une poudre et d'un solvant pour solution pour perfusion (10 mL, 100 mL ou 200 mL) en flacons de verre avec :
· un système de transfert pour la reconstitution de TEGELINE 0,5 g/10 mL, 5 g/100 mL et 10 g/200 mL ou un kit de reconstitution (seringue de 50 mL, aiguille-filtre et prise d’air) pour la reconstitution de TEGELINE 2,5 g/50 mL.
· une aiguille filtre pour l’administration de TEGELINE 0,5 g/10 mL ou un nécessaire de perfusion muni d’un filtre pour l’administration de TEGELINE 2,5 g/50 mL, 5g /100 mL et 10g /200 mL.
Toutes les présentations de TEGELINE peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
3, AVENUE DES TROPIQUES
ZA DE COURTABOEUF
91940 LES ULIS
Exploitant de l’autorisation de mise sur le marché
3, AVENUE DES TROPIQUES
ZA DE COURTABOEUF
91940 LES ULIS
3, AVENUE DES TROPIQUES
ZA DE COURTABOEUF
91940 LES ULIS
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
{MM/AAAA}>< {mois AAAA}
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé:
Les posologies suivantes sont données à titre indicatif :
· Traitement de substitution en cas de déficit immunitaire primitif :
Le traitement doit avoir pour but d’assurer un taux d’immunoglobulines G résiduel (c’est-à-dire avant l’administration suivante de TEGELINE) d’au moins 6 g/L. La persistance des infections peut amener à respecter un seuil d'IgG résiduel de 8, voire 10 g/L. Après le début d’un traitement par TEGELINE, l’équilibre s’effectue en 3 à 6 mois. On peut recommander une dose de charge de 0,4 à 0,8 g/kg selon les circonstances (infection) puis une perfusion de 0,2 g/kg toutes les 3 semaines. Les doses de TEGELINE nécessaires pour atteindre un taux résiduel de 6 g/L sont de l’ordre de 0,3 g/kg/mois avec des extrêmes de 0,2 à 0,8 g/kg/mois. La fréquence de perfusion varie de 15 jours à 1 mois. La survenue d’infections peut nécessiter l’emploi temporaire de perfusions plus fréquentes. Dans le traitement substitutif des déficits immunitaires primitifs, un dosage des concentrations sériques d’immunoglobulines G avant chaque perfusion s’avère nécessaire pour contrôler l’activité du traitement et éventuellement ajuster la dose ou l’intervalle d’administration.
· Traitement de substitution en cas de déficit immunitaire secondaire :
On peut recommander une dose de 0,2 à 0,4 g/kg toutes les 3 à 4 semaines afin d'assurer un taux d'IgG résiduel (c'est-à-dire avant l'injection suivante d'IgIV) d'au moins 4 à 6 g/L.
Le traitement de substitution dans les déficits immunitaires primitifs et secondaires peut être effectué à domicile. L'administration doit être initiée et surveillée par une infirmière ou une personne ayant satisfait à une formation spécifique par l'équipe hospitalière en charge du patient.
· Purpura thrombopénique idiopathique (PTI) :
Pour le traitement d’attaque, 0,8 à 1 g/kg/j au jour 1, éventuellement répété au jour 3, ou 0,4 g/kg/j pendant 2 à 5 jours. Ce traitement peut être renouvelé en cas de réapparition d’une thrombopénie sévère (diminution importante du nombre de plaquettes dans le sang).
· Traitement de la rétinochoroïdite de Birdshot :
La posologie initiale sera de 1,6 g/kg sur 2 à 4 jours toutes les 4 semaines pendant 6 mois. En entretien, 1,2 g/kg sur 2 à 4 jours, toutes les 4 à 10 semaines.
· Syndrome de Guillain et Barré de l'adulte :
0,4 g/kg de poids corporel/jour pendant 5 jours.
· Neuropathie motrice multifocale (NMM) :
Pour le traitement d'attaque, la posologie de 2 g/kg administrée sur 2 à 5 jours et répétée toutes les 4 semaines sera maintenue pendant 6 mois.
Le traitement d'entretien est de 2 g/kg administrés sur 2 à 5 jours. L'intervalle entre les administrations de TEGELINE et la durée du traitement d'entretien seront adaptés au délai individuel de réapparition des symptômes chez les patients.
En l'absence d'effet thérapeutique, le traitement par TEGELINE pourra être arrêté après au minimum 3 mois et au maximum 6 mois de traitement.
· Polyradiculonévrites inflammatoires démyélinisantes chroniques (PIDC) :
Pour le traitement d'attaque, la posologie de 2 g/kg administrée sur 5 jours et répétée toutes les 4 semaines sera maintenue pendant 4 mois maximum, en fonction de la réponse au traitement.
L'absence d'effet thérapeutique devra être évaluée à chaque cure et l’arrêt du traitement devra être envisagé après 3 mois de traitement sans effet.
· Traitement des poussées aiguës de myasthénie :
La posologie habituellement recommandée est de 1 g/kg, administrée sur une journée.
· Maladie de Kawasaki :
1,6 à 2,0 g/kg administrés en plusieurs doses réparties sur 2 à 5 jours ou 2 g/kg en dose unique, associées à l'acide acétylsalicylique.
Posologie et mode d’administration :
|
Indication |
Posologie |
Rythme des injections |
Traitement associé |
|
Traitement substitutif : |
|
|
|
|
Déficits immunitaires primitifs |
Dose de charge : |
|
|
|
Dose d'entretien : |
Toutes les 2 à 4 semaines pour obtenir un taux résiduel d'IgG d'au moins 6 g/L. La persistance des infections peut amener à respecter un seuil d'IgG résiduel de 8 voire 10 g/L |
|
|
|
Déficits immunitaires secondaires |
0,2 à 0,4 g/kg |
Toutes les 3 à 4 semaines pour obtenir un taux résiduel d'IgG d'au moins |
|
|
Traitement immuno modulateur : |
|
|
|
|
Purpura thrombopénique idiopathique |
0,8 à 1 g/kg |
A J1, éventuellement répété à J3
|
|
|
Rétinochoroïdite de Birdshot |
Dose initiale : |
Toutes les 4 semaines pendant 6 mois
|
|
|
Dose d'entretien :
|
Toutes les 4 à 10 semaines |
|
|
|
Syndrome de Guillain et Barré de l'adulte |
0,4 g/kg/j |
Pendant 5 jours |
|
|
Neuropathie motrice multifocale (NMM) |
Dose initiale : |
Toutes les 4 semaines pendant 6 mois
|
|
|
Dose d’entretien : |
L'intervalle entre les administrations et la durée du traitement d'entretien seront adaptés au délai individuel de réapparition des symptômes
|
|
|
|
Polyradiculonévrites inflammatoires démyélinisantes chroniques (PIDC) |
2 g/kg sur 5 j |
Toutes les 4 semaines pendant 4 mois maximum, en fonction de la réponse au traitement |
|
|
Poussées aiguës de myasthénie |
1 g/kg sur 1 j |
En une dose unique |
|
|
Maladie de Kawasaki |
1,6 à 2,0 g/kg |
En plusieurs doses réparties sur 2 à 5 jours |
Acide acétylsalicylique |
TEGELINE se présente sous la forme d’une poudre à reconstituer extemporanément avec de l’eau pour préparations injectables (solvant).
Respecter les règles d'asepsie habituelles.
Modes de reconstitution :
· TEGELINE 0,5 g/10 mL, 5 g/100 mL et 10 g/200 mL
|
|
Si nécessaire, amener les deux flacons (poudre et solvant) à température ambiante. |
|
|
Retirer la capsule protectrice du flacon de solvant (eau pour préparations injectables) et du flacon de poudre. Désinfecter la surface de chaque bouchon. |
|
|
Retirer le capuchon protecteur translucide du système de transfert et insérer à fond le biseau, ainsi dégagé, au centre du bouchon du flacon de solvant en opérant simultanément un mouvement de rotation. |
|
|
Retirer le deuxième capuchon protecteur de l'autre extrémité du système de transfert. Maintenir les deux flacons dans une position horizontale (évent vers le haut) et enfoncer rapidement l’extrémité libre du biseau au centre du bouchon du flacon de poudre. Veiller à ce que le biseau soit toujours immergé dans le solvant pour éviter un cassage précoce du vide. |
|
|
Placer immédiatement l'ensemble dans une position verticale, flacon de solvant bien au-dessus du flacon de poudre, de façon à permettre le transfert du solvant vers la poudre. Pendant le transfert, diriger le jet de solvant sur toute la surface de la poudre. Veiller à ce que la totalité du solvant soit transférée. A la fin du transfert, le vide est automatiquement cassé (air stérile). |
|
Retirer le flacon vide (solvant) avec le système de transfert puis jeter le dans le collecteur adapté aux déchets d’activités de soin à risque infection (DASRI).
Agiter modérément par un mouvement de rotation doux pour éviter la formation de mousse, jusqu'à dissolution complète de la poudre. |
· TEGELINE 2,5 g/50 mL
|
La reconstitution de cette présentation s’effectue avec un flacon de solvant de 100 mL. Seuls 50 mL seront prélevés et utilisés pour la reconstitution du produit à administrer.
|
|
|
|
Si nécessaire, amener les deux flacons (poudre et solvant) à température ambiante.
|
|
|
Retirer la capsule protectrice du flacon de solvant de 100 mL (eau pour préparations injectables).
Désinfecter la surface du bouchon du flacon de solvant.
|
|
|
Retirer la prise d’air de son blister puis retirer le capuchon protecteur.
Enfoncer la prise d’air sur le bord du bouchon du flacon de solvant, en évitant le centre du bouchon. |
|
|
Retirer la seringue de 50 mL de son blister.
Retirer avec précaution l’aiguille-filtre de son blister.
Retirer avec précaution le capuchon protecteur de l’aiguille-filtre.
Insérer l’aiguille-filtre sur la seringue de 50 mL.
|
|
|
Enfoncer, au centre du bouchon de flacon de solvant, l’aiguille-filtre (avec la seringue de 50 mL) en faisant attention de ne pas obstruer l’arrivée de la prise d’air.
Retourner le flacon de solvant à l’envers puis prélever 50 mL de solvant en tirant le piston de la seringue vers le bas.
Retirer l’ensemble aiguille-filtre /seringue (remplie de solvant) ainsi que la prise d’air du flacon de solvant.
|
|
|
Retirer la capsule protectrice du flacon de poudre.
Désinfecter la surface du bouchon du flacon de poudre.
|
|
|
Enfoncer verticalement l’aiguille-filtre de la seringue de 50 mL remplie de solvant, au centre du bouchon du flacon de poudre.
Appuyer sur le piston de la seringue pour transférer le solvant dans le flacon de poudre. Pendant le transfert, diriger le jet du solvant sur toute la surface de la poudre. Veillez à ce que la totalité du solvant soit transférée dans le flacon de poudre. Retirer l’ensemble seringue/aiguille-filtre puis jeter l’ensemble dans un collecteur adapté aux déchets d’activités de soins à risque infectieux (DASRI).
|
|
|
Agiter modérément par un mouvement de rotation doux pour éviter la formation de mousse, jusqu'à dissolution complète de la poudre.
Jeter le flacon de solvant avec le solvant non utilisé de manière appropriée. |
Précautions particulières de manipulation et d’élimination quel que soit le mode de reconstitution :
· Le produit reconstitué doit être examiné à l’œil, afin de s’assurer qu’il ne contient pas de particules.
· La solution reconstituée présente une opalescence plus ou moins prononcée.
· Ne pas utiliser de solution présentant un aspect non homogène ou contenant un dépôt.
· Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Administration :
· TEGELINE 0,5 g/10 mL : équiper une seringue avec l’aiguille-filtre et aspirer la solution reconstituée.
· TEGELINE 2,5 g/50 mL, 5g /100 mL et 10g /200 mL : équiper le flacon contenant la solution reconstituée avec le nécessaire de perfusion muni d’un filtre non stérilisant de 15 µm.
Le débit sera adapté en fonction de la tolérance clinique, sans dépasser un débit de 1 mL/kg/h pendant la première demi-heure, puis en augmentant progressivement sans dépasser 4 mL/kg/h.
Immédiatement après reconstitution, injecter la solution par voie intraveineuse en une seule fois (à noter que compte tenu de la stabilité après reconstitution, la perfusion pourrait être effectuée dans les 24 heures).
Conservation après reconstitution :
Après reconstitution, une administration immédiate est recommandée. Toutefois, la stabilité après reconstitution a été démontrée pendant 24 heures.
Informations importantes
Les informations importantes disponibles pour ce médicament sont les suivantes :
- Point de situation des approvisionnements des médicaments dérivés du sang
- Tégéline 50 mg/mL, Immunoglobuline humaine normale (IV) poudre et solvant pour solution pour perfusion : information sur le risque d'insuffisance rénale
- Ne pas utiliser les flacons d'eau PPI 100 mL et 200 mL présents dans certains médicaments dérivés du sang (MDS)
- Tensions d'approvisionnement en immunoglobulines humaines : rappel de la hiérarchisation des indications
- Recommandations dans l'utilisation d'alternatives à certains médicaments dérivés du sang du LFB