
CABAZITAXEL ZENTIVA 20 mg/mL, solution à diluer pour perfusion - Résumé des caractéristiques du produit |
 |
|
ANSM - Mis à jour le : 02/04/2025
CABAZITAXEL ZENTIVA 20 mg/mL, solution à diluer pour perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE 
Cabazitaxel............................................................................................................................ 20 mg
Pour un mL de solution à diluer.
Chaque flacon de 3 mL de solution à diluer contient 60 mg de cabazitaxel.
Excipient à effet notoire :
Le produit fini contient 395 mg/mL d’éthanol anhydre, donc chaque flacon de 3 mL de solution à diluer contient 1 185 mg d’éthanol anhydre.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution à diluer pour perfusion.
La solution à diluer est une solution huileuse limpide jaune à jaune-brunâtre.
4.1. Indications thérapeutiques 
4.2. Posologie et mode d'administration 
L’utilisation de CABAZITAXEL ZENTIVA doit être réservée aux unités spécialisées dans l’administration de cytotoxiques et doit être administré sous contrôle d’un médecin expérimenté dans l’utilisation des chimiothérapies anticancéreuses. Les moyens et l’équipement pour le traitement de réactions d’hypersensibilité sévères comme l’hypotension et le bronchospasme doivent être disponibles (voir rubrique 4.4).
Prémédication
La prémédication recommandée doit être effectuée au moins 30 minutes avant chaque administration de CABAZITAXEL ZENTIVA avec les médicaments injectés par voie intraveineuse suivants afin de diminuer le risque et la sévérité de l’hypersensibilité :
· antihistaminique (dexchlorphéniramine 5 mg ou diphénhydramine 25 mg ou équivalent),
· corticoïde (dexaméthasone 8 mg ou équivalent), et
· antagoniste H2 (ranitidine ou équivalent) (voir rubrique 4.4).
Une prophylaxie antiémétique est recommandée et peut être administrée par voie orale ou par voie intraveineuse si besoin.
Au cours du traitement, une hydratation adéquate du patient doit être garantie, pour prévenir des complications telles qu’une insuffisance rénale.
Posologie
La dose recommandée de CABAZITAXEL ZENTIVA est de 25 mg/m2 administrée par perfusion de 1 heure toutes les 3 semaines en association avec 10 mg par jour de prednisone ou prednisolone administrés par voie orale pendant tout le traitement.
Ajustements des doses
Des modifications de dose doivent être effectuées chez les patients ayant présenté les effets indésirables suivants (les grades font référence aux Critères Communs de Terminologie pour les Effets Indésirables [CTCAE 4.0]) :
Tableau 1 — Modifications de dose recommandées pour effets indésirables chez des patients traités par cabazitaxel
|
Effets indésirables |
Modification de la dose |
|
Neutropénie prolongée de grade ≥ 3 (de plus de 1 semaine) malgré un traitement approprié incluant du G-CSF |
Reporter le traitement jusqu’à ce que le nombre de neutrophiles soit >1 500 cellules/mm3, puis réduire la dose de cabazitaxel de 25 mg/m2 à 20 mg/m2. |
|
Neutropénie fébrile ou infection neutropénique |
Reporter le traitement jusqu’à amélioration ou normalisation, et jusqu’à ce que le nombre de neutrophiles soit > 1 500 cellules/mm3, puis réduire la dose de cabazitaxel de 25 mg/m2 à 20 mg/m2. |
|
Diarrhée de grade ≥ 3 ou diarrhées persistantes malgré un traitement approprié, incluant solutés et électrolytes de substitution |
Retarder le traitement jusqu’à amélioration ou normalisation, puis réduire la dose de cabazitaxel de 25 mg/m2 à 20 mg/m2. |
|
Neuropathie périphérique de grade ≥ 2 |
Retarder le traitement jusqu’à amélioration puis réduire la dose de cabazitaxel de 25 mg/m2 à 20 mg/m2. |
Si les patients continuent à présenter l’un de ces effets indésirables à 20 mg/m2, une réduction supplémentaire de la dose à 15 mg/m2 ou un arrêt de CABAZITAXEL ZENTIVA doit être envisagé(e). Les données chez les patients à une dose inférieure à 20 mg/m2 sont limitées.
Populations particulières
Patients présentant une insuffisance hépatique
Le cabazitaxel est largement métabolisé par le foie. Les patients présentant une insuffisance hépatique légère (bilirubine totale > 1 à ≤ 1,5 x la limite supérieure de la normale (LSN) ou aspartate aminotransférase (ASAT) > 1,5 x LSN) doivent recevoir une dose réduite de cabazitaxel de 20 mg/m2. L’administration de cabazitaxel chez des patients présentant une insuffisance hépatique légère doit être effectuée avec une attention particulière et la tolérance doit être surveillée étroitement.
Chez les patients présentant une insuffisance hépatique modérée (bilirubine totale > 1,5 à ≤ 3,0 x LSN), la dose maximale tolérée (DMT) était de 15 mg/m2. Si le traitement est envisagé chez les patients présentant une insuffisance hépatique modérée, la dose de cabazitaxel ne doit pas dépasser 15 mg/m2. Cependant, les données d’efficacité disponibles à cette dose sont limitées.
Le cabazitaxel ne doit pas être administré à des patients présentant une insuffisance hépatique sévère (bilirubine totale > 3 x LSN) (voir rubriques 4.3, 4.4 et 5.2).
Patients présentant une insuffisance rénale
Le cabazitaxel est très peu excrété par le rein. Aucun ajustement posologique n’est nécessaire chez des patients présentant une insuffisance rénale ne nécessitant pas d’hémodialyse. Compte-tenu de l’état des patients présentant une maladie rénale en phase terminale (clairance de la créatinine (CLCR < 15 mL/min/1,73 m2) et des données disponibles limitées, ces patients doivent être traités avec prudence et suivis étroitement pendant le traitement (voir rubriques 4.4 et 5.2).
Personnes âgées
Aucun ajustement posologique spécifique n’est recommandé pour l’utilisation du cabazitaxel chez les patients âgés (voir également rubriques 4.4, 4.8 et 5.2).
Prise concomitante de médicaments
La prise concomitante de médicaments qui sont de puissants inducteurs ou de puissants inhibiteurs du CYP3A doit être évitée. Cependant, si la co-administration d’un puissant inhibiteur du CYP3A est requise chez certains patients, une réduction de dose du cabazitaxel de 25 % devra être envisagée (voir rubriques 4.4 et 4.5).
Population pédiatrique
Il n’y a pas d’utilisation justifiée du cabazitaxel dans la population pédiatrique.
La sécurité et l’efficacité du cabazitaxel chez les enfants et chez les adolescents âgés de moins de 18 ans n’ont pas été établies (voir rubrique 5.1).
Mode d’administration
CABAZITAXEL ZENTIVA est destiné à un usage intraveineux.
Pour les instructions de préparation et d’administration du médicament, voir rubrique 6.6.
Les poches de perfusion en PVC et les sets de perfusion en polyuréthane ne doivent pas être utilisés.
CABAZITAXEL ZENTIVA ne doit pas être mélangé avec des médicaments autres que ceux mentionnés à la rubrique 6.6.
· Nombre de neutrophiles inférieur à 1 500/mm3.
· Insuffisance hépatique sévère (bilirubine totale > 3 x LSN).
· Vaccination concomitante avec le vaccin contre la fièvre jaune (voir rubrique 4.5).
4.4. Mises en garde spéciales et précautions d'emploi 
Réactions d’hypersensibilité
Tous les patients doivent recevoir une prémédication avant l’instauration de la perfusion de cabazitaxel (voir rubrique 4.2).
Les patients doivent être étroitement surveillés en vue de détecter des réactions d’hypersensibilité, notamment pendant la première et la seconde perfusion. Les réactions d’hypersensibilité peuvent survenir dans les quelques minutes suivant l’instauration de la perfusion de cabazitaxel, ainsi les installations et équipements pour le traitement de l’hypotension et du bronchospasme doivent être disponibles. Des réactions sévères peuvent survenir et peuvent inclure rash/érythèmes généralisés, hypotension et bronchospasme. Les réactions d’hypersensibilité sévères nécessitent un arrêt immédiat du cabazitaxel et un traitement approprié. Les patients présentant une réaction d’hypersensibilité doivent arrêter le traitement par cabazitaxel (voir rubrique 4.3).
Myélosuppression
Une myélosuppression se manifestant par une neutropénie, une anémie, une thrombopénie ou une pancytopénie peut survenir (voir « Risque de neutropénies » et « Anémie » en rubrique 4.4 ci-dessous).
Risque de neutropénies
Les patients traités par cabazitaxel peuvent recevoir une prophylaxie par G-CSF, conformément aux recommandations de l’American Society of Clinical Oncology (ASCO) et/ou aux recommandations institutionnelles en vigueur, pour réduire le risque ou prendre en charge les complications des neutropénies (neutropénie fébrile, neutropénie prolongée ou infection neutropénique). Une prophylaxie primaire par G-CSF doit être considérée chez les patients présentant des facteurs de risque clinique important (âge > 65 ans, état général altéré, épisodes précédents de neutropénie fébrile, champ d’irradiation antérieur extensif, état nutritionnel altéré ou autres comorbidités graves) qui les prédisposent à une augmentation des complications liées à une neutropénie prolongée. L’utilisation de G-CSF a montré qu’elle limitait l’incidence et la sévérité des neutropénies.
La neutropénie est l’effet indésirable le plus fréquent du cabazitaxel (voir rubrique 4.8). Le suivi de la numération formule sanguine hebdomadaire est essentiel pendant le cycle 1 et ensuite avant chaque cycle de traitement, afin d’ajuster la dose si besoin.
La dose doit être réduite en cas de neutropénie fébrile, ou de neutropénie prolongée malgré un traitement approprié (voir rubrique 4.2).
Le traitement ne devra être repris chez ces patients que lorsque les neutrophiles seront ≥ 1 500/mm3 (voir rubrique 4.3).
Affections gastro-intestinales
Les symptômes tels que douleurs et sensibilité abdominales, fièvre, constipation persistante, diarrhée, avec ou sans neutropénie, peuvent être des manifestations précoces d’une toxicité gastro-intestinale et doivent être évalués et traités rapidement. Le traitement par cabazitaxel peut alors être repoussé ou arrêté si nécessaire.
Risque de nausées, vomissements, diarrhée et déshydratation
Si des patients ont eu des antécédents de diarrhée après une administration de cabazitaxel, ils peuvent être traités par des médicaments anti-diarrhéiques fréquemment utilisés. Des mesures appropriées doivent être prises pour réhydrater ces patients. Des diarrhées peuvent se produire plus fréquemment chez des patients ayant reçu une irradiation abdomino-pelvienne. Une déshydratation est plus fréquente chez les patients âgés de 65 ans et plus. Des mesures appropriées doivent être prises pour réhydrater les patients, les suivre et corriger leurs taux sériques d’électrolytes, notamment le potassium. Un report du traitement ou une réduction de la dose peuvent être nécessaires pour des diarrhées de grade ≥ 3 (voir rubrique 4.2). Si des patients ont eu des antécédents de nausées ou vomissements, ils peuvent être traités avec des antiémétiques fréquemment utilisés.
Risque de réactions gastro-intestinales graves
Des hémorragies et des perforations gastro-intestinales (GI), des iléus, des colites, y compris d’issue fatale ont été rapportés chez des patients traités par cabazitaxel (voir rubrique 4.8). La prudence est requise chez les patients les plus à risque de développer des complications gastro-intestinales : ceux souffrant de neutropénie, les personnes âgées, en cas d’utilisation concomitante d’AINS, d’anti-agrégants plaquettaires ou d’anti-coagulants, et les patients ayant été antérieurement traités par radiothérapie pelvienne ou présentant des antécédents digestifs, comme des ulcérations ou des saignements GI.
Neuropathie périphérique
Des cas de neuropathie périphérique, de neuropathie périphérique sensitive (par exemple, paresthésies, dysesthésies) et de neuropathie motrice périphérique ont été observés chez les patients recevant du cabazitaxel. Les patients sous traitement par cabazitaxel doivent informer leur médecin avant de poursuivre le traitement si des symptômes de neuropathie apparaissent, tels qu’une douleur, une brûlure, un picotement, un engourdissement ou une faiblesse. Les médecins doivent évaluer la présence ou l’aggravation de la neuropathie avant chaque traitement. Le traitement doit être retardé jusqu’à amélioration des symptômes. La dose de cabazitaxel doit être réduite de 25 mg/m2 à 20 mg/m2 en cas de neuropathie périphérique de grade ≥ 2 persistante (voir rubrique 4.2).
Anémie
Une anémie a été observée chez les patients recevant du cabazitaxel (voir rubrique 4.8). Le taux d’hémoglobine et l’hématocrite doivent être contrôlés avant le traitement par cabazitaxel ainsi que lorsque les patients présentent des signes ou symptômes d’anémie ou de perte de sang. Une attention particulière est recommandée chez les patients ayant une hémoglobine < 10 g/dL et des mesures appropriées devront être prises en fonction de la clinique.
Risque d’insuffisance rénale
Des troubles rénaux associés à un sepsis, une déshydratation sévère due à des diarrhées, des vomissements et une uropathie obstructive ont été rapportés. Des cas d’insuffisance rénale, y compris d’issue fatale, ont été observés. Des mesures appropriées doivent être prises pour en identifier la cause et traiter les patients.
Une hydratation adéquate doit être assurée tout au long du traitement par cabazitaxel. Le patient doit être informé de la nécessité de signaler immédiatement tout changement de diurèse quotidienne. La créatinine plasmatique doit être mesurée à l’inclusion, à chaque bilan sanguin, et chaque fois que le patient rapporte une modification de sa diurèse. Le traitement par cabazitaxel doit être interrompu en cas de dégradation de la fonction rénale conduisant à une insuffisance rénale de grade ≥ 3 du CTCAE 4.0.
Affections respiratoires
Des cas de pneumonie interstitielle/pneumopathie inflammatoire et de pneumopathie interstitielle diffuse ont été rapportés et peuvent être associés à une issue fatale (voir rubrique 4.8).
Si de nouveaux symptômes pulmonaires apparaissent ou si des symptômes pulmonaires s’aggravent, les patients doivent être étroitement surveillés, rapidement examinés, et traités de façon appropriée. L’interruption du traitement par cabazitaxel est recommandée jusqu’à ce que le diagnostic soit établi. Une prise en charge précoce peut aider à améliorer l’état du patient. Le bénéfice de la reprise du traitement par cabazitaxel doit être évalué avec attention.
Risque d’arythmies cardiaques
Des cas d’arythmie cardiaque ont été rapportés, plus fréquemment des tachycardies et des fibrillations auriculaires (voir rubrique 4.8).
Personnes âgées
Les personnes âgées (≥ 65 ans) peuvent être plus susceptibles de présenter des effets indésirables incluant des neutropénies et des neutropénies fébriles (voir rubrique 4.8).
Patients présentant une insuffisance hépatique
Le traitement par cabazitaxel est contre-indiqué chez les patients présentant une insuffisance hépatique sévère (bilirubine totale > 3 x LSN) (voir rubriques 4.3 et 5.2).
La dose doit être réduite pour les patients présentant une insuffisance hépatique légère (bilirubine totale > 1 à ≤ 1,5 x LSN ou ASAT > 1,5 x LSN) (voir rubriques 4.2 et 5.2).
Interactions
La co-administration d’inhibiteurs puissants du CYP3A doit être évitée car ils peuvent augmenter les concentrations plasmatiques du cabazitaxel (voir rubriques 4.2 et 4.5). Si la co-administration avec un puissant inhibiteur du CYP3A ne peut être évitée, une surveillance étroite de la toxicité et une réduction de dose du cabazitaxel devront être envisagées (voir rubriques 4.2 et 4.5).
La co-administration d’inducteurs puissants du CYP3A doit être évitée car ils peuvent diminuer les concentrations plasmatiques du cabazitaxel (voir rubriques 4.2 et 4.5).
Contraception
Les hommes doivent utiliser une méthode de contraception efficace pendant le traitement et jusqu’à 4 mois après l’arrêt du traitement par cabazitaxel (voir rubrique 4.6).
Excipients
Ce médicament contient 1 185 mg d’alcool (éthanol) dans chaque flacon, ce qui équivaut à 395 mg/mL. La quantité contenue dans chaque flacon de ce médicament est équivalente à 30 mL de bière ou 12 mL de vin.
Une dose de 60 mg de ce médicament, administrée à un adulte pesant 70 kg, entraînerait une exposition à 17 mg/kg d’éthanol, ce qui pourrait provoquer une augmentation de l’alcoolémie d’environ 2,8 mg/100 mL.
A titre de comparaison, pour un adulte qui boit un verre de vin ou 500 mL de bière, le taux d’alcoolémie est susceptible d’être d’environ 50 mg/100 mL.
La co-administration de médicaments contenant, par exemple, du propylène glycol ou de l’éthanol peut entraîner une accumulation d’éthanol et induire des effets indésirables, en particulier chez les jeunes enfants dont la capacité métabolique est faible ou immature.
Des précautions particulières doivent être prises en compte chez les femmes enceintes ou allaitantes et chez les personnes dépendantes de l’alcool.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions 
Des études in vitro ont montré que le cabazitaxel était principalement métabolisé par le CYP3A (80 % à 90 %) (voir rubrique 5.2).
Inhibiteurs du CYP3A
L’administration répétée de kétoconazole (400 mg une fois par jour), un inhibiteur puissant du CYP3A, a conduit à une diminution de la clairance du cabazitaxel de 20 %, correspondant à une augmentation de l’ASC (aire sous la courbe) de 25 %. Par conséquent, l’administration concomitante d’inhibiteurs puissants du CYP3A (tels que kétoconazole, itraconazole, clarithromycine, indinavir, néfazodone, nelfinavir, ritonavir, saquinavir, télithromycine, voriconazole) doit être évitée étant donné qu’une augmentation des concentrations plasmatiques du cabazitaxel peut survenir (voir rubriques 4.2 et 4.4).
L’administration concomitante d’aprépitant, un inhibiteur modéré du CYP3A, n’a pas eu d’effet sur la clairance du cabazitaxel.
Inducteurs du CYP3A
L’administration répétée de rifampicine (600 mg une fois par jour), un inducteur puissant du CYP3A, a conduit à une augmentation de la clairance du cabazitaxel de 21 %, correspondant à une diminution de l’ASC de 17 %.
Par conséquent, l’administration concomitante d’inducteurs puissants du CYP3A (tels que phénytoïne, carbamazépine, rifampicine, rifabutine, rifapentine, phénobarbital) doit être évitée étant donné qu’une diminution des concentrations plasmatiques du cabazitaxel peut survenir (voir rubriques 4.2 et 4.4). De plus, les patients doivent aussi s’abstenir de prendre du millepertuis.
OATP1B1
In vitro, il a également été démontré que le cabazitaxel inhibait les protéines de transport OATP1B1 (polypeptides transporteurs d’anions organiques). Le risque d’interaction avec les substrats des OATP1B1 (par exemple, statines, valsartan, répaglinide) existe notamment pendant la durée de la perfusion (1 heure) et jusqu’à 20 minutes après la fin de la perfusion. Il est recommandé de respecter un intervalle de 12 heures avant la perfusion et d’au moins 3 heures après la fin de la perfusion avant d’administrer des substrats des OATP1B1.
Vaccinations
L’administration de vaccins vivants ou vivants atténués chez des patients immunodéprimés par des agents de chimiothérapie peut entraîner des infections graves ou fatales. La vaccination avec un vaccin vivant atténué doit être évitée chez les patients recevant du cabazitaxel. Les vaccins inactivés ou inertes peuvent être administrés ; cependant, la réponse de tels vaccins peut être diminuée.
4.6. Fertilité, grossesse et allaitement 
Contraception
En raison du risque génotoxique du cabazitaxel (voir rubrique 5.3), les hommes doivent utiliser une méthode de contraception efficace pendant le traitement et jusqu’à 4 mois après l’arrêt du traitement par cabazitaxel.
Grossesse
Il n’existe pas de données sur l’utilisation du cabazitaxel chez la femme enceinte. Des études chez des animaux ont montré une toxicité sur la reproduction à des doses maternotoxiques (voir rubrique 5.3) et un passage de la barrière placentaire par le cabazitaxel (voir rubrique 5.3). Comme tous les autres médicaments cytotoxiques, le cabazitaxel peut nuire au fœtus chez les femmes enceintes exposées.
Le cabazitaxel n’est pas indiqué pour une utilisation chez les femmes.
Des données pharmacocinétiques disponibles chez l’animal ont montré une excrétion du cabazitaxel et de ses métabolites dans le lait maternel (voir rubrique 5.3).
Le cabazitaxel ne doit pas être utilisé pendant l’allaitement.
Fertilité
Des études chez l’animal ont montré que le cabazitaxel affectait le système de reproduction chez les rats mâles et les chiens sans aucun effet fonctionnel sur la fertilité (voir rubrique 5.3). Toutefois, compte tenu de l’activité pharmacologique des taxanes, de leur potentiel génotoxique par un mécanisme aneugène et de l’effet de plusieurs composés de cette classe sur la fertilité dans les études animales, l’effet sur la fertilité masculine ne peut être exclu chez l’Homme.
Les hommes traités par cabazitaxel sont invités à demander des conseils sur la conservation du sperme avant le traitement.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines 
Le cabazitaxel a une influence modérée sur l’aptitude à conduire des véhicules et à utiliser des machines car il peut provoquer de la fatigue et des sensations vertigineuses. Il est conseillé aux patients qui présentent ces effets indésirables au cours du traitement de ne pas conduire de véhicules ni d’utiliser des machines.
Résumé du profil de sécurité
La sécurité du cabazitaxel en association avec la prednisone ou la prednisolone a été évaluée au cours de 3 études randomisées, en ouvert, contrôlées (TROPIC, PROSELICA et CARD) chez un total de 1 092 patients présentant un cancer de la prostate métastatique résistant à la castration ayant été traités par cabazitaxel à 25 mg/m2 une fois toutes les 3 semaines. Les patients ont reçu une médiane de 6 à 7 cycles de cabazitaxel.
Les incidences de l’analyse combinée des 3 essais sont présentées ci-dessous et dans le tableau.
Les effets indésirables les plus fréquents, quel que soit le grade, étaient l’anémie (99,0 %), la leucopénie (93,0 %), la neutropénie (87,9 %), la thrombopénie (41,1 %), la diarrhée (42,1 %), la fatigue (25,0 %) et l’asthénie (15,4 %). Les effets indésirables les plus fréquents de grade ≥ 3 survenant chez au moins 5 % des patients étaient la neutropénie (73,1 %), la leucopénie (59,5 %), l’anémie (12,0 %), la neutropénie fébrile (8,0 %) et la diarrhée (4,7 %).
L’arrêt du traitement lié aux effets indésirables est survenu à des fréquences similaires dans les 3 études (18,3 % dans TROPIC, 19,5 % dans PROSELICA et 19,8 % dans CARD) chez les patients recevant du cabazitaxel. Les effets indésirables les plus fréquents (> 1.0 %) entrainant l’arrêt du cabazitaxel étaient l’hématurie, la fatigue et les neutropénies.
Tableau des effets indésirables
Les effets indésirables sont listés dans le tableau 2 par classe de systèmes d’organes MedDRA et catégories de fréquences. Au sein de chaque groupe de fréquence, les effets indésirables sont présentés selon un ordre décroissant de gravité. L’intensité des effets indésirables est gradée selon le CTCAE 4.0 (grade ≥ 3 = G ≥ 3). Les fréquences sont basées sur tous les grades et définies comme suit : très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100) ; rare (≥ 1/10 000, < 1/1 000) ; très rare (< 1/10 000) ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Tableau 2 — Effets indésirables et anomalies hématologiques rapportés avec le cabazitaxel en association avec la prednisone ou la prednisolone de l’analyse combinée (n = 1 092)
|
Classe de systèmes d’organes |
Effet indésirable |
Tous grades n (%) |
Grade ≥ 3 n (%) |
||
|
Très fréquent |
Fréquent |
Peu fréquent |
|
||
|
Infections et infestations |
Infection neutropénique/ sepsis* |
|
48 (4,4) |
|
42 (3,8) |
|
Choc septique |
|
|
10 (0,9) |
10 (0,9) |
|
|
Sepsis |
|
13 (1,2) |
|
13 (1,2) |
|
|
Cellulite |
|
|
8 (0,7) |
3 (0,3) |
|
|
Infection des voies urinaires |
|
103 (9,4) |
|
19 (1,7) |
|
|
Grippe |
|
22 (2,0) |
|
0 |
|
|
Cystite |
|
22 (2,0) |
|
2 (0,2) |
|
|
Infection des voies aériennes supérieures |
|
23 (2,1) |
|
0 |
|
|
Zona |
|
14 (1,3) |
|
0 |
|
|
Candidiase |
|
11 (1,0) |
|
1 (< 0,1) |
|
|
Affections hématologiques et du système lymphatique |
Neutropéniea* |
950 (87,9) |
|
|
790 (73,1) |
|
Anémiea |
1 073 (99,0) |
|
|
130 (12,0) |
|
|
Leucopéniea |
1 008 (93,0) |
|
|
645 (59,5) |
|
|
Thrombopéniea |
478 (44,1) |
|
|
44 (4,1) |
|
|
Neutropénie fébrile |
|
87 (8,0) |
|
87 (8,0) |
|
|
Affections du système immunitaire |
Hypersensibilité |
|
|
7 (0,6) |
0 |
|
Troubles du métabolisme et de la nutrition |
Appétit diminué |
192 (17,6) |
|
|
11 (1,0) |
|
Déshydratation |
|
27 (2,5) |
|
11 (1,0) |
|
|
Hyperglycémie |
|
11 (1,0) |
|
7 (0,6) |
|
|
Hypokaliémie |
|
|
8 (0,7) |
2 (0,2) |
|
|
Affections psychiatriques |
Insomnie |
|
45 (4,1) |
|
0 |
|
Anxiété |
|
13 (1,2) |
|
0 |
|
|
Etat confusionnel |
|
12 (1,1) |
|
2 (0,2) |
|
|
Affections du système nerveux |
Dysgueusie |
|
64 (5,9) |
|
0 |
|
Trouble du goût |
|
56 (5,1) |
|
0 |
|
|
Neuropathie périphérique |
|
40 (3,7) |
|
2 (0,2) |
|
|
Neuropathie périphérique sensitive |
|
89 (8,2) |
|
6 (0,5) |
|
|
Polyneuropathie |
|
|
9 (0,8) |
2 (0,2) |
|
|
Paresthésie |
|
46 (4,2) |
|
0 |
|
|
Hypoesthésie |
|
18 (1,6) |
|
1 (< 0,1) |
|
|
Sensations vertigineuses |
|
63 (5,8) |
|
0 |
|
|
Céphalées |
|
56 (5,1) |
|
1 (< 0,1) |
|
|
Léthargie |
|
15 (1,4) |
|
1 (< 0,1) |
|
|
Sciatique |
|
|
9 (0,8) |
1 (< 0,1) |
|
|
Affections oculaires |
Conjonctivite |
|
11 (1,0) |
|
0 |
|
Augmentation de la sécrétion lacrymale |
|
22 (2,0) |
|
0 |
|
|
Affections des oreilles et du labyrinthe |
Acouphènes |
|
|
7 (0,6) |
0 |
|
Vertige |
|
15 (1,4) |
|
1 (< 0,1) |
|
|
Affections cardiaques* |
Fibrillation auriculaire |
|
14 (1,3) |
|
5 (0,5) |
|
Tachycardie |
|
11 (1,0) |
|
1 (< 0,1) |
|
|
Affections vasculaires |
Hypotension |
|
38 (3,5) |
|
5 (0,5) |
|
Thrombose veineuse profonde |
|
12 (1,1) |
|
9 (0,8) |
|
|
Hypertension |
|
29 (2,7) |
|
12 (1,1) |
|
|
Hypotension orthostatique |
|
|
6 (0,5) |
1 (< 0,1) |
|
|
Bouffée de chaleur |
|
23 (2,1) |
|
1 (< 0,1) |
|
|
Bouffée congestive |
|
|
9 (0,8) |
0 |
|
|
Affections respiratoires, thoraciques et médiastinales |
Dyspnée |
|
97 (8,9) |
|
9 (0,8) |
|
Toux |
|
79 (7,2) |
|
0 |
|
|
Douleur oropharyngée |
|
26 (2,4) |
|
1 (< 0,1) |
|
|
Pneumonie |
|
26 (2,4) |
|
16 (1,5) |
|
|
Embolie pulmonaire |
|
30 (2,7) |
|
23 (2,1) |
|
|
Affections gastro-intestinales |
Diarrhée |
460 (42,1) |
|
|
51 (4,7) |
|
Nausées |
347 (31,8) |
|
|
14 (1,3) |
|
|
Vomissements |
207 (19,0) |
|
|
14 (1,3) |
|
|
Constipation |
202 (18,5) |
|
|
8 (0,7) |
|
|
Douleur abdominale |
|
105 (9,6) |
|
15 (1,4) |
|
|
Dyspepsie |
|
53 (4,9) |
|
0 |
|
|
Douleur abdominale haute |
|
46 (4,2) |
|
1 (< 0,1) |
|
|
Hémorroïdes |
|
22 (2,0) |
|
0 |
|
|
Reflux gastro-œsophagien |
|
26 (2,4) |
|
1 (< 0,1) |
|
|
Hémorragie rectale |
|
14 (1,3) |
|
4 (0,4) |
|
|
Bouche sèche |
|
19 (1,7) |
|
2 (0,2) |
|
|
Distension abdominale |
|
14 (1,3) |
|
1 (< 0,1) |
|
|
Stomatite |
|
46 (4,2) |
|
2 (0,2) |
|
|
Iléus* |
|
|
7 (0,6) |
5 (0,5) |
|
|
Gastrite |
|
|
10 (0,9) |
0 |
|
|
Colite* |
|
|
10 (0,9) |
5 (0,5) |
|
|
Perforation gastro-intestinale |
|
|
3 (0,3) |
1 (< 0,1) |
|
|
Hémorragie gastro-intestinale |
|
|
2 (0,2) |
1 (< 0,1) |
|
|
Affections de la peau et du tissu sous-cutané |
Alopécie |
|
80 (7,3) |
|
0 |
|
Sécheresse de la peau |
|
23 (2,1) |
|
0 |
|
|
Erythème |
|
|
8 (0,7) |
0 |
|
|
Altération des ongles |
|
18 (1,6) |
|
0 |
|
|
Affections musculo-squelettiques et systémiques |
Dorsalgie |
166 (15,2) |
|
|
24 (2,2) |
|
Arthralgie |
|
88 (8,1) |
|
9 (0,8) |
|
|
Douleur des extrémités |
|
76 (7,0) |
|
9 (0,8) |
|
|
Spasmes musculaires |
|
51 (4,7) |
|
0 |
|
|
Myalgie |
|
40 (3,7) |
|
2 (0,2) |
|
|
Douleur thoracique musculo-squelettique |
|
34 (3,1) |
|
3 (0,3) |
|
|
Faiblesse musculaire |
|
31 (2,8) |
|
1 (0,2) |
|
|
Douleur au niveau du flanc |
|
17 (1,6) |
|
5 (0,5) |
|
|
Affections du rein et des voies urinaires |
Insuffisance rénale aiguë |
|
21 (1,9) |
|
14 (1,3) |
|
Insuffisance rénale |
|
|
8 (0,7) |
6 (0,5) |
|
|
Dysurie |
|
52 (4,8) |
|
0 |
|
|
Colique rénale |
|
14 (1,3) |
|
2 (0,2) |
|
|
Hématurie |
205 (18,8) |
|
|
33 (3,0) |
|
|
Pollakiurie |
|
26 (2,4) |
|
2 (0,2) |
|
|
Hydronéphrose |
|
25 (2,3) |
|
13 (1,2) |
|
|
Rétention urinaire |
|
36 (3,3) |
|
4 (0,4) |
|
|
Incontinence urinaire |
|
22 (2,0) |
|
0 |
|
|
Obstacle urétéral |
|
|
8 (0,7) |
6 (0,5) |
|
|
Affections des organes de reproduction et du sein |
Douleur pelvienne |
20 (1,8) |
|
5 (0,5) |
|
|
Troubles généraux et anomalies au site d’administration |
Fatigue |
333 (30,5) |
|
|
42 (3,8) |
|
Asthénie |
227 (20,8) |
|
|
32 (2,9) |
|
|
Fièvre |
|
90 (8,2) |
|
5 (0,5) |
|
|
Œdème périphérique |
|
96 (8,8) |
|
2 (0,2) |
|
|
Inflammation des muqueuses |
|
23 (2,1) |
|
1 (< 0,1) |
|
|
Douleur |
|
36 (3,3) |
|
7 (0,6) |
|
|
Douleur thoracique |
|
11 (1,0) |
|
2 (0,2) |
|
|
Œdème |
|
|
8 (0,7) |
1 (< 0,1) |
|
|
Frissons |
|
12 (1,1) |
|
0 |
|
|
Malaise |
|
21 (1,9) |
|
0 |
|
|
Investigations |
Poids diminué |
|
81 (7,4) |
|
0 |
|
Aspartate aminotransférase augmentée |
|
13 (1,2) |
|
1 (< 0,1) |
|
|
Transaminases augmentées |
|
|
7 (0,6) |
1 (< 0,1) |
|
a d’après les valeurs du laboratoire
* voir rubrique détaillée ci-dessous
Description de certains effets indésirables
Neutropénies et événements cliniques associés
L’utilisation du G-CSF a démontré qu’elle limitait l’incidence et la sévérité des neutropénies (voir rubriques 4.2 et 4.4).
L’incidence des cas de neutropénie de grade ≥ 3, d’après les données de laboratoire variait de 44,7 % à 76,7 % en fonction de l’utilisation du G-CSF, l’incidence la plus faible étant rapportée lorsque la prophylaxie par G-CSF était utilisée. De même, l’incidence des cas de neutropénie fébrile de grade ≥ 3 variait de 3,2 % à 8,6 %.
Des complications neutropéniques (incluant des cas de neutropénie fébrile, des infections neutropéniques/sepsis et des colites neutropéniques), d’issue fatale dans certains cas, ont été rapportées chez 4,0 % des patients lorsqu’une prophylaxie primaire par G-CSF était utilisée, et chez 12,8 % des patients dans le cas contraire.
Troubles cardiaques et arythmies
Dans l’analyse combinée, les événements cardiaques ont été rapportés chez 5,5 % des patients dont 1,1 % ont présenté des arythmies cardiaques de grade ≥ 3. L’incidence de la tachycardie dans le bras cabazitaxel a été de 1,0 %, dont moins de 0,1 % a été de grade ≥ 3. L’incidence de la fibrillation auriculaire a été de 1,3 %. Des cas d’insuffisance cardiaque ont été rapportés pour 2 patients (0,2 %), dont un a été d’issue fatale. Une fibrillation ventriculaire fatale a été rapportée chez 1 patient (0,3 %), et un arrêt cardiaque chez 3 patients (0,5 %). Aucun de ces événements n’a été considéré comme relié par l’investigateur.
Hématuries
Dans l’analyse combinée, la fréquence des hématuries, quels que soient leurs grades, a été de 18,8 % à la dose de 25 mg/m2 (voir rubrique 5.1). Lorsque cela était documenté, des facteurs de confusion tels que progression de la maladie, instrumentation, infection ou traitement par anticoagulant/AINS/acide acétylsalicylique ont été identifiés dans près de la moitié des cas.
Autres anomalies biologiques
Dans l’analyse combinée, l’incidence des anémies de grade ≥ 3, des augmentations des ASAT, ALAT, et bilirubine basées sur des anomalies de laboratoire a été respectivement de 12,0 %, 1,3 %, 1 % et 0,5 %.
Affections gastro-intestinales
Des colites (comprenantdes entérocolites et des entérocolites neutopéniques) etdes gastrites ont été observées. Des hémorragies gastro-intestinales, des perforations gastro-intestinales et des iléus (occlusions intestinales) ont également été rapportés (voir rubrique 4.4).
Affections respiratoires
Des cas de pneumonie interstitielle/pneumopathie inflammatoire et de pneumopathie interstitielle diffuse, parfois fatals ont été rapportés à une fréquence indéterminée (ne peut être estimée sur la base des données disponibles) (voir rubrique 4.4).
Affections rénales et urinaires
Des cystites dues à un phénomène de rappel après radiothérapie, incluant des cystites hémorragiques, ont été peu fréquemment rapportées.
Population pédiatrique
Voir rubrique 4.2
Autres populations particulières
Personnes âgées
Sur les 1 092 patients traités par cabazitaxel à la dose de 25 mg/m2 dans les études sur le cancer de la prostate, 755 patients étaient âgés de 65 ans et plus, parmi lesquels 238 patients âgés de plus de 75 ans. Les effets indésirables non hématologiques suivants ont été rapportés avec un taux ≥ 5 %, chez des patients âgés de plus de 65 ans, par rapport aux patients plus jeunes : fatigue (33,5 % versus 23,7 %), asthénie (23,7 % versus 14,2 %), constipation (20,4 % versus 14,2 %) et dyspnée (10,3 % versus 5,6 %), respectivement. La neutropénie (90,9 % versus 81,2 %) et la thrombopénie (48,8 % versus 36,1 %) ont également été 5 % plus élevées chez les patients âgés de 65 ans ou plus par rapport aux patients plus jeunes. La neutropénie de grade ≥ 3 et la neutropénie fébrile ont été rapportées avec la plus grande différence de taux entre les deux groupes d’âge (respectivement 14 % et 4 % plus élevée chez les patients âgés de ≥ 65 ans par rapport aux patients âgés de < 65 ans) (voir rubriques 4.2 et 4.4).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
Il n’y a pas d’antidote connu au cabazitaxel. Les complications prévisibles liées au surdosage consisteraient en une exacerbation des effets indésirables, tels qu’une aplasie médullaire et des troubles gastro-intestinaux.
En cas de surdosage, le patient doit être admis dans une unité spécialisée et faire l’objet d’une surveillance étroite. Les patients doivent recevoir un traitement par G-CSF dès que possible après découverte du surdosage. D’autres mesures symptomatiques appropriées doivent être prises.
5. PROPRIETES PHARMACOLOGIQUES 
5.1. Propriétés pharmacodynamiques 
Classe pharmacothérapeutique : Agents antinéoplasiques, taxanes, code ATC : L01CD04.
Mécanisme d’action
Le cabazitaxel est un agent antinéoplasique qui agit en perturbant le réseau de microtubules dans les cellules. Le cabazitaxel se lie à la tubuline et favorise l’assemblage de la tubuline en microtubules, tout en inhibant leur dépolymérisation. Ceci conduit à la stabilisation des microtubules, ce qui entraîne l’inhibition de la mitose et l’interphase des fonctions cellulaires.
Effets pharmacodynamiques
Le cabazitaxel a fait preuve d’un large spectre d’activité antitumorale contre des tumeurs humaines au stade avancé xénogreffées chez la souris. Le cabazitaxel est actif sur les tumeurs sensibles au docétaxel. En outre, le cabazitaxel a démontré une activité dans des modèles tumoraux insensibles à la chimiothérapie, y compris le docétaxel.
Efficacité et sécurité clinique
L’efficacité et la sécurité du cabazitaxel en association à la prednisone ou la prednisolone, ont été évaluées au cours d’une étude de phase III randomisée, en ouvert, internationale, multicentrique (étude EFC6193), chez des patients présentant un cancer de la prostate métastatique résistant à la castration, précédemment traités par un régime à base de docétaxel.
La survie globale (SG) a été le critère d’évaluation principal de l’efficacité de l’étude.
Les critères d’évaluation secondaires étaient la survie sans progression [SSP (définie comme le temps entre la randomisation et la progression tumorale, la progression de l’antigène prostatique spécifique (PSA), la progression de la douleur ou le décès quelle qu’en soit la cause, selon l’événement d’origine], le taux de réponse tumorale basé sur la réponse aux critères d’évaluation des tumeurs solides (RECIST), la progression du PSA (définie comme une augmentation ≥ 25 % ou > 50 % chez les non répondeurs ou les répondeurs au PSA respectivement), la réponse au PSA (baisse des taux de PSA sériques d’au moins 50 %), la progression de la douleur [évaluée à l’aide de l’échelle d’intensité de la douleur présente (PPI) issue du questionnaire McGill-Melzack et du score analgésique (AS)] et la réponse à la douleur (définie comme une réduction de plus de 2 points par rapport à la PPI médiane initiale sans augmentation concomitante de l’AS, ou une diminution de ≥ 50 % d’utilisation d’analgésique par rapport à l’AS moyen initial sans augmentation concomitante de la douleur).
Au total, 755 patients ont été randomisés pour recevoir soit le cabazitaxel 25 mg/m2 par voie intraveineuse, toutes les 3 semaines, pendant un maximum de 10 cycles avec de la prednisone ou de la prednisolone 10 mg par jour par voie orale (n = 378), soit la mitoxantrone 12 mg/m2 par voie intraveineuse, toutes les 3 semaines pendant un maximum de 10 cycles avec de la prednisone ou de la prednisolone 10 mg par jour par voie orale (n = 377).
Ont été inclus dans cette étude des patients âgés de plus de 18 ans présentant un cancer de la prostate métastatique résistant à la castration soit avec maladie mesurable selon les critères RECIST soit non mesurable avec une élévation des taux de PSA ou une apparition de nouvelles lésions et un état général (statut de performance) de 0 à 2 selon l’Eastern Cooperative Oncology Group (ECOG). Les patients devaient avoir un taux de neutrophiles >1 500/mm3, un taux de plaquettes > 100 000/mm3, un taux d’hémoglobine > 10 g/dL, une créatinine < 1,5 x LSN, une bilirubine totale < 1 x LSN, et un taux d’ASAT et d’ALAT < 1,5 x LSN.
Les patients ayant des antécédents d’insuffisance cardiaque congestive ou d’infarctus du myocarde dans les 6 derniers mois ou les patients présentant des arythmies cardiaques non contrôlées, une angine de poitrine et/ou une hypertension n’ont pas été inclus dans cette étude.
Les données démographiques, incluant l’âge, l’origine ethnique et l’état général selon l’ECOG (0 à 2) étaient équilibrées dans les bras de traitement. Dans le groupe cabazitaxel, la moyenne d’âge était de 68 ans (intervalle : 46–92) et la répartition ethnique était la suivante : 83,9 % Caucasien, 6,9 % Asiatique/Oriental, 5,3 % Noir et 4 % Autres.
Le nombre de cycles médian était de 6 dans le groupe cabazitaxel et de 4 dans le groupe mitoxantrone. Le nombre de patients ayant complété le traitement à l’étude (10 cycles) était respectivement de 29,4 % dans le groupe cabazitaxel et de 13,5 % dans le groupe comparateur.
La survie globale était significativement plus longue avec le cabazitaxel qu’avec la mitoxantrone (15,1 mois versus 12,7 mois, respectivement), avec une réduction du risque de décès de 30 % par rapport à la mitoxantrone (voir tableau 3 et figure 1).
Un sous-groupe de 59 patients a préalablement reçu une dose cumulative de docétaxel < 225 mg/m2 (29 patients dans le bras cabazitaxel, 30 patients dans le bras mitoxantrone. Il n’y a pas eu de différence significative de la survie globale dans ce groupe de patients (RR [IC à 95 %] 0,96 [0,49–1,86]).
Tableau 3 — Efficacité du cabazitaxel dans l’étude EFC6193 dans le traitement des patients présentant un cancer de la prostate métastatique résistant à la castration
|
|
cabazitaxel + prednisone n = 378 |
mitoxantrone + prednisone n = 377 |
|
Survie globale |
|
|
|
Nombre de patients décédés (%) |
234 (61,9 %) |
279 (74 %) |
|
Survie médiane [mois] (IC à 95 %) |
15,1 (14,1–16,3) |
12,7 (11,6–13,7) |
|
Rapport de risque (RR)1 (IC à 95 %) |
0,70 (0,59–0,83) |
|
|
Valeur de p |
< 0,0001 |
|
1 RR estimé selon le modèle de Cox ; un rapport de risque inférieur à 1 est en faveur du cabazitaxel
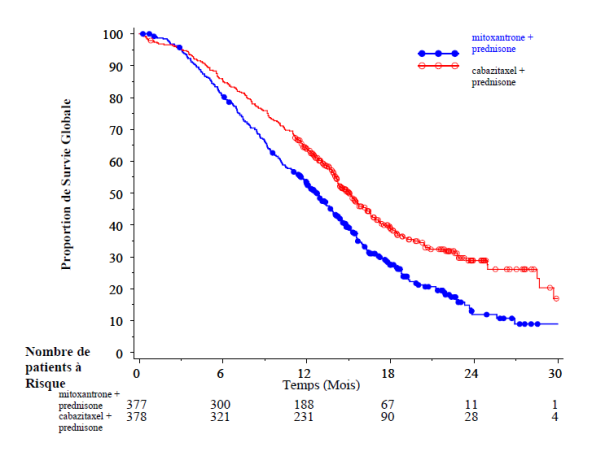
Figure 1 : Courbes de survie globale de Kaplan-Meier (EFC6193)
Il y a eu une amélioration de la SSP dans le bras cabazitaxel par rapport au bras mitoxantrone : respectivement 2,8 mois (2,4–3,0) versus 1,4 mois (1,4–1,7), RR (IC à 95 %) 0,74 (0,64–0,86), p < 0,0001.
Il y a eu un taux de réponse tumorale significativement plus élevé de 14,4 % (IC à 95 % : 9,6–19,3) chez les patients du bras cabazitaxel versus de 4,4 % (IC à 95 % : 1,6–7,2) chez les patients du bras mitoxantrone, p = 0,0005.
Les critères d’évaluation secondaires du PSA étaient positifs dans le bras cabazitaxel. Il y avait une progression médiane du PSA de 6,4 mois (IC à 95 % : 5,1–7,3) pour les patients du bras cabazitaxel, par rapport aux 3,1 mois (IC à 95 % : 2,2–4,4) du bras mitoxantrone, RR de 0,75 mois (IC à 95 % : 0,63–0,90), p = 0,0010. La réponse au PSA était de 39,2 % chez les patients du bras cabazitaxel (IC à 95 % : 33,9–44,5) versus 17,8 % des patients sous mitoxantrone (IC à 95 % : 13,7–22,0), p = 0,0002.
Il n’y a pas eu de différence statistique entre les deux bras de traitement concernant la progression de la douleur et la réponse à la douleur.
Au cours d’une étude de phase III, de non-infériorité, multicentrique, internationale, randomisée, en ouvert (étude EFC11785), 1 200 patients présentant un cancer de la prostate métastatique résistant à la castration, précédemment traités par un régime à base de docétaxel, ont été randomisés pour recevoir du cabazitaxel soit à la dose de 25 mg/m2 (n = 602) soit à la dose de 20 mg/m2 (n = 598). La survie globale (SG) était le critère d’évaluation principal de l’efficacité.
L’étude a atteint son objectif principal en démontrant la non-infériorité du cabazitaxel à la dose de 20 mg/m2 par rapport à la dose de 25 mg/m2 (voir tableau 4). Un pourcentage statistiquement et significativement plus élevé (p < 0,001) de patients a montré une réponse au PSA dans le groupe 25 mg/m2 (42,9 %) par rapport au groupe 20 mg/m2 (29,5 %). Un risque de progression du PSA statistiquement et significativement plus élevé a été observé chez les patients traités à la dose de 20 mg/m2 par rapport à la dose de 25 mg/m2 (RR 1,195 ; IC à 95 % : 1,025 à 1,393). Il n’y a pas eu de différence statistiquement significative en ce qui concerne les autres critères d’évaluation secondaires (SSP, réponse tumorale et à la douleur, progression de la tumeur et de la douleur et quatre sous-catégories du questionnaire FACT-P [Functional Assessment of Cancer Therapy-Prostate]).
Tableau 4 — Survie globale dans l’étude EFC11785 dans le bras cabazitaxel 25 mg/m2 versus bras cabazitaxel 20 mg/m2 (analyse en intention de traiter) — Critère d’évaluation principal de l’efficacité
|
|
CBZ20+PRED n = 598 |
CBZ25+PRED n = 602 |
|
Survie globale |
|
|
|
Nombre de décès, n (%) |
497 (83,1 %) |
501 (83,2 %) |
|
Survie médiane (IC à 95 %) [mois] |
13,4 (12,19 à 14,88) |
14,5 (13,47 à 15,28) |
|
Rapport de risquea |
|
|
|
versus CBZ25+PRED |
1,024 |
– |
|
ICS unilatéral à 98,89 % |
1,184 |
– |
|
ICI unilatéral à 95 % |
0,922 |
– |
CBZ20 : cabazitaxel 20 mg/m2, CBZ25 : cabazitaxel 25 mg/m2, PRED : prednisone/prednisolone, IC : intervalle de confiance, ICI : limite inférieure de l’intervalle de confiance, ICS : limite supérieure de l’intervalle de confiance
a Le rapport de risque est estimé à l’aide d’un modèle de régression de Cox, à risque proportionnel. Un rapport de risque < 1 indique un risque plus faible avec le cabazitaxel à la dose de 20 mg/m2 par rapport à la dose de 25 mg/m2.
Le profil de sécurité du cabazitaxel 25 mg/m2 observé dans l’étude EFC11785 était qualitativement et quantitativement similaire à celui observé dans l’étude EFC6193. L’étude EFC11785 a mis en évidence un meilleur profil de sécurité avec le cabazitaxel à la dose de 20 mg/m2.
Tableau 5 — Résumé des données de sécurité dans le bras cabazitaxel 25 mg/m2 versus bras cabazitaxel 20 mg/m2 dans l’étude EFC11785
|
|
CBZ20+PRED n = 580 |
CBZ25+PRED n = 595 |
|
Nombre médian de cycles/durée médiane du traitement |
6/18 semaines |
7/21 semaines |
|
|
|
|
|
Nombre de patients avec réduction de dose n (%) |
De 20 à 15 mg/m2 : 58 (10,0 %) De 15 à 12 mg/m2 : 9 (1,6 %) |
De 25 à 20 mg/m2 : 128 (21,5 %) De 20 à 15 mg/m2 : 19 (3,2 %) De 15 à 12 mg/m2 : 1 (0,2 %) |
|
|
|
|
|
Effets indésirables tous grades confondusa [%] |
||
|
Diarrhée |
30,7 |
39,8 |
|
Nausées |
24,5 |
32,1 |
|
Fatigue |
24,7 |
27,1 |
|
Hématurie |
14,1 |
20,8 |
|
Asthénie |
15,3 |
19,7 |
|
Appétit diminué |
13,1 |
18,5 |
|
Vomissements |
14,5 |
18,2 |
|
Constipation |
17,6 |
18,0 |
|
Dorsalgie |
11,0 |
13,9 |
|
Neutropénie clinique |
3,1 |
10,9 |
|
Infection des voies urinaires |
6,9 |
10,8 |
|
Neuropathie périphérique sensitive |
6,6 |
10,6 |
|
Dysgueusie |
7,1 |
10,6 |
|
|
|
|
|
Effets indésirables de grade ≥ 3b [%] |
||
|
Neutropénie clinique |
2,4 |
9,6 |
|
Neutropénie fébrile |
2,1 |
9,2 |
|
|
|
|
|
Anomalies hématologiquesc [%] |
||
|
Neutropénie de grade ≥ 3 |
41,8 |
73,3 |
|
Anémie de grade ≥ 3 |
9,9 |
13,7 |
|
Thrombopénie de grade ≥ 3 |
2,6 |
4,2 |
CBZ20 : cabazitaxel 20 mg/m2, CBZ25 : cabazitaxel 25 mg/m2, PRED : prednisone/prednisolone
a Effets indésirables tous grades confondus avec une incidence supérieure à 10 %
b Effets indésirables de grade ≥ 3 avec une incidence supérieure à 5 %
c D’après les valeurs du laboratoire
Dans une étude de phase IV prospective, internationale, randomisée, contre contrôle actif, en ouvert, (LPS14201/étude CARD), 255 patients présentant un cancer de la prostate métastatique résistant à la castration (CPRCm) précédemment traités, quel que soit l’ordre, par un régime à base de docétaxel et des agents ciblant les récepteurs androgéniques (ARTA) (abiratérone ou enzalutamide, avec une progression de la maladie dans les 12 mois suivant l’instauration du traitement), ont été randomisés pour recevoir soit le cabazitaxel 25 mg/m2 toutes les 3 semaines plus prednisone/prednisolone 10 mg par jour (n = 129) soit les ARTA (abiratérone 1 000 mg une fois par jour plus prednisone/prednisolone 5 mg deux fois par jour ou enzalutamide 160 mg une fois par jour) (n = 126). La survie sans progression radiographique (SSPr) définie par le Prostate Cancer Working Group-2 (PCWG2) était le critère d’évaluation principal. Les critères d’évaluation secondaires incluaient la survie globale, la survie sans progression, la réponse au PSA et la réponse tumorale.
Les caractéristiques démographiques et de la pathologie étaient équilibrées entre les deux bras de traitement. A l’inclusion, l’âge médian global était de 70 ans, 95 % des patients avaient un score de performance ECOG entre 0 et 1 et le score de Gleason médian était de 8. Soixante-et-un pour cent (61 %) des patients avaient reçu leur traitement antérieur par ARTA après le docétaxel.
L’étude a atteint le critère d’évaluation principal : la SSPr était significativement plus longue avec le cabazitaxel par rapport à l’ARTA (8,0 mois versus 3,7 respectivement), avec une réduction du risque de progression radiographique de 46 % par rapport à l’ARTA (voir tableau 6 et figure 2).
Tableau 6 — Efficacité du cabazitaxel dans l’étude CARD dans le traitement des patients présentant un cancer de la prostate métastatique résistant à la castration (analyse en intention de traiter) — Survie sans progression radiographique (SSPr)
|
|
Cabazitaxel + prednisone/prednisolone + G-CSF |
ARTA : abiratérone + prednisone/prednisolone ou enzalutamide |
|
|
n = 129 |
n = 126 |
|
Nombre d’événements à la date du gel des données (%) |
95 (73,6 %) |
101 (80,2 %) |
|
SSPr (mois) (IC à 95 %) |
8,0 (5,7 à 9,2) |
3,7 (2,8 à 5,1) |
|
Rapport de risque (RR) (IC à 95 %) |
0,54 (0,40 à 0,73) |
|
|
Valeur de p1 |
< 0,0001 |
|
1 test du log-rank stratifié, seuil de significativité = 0,05
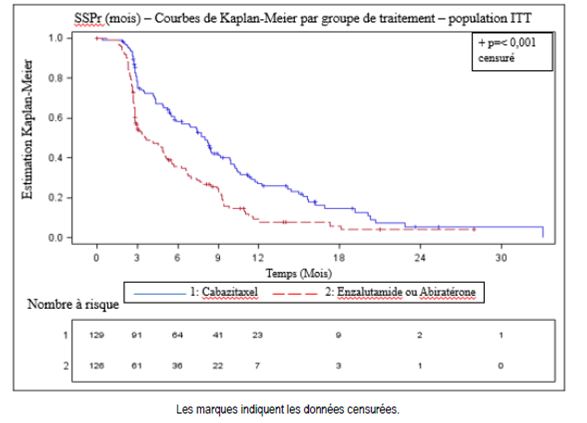
Figure 2 : Critère d’évaluation principal : courbe de Kaplan-Meier de la SSP radiographique (population ITT)
Les analyses en sous-groupes planifiées de la SSPr basées sur des facteurs de stratification à la randomisation ont produit un rapport de risque de 0,61 (IC à 95 % : 0,39 à 0,96) chez les patients ayant reçu l’ARTA antérieur avant le docétaxel et un rapport de risque de 0,48 (IC à 95 % : 0,32 à 0,70) chez les patients ayant reçu l’ARTA antérieur après le docétaxel.
Le cabazitaxel a été statistiquement supérieur aux comparateurs ARTA pour chaque critère d’évaluation secondaire clé protégé par alpha, incluant la survie globale (13,6 mois pour le bras cabazitaxel versus 11,0 mois pour le bras ARTA, RR 0,64, IC à 95 % : 0,46 à 0,89 ; p = 0,008), la survie sans progression (4,4 mois pour le bras cabazitaxel versus 2,7 mois pour le bras ARTA, RR 0,52 ; IC à 95 % : 0,40 à 0,68), la réponse au PSA confirmée (36,3 % pour le bras cabazitaxel versus 14,3 % pour le bras ARTA, p = 0,0003) et la meilleure réponse tumorale (36,5 % pour le bras cabazitaxel versus 11,5 % pour le bras ARTA, p = 0,004).
Le profil de sécurité du cabazitaxel 25 mg/m2 observé dans l’étude CARD était globalement cohérent avec celui observé dans les études TROPIC et PROSELICA (voir rubrique 4.8). L’incidence d’effets indésirables de grade ≥ 3 était de 53,2 % dans le bras cabazitaxel versus 46,0 % dans le bras ARTA. L’incidence d’événements indésirables graves de grade ≥ 3 était de 31,7 % dans le bras cabazitaxel versus 37,1 % dans le bras ARTA. L’incidence des patients ayant arrêté définitivement le traitement à l’étude en raison d’événements indésirables était de 19,8 % dans le bras cabazitaxel versus 8,1 % dans le bras ARTA. L’incidence des patients ayant présenté un événement indésirable fatal était de 5,6 % dans le bras cabazitaxel versus 10,5 % dans le bras ARTA.
Population pédiatrique
L’Agence européenne des médicaments a accordé une dérogation à l’obligation de soumettre les résultats d’études réalisées avec le médicament de référence contenant du cabazitaxel dans tous les sous-groupes de la population pédiatrique dans l’indication du cancer de la prostate (voir rubrique 4.2 pour les informations concernant l’usage pédiatrique).
Le cabazitaxel a été évalué au cours d’une étude de phase I/II, en ouvert, multicentrique menée chez 39 patients pédiatriques au total (âgés de 4 à 18 ans pour la phase I de l’étude et de 3 à 16 ans pour la phase II de l’étude). La phase II n’a pas démontré l’efficacité du cabazitaxel administré en monothérapie dans la population pédiatrique présentant des gliomes infiltrants du tronc cérébral (GITC) récidivants ou réfractaires et des gliomes de haut grade (GHG) traités à la dose de 30 mg/m2.
5.2. Propriétés pharmacocinétiques 
Une analyse de la pharmacocinétique de population a été réalisée chez 170 patients incluant des patients présentant des tumeurs solides avancées (n = 69), un cancer du sein métastatique (n = 34) et un cancer de la prostate métastatique (n = 67). Ces patients ont reçu du cabazitaxel à des doses de 10 à 30 mg/m2 une fois par semaine ou toutes les 3 semaines.
Absorption
Après une administration intraveineuse de 1 heure de cabazitaxel à 25mg/m2 chez des patients présentant un cancer de la prostate métastatique (n = 67), la Cmax était de 226 ng/mL (coefficient de variation [CV] : 107 %) et était atteinte à la fin d’une perfusion de 1 heure (Tmax). L’ASC moyenne était de 991 ng.h/mL (CV : 34 %).
Aucune déviation majeure proportionnelle à la dose n’a été observée de 10 à 30 mg/m2 chez des patients présentant des tumeurs solides avancées (n = 126).
Distribution
Le volume de distribution (VSS) était de 4 870 L (2 640 L/m2 pour un patient avec une surface corporelle médiane de 1,84 m2) à l’état d’équilibre.
In vitro, la liaison du cabazitaxel aux protéines sériques humaines était de 89–92 % et n’était pas saturable jusqu’à 50 000 ng/mL, ce qui couvre les concentrations maximales observées dans les études cliniques. Le cabazitaxel est principalement lié à l’albumine sérique humaine (82,0 %) et aux lipoprotéines (87,9 % pour le HDL, 69,8 % pour le LDL, et 55,8 % pour le VLDL). Le rapport des concentrations in vitro sang-plasma dans le sang humain varie entre 0,90 et 0,99, indiquant que le cabazitaxel était distribué de façon égale entre le sang et le plasma.
Biotransformation
Le cabazitaxel est largement métabolisé dans le foie (> 95 %), principalement par l’isoenzyme CYP3A (80 % à 90 %). Le cabazitaxel est le principal composé circulant dans le plasma humain. Sept métabolites ont été détectés dans le plasma (incluant 3 métabolites actifs issus de la O-déméthylation), le principal représentant 5 % de l’exposition de la molécule mère administrée. Environ 20 métabolites du cabazitaxel sont excrétés dans les urines et fèces humaines.
A partir des études in vitro, le risque potentiel d’inhibition avec le cabazitaxel à des concentrations cliniquement pertinentes est possible vis à vis des produits médicamenteux qui sont principalement des substrats du CYP3A. Cependant, une étude clinique a démontré que le cabazitaxel (25 mg/m2 administré en perfusion unique de 1 heure) ne modifie pas les taux plasmatiques de midazolam, un substrat-test du CYP3A. Par conséquent, aux doses thérapeutiques, la co-administration de substrats du CYP3A et de cabazitaxel ne devrait pas avoir d’impact clinique.
Il n’y a pas de risque potentiel d’inhibition des médicaments qui sont des substrats d’autres enzymes du CYP (1A2, 2B6, 2C9, 2C8, 2C19, 2E1 et 2D6) de même qu’il n’y a pas de risque potentiel d’induction par le cabazitaxel sur des médicaments substrats du CYP1A, CYP2C9 et CYP3A.
Le cabazitaxel n’a pas inhibé in vitro la principale voie de biotransformation de la warfarine en 7-hydroxywarfarine qui est médiée par le CYP2C9. Par conséquent, aucune interaction pharmacocinétique du cabazitaxel sur la warfarine n’est attendue in vivo.
In vitro, le cabazitaxel n’a pas inhibé les protéines multidrogues résistantes (MRP) : MRP1 et MRP2 ou transporteur de cations organiques (OCT1). Le cabazitaxel inhibe le transport assuré par la glycoprotéine P (P-gP) (digoxine, vinblastine), par les protéines résistantes au cancer du sein (BCRP) (méthotrexate) et par le polypeptide transporteur d’anions organiques OATP1B3 (CCK8) à des concentrations au moins 15 fois supérieures à ce qui est observé en clinique tandis qu’il inhibe le transport par OATP1B1 (estradiol-17β-glucuronide) à des concentrations seulement 5 fois supérieures à ce qui est observé en clinique. Par conséquent, le risque d’interaction avec les substrats des MRP, de l’OCT1, de la P-gP, de la BRCP et de l’OATP1B3 est peu probable in vivo à la dose de 25 mg/m2. Le risque d’interaction avec le transporteur OATP1B1 existe notamment pendant la durée de la perfusion (1 heure) et jusqu’à 20 minutes après la fin de la perfusion (voir rubrique 4.5).
Elimination
Après la perfusion intraveineuse de 1 heure de [14C]-cabazitaxel à 25mg/m2, environ 80 % de la dose administrée étaient éliminée en moins de 2 semaines. Le cabazitaxel est principalement éliminé dans les fèces en plusieurs métabolites (76 % de la dose) ; tandis que l’excrétion rénale du cabazitaxel et de ses métabolites représente moins de 4 % de la dose (2,3 % comme médicament inchangé dans les urines).
Le cabazitaxel avait une forte clairance plasmatique de 48,5 L/h (26,4 L/h/m2 pour un patient avec une surface corporelle médiane de 1,84 m2) et une longue demi-vie terminale de 95 heures.
Populations particulières
Patients âgés
Dans les analyses pharmacocinétiques de population chez 70 patients âgés de 65 ans et plus (57 patients âgés de 65 à 75 ans et 13 patients âgés de plus de 75 ans), aucun effet de l’âge sur les paramètres pharmacocinétiques du cabazitaxel n’a été observé.
Patients pédiatriques
La sécurité et l’efficacité du cabazitaxel n’ont pas été établies chez les enfants et les adolescents âgés de moins de 18 ans.
Insuffisants hépatiques
Le cabazitaxel est éliminé principalement par métabolisation hépatique.
Une étude spécifique menée chez 43 patients présentant un cancer et une insuffisance hépatique a démontré l’absence d’influence de l’insuffisance hépatique légère (bilirubine totale > 1 à ≤ 1,5 x LSN ou ASAT > 1,5 x LSN) ou modérée (bilirubine totale > 1,5 à ≤ 3,0 x LSN) sur la pharmacocinétique du cabazitaxel. La dose maximale tolérée (DMT) du cabazitaxel était respectivement de 20 et 15 mg/m2.
Chez 3 patients présentant une insuffisance hépatique sévère (bilirubine totale > 3 x LSN), une baisse de 39 % de la clairance a été observée comparativement aux patients présentant une insuffisance hépatique légère, révélant l’effet de l’insuffisance hépatique sévère sur la pharmacocinétique du cabazitaxel. La DMT du cabazitaxel chez les patients présentant une insuffisance hépatique sévère n’a pas été établie.
D’après les données de sécurité et de tolérance, la dose du cabazitaxel doit être réduite chez les patients présentant une insuffisance hépatique légère (voir rubriques 4.2, 4.4). Le cabazitaxel est contre-indiqué chez les patients présentant une insuffisance hépatique sévère (voir rubrique 4.3).
Insuffisants rénaux
Le cabazitaxel est à peine excrété par les reins (2,3 % de la dose). Une analyse pharmacocinétique de population réalisée chez 170 patients dont 14 patients présentant une insuffisance rénale modérée (clairance de la créatinine comprise entre 30 et 50 mL/min) et 59 patients une insuffisance rénale légère (clairance de la créatinine comprise entre 50 et 80 mL/min), a démontré qu’une insuffisance rénale légère à modérée n’avait pas d’effet significatif sur la pharmacocinétique du cabazitaxel. Cela a été confirmé par une étude pharmacocinétique comparative menée chez des patients atteints d’une tumeur solide et présentant une fonction rénale normale (8 patients), une insuffisance rénale modérée (8 patients) et sévère (9 patients), ayant reçu plusieurs cycles de cabazitaxel en perfusion IV jusqu’à 25 mg/m2 maximum.
5.3. Données de sécurité préclinique 
Les effets indésirables non observés au cours des études cliniques mais observés chez le chien après l’administration d’une dose unique, durant 5 jours consécutifs et à un rythme hebdomadaire, à des niveaux d’exposition plus faible que les niveaux d’exposition clinique et pouvant être pertinents en clinique, étaient des nécroses artériolaires/périartériolaires au niveau du foie, des hyperplasies de la voie biliaire et/ou des nécroses hépatocellulaires (voir rubrique 4.2).
Les effets indésirables non observés au cours des études cliniques mais observés chez le rat lors d’études de toxicité à doses répétées, à des niveaux d’exposition plus élevés que les niveaux d’exposition clinique et pouvant être pertinents en clinique, étaient des troubles oculaires caractérisés par un gonflement/une dégénérescence de la fibre optique sous-capsulaire. Ces effets étaient partiellement réversibles après 8 semaines.
Aucune étude de carcinogénicité n’a été menée avec le cabazitaxel.
Le cabazitaxel n’a pas induit de mutations dans le test de mutation reverse bactérienne (Ames). Il n’était pas clastogénique dans les tests in vitro dans les lymphocytes humains (pas d’induction d’aberration structurale chromosomique mais il augmentait le nombre de cellules polyploïdes) et a induit une augmentation des micronoyaux dans les tests in vivo chez le rat. Ces résultats de génotoxicité (par un mécanisme aneugène) sont inhérents à l’activité pharmacologique de la molécule (inhibition de la dépolymérisation de la tubuline).
Le cabazitaxel n’a pas d’incidence sur les performances d’accouplement ou la fertilité des rats mâles traités. Cependant, dans les études de toxicité à doses répétées, une dégénérescence de la vésicule séminale et une atrophie du tubule séminifère dans les testicules ont été observées chez le rat et une dégénérescence testiculaire (nécrose minime des cellules épithéliales uniques dans l’épididyme) a été observée chez le chien. Les expositions chez les animaux étaient similaires ou plus faibles que celles observées chez les humains recevant des doses cliniquement pertinentes de cabazitaxel.
Le cabazitaxel a induit une toxicité embryofœtale chez le rat femelle traité par voie intraveineuse une fois par jour, du 6e au 17e jour gestationnel, liée à une toxicité maternelle et consistant en des morts fœtales et une diminution du poids moyen fœtal associée à un retard dans l’ossification du squelette. Les expositions chez l’animal étaient plus basses que celles observées chez les humains recevant des doses cliniquement pertinentes de cabazitaxel. Le cabazitaxel passe la barrière placentaire chez le rat.
Chez le rat, le cabazitaxel et ses métabolites sont excrétés dans le lait maternel à une quantité pouvant aller jusqu’à 1,5 % de la dose administrée sur 24 heures.
Evaluation du risque environnemental (ERE)
Les résultats des études d’évaluation du risque environnemental ont indiqué que l’utilisation du cabazitaxel n’aura pas de risque significatif sur l’environnement aquatique (voir rubrique 6.6 relative à l’élimination des médicaments non utilisés).
Polysorbate 80, éthanol anhydre, acide citrique.
Flacon non ouvert
3 ans
Après ouverture du flacon
La stabilité physico-chimique en cours d’utilisation a été démontrée pendant 4 semaines entre 2 °C et 8 °C.
D’un point de vue microbiologique, le produit doit être utilisé immédiatement. En cas d’utilisation non immédiate, les durées et conditions de conservation relèvent de la responsabilité de l’utilisateur et ne devraient pas normalement dépasser 24 heures entre 2 °C et 8 °C.
Après la dilution finale dans la poche de perfusion
La stabilité physico-chimique en cours d’utilisation a été démontrée dans les poches pour perfusion exemptes de PVC pendant 14 jours entre 2 °C et 8 °C et pendant 48 heures à 25 °C.
D’un point de vue microbiologique, le produit doit être utilisé immédiatement. En cas d’utilisation non immédiate, les durées et conditions de conservation relèvent de la responsabilité de l’utilisateur et ne devraient pas normalement dépasser 24 heures entre 2 °C et 8 °C, sauf en cas de dilution réalisée dans des conditions d’asepsie contrôlées et validées.
6.4. Précautions particulières de conservation 
Ce médicament ne nécessite pas de précautions particulières de conservation.
Pour les conditions de conservation du médicament après ouverture et dilution, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur 
Flacon en verre transparent (type I) fermé par un bouchon en caoutchouc halobutyle scellé par une capsule en aluminium recouverte d’une sur-capsule en plastique de type flip-off contenant 3 mL de solution à diluer. Une boîte de 1 flacon est disponible.
6.6. Précautions particulières d’élimination et de manipulation 
Le cabazitaxel doit être préparé et administré seulement par un personnel formé à la manipulation des agents cytotoxiques. Les femmes enceintes ne doivent pas manipuler le médicament. Comme tous les autres agents antinéoplasiques, des précautions doivent être prises pendant la manipulation et la préparation de la solution de cabazitaxel, prenant en compte l’utilisation des dispositifs adaptés, des équipements de protection personnelle (comme des gants) et des procédures de préparation. En cas de contact cutané lors de chacune des étapes de manipulation, laver immédiatement et soigneusement la peau avec de l’eau et du savon. En cas de contact avec des muqueuses, laver immédiatement et soigneusement avec de l’eau.
Les poches de perfusion en PVC ou les sets de perfusion en polyuréthane ne doivent pas être utilisés pour la préparation et l’administration de la solution pour perfusion.
Préparation de la solution pour perfusion prête à l’emploi
NE PAS utiliser d’autres médicaments à base de cabazitaxel comprenant 2 flacons (solution à diluer et solvant) avec CABAZITAXEL ZENTIVA 20 mg/mL, solution à diluer pour perfusion, qui contient uniquement 1 flacon de 3 mL (60 mg/3 mL).
CABAZITAXEL ZENTIVA 20 mg/mL, solution à diluer pour perfusion ne nécessite AUCUNE dilution préalable avec un solvant, il est prêt à être ajouté à la solution pour perfusion.
Etape 1
Si les flacons sont conservés au réfrigérateur, laissez reposer le nombre nécessaire de flacons de cabazitaxel, solution à diluer pour perfusion à une température comprise entre 20 °C et 25 °C pendant 5 minutes avant utilisation.
Il peut être nécessaire d’utiliser plusieurs flacons de cabazitaxel 20 mg/mL solution à diluer pour perfusion pour obtenir la dose prescrite au patient. Prélevez de façon aseptique le volume requis de cabazitaxel, solution à diluer pour perfusion avec une seringue graduée munie d’une aiguille de calibre 21G. N’utilisez pas la totalité du contenu du flacon sans contrôle du volume car il pourrait y avoir un surremplissage important.
Chaque mL de médicament contient 20 mg de cabazitaxel.
Etape 2
Injectez le volume requis de cabazitaxel, solution à diluer pour perfusion dans une poche stérile exempte de PVC contenant soit une solution de glucose à 5 % soit une solution de chlorure de sodium à 9 mg/mL (0,9 %). La concentration de la solution pour perfusion doit être comprise entre 0,10 mg/mL et 0,26 mg/mL.
Etape 3
Retirez la seringue et mélangez le contenu de la poche ou du flacon de perfusion par rotation manuelle.
Etape 4
Comme tous les médicaments administrés par voie parentérale, la solution pour perfusion obtenue doit être contrôlée visuellement avant utilisation. Comme la solution pour perfusion est hypersaturée, elle peut parfois cristalliser avec le temps. Dans ce cas, la solution ne doit pas être utilisée et doit être détruite.
La solution pour perfusion doit être utilisée immédiatement. Toutefois, la durée de conservation peut être plus longue sous certaines conditions précisées dans la rubrique 6.3.
Un filtre en ligne de pores de 0,22 micromètre de diamètre (également appelé 0,2 micromètre) est recommandé lors de l’administration.
N’utilisez pas des poches de perfusion en PVC ni de sets de perfusion contenant du polyuréthane pour la préparation et l’administration du cabazitaxel.
Le cabazitaxel ne doit pas être mélangé avec des médicaments autres que ceux mentionnés.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE 
35 RUE DU VAL DE MARNE
75013 PARIS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE 
· 34009 550 827 0 5 : 3 mL en flacon (verre). Boîte de 1.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION 
[à compléter ultérieurement par le titulaire]
Date de première autorisation:{JJ mois AAAA}
10. DATE DE MISE A JOUR DU TEXTE 
[à compléter ultérieurement par le titulaire]
{JJ mois AAAA}
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES 
Liste I.
Médicament réservé à l’usage hospitalier.
Prescription réservée aux spécialistes en oncologie ou en hématologie, ou aux médecins compétents en cancérologie.
Médicament nécessitant une surveillance particulière pendant le traitement.
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |