Dernière mise à jour le 01/12/2025
MOMETASONE TEVA 50 microgrammes/dose, suspension pour pulvérisation nasale
Indications thérapeutiques
Classe pharmacothérapeutique - code ATC : R01A D09
Le furoate de mométasone ne doit pas être confondu avec les stéroïdes anabolisants que les athlètes prennent parfois sous forme de comprimés ou d’injections pour se doper.
La pulvérisation de furoate de mométasone dans le nez permet d’atténuer l’inflammation (gonflement et irritation du nez), les éternuements, les démangeaisons, la congestion nasale et l’écoulement nasal.
Dans quel cas MOMETASONE TEVA 50 microgrammes/dose, suspension pour pulvérisation nasale est-il utilisé ?
Rhume des foins et rhinite perannuelle
Le furoate de mométasone en pulvérisation nasale est utilisé pour traiter les symptômes du rhume des foins (également appelé rhinite allergique saisonnière) et la rhinite perannuelle chez l’adulte et l’enfant à partir de 3 ans.
Le rhume des foins survient à certaines époques de l’année ; il s’agit d’une réaction allergique causée par l’inhalation de pollens des arbres, des graminées, des herbacées et également des moisissures et des spores de champignons. La rhinite perannuelle se produit tout au long de l’année et les symptômes peuvent être causés par une sensibilité à différents éléments tels que les acariens, les poils d’animaux (ou squames), les plumes et certains aliments. Le furoate de mométasone en pulvérisation nasale réduit le gonflement et l’irritation de la muqueuse nasale et apaise ainsi les éternuements, les démangeaisons, le nez congestionné et l’écoulement nasal causés par le rhume des foins ou la rhinite perannuelle.
Polypes nasaux
Le furoate de mométasone en pulvérisation nasale est utilisé pour traiter les polypes nasaux chez les adultes âgés de 18 ans et plus.
Les polypes nasaux sont de petites excroissances de la muqueuse qui tapisse l’intérieur du nez ; ils touchent généralement les deux narines. Le furoate de mométasone en pulvérisation nasale réduit l’inflammation dans la cavité nasale et atrophie progressivement les polypes, soulageant ainsi la sensation de nez bouché qui peut gêner la respiration par le nez.
Présentations
> 1 flacon(s) polyéthylène haute densité (PEHD) de 120 dose(s) avec pompe polypropylène
Code CIP : 279 395-0 ou 34009 279 395 0 1
Déclaration de commercialisation : 04/09/2015
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 4,46 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 5,48 €
- Taux de remboursement :30%
Service médical rendu (SMR)
Amélioration du service médical rendu (ASMR)
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
ANSM - Mis à jour le : 04/10/2024
MOMETASONE TEVA 50 microgrammes/dose, suspension pour pulvérisation nasale
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque pulvérisation (0,1 ml) délivre une dose de 50 microgrammes de furoate de mométasone (sous forme monohydratée). Le poids total d’une pulvérisation est de 100 mg.
Excipient à effet notoire :
Chaque pulvérisation (0,1 ml) contient 20 microgrammes de chlorure de benzalkonium.
Pour la liste complète des excipients, voir rubrique 6.1.
Suspension pour pulvérisation nasale.
Suspension opaque de couleur blanche à blanc cassé.
pH : entre 4,3 et 4,9.
Osmolalité : entre 270 et 330 mOsm/kg.
4.1. Indications thérapeutiques
Le furoate de mométasone en suspension pour pulvérisation nasale est indiqué pour le traitement symptomatique de la polypose nasale chez l’adulte à partir de 18 ans.
4.2. Posologie et mode d'administration
Après amorçage initial de la pompe du flacon pulvérisateur, chaque pulvérisation délivre environ 100 mg de suspension de furoate de mométasone, équivalent à 50 microgrammes de furoate de mométasone sous forme monohydratée dans chaque narine.
Rhinite saisonnière ou perannuelle
Adulte (y compris les sujets âgés) et enfants de 12 ans et plus : la dose habituellement recommandée est de 2 pulvérisations (50 microgrammes/pulvérisation) dans chaque narine une fois par jour (soit une dose totale de 200 microgrammes). Lorsque les symptômes sont stabilisés, la posologie réduite à 1 pulvérisation par narine (soit une dose totale de 100 microgrammes) peut être efficace en traitement d’entretien.
Si les symptômes ne sont pas suffisamment contrôlés, la posologie peut être augmentée à une dose journalière maximale de quatre pulvérisations par narine (soit une dose totale de 400 microgrammes). Une réduction de la posologie est recommandée après stabilisation des symptômes.
Enfants âgés de 3 à 11 ans : la posologie usuelle recommandée est d’une pulvérisation (50 microgrammes/pulvérisation) dans chaque narine une fois par jour (soit une dose totale de 100 microgrammes).
Chez des patients présentant une rhinite allergique saisonnière, un effet clinique significatif a été observé dans les 12 heures suivant la première dose de la suspension pour pulvérisation nasale de furoate de mométasone. Néanmoins, le plein bénéfice du traitement peut ne pas être atteint dans les premières 48 heures. C’est pourquoi, le patient doit poursuivre la prise régulière du traitement pour obtenir le bénéfice thérapeutique complet.
Chez les patients ayant des antécédents de symptômes modérés à sévères de rhinite allergique saisonnière, le traitement par furoate de mométasone en suspension pour pulvérisation nasale peut être initié quelques jours avant le début prévisionnel de la saison des pollens.
Polypose nasale
La posologie initiale usuelle recommandée pour la polypose est de 2 pulvérisations (50 microgrammes/pulvérisation) dans chaque narine une fois par jour (soit une dose journalière totale de 200 microgrammes). Si les symptômes ne sont pas suffisamment contrôlés après 5 à 6 semaines de traitement, la posologie peut être augmentée à une dose journalière de 2 pulvérisations dans chaque narine deux fois par jour (soit une dose journalière totale de 400 microgrammes). La dose de maintien pourra être réduite à la dose minimale efficace. Si aucune amélioration des symptômes n’est observée après 5 à 6 semaines d’administration deux fois par jour, des traitements alternatifs doivent être envisagés.
Les études d’efficacité et tolérance sur le furoate de mométasone en suspension pour pulvérisation nasale dans le traitement des polyposes nasales ont été conduites avec quatre mois de traitement.
Population pédiatrique
Rhinite allergique saisonnière ou rhinite perannuelle
La sécurité d’emploi et l’efficacité du furoate de mométasone en suspension pour pulvérisation nasale n’ont pas été étudiées chez l’enfant de moins de 3 ans.
Polypose nasale
La sécurité d’emploi et l’efficacité du furoate de mométasone en suspension pour pulvérisation nasale n’ont pas été étudiées chez l’enfant et l’adolescent de moins de 18 ans.
Mode d’administration
Avant administration de la première dose, bien agiter le flacon et exercer 10 pressions sur la pompe jusqu’à obtenir une pulvérisation uniforme. Si la dernière utilisation du flacon pulvérisateur remonte à au moins 14 jours, réamorcer le flacon en appuyant 2 fois sur la pompe jusqu’à obtenir une pulvérisation uniforme avant de l’utiliser à nouveau.
Bien agiter le flacon avant chaque utilisation. Le flacon doit être éliminé quand le nombre de doses indiqué a été atteint, ou dans les 2 mois suivant la première utilisation.
· Infection localisée non traitée au niveau de la muqueuse nasale, telle que l’herpès.
· Antécédents récents de chirurgie nasale ou de traumatisme nasal, jusqu’à la cicatrisation, en raison du possible retard à la cicatrisation induit par le corticoïde.
4.4. Mises en garde spéciales et précautions d'emploi
Immunosuppression
Le furoate de mométasone, suspension pour pulvérisation nasale doit être utilisé avec prudence, voire évité, en cas de tuberculose pulmonaire active ou latente, en cas d’infections virales systémiques, bactériennes ou fongiques non traitées.
Les patients recevant des corticoïdes, qui sont potentiellement immunodéprimés, doivent être avertis du risque d’exposition à certaines infections (ex. : varicelle, rougeole) et de l’importance d’obtenir un avis médical si une telle exposition avait lieu.
Effets locaux au niveau des voies nasales
Dans le cadre d’une étude menée auprès de patients souffrant d’une rhinite perannuelle, après 12 mois de traitement avec le furoate de mométasone en suspension pour pulvérisation nasale, il n’a pas été mis en évidence d’atrophie de la muqueuse nasale, de plus le furoate de mométasone a eu tendance à ramener l’aspect de la muqueuse nasale à un état plus proche de l’aspect d’une muqueuse normale. Toutefois, les patients utilisant le furoate de mométasone en suspension pour pulvérisation nasale pendant plusieurs mois ou sur une plus longue durée doivent être examinés régulièrement afin de détecter toute modification de la muqueuse nasale.
En cas de survenue d’une infection fongique nasale ou pharyngée localisée, l’arrêt du traitement à base de furoate de mométasone en suspension pour pulvérisation nasale et le recours à une alternative thérapeutique seront envisagés. La persistance d’une irritation rhinopharyngée peut nécessiter l’interruption du traitement par furoate de mométasone.
Le furoate de mométasone en suspension pour pulvérisation nasale n’est pas recommandé en cas de perforation de la cloison nasale (voir rubrique 4.8).
Dans le cadre des études cliniques, des cas d’épistaxis sont survenus avec une incidence plus importante qu’avec le placebo. L’épistaxis s’est généralement autolimitée et était d’intensité légère (voir rubrique 4.8).
Effets systémiques des corticoïdes
Des effets systémiques des corticostéroïdes nasaux peuvent se produire, en particulier avec des doses élevées prescrites pendant des périodes prolongées. Ces effets sont beaucoup moins susceptibles de se produire qu'avec les corticostéroïdes oraux et ils peuvent varier d'un patient à l'autre et d'une préparation corticostéroïdienne à l'autre. Les effets systémiques potentiels peuvent comporter un syndrome de Cushing, des traits cushingoïdes, une suppression surrénalienne, un retard de croissance chez les enfants et les adolescents, une cataracte, un glaucome et, plus rarement, une série d'effets psychologiques ou comportementaux comportant une hyperactivité psychomotrice, des troubles du sommeil, de l'anxiété, de la dépression ou de l'agressivité (en particulier chez les enfants).
Suite à l’administration de corticoïdes par voie intranasale, des cas d’augmentation de la pression intraoculaire ont été signalés (voir rubrique 4.8).
Le passage d’un traitement prolongé sous corticostéroïdes systémiques au traitement par furoate de mométasone en suspension pour pulvérisation nasale nécessite une attention toute particulière. L’interruption des corticostéroïdes systémiques chez ces patients peut entraîner une insuffisance surrénalienne pendant quelques mois, jusqu’à restauration de la fonction de l’axe hypothalamo-hypophyso-surrénalien (HHS). Si ces patients présentent des signes et des symptômes d’insuffisance surrénalienne ou des symptômes de sevrage (ex. : des douleurs articulaires et/ou musculaires, de la lassitude et, initialement de la dépression), malgré le soulagement des symptômes nasaux, l’administration systémique de corticoïdes doit être reprise et le recours à d’autres modes de traitement et à des mesures adéquates sera nécessaire. Un tel passage peut également démasquer des affections allergiques préexistantes telles qu'une conjonctivite allergique et un eczéma, précédemment inhibées par la corticothérapie systémique.
L’administration de doses plus élevées que celles recommandées peut entraîner une inhibition importante de la fonction surrénalienne. Si des doses plus élevées que celles recommandées sont utilisées, alors une corticothérapie systémique de supplémentation doit être envisagée lors des périodes de stress ou lorsqu’une intervention chirurgicale est prévue.
Troubles visuels
Des troubles visuels peuvent apparaitre lors d'une corticothérapie par voie systémique ou locale. En cas de vision floue ou d'apparition de tout autre symptôme visuel apparaissant au cours d'une corticothérapie, un examen ophtalmologique est requis à la recherche notamment d'une cataracte, d'un glaucome, ou d'une lésion plus rare telle qu'une choriorétinopathie séreuse centrale (CSCR), décrits avec l'administration de corticostéroïdes par voie systémique ou locale.
Polypes nasaux
La sécurité et l’efficacité de la suspension pour pulvérisation nasale de furoate de mométasone n’ont pas été étudiées dans le traitement des polypes unilatéraux, des polypes associés à une mucoviscidose ou des polypes qui obstruent totalement les cavités nasales.
Les polypes unilatéraux dont l’aspect est inhabituel ou irrégulier, en particulier en cas d’ulcère ou de saignement, doivent faire l’objet d’un examen approfondi.
Effets sur la croissance dans la population pédiatrique
Il est recommandé de surveiller régulièrement la taille des enfants qui reçoivent un traitement prolongé par corticostéroïdes nasaux. Si la croissance est ralentie, le traitement doit être revu afin de réduire la dose de corticostéroïde nasal, en la ramenant si possible à la dose la plus faible permettant de maintenir un contrôle efficace des symptômes. En outre, il faut envisager d'adresser le patient à un spécialiste pédiatrique
Symptômes autres que nasaux
Bien que le furoate de mométasone en suspension pour pulvérisation nasale permette de contrôler les symptômes nasaux chez la plupart des patients, l’utilisation concomitante d’un traitement supplémentaire adéquat peut permettre de soulager d’autres symptômes, notamment des symptômes oculaires.
Chlorure de benzalkonium
Le chlorure de benzalkonium peut provoquer des irritations ou un gonflement à l’intérieur du nez, surtout s’il est utilisé sur une longue période.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
(Voir rubrique 4.4 « Mises en garde spéciales et précautions d’emploi » concernant l’usage de corticostéroïdes systémiques.)
Une étude clinique d’interaction avec la loratadine a été réalisée. Aucune interaction n’a été observée.
En cas d’administration concomitante avec des inhibiteurs du CYP3A, y compris des produits contenant du cobicistat, on peut s’attendre à une augmentation du risque d’effets secondaires systémiques. L’association doit être évitée, sauf si les bénéfices sont supérieurs au risque accru d’effets secondaires systémiques des corticostéroïdes; dans ce cas, les patients doivent être surveillés en vue de détecter les éventuels effets secondaires systémiques des corticostéroïdes.
Population pédiatrique
Les études d’interactions n’ont été réalisées que chez l’adulte.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n’existe pas de données, sinon des données limitées, concernant l'utilisation du furoate de mométasone chez la femme enceinte. Les études réalisées sur les animaux ont mis en évidence une toxicité sur la reproduction (voir rubrique 5.3). Comme avec d’autres corticostéroïdes par voie nasale, le furoate de mométasone en suspension pour pulvérisation nasale ne doit pas être utilisé chez la femme enceinte sauf si le bénéfice potentiel pour la mère justifie le risque potentiel pour la mère, le fœtus ou le nourrisson. Le nourrisson dont la mère a reçu des corticostéroïdes pendant la grossesse doit faire l’objet d’une surveillance attentive en raison des risques d’insuffisance surrénalienne.
Allaitement
On ne sait pas si le furoate de mométasone est excrété dans le lait humain. Comme avec les autres préparations à base de corticoïdes administrées par voie nasale, une décision doit être prise soit d’interrompre l’allaitement, soit d’interrompre/de suspendre le traitement par le furoate de mométasone en suspension pour pulvérisation nasale en prenant en compte le bénéfice de l’allaitement pour l’enfant et le bénéfice du traitement pour la femme.
Fertilité
Il n'existe pas de données cliniques concernant l'effet du furoate de mométasone sur la fertilité. Des études réalisées sur les animaux ont montré une toxicité sur la reproduction, mais n’ont montré aucun effet sur la fertilité (voir rubrique 5.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil de sécurité
En général, l'épistaxis a été autolimitée et de faible intensité, et s'est produit avec une incidence plus élevée qu'avec un placebo (5 %), mais avec une incidence comparable ou plus faible que celle observée avec les corticostéroïdes nasaux actifs utilisés comme témoins (jusqu'à 15 %) selon les études cliniques menées chez des patients souffrant d’une rhinite allergique. L’incidence de tous les autres effets a été comparable à celle d'un placebo.
Chez les patients traités pour une polypose nasale, l’incidence globale des effets indésirables était similaire à celle observée chez les patients atteints de rhinite allergique.
Des effets systémiques suite à l’administration de corticoïdes par voie nasale peuvent survenir, notamment lorsqu’ils sont prescrits à fortes doses, sur de longues périodes.
Liste tabulée des effets indésirables
Les effets indésirables liés au traitement (≥ 1 %) rapportés au cours des études cliniques chez des patients présentant une rhinite allergique ou une polypose nasale, et les effets indésirables signalés suite à la commercialisation du produit – quelle que soit l’indication – sont présentés dans le tableau 1. Les effets indésirables sont listés par classe de systèmes d’organes MedDRA. Au sein de chaque classe de systèmes d’organes, les effets indésirables sont classés par fréquence. Les fréquences sont définies comme suit : très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100). La fréquence des effets indésirables signalés suite à la commercialisation du produit est considérée comme « indéterminée », c’est-à-dire qu’elle ne peut être déterminée sur la base des données disponibles.
|
Tableau 1 : effets indésirables liés au traitement, classés par classe de systèmes d’organes et par fréquence |
|||
|
|
Très fréquent |
Fréquent |
Fréquence indéterminée |
|
Infections et infestations |
|
Pharyngite Infection des voies respiratoires supérieures** |
|
|
Affections du système immunitaire |
|
|
Hypersensibilité, y compris des réactions anaphylactiques, angio-œdème, bronchospasme et dyspnée |
|
Affections du système nerveux |
|
Maux de tête |
|
|
Affections oculaires |
|
|
Glaucome Augmentation de la pression intraoculaire Cataractes Vision floue (voir rubrique 4.4) |
|
Affections respiratoires, thoraciques et médiastinales |
Épistaxis* |
Épistaxis Brûlure nasale Irritation nasale Ulcération nasale |
Perforation de la cloison nasale |
|
Affections gastrointestinales |
|
Irritation de la gorge* |
Altérations du goût et de l’odorat |
* effet rapporté dans le traitement de la polypose nasale (deux doses par jour)
** effet rapporté à une fréquence indéterminée dans le traitement de la polypose nasale (deux doses par jour)
Population pédiatrique
Chez l’enfant, l’incidence des événements indésirables rapportés au cours des études cliniques avec le furoate de mométasone, tels que épistaxis (6 %), céphalées (3 %), irritation de la muqueuse nasale (2 %) et éternuements (2 %), est similaire à celle rapportée avec le placebo.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
Symptômes
L’inhalation ou l’administration par voie orale de doses excessives de corticoïdes peut conduire à une inhibition de l'axe hypothalamo-hypophyso-surrénalien.
Prise en charge
En raison de la biodisponibilité systémique < 1 % du furoate de mométasone en suspension pour pulvérisation nasale, il est peu probable qu’un surdosage nécessite d’autres mesures que la simple observation, suivie par l’instauration de la dose prescrite appropriée.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
Le furoate de mométasone est un glucocorticostéroïde qui exerce un effet anti-inflammatoire topique avec un moindre retentissement systémique.
Le mécanisme d’action concernant les effets antiallergiques et anti-inflammatoires du furoate de mométasone réside probablement en majeure partie dans sa capacité à inhiber la libération des médiateurs des réactions allergiques. Le furoate de mométasone inhibe significativement la libération des leucotriènes par les leucocytes des patients allergiques.
En culture cellulaire, le furoate de mométasone a très fortement inhibé la synthèse et la libération de l’IL-1, de l’IL-5, de l’IL-6 et du TNFα ; c’est également un puissant inhibiteur de la production des leucotriènes. Le furoate de mométasone est par ailleurs un inhibiteur très puissant de la production des cytokines Th2, de l’IL-4 et de l’IL-5 par les lymphocytes T CD4+ humains.
Effets pharmacodynamiques
Dans les études utilisant un test de provocation antigénique nasal, le furoate de mométasone en pulvérisation nasale a présenté une activité anti-inflammatoire sur les réponses allergiques précoces et tardives. Cet effet correspondait à une diminution, par rapport au placebo, de l’activité histaminique et des éosinophiles, et par la diminution par rapport aux valeurs de base, des éosinophiles, des neutrophiles et des protéines d’adhésion aux cellules épithéliales.
Chez 28 % des patients présentant une rhinite allergique saisonnière, un effet clinique significatif a été observé dans les 12 heures suivant la première dose de la suspension pour pulvérisation nasale de furoate de mométasone. Le délai médian (50 % de la population étudiée) pour obtenir le soulagement a été de 35,9 heures.
Population pédiatrique
Dans un essai clinique contrôlé versus placebo, aucun retard de croissance n’a été observé chez les patients pédiatriques (n = 49/groupe) recevant une dose de 100 microgrammes de furoate de mométasone en suspension pour pulvérisation nasale par jour pendant un an.
Les données de tolérance et l’efficacité du furoate de mométasone en suspension pour pulvérisation nasale chez les enfants âgés de 3 à 5 ans sont limitées ; une posologie adaptée n’a pu être établie. Dans une étude conduite chez 48 enfants âgés de 3 à 5 ans recevant 50, 100 ou 200 microgrammes de furoate de mométasone par voie nasale par jour pendant 14 jours, aucune différence significative n’a été observée par rapport au placebo en ce qui concerne la variation moyenne du cortisol plasmatique après un test de stimulation à l’ACTH (test au tétracosactide).
L’agence européenne des médicaments a annulé l’obligation de soumettre les résultats des études réalisées avec le furoate de mométasone en suspension pour pulvérisation nasale au sein de tous les sous-groupes d’enfants souffrant de rhinite allergique saisonnière ou d’une rhinite perannuelle (voir rubrique 4.2 pour des informations sur l’utilisation du médicament chez les enfants)
5.2. Propriétés pharmacocinétiques
Absorption
Le furoate de mométasone administré en pulvérisation nasale aqueuse a une biodisponibilité systémique < 1 % dans le plasma avec une méthode de dosage sensible ayant une limite de quantification basse de 0,25 pg/ml.
Distribution
Non applicable, dans la mesure où le mométasone est peu absorbé par voie nasale.
Biotransformation
La faible quantité qui pourrait être déglutie et absorbée subit un effet de premier passage hépatique important.
Elimination
Le furoate de mométasone absorbé est largement métabolisé et les métabolites sont excrétés dans l’urine et dans la bile.
5.3. Données de sécurité préclinique
Les études précliniques montrent que le furoate de mométasone est dépourvu d’effets androgènes, antiandrogènes, œstrogéniques et antiœstrogéniques. Cependant, comme avec les autres glucocorticoïdes, sur les modèles expérimentaux animaux, l’administration par voie orale de fortes doses de 56 mg/kg/jour et de 280 mg/kg/jour exerce une certaine action anti-utérotrophique et un retard de l’ouverture du vagin.
Comme d’autres glucocorticoïdes, le furoate de mométasone présente un potentiel clastogène in vitro à des concentrations élevées. Toutefois, aucun effet mutagène n’est attendu aux doses thérapeutiques préconisées.
Dans les études sur la fonction de reproduction, l’injection sous-cutanée de furoate de mométasone à la dose de 15 microgrammes/kg a entraîné une prolongation de la gestation et des complications lors du travail avec une réduction de la survie et du poids de la progéniture ou une prise de poids. Il n’y a pas eu d’effet sur la fertilité.
Comme d’autres glucocorticoïdes, le furoate de mométasone est tératogène chez les rongeurs et les lapins. Les effets observés ont été la survenue de hernies ombilicales chez le rat, de fentes palatines chez la souris et d’agénésies de la vésicule biliaire, de hernies ombilicales et un fléchissement des pattes avant chez le lapin. Ont également été observés chez le rat, le lapin et la souris une baisse de la prise de poids chez les mères, un retentissement sur la croissance des fœtus (poids fœtal inférieur à la normale et/ou retard de l’ossification), de même qu’une diminution de la survie de la progéniture chez la souris.
Le potentiel cancérogène du furoate de mométasone en inhalation (aérosol délivré par un flacon pressurisé avec un gaz propulseur CFC et un tensioactif) à des concentrations allant de 0,25 à 2,0 microgrammes/l a été étudié pendant 24 mois chez la souris et le rat. Les effets caractéristiques des glucocorticoïdes, incluant l’apparition de plusieurs lésions non néoplasiques, ont été observés. Il n’a pas été possible d’établir de relation dose-réponse statistiquement significative pour aucune des tumeurs étudiées.
Après ouverture : à utiliser dans les 8 semaines.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C. Ne pas congeler.
6.5. Nature et contenu de l'emballage extérieur
60 doses en flacon blanc (PEHD) de polyéthylène de haute densité de 10 g avec une pompe pour pulvérisation en polypropylène. Boîte de 1.
120 doses en flacon blanc (PEHD) de polyéthylène de haute densité de 18 g avec une pompe pour pulvérisation en polypropylène. Boîte de 1.
140 doses en flacon blanc (PEHD) de polyéthylène de haute densité de 18 g avec une pompe pour pulvérisation en polypropylène. Boîte de 1, 2, et 3.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières pour l’élimination.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
100-110, ESPLANADE DU GENERAL DE GAULLE
92931 PARIS LA DEFENSE CEDEX
FRANCE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 276 377 1 1 : 60 doses en flacon (PEHD) avec pompe pour pulvérisation. Boîte de 1.
· 34009 279 395 0 1 : 120 doses en flacon (PEHD) avec pompe pour pulvérisation. Boîte de 1.
· 34009 276 378 8 9 : 140 doses en flacon (PEHD) avec pompe pour pulvérisation. Boîte de 1.
· 34009 585 825 9 2 :140 doses en flacon (PEHD) avec pompe pour pulvérisation. Boîte de 2.
· 34009 585 826 5 3 : 140 doses en flacon (PEHD) avec pompe pour pulvérisation. Boîte de 3.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament soumis à prescription médicale.
Liste I.
ANSM - Mis à jour le : 04/10/2024
MOMETASONE TEVA 50 microgrammes/dose, suspension pour pulvérisation nasale
Furoate de mométasone
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que MOMETASONE TEVA 50 microgrammes/dose, suspension pour pulvérisation nasale et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser MOMETASONE TEVA 50 microgrammes/dose, suspension pour pulvérisation nasale ?
3. Comment utiliser MOMETASONE TEVA 50 microgrammes/dose, suspension pour pulvérisation nasale ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver MOMETASONE TEVA 50 microgrammes/dose, suspension pour pulvérisation nasale ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE MOMETASONE TEVA 50 microgrammes/dose, suspension pour pulvérisation nasale ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC : R01A D09
Le furoate de mométasone ne doit pas être confondu avec les stéroïdes anabolisants que les athlètes prennent parfois sous forme de comprimés ou d’injections pour se doper.
La pulvérisation de furoate de mométasone dans le nez permet d’atténuer l’inflammation (gonflement et irritation du nez), les éternuements, les démangeaisons, la congestion nasale et l’écoulement nasal.
Dans quel cas MOMETASONE TEVA 50 microgrammes/dose, suspension pour pulvérisation nasale est-il utilisé ?
Rhume des foins et rhinite perannuelle
Le furoate de mométasone en pulvérisation nasale est utilisé pour traiter les symptômes du rhume des foins (également appelé rhinite allergique saisonnière) et la rhinite perannuelle chez l’adulte et l’enfant à partir de 3 ans.
Le rhume des foins survient à certaines époques de l’année ; il s’agit d’une réaction allergique causée par l’inhalation de pollens des arbres, des graminées, des herbacées et également des moisissures et des spores de champignons. La rhinite perannuelle se produit tout au long de l’année et les symptômes peuvent être causés par une sensibilité à différents éléments tels que les acariens, les poils d’animaux (ou squames), les plumes et certains aliments. Le furoate de mométasone en pulvérisation nasale réduit le gonflement et l’irritation de la muqueuse nasale et apaise ainsi les éternuements, les démangeaisons, le nez congestionné et l’écoulement nasal causés par le rhume des foins ou la rhinite perannuelle.
Polypes nasaux
Le furoate de mométasone en pulvérisation nasale est utilisé pour traiter les polypes nasaux chez les adultes âgés de 18 ans et plus.
Les polypes nasaux sont de petites excroissances de la muqueuse qui tapisse l’intérieur du nez ; ils touchent généralement les deux narines. Le furoate de mométasone en pulvérisation nasale réduit l’inflammation dans la cavité nasale et atrophie progressivement les polypes, soulageant ainsi la sensation de nez bouché qui peut gêner la respiration par le nez.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER MOMETASONE TEVA 50 microgrammes/dose, suspension pour pulvérisation nasale ?
N’utilisez jamais MOMETASONE TEVA 50 microgrammes/dose, suspension pour pulvérisation nasale :
· Si vous êtes allergique au furoate de mométasone ou à l’un des autres composants contenus dans ce médicament (mentionnés à la rubrique 6).
· Si vous avez une infection nasale non traitée. L’utilisation de furoate de mométasone en pulvérisation nasale lors d’une infection du nez non traitée, telle que de l’herpès, peut aggraver l’infection. Vous devez attendre que l’infection soit guérie avant d’utiliser le pulvérisateur nasal.
· Si vous avez récemment été opéré du nez ou été blessé au nez. Vous ne devez pas utiliser le pulvérisateur nasal avant que votre nez soit cicatrisé.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser MOMETASONE TEVA 50 microgrammes/dose, suspension pour pulvérisation nasale :
· si vous avez ou avez eu la tuberculose ;
· si vous avez une autre infection ;
· si vous suivez un traitement par corticostéroïdes autres que le furoate de mométasone, par voie orale ou en injection ;
· si vous êtes atteint de la mucoviscidose.
Pendant que vous utilisez MOMETASONE TEVA 50 microgrammes/dose, suspension pour pulvérisation nasale, adressez-vous à votre médecin :
· si votre système immunitaire ne fonctionne pas bien (si vous avez du mal à lutter contre les infections) et si vous entrez en contact avec un sujet qui a la rougeole ou la varicelle. Vous devez éviter tout contact avec les personnes souffrant de ces infections ;
· si vous avez une infection du nez ou de la gorge ;
· si vous utilisez le médicament depuis quelques mois ou plus ;
· si vous présentez une irritation persistante du nez ou de la gorge.
L’administration de corticoïdes par voie nasale, à des doses élevées et sur de longues périodes, peut entraîner des effets indésirables en raison de l’absorption du médicament par l’organisme.
Si vos yeux vous démangent ou sont irrités, votre médecin pourra vous recommander d’utiliser d’autres traitements en plus de MOMETASONE TEVA.
Contactez votre médecin en cas de vision floue ou d’autres troubles visuels.
Enfants
L’administration de corticoïdes par voie nasale, à des doses élevées et sur de longues périodes, peut entraîner certains effets indésirables chez les enfants, tels qu’un retard de croissance.
Il est recommandé de régulièrement contrôler la taille des enfants recevant des corticoïdes par voie nasale sur le long terme. Si des changements anormaux sont observés, il conviendra d’avertir leur médecin.
Autres médicaments et MOMETASONE TEVA 50 microgrammes/dose, suspension pour pulvérisation nasale
Veuillez avertir votre médecin ou pharmacien si vous prenez ou avez pris récemment tout autre médicament, y compris des médicaments obtenus sans prescription.
Si vous prenez d’autres corticostéroïdes, par voie orale ou en injection, pour traiter une allergie, votre médecin peut vous conseiller d’arrêter de les prendre dès que vous commencez MOMETASONE TEVA. Certaines personnes peuvent présenter des effets indésirables, par exemple des douleurs articulaires ou musculaires, une faiblesse ou une dépression, dès qu’ils cessent de prendre les corticostéroïdes par voie orale ou en injection. Il se peut qu’apparaissent d’autres symptômes d’allergie par exemple des démangeaisons oculaires, des larmoiements, ou des rougeurs et des démangeaisons cutanées. Si vous souffrez de l’un de ces effets, consultez votre médecin.
Certains médicaments peuvent augmenter les effets de MOMETASONE TEVA et il est possible que votre médecin souhaite vous surveiller attentivement si vous prenez ces médicaments (y compris certains médicaments pour traiter l’infection à VIH : ritonavir, cobicistat).
MOMETASONE TEVA 50 microgrammes/dose, suspension pour pulvérisation nasale avec des aliments et boissons
Sans objet.
Grossesse, allaitement et fertilité
Il n’existe que peu ou pas d’informations sur l’utilisation du furoate de mométasone chez les femmes enceintes. On ne sait pas si le furoate de mométasone est excrété dans le lait maternel.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant d’utiliser ce médicament.
Conduite de véhicules et utilisation de machines
On ne dispose d’aucune information sur l’effet du furoate de mométasone sur l’aptitude à conduire des véhicules ou à utiliser des machines.
MOMETASONE TEVA 50 microgrammes/dose, suspension pour pulvérisation nasale contient du chlorure de benzalkonium.
Ce médicament contient 20 microgrammes de chlorure de benzalkonium dans chaque pulvérisation (0,1 ml).
Le chlorure de benzalkonium peut provoquer des irritations ou un gonflement à l’intérieur du nez, surtout s’il est utilisé sur une longue période.
3. COMMENT UTILISER MOMETASONE TEVA 50 microgrammes/dose, suspension pour pulvérisation nasale ?
Posologie
Traitement du rhume des foins et de la rhinite perannuelle
Utilisation chez l’adulte et l’enfant âgé de 12 ans et plus
La dose recommandée est de deux pulvérisations dans chaque narine une fois par jour.
· Une fois les symptômes contrôlés, votre médecin vous conseillera peut-être de réduire la dose à une seule pulvérisation dans chaque narine une fois par jour.
· Si vous ne ressentez aucune amélioration, consultez votre médecin et il ou elle vous dira peut-être d’augmenter la dose ; la quantité journalière maximale est de quatre pulvérisations dans chaque narine une fois par jour.
Utilisation chez l’enfant de 3 à 11 ans
La dose recommandée est d’une pulvérisation dans chaque narine une fois par jour.
Chez certains patients MOMETASONE TEVA commence à soulager les symptômes dans les 12 heures après la première administration, cependant tous les effets du traitement peuvent ne pas être observés dans les 2 premiers jours. Par conséquent, vous devez continuer à prendre régulièrement votre traitement pour en ressentir tous les bénéfices.
Si vous ou votre enfant avez un rhume des foins très invalidant, votre médecin peut vous inviter à commencer le furoate de mométasone quelques jours avant le début de la saison pollinique pour vous aider à éviter les symptômes de l’allergie. À la fin de la saison pollinique, les symptômes du rhume des foins sont normalement moins prononcés et le traitement n’est plus forcément nécessaire.
Polypes nasaux
Utilisation chez l’adulte de plus de 18 ans
La dose initiale recommandée est de deux pulvérisations dans chaque narine une fois par jour.
· Si les symptômes ne sont pas contrôlés après 5 à 6 semaines de traitement, la dose peut être augmentée à deux pulvérisations dans chaque narine deux fois par jour. Une fois les symptômes contrôlés, votre médecin vous prescrira une dose réduite à la dose minimale suffisante pour que ce contrôle soit maintenu.
· Si vous ne ressentez aucune amélioration après 5 à 6 semaines de traitement avec l’administration biquotidienne, contactez votre médecin pour envisager de remplacer MOMETASONE TEVA par d’autres traitements.
Préparation du pulvérisateur nasal
MOMETASONE TEVA 50 microgrammes/dose, suspension pour pulvérisation nasale dispose d’un bouchon anti-poussière qui protège l’embout et le maintient propre. N’oubliez pas de le retirer avant d’utiliser le flacon pulvérisateur et de le remettre ensuite.
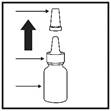
Si vous utilisez le flacon pulvérisateur pour la première fois, vous devez « amorcer » le flacon en exerçant 10 pressions sur le pulvérisateur jusqu’à obtenir une brume fine.
1. Bien agiter le flacon.
2. Placez votre index et votre majeur de chaque côté de l’embout et votre pouce sous le flacon. Ne percez pas l’applicateur nasal.
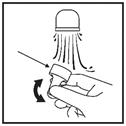
3. Orientez l’embout dans une autre direction que la vôtre, et appuyez 10 fois sur la pompe pour amorcer le pulvérisateur jusqu’à obtenir une brume fine (Figure 1).
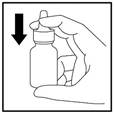
Figure 1
Si la dernière utilisation de votre pulvérisateur remonte à au moins 14 jours, vous devez réamorcer le flacon en appuyant 2 fois sur le flacon pulvérisateur jusqu’à obtenir une brume fine.
Durée du traitement avec un flacon
A la dose normale de deux pulvérisations une fois par jour dans chaque narine, pour le traitement du rhume des foins, de la rhinite perannuelle et des polypes nasaux, vous devez avoir suffisamment de produit pour 15 jours de traitement (pour le flacon contenant 60 doses-pulvérisations), pour 30 jours de traitement (pour le flacon contenant 120 doses-pulvérisations) ou pour 35 jours de traitement (pour le flacon contenant 140 doses-pulvérisations).
Utilisation du pulvérisateur nasal
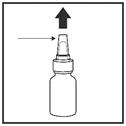
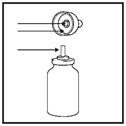
1. Bien agiter le flacon et retirez le bouchon. (Figure 2)
|
bouchon
pulvérisateur
Flacon |
Figure 2 |
2. Mouchez-vous délicatement.
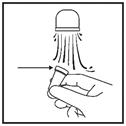
3. Fermez l’une de vos narines en appuyant dessus avec votre doigt et insérez l’embout du pulvérisateur dans l’autre comme indiqué (Figure 3)
Inclinez légèrement la tête en avant en maintenant le flacon à la verticale.
Dirigez la pointe du pulvérisateur vers le côté de la narine et non vers le milieu (septum nasal). 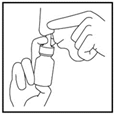 Figure 3
Figure 3
4. Commencez à respirer doucement ou lentement par le nez, et pendant que vous inspirez, exercez UNE SEULE pression sur le pulvérisateur (Figure 4).
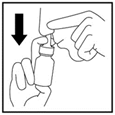 Figure 4
Figure 4
5. Expirez par la bouche. Répétez, si besoin, l’étape 4 et inspirez une deuxième fois le produit dans la même narine.
6. Retirez l’embout de la narine et expirez par la bouche.
7. Répétez les étapes 3 à 6 pour l’autre narine (Figure 5)
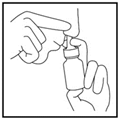 Figure 5
Figure 5
Lorsque vous avez terminé, essuyez soigneusement l’embout avec un mouchoir propre, et remettez le bouchon.
Nettoyage du pulvérisateur nasal
· Il est important de nettoyer régulièrement votre pulvérisateur pour éviter les dysfonctionnements.
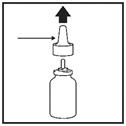
· Retirez le bouchon (Figure 6) et ôtez délicatement le pulvérisateur (Figure 7).
|
bouchon |
|
Pulvérisateur |
|
· Lavez le bouchon (Figure 8) et le pulvérisateur (Figure 9) dans de l’eau chaude, et rincez à l’eau courante.
|
bouchon |
|
pulvérisateur
|
|
· N’essayez pas de déboucher l’applicateur nasal en introduisant une épingle ou tout autre objet pointu, vous risqueriez d’endommager l’applicateur et de ne plus pouvoir obtenir la bonne dose.
· Laissez sécher le bouchon et l’embout dans un endroit chaud.
· Remettez l’embout sur le flacon (Figure 10), puis le bouchon (Figure 11).
|
Trou central embout Systeme de pompe |
Figure 10 |
Figure 11 |
· Après son nettoyage, le pulvérisateur nécessite d’être réamorcé à l’aide de 2 pulvérisations pour pouvoir être réutilisé (Figure 12).
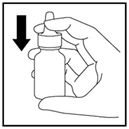 Figure 12
Figure 12
Si vous avez utilisé plus de MOMETASONE TEVA 50 microgrammes/dose, suspension pour pulvérisation nasale que vous n’auriez dû :
Si vous avez pris accidentellement une dose plus forte que la dose prescrite, avertissez votre médecin.
L’utilisation de corticostéroïdes pendant longtemps ou en grandes quantités peut agir sur la production de certaines hormones, mais ceci est rare. Chez l’enfant, ils peuvent avoir des conséquences sur la croissance et le développement.
Si vous oubliez d’utiliser MOMETASONE TEVA 50 microgrammes/dose, suspension pour pulvérisation nasale :
Si vous avez oublié de prendre une dose de MOMETASONE TEVA à l’heure habituelle, prenez-la dès que vous vous en apercevez, puis poursuivez comme avant. Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez d’utiliser MOMETASONE TEVA 50 microgrammes/dose, suspension pour pulvérisation nasale :
Chez certains patients, MOMETASONE TEVA devrait commencer à soulager les symptômes 12 heures après la première dose ; néanmoins, le bénéfice total du traitement peut ne pas apparaître avant deux jours. Il est très important que vous utilisiez votre pulvérisateur nasal régulièrement. N'arrêtez pas le traitement, même si vous vous sentez mieux, à moins que votre médecin ne vous dise de le faire.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Des réactions d’hypersensibilité immédiate (allergies) peuvent se produire après utilisation du produit. Ces réactions peuvent être graves. Vous devez arrêter d’utiliser MOMETASONE TEVA et consulter immédiatement un médecin si vous développez les symptômes suivants :
· gonflement du visage, de la langue ou du pharynx,
· difficulté à déglutir,
· urticaire,
· respiration sifflante ou difficulté à respirer.
L’administration de corticoïdes par voie nasale, à des doses élevées et sur de longues périodes, peut entraîner des effets indésirables en raison de l’absorption du médicament par l’organisme.
Autres effets indésirables
La plupart du temps, le furoate de mométasone en pulvérisateur nasal ne provoque aucun effet indésirable. Toutefois, suite à l’administration de MOMETASONE TEVA ou d’autres corticoïdes par voie nasale, certaines personnes peuvent présenter les effets suivants :
Effets indésirables fréquents (pouvant affecter jusqu’à 1 personne sur 10) :
· céphalées,
· éternuements et irritation/sensation de brûlure du nez,
· saignements de nez [très fréquents (pouvant toucher plus d’une personne sur 10) chez les personnes présentant des polypes nasaux et recevant deux pulvérisations de MOMETASONE TEVA dans chaque narine, deux fois par jour],
· douleur nasale ou mal de gorge,
· ulcères dans le nez,
· infection des voies respiratoires.
Fréquence indéterminée (la fréquence ne peut être estimée sur la base des données disponibles) :
· augmentation de la pression dans l'œil (glaucome) et/ou cataractes provoquant des troubles visuels,
· lésion de la cloison du nez qui sépare les narines,
· modification du goût ou de l’odorat,
· difficulté à respirer et/ou respiration sifflante,
· vision floue.
Autres effets indésirables chez l'enfant et chez l'adolescent
La fréquence et le type d’effets indésirables attendus chez l’enfant sont les mêmes que chez l’adulte. L'usage à long terme de fortes doses de corticostéroïdes par voie nasale peut entraîner certains effets indésirables, comme par exemple ralentir la croissance de l'enfant. Il est recommandé de surveiller régulièrement la taille de l'enfant qui reçoit des corticostéroïdes par voie nasale au long cours, et de signaler au médecin tout changement observé.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER MOMETASONE TEVA 50 microgrammes/dose, suspension pour pulvérisation nasale ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur le flacon et la boîte après EXP. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas 25°C. Ne pas congeler. Après ouverture, à utiliser dans les 8 semaines.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient MOMETASONE TEVA 50 microgrammes/dose, suspension pour pulvérisation nasale
· La substance active est : le furoate de mométasone.
Chaque pulvérisation (0,1 ml) délivre une dose de 50 microgrammes de furoate de mométasone (sous forme monohydratée). Le poids total d’une pulvérisation est de 100 mg.
· Les autres composants sont :
Cellulose microcristalline et carmellose sodique, glycérol, citrate de sodium dihydraté, acide citrique monohydraté, polysorbate 80, chlorure de benzalkonium (voir rubrique 2) et eau pour préparations injectables.
Mométasone Teva est une suspension pour pulvérisation nasale.
Chaque flacon permet 60, 120 ou 140 pulvérisations.
Les flacons de 60 ou 120 pulvérisations sont fournis à l’unité.
Les flacons de 140 pulvérisations sont fournis à l’unité, ou par boîte de 2 ou 3 flacons.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
100-110, ESPLANADE DU GENERAL DE GAULLE
92931 PARIS LA DEFENSE CEDEX
FRANCE
Exploitant de l’autorisation de mise sur le marché
100-110, ESPLANADE DU GENERAL DE GAULLE
92931 PARIS LA DEFENSE CEDEX
FRANCE
OSTRAVSKA 305/29
KOMAROV
747 70 OPAVA
REPUBLIQUE TCHEQUE
ou
MERCKLE GMBH
LUDWIG-MERCKLE-STRAßE 3,
89143 BLAUBEUREN
ALLEMAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France) : www.ansm.sante.fr.