Dernière mise à jour le 08/01/2026
CARBOCAINE 20 mg/ml, solution injectable
Indications thérapeutiques
ANESTHESIQUE LOCAL. (N : système nerveux central). Code ATC : N01BB
Ce médicament est indiqué :
· Pour les anesthésies limitées à une région du corps notamment lors d’intervention chirurgicale (sauf en obstétrique).
Présentations
> 5 ampoule(s) polypropylène de 20 ml
Code CIP : 352 429-3 ou 34009 352 429 3 8
Déclaration de commercialisation : 01/01/2000
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l\'aide)
ANSM - Mis à jour le : 24/03/2025
CARBOCAINE 20 mg/ml, solution injectable.
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Pour 1 ml
Une ampoule de 20 ml contient 400 mg de mépivacaïne.
Excipients à effet notoire : sodium.
Ce médicament contient 55 mg de sodium par ampoule.
Pour la liste complète des excipients, voir rubrique 6.1.
4.1. Indications thérapeutiques
· Anesthésie locale par infiltration.
· Anesthésie régionale lors d'intervention chirurgicale (sauf en obstétrique) : anesthésie tronculaire, plexique, caudale, péridurale.
4.2. Posologie et mode d'administration
La forme et la concentration utilisée varient en fonction de l’indication et du but recherché, de l’âge et de l’état pathologique du patient.
L’anesthésie obtenue est habituellement fonction de la dose totale administrée.
La dose à injecter est fonction de la technique d’anesthésie pour laquelle le produit est utilisé.
La mépivacaïne n’a pas été approuvée pour l’usage intra-articulaire continu post-opératoire et ne doit donc pas être utilisée dans ce cadre (voir rubrique 4.4).
Adultes
Le tableau suivant donne à titre indicatif les posologies pour les techniques couramment utilisées. L’expérience du médecin et la connaissance de l’état clinique du patient sont importantes dans le choix de la dose. Lors de l’utilisation de blocs prolongés, par l’administration répétée, les risques d’atteindre une concentration plasmatique toxique ou de provoquer un traumatisme nerveux local doivent être pris en considération.
La mépivacaïne 20 mg/ml n’est pas recommandée pour les blocs intercostaux en l’absence d’adrénaline, ni chez l’enfant.
|
Conc mg/ml |
Volume ml |
Dose mg |
Délai d’installation minutes |
Durée heures |
|
|
Anesthésie Chirurgicale |
|||||
|
Administration péridurale lombaire |
20 |
15-20 |
300-400 |
15-20 |
1,5-2 |
|
Administration péridurale thoracique |
10-20 |
5-12 |
50-240 |
10-20 |
1,5-2 |
|
Bloc caudala |
10 20 |
20-30 15-25 |
200-300 300-500 |
15-30 15-30 |
1-1,5 1,5-2 |
|
Anesthésie régionale intraveineuse (ALRIV) |
|||||
|
a. membres supérieursa |
5 |
40 |
200 |
10-15 |
Jusqu'au relâchement du garrot |
|
Blocs nerveux (petit nerf périphérique et infiltration) |
|||||
|
- infiltration |
5 10 |
<80 <40 |
<400 <400 |
1-2 1-2 |
1,5-2 2-3 |
|
-bloc digital |
10 |
1-5 |
10-50 |
2-5 |
1,5-2 |
|
-bloc intercostal (par segment)-nombre maximal de blocs nerveux simultanés doit être au maximum de 10 |
10 |
4 |
<400 (Dose cumulée de chacune des injections) |
3-5 |
1-2 |
|
-bloc péribulbaire |
20 |
5-7,5 |
100-150 |
3-5 |
1,5-2 |
|
Blocs nerveux périphériques majeurs |
|||||
|
- bloc paracervical (de chaque côté)b |
10 |
10 |
100 |
3-5 |
1-1,5 |
|
- bloc plexus brachial - axilaire - supraclaviculaire, interscalenique et |
10 10 |
40 30-40 |
400 300-400 |
15-30 15-30 |
1,5-2 1,5-2 |
|
- bloc du nerf sciatique |
20 |
15-25 |
300-500 |
15-30 |
2-3 |
|
- Bloc fémoral ou bloc du fascia iliaca |
10 |
30-50 |
300-500 |
15-30 |
1,5-2 |
a. Ne pas relâcher le garrot dans les 20 min suivant l’injection.
b. Non recommandée durant l’accouchement.
Populations particulières
lnsuffisants hépatiques
Aucune réduction de dose n'est nécessaire lors d'une anesthésie avant chirurgie chez les patients atteints d'insuffisance hépatique. Dans le cas d'anesthésie prolongée par blocs nerveux, par exemple lors d'administrations répétées, les doses répétées de mepivacaïne doivent être réduites de 50% chez les patients atteints d'une insuffisance hépatique au stade de Child C et une dose quotidienne totale de 750 mg de mepivacaïne ne doit pas être dépassée (voir rubrique 4.4).
lnsuffisants rénaux
Aucune réduction de dose n'est nécessaire lors d'une anesthésie avant chirurgie de moins de 24 heures chez les patients atteints d'insuffisance rénale (voir rubriques 4.4 et 5.2).
· Enfant en raison de l’absence de données cliniques.
· Hypersensibilité aux anesthésiques locaux à liaison amide.
· L’anesthésie locorégionale est généralement déconseillée chez les malades sous anticoagulants.
· Troubles de la conduction auriculoventriculaire nécessitant un entraînement électrosystolique permanent non encore réalisé.
· Epilepsie non contrôlée par un traitement.
· Injections intravasculaires.
· Sujets porphyriques.
4.4. Mises en garde spéciales et précautions d'emploi
L’attention des sportifs est attirée sur le fait que cette spécialité contient un principe actif pouvant induire une réaction positive des tests pratiqués lors des contrôles antidopage.
Un surdosage ou une injection IV rapide accidentelle peut provoquer des réactions toxiques.
Il n’est pas recommandé de faire une anesthésie locale par infiltration dans les zones infectées et inflammatoires.
Des cas de chondrolyse ont été rapportés chez des patients recevant une perfusion continue intra-articulaire d’anesthésiques locaux en post-opératoire. La majorité des cas rapportés de chondrolyse impliquaient l’articulation de l’épaule. En raison de multiples facteurs contributifs et de l’inconsistance de la littérature scientifique concernant le mécanisme d’action, un lien de causalité n’a pas été établi. La perfusion continue intra-articulaire de Carbocaïne n’est pas une indication approuvée de ce médicament.
Une anesthésie épidurale peut conduire à une hypotension et à une bradycardie. L’hypotension devra être rapidement traitée par l’administration d’un vasopresseur en injection intraveineuse et par un remplissage vasculaire adapte.
Les injections rétrobulbaires peuvent très occasionnellement atteindre l'espace sous-arachnoïdien crânien, pouvant provoquer une cécité temporaire, un collapsus cardiovasculaire, une apnée, des convulsions. Ces complications doivent être diagnostiquées et traitées rapidement.
Les injections rétrobulbaires et péribulbaires d'anesthésiques locaux présentent un faible risque de dysfonction persistante des muscles oculaires. Les causes principales sont un traumatisme et/ou des effets toxiques locaux sur les muscles et/ou les nerfs. La sévérité de ces réactions tissulaires est liée à l'importance du traumatisme, à la concentration de l'anesthésique local et à la durée d'exposition du tissu à l'anesthésique local. Pour cette raison, comme avec tous les anesthésiques locaux, il faut utiliser la plus faible concentration efficace et la plus faible dose d’anesthésique local. Les vasoconstricteurs peuvent aggraver les réactions tissulaires et ne doivent être utilisés que s'ils sont indiqués.
Précautions d'emploi
L’utilisation de la mépivacaïne nécessite :
Lors de l’anesthésie locale,
· un interrogatoire destiné à connaître le terrain, les thérapeutiques en cours, les antécédents du patient.
· si nécessaire, une prémédication par une benzodiazépine à dose modérée,
· de faire l’injection strictement hors des vaisseaux après aspirations répétées,
· de disposer d’un matériel de réanimation (en particulier d’une source d’oxygène),
· de disposer d’une émulsion lipidique à administrer en cas d’intoxication avec signes cliniques de neurotoxicité ou de cardiotoxicité.
En outre, lors de l’anesthésie régionale (caudale, péridurale, tronculaire, plexique),
· de disposer d’une voie veineuse et d’un matériel complet de réanimation,
· de disposer de médicaments aux propriétés anticonvulsivantes (thiopental, benzodiazépines), myorelaxantes (benzodiazépines), d’atropine et de vasopresseurs,
· une surveillance électrocardiographique continue (cardioscopie), et tensionnelle,
· de pratiquer une injection test de 3 à 4 ml,
· d’injecter lentement en réaspirant fréquemment,
· de maintenir le contact verbal avec le patient.
lnsuffisants hépatiques sévères et insuffisants rénaux sévères
Chez les insuffisants hépatiques sévères (stade de Child C), les données disponibles sur la lidocaïne suggèrent que la clairance peut être réduite d'environ 50% (voir rubrique 4.2).
Une diminution cliniquement significative de la clairance de la mepivacaïne n’est attendue que chez les patients atteints d'insuffisance rénale sévère (CL(cr) < 30 ml/min) qui ne sont pas hémodialysés.
Une diminution de la clairance ne devrait pas impacter la survenue d'une toxicité liée aux concentrations plasmatiques élevées après une dose de mépivacaïne lors d'une anesthésie avant chirurgie. Néanmoins, chez l'insuffisant rénal chronique, la clairance du métabolite de la mépivacaïne PPX excrété par voie rénale est diminuée et une accumulation peut survenir après une administration répétée (voir rubrigue 4 .2).
La mépivacaïne étant métabolisée par le foie, les doses doivent être limitées chez l’insuffisant hépatique sévère. Un renouvellement éventuel des injections, par exemple pour l’anesthésie péridurale, doit être strictement surveillé chez de tels sujets, pour éviter un surdosage relatif par insuffisance de métabolisation.
Pour la même raison, la mépivacaïne doit être utilisée avec précaution chaque fois qu’une pathologie (état de choc, insuffisance cardiaque) ou une thérapeutique concomitante diminue le débit sanguin hépatique.
La mépivacaïne doit être utilisée avec précaution (diminuer les doses) en cas d'hypoxie, d'hyperkaliémie ou d'acidose.
La mépivacaïne ne doit généralement pas être utilisée chez la femme enceinte.
Ce médicament contient 55 mg de sodium par ampoule, ce qui équivaut à 2,75 % de l’apport alimentaire quotidien maximal recommandé par l’OMS de 2g de sodium par adulte.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
4.6. Fertilité, grossesse et allaitement
Grossesse
Les études effectuées chez l’animal ont mis en évidence une foetotoxicité.
En clinique, aucun des anesthésiques locaux n’est connu pour être tératogène.
Chez le fœtus : bradycardie, accompagnée éventuellement d’acidose, et chez le nouveau-né, cyanose et baisse transitoire des réponses neurocomportementales (atonie, réflexe de succion) ont été retrouvées, essentiellement avec la lidocaïne et la mépivacaïne. Ces effets sont d’autant plus manifestes que l’anesthésie est proche de la délivrance.
En conséquence, l’utilisation de la mépivacaïne est déconseillée chez la femme enceinte, notamment dans le cadre de l’anesthésie et l’analgésie péridurale obstétricales.
Comme les autres anesthésiques locaux, la mépivacaïne passe dans le lait maternel, en très faible quantité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Le profil des effets indésirables de la mépivacaïne est semblable à celui des autres agents anesthésiques locaux de type amide. La survenue d’un effet indésirable cardio-vasculaire ou neurologique doit faire suspecter un surdosage (voir rubrique 4.9). Les effets indésirables de cette classe thérapeutique peuvent être :
Affections cardio-vasculaires :
· hypotension,
· hypertension,
· bradycardie,
· arythmie cardiaque,
· arrêt cardiaque.
Affections gastro-intestinales :
· nausées,
· vomissements.
Affections du système nerveux :
· paresthésies,
· étourdissements,
· signes et symptômes de toxicité du SNC (convulsions, engourdissements de la langue, hyperacousie, troubles de la vue, perte de conscience, tremblements, bourdonnements d’oreilles, dysarthrie, dépression du SNC),
· neuropathie,
· lésion du nerf périphérique,
· arachnoïdite.
Affections du système immunitaire :
· réactions allergiques,
· choc anaphylactique.
Affections respiratoires :
· dépression respiratoire.
Affections oculaires :
· diplopie.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
Ces réactions toxiques sont de deux ordres cardiovasculaires et neurologiques.
Les réactions cardiovasculaires sont de type dépresseur, et peuvent être caractérisées par une hypotension, une dépression myocardique, une bradycardie voire même un arrêt cardiaque.
Les réactions du Système Nerveux Central (SNC) sont de type excitateur et/ou dépresseur. Les premiers symptômes de toxicité sont des sensations d’étourdissement, un engourdissement des lèvres et de la langue, un dysfonctionnement de l’audition avec des bourdonnements d’oreilles et une dysarthrie. D’autres symptômes subjectifs du SNC comportent une désorientation et des sensations de somnolence. Les signes objectifs de toxicité du SNC sont généralement excitateurs et comprennent frissons, contractions musculaires et tremblements impliquant au départ les muscles du visage et les parties distales des extrémités. Finalement, des convulsions généralisées de type « grand mal » apparaissent. Si une dose très importante est administrée, les premiers signes d’excitation du SNC (activité épileptoïde) sont rapidement suivis d’une dépression généralisée du SNC (dépression respiratoire puis arrêt respiratoire).
Les concentrations veineuses auxquelles peuvent apparaître les premiers signes de toxicité neurologique sont de 5 à 6 µg/ml.
Les manifestations de toxicité neurologique sont traitées par l’injection d’un barbiturique de courte durée d’action ou d’une benzodiazépine, l’oxygénation, la ventilation assistée.
Le traitement d’un patient présentant des signes de toxicité systémique consiste à traiter les convulsions et assurer une ventilation adéquate avec de l’oxygène, si nécessaire par ventilation (respiration) assistée ou contrôlée. Chez l’adulte, lorsque des convulsions apparaissent, elles doivent être rapidement traitées par injection intraveineuse de thiopental (2 à 4 mg/kg) ou benzodiazépines à action courte (diazépam 0,1 mg/kg ou midazolam 0,05 mg/kg). La succinylcholine intraveineuse (1 mg/kg) peut être utilisée pour assurer une relaxation musculaire à condition que le clinicien soit capable d’effectuer une intubation endotrachéale et de prendre en charge un patient complètement paralysé.
Après arrêt des convulsions et lorsqu’une ventilation pulmonaire adaptée est assurée, aucun autre traitement n’est habituellement nécessaire. Cependant, en cas d’hypotension, un vasopresseur doit être administré par voie intraveineuse.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : ANESTHESIQUE LOCAL (N : système nerveux central) ; Code ATC : N01BB
La mépivacaïne fait partie du groupe des anesthésiques à liaison amide.
L’activité anesthésique de la mépivacaïne se caractérise par :
· un délai rapide d’installation de l’anesthésie (10 à 30 minutes).
· une durée d’action intermédiaire (60 à 180 minutes).
· une meilleure intensité du bloc moteur est obtenue à une concentration de 20 mg/ml.
5.2. Propriétés pharmacocinétiques
Caractéristiques de la mépivacaïne :
· le poids moléculaire du chlorhydrate de mépivacaïne est de 246,
· fixation aux protéines plasmatiques (préférentiellement les alpha 1-glycoprotéines) est de l’ordre de 75% aux doses utilisées en thérapeutique,
· solubilité dans les graisses : en comparaison avec la lidocaïne, la même méthode étant utilisée (n-heptane/tampon pH=7,4), le coefficient de partage est de 0,8 pour la mépivacaïne, soit 3 fois moins élevé que pour la lidocaïne,
· pKa de 7,6.
Concentrations sanguines :
· péridurale et bloc plexique (400 mg) : une concentration sanguine maximale de l’ordre de 3,5 µg/ml est obtenue en 15 à 20 minutes.
· infiltration (5mg/kg) : une concentration sanguine maximale de l’ordre de 1,25µg/ml est obtenue en 30 minutes.
· bloc intercostal : un pic de concentration plasmatique à 5 µg/ml est observé en 10-15 minutes.
Distribution :
Le volume de distribution est de 84 litres.
La demi-vie apparente d’élimination est de 1,9 heures.
La clairance totale plasmatique est de 0,8 l/min.
Diffusion placentaire :
Le passage transplacentaire se fait par simple diffusion.
Le rapport sang foetal/ sang maternel est de l’ordre de 70%.
Métabolisation et élimination :
La métabolisation de la mépivacaïne est hépatique par dégradation enzymatique (hydroxylation et conjugaison).
La presque totalité de la mépivacaïne injectée est éliminée sous forme de métabolites.
Environ 5 % du produit sont éliminés par voie urinaire sous forme inchangée.
lnsuffisance rénale
L'insuffisance rénale n'a que peu ou pas d'influence sur la tolérance de la mépivacaïne lorsque celle-ci est utilisée à court terme en anesthésie avant chirurgie. Les concentrations plasmatiques de mépivacaïne ont été évaluées après un bloc axillaire (600 mg pour le bloc axillaire et 50 mg en supplémentation) chez 8 patients atteints d’insuffisance rénale chronique terminale. Les concentrations plasmatiques totales sont exprimées en µg/ml. Leurs médianes et intervalles sont : 1,69 (1,23 – 7,78) à 5 min : 5,61 (4,36 - 8,19) à 30 min : 8,28 (3,83 – 11,21) à 60 min ; 7,93 (5,63 - 11,1) à 90 min et 6,49 (5,56 - 8,35) à 150 min. Aucun signe de toxicité n'a été observé. A titre comparatif, les patients sans insuffisance rénale recevant 600 mg de mépivacaïne pour un bloc du plexus axillaire avaient une concentration plasmatique totale moyenne de 3.33 µg/ml avec une valeur maximale à 5,21 µg/ml.
Les patients souffrant d'insuffisance rénale chronique ont des concentrations augmentées d'AAG et par conséquent une augmentation de la fixation aux protéines plasmatiques et une augmentation des concentrations totales, alors que la concentration de la fraction non liée de mépivacaïne pharmacologiquement active peut ne pas atteindre le seuil de toxicité.
La clairance rénale du métabolite PPX est significativement corrélée à la clairance de la créatinine. Un défaut de corrélation entre I'exposition totale, exprimée en Aire Sous la Courbe (ASC), et la clairance de la créatinine indique que la clairance totale de PPX inclut une élimination non rénale en plus de l'excrétion rénale. Certains patients insuffisants rénaux peuvent présenter une exposition augmentée au PPX résultant d'une clairance non rénale faible. En raison de la toxicité réduite du PPX sur le SNC en comparaison à la toxicité de la mépivacaïne, les conséquences cliniques sont considérées comme négligeables lors d'un traitement à court terme.
5.3. Données de sécurité préclinique
Chlorure de sodium, hydroxyde de sodium (2M), eau pour préparations injectables.
Après ouverture, le produit doit être utilisé immédiatement.
6.4. Précautions particulières de conservation
Avant ouverture : Pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
20 ml en ampoule (polypropylène), sous barquette stérile.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Les ampoules (Polyamp) de chlorhydrate de mépivacaïne, s’adaptent sur des seringues Luer Fit.
1. Tenir l’ampoule verticalement. Faire descendre dans la partie inférieure, toute partie de solution qui serait retenue dans le col, en tapotant à ce niveau.
2. Détacher la partie supérieure de l’ampoule en la tournant dans le sens indiqué par la flèche.
3. Adapter directement la seringue à l’ampoule en l’enfonçant fermement.
4. Tenir l’ampoule renversée en aspirant la solution.
Maintenir le piston de la seringue jusqu’à ce que l’ampoule soit retirée.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
3016 Lake Drive
Citywest Business Campus
DUBLIN 24
IRLANDE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 341 694 2 7 : 20 ml en ampoule (polypropylène) sous barquette stérile : boîte de 10
· 34009 352 429 3 8 : 20 ml en ampoule (polypropylène) sous barquette stérile : boite de 5
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
Date de première autorisation : 20 août 1996
Date de dernier renouvellement : 20 août 2006
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste II
ANSM - Mis à jour le : 24/03/2025
CARBOCAINE 20 mg/ml, solution injectable
Chlorhydrate de mépivacaïne
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que CARBOCAÏNE 20 mg/ml, solution injectable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser CARBOCAÏNE 20 mg/ml, solution injectable ?
3. Comment utiliser CARBOCAÏNE 20 mg/ml, solution injectable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver CARBOCAÏNE 20 mg/ml, solution injectable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE CARBOCAÏNE 20 mg/ml, solution injectable ET DANS QUELS CAS EST-IL UTILISE ?
ANESTHESIQUE LOCAL. (N : système nerveux central). Code ATC : N01BB
Ce médicament est indiqué :
· Pour les anesthésies limitées à une région du corps notamment lors d’intervention chirurgicale (sauf en obstétrique).
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER CARBOCAÏNE 20 mg/ml, solution injectable ?
N’utilisez jamais CARBOCAÏNE 20 mg/ml, solution injectable :
· Chez l’enfant en raison de l’absence de données cliniques.
· En injections intravasculaires.
· Si vous êtes allergiques aux anesthésiques locaux du même groupe chimique (anesthésiques locaux à liaison amide).
· Si vous souffrez de certains troubles cardiaques (troubles de la conduction auriculoventriculaire nécessitant un entraînement électrosystolique permanent non encore réalisé).
· Si vous avez une épilepsie non contrôlée par un traitement.
· L’anesthésie locorégionale est généralement déconseillée chez les malades sous anticoagulants.
· Si vous présentez une porphyrie.
EN CAS DE DOUTE, IL EST INDISPENSABLE DE DEMANDER L’AVIS DE VOTRE MEDECIN OU DE VOTRE PHARMACIEN.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien ou infirmier/ère avant d’utiliser CARBOCAÏNE 20 mg/ml, solution injectable.
Mises en garde spéciales
Un surdosage ou une injection IV rapide accidentelle peut provoquer des réactions toxiques.
Il n’est pas recommandé de faire une anesthésie locale par infiltration dans les zones infectées et inflammatoires.
Précautions d’emploi
Prévenez le médecin, en cas de :
· insuffisance sévère du foie,
· insuffisance rénale chronique,
· insuffisance cardiaque,
· hypoxie (diminution de la quantité d’oxygène distribuée aux tissus par le sang),
· hyperkaliémie (quantité excessive de potassium dans le sang) ou acidose (acidité excessive dans le sang).
Dans ces cas, les doses doivent être diminuées et le renouvellement éventuel des injections strictement surveillé.
EN CAS DE DOUTE NE PAS HESITER A DEMANDER L’AVIS DE VOTRE MEDECIN OU DE VOTRE PHARMACIEN.
Enfants
CARBOCAÏNE 20 mg/ml, solution injectable n’est pas recommandée chez l’enfant.
Autres médicaments et CARBOCAÏNE 20 mg/ml, solution injectable
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
CARBOCAÏNE 20 mg/ml, solution injectable avec des aliments et boissons
Sans objet.
Ce médicament ne doit généralement pas être utilisé pendant la grossesse sauf avis contraire de votre médecin.
Prévenez le médecin anesthésiste si vous êtes enceinte ou si vous allaitez.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Sportifs
L’attention des sportifs est attirée sur le fait que cette spécialité contient un principe actif pouvant induire une réaction positive des tests pratiqués lors des contrôles antidopage.
Conduite de véhicules et utilisation de machines
Ce produit peut altérer les capacités de réaction pour la conduite de véhicules ou l’utilisation de machines.
CARBOCAÏNE 20 mg/ml, solution injectable contient du sodium
Ce médicament contient 55 mg de sodium (composant principal du sel de cuisine/table) par ampoule. Cela équivaut à 2,75 % de l’apport alimentaire quotidien maximal recommandé de sodium pour un adulte.
3. COMMENT UTILISER CARBOCAÏNE 20 mg/ml, solution injectable ?
L’utilisation de la mépivacaïne nécessite :
Lors de l’anesthésie locale,
· un interrogatoire destiné à connaître le terrain, les thérapeutiques en cours, les antécédents du patient,
· si nécessaire, une prémédication par une benzodiazépine à dose modérée,
· de faire l’injection strictement hors des vaisseaux après aspirations répétées,
· de disposer d’un matériel de réanimation (en particulier d’une source d’oxygène),
· de disposer d’une émulsion lipidique à administrer en cas d’intoxication avec signes cliniques de neurotoxicité et cardiotoxicité.
En outre, lors de l’anesthésie régionale,
· de disposer d’une voie veineuse et d’un matériel complet de réanimation,
· de disposer de médicaments aux propriétés anticonvulsivantes (thiopental, benzodiazépine), myorelaxantes (benzodiazépines), et d’atropine et vasopresseurs,
· une surveillance électrocardiographique continue (cardioscopie) et tensionnelle,
· de pratiquer une injection test de 3 à 4 ml,
· d’injecter lentement en réaspirant fréquemment,
· de maintenir le contact verbal avec le patient.
Posologie
La forme et la concentration utilisées varient en fonction de l’indication et du but recherché, de l’âge et de l’état pathologique du patient.
L’anesthésie obtenue est habituellement fonction de la dose totale administrée.
La dose à injecter est fonction de la technique d’anesthésie pour laquelle le produit est utilisé.
Mode et voie d’administration
Voie injectable (sauf intravasculaire).
Instructions concernant la manipulation :
Les ampoules (POLYAMPâ) de chlorhydrate de mépivacaïne sont conçues pour s’adapter à la fois sur des seringues Luer Lock ou Luer Fit.
1. Tenir l’ampoule verticalement. Faire descendre dans la partie inférieure, toute fraction de solution qui serait retenue dans le col, en tapotant à ce niveau.
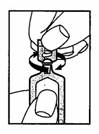
2. Détacher la partie supérieure de l’ampoule en la tournant dans le sens indiqué par la flèche (comme sur le schéma).
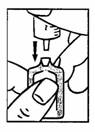
3. Adapter directement la seringue à l’ampoule en l’enfonçant fermement.
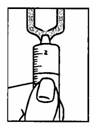
4. Tenir l’ampoule renversée en aspirant la solution.
Maintenir le piston de la seringue jusqu’au retrait de l’ampoule.
Si vous avez utilisé plus de CARBOCAÏNE 20 mg/ml, solution injectable que vous n’auriez dû :
Les effets indésirables graves liés à un surdosage de CARBOCAÏNE nécessitent un traitement particulier et votre médecin est expérimenté pour gérer ce type de situation. Les premiers signes de surdosage sont les suivants :
· Vertiges, sensations d’étourdissements,
· Engourdissement des lèvres et de la zone autour de la bouche,
· Engourdissement de la langue,
· Troubles de l’audition,
· Troubles de la vue.
Afin de réduire le risque d’effets indésirables graves, votre médecin doit arrêter l’administration de CARBOCAÏNE dès que ces signes apparaissent. Cela signifie que si l’un de ces symptômes survient ou que vous pensez avoir reçu trop de CARBOCAÏNE, vous devez prévenir immédiatement votre médecin.
Les effets indésirables les plus graves dus à un surdosage en CARBOCAÏNE sont des troubles d’élocution, des secousses musculaires, des tremblements, des convulsions et une perte de connaissance.
Les manifestations de toxicité neurologique sont traitées par l’injection d’un barbiturique de courte durée d’action ou d’une benzodiazépine, l’oxygénation, la ventilation assistée.
Si vous oubliez d’utiliser CARBOCAÏNE 20 mg/ml, solution injectable :
Si vous arrêtez d’utiliser CARBOCAÏNE 20 mg/ml, solution injectable :
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les effets indésirables dus à la mépivacaïne doivent être différenciés des effets physiologiques dus au bloc lui-même (diminution de la tension artérielle, ralentissement du rythme cardiaque) ainsi que les effets dus à l’introduction de l’aiguille (lésion d’un nerf, abcès).
Le profil des effets indésirables de la mépivacaïne est semblable à celui des autres agents anesthésiques locaux de la même classe thérapeutique.
Troubles cardio-vasculaires :
· diminution ou augmentation de la tension artérielle,
· diminution du rythme cardiaque,
· troubles du rythme cardiaque,
· arrêt cardiaque.
Troubles gastro-intestinales :
· nausées,
· vomissements.
· sensation de fourmillements ou d’engourdissements,
· étourdissements,
· convulsions,
· engourdissement de la langue,
· hypersensibilité de l’ouïe,
· troubles de la vue,
· perte de conscience,
· tremblements,
· bourdonnements d’oreilles,
· difficulté à parler et émettre des sons,
· neuropathie (maladie des nerfs périphériques),
· lésion du nerf périphérique,
· arachnoïdite (inflammation d’une des méninges).
Troubles du système immunitaire :
· réactions allergiques,
· choc anaphylactique.
Troubles respiratoires :
· dépression respiratoire.
Troubles oculaires :
· vision double.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER CARBOCAÏNE 20 mg/ml, solution injectable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur le conditionnement extérieur. La date de péremption fait référence au dernier jour de ce mois.
Après ouverture, le produit doit être utilisé immédiatement.
Avant ouverture : Pas de précautions particulières de conservation.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient CARBOCAÏNE 20 mg/ml, solution injectable
· La substance active est :
Chlorhydrate de mépivacaïne....................................................................................... 20,00 mg
Pour 1 ml.
Une ampoule de 20 ml contient 400 mg de chlorhydrate de mépivacaïne.
Le contenu d’une ampoule (20 ml) correspond à un apport en sodium de 55 mg.
· Les autres composants sont :
Chlorure de sodium, hydroxyde de sodium, eau pour préparations injectables (voir section 2).
Qu’est-ce que CARBOCAÏNE 20 mg/ml, solution injectable et contenu de l’emballage extérieur
Titulaire de l’autorisation de mise sur le marché
3016 Lake Drive
Citywest Business Campus
DUBLIN 24
IRLANDE
Exploitant de l’autorisation de mise sur le marché
21 aVENUE eDOUARD BELIN
92500 RUEIL MALMAISON
France
FORSKARGATAN 18
151 36 SODERTÄLJE
SUEDE
Aspen notre dame de bondeville
1 rue de l’abbaye
76960 notre-dame-de-bondeville
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Sans objet.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).