Dernière mise à jour le 01/12/2025
FLUVERMAL 2 POUR CENT, suspension buvable
Présentations
> 1 flacon(s) en verre de 30 ml avec cuillère-mesure
Code CIP : 324 407-9 ou 34009 324 407 9 5
Déclaration de commercialisation : 19/02/1984
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 2,69 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 3,71 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 19/10/2016 | Renouvellement d'inscription (CT) | Le service médical rendu par FLUVERMAL reste important dans les indications de l’AMM. |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 06/10/2025
FLUVERMAL 2 POUR CENT, suspension buvable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Flubendazole............................................................................................................................. 2 g
Pour 100 mL.
Excipient(s) à effet notoire : 1,4 g de saccharose, 9 mg de parahydroxybenzoate de méthyle sodique (E219), traces d’éthanol, 2,64 mg de propylène glycol par cuillère mesure de 5 mL.
Pour la liste complète des excipients, voir rubrique 6.1.
4.1. Indications thérapeutiques
· Ascaridiase.
· Trichocéphalose.
· Ankylostomiase.
4.2. Posologie et mode d'administration
Adultes et enfants :
· Oxyurose : une cuillère-mesure en prise unique. Dans l'oxyurose, en raison du cycle parasitaire, la prise devrait être renouvelée 15 à 20 jours après, pour éviter l'auto-infestation et la réinfestation.
Les mesures d'hygiène rigoureuses doivent être prises et l'entourage devra être également traité pour éviter une réinfestation.
· Autres nématodoses (ascaridiase, trichocéphalose, ankylostomiase) : une cuillère-mesure matin et soir pendant 3 jours.
Population pédiatrique
Pour les enfants de moins d’un an, voir la section 4.4.
Mode d’administration
Voie orale.
Bien agiter la suspension buvable avant l'emploi. Pour prendre FLUVERMAL 2 POUR CENT, suspension buvable, utilisez la cuillère-mesure.
Ni purge, ni jeûne préalable ne sont nécessaires. Il n'y a pas lieu de prévoir un régime alimentaire particulier pendant le traitement.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
Ce médicament contient du saccharose. Les patients présentant une intolérance au fructose, un syndrome de malabsorption du glucose et du galactose ou un déficit en sucrase/isomaltase. (maladies héréditaires rares) ne doivent pas prendre ce médicament.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par cuillère mesure, c.-à-d. qu’il est essentiellement « sans sodium ».
Ce médicament contient 0,000 028 mL d'alcool (éthanol) par cuillère-mesure. La faible quantité d'alcool contenue dans ce médicament n'est pas susceptible d'entraîner d'effet notable.
Ce médicament contient 2,64 mg de propylène glycol par cuillère mesure.
Population pédiatrique
Compte tenu du manque d’expérience bien documentée chez les enfants âgés de moins d’un an, FLUVERMAL ne doit être administré aux très jeunes enfants que si l’infestation helminthique interfère de manière significative avec leur statut nutritionnel et leur développement physique.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
4.6. Fertilité, grossesse et allaitement
Grossesse
Chez le rat, le flubendazole a été associé à des effets embryotoxiques et tératogènes dans certaines études. Aucun résultat de ce type n’a été rapporté dans les études de tératologie menées chez le lapin ou la souris.
Les données relatives à l’utilisation du flubendazole chez la femme enceinte sont limitées. Le flubendazole n’est pas recommandé pendant la grossesse et chez les femmes en âge de procréer n’utilisant pas de contraception.
Allaitement
En raison du manque de données concernant le passage dans le lait, l'allaitement est déconseillé.
Fertilité
Il n’a été observé aucun effet sur l’accouplement ou sur la fertilité des rats mâles ou femelles. Aucune donnée n’est disponible chez l’homme sur les effets du flubendazole sur la fertilité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
La tolérance de FLUVERMAL a été évaluée chez 1673 adultes ayant participé à 16 études cliniques, dont 5 contre placebo et produit de référence, 2 contre placebo, 3 contre produit de référence et 6 non comparatives. De plus, la tolérance a été évaluée chez 689 enfants (15 ans ou moins) ayant participé à 10 études cliniques, dont 2 contre placebo, 2 contre produit de référence et 6 non comparatives.
Le tableau ci-dessous présente les effets indésirables rapportés avec le flubendazole dans le cadre des études cliniques ou de la pharmacovigilance post-commercialisation, les fréquences étant basées sur l’ensemble des données chez l’adulte et l’enfant (N=2362).
Les fréquences des effets indésirables sont présentées selon la convention suivante :
Très fréquent (≥ 1/10) ; fréquent (≥ 1/100 ; < 1/10) ; peu fréquent (≥ 1/1 000 ; < 1/100) ; rare (≥ 1/10 000 ; < 1/1 000) ; très rare (< 1/10 000) incluant les cas isolés ; indéterminée (ne peut être estimée sur la base des données disponibles).
|
Système d’organes |
Fréquence |
Effet indésirable rapporté |
|
Affections du système immunitaire |
Rare |
Réactions d’hypersensibilité (notamment œdème de Quincke, urticaire, éruption cutanée et prurit) |
|
Affections gastro-intestinales |
Fréquent |
Douleur abdominale |
|
Diarrhée |
||
|
Peu fréquent |
Nausées |
|
|
Vomissements |
||
|
Affections du système nerveux |
Fréquent |
Céphalées |
|
Sensations vertigineuses |
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Dans l’éventualité d’un surdosage accidentel, des crampes abdominales, des nausées, des vomissements et une diarrhée peuvent se produire.
Bien que la durée maximale recommandée du traitement par FLUVERMAL soit limitée à trois jours, de rares cas ont fait état de troubles réversibles de la fonction hépatique, d’hépatites et de dyscrasies sanguines décrites chez des patients traités pour une hydatidose avec des doses massives pendant des périodes prolongées.
Il n’existe aucun antidote spécifique. Du charbon activé peut être administré le cas échéant.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : ANTHELMINTHIQUES, code ATC : P02CA05.
Antihelminthique intestinal à large spectre appartenant à la classe des benzimidazolés.
Actif sur les nématodes : oxyures, ascaris, trichocéphales, ankylostomes, par blocage des mécanismes d'absorption nutritive des vers.
5.2. Propriétés pharmacocinétiques
Du fait de sa faible absorption, les taux plasmatiques et l'élimination urinaire sont négligeables à cette posologie.
5.3. Données de sécurité préclinique
*Arôme banane : acétaldéhyde, butyrate d'amyle, propionate de benzyle, citral, malonate de diéthyle, eugenol, acétate de furfuryle, héliotropine, acétate d'isoamyle, acétate d'isobutyle, maltol, 2-octynoate de méthyle, gamma-nonalactone, alcool phénéthylique, propylène glycol, vanilline.
Avant ouverture : 2 ans.
Après ouverture : 3 mois.
6.4. Précautions particulières de conservation
Pour les conditions de conservation du médicament après première ouverture, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
30 mL en flacon (verre) avec cuillère-mesure de 5 mL.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
41 rue Camille Desmoulins
92130 ISSY-LES-MOULINEAUX
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· CIP 34009 324 407 9 5 : 30 mL en flacon (verre) avec cuillère-mesure de 5 mL.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 06/10/2025
FLUVERMAL 2 POUR CENT, suspension buvable
Flubendazole
Vous devez toujours prendre ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin ou votre pharmacien.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre pharmacien pour tout conseil ou information.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien.
1. Qu'est-ce que FLUVERMAL 2 POUR CENT, suspension buvable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre FLUVERMAL 2 POUR CENT, suspension buvable ?
3. Comment prendre FLUVERMAL 2 POUR CENT, suspension buvable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver FLUVERMAL 2 POUR CENT, suspension buvable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE FLUVERMAL 2 POUR CENT, suspension buvable ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique ANTHELMINTHIQUES - code ATC : P02CA05.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE FLUVERMAL 2 POUR CENT, suspension buvable ?
Ne prenez jamais FLUVERMAL 2 POUR CENT, suspension buvable :
· si vous êtes allergique au flubendazole ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Avertissements et précautions
Ce médicament contient du parahydroxybenzoate de méthyle sodique (E219) et peut provoquer des réactions allergiques.
Si votre médecin vous a informé(e) que vous avez une intolérance à certains sucres, contactez votre médecin avant de prendre ce médicament.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par cuillère mesure de 5 mL, c.-à-d. qu’il est essentiellement « sans sodium ».
Ce médicament contient 0,000 028 mL mL d'alcool (éthanol) par cuillère-mesure de 5 mL. La faible quantité d'alcool contenue dans ce médicament n'est pas susceptible d'entraîner d'effet notable.
Ce médicament contient 2,64 mg de propylène glycol par cuillère-mesure de 5 mL..
Adressez-vous à votre médecin ou pharmacien avant de prendre FLUVERMAL 2 POUR CENT, suspension buvable.
Enfants
Ne pas utiliser chez les enfants de moins d’un an sans avis médical.
Autres médicaments et FLUVERMAL 2 POUR CENT, suspension buvable
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
FLUVERMAL 2 POUR CENT, suspension buvable avec des aliments et boissons
Sans objet.
Si vous êtes enceinte ou si vous allaitez, si vous pensez être enceinte ou avez l’intention de le devenir, ou si vous êtes une femme en âge de procréer, vous devriez consulter votre médecin ou votre pharmacien avant de prendre ce médicament. Le flubendazole ne devrait être administré aux femmes enceintes ou qui allaitent que s’il est prescrit par un médecin.
Conduite de véhicules et utilisation de machines
Ce médicament peut occasionner des vertiges chez certaines personnes. Si tel est votre cas, vous ne devez pas conduire de véhicules ou utiliser des machines.
FLUVERMAL 2 POUR CENT, suspension buvable contient du saccharose et du parahydroxybenzoate de méthyle sodique (E219), du sodium, de l’éthanol, et du propylène glycol..
3. COMMENT PRENDRE FLUVERMAL 2 POUR CENT, suspension buvable ?
Posologie
La dose recommandée est identique chez l'enfant et chez l'adulte. Elle dépend du ver infestant :
· Oxyure : 1 cuillère-mesure en prise unique. La prise sera renouvelée 15 à 20 jours plus tard afin d'éliminer totalement toute infestation.
Des mesures d'hygiène rigoureuses corporelles (nettoyage des ongles, etc ) et vestimentaires doivent accompagner le traitement pour éliminer le risque de réinfestation.
· Ascaris, trichocéphalose, ankylostomiase : 1 cuillère-mesure matin et soir pendant 3 jours.
FLUVERMAL existe sous forme de comprimé et de suspension buvable.
Mode d'administration
Voie orale.
Ni purge, ni jeûne préalable ne sont nécessaires. Il n'y a pas lieu de prévoir un régime alimentaire particulier pendant le traitement.
Bien agiter la suspension buvable avant l'emploi. Pour prendre FLUVERMAL 2 POUR CENT, suspension buvable, utilisez la cuillère-mesure.
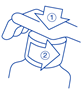
Instructions pour ouvrir le flacon :
Le flacon se présente par un bouchon sécurité-enfant et doit être ouvert comme suit : appuyer sur le bouchon, tout en le tournant dans le sens contraire des aiguilles d'une montre.
Utilisation chez les enfants
Ne pas utiliser chez les enfants de moins d’un an sans avis médical.
Si vous avez pris plus de FLUVERMAL 2 POUR CENT, suspension buvable que vous n’auriez dû
Si vous avez pris accidentellement une trop grande quantité de FLUVERMAL, consultez immédiatement votre médecin, par mesure de sécurité.
Si vous oubliez de prendre FLUVERMAL 2 POUR CENT, suspension buvable
Ne prenez pas de dose double pour compenser la dose que vous avez oubliée de prendre.
Si vous arrêtez de prendre FLUVERMAL 2 POUR CENT, suspension buvable
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Fréquent (moins de 1 patient sur 10) :
Douleur abdominale, diarrhée ;
Céphalées.
Peu fréquent (moins de 1 patient sur 100) :
Nausées, vomissements ;
Vertiges.
Rare (moins de 1 patient sur 1 000) :
Réactions allergiques à type d’urticaire, éruption cutanée, gonflement du visage et du cou (œdème de Quincke), démangeaisons.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER FLUVERMAL 2 POUR CENT, suspension buvable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur le flacon. La date de péremption fait référence au dernier jour de ce mois.
Ne pas conserver au-delà de 3 mois après première ouverture du flacon.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient FLUVERMAL 2 POUR CENT, suspension buvable
· La substance active est :
Flubendazole....................................................................................................................... 2 g
Pour 100 mL.
· Les autres composants sont : saccharose, carbomère (carbopol 974P), laurilsulfate de sodium, parahydroxybenzoate de méthyle sodique (E 219), arôme banane*, hydroxyde de sodium (qs pH = 6,1 - 6,5), eau purifiée.
*Arôme banane : acétaldéhyde, butyrate d'amyle, propionate de benzyle, citral, malonate de diéthyle, eugenol, acétate de furfuryle, héliotropine, acétate d'isoamyle, acétate d'isobutyle, maltol, 2-octynoate de méthyle, gamma-nonalactone, alcool phénéthylique, propylène glycol, vanilline.
Voir la section 2 pour plus d’informations.
Qu’est-ce que FLUVERMAL 2 POUR CENT, suspension buvable et contenu de l’emballage extérieur
Ce médicament se présente sous forme de suspension buvable. Flacon de 30 mL avec cuillère-mesure de 5 mL.
Titulaire de l’autorisation de mise sur le marché
41 rue Camille Desmoulins
92130 ISSY-LES-MOULINEAUX
Exploitant de l’autorisation de mise sur le marché
41 RUE CAMILLE DESMOULINS
91230 ISSY-LES-MOULINEAUX
TURNHOUTSEWEG 30
2340 BEERSE
BELGIQUE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).