Dernière mise à jour le 08/01/2026
DORZOLAMIDE/TIMOLOL VIATRIS 20 mg/ml + 5 mg/ml, collyre en solution
Indications thérapeutiques
Dorzolamide/Timolol Viatris contient deux médicaments : dorzolamide et timolol.
· Le dorzolamide appartient à une classe de médicaments appelés « inhibiteurs de l'anhydrase carbonique ».
· Le timolol appartient à une classe de médicaments appelés « bêta-bloquants ».
Ces médicaments diminuent la pression oculaire par des mécanismes d’action différents.
Dorzolamide/Timolol Viatris est prescrit pour faire baisser la pression intra-oculaire élevée (PIO) chez les patients présentant un glaucome lorsqu'un collyre bêta- bloquant administré seul est insuffisant.
Présentations
> 1 flacon(s) polyéthylène de 5 ml avec compte-gouttes polyéthylène basse densité (PEBD)
Code CIP : 419 606-9 ou 34009 419 606 9 7
Déclaration de commercialisation : 29/05/2012
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 5,53 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 6,55 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Amélioration du service médical rendu (ASMR)
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
ANSM - Mis à jour le : 31/01/2025
DORZOLAMIDE/TIMOLOL VIATRIS 20 mg/ml + 5 mg/ml, collyre en solution
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque millilitre contient 20 mg de dorzolamide (sous forme de chlorhydrate de dorzolamide) et 5 mg de timolol (sous forme de maléate de timolol).
Excipient à effet notoire : chaque ml de collyre en solution contient 0,15 mg de chlorure de benzalkonium.
Pour la liste complète des excipients, voir rubrique 6.1.
Collyre en solution (collyre).
Solution claire, incolore, légèrement visqueuse avec un pH compris entre 5,4 et 5,8 et une osmolarité comprise entre 242 à 323 mOsmol / kg.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
La dose est d'une goutte de Dorzolamide/Timolol Viatris dans le cul-de-sac conjonctival de(s) l'œil (des yeux) atteint(s), deux fois par jour.
En cas d'utilisation concomitante avec un autre collyre, Dorzolamide/Timolol Viatris et l'autre collyre doivent être administrés à 10 minutes d'intervalle au moins.
Les patients doivent être avertis de se laver les mains avant utilisation de ce collyre et d'éviter de mettre en contact l'embout du flacon avec l'œil ou les parties avoisinantes.
Afin de garantir une dose correcte - l’embout compte-gouttes ne doit pas être agrandi.
Les patients doivent aussi être informés que les solutions ophtalmiques, incorrectement manipulées, peuvent être contaminées par des bactéries communes, connues pour entraîner des infections oculaires. L'usage de solutions contaminées peut provoquer des lésions graves de l'œil et par la suite une perte de la vision.
Les patients doivent être informés de la manipulation correcte des flacons.
Mode d’administration
Voie ophtalmique.
Mode d’emploi
1. Lavez-vous les mains.
2. Ouvrez le flacon. Faites attention de ne pas toucher votre œil, la peau autour de votre œil ou vos doigts avec l’embout du flacon.
3. Inclinez la tête vers l’arrière et tenez le récipient à l’envers au-dessus de votre œil.
4. Tirez la paupière inférieure vers le bas et regardez vers le haut. Tenez le flacon par les côtés aplatis et pressez doucement pour laisser tomber une goutte dans l’espace entre la paupière inférieure et l’œil.
5. Fermez votre œil et appuyez sur le coin intérieur de l’œil avec votre doigt pendant environ deux minutes. Le passage systémique est réduit par une occlusion nasolacrymale ou la fermeture des paupières pendant 2 minutes. Cette technique peut permettre une diminution des effets indésirables systémiques et une augmentation de l’efficacité locale.
6. Répétez les étapes 3 à 5 pour l’autre œil si votre médecin vous l’a prescrit.
7. Remettez le bouchon et fermez soigneusement le flacon.
Lors de l'utilisation d'une occlusion nasolacrymale ou de la fermeture des paupières pendant 2 minutes, l'absorption systémique est réduite. Cela peut entraîner une diminution des effets secondaires systémiques et une augmentation de l'activité locale.
Population pédiatrique
L’efficacité chez les patients pédiatriques n’a pas été établie.
La tolérance chez l’enfant de moins de 2 ans n’a pas été établie. (Voir rubrique 5.1 pour plus d’informations sur la tolérance chez l’enfant ≥2 ans et < 6 ans).
Dorzolamide/Timolol Viatris est contre-indiqué chez les patients ayant :
· une hypersensibilité à l’un ou aux deux principes actifs, ou à l'un des excipients mentionnés à la rubrique 6.1 ;
· une maladie réactive des voies aériennes incluant un asthme ou un antécédent d'asthme, ou une broncho-pneumopathie chronique obstructive sévère ;
· une bradycardie sinusale, un syndrome de dysfonctionnement sinusal, un bloc sino-auriculaire, un bloc auriculo-ventriculaire de second ou troisième degré non contrôlé par un stimulateur cardiaque, une insuffisance cardiaque patente, un choc cardiogénique ;
· une insuffisance rénale sévère (ClCr <30 ml/mn) ou une acidose hyperchlorémique.
Les contre-indications ci-dessus proviennent de celles de chacun des constituants et ne sont pas uniquement spécifiques à l'association.
4.4. Mises en garde spéciales et précautions d'emploi
Réactions cardio-vasculaires/respiratoires
Comme d’autres agents ophtalmiques utilisés localement, le dorzolamide/timolol passe dans la circulation systémique. Du fait de sa composante bêta-adrénergique, le timolol, les mêmes types d’effets indésirables cardio-vasculaires, pulmonaires et autres, observés avec les bêta-bloquants systémiques, peuvent se produire. Après application ophtalmique locale, la fréquence des effets indésirables systémiques est moindre qu’après administration systémique. Pour diminuer l’absorption systémique, voir rubrique 4.2.
Affections cardiaques
Chez les patients atteints de cardiopathie (par exemple, maladie coronarienne, angor de Prinzmetal ou insuffisance cardiaque) ou d’hypotension artérielle, l’administration d’un traitement bêta-bloquant doit être soigneusement pesée et un traitement par d’autres substances envisagé. Chez les patients souffrant de maladies cardio-vasculaires, il convient de rechercher des signes de dégradation de ces maladies et d’effets indésirables. En raison de leur effet négatif sur la vitesse de conduction, les bêta-bloquants ne doivent être administrés qu’avec précaution aux patients présentant un bloc cardiaque du premier degré.
Affections vasculaires
Des précautions doivent être prises en cas de traitement de patients atteints de troubles ou de maladies circulatoires périphériques sévères (formes sévères de maladie de Raynaud ou syndrome de Raynaud).
Affections respiratoires
Des réactions respiratoires pouvant aller jusqu’au décès par bronchospasme chez des patients asthmatiques ont été décrites après l’administration de certains bêta-bloquants à usage ophtalmique. Dorzolamide/Timolol Viatris doit être utilisé avec précautions en cas de broncho-pneumopathie chronique obstructive (BPCO) légère à modérée et uniquement si le bénéfice attendu dépasse le risque potentiel.
Insuffisance hépatique
Ce médicament n'a pas été étudié chez les patients présentant une insuffisance hépatique et doit donc être utilisé avec précaution chez de tels patients.
Immunologie et hypersensibilité
Comme pour tous les autres médicaments à usage ophtalmique administrés par voie locale, ce médicament peut passer dans la circulation générale. Le dorzolamide contient un groupe sulfonamido commun aux sulfonamides. Par conséquent, les mêmes types d'effets secondaires que ceux observés avec les sulfonamides par voie générale peuvent survenir par voie locale, incluant des réactions sévères telles que syndrome de Stevens-Johnson et nécrolyse épidermique toxique. En cas de réactions graves ou d'hypersensibilité, ce médicament doit être arrêté.
Des effets secondaires oculaires, identiques à ceux observés avec le collyre à base de chlorhydrate de dorzolamide ont été observés avec ce médicament. Si de telles réactions surviennent, l'arrêt de ce médicament Viatris doit être envisagé.
Pendant la prise d’un bêta-bloquant, les patients qui ont des antécédents d’atopie ou de réaction anaphylactique sévère à un certain nombre d’allergènes peuvent être plus sensibles à l’exposition répétée à ces allergènes et ne pas répondre aux doses habituelles d’adrénaline utilisées pour le traitement des réactions anaphylactiques.
Traitement concomitant
L’effet sur la pression intra-oculaire ou les effets connus du blocage bêta-adrénergique systémique peuvent être potentialisés quand du timolol est administré aux patients recevant déjà un bêta-bloquant par voie générale. La réponse de ces patients doit être surveillée attentivement. L’utilisation de deux bêtabloquants topiques est déconseillée (voir rubrique 4.5)
L'utilisation du dorzolamide et des inhibiteurs de l’anhydrase carbonique oraux n'est pas recommandée.
Arrêt du traitement
Comme avec les bêta-bloquants utilisés par voie générale, s'il est nécessaire d'arrêter le timolol chez des patients ayant une maladie coronarienne, le traitement sera interrompu progressivement.
Autres effets des bêta-bloquants
Hypoglycémie/Diabète
Les bêta-bloquants doivent être administrés avec précautions aux patients sujets aux hypoglycémies spontanées ou aux patients souffrant d’un diabète labile, car les bêta-bloquants peuvent masquer les signes et les symptômes d’une hypoglycémie aiguë.
Les bêta-bloquants peuvent également masquer les signes d’une hyperthyroïdie. L’arrêt brutal du traitement bêta-bloquant peut provoquer une aggravation des symptômes.
Affections de la cornée
Les bêta-bloquants topiques peuvent induire une sécheresse oculaire. Les patients ayant des affections de la cornée doivent être traités avec prudence.
Anesthésie chirurgicale
Les préparations ophtalmiques contenant des bêta-bloquants peuvent bloquer les effets généraux des bêta-agonistes, par exemple l’adrénaline. Les anesthésistes doivent être informés lorsque le patient est traité par le timolol.
Le traitement par bêta-bloquants peut aggraver les symptômes d'une myasthénie.
Autres effets de l'inhibition de l'anhydrase carbonique
Le traitement par inhibiteurs de l'anhydrase carbonique a été associé à des lithiases urinaires résultant de troubles acido-basiques, particulièrement chez des patients ayant un antécédent de calculs rénaux. Même si l'on n'a pas observé de troubles acido-basiques avec ce médicament, des lithiases urinaires ont été rarement rapportées. Dorzolamide/Timolol Viatris contient un inhibiteur topique de l'anhydrase carbonique qui est absorbé par voie générale, les patients ayant un antécédent de calculs rénaux peuvent donc présenter un risque accru de lithiases urinaires lors de l'utilisation de ce médicament.
Autres
La prise en charge des patients ayant un glaucome aigu par fermeture de l'angle nécessite en plus des agents hypotenseurs d'autres mesures thérapeutiques. Ce médicament n'a pas été étudié chez les patients porteurs d'un glaucome aigu par fermeture de l'angle.
Des œdèmes cornéens et des décompensations irréversibles de la cornée ont été décrits chez des patients présentant une altération chronique pré-existante de la fonction cornéenne et/ou ayant des antécédents de chirurgie intra-oculaire lorsqu'ils sont traités par le dorzolamide. Les patients ayant un faible nombre de cellules endothéliales ont un risque accru de développer un œdème cornéen. La prescription de DORZOLAMIDE/TIMOLOL VIATRIS chez ce type de patient doit s’effectuer avec précaution.
Décollement de la choroïde
Des décollements de la choroïde ont été rapportés avec l’administration d’un traitement suppresseur de la sécrétion de l’humeur aqueuse (par exemple, le timolol ou l’acétazolamide) après des interventions de filtration.
Comme avec d'autres médicaments antiglaucomateux, on a observé chez certains patients une diminution de la réponse au maléate de timolol en collyre lors de traitement prolongé. Cependant, dans des études cliniques au cours desquelles 164 patients ont été suivis pendant au moins trois ans, aucune différence significative de la pression intra-oculaire moyenne n'a été observée après stabilisation initiale.
Population pédiatrique
Les patients présentant une immaturité tubulaire rénale significative ne doivent recevoir du dorzolamide qu'après un examen attentif du rapport bénéfice/risque en raison du risque possible d'acidose métabolique.
Voir rubrique 5.1.
Chlorure de benzalkonium
Le chlorure de benzalkonium est connu pour provoquer une irritation des yeux, des symptômes du syndrome de l’œil sec et peut affecter le film lacrymal et la surface de la cornée. Il doit être utilisé avec prudence chez les patients atteints d’œil sec et ceux présentant un risque d’endommagement de la cornée.
Les patients doivent être surveillés en cas d’utilisation prolongée.
D'après les données limitées disponibles, il n'y a aucune différence dans le profil des événements indésirables chez les enfants par rapport aux adultes. Cependant, en général, les yeux des enfants réagissent plus fortement à un stimulus donné que l’œil adulte. L'irritation peut avoir un effet sur l'observance du traitement chez les enfants.
Lentilles de contact
Le chlorure de benzalkonium peut être absorbé par les lentilles de contact souples et changer leur couleur. Les lentilles de contact doivent être retirées avant instillation et il est nécessaire d’attendre au moins 15 minutes avant de les remettre..
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude spécifique d'interactions médicamenteuses n'a été faite avec Dorzolamide/timolol.
Dans les études cliniques, ce médicament a été utilisé de façon concomitante sans interaction indésirable patente avec les médicaments systémiques suivants : inhibiteurs de l'enzyme de conversion, inhibiteurs calciques, diurétiques, anti-inflammatoires non stéroïdiens dont l'aspirine, et des hormones (par exemple, estrogènes, insuline, thyroxine).
Il existe un risque d’additivité des effets aboutissant à une hypotension artérielle et/ou une bradycardie importante lorsqu’un collyre bêta-bloquant est administré en même temps que des inhibiteurs calciques, des médicaments entraînant une diminution des catécholamines ou des bêta-bloquants, des anti-arythmiques (y compris l’amiodarone), des digitaliques, des parasympathomimétiques ou de la guanéthidine pris par voie orale, des narcotiques et des inhibiteurs de la monoamine oxydase (IMAO).
Une potentialisation des effets systémiques bêta-bloquants (par exemple, diminution de la fréquence cardiaque, dépression) a été rapportée lors de traitements associant les inhibiteurs du CYP2D6 (par ex., quinidine, fluoxetine, paroxetine) et le timolol.
Bien que Dorzolamide/Timolol seul ait peu ou pas d'effet sur le diamètre pupillaire, on a rapporté occasionnellement des cas de mydriase résultant de l'utilisation concomitante de collyre bêta-bloquant et d'épinéphrine (adrénaline).
Les bêta-bloquants peuvent augmenter l'effet hypoglycémiant des antidiabétiques.
Les bêta-bloquants par voie orale peuvent exacerber le rebond de l'hypertension artérielle qui peut suivre l'arrêt de la clonidine.
4.6. Fertilité, grossesse et allaitement
Grossesse
Dorzolamide/Timolol Viatris ne doit pas être utilisé pendant la grossesse.
Dorzolamide
Il n'y a pas de données cliniques disponibles sur l'utilisation chez la femme enceinte. Le dorzolamide a entraîné des effets tératogènes chez le lapin à des doses maternotoxiques (voir rubrique 5.3).
Timolol
Il n’existe pas de données pertinentes sur l’utilisation du timolol chez la femme enceinte. Le timolol est contre-indiqué pendant la grossesse, sauf s’il s’avère absolument nécessaire. Pour diminuer l’absorption systémique, voir rubrique 4.2.
Les études épidémiologiques n’ont pas mis de malformations en évidence, mais elles montrent qu’il existe un risque de retard de croissance intra-utérin lorsque des bêta-bloquants sont administrés par voie orale. De plus, des signes et symptômes de blocage bêta-adrénergique (bradycardie, hypotension artérielle, insuffisance respiratoire et hypoglycémie) ont été observés chez le nouveau-né lorsque des bêtabloquants ont été administrés jusqu’au moment de l’accouchement. Si ce médicament est administré jusqu’à l’accouchement, le nouveau-né doit être surveillé attentivement au cours des premiers jours de sa vie.
Allaitement
Il n'y a pas de données concernant l'excrétion de dorzolamide dans le lait maternel. Chez des rates en période de lactation recevant du dorzolamide, on a observé une diminution du poids chez les descendants. Les bêta-bloquants sont excrétés dans le lait maternel. Avec les doses thérapeutiques de timolol en collyre, il est cependant peu probable d’en observer une quantité suffisante dans le lait maternel pour induire des symptômes cliniques de blocage bêta-adrénergique chez le nourrisson. Pour diminuer l’absorption systémique, voir rubrique 4.2.
Si le traitement avec Dorzolamide/Timolol Viatris est nécessaire, alors l'allaitement n'est pas recommandé.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Dans les études cliniques, les effets indésirables observés avec DORAZOLAMIDE/TIMOLOL VIATRIS ont été cohérents avec ceux précédemment rapportés avec le chlorhydrate de dorzolamide et/ou le maléate de timolol.
Au cours des études cliniques, 1 035 patients ont été traités par Dorzolamide/Timolol. Approximativement 2,4 % d'entre eux ont arrêté le traitement par ce médicament en raison d'événements indésirables oculaires et approximativement 1,2 % des patients ont arrêté le traitement en raison d'événements indésirables locaux évocateurs d'allergie ou d'hypersensibilité (tels qu’inflammation de la paupière et conjonctivite).
Comme d’autres médicaments ophtalmiques à usage topique, Dorzolamide/Timolol passe dans la circulation systémique. Il peut en résulter les mêmes effets indésirables qu’avec les bêta-bloquants systémiques. Après administration ophtalmique topique, la fréquence des effets indésirables systémiques est moindre qu’après administration systémique.
Les effets indésirables suivants ont été rapportés avec Dorzolamide/Timolol ou l'un de ses composants soit au cours des études cliniques soit depuis la mise sur le marché :
Très fréquent (≥1/10).
Fréquent (≥1/100 et <1/10).
Peu fréquent (≥1/1 000 et <1/100).
Rare (≥1/10 000 et <1/1 000).
Très rare (≤10 000).
Fréquence indéterminée : ne peut être estimée sur la base des données disponibles.
Données tirées d’études cliniques, y compris les fréquences (le cas échéant).
|
Classes de systèmes d'organes (MedDRA)) |
Formule |
Très fréquent |
Fréquent |
Peu fréquent |
Rare |
Indéterminé** |
|
Affections du système immunitaire |
DORZOLAMIDE/TIMOLOL VIATRIS |
|
|
|
Signes et symptômes de réactions allergiques systémiques, incluant angio-œdème, urticaire, prurit, rash, anaphylaxie |
|
|
|
Maléate de timolol, collyre en solution |
|
|
|
Signes et symptômes de réactions allergiques systémiques, incluant angio-œdème, urticaire, rash local et général, anaphylaxie |
Prurit |
|
Troubles du métabolisme et de la nutrition |
Maléate de timolol, collyre en solution |
|
|
|
|
Hypoglycémie |
|
Affections psychiatriques |
Maléate de timolol, collyre en solution |
|
|
Dépression* |
Insomnies*, cauchemars*, pertes de mémoire |
Hallucination |
|
Affections du système nerveux |
Chlorhydrate de dorzolamide, collyre en solution |
|
Céphalées* |
|
Etourdissements*, paresthésies* |
|
|
|
Maléate de timolol, collyre en solution |
|
Céphalées* |
Etourdissements*, syncope* |
Paresthésies*, aggravation des signes et symptômes de myasthénie, diminution de la libido*, accident vasculaire cérébral*, ischémie cérébrale |
|
|
Affections oculaires |
DORZOLAMIDE/TIMOLOL VIATRIS |
Brûlures et picotements |
Hyperhémie conjonctivale, vision trouble, érosion de la cornée, démangeaisons oculaires, larmoiement |
|
|
Sensation de corps étranger dans l’œil |
|
|
Chlorhydrate de dorzolamide, collyre en solution |
|
Inflammation palpébrale*, irritation palpébrale* |
Iridocyclite* |
Irritations incluant rougeur*, douleur*, lésions crouteuses palpébrales*, myopie transitoire (qui a disparu à l'arrêt du traitement), œdème cornéen*, hypotonie oculaire*, décollement de la choroïde (après chirurgie filtrante)* |
Sensation de corps étranger dans l’œil |
|
|
Maléate de timolol, collyre en solution |
|
Signes et symptômes d'irritation oculaire incluant blépharites*, kératites*, hypoesthésie cornéenne et sécheresse oculaire* |
Troubles visuels comprenant des modifications de la réfraction (dues parfois à l'arrêt du traitement par les myotiques)* |
Ptosis, diplopie, décollement de la choroïde (après chirurgie filtrante)* (voir rubrique 4.4) |
Démangeaisons, larmoiement, rougeur, vision trouble, érosion de la cornée |
|
Affections de l'oreille et du labyrinthe |
Maléate de timolol, collyre en solution |
|
|
|
Acouphènes* |
|
|
Affections cardiaques |
Maléate de timolol, collyre en solution |
|
|
Bradycardie* |
Douleur thoracique*, palpitations*, œdème*, arythmie*, insuffisance cardiaque congestive*, arrêt cardiaque*, bloc cardiaque |
Bloc auriculo-ventriculaire, insuffisance cardiaque |
|
|
Chlorhydrate de dorzolamide, collyre en solution |
|
|
|
|
Palpitations,tachycardie |
|
Affections vasculaires |
Maléate de timolol, collyre en solution |
|
|
|
Hypotension*, claudication, phénomène de Raynaud*, froideur des extrémités* |
|
|
Chlorhydrate de dorzolamide, collyre en solution |
|
|
|
|
Hypertension |
|
|
Affections respiratoires, thoraciques et médiastinales |
DORZOLAMIDE/TIMOLOL VIATRIS |
|
Sinusite |
|
Essoufflement, insuffisance respiratoire, rhinite, rarement bronchospasme |
|
|
|
Chlorhydrate de dorzolamide, collyre en solution |
|
|
|
Epistaxis* |
Dyspnée |
|
|
Maléate de timolol, collyre en solution |
|
|
Dyspnée* |
Bronchospasme (surtout chez les patients ayant une maladie bronchospastique pré-existante)*, insuffisance respiratoire, toux* |
|
|
Affections gastro-intestinales |
DORAZOLAMIDE/TIMOLOL VIATRIS |
Dysgueusie |
|
|
|
|
|
|
Chlorhydrate de dorzolamide, collyre en solution |
|
Nausées* |
|
Irritation de la gorge, sécheresse buccale* |
|
|
|
Maléate de timolol, collyre en solution |
|
|
Nausées*, dyspepsie* |
Diarrhée, sécheresse buccale* |
Dysgueusie, douleur abdominale, vomissements |
|
Affections de la peau et du tissu sous-cutané |
DORZOLAMIDE/TIMOLOL VIATRIS |
|
|
|
Dermite de contact, syndrome de stevens-johnson, nécrolyse épidermique toxique |
|
|
|
Chlorhydrate de dorzolamide, collyre en solution |
|
|
|
Eruption* |
|
|
|
Maléate de timolol, collyre en solution |
|
|
|
Alopécie*, éruptions psoriasiformes ou aggravation d'un psoriasis* |
Eruption cutanée |
|
Affections musculo-squelettiques et systémiques |
Maléate de timolol, collyre en solution |
|
|
|
Lupus érythémateux disséminé |
Myalgie |
|
Affections du rein et des voies urinaires |
DORAZOLAMIDE/TIMOLOL VIATRIS |
|
|
Lithiase urinaire |
|
|
|
Affections des organes de reproduction et du sein |
Maléate de timolol, collyre en solution |
|
|
|
Maladie de La Peyronie*, diminution de la libido |
Dysfonctionnement sexuel |
|
Troubles généraux et anomalies au site d'administration |
Chlorhydrate de dorzolamide, collyre en solution |
|
Asthénie/
fatigue* |
|
|
|
|
|
Maléate de timolol, collyre en solution |
|
|
Asthénie/ fatigue* |
|
|
* Ces effets indésirables ont également été observés avec Dorzolamide/Timolol depuis sa mise sur le marché.
** D'autres effets indésirables ont également été observés avec des bêta-bloquants ophtalmiques et peuvent potentiellement survenir avec dorzolamide/timolol .
Examens biologiques
Dorzolamide/Timolol n'a pas été associé à des troubles électrolytiques cliniquement pertinents dans les études cliniques.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament.
Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Il n'existe pas de données chez l'Homme concernant un surdosage par ingestion accidentelle ou volontaire de Dorzolamide/Timolol.
Symptômes
Il y a eu des cas de surdosage accidentel avec le maléate de timolol en collyre se traduisant par des effets systémiques identiques à ceux observés avec les bêta-bloquants par voie générale tels qu’étourdissements, céphalées, dyspnée, bradycardie, bronchospasme et arrêt cardiaque. Les symptômes les plus fréquents observés avec un surdosage en dorzolamide sont un déséquilibre électrolytique, l'apparition d'une acidose et des effets possibles sur le système nerveux central.
Il n'existe qu'un nombre limité de données disponibles chez l'Homme concernant un surdosage par ingestion accidentelle ou volontaire de chlorhydrate de dorzolamide. Les effets suivants ont été rapportés à la suite d'une ingestion orale : somnolence; en application locale : nausées, étourdissements, céphalées, fatigue, rêves anormaux et dysphagie.
Traitement
Le traitement doit être symptomatique et adapté. L'ionogramme sanguin (en particulier le potassium) et le pH sanguin doivent être surveillés. Les études ont montré que le timolol n'est pas facilement dialysable.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : antiglaucomateux et myotiques, bêta-bloquants, Timolol, associations
Code ATC : S01ED51
Mécanisme d'action
Dorzolamide/Timolol Viatris est une association de deux constituants : le chlorhydrate de dorzolamide et le maléate de timolol. Chacun de ces deux constituants diminue la pression intra-oculaire élevée en réduisant la sécrétion d'humeur aqueuse par un mécanisme d'action différent.
Le chlorhydrate de dorzolamide est un puissant inhibiteur de l'anhydrase carbonique humaine, de type II. L'inhibition de l'anhydrase carbonique dans les processus ciliaires de l'œil diminue la sécrétion d'humeur aqueuse, en ralentissant probablement la formation des ions bicarbonates avec une diminution secondaire du transport du sodium et des liquides. Le timolol est un bêta-bloquant non cardio-sélectif. Le mécanisme d'action précis du maléate de timolol dans la réduction de la pression intra-oculaire n'est pas clairement établi à l'heure actuelle, bien qu'une étude avec la fluorescéine et des études de tonographie indiquent que l'action principale peut être une réduction de la formation de l'humeur aqueuse. Cependant, dans quelques études une augmentation légère de l'écoulement de l'humeur aqueuse a également été observée. L'association de ces deux agents a un effet additif sur la réduction de la pression intra-oculaire (PIO) par rapport à chacun des constituants administrés séparément.
Après administration locale, ce médicament diminue l'élévation de la pression intra-oculaire, associée ou non à un glaucome. Une pression intra-oculaire élevée est un facteur de risque majeur dans la pathogénie des altérations du nerf optique et de la perte du champ visuel due au glaucome.
Ce médicament réduit la pression intra-oculaire sans avoir les effets secondaires des myotiques comme la cécité nocturne, les spasmes d'accommodation et la contraction pupillaire.
Effets pharmacodynamiques
Effets cliniques
Patients adultes :
Des études cliniques allant jusqu'à 15 mois ont été menées pour comparer l'effet sur la réduction de la PIO de Dorzolamide/Timolol, administré deux fois par jour (le matin et le soir au coucher), par rapport à celui de timolol 0,5 % et de dorzolamide 2,0 % seuls ou en association, chez des patients présentant un glaucome ou une hypertension oculaire et pour lesquels un traitement associé a été considéré dans les essais comme adapté. Des patients non traités et des patients insuffisamment contrôlés par le timolol en monothérapie ont été inclus. La majorité des patients étaient traités par collyre bêta-bloquant en monothérapie avant d'être enrôlés dans l'étude. Dans une analyse groupée des études, l'effet de Dorzolamide/Timolol administré deux fois par jour sur la réduction de la PIO était supérieur à celui d'une monothérapie par dorzolamide 2 % administré trois fois par jour ou timolol 0,5 % administré deux fois par jour. L'effet de Dorzolamide/Timolol administré deux fois par jour sur la réduction de la PIO était similaire à celui d'un traitement concomitant de dorzolamide et de timolol administré deux fois par jour.
L'effet de Dorzolamide/Timolol administré deux fois par jour sur la réduction de la pression intra-oculaire a été démontré à différents moments de la journée et cet effet s'est maintenu pendant l'administration au long cours.
Population pédiatrique
Une étude contrôlée de 3 mois a été conduite, avec comme objectif principal de documenter la tolérance du chlorhydrate de dorzolamide en solution ophtalmique à 2 % chez l'enfant de moins de 6 ans. Dans cette étude, 30 patients de 2 ans ou plus et de moins de 6 ans, dont la pression intra-oculaire n'était pas contrôlée de façon suffisante par dorzolamide ou timolol en monothérapie, ont reçu Dorzolamide/Timolol dans une phase en ouvert. L'efficacité chez ces patients n'a pas été établie. Dans ce petit groupe de patients, l'administration biquotidienne de Dorzolamide/Timolol a généralement été bien tolérée : 19 patients ont terminé le traitement et 11 l'ont arrêté pour intervention chirurgicale, modification du traitement médical, ou autres raisons
5.2. Propriétés pharmacocinétiques
Contrairement aux inhibiteurs de l'anhydrase carbonique par voie orale, l'administration locale de chlorhydrate de dorzolamide permet une action directe du principe actif sur l'œil à des doses substantiellement plus basses et donc une exposition systémique plus faible. Dans les essais cliniques, la conséquence a été une réduction de la PIO sans perturbation de l'équilibre acido-basique ni les troubles hydroélectrolytiques caractéristiques des inhibiteurs de l'anhydrase carbonique administrés par voie orale.
Par voie locale, le dorzolamide passe dans la circulation générale. Pour évaluer la possibilité d'une inhibition de l'anhydrase carbonique systémique après administration locale, les concentrations du principe actif et de ses métabolites ont été mesurées dans les globules rouges et le plasma, ainsi que l'inhibition de l'anhydrase carbonique dans les globules rouges. Lors d'une administration chronique, le dorzolamide s'accumule dans les globules rouges par suite d'une liaison sélective à l'AC-II alors que des concentrations extrêmement faibles du principe actif sous forme libre sont maintenues dans le plasma. La molécule mère est transformée en métabolite N-déséthyl qui inhibe l'AC-II de façon moins puissante mais inhibe aussi une isoenzyme moins active (l'AC-I). Ce métabolite s'accumule également dans les globules rouges où il se lie surtout avec l'AC-I. Le dorzolamide se fixe modérément aux protéines plasmatiques (environ 33 %). Le dorzolamide est surtout excrété inchangé dans les urines ; son métabolite est aussi éliminé dans les urines. Après le traitement, le dorzolamide se libère des globules rouges de façon non linéaire, ce qui entraîne une diminution rapide de la concentration initiale du médicament suivie d'une phase d'élimination plus lente avec une demi-vie d'environ quatre mois.
Lorsque le dorzolamide a été administré par voie orale pour simuler une exposition systémique maximale consécutive à une administration oculaire au long cours, l'état d'équilibre a été atteint en 13 semaines. A l'état d'équilibre, il n'y avait virtuellement pas de principe actif sous forme libre ni de métabolite dans le plasma ; l'inhibition de l'AC dans les globules rouges a été inférieure à celle nécessaire à l'obtention d'un effet pharmacologique sur la fonction rénale ou la respiration. Des résultats identiques de pharmacocinétique furent observés après administration locale prolongée de chlorhydrate de dorzolamide. Néanmoins, quelques patients âgés présentant une insuffisance rénale (clairance de la créatinine estimée à 30-60 ml/min.) ont eu des concentrations en métabolite plus élevées dans les globules rouges, mais aucune différence significative sur l'inhibition de l'anhydrase carbonique et aucun effet secondaire systémique cliniquement significatif n'ont été imputés directement à ces données.
Maléate de timolol
Dans une étude sur les concentrations plasmatiques du principe actif chez six patients, l'exposition systémique au timolol fut déterminée après administration locale de maléate de timolol solution ophtalmique à 0,5 % deux fois par jour. Les concentrations plasmatiques moyennes après la prise du matin étaient en moyenne de 0,46 ng/ml et de 0,35 ng/ml après la prise de l'après-midi.
5.3. Données de sécurité préclinique
Le profil de tolérance oculaire et générale des constituants pris séparément est bien établi.
Dorzolamide
Chez des lapins ayant reçu des doses maternotoxiques de dorzolamide associées à une acidose métabolique, des malformations des corps vertébraux ont été observées.
Timolol
Des études chez l'animal n'ont pas montré d'effets tératogènes.
De plus, on n'a observé aucun effet secondaire oculaire chez des animaux traités par voie locale avec du chlorhydrate de dorzolamide et du maléate de timolol administrés seuls ou simultanément. Les études in vitro et in vivo effectuées avec chacun des constituants n'ont pas révélé de pouvoir mutagène. Par conséquent, aucun risque significatif en matière de tolérance n'est attendu chez l'Homme aux doses thérapeutiques de Dorzolamide/Timolol Viatris.
Avant ouverture : 2 ans.
Après ouverture : 28 jours après la première ouverture du flacon.
6.4. Précautions particulières de conservation
6.5. Nature et contenu de l'emballage extérieur
Flacon à usage ophtalmique blanc opaque (PE de densité intermédiaire), muni d'un embout compte-gouttes scellé (PEBD) et avec un bouchon à vis (PEHD) et une bague d'inviolabilité au niveau du col.
Boîte de 1, 3 ou 6 flacons de 5 ml.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
1 RUE DE TURIN
69007 LYON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 419 606 9 7 : 1 flacon (PE) de 5 ml avec embout compte-gouttes (PEBD).
· 34009 419 607 5 8 : 3 flacons (PE) de 5 ml avec embout compte-gouttes (PEBD).
· 34009 419 608 1 9 : 6 flacons (PE) de 5 ml avec embout compte-gouttes (PEBD).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
ANSM - Mis à jour le : 31/01/2025
DORZOLAMIDE/TIMOLOL VIATRIS 20 mg/ml + 5 mg/ml, collyre en solution
Dorzolamide/timolol
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que DORZOLAMIDE/TIMOLOL VIATRIS 20 mg/ml + 5 mg/ml, collyre en solution et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre DORZOLAMIDE/TIMOLOL VIATRIS 20 mg/ml + 5 mg/ml, collyre en solution ?
3. Comment prendre DORZOLAMIDE/TIMOLOL VIATRIS 20 mg/ml + 5 mg/ml, collyre en solution ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver DORZOLAMIDE/TIMOLOL VIATRIS 20 mg/ml + 5 mg/ml, collyre en solution ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE DORZOLAMIDE/TIMOLOL VIATRIS 20 mg/ml + 5 mg/ml, collyre en solution ET DANS QUELS CAS EST-IL UTILISE ?
Dorzolamide/Timolol Viatris contient deux médicaments : dorzolamide et timolol.
· Le dorzolamide appartient à une classe de médicaments appelés « inhibiteurs de l'anhydrase carbonique ».
· Le timolol appartient à une classe de médicaments appelés « bêta-bloquants ».
Ces médicaments diminuent la pression oculaire par des mécanismes d’action différents.
Dorzolamide/Timolol Viatris est prescrit pour faire baisser la pression intra-oculaire élevée (PIO) chez les patients présentant un glaucome lorsqu'un collyre bêta- bloquant administré seul est insuffisant.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER DORZOLAMIDE/TIMOLOL VIATRIS 20 mg/ml + 5 mg/ml, collyre en solution ?
N’utilisez pas DORZOLAMIDE/TIMOLOL VIATRIS :
· si vous êtes allergique au dorzolamide, au timolol, ou à l’un des autres composants de ce médicament mentionnés dans la rubrique 6 ;
· si vous avez maintenant ou ou avez eu dans le passé des problèmes respiratoires tels que l’asthme ou une bronchite chronique obstructive sévère (, maladie sévère des poumons pouvant entraîner des sifflements, une difficulté à respirer et/ou une toux persistante) ;
· si vous avez un rythme cardiaque lent, une insuffisance cardiaque ou des troubles du rythme cardiaque (battements du cœur irréguliers) ;
· si vous avez une maladie rénale sévère ou des antécédents de calculs rénaux ;
· si vous avez une acidité sanguine élevée, causée par une accumulation de chlorure dans le sang (acidose hyperchlorémique).
Si vous n'êtes pas sûr de pouvoir utiliser ce médicament, contactez votre médecin ou votre pharmacien.
Avertissements et précautions :
Adressez-vous à votre médecin ou votre pharmacien avant d’utiliser Dorzolamide/Timolol Viatris si vous avez :
· une maladie coronarienne (les symptômes peuvent inclure douleur ou oppression thoracique, essoufflement, suffocation), insuffisance cardiaque, hypotension artérielle ;
· troubles du rythme cardiaque tels qu’un ralentissement des battements du cœur,
· problèmes de respiration, asthme ou maladie pulmonaire chronique obstructive,
· troubles de la circulation sanguine, tels qu’une maladie de Raynaud ou un syndrome de Raynaud ;
· un diabète ou une hypoglycémie (faible quantité de sucre dans le sang), car le timolol peut masquer les signes et symptômes d’une hypoglycémie ;
· une hyperactivité de la thyroïde, car le timolol peut en masquer les signes et symptômes ;
Informez votre médecin avant d'être opéré que vous prenez Dorzolamide/Timolol Viatris car le timolol peut modifier l'action de certains médicaments utilisés pour l'anesthésie.
Informez également votre médecin de toute allergie ou réaction allergique y compris urticaire, gonflement du visage, des lèvres, de la langue, et/ou de la gorge, qui peut entraîner une difficulté à respirer ou à avaler.
Informez votre médecin si vous avez des faiblesses musculaires ou si une myasthénie a été diagnostiquée.
Si vous développez une irritation ou tout nouveau problème oculaire tel que rougeur de l'œil ou des yeux, contactez votre médecin immédiatement.
Si vous pensez que Dorzolamide/Timolol Viatris est à l’origine d’une réaction allergique ou d’une hypersensibilité (par exemple, éruption de la peau, éruption cutanée sévère ou rougeur de l'œil et démangeaison oculaire), arrêtez le traitement et contactez votre médecin immédiatement.
Informez votre médecin si vous développez une infection oculaire, avez une blessure à l'œil, avez une intervention chirurgicale oculaire, développez d'autres réactions ou si les symptômes s'aggravent.
Quand Dorzolamide/Timolol Viatris est instillé dans l’œil, il peut avoir un effet sur l’ensemble de l’organisme.
Enfants
Chez le nourrissonet l'enfant, l'expérience avec Dorzolamide/Timolol Viatris est limitée
Personnes âgées
Dans les études avec ce médicament, les effets ont été similaires chez les patients âgés et les patients plus jeunes.
Utilisation chez l’insuffisant hépatique
Informez votre médecin de tous problèmes hépatiques que vous avez ou avez eus par le passé.
Autres médicaments et DORZOLAMIDE/TIMOLOL VIATRIS 20 mg/ml + 5 mg/ml, collyre en solution
Dorzolamide/Timolol Viatris peut modifier les effets d’autres médicaments que vous prenez ou être modifié par eux, y compris par d’autres collyres utilisés pour le traitement du glaucome. Informez votre médecin que vous prenez ou avez l’intention de prendre des médicaments antihypertenseurs ou pour le traitement de troubles cardiaques ou du diabète. Si vous utilisez ou avez utilisé récemment ou pourriez utiliser un autre médicament, y compris un médicament délivré sans ordonnance, parlez-en à votre médecin ou à votre pharmacien. Ceci est particulièrement important si l’un des points ci-dessous s’applique à vous :
· vous prenez des médicaments pour diminuer la pression artérielle ou pour traiter une maladie cardiaque (tels qu'un inhibiteur calcique, un bêta-bloquant ou de la digoxine)
· vous utilisez un autre collyre qui contient un bêta-bloquant,
· vous prenez un autre inhibiteur de l’anhydrase carbonique tel que l’acétazolamide,
· vous prenez un médicament de la famille des inhibiteurs de la monoamine oxydase (IMAO), utilisés pour traiter la dépression,
· vous prenez un médicament parasympathomimétique qui vous a été prescrit pour vous aider à uriner. Les parasympathomimétiques appartiennent à une famille de médicaments qui sont parfois également utilisés pour aider à la restauration d’un transit intestinal normal,
· vous prenez des narcotiques tels que la morphine utilisée pour traiter des douleurs modérées à fortes,
· vous prenez un médicament pour traiter le diabète,
· vous prenez un médicament antidépresseur tel que fluoxétine ou paroxétine,
· vous prenez un médicament de la classe des sulfamides,
· vous prenez de la quinidine (médicament utilisé dans le traitement des maladies cardiaques et certains types de malaria).
DORZOLAMIDE/TIMOLOL VIATRIS 20 mg/ml + 5 mg/ml, collyre en solution avec des aliments et boissons
Sans objet.
Grossesse et allaitement
Si vous être enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez d’avoir un bébé, demandez conseil à votre médecin ou à votre pharmacien avant de prendre ce médicament.
N’utilisez pas Dorzolamide/Timolol Viatris si vous êtes enceinte, sauf si votre médecin l’estime nécessaire. N’utilisez pas Dorzolamide/Timolol Viatris si vous allaitez. Le timolol peut passer dans votre lait.
Demandez conseil à votre médecin avant de prendre un médicament pendant que vous allaitez.
Conduite de véhicules et utilisation de machines
Aucune étude sur la capacité à conduire ou à utiliser des machines n’a été menée. Il existe des effets indésirables associés à DORZOLAMIDE/TIMOLOL VIATRIS tels qu’une vision trouble qui peuvent altérer l'aptitude à conduire ou à utiliser des machines. Ne conduisez pas et n’utilisez pas de machines avant que vous ne vous sentiez bien ou que votre vision soit claire.
DORZOLAMIDE/TIMOLOL VIATRIS contient du chlorure de benzalkonium :
Ce médicament contient 0,15 mg de chlorure de benzalkonium dans chaque millilitre de collyre en solution.
Le chlorure de benzalkonium peut être absorbé par les lentilles de contact souples et changer leur couleur. Retirer les lentilles de contact avant application et attendre au moins 15 minutes avant de les remettre.
Le chlorure de benzalkonium peut également provoquer une irritation des yeux, surtout si vous souffrez du syndrome de l’œil sec ou de troubles de la cornée (couche transparente à l’avant de l’œil). En cas de sensation anormale, de picotements ou de douleur dans les yeux après avoir utilisé ce médicament, contactez votre médecin.
3. COMMENT UTILISER DORZOLAMIDE/TIMOLOL VIATRIS 20 mg/ml + 5 mg/ml, collyre en solution ?
La posologie adéquate et la durée du traitement seront établies par votre médecin.
La dose recommandée est d'une goutte dans l'œil (les yeux) atteint(s), deux fois par jour, par exemple le matin et le soir.
En cas d'utilisation concomitante de ce médicament avec un autre collyre : les instillations successives de chaque collyre doivent être espacées d'au moins 10 minutes.
Ne modifiez pas la posologie de ce médicament sans en avertir votre médecin. Si vous devez arrêter votre traitement, contactez votre médecin immédiatement.
Evitez tout contact de l'extrémité du flacon avec l'œil ou les parties avoisinantes. Il pourrait, en effet, être contaminé par des bactéries qui peuvent entraîner des lésions graves de l'œil, voire même la perte de la vision. Pour éviter toute contamination possible du flacon, lavez-vous les mains avant utilisation de ce collyre et empêchez tout contact de l'embout du flacon avec son environnement. Si vous pensez que votre médicament a pu être contaminé ou si vous présentez une infection oculaire, contactez immédiatement votre médecin afin de savoir si vous pouvez réutiliser ce flacon.
Pour garantir la délivrance d'une dose conforme, l'embout ne doit pas être élargi.
Mode d'emploi :
Ne pas utiliser le flacon si la languette de sécurité en plastique n’est pas présente ou est endommagée. Lorsque vous ouvrez le flacon pour la première fois, déchirez la languette de sécurité en plastique.
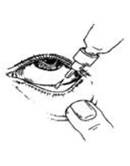
Chaque fois que vous utilisez Dorzolamide/Timolol Viatris :
1. Lavez-vous les mains.
2. Ouvrez le flacon. Faites attention de ne pas toucher votre œil, la peau autour de votre œil ou vos doigts avec l’embout du flacon.
3. Inclinez votre tête en arrière et tenez le flacon à l’envers au-dessus de votre œil.
4. Tirez la paupière inférieure vers le bas et regardez vers le haut. Tenez le flacon par les côtés aplatis et pressez doucement pour laisser tomber une goutte dans l’espace entre la paupière inférieure et l’œil.
5. Fermez votre œil et appuyez sur le coin intérieur de l’œil avec votre doigt pendant environ deux minutes. Cela aide à stopper la propagation du médicament dans le reste du corps.
6. Répétez les étapes 3 à 5 pour l’autre œil si votre médecin vous l’a prescrit.
7. Remettez le bouchon et fermez soigneusement le flacon.

Si vous avez utilisé plus de DORZOLAMIDE/TIMOLOL VIATRIS 20 mg/ml + 5 mg/ml, collyre en solution que vous n’auriez dû :
Il est important de respecter la dose prescrite par votre médecin. Si vous instillez trop de gouttes dans votre œil ou si vous avalez le contenu du flacon, vous pouvez vous sentir mal. Par exemple, vous pouvez avoir mal à la tête ou être fatigué, être étourdi ou avoir des vertiges, des difficultés à respirer, un essoufflement ou sentir que votre rythme cardiaque ralentit. Contactez immédiatement votre médecin.
Si vous oubliez d’utiliser DORZOLAMIDE/TIMOLOL VIATRIS 20 mg/ml + 5 mg/ml, collyre en solution :
Il est important de prendre ce médicament comme votre médecin vous l'a prescrit. Si vous oubliez d'instiller une goutte à l'heure prévue, instillez-la le plus tôt possible après l'oubli.
Cependant, s'il est presque l'heure de l'instillation suivante, reprenez votre médicament normalement à l'heure habituelle suivante. Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez d’utiliser DORZOLAMIDE/TIMOLOL VIATRIS 20 mg/ml + 5 mg/ml, collyre en solution :
Si vous voulez arrêter ce médicament, parlez-en d'abord à votre médecin.
Si vous avez d'autres questions sur l'utilisation de ce médicament, demandez conseil à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Effets indésirables graves :
Si vous ressentez l’un des effets indésirables suivants, arrêtez d’utiliser ce médicament et consulter immédiatement votre médecin car cela pourrait être un signe de réaction au médicament.
Des réactions allergiques généralisées incluant des gonflements sous la peau peuvent se produire à des endroits tels que la figure ou les membres, et peuvent obstruer les voies aériennes, ce qui peut provoquer une difficulté à avaler, une difficulté respiratoire, de l'urticaire ou une éruption qui démange, une éruption locale et généralisée, des démangeaisons, une réaction allergique soudaine menaçant le pronostic vital.
Il est généralement possible de continuer à utiliser le collyre, à moins que les effets ne soient sévères. Si vous êtes inquiet, parlez-en à votre médecin ou à votre pharmacien. N’arrêtez pas d’utiliser Dorzolamide/Timolol sans en avoir parlé à votre médecin.
Les effets indésirables suivants ont été rapportés avec Dorzolamide/Timolol Viatris ou l’un de ses composants pendant les études cliniques ou depuis la commercialisation :
Très fréquent (peut affecter plus d’1 personne sur 10) :
· Brûlures et picotements des yeux, altération du goût.
Fréquent (peuvent affecter jusqu’à 1 personne sur 10) :
· Rougeur de/et autour de l’œil (des yeux), larmoiement ou démangeaisons de l’œil (des yeux),
· érosion de la cornée (dommage de la couche superficielle du globe oculaire),
· gonflement et/ou irritation de/et autour de l’œil (des yeux),
· sensation d'avoir quelque chose dans l'œil,
· baisse de la sensibilité cornéenne (ne pas se rendre compte de la présence d'un corps étranger dans l'œil et absence de sensation de douleur),
· douleur oculaire,
· yeux secs,
· vision trouble,
· maux de tête,
· sinusite (sensation de tension dans le nez ou de nez plein),
· nausées,
· faiblesse/lassitude et fatigue.
Peu fréquent (peuvent affecter jusqu’à 1 personne sur 100) :
· Etourdissement
· dépression,
· inflammation de l’iris,
· troubles visuels dont changement de la réfraction (dû dans certains cas à l’interruption d’un traitement pour traiter la contraction excessive de la pupille),
· rythme cardiaque lent,
· évanouissement,
· difficulté respiratoire,
· indigestion
· calculs rénaux (souvent marquées par une apparition soudaine de douleurs atroces et crampes dans le bas du dos et/ou les côtés, l'aine ou l'abdomen).
Rare (peuvent affecter jusqu’à 1 personne sur 1000) :
· Lupus érythémateux disséminé (une maladie immunitaire qui peut entraîner une inflammation des organes internes)
· fourmillement ou engourdissement des mains ou des pieds,
· insomnies,
· cauchemars,
· perte de mémoire,
· augmentation des signes et symptômes de myasthénie (trouble des muscles),
· diminution de la libido,
· accident vasculaire cérébral,
· myopie transitoire qui peut cesser à l’arrêt du traitement,
· détachement de la couche située sous la rétine qui contient des vaisseaux sanguins, après chirurgie filtrante, qui peut occasionner des troubles visuels,
· chute de la paupière (l'œil reste à moitié fermé),
· vision double,
· lésions croûteuses de la paupière,
· œdème de la cornée (avec des symptômes de troubles visuels),
· pression oculaire basse,
· bourdonnements dans les oreilles,
· pression artérielle basse,
· modification du rythme ou de la vitesse des battements du cœur,
· insuffisance cardiaque congestive (maladie du cœur avec essoufflement et gonflement des pieds et des jambes dû à l'accumulation de liquide),
· œdème (accumulation de liquide),
· ischémie cérébrale (diminution de la circulation sanguine du cerveau),
· douleur thoracique,
· battements du cœur puissants pouvant être rapides ou irréguliers (palpitations),
· crise cardiaque,
· syndrome de Raynaud,
· gonflement ou froideur des mains et des pieds et mauvaise circulation des bras et des jambes,
· crampes et/ou douleur des jambes pendant la marche (claudication),
· nez bouché ou qui coule,
· saignement de nez,
· constriction des voies aériennes au niveau des poumons entraînant des difficultés respiratoires,
· toux,
· irritation de la gorge,
· sécheresse buccale,
· diarrhée,
· dermite de contact,
· perte de cheveux,
· éruption cutanée d'apparence blanc argenté (éruption psoriasiforme),
· maladie de La Peyronie (pouvant causer une courbure du pénis),
· réactions de type allergique telles que éruption, urticaire, démangeaisons, en de rares cas gonflement possible des lèvres, des yeux et de la bouche, respiration sifflante ou réactions cutanées sévères (syndrome de Stevens-Johnson, nécrolyse épidermique toxique).
Comme d'autres médicaments instillés dans l'œil, le timolol passe dans le sang. Ceci peut provoquer des effets indésirables similaires à ceux observés avec des médicaments bêta-bloquants administrés par voie orale. L'incidence de ces effets indésirables après une instillation dans l'œil est moins importante que si le médicament est pris par exemple par voie orale ou par injection. Les effets indésirables additionnels listés incluent les réactions observées dans la classe des bêta-bloquants lors de leur utilisation dans le traitement des maladies oculaires.
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) :
· Taux bas de glucose dans le sang ;
· insuffisance cardiaque ;
· un type de trouble des battements du cœur ;
· douleur abdominale ;
· vomissements ;
· douleur musculaire non induite par l'exercice ;
· dysfonctionnement sexuel ;
· hallucination ;
· sensation de corps étranger dans l’œil (impression d’avoir quelque chose dans l’œil) ;
· augmentation de la fréquence cardiaque ;
· augmentation de la pression artérielle ;
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER DORZOLAMIDE/TIMOLOL VIATRIS 20 mg/ml + 5 mg/ml, collyre en solution ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette, la boîte après {EXP}. La date de péremption fait référence au dernier jour de ce mois.
Pas de précautions particulières de température de conservation. Conserver dans l’emballage extérieur d’origine pour protéger de la lumière et de l’humidité.
Dorzolamide/Timolol Viatris doit être utilisé dans les 28 jours qui suivent l'ouverture du flacon. Vous devez donc jeter le flacon 4 semaines après l'avoir ouvert même s'il reste un peu de solution. Pour vous aider à vous en rappeler, inscrivez la date à laquelle vous avez ouvert le flacon dans le cadre prévu à cet effet sur la boîte.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient DORZOLAMIDE/TIMOLOL VIATRIS 20 mg/ml + 5 mg/ml, collyre en solution
· Les substances actives sont : le dorzolamide et le timolol.
Chaque millilitre contient 20 mg de dorzolamide (sous forme de chlorhydrate de dorzolamide) et 5 mg de timolol (sous forme de maléate de timolol).
· Les autres composants sont :
Le mannitol, l'hydroxyéthylcellulose, le chlorure de benzalkonium (comme conservateur) (voir rubrique 2 « Dorzolamide/Timolol Viatris contient un conservateur »), le citrate de sodium, l'hydroxyde de sodium et l'eau pour préparations injectables.
DORZOLAMIDE/TIMOLOL VIATRIS 20 mg/ml + 5 mg/ml, collyre en solution est une solution stérile, incolore, claire et légèrement visqueuse.
Flacon à usage ophtalmique blanc opaque (PE de densité intermédiaire), muni d'un embout compte-gouttes scellé (PEBD) et avec un bouchon à vis (PEHD) et une bague d'inviolabilité au niveau du col, contenant 5 ml de collyre en solution.
Boîte de 1, 3 ou 6 flacons de 5 ml.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
VIATRIS SANTE
1 RUE DE TURIN
69007 LYON
Exploitant de l’autorisation de mise sur le marché
1 RUE DE TURIN
69007 LYON
6, DERVENAKION STR.,
15351 PALLINI, ATTIKI
GRECE
ou
FAMAR SA, PLANT A
63 AGIOU DIMITRIOU STREET,
174 56 ALIMOS
GRECE
ou
VIATRIS SANTE
1 RUE DE TURIN
69007 LYON
FRANCE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).