Dernière mise à jour le 01/12/2025
ACIDE ZOLEDRONIQUE VIATRIS 4 mg/100 ml, solution pour perfusion
Indications thérapeutiques
Classe pharmacothérapeutique - code ATC : M05BA08
La substance active contenue dans ACIDE ZOLEDRONIQUE VIATRIS est l’acide zolédronique qui appartient à un groupe de substances appelées bisphosphonates. L’acide zolédronique agit en s’attachant à l’os et en ralentissant le taux de renouvellement osseux.
Il est utilisé :
Pour prévenir les complications osseuses, ex. fractures, chez les patients adultes ayant des métastases osseuses (diffusion du cancer du site principal à l’os).
Pour diminuer le taux de calcium dans le sang des patients adultes lorsque celui-ci est élevé en raison de la présence d’une tumeur. Les tumeurs peuvent accélérer le renouvellement osseux habituel de sorte que la quantité de calcium libéré par l’os est augmentée. Cette pathologie est appelée hypercalcémie induite par les tumeurs.
Présentations
> 1 flacon(s) en verre de 100 ml
Code CIP : 278 000-2 ou 34009 278 000 2 3
Déclaration de commercialisation : 19/07/2021
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 98,27 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 99,29 €
- Taux de remboursement :65 %
Service médical rendu (SMR)
Amélioration du service médical rendu (ASMR)
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
Autres informations
- Titulaire de l'autorisation : VIATRIS SANTE
- Conditions de prescription et de délivrance :
- liste I
- médicament nécessitant une surveillance particulière pendant le traitement
- Statut de l'autorisation : Valide
- Type de procédure : Procédure décentralisée
- Code CIS : 6 848 062 7
ANSM - Mis à jour le : 18/02/2025
ACIDE ZOLEDRONIQUE VIATRIS 4 mg/100 ml, solution pour perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Un flacon de 100 ml de solution contient 4 mg d’acide zolédronique, correspondant à 4,26 mg d’acide zolédronique monohydraté.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution transparente et incolore.
pH : 5,5 - 7,0
Osmolalité : 0,27 - 0,33 Osmol/kg.
4.1. Indications thérapeutiques
· Traitement de l’hypercalcémie induite par des tumeurs (TIH) chez des patients adultes.
4.2. Posologie et mode d'administration
ACIDE ZOLEDRONIQUE VIATRIS doit être uniquement prescrit et administré aux patients par des professionnels de santé qui ont l’expérience de l’administration des bisphosphonates par voie intraveineuse.
Les patients traités par ACIDE ZOLEDRONIQUE VIATRIS doivent recevoir la notice et la carte patient.
Prévention des complications osseuses chez des patients atteints de pathologie maligne à un stade avancé avec atteinte osseuse
Adultes et personnes âgées :
La dose recommandée dans la prévention des complications osseuses chez des patients atteints de pathologie maligne à un stade avancé avec atteinte osseuse est de 4 mg d’acide zolédronique toutes les 3 à 4 semaines.
Les patients devront aussi recevoir, par voie orale, un apport de 500 mg de calcium et de 400 UI de vitamine D par jour.
La décision de traiter les patients ayant des métastases osseuses afin de prévenir les complications osseuses devra être prise en tenant compte du fait que le délai d’action du traitement est de 2 à 3 mois.
Traitement de l’hypercalcémie induite par des tumeurs
Adultes et personnes âgées :
La dose recommandée dans l’hypercalcémie (calcémie corrigée en fonction de l’albumine ≥ 12,0 mg/dl ou 3,0 mmol/l) est une dose unique de 4 mg d’acide zolédronique.
Insuffisance rénale
TIH :
Le traitement par l’acide zolédronique des patients ayant une hypercalcémie induite par des tumeurs et présentant également une atteinte rénale sévère devra être envisagé uniquement après l’évaluation des risques et des bénéfices de ce traitement. Dans les études cliniques, les patients ayant une créatininémie > 400 µmol/l ou > 4,5 mg/dl ont été exclus. Aucune adaptation de la dose n’est nécessaire chez les patients présentant une hypercalcémie induite par des tumeurs avec une créatininémie < 400 µmol/l ou < 4,5 mg/dl (voir rubrique 4.4).
Prévention des complications osseuses chez des patients atteints de pathologie maligne à un stade avancé avec atteinte osseuse :
A l’initiation du traitement par l’acide zolédronique des patients avec un myélome multiple ou avec atteintes osseuses métastatiques secondaires à des tumeurs solides, la créatininémie et la clairance à la créatinine (CLcr) devront être évaluées. CLcr est calculée selon la formule de Cockcroft-Gault à partir de la créatininémie. L’acide zolédronique n’est pas recommandé chez des patients présentant une atteinte rénale sévère avant l’initiation du traitement, atteinte rénale qui est définie par une CLcr < 30 ml/min pour cette population. Dans les études cliniques menées avec l’acide zolédronique, les patients ayant une créatininémie > 265 µmol/l ou 3,0 mg/dl étaient exclus.
Chez les patients ayant une fonction rénale normale (définie par une Clcr > 60 ml/min), l’acide zolédronique 4 mg/100 ml solution pour perfusion peut être directement administré sans préparation supplémentaire.
Chez les patients avec des métastases osseuses présentant une atteinte rénale légère à modérée avant l’initiation du traitement, atteinte rénale qui est définie par une CLcr de 30 à 60 ml/min, des doses réduites d’acide zolédronique sont recommandées (voir rubrique 4.4).
|
Clairance à la créatinine initiale (ml/min) |
Dose recommandée d’acide zolédronique * |
|
> 60 |
4,0 mg d’acide zolédronique |
|
50‑60 |
3,5 mg* d’acide zolédronique |
|
40‑49 |
3,3 mg* d’acide zolédronique |
|
30‑39 |
3,0 mg* d’acide zolédronique |
* Les doses ont été calculées en vue d’atteindre une valeur de l’ASC de 0,66 (mgh/l) (pour une CLcr = 75 ml/min). L’objectif étant que chez les patients avec atteinte rénale, les doses réduites d’acide zolédronique permettent d’obtenir la même ASC que celle observée chez des patients avec une clairance à la créatinine de 75 ml/min.
Après l’initiation du traitement, la créatininémie devra être mesurée avant chaque administration d’acide zolédronique et le traitement devra être suspendu si la fonction rénale s’est détériorée. Dans les études cliniques l’altération de la fonction rénale était définie comme suit :
· Une augmentation de 0,5 mg/dl ou 44 µmol/l chez les patients qui avaient une valeur de la créatinine de base normale (< 1,4 mg/dl ou < 124 µmol/l).
· Une augmentation de 1,0 mg/dl ou 88 µmol/l chez les patients qui avaient une valeur de la créatinine de base anormale (> 1,4 mg/dl ou > 124 µmol/l).
Dans les études cliniques, le traitement par l’acide zolédronique était repris uniquement lorsque la valeur de la créatininémie était revenue à la valeur de base ± 10 % (voir rubrique 4.4). Le traitement par l’acide zolédronique devra être repris à la même dose que celle administrée avant l’interruption du traitement.
Population pédiatrique
La sécurité et l’efficacité de l’acide zolédronique chez les enfants âgés de 1 an à 17 ans n’ont pas été établies. Les données actuellement disponibles sont décrites à la rubrique 5.1 mais aucune recommandation sur la posologie ne peut être donnée.
Mode d’administration
Voie intraveineuse uniquement.
ACIDE ZOLEDRONIQUE VIATRIS 4 mg/100 ml solution pour perfusion doit être administré en une seule perfusion intraveineuse d’une durée d’au moins 15 minutes.
Chez les patients ayant une fonction rénale normale, fonction définie par une Clcr > 60 ml/min, l’acide zolédronique 4 mg/100 ml solution pour perfusion, ne doit pas être dilué.
Chez les patients présentant une atteinte rénale légère à modérée, des doses réduites d’acide zolédronique sont recommandées (voir rubrique « Posologie » ci-dessus et rubrique 4.4).
Pour la préparation des doses réduites pour les patients ayant une Clcr initiale ≤ 60 ml/min, se référer au Tableau 1 ci-dessous. Retirer du flacon le volume de solution d’acide zolédronique indiqué et le remplacer par un volume équivalent de solution injectable de chlorure de sodium stérile à 9 mg/ml (0,9 %) ou une solution injectable de glucose à 5 %.
Tableau 1 : Préparation des doses réduites d’acide zolédronique 4 mg/100 ml solution pour perfusion
|
Clairance de la créatine initiale (ml/min) |
Retirer du flacon le volume suivant d’acide zolédronique solution pour perfusion (ml) |
Le remplacer avec un volume équivalent de chlorure de sodium stérile à 9 mg/ml (0,9 %) ou une solution injectable de glucose à 5% (ml) |
Dose adaptée (mg d’acide zolédronique dans 100 ml) |
|
50-60 |
12,0 |
12,0 |
3,5 |
|
40-49 |
18,0 |
18,0 |
3,3 |
|
30-39 |
25,0 |
25,0 |
3,0 |
ACIDE ZOLEDRONIQUE VIATRIS 4 mg/100 ml, solution pour perfusion ne doit pas être mélangé avec d’autres solutions pour perfusion et doit être administré de manière dissociée des autres perfusions via une ligne séparée.
Les patients doivent être correctement hydratés avant et après l’administration d’acide zolédronique.
· Allaitement (voir rubrique 4.6).
4.4. Mises en garde spéciales et précautions d'emploi
Général
Les patients devront être évalués avant l’administration d’acide zolédronique pour s’assurer qu’ils sont correctement hydratés.
L’hyperhydratation doit être évitée chez les patients présentant un risque d’insuffisance cardiaque.
Les paramètres métaboliques standards associés à l’hypercalcémie, tels que la calcémie, la phosphatémie et la magnésémie, doivent être surveillés avec attention après initiation du traitement par l’acide zolédronique. En cas d’hypocalcémie, d’hypophosphatémie ou d’hypomagnésémie, un traitement de supplémentation de courte durée peut être nécessaire. Les patients ayant une hypercalcémie non traitée présentent généralement une atteinte de la fonction rénale ; il est donc recommandé de surveiller avec précaution la fonction rénale.
La substance active contenue dans ACIDE ZOLEDRONIQUE VIATRIS 4 mg/100 ml est identique à celle de l’acide zolédronique 5 mg/100 ml autorisé dans les indications de l’ostéoporose et de la maladie osseuse de Paget. Les patients traités par l’ACIDE ZOLEDRONIQUE VIATRIS 4 mg/100 ml ne doivent pas être traités de façon concomitante par l’acide zolédronique 5 mg/100 ml ou par un autre bisphosphonate, car les effets de ces associations ne sont pas connus.
Insuffisance rénale
Les patients ayant une TIH et présentant une altération de la fonction rénale devront être évalués de façon appropriée pour apprécier le rapport bénéfice/risque du traitement avec l’acide zolédronique.
La décision de traiter les patients ayant des métastases osseuses afin de prévenir les complications osseuses devra être prise en tenant compte du fait que l’effet du traitement commence à s’observer au bout de 2 à 3 mois.
L’acide zolédronique a été associé à des cas de dysfonctionnements rénaux. Les facteurs qui peuvent augmenter le risque d’une altération de la fonction rénale comprennent la déshydratation, l’insuffisance rénale préexistante, les cycles multiples d’acide zolédronique et d’autres bisphosphonates, aussi bien que d’autres médicaments néphrotoxiques.
Bien que le risque soit réduit en administrant sur 15 minutes la dose de 4 mg d’acide zolédronique, une altération de la fonction rénale peut cependant se produire. Une altération rénale, une progression de l’insuffisance rénale et le cas de dialyse ont été rapportés chez des patients après une dose initiale ou une seule dose de 4 mg d’acide zolédronique. Des augmentations de la créatininémie peuvent aussi s’observer, quoique moins fréquemment, chez quelques patients qui reçoivent l’acide zolédronique en administration chronique aux doses recommandées pour la prévention des complications osseuses.
Les patients devront avoir un dosage de leur créatininémie avant chaque administration d’acide zolédronique. En cas d’initiation de traitement chez des patients ayant des métastases osseuses et une atteinte rénale légère à modérée, des doses plus faibles d’acide zolédronique sont recommandées. En cas d’altération de la fonction rénale au cours du traitement, l’acide zolédronique devra être interrompu. L’acide zolédronique devra être repris uniquement lorsque la créatininémie est revenue à la valeur de base ± 10 %. Le traitement par l’acide zolédronique devra être repris à la même dose que celle administrée avant l’interruption du traitement.
En raison de l’effet potentiel de l’acide zolédronique sur la fonction rénale, du manque de données de tolérance clinique chez des patients ayant avant traitement une atteinte rénale sévère (définie dans les études cliniques, par une créatininémie ≥ 400 µmol/l ou ≥ 4,5 mg/dl chez des patients ayant une TIH et par une créatininémie ≥ 265 µmol/l ou ≥ 3,0 mg/dl chez des patients atteints de pathologie maligne avec atteinte osseuse) et compte tenu des données pharmacocinétiques encore limitées chez les patients ayant au départ une atteinte rénale sévère (clairance de la créatinine < 30 ml/min), l’utilisation de l’acide zolédronique n’est pas recommandée chez des patients ayant une atteinte rénale sévère.
Insuffisance hépatique
Les données cliniques disponibles sont limitées chez les patients ayant une insuffisance hépatique sévère, aussi aucune recommandation spécifique ne peut être donnée pour cette population de patients.
Ostéonécrose
Ostéonécrose de la mâchoire
L’ostéonécrose de la mâchoire (ONM) a été peu fréquemment rapportée dans les essais cliniques chez des patients recevant de l’acide zolédronique. L’expérience après commercialisation et la littérature scientifique suggèrent une fréquence plus importante de signalements d’ONM en fonction du type de tumeur (cancer du sein avancé, myélome multiple). Une étude a montré que l’ONM était plus fréquente chez les patients atteints de myélome par rapport à d’autres cancers (voir rubrique 5.1).
Le début du traitement ou d'un nouveau cycle de traitement doit être retardé chez les patients atteints de lésions ouvertes, non cicatrisées, des tissus mous de la bouche, sauf en cas de situation d’urgence médicale. Un bilan bucco-dentaire accompagné de soins dentaires préventifs appropriés et d’une évaluation individuelle du rapport bénéfice-risque est recommandé avant le traitement par les bisphosphonates chez les patients présentant des facteurs de risque.
Les facteurs de risques suivants doivent être pris en compte lors de l’évaluation du risque individuel de développer une ONM :
· Puissance du bisphosphonate (risque plus élevé pour les composés de grande puissance), voie d’administration (risque plus élevé par voie parentérale), et dose cumulée du bisphosphonate.
· Cancer, situations de comorbidité (telles que : anémie, coagulopathies, infection), tabagisme.
· Traitements concomitants : chimiothérapie, inhibiteurs de l'angiogenèse (voir rubrique 4.5), radiothérapie de la tête et du cou, corticostéroïdes.
· Antécédents de troubles dentaires, mauvaise hygiène buccale, maladie parodontale, soins dentaires invasifs (telles que des extractions dentaires) et prothèses dentaires mal ajustées.
Tous les patients doivent être encouragés à maintenir une bonne hygiène bucco-dentaire, à faire effectuer des contrôles dentaires réguliers et à signaler immédiatement tout symptôme buccal tels que la mobilité dentaire, des douleurs ou un gonflement, ou la non-cicatrisation des plaies ou un écoulement pendant le traitement par l’acide zolédronique.
Pendant la durée du traitement, les interventions dentaires invasives doivent être effectuées uniquement après un examen attentif et à distance des administrations d’acide zolédronique.
Pour les patients qui développent une ostéonécrose de la mâchoire au cours d’un traitement par bisphosphonates, une chirurgie dentaire peut aggraver cette atteinte. Pour les patients nécessitant une intervention dentaire, il n’y a pas de donnée disponible suggérant que l’arrêt du traitement par bisphosphonates diminuerait le risque d’ostéonécrose de la mâchoire.
Une prise en charge des patients qui développent une ostéonécrose de la mâchoire doit être mise en place en étroite collaboration entre le médecin traitant et un dentiste ou chirurgien stomatologiste ayant l’expertise des ostéonécroses de la mâchoire. Une interruption temporaire du traitement par l'acide zolédronique doit être considérée jusqu'à résolution du problème et si possible jusqu’à l’atténuation des facteurs de risque qui y contribuent.
Ostéonécrose d’autres sites anatomiques
L'ostéonécrose du conduit auditif externe a été rapportée avec les bisphosphonates, surtout en association avec une thérapie à long terme. Les facteurs de risque éventuels d'ostéonécrose du conduit auditif externe comprennent l'utilisation de stéroïdes et la chimiothérapie et/ou les facteurs de risque locaux tels qu'une infection ou un traumatisme. La possibilité d'ostéonécrose du conduit auditif externe doit être envisagée chez les patients recevant des bisphosphonates qui présentent des symptômes auditifs, notamment des infections chroniques de l’oreille.
De plus, des cas sporadiques d’ostéonécrose d’autres sites anatomiques ont été rapportés, y compris de la hanche et du fémur, principalement chez les adultes atteints de cancer traités par l’acide zolédronique.
Douleurs musculosquelettiques
Après mise sur le marché, des douleurs osseuses, articulaires et/ou musculaires sévères ou occasionnellement invalidantes ont été rapportées chez des patients traités par l’acide zolédronique. Toutefois de tels cas n’ont été rapportés que peu fréquemment. Le délai d’apparition des symptômes varie d’un jour à plusieurs mois après le début du traitement. Chez la majorité des patients ces symptômes ont régressé après l’arrêt du traitement. Une réapparition des symptômes a été observée chez certains patients après la reprise du traitement avec l’acide zolédronique ou avec un autre bisphosphonate.
Fractures atypiques du fémur
Des fractures fémorales atypiques sous-trochantériennes et diaphysaires ont été rapportées sous bisphosphonates, principalement chez des patients traités au long cours pour ostéoporose. Ces fractures transverses ou obliques courtes peuvent survenir sur n’importe quelle partie du fémur du dessous du petit trochanter jusqu’au-dessus de la zone supracondylienne. Ces fractures surviennent après un traumatisme minime ou sans traumatisme, et certains patients présentent une douleur dans la cuisse ou l’aine, souvent associée à des signes radiologiques de fractures de stress, des semaines ou des mois avant la fracture fémorale. Les fractures sont souvent bilatérales ; par conséquent, le fémur controlatéral doit être examiné chez les patients traités par bisphosphonates ayant eu une fracture fémorale diaphysaire. Une mauvaise consolidation de ces fractures a été également rapportée. L’arrêt du traitement par bisphosphonates chez les patients chez lesquels une fracture fémorale atypique est suspectée, doit être envisagé en fonction de l’évaluation du bénéfice/risque pour le patient.
Durant le traitement par bisphosphonates, les patients doivent être informés que toute douleur au niveau de la cuisse, de la hanche ou de l’aine doit être rapportée et tous les patients présentant de tels symptômes devront être examinés pour rechercher une fracture fémorale atypique.
Hypocalcémie
Une hypocalcémie a été rapportée chez des patients traités par l’acide zolédronique. Des arythmies cardiaques et des effets indésirables neurologiques secondaires à des cas d’hypocalcémie sévère (incluant convulsions, hypoesthésie et tétanie) ont été rapportés. Des cas d’hypocalcémie sévère nécessitant une hospitalisation ont été rapportés. Dans certains cas, l’hypocalcémie peut engager le pronostic vital (voir rubrique 4.8). La prudence est conseillée lorsque l’acide zolédronique est administré en même temps que des médicaments connus pour provoquer une hypocalcémie, car ceux-ci peuvent avoir un effet synergique conduisant à une hypocalcémie sévère (voir rubrique 4.5). La calcémie doit être mesurée et l’hypocalcémie doit être corrigée avant le début du traitement par l’acide zolédronique. Les patients doivent recevoir une supplémentation en calcium et en vitamine D adaptée.
ACIDE ZOLEDRONIQUE VIATRIS 4 mg/100 ml contient du sodium.
Ce médicament contient moins de 1 mmol de sodium (23 mg) par flacon, c'est-à-dire qu’il est essentiellement « sans sodium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
La prudence est conseillée lorsque les bisphosphonates sont administrés avec des aminosides, la calcitonine ou des diurétiques de l’anse, puisque ces substances peuvent avoir un effet additif, entraînant un taux plus faible de la calcémie sur des périodes plus longues que celles requises (voir rubrique 4.4).
La prudence est requise lorsque l’acide zolédronique est administré avec d’autres médicaments potentiellement néphrotoxiques. Il faut aussi prêter attention à la survenue possible d’une hypomagnésémie pendant le traitement.
Chez les patients atteints de myélome multiple, le risque d’altération de la fonction rénale peut être augmenté lorsque l’acide zolédronique est utilisé en association avec la thalidomide.
La prudence est recommandée lorsque l’acide zolédronique est administré avec des médicaments anti-angiogéniques puisqu’une augmentation de l’incidence des ONM a été observée chez des patients traités de façon concomitante par ces médicaments.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n’existe pas de données suffisantes concernant l’utilisation de l’acide zolédronique chez la femme enceinte. Des études effectuées chez l’animal ont mis en évidence une toxicité sur la reproduction avec l’acide zolédronique (voir rubrique 5.3). Le risque potentiel en clinique n’est pas connu. L’acide zolédronique ne doit pas être utilisé pendant la grossesse. Il doit être conseillé aux femmes en âge de procréer d’éviter une grossesse.
Il n’est pas établi si l’acide zolédronique est excrété dans le lait maternel. L’acide zolédronique est contre-indiqué chez la femme qui allaite (voir rubrique 4.3).
Fertilité
Les potentiels effets délétères de l’acide zolédronique sur la fécondité des parents et de la génération F1 ont été évalués chez le rat. Il a été observé des effets pharmacologiques majorés considérés comme liés à l’inhibition du métabolisme du calcium osseux par le produit, résultant en une hypocalcémie péri-parturiente, un effet de classe des bisphosphonates, une dystocie et un arrêt anticipé de l’étude. Ainsi il n’a pas été possible d’éliminer un effet de l’acide zolédronique sur la fertilité chez l’homme.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil de sécurité
Il a généralement été rapporté une réaction de phase aiguë dans les trois jours suivants l’administration de l’acide zolédronique avec des symptômes incluant douleur osseuse, fièvre, fatigue, arthralgies, myalgies, frissons et arthrite avec gonflement articulaire consécutif ; ces symptômes se résolvent habituellement en quelques jours (voir la description des effets indésirables sélectionnés).
Les risques importants identifiés avec l’acide zolédronique dans les indications approuvées sont les suivants :
Atteinte de la fonction rénale, ostéonécrose de la mâchoire, réaction de phase aiguë, hypocalcémie, fibrillation auriculaire, anaphylaxie, pneumopathie interstitielle. La fréquence de chacun de ces risques identifiés est présentée dans le Tableau 2.
Tableau des effets indésirables
Les effets indésirables suivants, énumérés dans le Tableau 2, ont été collectés à partir des études cliniques et des signalements d’effets indésirables après commercialisation, principalement après l’administration chronique du traitement par l’acide zolédronique 4 mg :
Tableau 2
Les réactions indésirables sont classées par ordre de fréquence décroissante en utilisant la convention suivante : très fréquent (≥ 1/10), fréquent (≥ 1/100, < 1/10), peu fréquent (≥ 1/1 000, < 1/100), rare (≥ 1/10 000, < 1/1 000), très rare (< 1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
Affections hématologiques et du système lymphatique |
|
|
Fréquent |
Anémie |
|
Peu fréquent |
Thrombopénie, leucopénie |
|
Rare |
Pancytopénie |
|
Affections du système immunitaire |
|
|
Peu fréquent |
Réaction d’hypersensibilité |
|
Rare |
Œdème de Quincke (angioneurotique) |
|
Affections psychiatriques |
|
|
Peu fréquent |
Anxiété, troubles du sommeil |
|
Rare |
Confusion |
|
Affections du système nerveux |
|
|
Fréquent |
Céphalée |
|
Peu fréquent |
Etourdissements, paresthésie, dysgueusie, hypoesthésie, hyperesthésie, tremblements, somnolence |
|
Très rare |
Convulsions, hypoesthésie et tétanie (secondairement à l’hypocalcémie) |
|
Affections oculaires |
|
|
Fréquent |
Conjonctivite |
|
Peu fréquent |
Vision trouble, sclérite et inflammation orbitale |
|
Rare |
Uvéite |
|
Très rare |
Episclérite |
|
Affections cardiaques |
|
|
Peu fréquent |
Hypertension, hypotension, fibrillation auriculaire, hypotension pouvant conduire à une syncope ou un collapsus circulatoire |
|
Rare |
Bradycardie, arythmie cardiaque (secondairement à l’hypocalcémie) |
|
Affections respiratoires, thoraciques et médiastinales |
|
|
Peu fréquent |
Dyspnée, toux, bronchoconstriction |
|
Rare |
Pneumopathie interstitielle |
|
Affections gastro-intestinales |
|
|
Fréquent |
Nausées, vomissements, diminution de l’appétit |
|
Peu fréquent |
Diarrhée, constipation, douleurs abdominales, dyspepsie, stomatite, bouche sèche |
|
Affections de la peau et du tissu sous-cutané |
|
|
Peu fréquent |
Prurit, éruptions cutanées (y compris éruptions érythémateuses et maculaires), transpiration accrue |
|
Affections musculo-squelettiques et systémiques |
|
|
Fréquent |
Douleurs osseuses, myalgie, arthralgie, douleur généralisée |
|
Peu fréquent |
Spasmes musculaires, ostéonécroses de la mâchoire |
|
Très rare |
Ostéonécrose du conduit auditif externe (effets indésirables de la classe des bisphosphonates) et d’autres sites anatomiques y compris le fémur et la hanche |
|
Affections du rein et des voies urinaires |
|
|
Fréquent |
Atteintes rénales |
|
Peu fréquent |
Insuffisance rénale aiguë, hématurie, protéinurie |
|
Rare |
Syndrome de Fanconi acquis |
|
Troubles généraux et anomalies au site d’administration |
|
|
Fréquent |
Fièvre, syndrome pseudo-grippal (y compris fatigue, frissons, malaise et bouffée vasomotrice) |
|
Peu fréquent |
Asthénie, œdème périphérique, réactions au site d’injection (y compris douleurs, irritation, tuméfaction, induration), douleur thoracique, prise de poids, choc anaphylactique, urticaire |
|
Rare |
Symptômes de la réaction de phase aiguë : arthrite et gonflement articulaire |
|
Fréquence indéterminée |
Néphrite tubulo-interstitielle |
|
Investigations |
|
|
Très fréquent |
Hypophosphatémie |
|
Fréquent |
Augmentation de la créatinémie et de l’uricémie, hypocalcémie |
|
Peu fréquent |
Hypomagnésémie, hypokaliémie |
|
Rare |
Hyperkaliémie, hypernatrémie |
Description des réactions indésirables sélectionnées
Atteintes de la fonction rénale
Des altérations de la fonction rénale ont été signalées sous acide zolédronique. Dans une analyse poolée des données de tolérance provenant des études d’enregistrement réalisées chez les patients ayant des tumeurs malignes d’origine osseuse à un stade avancé traités pour la prévention des évènements musculo-squelettiques, la fréquence des cas d’insuffisance rénale suspectés d’être en rapport avec l’acide zolédronique (effets indésirables) était la suivante : myélome multiple (3,2 %), cancer de la prostate (3,1 %), cancer du sein (4,3 %), tumeurs du poumon et autres tumeurs solides (3,2 %). Les facteurs pouvant accroître le risque de détérioration de la fonction rénale sont la déshydratation, les atteintes rénales préexistantes, la répétition des cycles d’acide zolédronique ou d’autres bisphosphonates, l’utilisation concomitante de médicaments néphrotoxiques et un temps de perfusion plus court que celui recommandé. L’altération de la fonction rénale, la progression d’une insuffisance rénale et la dialyse ont été rapportées chez des patients après la première dose ou une unique dose de 4 mg d’acide zolédronique (voir rubrique 4.4).
Ostéonécrose de la mâchoire
Des cas d’ostéonécroses de la mâchoire ont été rapportés, principalement chez des patients atteints d’un cancer et traités par des médicaments qui inhibent la résorption osseuse, tel que l’acide zolédronique (voir rubrique 4.4). Beaucoup de ces patients étaient également traités par chimiothérapie et corticostéroïdes et présentaient des signes d’infection locale y compris une ostéomyélite. La majorité des cas concernait des patients atteints d’un cancer et ayant subi une extraction dentaire ou d’autres chirurgies dentaires.
Fibrillation auriculaire
Au cours d’une étude de 3 ans, randomisée et contrôlée en double aveugle, qui a évalué l’efficacité et la tolérance de 5 mg d’acide zolédronique administré une fois par an versus placebo dans le traitement de l’ostéoporose post-ménopausique (OPM), l’incidence globale des fibrillations auriculaires a été de 2,5 % (96 sur 3 862) dans le bras acide zolédronique et de 1,9 % (75 sur 3 852) dans le bras placebo. Le taux de fibrillations auriculaires classées comme évènements indésirables graves a été de 1,3 % (51 sur 3 862) dans le bras acide zolédronique et 0,6 % (22 sur 3 852) dans le bras placebo.
Le déséquilibre observé dans cette étude n’a pas été observé dans d’autres études avec l’acide zolédronique, y compris celles avec l’acide zolédronique 4 mg administré toutes les 3-4 semaines chez les patients traités en oncologie. Le mécanisme de l’augmentation de cette incidence des fibrillations auriculaires dans cette seule étude clinique n’est pas connu.
Réaction de phase aiguë
Cet effet indésirable consiste en une constellation de symptômes qui incluent fièvre, myalgies, céphalées, douleurs des extrémités, nausées, vomissements, diarrhée, arthralgies et arthrite avec gonflement articulaire consécutif. Le délai d’apparition de ces symptômes est ≤ 3 jours après perfusion de l’acide zolédronique. L’ensemble de ces symptômes peut être présenté comme des symptômes « pseudo-grippaux » ou « post-dose ».
Fractures atypiques du fémur
Après la commercialisation, les effets indésirables suivants ont été rapportés (fréquence rare) : fractures fémorales atypiques sous-trochantériennes et diaphysaires (effets indésirables de classe des bisphosphonates).
Effets indésirables liés à l’hypocalcémie
L’hypocalcémie est un risque important identifié avec l’acide zolédronique dans ses indications approuvées. La revue des cas d’hypocalcémie issus des essais cliniques et des cas d’hypocalcémie rapportés depuis la mise sur le marché apporte suffisamment de preuves pour établir le lien entre le traitement par l’acide zolédronique, la survenue d’une hypocalcémie et l’apparition d’une arythmie cardiaque secondaire. De même, il existe des preuves d’une association entre l’hypocalcémie et des effets neurologiques secondaires rapportés dans ces cas, incluant : convulsions, hypoesthésie et tétanie (voir rubrique 4.4).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
L’expérience clinique d’un surdosage aigu d’acide zolédronique est limitée. L’administration par erreur de doses d’acide zolédronique allant jusqu’à 48 mg a été rapportée. Les patients qui ont reçu des doses supérieures à celles recommandées (voir rubrique 4.2) doivent être surveillés attentivement étant donné qu’une altération de la fonction rénale (y compris une insuffisance rénale) et des anomalies des électrolytes sériques (incluant le calcium, le phosphore et le magnésium) ont été observées. En présence d’une hypocalcémie, des perfusions de gluconate de calcium doivent être administrées en fonction de la nécessité clinique.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
L’acide zolédronique appartient à la classe des bisphosphonates et agit principalement sur l’os. Il inhibe la résorption ostéoclastique osseuse.
L’action sélective des bisphosphonates sur l’os découle de leur forte affinité pour l’os minéralisé mais le mécanisme moléculaire précis, menant à l’inhibition de l’activité ostéoclastique n’est pas encore élucidé. Dans les études à long terme menées chez l’animal, l’acide zolédronique inhibe la résorption osseuse sans effet défavorable sur la formation, la minéralisation ou les propriétés mécaniques de l’os.
En plus d’être un puissant inhibiteur de la résorption osseuse, l’acide zolédronique possède également plusieurs propriétés antitumorales qui pourraient contribuer à son efficacité globale dans le traitement de la maladie métastatique osseuse. Les propriétés suivantes ont été démontrées dans des études pré-cliniques :
In vivo : inhibition de la résorption ostéoclastique osseuse qui altère le microenvironnement médullaire, le rendant moins favorable à la croissance des cellules tumorales, activité anti-angiogénique et activité antalgique
In vitro : inhibition de la prolifération ostéoblastique, activité cytostatique directe et pro-apoptotique sur les cellules tumorales, effet cytostatique synergique en association à d’autres médicaments anti-cancéreux, activité anti-adhésion/invasion cellulaire.
Résultats des études cliniques dans la prévention des complications osseuses chez des patients atteints de pathologie maligne à un stade avancé avec atteinte osseuse :
La première étude randomisée, en double aveugle, contrôlée versus placebo comparait 4 mg d’acide zolédronique au placebo dans la prévention des complications osseuses (Skeletal Related Events : SREs) chez des patients présentant un cancer de la prostate. L’acide zolédronique 4 mg a réduit significativement la proportion de patients présentant au moins une complication osseuse (SRE), a retardé le délai médian de survenue de la première complication osseuse de plus de 5 mois et a réduit l’incidence annuelle de complications osseuses par patient (taux de morbidité osseuse). L’analyse des « événements multiples » a montré une réduction de 36 % du risque de développer des SREs dans le groupe acide zolédronique en comparaison avec le groupe placebo. Les patients ayant reçu 4 mg d’acide zolédronique ont rapporté moins d’augmentation de la douleur que ceux ayant reçu le placebo avec des différences significatives à 3, 9, 21 et 24 mois. Il y a eu moins de patients traités par l’acide zolédronique 4 mg qui ont souffert de fractures pathologiques. Les effets du traitement étaient moins prononcés chez les patients présentant des lésions blastiques. Les résultats d’efficacité sont rapportés dans le Tableau 3.
Dans une seconde étude comprenant des tumeurs solides autres que le cancer du sein ou le cancer de la prostate, l’acide zolédronique 4 mg a réduit significativement la proportion de patients avec au moins une SRE, a retardé le délai médian de survenue de la première complication osseuse de plus de 2 mois, et a réduit le taux de morbidité osseuse. L’analyse des « événements multiples » a montré une réduction de 30,7 % du risque de développer des SREs dans le groupe acide zolédronique en comparaison avec le placebo. Les résultats d’efficacité sont rapportés dans le Tableau 4.
Tableau 3 : Résultats d’efficacité (Patients présentant un cancer de la prostate et recevant une hormonothérapie).
|
|
Toute complication osseuse (TIH incluse) |
Fractures* |
Radiothérapie osseuse |
|||
|
|
Acide zolédronique 4 mg |
Placebo |
Acide zolédronique 4 mg |
Placebo |
Acide zolédronique 4 mg |
Placebo |
|
N |
214 |
208 |
214 |
208 |
214 |
208 |
|
Proportion de patients avec complications osseuses (%) |
38 |
49 |
17 |
25 |
26 |
33 |
|
Valeur p |
0,028 |
0,052 |
0,119 |
|||
|
Médiane de survenue de la 1ère complication osseuse (jours) |
488 |
321 |
NA |
NA |
NA |
640 |
|
Valeur p |
0,009 |
0,020 |
0,055 |
|||
|
Taux de morbidité osseuse |
0,77 |
1,47 |
0,20 |
0,45 |
0,42 |
0,89 |
|
Valeur p |
0,005 |
0,023 |
0,060 |
|||
|
Réduction du risque de développer des complications osseuses (analyse des « événements multiples ») ** (%) |
36 |
|
NApp |
NApp |
NApp |
NApp |
|
Valeur p |
0,002 |
NApp |
Napp |
|||
* Incluant les fractures vertébrales et non-vertébrales
** Prend en compte toutes les complications osseuses, aussi bien le nombre total que la durée entre chaque complication au cours de l’étude
NA = Non Atteint
NApp = Non Applicable
Tableau 4 : Résultats d’efficacité (Patients présentant des tumeurs solides autres que cancer du sein ou cancer de la prostate)
|
|
Toute complication osseuse (TIH incluse) |
Fractures* |
Radiothérapie osseuse |
|||
|
|
Acide zolédronique 4 mg |
Placebo |
Acide zolédronique 4 mg |
Placebo |
Acide zolédronique 4 mg |
Placebo |
|
N |
257 |
250 |
257 |
250 |
257 |
250 |
|
Proportion de patients avec complications osseuses (%) |
39 |
48 |
16 |
22 |
29 |
34 |
|
Valeur p |
0,039 |
0,064 |
0,173 |
|||
|
Médiane de survenue de la 1ere complication osseuse (jours) |
236 |
155 |
NA |
NA |
424 |
307 |
|
Valeur p |
0,009
|
0,020 |
0,079 |
|||
|
Taux de morbidité osseuse |
1,74 |
2,71 |
0,39 |
0,63 |
1,24 |
1,89 |
|
Valeur p |
0,012 |
0,066 |
0,099 |
|||
|
Réduction du risque de développer des complications osseuses (analyse des « événements multiples ») ** (%) |
30,7 |
|
NApp |
NApp |
NApp |
NApp |
|
Valeur p |
0,003 |
NApp |
NApp |
|||
* Incluant les fractures vertébrales et non-vertébrales
** Prend en compte toutes les complications osseuses, aussi bien le nombre total que la durée entre chaque complication au cours de l’étude
NA = Non Atteint
NApp = Non Applicable
Dans une troisième étude de phase III, randomisée, en double aveugle, l’acide zolédronique 4 mg a été comparé à 90 mg de pamidronate administrés toutes les 3 à 4 semaines chez des patients ayant un myélome multiple ou un cancer du sein avec au moins une complication osseuse. Les résultats ont démontré que l’acide zolédronique 4 mg avait une efficacité comparable à 90 mg de pamidronate dans la prévention des complications osseuses. L’analyse des « événements multiples » a montré une réduction significative de 16 % du risque de développer des complications osseuses chez les patients traités par l’acide zolédronique 4 mg en comparaison avec ceux traités par le pamidronate. Les résultats d’efficacité sont rapportés dans le Tableau 5.
Tableau 5 : Résultats d’efficacité (patients présentant un cancer du sein ou un myélome multiple)
|
|
Toute complication osseuse (TIH incluse) |
Fractures* |
Radiothérapie osseuse |
|||
|
|
Acide zolédronique 4 mg |
Pam 90 mg |
Acide zolédronique 4 mg |
Pam 90 mg |
Acide zolédronique 4 mg |
Pam 90 mg |
|
N |
561 |
555 |
561 |
555 |
561 |
555 |
|
Proportion de patients avec complications osseuses (%) |
48 |
52 |
37 |
39 |
19 |
24 |
|
Valeur p |
0,198 |
0,653 |
0,037 |
|||
|
Médiane de survenue de la 1ere complication osseuse (jours) |
376 |
356 |
NA |
714 |
NA |
NA |
|
Valeur p |
0,151 |
0,672 |
0,026 |
|||
|
Taux de morbidité osseuse |
1,04 |
1,39 |
0,53 |
0,60 |
0,47 |
0,71 |
|
Valeur p |
0,084 |
0,614 |
0,015 |
|||
|
Réduction du risque de développer des complications osseuses (analyse des « événements multiples ») ** (%) |
16 |
‑ |
NApp |
NApp |
NApp |
NApp |
|
Valeur p |
0,030 |
NApp |
NApp |
|||
* Incluant les fractures vertébrales et non-vertébrales
** Prend en compte toutes les complications osseuses, aussi bien le nombre total que la durée entre chaque complication au cours de l’étude
NA = Non Atteint
NApp = Non Applicable
L’acide zolédronique 4 mg a aussi été étudié dans une étude randomisée, en double aveugle, contrôlée versus placebo, chez 228 patients avec métastases osseuses documentées provenant d’un cancer du sein, pour évaluer l’effet de l’acide zolédronique 4 mg sur l’incidence des complications osseuses (Skeletal Related Events : SREs), déterminée comme le rapport du nombre total de SREs (excluant l’hypercalcémie et ajusté en fonction des fractures antérieures), sur le temps d’exposition au risque. Les patients recevaient 4 mg d’acide zolédronique ou du placebo toutes les 4 semaines pendant une année. La répartition des patients entre le groupe traité par l’acide zolédronique et le groupe placebo était homogène.
L’incidence des SREs (complication/année-patient) était de 0,628 pour l’acide zolédronique et 1,096 pour le placebo. La proportion de patients avec au moins une SRE (excluant l’hypercalcémie) était de 29,8 % dans le groupe traité par l’acide zolédronique versus 49,6 % pour le groupe placebo (p = 0,003). Le temps médian d’apparition de la première SRE n’était pas encore atteint dans le groupe acide zolédronique à la fin de l’étude et était significativement prolongé par comparaison au placebo (p = 0,007). Dans une analyse d’événements multiples, l’acide zolédronique 4 mg a réduit le risque de SREs de 41 % par comparaison au placebo (risque relatif = 0,59, p = 0,019).
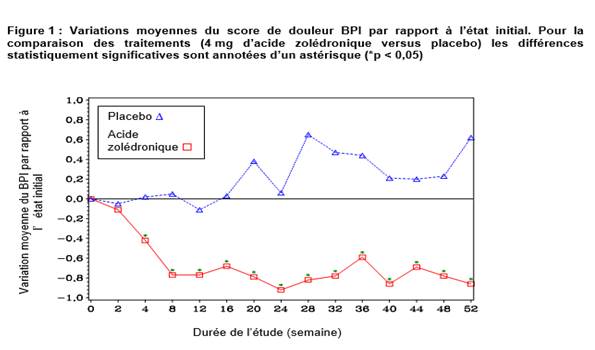
Dans le groupe acide zolédronique, une amélioration statistiquement significative du score de douleur (utilisation de la « Brief Pain Inventory » (BPI)) a été observée à 4 semaines et à tous les moments ultérieurs de l’étude, en comparaison au placebo (figure 1). Le score de douleur avec l’acide zolédronique était constamment inférieur à celui observé à l’état initial et il était accompagné d’une tendance à la réduction du score d’analgésie.
Etude CZOL446EUS122/SWOG
L’objectif principal de cette étude observationnelle était d’estimer l’incidence cumulative de l’ostéonécrose de la mâchoire (ONM) à 3 ans chez des patients cancéreux atteints de cancer avec métastases osseuses recevant de l’acide zolédronique. La thérapie d’inhibition des ostéoclastes, d’autres thérapies contre le cancer, et les soins dentaires ont été effectués conformément à la situation clinique afin de représenter au mieux les soins académiques et communautaires. Un bilan bucco-dentaire a été recommandé mais n’était pas obligatoire.
Parmi les 3491 patients évaluables, 87 cas de diagnostic d’ONM ont été confirmés. L’incidence cumulée globale estimée des ONM confirmées à 3 ans était de 2,8% (IC à 95% : 2,3-3,5%). Les taux étaient de 0,8% à l’année 1 et de 2,0% à l’année 2. Les taux d’ONM confirmées à 3 ans étaient plus élevés chez les patients atteints d’un myélome (4,3%) et plus faibles chez les patients atteints d’un cancer du sein (2,4%). Les cas d’ONM confirmées étaient significativement plus important sur le plan statistique chez les patients atteints de myélome multiple (p=0,03) que les autres cancers combinés.
Résultats des études cliniques dans le traitement des hypercalcémies induites par les tumeurs (TIH)
Les études cliniques dans l’hypercalcémie induite par des tumeurs (TIH) ont démontré que l’effet de l’acide zolédronique est caractérisé par une baisse de la calcémie et de l’excrétion urinaire de calcium. Dans les études phase I de recherche de doses, chez des patients présentant une hypercalcémie légère à modérée secondaire à des tumeurs (TIH), les doses efficaces testées ont été approximativement de 1,2 à 2,5 mg.
Pour évaluer les effets de 4 mg d’acide zolédronique par rapport à 90 mg de pamidronate, les résultats de deux études pivots multicentriques chez des patients ayant une TIH ont été combinés dans une analyse préalablement programmée. Il a été observé une normalisation de la calcémie corrigée plus rapide au 4ème jour avec 8 mg d’acide zolédronique et au 7ème jour avec 4 mg et 8 mg d’acide zolédronique. Les taux de réponse suivants ont été observés :
Tableau 6 : Pourcentage de patients ayant une réponse complète par jour dans les études TIH combinées :
|
|
4e jour |
7e jour |
10e jour |
|
Acide zolédronique 4 mg (n = 86) |
45,3 % (p = 0,104) |
82,6 % (p = 0,005)* |
88,4 % (p = 0,002)* |
|
Acide zolédronique 8 mg (n = 90) |
55,6 % (p = 0,021)* |
83,3 % (p = 0,010)* |
86,7 % (p = 0,015)* |
|
Pamidronate 90 mg (n = 99) |
33,3 % |
63,6 % |
69,7 % |
|
*Valeurs p comparées au pamidronate. |
|||
Le délai médian de normalisation de la calcémie a été de 4 jours. Le délai médian avant la rechute (ré-augmentation de la calcémie corrigée en fonction de l’albumine ≥ à 2,9 mmol/l) a été de 30 à 40 jours pour les patients traités par l’acide zolédronique versus 17 jours pour ceux traités par 90 mg de pamidronate (p = 0,001 pour 4 mg et p = 0,007 pour 8 mg). Il n’y a pas de différence statistiquement significative entre les deux doses d’acide zolédronique.
Dans les études cliniques, 69 patients qui ont rechuté ou qui étaient réfractaires au traitement initial (acide zolédronique 4 mg, 8 mg ou pamidronate 90 mg) ont été traités une seconde fois avec 8 mg d’acide zolédronique. Le taux de réponse chez ces patients était environ de 52 %. Puisque ces patients ont été traités de nouveau uniquement par 8 mg d’acide zolédronique, il n’y a pas de données disponibles qui permettent de comparer avec la dose de 4 mg.
Dans les études cliniques réalisées chez des patients avec hypercalcémie induite par des tumeurs, le profil global de tolérance dans les trois groupes de traitement (acide zolédronique 4 mg et 8 mg et pamidronate 90 mg) était similaire en nature et en sévérité.
Population pédiatrique
· Résultats des études cliniques dans le traitement de l’ostéogénèse imparfaite sévère chez les enfants âgés de 1 à 17 ans
Les effets de l’acide zolédronique administré par voie intraveineuse chez l’enfant (âgé de 1 à 17 ans) atteint d’ostéogénèse imparfaite sévère (types I, III, et IV) ont été comparés avec le pamidronate administré par voie intraveineuse dans une étude internationale, multicentrique, randomisée et en ouvert avec respectivement 74 et 76 patients dans chaque groupe de traitement. La durée du traitement était de 12 mois précédée d’une période de sélection de 4 à 9 semaines pendant laquelle une supplémentation en vitamine D et en calcium a été administrée pendant au moins 2 semaines. Dans le programme clinique, les patients âgés de 1 à 3 ans recevaient 0,025 mg/kg d’acide zolédronique (jusqu’à une dose unique maximale de 0,35 mg) tous les 3 mois et les patients âgés de 3 à 17 ans recevaient 0,05 mg/kg d’acide zolédronique (jusqu’à une dose unique maximale de 0,83 mg) tous les 3 mois. Une étude d’extension a été menée afin d’examiner la tolérance générale et rénale à long terme de l’acide zolédronique une ou deux fois par an sur une période d’extension de 12 mois de traitement chez les enfants ayant reçu un an de traitement soit par l’acide zolédronique soit par le pamidronate dans l’étude principale.
L’objectif principal de l’étude était le pourcentage de changement de la Densité Minérale Osseuse (DMO) au col fémoral après 12 mois de traitement. Les effets estimés des traitements sur la DMO étaient similaires mais le design de l’essai n’était pas suffisamment robuste pour établir la non infériorité d’efficacité de l’acide zolédronique. En particulier, il n’était pas clairement démontré l’efficacité sur des fractures ou sur la douleur. Des fractures des os longs des extrémités inférieurs ont été rapportés chez approximativement 24 % (fémur) et 14 % (tibia) des patients traités par l’acide zolédronique contre 12 % et 5 % des patients traités par le pamidronate atteints d’ostéogenèse imparfaite sévère, sans tenir compte du type de maladie et de la causalité mais l’incidence moyenne des fractures était comparable chez les patients traités par l’acide zolédronique et chez ceux traités par le pamidronate : 43 % (32/74) contre 41 % (31/76). L’interprétation du risque de fracture est compromise par le fait que les fractures sont des événements indésirables fréquents chez les patients atteints d’ostéogenèse imparfaite sévère, du fait de la maladie.
Le type d’événements indésirables observés dans cette population était généralement similaire avec ceux précédemment observés chez les adultes ayant un cancer des os avancé (voir rubrique 4.8). Les réactions indésirables présentées dans le Tableau 7, sont classées par ordre de fréquence décroissante en utilisant la convention suivante : très fréquent (≥1/10), fréquent (≥1/100, <1/10), peu fréquent (≥1/1 000, <1/100), rare (≥1/10 000, <1/1 000), très rare (<1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Tableau 7 : Réactions indésirables observées chez l’enfant atteint d’ostéogenèse imparfaite sévère.
|
Affections du système nerveux |
|
|
Fréquent |
Céphalée |
|
Affections cardiaques |
|
|
Fréquent |
Tachycardie |
|
Affections respiratoires, thoraciques et médiastinales |
|
|
Fréquent |
Rhino-pharyngite |
|
Affections gastro-intestinales |
|
|
Très fréquent |
Nausées, vomissements |
|
Fréquent |
Douleurs abdominales |
|
Affections musculo-squelettiques et systémiques |
|
|
Fréquent |
Douleurs des extrémités, arthralgies, douleurs musculo-squelettiques |
|
Troubles généraux et anomalies au site d’administration |
|
|
Très fréquent |
Fièvre, fatigue |
|
Fréquent |
Réaction de phase aiguë, douleurs |
|
Investigations |
|
|
Très fréquent |
Hypocalcémie |
|
Fréquent |
Hypophosphatémie |
Les réactions indésirables apparaissant avec des fréquences < 5 % ont été médicalement évaluées et il a été montré que ces cas sont en accord avec le profil de sécurité d’emploi bien établi de l’acide zolédronique (voir rubrique 4.8).
Chez l’enfant atteint d’ostéogenèse imparfaite sévère, l’acide zolédronique semble être associé à des risques plus prononcés de réaction de phase aiguë, d’hypocalcémie ou de tachycardie inexpliquée, en comparaison au pamidronate, mais cette différence diminue après plusieurs perfusions.
L’Agence européenne des médicaments a accordé une dérogation à l’obligation de soumettre les résultats d’études réalisées avec le produit de référence contenant l’acide zolédronique dans tous les sous-groupes de la population pédiatrique dans le traitement de l’hypercalcémie induite par des tumeurs et dans la prévention des complications osseuses chez des patients atteints de pathologie maligne à un stade avancé avec atteinte osseuse (voir rubrique 4.2 pour les informations concernant l’usage pédiatrique).
5.2. Propriétés pharmacocinétiques
Des perfusions uniques et multiples de 5 et 15 minutes de 2, 4, 8 et 16 mg d’acide zolédronique chez 64 patients ayant des métastases osseuses ont fourni les données pharmacocinétiques suivantes, qui sont dose-indépendantes.
Après le début de la perfusion d’acide zolédronique, les concentrations plasmatiques de l’acide zolédronique ont augmenté rapidement pour atteindre leurs pics à la fin de la perfusion et pour ensuite diminuer rapidement à moins de 10 % du pic après 4 heures et à moins de 1 % du pic après 24 heures, avec une période prolongée ultérieure de concentration très basse, ne dépassant pas 0,1 % du pic avant la seconde perfusion d’acide zolédronique au jour 28.
L’acide zolédronique, administré par voie intraveineuse a une élimination triphasique : une disparition rapide biphasique de la circulation sanguine, avec des demi-vies de t½α 0,24 et t½β 1,87 heure, suivie par une longue phase d’élimination avec une demi-vie d’élimination terminale de t½γ 146 heures. Il n’y a pas d’accumulation plasmatique d’acide zolédronique après administration de doses multiples tous les 28 jours. L’acide zolédronique n’est pas métabolisé et est excrété sous forme inchangée par voie rénale. Au-delà des 24 premières heures, 39 ± 16 % de la dose administrée sont retrouvés dans les urines, alors que la quantité restante est principalement liée au tissu osseux. A partir du tissu osseux, il est libéré très lentement dans la circulation systémique et éliminé par voie rénale. La clairance corporelle totale est de 5,04 ± 2,5 l/h, est indépendante de la dose et non affectée par le sexe, l’âge, la race et le poids corporel. L’augmentation de la durée de perfusion de 5 à 15 minutes a entraîné une réduction de 30 % de la concentration de l’acide zolédronique en fin de perfusion mais n’a pas modifié l’aire sous la courbe de la concentration plasmatique par rapport au temps.
Comme cela est observé avec les autres bisphosphonates, la variabilité entre les patients des paramètres pharmacocinétiques de l’acide zolédronique est élevée.
Aucune donnée pharmacocinétique concernant l’acide zolédronique n’est disponible chez les patients ayant une hypercalcémie ou chez les patients atteints d’une insuffisance hépatique. In vitro, l’acide zolédronique n’inhibe pas les isoenzymes humaines du cytochrome P450, il ne subit pas de biotransformation, et dans les études animales, moins de 3 % de la dose administrée sont retrouvés dans les fèces, suggérant l’absence de rôle significatif de la fonction hépatique dans la pharmacocinétique de l’acide zolédronique.
La clairance rénale de l’acide zolédronique était corrélée à la clairance de la créatinine, la clairance rénale représentant 75 ± 33 % de la clairance de la créatinine, qui atteint une moyenne de 84 ± 29 ml/min (extrêmes : 22 et 143 ml/min) chez 64 patients atteints d’un cancer. L’analyse de la population a montré que pour les patients ayant une clairance de la créatinine de 20 ml/min (insuffisance rénale sévère) ou de 50 ml/min (insuffisance rénale modérée), la clairance prédictive correspondante de l’acide zolédronique devrait être respectivement de 37 % ou de 72 %, de celle d’un patient ayant une clairance de la créatinine de 84 ml/min.
Des données pharmacocinétiques encore limitées sont disponibles uniquement chez des patients avec une insuffisance rénale sévère (clairance de la créatinine < 30 ml/min).
Dans une étude réalisée in vitro, l’acide zolédronique a montré une affinité faible pour les composants cellulaires du sang humain, avec un rapport moyen entre la concentration sanguine et la concentration plasmatique de 0,59 dans un intervalle de concentration compris entre 30 ng/ml et 5000 ng/ml. La liaison aux protéines plasmatiques est faible, avec une fraction libre allant de 60% à 2 ng/ml d’acide zolédronique à 77% à 2000 ng/ml d’acide zolédronique.
Populations particulières
Enfants
Les données limitées de pharmacocinétique chez l’enfant atteint d’ostéogénèse imparfaite sévère suggèrent que la pharmacocinétique de l’acide zolédronique chez l’enfant âgé de 3 à 17 ans est identique à celle de l’adulte à des taux similaires en mg/kg. L’âge, le poids, le sexe et la clairance de la créatinine semblent ne pas avoir d’effet sur l’exposition à l’acide zolédronique.
5.3. Données de sécurité préclinique
La dose non létale la plus élevée en administration intraveineuse unique était de 10 mg/kg de poids corporel chez la souris et de 0,6 mg/kg chez le rat.
Toxicité subchronique et chronique
L’acide zolédronique a été bien toléré lorsqu’il a été administré par voie sous-cutanée chez le rat et par voie intraveineuse chez le chien, à des doses inférieures ou égales à 0,02 mg/kg/j pendant 4 semaines. L’administration de 0,001 mg/kg/j par voie sous-cutanée chez le rat et de 0,005 mg/kg une fois tous les 2 à 3 jours par voie intraveineuse chez le chien sur une période de 52 semaines a été également bien tolérée.
Le résultat le plus fréquent dans les études à doses répétées est une augmentation de la spongiose primaire dans les métaphyses des os longs chez les animaux en cours de croissance à presque toutes les doses, un résultat qui reflète l’activité pharmacologique du produit sur la résorption osseuse.
Les marges de sécurité relatives aux effets rénaux étaient faibles dans les études animales d’administration répétée par voie parentérale et à long terme, mais les doses sans effets adverses observés (NOAEL) à dose unique (1,6 mg/kg) et à doses répétées sur un mois (0,06-0,6 mg/kg/j) n’ont pas montré d’effets rénaux à des doses équivalentes ou excédant la plus forte dose thérapeutique envisagée chez l’homme.
L’administration répétée à plus long terme de doses d’acide zolédronique voisines de la plus forte dose thérapeutique envisageable chez l’homme, a produit des effets toxiques sur d’autres organes incluant le tractus gastro-intestinal, le foie, la rate, les poumons, et au niveau du site d’injection IV.
Toxicité sur la reproduction
L’acide zolédronique est tératogène chez le rat par voie sous-cutanée à des doses ≥ 0,2 mg/kg. Bien qu’aucun effet tératogène ou fœtotoxique n’ait été observé chez le lapin, une toxicité maternelle a été mise en évidence. Une dystocie a été observée chez le rat à la plus faible dose testée (0,01 mg/kg de poids corporel).
Mutagenèse et potentiel cancérogène
L’acide zolédronique ne s’est pas révélé mutagène au cours des tests de mutagenèse, et les études de cancérogenèse n’ont pas mis en évidence de potentiel carcinogène.
Mannitol (E421), citrate de sodium (E331), eau pour préparations injectables.
Avant ouverture : 3 ans.
Après ouverture ou après préparation de doses réduites d’acide zolédronique (comme décrit en section 4.2) :
La stabilité physico-chimique a été démontrée pendant 24 heures à une température comprise entre 2°C et 8°C et à 25°C.
Toutefois, d’un point de vue microbiologique, la solution pour perfusion doit être utilisée immédiatement. Dans le cas où elle ne serait pas utilisée immédiatement, la durée et les conditions de stockage avant utilisation sont sous la responsabilité de l’utilisateur et ne doivent pas dépasser 24 h entre 2°C et 8°C.
La solution réfrigérée doit revenir à température ambiante avant l’administration.
6.4. Précautions particulières de conservation
Ce médicament ne nécessite pas de précautions particulières de conservation.
Pour les conditions de conservation du médicament après ouverture, voir rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
100 ml de solution en flacon de verre type I avec ou sans film interne de dioxyde de silicone fermé par un bouchon en caoutchouc bromobutyle et une capsule flip-off en aluminium/polypropylène.
ACIDE ZOLEDRONIQUE VIATRIS 4 mg/100 ml, solution pour perfusion est présenté dans des boîtes contenant 1, 4 ou 5 flacons.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Des informations supplémentaires sur la manipulation de l’acide zolédronique, incluant la préparation des réductions de doses en utilisant les solutions prêtes à l’emploi d’acide zolédronique, sont fournies en rubrique 4.2.
La préparation doit se faire dans des conditions aseptiques. Réservé à un usage unique.
Seule une solution sans particule et sans coloration doit être utilisée.
Il est rappelé aux professionnels de santé que tout produit non utilisé ne doit pas être jeté au tout-à-l’égout.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
1 RUE DE TURIN
69007 LYON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 278 000 2 3 : 100 ml en flacon (verre); boîte de 1.
· 34009 586 357 9 3 : 100 ml en flacon (verre); boîte de 4.
· 34009 586 358 5 4 : 100 ml en flacon (verre); boîte de 5.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
A compléter ultérieurement par le titulaire.
10. DATE DE MISE A JOUR DU TEXTE
A compléter ultérieurement par le titulaire.
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
Médicament nécessitant une surveillance particulière pendant le traitement.
ANSM - Mis à jour le : 18/02/2025
ACIDE ZOLEDRONIQUE VIATRIS 4 mg/100 ml, solution pour perfusion
Acide zolédronique
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que ACIDE ZOLEDRONIQUE VIATRIS 4 mg/100 ml, solution pour perfusion et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de recevoir ACIDE ZOLEDRONIQUE VIATRIS 4 mg/100 ml, solution pour perfusion ?
3. Comment utiliser ACIDE ZOLEDRONIQUE VIATRIS 4 mg/100 ml, solution pour perfusion ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver ACIDE ZOLEDRONIQUE VIATRIS 4 mg/100 ml, solution pour perfusion ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE ACIDE ZOLEDRONIQUE VIATRIS 4 mg/100 ml, solution pour perfusion ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC : M05BA08
La substance active contenue dans ACIDE ZOLEDRONIQUE VIATRIS est l’acide zolédronique qui appartient à un groupe de substances appelées bisphosphonates. L’acide zolédronique agit en s’attachant à l’os et en ralentissant le taux de renouvellement osseux.
Il est utilisé :
Pour prévenir les complications osseuses, ex. fractures, chez les patients adultes ayant des métastases osseuses (diffusion du cancer du site principal à l’os).
Pour diminuer le taux de calcium dans le sang des patients adultes lorsque celui-ci est élevé en raison de la présence d’une tumeur. Les tumeurs peuvent accélérer le renouvellement osseux habituel de sorte que la quantité de calcium libéré par l’os est augmentée. Cette pathologie est appelée hypercalcémie induite par les tumeurs.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE RECEVOIR ACIDE ZOLEDRONIQUE VIATRIS 4 mg/100 ml, solution pour perfusion ?
Suivez attentivement toutes les instructions qui vous sont données par votre médecin.
Votre médecin pourra réaliser des tests sanguins avant le début du traitement par ACIDE ZOLEDRONIQUE VIATRIS et pourra contrôler votre réponse au traitement à intervalles réguliers.
Vous ne devez pas recevoir ACIDE ZOLEDRONIQUE VIATRIS 4 mg/100 ml, solution pour perfusion :
· si vous êtes en cours d’allaitement.
· si vous êtes allergique à l’acide zolédronique, à un autre bisphosphonate (le groupe de substances auquel appartient ACIDE ZOLEDRONIQUE VIATRIS) ou à l’un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6).
Avertissements et précautions
Adressez-vous à votre médecin avant de recevoir ACIDE ZOLEDRONIQUE VIATRIS :
· si vous avez ou avez eu un problème aux reins.
· si vous avez ou avez eu une douleur, un gonflement, un engourdissement ou une sensation de lourdeur dans la mâchoire ou une dent déchaussée. Votre médecin peut vous recommander un examen dentaire avant de commencer le traitement par l’acide zolédronique.
· si vous avez des soins dentaires en cours ou si vous allez subir une chirurgie dentaire, informez votre dentiste que vous allez être traité(e) par l’acide zolédronique et informez votre médecin de vos soins dentaires.
Pendant votre traitement par ACIDE ZOLEDRONIQUE VIATRIS, vous devez maintenir une bonne hygiène bucco-dentaire (y compris un brossage régulier des dents) et suivre des examens dentaires réguliers.
Contactez immédiatement votre médecin et votre dentiste si vous rencontrez des problèmes au niveau de votre bouche ou de vos dents comme un déchaussement des dents, des douleurs ou un gonflement, ou une non-cicatrisation des plaies ou un écoulement, car ceux-ci pourraient être les signes d’un trouble appelé ostéonécrose de la mâchoire.
Les patients sous chimiothérapie et/ou radiothérapie, qui prennent des corticoïdes, qui suivent une chirurgie dentaire, qui ne reçoivent pas de soins dentaires réguliers, qui ont une maladie des gencives, qui sont fumeurs ou qui ont déjà été traités avec un bisphosphonate (utilisé pour traiter ou prévenir des troubles osseux) peuvent présenter un risque plus élevé de développer une ostéonécrose de la mâchoire.
Contactez votre médecin si vous ressentez une douleur, une faiblesse ou un inconfort dans la cuisse, au niveau de la hanche ou de l’aine car ce peut être une indication précoce d’une possible fracture du fémur (voir la rubrique 4 « Quels sont les effets indésirables éventuels ? »).
Une diminution du taux de calcium dans le sang (hypocalcémie), causant parfois des crampes musculaires, une sécheresse de la peau, des sensations de brûlure ont été rapportés chez des patients traités par l’acide zolédronique. Une irrégularité des battements cardiaques (arythmie cardiaque), des convulsions, des spasmes et des contractions (tétanie) ont été rapportés secondairement à une hypocalcémie sévère. Dans certains cas, l’hypocalcémie peut engager le pronostic vital. Si vous présentez un de ces signes, prévenez votre médecin immédiatement. Si vous avez une hypocalcémie, elle doit être corrigée avant de débuter le traitement par l’acide zolédronique. Des suppléments appropriés en calcium et en vitamine D vous seront prescrits.
Patients âgés de 65 ans et plus
ACIDE ZOLEDRONIQUE VIATRIS peut être administré chez les patients âgés de 65 ans et plus. Il n’existe aucun élément indiquant que des précautions supplémentaires soient nécessaires.
Enfants et adolescents
L’utilisation de l’ACIDE ZOLEDRONIQUE VIATRIS n’est pas recommandée chez les adolescents et les enfants de moins de 18 ans.
Autres médicaments et ACIDE ZOLEDRONIQUE VIATRIS 4 mg/100 ml, solution pour perfusion
Informez votre médecin si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament. Il est particulièrement important que votre médecin sache si vous prenez également :
· Des aminosides (une famille de médicaments utilisés pour traiter les infections sévères), la calcitonine (un type de médicament utilisé pour traiter l’ostéoporose post-ménopausique et l’hypercalcémie), les diurétiques de l’anse (un type de médicament utilisé pour traiter l’hypertension artérielle ou les oedèmes (gonflements)) ou d’autres médicaments faisant baisser le calcium, puisque la combinaison de ceux-ci avec les bisphosphonates peut entraîner une diminution trop importante du taux de calcium dans le sang.
· De la thalidomide (un médicament utilisé pour traiter un certain cancer du sang avec atteintes osseuses) ou tout autre médicament pouvant endommager vos reins.
· Tout autre médicament qui contient aussi de l’acide zolédronique et est utilisé pour le traitement de l’ostéoporose et d’autres maladies osseuses non cancéreuses, ou tout autre bisphosphonate, étant donné que les effets de ces associations sont inconnus.
· Médicaments anti-angiogéniques (utilisés pour traiter des cancers), car une augmentation du risque d’ostéonécrose de la mâchoire (ONM) a été associée à l’administration concomitante de ces médicaments avec l’acide zolédronique.
ACIDE ZOLEDRONIQUE VIATRIS 4 mg/100 ml, solution pour perfusion avec des aliments et des boissons
Sans objet.
Vous ne devriez pas recevoir ACIDE ZOLEDRONIQUE VIATRIS si vous êtes enceinte. Informez votre médecin si vous êtes ou pensez être enceinte.
Vous ne devez pas recevoir ACIDE ZOLEDRONIQUE VIATRIS si vous allaitez.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
Il a été observé de très rares cas de somnolence et d’endormissement avec l’acide zolédronique. La prudence est recommandée en cas de conduite de véhicules, d’utilisation de machines ou en cas d’exécution d’autres tâches qui nécessiteraient toute votre attention.
ACIDE ZOLEDRONIQUE VIATRIS 4 mg/100 ml, solution pour perfusion contient du sodium
Ce médicament contient moins d’1 mmol de sodium (23 mg) par dose (100 ml), c’est-à-dire qu’il est essentiellement « sans sodium ».
3. COMMENT UTILISER ACIDE ZOLEDRONIQUE VIATRIS 4 mg/100 ml, solution pour perfusion ?
Votre médecin vous recommandera de boire suffisamment d’eau avant chaque administration afin de prévenir une déshydratation.
Suivez attentivement toutes les autres instructions données par votre médecin, pharmacien ou infirmier/ère.
Quelle quantité d’ACIDE ZOLEDRONIQUE VIATRIS est administrée ?
La dose recommandée est de 4 mg.
Si vous avez un problème rénal, votre médecin vous administrera une dose plus faible adaptée en fonction de la sévérité de votre problème rénal.
Combien de fois ACIDE ZOLEDRONIQUE VIATRIS est-il administré ?
Si vous êtes traité(e) pour la prévention des complications osseuses liées à des métastases osseuses, ACIDE ZOLEDRONIQUE VIATRIS vous sera administré en perfusion toutes les 3 à 4 semaines.
Si vous êtes traité(e) afin de réduire le taux de calcium dans votre sang, vous ne recevrez normalement qu’une seule perfusion d’ACIDE ZOLEDRONIQUE VIATRIS.
Comment ACIDE ZOLEDRONIQUE VIATRIS est-il administré ?
ACIDE ZOLEDRONIQUE VIATRIS est administré en perfusion intraveineuse lente qui doit durer au moins 15 minutes et doit être administrée par voie de perfusion séparée en solution intraveineuse unique.
Les patients pour lesquels les taux de calcium ne sont pas trop élevés recevront quotidiennement un apport supplémentaire de calcium et de vitamine D.
Si vous avez reçu plus d’ACIDE ZOLEDRONIQUE VIATRIS 4 mg/100 ml, solution pour perfusion que vous n’auriez dû
Si vous avez reçu des doses supérieures à celles recommandées, vous devez être surveillé(e) attentivement par votre médecin. En effet, vous pouvez développer des anomalies des électrolytes sériques (ex : taux anormaux de calcium, phosphore et magnésium) et/ou des modifications du fonctionnement des reins, y compris une insuffisance rénale grave. Si votre taux de calcium baisse trop, vous devez recevoir des perfusions de suppléments de calcium.
Si vous oubliez d’utiliser ACIDE ZOLEDRONIQUE VIATRIS 4 mg/100 ml, solution pour perfusion
Si vous arrêtez d’utiliser ACIDE ZOLEDRONIQUE VIATRIS 4 mg/100 ml, solution pour perfusion
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les plus fréquents sont généralement modérés et disparaîtront probablement après une courte période.
Prévenez votre médecin immédiatement en cas de survenue d’un des effets indésirables graves suivants :
Fréquent (peut affecter jusqu’à 1 personne sur 10) :
· Insuffisance rénale sévère (qui sera généralement déterminée par votre médecin à l’aide d’examens sanguins).
· Faible taux de calcium dans le sang.
Peu fréquent (peut affecter jusqu’à 1 personne sur 100) :
· Douleur au niveau de la bouche, des dents et/ou de la mâchoire, gonflement ou plaies non cicatrisées au niveau de la bouche, ou de la mâchoire, écoulement, engourdissement ou sensation de lourdeur de la mâchoire, ou si une dent devient mobile. Ces symptômes pourraient être les signes de dégâts osseux de la mâchoire (ostéonécrose). Prévenez votre médecin et votre dentiste immédiatement si vous présentez de tels symptômes au cours du traitement par l’acide zolédronique ou après l’arrêt du traitement.
· Des irrégularités du rythme cardiaque (fibrillation auriculaire) ont été observées chez des patientes recevant de l’acide zolédronique pour le traitement de l’ostéoporose post-ménopausique. Il n’est pas clairement établi à ce jour que l’acide zolédronique soit à l’origine de ces irrégularités du rythme cardiaque mais si ces symptômes apparaissent après que vous ayez reçu de l’acide zolédronique vous devez en faire part à votre médecin.
· Réaction allergique sévère : essoufflement, gonflement principalement du visage et de la gorge.
Rare (peut affecter jusqu’à 1 personne sur 1 000) :
· Comme conséquence des valeurs basses de calcium : battements du cœur irréguliers (arythmie cardiaque ; secondaire à l’hypocalcémie).
· Un trouble de la fonction rénale appelé syndrome de Fanconi (qui sera généralement diagnostiqué par votre médecin à l’aide d’examens urinaires).
Très rare (peut affecter jusqu’à 1 personne sur 10 000) :
· Comme conséquence des valeurs basses de calcium : convulsions, engourdissements et tétanie (secondaires à l’hypocalcémie).
· Consultez votre médecin si vous présentez des douleurs de l’oreille, des écoulements de l’oreille et/ou une infection de l’oreille. Il pourrait s'agir de signes de lésion osseuse de l'oreille.
· L’ostéonécrose d’autres os que la mâchoire a été très rarement observée et affectait principalement la hanche ou la cuisse (fémur). Informez immédiatement votre médecin si vous ressentez des symptômes tels que l'apparition ou l'aggravation de douleurs ou de raideurs lors d'un traitement par ACIDE ZOLEDRONIQUE VIATRIS ou après l’arrêt du traitement.
Fréquence indéterminée : la fréquence ne peut être calculée à partir des données disponibles
· Inflammation des reins (néphrite tubulo-interstitielle) : les signes et symptômes peuvent inclure une diminution du volume des urines, la présence de sang dans les urines, des nausées, une sensation de malaise général.
Prévenez votre médecin aussi vite que possible en cas de survenue d’un des effets indésirables suivants :
Très fréquent (peut affecter plus d’1 personne sur 10) :
· Taux faible de phosphates dans le sang.
Fréquent (peut affecter jusqu’à 1 personne sur 10) :
· Maux de tête et un syndrome grippal se manifestant par fièvre, fatigue, faiblesse, somnolence, frissons et douleurs osseuses, articulaires et/ou musculaires. Dans la plupart des cas, aucun traitement spécifique n’est requis et les symptômes disparaissent rapidement (en quelques heures ou jours).
· Réactions gastro-intestinales, telles que nausées et vomissements ainsi qu’une perte d’appétit.
· Des cas de conjonctivite.
· Faible taux de globules rouges (anémie).
Peu fréquent (peut affecter jusqu’à 1 personne sur 100) :
· Réactions d’hypersensibilité.
· Pression artérielle basse.
· Douleur dans la poitrine.
· Réactions cutanées (rougeurs ou gonflements) au site d’injection, rash, démangeaisons.
· Hypertension artérielle, essoufflements, sensations vertigineuses, anxiété, troubles du sommeil, troubles du goût, tremblements, fourmillements ou engourdissements des mains ou des pieds, diarrhées, constipation, douleurs abdominales, bouche sèche.
· Diminution du nombre de globules blancs et des plaquettes sanguines.
· Faible taux de magnésium ou de potassium dans le sang. Votre médecin les contrôlera et prendra les mesures nécessaires.
· Prise de poids.
· Augmentation de la transpiration.
· Somnolence.
· Vision trouble, tiraillement de l’œil, sensibilité à la lumière.
· Sensation de froid soudaine avec évanouissement, faiblesse et collapsus.
· Difficultés à respirer avec râle et toux.
· Urticaire.
Rare (peut affecter jusqu’à 1 personne sur 1 000) :
· Rythme cardiaque lent.
· Confusion.
· Une fracture inhabituelle de l’os de la cuisse peut survenir rarement, particulièrement chez les patients traités au long cours pour ostéoporose. Contactez votre médecin si vous ressentez une douleur, une faiblesse ou un inconfort au niveau de la cuisse, de la hanche ou de l’aine car cela peut être un signe précoce d’une possible fracture de l’os de la cuisse.
· Pneumopathie interstitielle (inflammation du tissu entourant les alvéoles des poumons).
· Symptômes ressemblant à la grippe avec arthrite et gonflement articulaire.
· Rougeur douloureuse et/ou gonflement de l’œil.
Très rare (peut affecter jusqu’à 1 personne sur 10 000) :
· Evanouissement dû à une pression artérielle basse.
· Douleurs osseuses, articulaires et /ou musculaires sévères, parfois invalidantes.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER ACIDE ZOLEDRONIQUE VIATRIS 4 mg/100 ml, solution pour perfusion ?
Après première ouverture du flacon ou après préparation de doses réduites d’acide zolédronique (comme décrit ci-dessus) : la stabilité physico-chimique de la solution a été démontrée pendant 24 heures entre 2°C et 8°C et à 25°C.
Toutefois, du point de vue microbiologique, le produit doit être utilisé immédiatement. En cas d'utilisation non immédiate, les durées et conditions de conservation avant utilisation relèvent de la seule responsabilité de l'utilisateur et ne devraient pas dépasser 24 heures à une température comprise entre 2 et 8°C.
Ne jetez aucun médicament au tout-à-l’égout ni avec les ordures ménagères. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient ACIDE ZOLEDRONIQUE VIATRIS 4 mg/100 ml, solution pour perfusion
· La substance active est : l’acide zolédronique.
Un flacon contient 4 mg d’acide zolédronique, correspondant à 4,26 mg d’acide zolédronique monohydraté.
· Les autres composants sont :
Mannitol, citrate de sodium (voir la rubrique 2 « ACIDE ZOLEDRONIQUE VIATRIS 4 mg/100 ml, solution pour perfusion contient du sodium »), eau pour préparations injectables.
Ce médicament se présente sous forme d'une solution claire et incolore, sans particule visible en flacon. Un flacon contient 4 mg d’acide zolédronique.
ACIDE ZOLEDRONIQUE VIATRIS 4 mg/100 ml, solution pour perfusion est présenté dans des boîtes contenant 1, 4 ou 5 flacons.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
1 RUE DE TURIN
69007 LYON
Exploitant de l’autorisation de mise sur le marché
VIATRIS SANTÉ
1 RUE DE TURIN
69007 LYON
10, DANISZEWSKA STR.
03-230 WARSAW
POLOGNE
ou
PHARMADOX HEALTHCARE LTD.
KW20A KORDIN INDUSTRIAL PARK
PAOLA, PLA 3000
MALTE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
À compléter ultérieurement par le titulaire.
La dernière date à laquelle cette notice a été révisée est :
A compléter ultérieurement par le titulaire.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé :
Comment préparer et administrer ACIDE ZOLEDRONIQUE VIATRIS
· ACIDE ZOLEDRONIQUE VIATRIS 4 mg/100 ml, solution pour perfusion, contient 4 mg d’acide zolédronique dans 100 ml d’une solution pour perfusion prête à l’emploi pour les patients ayant une fonction rénale normale.
· Réservé à un usage unique. Toute solution non utilisée doit être éliminée. Seule une solution limpide, sans particule et sans coloration doit être utilisée. La préparation de la perfusion doit s’effectuer dans des conditions aseptiques.
· Après première ouverture du flacon ou après préparation de doses réduites d’acide zolédronique (comme décrit ci-dessous) : la stabilité physico-chimique de la solution a été démontrée pendant 24 heures entre 2°C et 8°C et à 25°C. Toutefois, d’un point de vue microbiologique, le produit doit être utilisé immédiatement. En cas d'utilisation non immédiate, les durées et conditions de conservation avant utilisation relèvent de la seule responsabilité de l'utilisateur et ne devraient pas dépasser 24 heures à une température comprise entre 2 et 8°C. La solution réfrigérée doit ensuite revenir à température ambiante avant l’administration.
· La solution contenant l’acide zolédronique ne doit pas être diluée ou mélangée avec d’autres solutions pour perfusion. Elle est administrée en une seule perfusion de 15 minutes via une ligne de perfusion séparée. L’état d’hydratation des patients doit être évalué avant et après l’administration de l’ACIDE ZOLEDRONIQUE VIATRIS pour s’assurer qu’ils soient convenablement hydratés.
· ACIDE ZOLEDRONIQUE VIATRIS 4 mg/100 ml, solution pour perfusion peut être utilisées immédiatement sans préparation supplémentaire chez les patients ayant une fonction rénale normale. Chez les patients présentant une insuffisance rénale légère à modérée, des doses réduites doivent être préparées selon les indications suivantes :
Pour la préparation des doses réduites pour les patients ayant une Clcr initiale ≤ 60 ml/min, se référer au Tableau 1 ci-dessous. Retirer du flacon le volume de solution d’acide zolédronique indiqué et le remplacer par un volume équivalent de solution injectable de chlorure de sodium stérile à 9 mg/ml (0,9 %) ou une solution injectable de glucose à 5 %.
Tableau 1 : Préparation des doses réduites d’ACIDE ZOLEDRONIQUE VIATRIS 4 mg/100 ml, solution pour perfusion
|
Clairance de la créatine initiale (ml/min) |
Retirer du flacon le volume suivant d’acide zolédronique solution pour perfusion (ml) |
Le remplacer avec un volume équivalent de chlorure de sodium stérile à 9 mg/ml (0,9 %) ou une solution injectable de glucose à 5% (ml) |
Dose adaptée (mg d’acide zolédronique dans 100 ml) |
|
50-60 |
12,0 |
12,0 |
3,5 |
|
40-49 |
18,0 |
18,0 |
3,3 |
|
30-39 |
25,0 |
25,0 |
3,0 |
Les doses ont été calculées en vue d’atteindre une valeur de l’ASC de 0,66 (mgh/l) (pour une CLcr = 75 ml/min). L’objectif étant que chez les patients avec atteinte rénale, les doses réduites d’acide zolédronique permettent d’obtenir la même ASC que celle observée chez des patients avec une clairance à la créatinine de 75 ml/min.
· Des études avec plusieurs types de tubulures à perfusion en chlorure de polyvinyle, polyéthylène et polypropylène n’ont montré aucune incompatibilité avec l’acide zolédronique.
· Puisque aucune donnée n’est disponible sur la compatibilité de l’acide zolédronique avec d’autres substances administrées par voie intraveineuse, l’acide zolédronique ne doit pas être mélangé avec d’autres médicaments ou substances et doit toujours être donné à travers une ligne de perfusion séparée.
Comment conserver ACIDE ZOLEDRONIQUE VIATRIS ?
· Tenir hors de la vue et de la portée des enfants.
· Ne pas utiliser ACIDE ZOLEDRONIQUE VIATRIS après la date de péremption mentionnée sur la boîte. La date de péremption fait référence au dernier jour de ce mois.
· Ce médicament ne nécessite pas de précautions particulières de conservation.
· Après première ouverture du flacon ou après préparation de doses réduites d’acide zolédronique (comme décrit ci-dessus) : la stabilité physico-chimique de la solution a été démontrée pendant 24 heures à 25°C et entre 2°C et 8°C. Toutefois, d’un point de vue microbiologique, le produit doit être utilisé immédiatement.