 Participez à la création d’un site d'informations accessibles sur les médicaments pensé pour le grand public !
Participez à la création d’un site d'informations accessibles sur les médicaments pensé pour le grand public !Inscrivez-vous ici pour le tester en avant-première, partager vos impressions, et nous aider à l’améliorer !
 Participez à la création d’un site d'informations accessibles sur les médicaments pensé pour le grand public !
Participez à la création d’un site d'informations accessibles sur les médicaments pensé pour le grand public !OFLOCET 1,5 mg/0,5 ml, solution auriculaire en récipient unidose - Résumé des caractéristiques du produit |
 |
|
ANSM - Mis à jour le : 06/05/2024
OFLOCET 1,5 mg/0,5 ml, solution auriculaire en récipient unidose
2. COMPOSITION QUALITATIVE ET QUANTITATIVE 
Ofloxacine............................................................................................................................ 1,5 mg
Pour un récipient unidose.
Pour la liste complète des excipients, voir rubrique 6.1.
4.1. Indications thérapeutiques 
Traitement local des otorrhées purulentes :
· sur aérateur transtympanique,
· sur cavité d'évidement,
· sur otites chroniques non ostéitiques à tympan ouvert.
Remarque : aucune étude n'a été menée dans l'otite externe.
Il convient de tenir compte des recommandations officielles concernant l'utilisation appropriée des antibactériens.
4.2. Posologie et mode d'administration 
Instiller chaque matin la totalité du contenu du récipient unidose (soit environ 10 gouttes) dans le conduit auditif de l'oreille atteinte, et renouveler l'opération le soir.
La durée du traitement est habituellement de 7 jours.
Si au bout de 10 jours les symptômes persistent, il faut revoir le patient pour réévaluer la pathologie et le traitement.
Mode d’administration
· Pour instillation auriculaire uniquement.
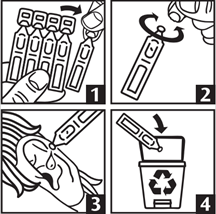
· Détacher un récipient unidose de la plaquette (schéma n°1).
· Tiédir le récipient unidose au moment de l'emploi en le maintenant quelques minutes dans la paume de la main.
· Ouvrir ce récipient unidose en effectuant une rotation au niveau du bouchon (schéma n°2).
· Renverser le récipient unidose afin de faire descendre son contenu vers l'extrémité.
· Instiller, tête penchée, la totalité du contenu du récipient unidose dans le conduit auditif de l'oreille atteinte, en tirant à plusieurs reprises sur le pavillon de l'oreille (schéma n°3).
· Maintenir la tête penchée sur le côté pendant environ 5 minutes, afin de faciliter la pénétration des gouttes dans le conduit auditif externe.
· Répéter, si nécessaire, dans l’autre oreille, en utilisant un autre récipient unidose.
· Jeter immédiatement le récipient unidose après usage (schéma n°4).
4.4. Mises en garde spéciales et précautions d'emploi 
L'administration d'antibiotiques locaux participe à la survenue de sensibilisation à ces substances actives, avec possiblement la survenue de réactions générales.
Interrompre le traitement dès les premiers signes d'apparition d'un rash cutané ou de tout autre signe d'hypersensibilité locale ou générale.
Tendinites et ruptures des tendons
Des tendinites et ruptures de tendons peuvent survenir avec un traitement systémique par fluoroquinolone comme l'ofloxacine, en particulier chez le sujet âgé et chez ceux traités simultanément par des corticostéroïdes. Par conséquent, OFLOCET 1,5 mg/0,5 ml, solution auriculaire en récipient unidose doit être arrêté dès les premiers signes d'inflammation du tendon.
Précautions d’utilisation
NE PAS INJECTER, NE PAS AVALER, NE PAS METTRE DANS L’ŒIL, NE PAS INHALER.
NE PAS METTRE AILLEURS QUE DANS L’OREILLE.
Au moment de l'emploi, éviter la mise en contact de l'embout avec l'oreille ou les doigts, afin de limiter les risques de contamination.
Cette solution est présentée en récipient à usage unique.
Le récipient unidose doit être jeté immédiatement après usage et ne doit pas être conservé en vue d'une réutilisation : en effet, ce produit ne contenant pas de conservateur, il existe un risque de rapide contamination bactérienne.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions 
Les données disponibles à ce jour ne laissent pas supposer l'existence d'interactions cliniquement significatives.
4.6. Fertilité, grossesse et allaitement 
Grossesse
L’exposition systémique à l’ofloxacine apparait négligeable après administration d’OFLOCET, solution auriculaire. Cependant, étant donné le risque d’atteintes articulaires décrit chez des enfants traités par des quinolones par voie systémique, par mesure de précaution, il est préférable d’éviter d’utiliser OFLOCET, solution auriculaire pendant la grossesse.
Allaitement
Aucun effet sur les nouveau-nés / nourrissons allaités n’est attendu, étant donné que l’exposition systémique à OFLOCET, solution auriculaire chez les femmes qui allaitent est négligeable. Cependant, par mesure de précaution, ce médicament doit être évité chez les femmes qui allaitent.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines 
Les fréquences sont déterminées de la façon suivante : très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100) ; rare (≥ 1/10 000, < 1/1 000) ; très rare (< 1/10 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Affections de l’oreille et du labyrinthe
Rare : otalgies.
Affections du système immunitaire
Rare : réactions d’hypersensibilité
Affections musculosquelettiques et du tissu conjonctif 1
Fréquence indéterminée : troubles tendineux
1 Des ruptures de tendons au niveau des épaules, des mains et des tendons d'Achille, nécessitant une intervention chirurgicale ou entraînant une invalidité prolongée, ont été rapportées chez des patients traités par fluoroquinolones administrées par voie générale. Les études et l'expérience depuis la mise sur le marché des fluoroquinolones administrées par voie générale indiquent que le risque de ces ruptures pourrait être augmenté chez les patients traités par corticoïdes (en particulier les personnes âgées) et dans le cas où les tendons sont soumis à une tension élevée (y compris le tendon d'Achille). À ce jour, les données cliniques et depuis la mise sur le marché n'ont pas montré de lien entre l'administration auriculaire d'ofloxacine et ces effets indésirables portant sur les tissus musculo-squelettiques et conjonctifs.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
5. PROPRIETES PHARMACOLOGIQUES 
5.1. Propriétés pharmacodynamiques 
Classe pharmacothérapeutique : Médicaments otologiques, Anti-infectieux, Code ATC : S02AA.
L'ofloxacine est un antibiotique de synthèse appartenant à la famille des quinolones, du groupe des fluoroquinolones. Son activité est fortement bactéricide par inhibition de l'ADN-gyrase bactérienne empêchant la synthèse de l'ADN chromosomique bactérien.
Spectre d’activité antibactérienne
Les concentrations critiques séparent les souches sensibles des souches de sensibilité intermédiaire, et ces dernières, des résistantes : S £ 1 mg/l et R > 4 mg/l.
La prévalence de la résistance acquise peut varier en fonction de la géographie et du temps pour certaines espèces. Il est donc utile de disposer d’informations sur la prévalence de la résistance locale, surtout pour le traitement d’infections sévères. Ces données ne peuvent apporter qu’une orientation sur les probabilités de la sensibilité d’une souche bactérienne à cet antibiotique.
Lorsque la variabilité de la prévalence de la résistance en France est connue pour une espèce bactérienne, elle est indiquée dans le tableau ci-dessous :
|
Catégories |
Fréquence de résistance acquise en France (> 10%) (valeurs extrêmes) |
|
ESPÈCES SENSIBLES |
|
|
Aérobies à Gram positif |
|
|
Bacillus anthracis*** |
|
|
Staphylococcus méti-S * |
|
|
Aérobies à Gram négatif |
|
|
Acinetobacter (essentiellement Acinetobacter baumannii) |
50 - 75 % |
|
Branhamella catarrhalis |
|
|
Bordetella pertussis |
|
|
Campylobacter |
|
|
Citrobacter freundii |
15 - 25 % |
|
Enterobacter cloacae |
15 - 25 % |
|
Escherichia coli |
0 - 10 % |
|
Haemophilus influenzae |
|
|
Klebsiella oxytoca |
0 - 11 % |
|
Klebsiella pneumoniae |
0 - 25 % |
|
Legionella |
|
|
Morganella morganii |
|
|
Neisseria |
|
|
Pasteurella |
|
|
Proteus mirabilis |
0 - 10 % |
|
Proteus vulgaris |
|
|
Providencia |
45 - 70 % |
|
Pseudomonas aeruginosa * |
45 - 85 % |
|
Salmonella |
|
|
Serratia |
40 - 45 % |
|
Shigella |
|
|
Vibrio |
|
|
Yersinia |
|
|
Anaérobies |
|
|
Mobiluncus |
|
|
Propionibacterium acnes |
|
|
Autres |
|
|
Mycoplasma hominis |
|
|
ESPÈCES MODÉRÉMENT SENSIBLES |
|
|
(in vitro de sensibilité intermédiaire) |
|
|
Aérobies à Gram positif |
|
|
Corynébactéries |
|
|
Streptococcus |
|
|
Streptococcus pneumoniae |
|
|
Autres |
|
|
Chlamydiae |
|
|
Mycoplasma pneumoniae |
|
|
Ureaplasma urealyticum |
|
|
ESPÈCES RÉSISTANTES |
|
|
Aérobies à Gram positif |
|
|
Entérocoques |
|
|
Listeria monocytogenes |
|
|
Nocardia asteroïdes |
|
|
Staphylococcus méti-R** |
|
|
Anaérobies |
|
|
à l’exception de Mobiluncus et Propionibacterium acnes |
* Efficacité clinique démontrée pour les souches sensibles dans les indications cliniques approuvées.
** La fréquence de résistance à la méticilline est environ de 30 à 50 % de l’ensemble des staphylocoques et se rencontre surtout en milieu hospitalier.
*** Bacillus anthracis : aucune étude animale d’infection expérimentale dans la maladie du charbon n’a été réalisée.
Mycobactéries atypiques :
L’ofloxacine a in vitro une activité modérée sur certaines espèces de mycobactéries : Mycobacterium tuberculosis, Mycobacterium fortuitum, moindre sur Mycobacterium kansasii et encore moindre sur Mycobacterium avium.
Remarque : ce spectre correspond à celui des formes systémiques de l'ofloxacine. Avec les présentations pharmaceutiques locales, les concentrations obtenues in situ sont très supérieures aux concentrations plasmatiques. Quelques incertitudes demeurent sur la cinétique des concentrations in situ, sur les conditions physico-chimiques locales qui peuvent modifier l'activité de l'antibiotique et sur la stabilité du produit in situ.
5.2. Propriétés pharmacocinétiques 
Chez l'enfant, les concentrations sériques d'ofloxacine après instillation unique, sont inférieures ou égales à 0,013 µg/ml.
Le passage systémique de cette présentation d'ofloxacine est négligeable, on constate une bonne diffusion à des concentrations élevées au siège de l'infection.
5.3. Données de sécurité préclinique 
Chlorure de sodium, acide chlorhydrique et hydroxyde de sodium, eau purifiée.
3 ans.
6.4. Précautions particulières de conservation 
A conserver à l'abri de la lumière.
Stabilité après ouverture : après usage, le récipient unidose doit être jeté.
Ne pas utiliser un récipient unidose déjà entamé.
6.5. Nature et contenu de l'emballage extérieur 
0,5 ml en récipient unidose (PE) ; boîte de 20.
6.6. Précautions particulières d’élimination et de manipulation 
Pas d’exigences particulières.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE 
82 AVENUE RASPAIL
94250 GENTILLY
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE 
· 34009 339 863 5 3 : 20 récipients unidose polyéthylène de 0,5 ml.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION 
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE 
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES 
Liste I
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |