Dernière mise à jour le 08/01/2026
CROMOPTIC 2 % SANS CONSERVATEUR, collyre en solution
Indications thérapeutiques
Classe pharmacothérapeutique : Anti-allergique local - code ATC : S01GX01.
CROMOPTIC 2 % sans conservateur, collyre en solution contient une substance active, le cromoglicate de sodium, ayant une action antiallergique.
Ce collyre est indiqué en cas de conjonctivite allergique saisonnière ou non saisonnière (reconnaissable par des yeux et/ou des paupières gonflées, yeux rouges, qui piquent ou qui larmoient).
Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien après 7 jours de traitement.
Présentations
> 1 flacon(s) polyéthylène haute densité (PEHD) de 10 ml avec pompe(s) équipé(s) d'un manchon
Code CIP : 346 922-3 ou 34009 346 922 3 9
Déclaration de commercialisation : 02/01/2013
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 5,32 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 6,34 €
- Taux de remboursement :30%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Modéré | Avis du 17/04/2019 | Renouvellement d'inscription (CT) | Le service médical rendu par CROMOFREE 2 %, collyre en solution reste modéré dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 05/09/2012 | Inscription (CT) | Absence d'amélioration du service médical rendu (ASMR V) par rapport aux autres collyres de cromoglicate de sodium. |
ANSM - Mis à jour le : 06/05/2025
CROMOPTIC 2 % SANS CONSERVATEUR, collyre en solution
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Cromoglicate de sodium............................................................................................................ 2 g
Pour 100 mL de solution.
Pour la liste complète des excipients, voir rubrique 6.1.
4.1. Indications thérapeutiques
Traitement symptomatique des affections ophtalmiques d'origine allergique.
4.2. Posologie et mode d'administration
Posologie
Adulte et enfant : selon la sévérité des symptômes, instiller 1 goutte de collyre 2 à 6 fois par jour, à intervalles réguliers, dans le cul-de-sac conjonctival de l'œil malade, en regardant vers le haut, et en tirant légèrement la paupière vers le bas.
Population pédiatrique
Chez l'enfant, un avis médical est nécessaire.
Mode d’administration
Se laver soigneusement les mains avant de procéder à l'instillation.
Eviter le contact de l'embout avec l'œil ou les paupières.
Le passage systémique peut être réduit par une occlusion nasolacrymale ou par la fermeture des paupières pendant 2 minutes. Cette méthode peut contribuer à diminuer les effets indésirables systémiques et à augmenter l’efficacité locale.
Refermez le flacon immédiatement après utilisation.
En cas de traitement concomitant par un autre collyre, attendre 15 minutes entre chaque instillation.
En l'absence d'amélioration au bout de 7 jours de traitement, il est nécessaire de prendre un avis médical.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
· NE PAS INJECTER, NE PAS AVALER.
Le collyre ne doit pas être administré en injection péri ou intra-oculaire.
· Ne pas dépasser la posologie recommandée.
· Ce collyre ne contient pas de conservateur.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
4.6. Fertilité, grossesse et allaitement
Grossesse
Les études effectuées chez l'animal n'ont pas mis en évidence d'effet tératogène.
En l'absence d'effet tératogène chez l'animal, un effet malformatif dans l'espèce humaine n'est pas attendu. En effet, à ce jour, les substances responsables de malformations dans l'espèce humaine se sont révélées tératogènes chez l'animal au cours d'études bien conduites sur deux espèces.
En clinique, il n'existe pas actuellement de données suffisamment pertinentes pour évaluer un éventuel effet malformatif ou fœtotoxique du cromoglicate de sodium lorsqu'il est administré pendant la grossesse.
En conséquence, par mesure de précaution, il est préférable de ne pas utiliser le cromoglicate de sodium pendant la grossesse.
Il n'y a pas de données sur le passage du cromoglicate de sodium dans le lait maternel. Toutefois, compte tenu de l'absence de toxicité, l'allaitement est possible en cas de traitement par ce médicament.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Possibilité de survenue :
· de réactions d'hypersensibilité au cromoglicate de sodium ou à l'un des constituants du collyre,
· de gêne visuelle passagère après instillation du collyre.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Aucun cas de surdosage n'a été rapporté. Cependant des applications répétées de façon prolongée peuvent entrainer un passage systémique non négligeable des principes actifs, en outre d’une exacerbation des effets indésirables locaux.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Anti-allergique local, code ATC : S01GX01.
Le cromoglicate de sodium possède des propriétés anti-allergiques reconnues au niveau des muqueuses ; il prévient, par stabilisation de la membrane mastocytaire, la libération des médiateurs chimiques responsable des réactions anaphylactiques.
5.2. Propriétés pharmacocinétiques
5.3. Données de sécurité préclinique
Eau pour préparations injectables.
Après 1ère ouverture du flacon : à conserver maximum 3 mois.
6.4. Précautions particulières de conservation
Pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
10 mL de solution en flacon (PEHD) avec pompe munie d'un filtre, équipé d’un manchon avec support ergonomique destiné à l’appui du pouce.
10 mL de solution en flacon (PEHD) avec pompe équipée d’un manchon distributeur avec levier et actionnement latéral combiné avec un capuchon protecteur.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
416 RUE SAMUEL MORSE – CS99535
34961 MONTPELLIER
[Tel, fax, e-Mail : à compléter ultérieurement par le titulaire]
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· CIP 34009 346 922 3 9 : 10 mL de solution en flacon (PE)
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
Date de première autorisation:{JJ mois AAAA}
Date de dernier renouvellement:{JJ mois AAAA}
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
{JJ mois AAAA}
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 06/05/2025
CROMOPTIC 2 % SANS CONSERVATEUR, collyre en solution
Cromoglicate de sodium
Vous devez toujours utiliser ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin ou votre pharmacien.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre pharmacien pour tout conseil ou information.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien après 7 jours.
1. Qu'est-ce que CROMOPTIC 2 % sans conservateur, collyre en solution et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser CROMOPTIC 2 % sans conservateur, collyre en solution ?
3. Comment utiliser CROMOPTIC 2 % sans conservateur, collyre en solution ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver CROMOPTIC 2 % sans conservateur, collyre en solution ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE CROMOPTIC 2 % SANS CONSERVATEUR, COLLYRE EN SOLUTION ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Anti-allergique local - code ATC : S01GX01.
CROMOPTIC 2 % sans conservateur, collyre en solution contient une substance active, le cromoglicate de sodium, ayant une action antiallergique.
Ce collyre est indiqué en cas de conjonctivite allergique saisonnière ou non saisonnière (reconnaissable par des yeux et/ou des paupières gonflées, yeux rouges, qui piquent ou qui larmoient).
Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien après 7 jours de traitement.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER CROMOPTIC 2 % SANS CONSERVATEUR, COLLYRE EN SOLUTION ?
N’utilisez jamais CROMOPTIC 2 % SANS CONSERVATEUR, collyre en solution :
· si vous êtes allergique au cromoglicate de sodium ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser CROMOPTIC 2 % sans conservateur, collyre en solution.
NE JAMAIS LAISSER A LA PORTEE DES ENFANTS.
Ne dépassez pas la posologie recommandée.
En l'absence d'amélioration comme en cas de persistance des symptômes au-delà de 7 jours de traitement, prenez un avis médical.
En cas de traitement concomitant par un autre collyre, attendez 15 minutes entre chaque instillation.
Lavez-vous soigneusement les mains avant de procéder à l'instillation.
Refermez soigneusement le flacon après utilisation.
Enfants
Chez l'enfant, un avis médical est nécessaire.
Autres médicaments et CROMOPTIC 2 % SANS CONSERVATEUR, collyre en solution
L'efficacité d'un collyre peut être affectée par l'instillation simultanée d'un autre collyre. Vous devez espacer les utilisations de ces collyres de 15 minutes.
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
CROMOPTIC 2 % SANS CONSERVATEUR, collyre en solution avec des aliments et boissons
Sans objet.
Par mesure de précaution, il est préférable de ne pas utiliser CROMOPTIC 2 % sans conservateur, collyre en solution pendant la grossesse.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
Soyez prudent. Une gêne visuelle passagère peut être ressentie après l'administration du collyre. Dans ce cas, vous devez attendre la fin des symptômes pour conduire un véhicule ou utiliser une machine.
CROMOPTIC 2 % SANS CONSERVATEUR, collyre en solution contient {nommer le/les excipient (s)}
Sans objet.
3. COMMENT UTILISER CROMOPTIC 2 % SANS CONSERVATEUR, COLLYRE EN SOLUTION ?
Posologie
Adultes et enfants : selon la sévérité des symptômes, instillez 1 goutte dans chaque œil malade 2 à 6 fois par jour, à intervalles réguliers.
Utilisation chez les enfants
Chez l'enfant, un avis médical préalable est nécessaire.
Espacez les instillations.
En cas de traitement concomitant par un autre collyre, attendez 15 minutes entre chaque instillation.
Ne dépassez jamais la dose recommandée.
Mode d'administration
Voie ophtalmique.
NE PAS INJECTER, NE PAS AVALER.
Le collyre ne doit pas être administré en injection péri ou intra-oculaire.
Lavez-vous soigneusement les mains avant de procéder à l'instillation.
Evitez le contact de l'embout du flacon avec l'œil ou les paupières.
CROMOPTIC 2 % sans conservateur, collyre en solution dispose d'un mécanisme de pompe breveté et il s'utilise de façon sûre et simple.
Lors de l'utilisation de ce collyre, vous devez respecter les étapes suivantes :
|
Flacon avec manchon distributeur à actionnement latéral : |
|
||
|
|
1. Lavez-vous les mains avant d’utiliser CROMOPTIC 2 % sans conservateur, collyre en solution et tenez le flacon comme indiqué. |
|
|
|
|
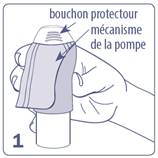
2. Enlevez le bouchon protecteur de l’embout du flacon avant chaque utilisation. Évitez tout contact entre l’embout du flacon et vos doigts ou toute autre surface afin d’éviter tout risque de contamination de la solution. |
|
|
|
|
3. Retournez le flacon et penchez légèrement la tête en arrière. Tirez doucement votre paupière inférieure vers le bas avec un doigt de votre main libre, tenez le flacon en position verticale au-dessus de l’œil et appuyez en même temps sur le mécanisme de pompe pour appliquer une goutte dans votre œil. Évitez de toucher la surface de l’œil avec l’embout du flacon afin d’éviter tout risque de blessure. Fermez l’œil et tournez-le doucement afin de diffuser la solution uniformément à la surface de votre œil. Puis, appuyez avec un doigt sur le coin de votre œil situé du côté du nez pendant 2 minutes. Cela permettra de réduire le passage des substances actives dans le reste de votre organisme. |
|
|
|
|
4. Immédiatement après utilisation, secouez le flacon pour faire tomber les éventuelles gouttes résiduelles et replacez le bouchon protecteur sur l’embout sec du flacon. On peut entièrement vider le flacon du volume de remplissage déclaré. En raison de la conception du flacon, il reste un peu de solution dans le flacon. |
|
|
|
Flacon avec manchon ergonomique avec appui du pouce : |
|||
|
|
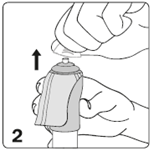
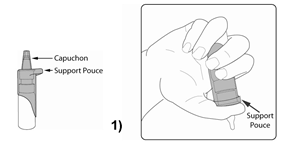
Avant la première utilisation, environ 15 mouvements de pression sont nécessaires afin d'activer le mécanisme de pompage et obtenir la quantité de solution nécessaire (Fig. 1). Tenez le flacon tête en bas comme sur le schéma. Cette manipulation ne sera ensuite plus nécessaire. |
||
|
|
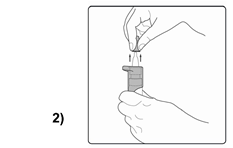
Avant chaque utilisation, lavez-vous les mains, enlevez le capuchon de protection de l'embout de flacon (Fig. 2) Evitez tout éventuel contact de l'embout du flacon avec les doigts. |
||
|
|
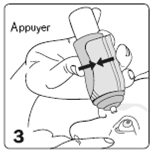
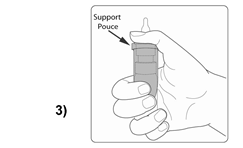
La figure 3 décrit comment tenir le produit de façon à l'instiller de façon sûre et confortable. Placez le pouce sur le support ergonomique prévu spécialement à cet effet et 2 doigts à la base du flacon. |
||
|
|
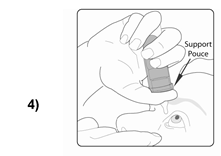
Pour l'utilisation, penchez la tête légèrement vers l'arrière et tenez le flacon compte-gouttes au-dessus de votre œil, comme le montre la figure 4. Avec l'index de la main libre, tirez la paupière inférieure légèrement vers le bas. L'espace qui se forme alors est appelé le cul de sac conjonctival. Veillez dans la mesure du possible à tenir le flacon compte-gouttes à la verticale. Evitez le contact de l'embout du flacon avec les doigts ou l'œil. |
||
|
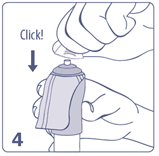
Afin de déposer une goutte de CROMOPTIC 2 % sans conservateur, collyre en solution dans le cul de sac conjonctival, appuyez brièvement, mais fermement sur le flacon. Grâce au dosage automatique, une goutte est libérée exactement à chaque pompage. Fermez maintenant votre œil et faites-le bouger lentement dans tous les sens afin de répartir la solution ophtalmique sur la surface de l’œil de façon optimale. Puis, appuyez avec un doigt sur le coin de votre œil situé du côté du nez pendant 2 minutes. Cela permettra de réduire le passage des substances actives dans le reste de votre organisme. Refermez l’embout du flacon avec le bouchon immédiatement après utilisation. |
|||
Si vous avez l’impression que l’effet de CROMOPTIC 2 % sans conservateur, collyre en solution est trop fort ou trop faible, consultez votre médecin ou votre pharmacien.
Fréquence d'administration
La dose recommandée est de 1 goutte dans chaque œil, 2 à 6 fois par jour, à intervalles réguliers.
Durée du traitement
Ne prolongez pas le traitement au-delà de 7 jours sans avis médical : en l'absence d'amélioration comme en cas de persistance des symptômes, prenez un avis médical.
Si vous avez utilisé plus de CROMOPTIC 2 % SANS CONSERVATEUR, collyre en solution que vous n’auriez dû
Des applications répétées de façon prolongée peuvent entraîner un passage systémique non négligeable des principes actifs, en outre d’une exacerbation des effets indésirables locaux.
Si vous pensez avoir utilisé plus de CROMOPTIC 2 % sans conservateur, collyre en solution qu’il ne le fallait et que vous sentez des effets indésirables non mentionnés dans cette notice, veuillez contacter votre médecin.
Si vous oubliez d’utiliser CROMOPTIC 2 % SANS CONSERVATEUR, collyre en solution
Ne prenez pas de dose double pour compenser la dose que vous avez oubliée de prendre mais poursuivez simplement votre traitement.
Si vous arrêtez d’utiliser CROMOPTIC 2 % SANS CONSERVATEUR, collyre en solution
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les effets suivants peuvent survenir :
· des réactions allergiques aux composants du collyre,
· une gêne visuelle passagère après l'application du collyre.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER CROMOPTIC 2 % SANS CONSERVATEUR, COLLYRE EN SOLUTION ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur le conditionnement extérieur après EXP. La date de péremption fait référence au dernier jour de ce mois.
Après 1ère ouverture du flacon : à conserver maximum 3 mois.
Une fois ce délai dépassé, vous ne devez plus utiliser ce collyre.
Notez la date d'ouverture en clair sur l’emballage.
Pas de précautions particulières de conservation.
N’utilisez pas ce médicament si vous remarquez des signes visibles de détérioration.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient CROMOPTIC 2 % sans conservateur, collyre en solution
· La substance active est :
Cromoglicate de sodium....................................................................................................... 2 g
Pour 100 mL de solution.
· L’autre composant est :
Eau pour préparations injectables.
Ce médicament se présente sous la forme d'un collyre en solution ; boîte de 1 flacon de 10 mL avec pompe équipée d’un manchon
Titulaire de l’autorisation de mise sur le marché
416 RUE SAMUEL MORSE – CS99535
34961 MONTPELLIER
Exploitant de l’autorisation de mise sur le marché
LABORATOIRE CHAUVIN
416 RUE SAMUEL MORSE – CS99535
34961 MONTPELLIER
ZONE INDUSTRIELLE DE RIPOTIER
50 AVENUE JEAN MONNET
07200 AUBENAS
ou
DR GERHARD MANN CHEM. PHARM. FABRIK GMBH
BRUNSBÜTTELER DAMM, 165/173
13581 BERLIN
ALLEMAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
{mois AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Conseil d’éducation sanitaire :
a) Qu'appelle-t-on allergie, qu'est-ce qu'une réaction allergique ?
L'allergie est une réaction excessive de notre organisme vis-à-vis de substances qu'il considère comme nocives, les allergènes. Les allergènes sont les facteurs et substances déclenchant l'allergie et les troubles qui y sont associés.
Au cours de contacts répétés de l'organisme avec l'allergène, une réaction allergique se déclenche.
La réaction allergique désigne l'ensemble des symptômes apparaissant quelques minutes ou quelques heures après l'exposition aux allergènes. Ces allergènes sont issus de plantes, de poils d'animaux, d'aliments, d'acariens, de moisissures ou sont des substances d'origine professionnelle.
Cette réaction allergique provoque la libération dans l'organisme de substances telles que l'histamine responsable des troubles ressentis.
Comme toute maladie de nature allergique, il est important de consulter un médecin au moins une fois. IL DETERMINERA NOTAMMENT LA NECESSITE D'EFFECTUER UN BILAN ALLERGOLOGIQUE.
b) Comment reconnaître une conjonctivite allergique ?
Une rougeur de l'œil et de l'intérieur des paupières accompagnée de démangeaisons, gonflement et larmoiement de l'œil sont les signes d'une conjonctivite allergique.
Cette affection accompagne souvent la rhinite allergique (éternuements, écoulement nasal, nez bouché) car elles sont déclenchées par les mêmes allergènes (pollens, acariens, poils d'animaux...).
c) Quelques conseils pratiques
· Ne vous frottez pas les yeux, même s'ils vous démangent car après un soulagement passager, ce frottement ne peut qu'aggraver la situation.
· Rincez doucement vos yeux à l'eau claire ou avec une solution stérile de lavage pour éliminer le pollen et ainsi vous soulager.
· Supprimez provisoirement le maquillage. La guérison de la conjonctivite ou la réapparition lors d'une nouvelle application peut permettre éventuellement d'identifier la substance responsable. La présence d'une allergie oculaire doit conduire à être vigilant dans le choix de ses cosmétiques.
· Si vous portez des lentilles de contact, mieux vaut les retirer pendant toute la durée du traitement par un collyre.
d) En cas de douleur oculaire aiguë, sensation de baisse de la vision ou de flou visuel, consulter votre médecin.
e) Prévention des récidives
· Faire disparaître l'allergène (l'éviction) est la mesure de choix pour supprimer ou réduire les symptômes de l'allergie.
· Pour les allergènes de maison, il est indispensable de prendre des mesures pour réduire la présence d'allergènes
· Le matelas devra être totalement entouré d'une housse plastique anti-acariens ainsi que les oreillers. Le sommier, sauf s'il est en lattes ou en métal, devra être entouré d'un plastique. Toute literie devra être lavée deux fois par mois à 60°C si possible.
· La chambre doit être aérée et nettoyée régulièrement.
· Sur le sol, on évitera les descentes de lit et les moquettes.
· Evitez les animaux domestiques.
· Pendant la saison pollinique, il est possible de diminuer l'exposition aux pollens.
· Dans votre jardin, diversifiez les plantations en évitant les espèces les plus allergisantes (cyprès, thuyas, bouleaux ).
· Evitez de tondre vous-même le gazon pendant la saison pollinique.
· Jardinez de préférence avec des lunettes et un masque de protection.