Dernière mise à jour le 01/12/2025
GONADOTROPHINE CHORIONIQUE IBSA 5000 UI, poudre et solvant pour solution injectable

: Ce médicament fait l'objet d'une surveillance renforcée. Pour plus d'informations, cliquez ici
Indications thérapeutiques
Qu’est-ce que GONADOTROPHINE CHORIONIQUE IBSA 5000 UI, poudre et solvant pour solution injectable ?
GONADOTROPHINE CHORIONIQUE IBSA contient de la gonadotrophine chorionique humaine hautement purifiée, une hormone obtenue à partir de l'urine humaine, appartenant à la famille des « gonadotrophines », qui sont des hormones naturelles impliquées dans la reproduction et la fertilité.
Dans quels cas GONADOTROPHINE CHORIONIQUE IBSA 5000 UI, poudre et solvant pour solution injectable est utilisé ?
GONADOTROPHINE CHORIONIQUE IBSA est utilisé :
· Pour aider au développement et à la maturation de plusieurs follicules (chacun contenant un œuf) chez les femmes ayant recours aux techniques d’assistance médicale à la procréation (une procédure qui peut vous aider à être enceinte) comme la « fécondation in vitro ».
· Pour favoriser la libération d’un œuf par les ovaires (induction de l'ovulation) chez les femmes qui ne produisent pas d’œufs (« anovulation ») ou qui produisent trop peu d’œufs (« oligo-ovulation »).
Ce médicament doit être utilisé sous la surveillance de votre médecin, sauf avis contraire de votre médecin.
Présentations
> 1 flacon en verre - 1 seringue préremplie en verre de 1 mL + 1 aiguille longue pour la reconstitution et l'injection intramusculaire + 1 aiguille courte pour l'injection sous-cutanée
Code CIP : 34009 302 293 9 2
Déclaration de commercialisation : 04/12/2023
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 21,68 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 22,70 €
- Taux de remboursement :100 %
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 06/07/2022 | Inscription (CT) | Le service médical rendu par GONADOTROPHINE CHORIONIQUE IBSA (gonadotrophine chorionique) est important dans l’indication de l’AMM. Pour les programmes d’assistance médicale à la procréation (AMP) tels que la fécondation in vitro (FIV) : déclenchement de la maturation folliculaire finale et lutéinisation après stimulation de la croissance folliculaire |
| Important | Avis du 06/07/2022 | Inscription (CT) | Le service médical rendu par GONADOTROPHINE CHORIONIQUE IBSA (gonadotrophine chorionique) est important dans l’indication de l’AMM. Femmes anovulatoires ou oligo-ovulatoires, pour déclencher l’ovulation et la lutéinisation après stimulation de la croissance folliculaire |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 06/07/2022 | Inscription (CT) | GONADOTROPHINE CHORIONIQUE IBSA (gonadotrophine chorionique) n’apporte pas d’amélioration du service médical rendu (ASMR V) versus la choriogonadotropine alfa recombi-nante (OVITRELLE) chez les femmes anovulatoires ou oligo-ovulatoires, pour déclencher l’ovulation et la lutéinisation après stimulation de la croissance folliculaire et pour les programmes d’assistance médicale à la procréation (AMP) tels que la fécondation in vitro (FIV) : déclenchement de la maturation folliculaire finale et lutéinisation après stimulation de la crois-sance folliculaire. |
Autres informations
- Titulaire de l'autorisation : IBSA PHARMA SAS
- Conditions de prescription et de délivrance :
- liste I
- médicament nécessitant une surveillance particulière pendant le traitement
- prescription réservée aux spécialistes et services ENDOCRINOLOGIE
- prescription réservée aux spécialistes et services GYNECOLOGIE
- prescription réservée aux spécialistes et services MALADIES METABOLIQUES
- prescription réservée aux spécialistes et services OBSTETRIQUE
- Statut de l'autorisation : Valide
- Type de procédure : Procédure décentralisée
- Code CIS : 6 837 708 2
ANSM - Mis à jour le : 04/02/2025
![]() Ce médicament fait l’objet d’une surveillance supplémentaire qui permettra l’identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable suspecté. Voir rubrique 4.8 pour les modalités de déclaration des effets indésirables.
Ce médicament fait l’objet d’une surveillance supplémentaire qui permettra l’identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable suspecté. Voir rubrique 4.8 pour les modalités de déclaration des effets indésirables.
GONADOTROPHINE CHORIONIQUE IBSA 5000 UI, poudre et solvant pour solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque flacon contient :
5000 UI de gonadotrophine chorionique humaine hautement purifiée, produite à partir d’urine humaine.
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre et solvant pour solution injectable.
Poudre en flacon : poudre lyophilisée blanche à blanchâtre.
Solvant en seringue préremplie (0,9% de chlorure de sodium) : solution claire et incolore.
4.1. Indications thérapeutiques
Pour les programmes d’assistance médicale à la procréation tels que la fécondation in vitro (FIV) : déclenchement de la maturation folliculaire finale et de la lutéinisation après stimulation de la croissance folliculaire.
4.2. Posologie et mode d'administration
Le traitement doit être effectué sous la surveillance d’un médecin ayant l’expérience du traitement des problèmes de fertilité.
· Femmes anovulatoires ou oligo-ovulatoires : un flacon (5000 UI) ou deux flacons (10000 UI) de GONADOTROPHINE CHORIONIQUE IBSAsont administrés 24 à 48 heures après obtention d’une croissance folliculaire adéquate. Il est recommandé à la patiente d’avoir un rapport sexuel le jour même et le jour suivant l’injection de GONADOTROPHINE CHORIONIQUE IBSA.
· Assistance médicale à la procréation (FIV) : un flacon (5000 UI) ou deux flacons (10000 UI) de GONADOTROPHINE CHORIONIQUE IBSA sont administrés 24 à 48 heures après la dernière injection d’hormone FSH ou hMG, c’est à dire lorsqu’une croissance folliculaire adéquate est obtenue.
Population pédiatrique
Il n’existe pas d’utilisation justifiée de GONADOTROPHINE CHORIONIQUE IBSA dans la population pédiatrique.
Mode d’administration
Après reconstitution de la poudre avec le solvant, la solution finale doit immédiatement être administrée par voie intramusculaire ou sous-cutanée. Toute solution non utilisée doit être jetée.
· Endocrinopathies non gonadiques non contrôlées (par exemple : troubles de la thyroïde, des surrénales ou de l’hypophyse).
· Carcinomes ovariens, utérins ou mammaires.
· Saignements gynécologiques d’étiologie indéterminée (non menstruels).
· GONADOTROPHINE CHORIONIQUE IBSA est contre-indiqué lorsqu’une réponse efficace ne pourra pas être obtenue telle qu’une insuffisance ovarienne primaire.
· Malformations des organes génitaux incompatibles avec une grossesse.
· Fibrome utérin incompatible avec une grossesse.
4.4. Mises en garde spéciales et précautions d'emploi
Interférence avec les analyses sérologiques ou d’urine
Jusqu’à 10 jours après l’administration, GONADOTROPHINE CHORIONIQUE IBSA peut interférer avec le dosage immunologique de l’hCG sérique ou urinaire, conduisant potentiellement à des résultats faux-positifs au test de grossesse.
Réactions d’hypersensibilité
Des réactions d’hypersensibilité, générales et locales, des réactions anaphylactiques, et des angioœdèmes ont été signalés. Si une réaction d’hypersensibilité est suspectée, arrêter la prise de GONADOTROPHINE CHORIONIQUE IBSA et évaluer les autres causes potentielles de la réaction (voir rubrique 4.3).
Grossesse extra-utérine
Les femmes infertiles recourant à l’assistance médicale à la procréation (AMP) présentent une incidence accrue de grossesse extra-utérine. Il est donc important de confirmer par une échographie précoce que la grossesse est intra-utérine. Avant de traiter des patientes pour un défaut de stimulation endogène des gonades, un examen doit être réalisé pour exclure des anomalies anatomiques des organes génitaux ou des endocrinopathies non gonadiques (ex. troubles thyroïdiens ou surrénaliens, diabète). L'insuffisance ovarienne primaire doit être exclue par la détermination des taux de gonadotrophine.
Grossesse et naissances multiples et fausse-couche
Lors de grossesses survenant après induction de l’ovulation avec des préparations de gonadotrophines, il existe un risque accru d’avortement et de grossesses multiples. Les grossesses multiples, surtout d’ordre élevé, comportent un risque accru pour la mère et les enfants lors de l’accouchement. Les parents doivent être informés des risques potentiels de grossesses multiples avant de commencer le traitement.
Malformations congénitales
L’incidence des malformations congénitales suite à l’assistance médicale à la procréation (AMP) peut être légèrement plus élevée que suite à une conception naturelle. Cela serait dû à des facteurs contribuant à l'infertilité (ex. âge de la mère, caractéristiques du sperme) et à l’incidence accrue des grossesses multiples.
Complications vasculaires
Des accidents thromboemboliques, à la fois en association et séparément du syndrome d'hyperstimulation ovarienne (SHO), ont été rapportés à la suite de traitements par gonadotrophines, y compris GONADOTROPHINE CHORIONIQUE IBSA. Les thromboses intravasculaires, qui peuvent provenir des réseaux veineux ou artériels, peuvent entraîner une diminution du flux sanguin vers les organes vitaux ou les extrémités. Les femmes présentant des facteurs de risque de thrombose généralement reconnus, tels que des antécédents personnels ou familiaux, une obésité sévère ou une thrombophilie, peuvent présenter un risque accru d'accidents thromboemboliques veineux ou artériels, pendant ou après un traitement par gonadotrophines. Chez ces femmes, les bénéfices d’un traitement par FIV doivent être évalués au regard des risques. Il est à noter cependant que la grossesse elle-même est associée à un risque accru d’accidents thromboemboliques.
Tumeurs bénignes ou malignes
Des tumeurs ovariennes et autres tumeurs de l'appareil reproducteur, bénignes et malignes, ont été rapportées chez des femmes ayant subi plusieurs traitements médicamenteux pour le traitement de l'infertilité. L'effet des gonadotrophines sur le développement de tumeurs bénignes et malignes chez les femmes infertiles n'a pas encore été établi.
Examens médicaux
Jusqu’à 10 jours après l’administration de GONADOTROPHINE CHORIONIQUE IBSA, un test de grossesse peut donner un résultat faux-positif.
Syndrome d’hyperstimulation ovarienne (SHO)
Le SHO est un cas médical différent de l'hypertrophie ovarienne non compliquée. Les signes cliniques et les symptômes du SHO léger et modéré sont des douleurs abdominales, nausées, diarrhée, une hypertrophie légère à modérée des ovaires et des kystes ovariens. Le SHO sévère peut mettre la vie en danger. Les signes cliniques et les symptômes d'un SHO sévère sont des kystes ovariens volumineux, des douleurs abdominales aiguës, une ascite, un épanchement pleural, un hydrothorax, une dyspnée, une oligurie, des anomalies hématologiques et une prise de poids. Dans de rares cas, une thromboembolie veineuse ou artérielle peut survenir en association avec un SHO. Des anomalies transitoires des tests de la fonction hépatique suggérant un dysfonctionnement hépatique avec ou sans modifications morphologiques sur biopsie hépatique ont également été rapportées en association avec le SHO.
Le SHO peut être causé par l'administration de gonadotrophine chorionique humaine (hCG) et par la grossesse (hCG endogène). Un SHO précoce survient généralement dans les 10 jours suivant l'administration d'hCG et peut être associé à une réponse ovarienne excessive à la stimulation des gonadotrophines. Un SHO tardif survient plus de 10 jours après l'administration d'hCG, en raison des changements hormonaux pendant la grossesse. En raison du risque de développer un SHO, les patientes doivent être surveillées pendant au moins deux semaines après l'administration d'hCG.
Les femmes présentant des facteurs de risque connus de réponse ovarienne élevée peuvent être particulièrement sujettes au développement d'un SHO pendant ou après le traitement par GONADOTROPHINE CHORIONIQUE IBSA. Pour les femmes ayant leur premier cycle de stimulation ovarienne, pour qui les facteurs de risque ne sont que partiellement connus, une surveillance étroite des signes et symptômes précoces du SHO est recommandée.
Pour réduire le risque de SHO, des évaluations échographiques du développement folliculaire doivent être effectuées avant le traitement et à intervalles réguliers pendant le traitement. La détermination concomitante des taux sériques d'estradiol peut également être utile. Avec les techniques d’assistance médicale à la procréation, il existe un risque d’hyperstimulation ovarienne avec 18 follicules ou plus de diamètre supérieur ou égal à 11 mm. Lorsqu'il existe 30 follicules ou plus au total, il est conseillé de suspendre l'administration d'hCG.
Le respect de la dose et du schéma thérapeutique recommandés de GONADOTROPHINE CHORIONIQUE IBSA ainsi qu’une surveillance attentive de la réponse ovarienne sont importants pour réduire le risque de survenue SHO. Si le SHO se développe, une prise en charge standard et appropriée doit être mise en œuvre et suivie.
Torsion ovarienne
Une torsion ovarienne a été rapportée après un traitement par gonadotrophines, y compris GONADOTROPHINE CHORIONIQUE IBSA. Une torsion ovarienne peut être liée à d'autres évènements, tels que SHO, grossesse, chirurgie abdominale antérieure, antécédents de torsion ovarienne et kystes ovariens antérieurs ou actuels. Les dommages sur l'ovaire dus à un apport sanguin réduit peuvent être réduits par un diagnostic précoce et une détorsion immédiate.
Traçabilité
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Autres informations
Ce médicament contient moins de 1 mmol (23 mg) de sodium par solution reconstituée, c'est-à-dire qu'il est essentiellement « sans sodium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
L'hCG peut réagir de manière croisée lors de dosage radio-immunologique des gonadotrophines, en particulier de l'hormone lutéinisante. Les médecins doivent informer le laboratoire si des taux de gonadotrophine sont demandés à des patients sous hCG.
Jusqu'à 10 jours après l'administration de GONADOTROPHINE CHORIONIQUE IBSA, un test de grossesse peut donner un résultat faux-positif.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n'existe aucune indication pour l'utilisation de GONADOTROPHINE CHORIONIQUE IBSA pendant la grossesse. Il n’existe pas de données sur l’utilisation de ce médicament chez la femme enceinte. Le risque potentiel en clinique n’est pas connu.
L’utilisation de GONADOTROPHINE CHORIONIQUE IBSA pendant l’allaitement n’est pas indiquée. Il n’existe aucune donnée sur l’excrétion de la gonadotrophine chorionique humaine dans le lait.
Fertilité
L’utilisation de GONADOTROPHINE CHORIONIQUE IBSA est indiquée en cas d’infertilité (voir rubrique 4.1).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
GONADOTROPHINE CHORIONIQUE IBSA n’a aucun effet sur l’aptitude à conduire des véhicules et à utiliser des machines.
GONADOTROPHINE CHORIONIQUE IBSA peut provoquer des réactions au site d'injection qui sont généralement légères et transitoires. L'effet indésirable le plus grave est le syndrome d'hyperstimulation ovarienne (SHO) qui, dans la plupart des cas, peut être correctement pris en charge s'il est diagnostiqué et traité rapidement (voir rubrique 4.4).
Les effets indésirables sont listés ci-dessous selon la convention de fréquence MedDRA et la base de données des classes de systèmes d'organes.
Parmi chaque classe de système d'organe, les effets indésirables sont classés par ordre de fréquence, les effets les plus fréquents en premier, la convention étant la suivante : très fréquent (≥ 1/10) ; fréquent (≥ 1/100 à ≤1/10) ; peu fréquent (≥ 1/1 000 à ≤ 1/100) ; rare (≥ 1/10 000 à ≤ 1/1 000); très rare (≤ 1/10 000), inconnu (ne peut pas être estimé sur la base des données disponibles).
Affections du système immunitaire
Fréquent : réaction locale d’hypersensibilité
Rare : éruption cutanée généralisée ou fièvre, réaction d'hypersensibilité générale, réaction anaphylactique
Affections gastro-intestinales
Fréquent : douleurs abdominales, nausées, vomissements et diarrhée
Peu fréquent : ascites
Troubles généraux et anomalies au site d’administration
Fréquent : ecchymose, douleur, rougeur, gonflement et démangeaisons au site d'injection, œdème
Peu fréquent : fatigue
Affections du système nerveux
Fréquent : céphalées
Affections psychiatriques
Fréquent : changements d’humeur
Peu fréquent : agitation
Affections des organes de reproduction et du sein
Fréquent : SHO léger ou modéré, seins douloureux, kystes ovariens
Peu fréquent : SHO sévère
Rare : rupture de kyste ovarien
Affections respiratoires, thoraciques et médiastinales
Peu fréquent : épanchement pleural associé à un SHO sévère
Affections de la peau et du tissu sous-cutané
Rare : angioœdème
Investigations
Peu fréquent : prise de poids associée à un SHO sévère
Affections vasculaires
Rare : thromboembolie associée à un SHO
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
La toxicité de l'hormone gonadotrophine chorionique humaine est très faible. Cependant, une dose trop élevée peut entraîner une hyperstimulation des ovaires (voir SHO, rubrique 4.4).
Conduite à tenir
En cas de surdosage, les femmes doivent être évaluées par un clinicien pour des symptômes évocateurs de SHO (voir rubrique 4.4). Les femmes présentant un SHO léger ou modéré peuvent faire l’objet d’une surveillance de leur consommation et excrétion de liquide. Une paracentèse du liquide ascitique peut être nécessaire. Les femmes souffrant de SHO sévère doivent également faire l'objet d'une surveillance de leur consommation et excrétion de liquide, de plus une thromboprophylaxie avec héparine de bas poids moléculaire (HBPM) doit être envisagée. L'hématocrite est un guide utile du degré d'épuisement du volume intravasculaire. Les paramètres vitaux doivent être surveillés et l'hospitalisation doit être envisagée pour les femmes incapables de maîtriser la douleur de manière satisfaisante ou de maintenir un apport hydrique adéquat en raison de nausées ou souffrant d'un SHO critique.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
GONADOTROPHINE CHORIONIQUE IBSA est une préparation de gonadotrophine chorionique humaine hautement purifiée obtenue à partir de l'urine de femmes enceintes.
GONADOTROPHINE CHORIONIQUE IBSA stimule la stéroïdogenèse dans les gonades, un effet biologique similaire à celui de la LH (hormone lutéinisante). GONADOTROPHINE CHORIONIQUE IBSA favorise la production d'œstrogènes et de progestérone après l'ovulation.
Lors d’un essai clinique comparatif, impliquant 147 femmes infertiles, âgées de 18 à 39 ans dont l'IMC était compris entre 18 et 30 kg/m2, FSH basale <10 mUI/mL, cycles menstruels réguliers et présence des deux ovaires, subissant une stimulation ovarienne contrôlée par un protocole standard long avec des agonistes de GnRH, l'administration d'une dose de 10000 UI de GONADOTROPHINE CHORIONIQUE IBSA a été aussi efficace que 250 µg d'hCG recombinante pour induire la maturation folliculaire finale et la lutéinisation précoce. Le nombre d'ovocytes prélevés n'était pas inférieur lorsque l’HP-hCG était utilisée par rapport à la r-hCG: le nombre moyen était de 13,3 (6,8) dans le groupe HP-hCG et 12,5 (5,8) dans le groupe r-hCG (p = 0,49) avec un IC à 95% (−1,34, 2,77).
L’hCG est d'origine humaine, par conséquent aucune formation d'anticorps n'est attendue.
5.2. Propriétés pharmacocinétiques
Aucune étude pharmacocinétique n'a été réalisée chez des patientes présentant une insuffisance hépatique ou rénale.
5.3. Données de sécurité préclinique
Aucune étude préclinique n'a été réalisée avec GONADOTROPHINE CHORIONIQUE IBSA.
Il n'existe pas de données précliniques pertinentes pour le prescripteur autres que celles déjà incluses dans d'autres rubriques du RCP.
Solvant : chlorure de sodium, eau pour préparation injectable
3 ans
Après reconstitution, le produit doit être utilisé immédiatement.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
Conserver le flacon et le solvant en seringue préremplie dans leurs emballages d'origine, à l’abri de la lumière.
6.5. Nature et contenu de l'emballage extérieur
La boite de 1 contient :
Un étui en plastique contenant la poudre dans un flacon (verre de type I), scellé avec un bouchon en caoutchouc et maintenu en place avec un capuchon amovible. 1 mL de solvant dans une seringue préremplie (verre de type I), 1 aiguille longue pour la reconstitution et pour l'injection intramusculaire et 1 aiguille courte pour l'injection sous-cutanée.
Le conditionnement multiple contient 10 étuis en plastique, comme décrit ci-dessus.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
La solution doit être préparée juste avant l'injection.
Chaque flacon est à usage unique. Le médicament doit être reconstitué dans des conditions aseptiques.
GONADOTROPHINE CHORIONIQUE IBSA ne doit être reconstitué qu'avec le solvant fourni dans l'emballage.
Utilisez une surface propre et lavez-vous les mains avant de reconstituer la solution.
Disposez tous les éléments suivants sur une surface propre :
· deux compresses imbibées d’alcool (non fournis)
· un flacon contenant la poudre de GONADOTROPHINE CHORIONIQUE IBSA
· une seringue préremplie de solvant
· une longue aiguille pour la reconstitution et pour l’injection intramusculaire
· une aiguille courte pour l’injection sous-cutanée
Reconstitution de la solution injectable
Préparez la solution injectable :
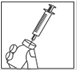
Décapuchonnez uniquement la seringue préremplie, introduisez l'aiguille de reconstitution (aiguille longue) dans la seringue et vérifiez que l'aiguille est bien positionnée afin d’éviter les fuites de solution.
En cas de fuite de solution, essayez de mieux fixer l'aiguille avec une légère rotation.
1. Retirez la capsule plastique colorée du flacon contenant la poudre de GONADOTROPHINE CHORIONIQUE IBSA et désinfectez la surface du bouchon en caoutchouc avec une compresse imbibée d'alcool.
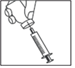
2. Prenez la seringue et injectez lentement le solvant dans le flacon de poudre à travers le bouchon en caoutchouc.
3. NE PAS AGITER, faites rouler doucement le flacon entre vos mains jusqu'à dissolution complète de la poudre, en prenant soin d'éviter la formation de mousse.
4. Une fois la poudre dissoute (ce qui, en général, se produit immédiatement), aspirez doucement la solution dans la seringue.
· L'aiguille toujours insérée, retournez le flacon.
· Assurez-vous que la pointe de l'aiguille se trouve sous le niveau du liquide.
· Tirez doucement sur le piston pour aspirer toute la solution dans la seringue.
· Vérifiez que la solution reconstituée est limpide et incolore.
Préparation de doses plus élevées
· Une dose plus élevée de 10000 UI peut être obtenue en utilisant deux flacons de poudre. A la fin de l'étape 4 ci-dessus, aspirez le contenu reconstitué du premier flacon dans la seringue et injectez lentement dans un deuxième flacon de poudre. Répétez les étapes 2 à 4 pour le deuxième flacon.
· Si plusieurs flacons de poudre sont utilisés, la quantité de gonadotrophine chorionique humaine contenue dans 1 mL de solution reconstituée sera la suivante :
GONADOTROPHINE CHORIONIQUE IBSA 5000 UI, poudre et solvant pour solution injectable |
|
|
Nombre de flacons utilisés |
Quantité totale de gonadotrophine chorionique humaine dans 1 mL de solution |
|
1 |
5000 IU |
|
2 |
10000 IU |
La solution doit être limpide et incolore.
Jetez tous les articles usagés.
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur (une fois l'injection terminée, toutes les aiguilles et les seringues vides doivent être jetées dans un récipient approprié).
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
PARC DE SOPHIA ANTIPOLIS
LES TROIS MOULINS, 280, RUE DE GOA
06600 ANTIBES
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 293 9 2 : 1 boîte contenant : 1 flacon (verre) de poudre + 1 mL de solvant en seringue préremplie (verre) + 1 aiguille longue pour la reconstitution et l'injection intramusculaire + 1 aiguille courte pour l'injection sous-cutanée.
· 34009 550 818 0 7 : Conditionnement multiple de 10 boîtes, contenant chacune : 1 flacon (verre) de poudre + 1 mL de solvant en seringue préremplie (verre) + 1 aiguille longue pour la reconstitution et l'injection intramusculaire + 1 aiguille courte pour l'injection sous-cutanée.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament nécessitant une surveillance particulière pendant le traitement.
Médicament à prescription réservée aux spécialistes en gynécologie et/ou gynécologie-obstétrique et/ou endocrinologie et métabolisme.
ANSM - Mis à jour le : 04/02/2025
GONADOTROPHINE CHORIONIQUE IBSA 5000 UI, poudre et solvant pour solution injectable
Gonadotrophine Chorionique humaine
![]() Ce médicament fait l’objet d’une surveillance supplémentaire qui permettra l’identification rapide de nouvelles informations relatives à la sécurité. Vous pouvez y contribuer en signalant tout effet indésirable que vous observez. Voir en fin de rubrique 4 comment déclarer les effets indésirables.
Ce médicament fait l’objet d’une surveillance supplémentaire qui permettra l’identification rapide de nouvelles informations relatives à la sécurité. Vous pouvez y contribuer en signalant tout effet indésirable que vous observez. Voir en fin de rubrique 4 comment déclarer les effets indésirables.
Veuillez lire attentivement cette notice avant d’utiliser ce médicament car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que GONADOTROPHINE CHORIONIQUE IBSA 5000 UI, poudre et solvant pour solution injectable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser GONADOTROPHINE CHORIONIQUE IBSA 5000 UI, poudre et solvant pour solution injectable ?
3. Comment utiliser GONADOTROPHINE CHORIONIQUE IBSA 5000 UI, poudre et solvant pour solution injectable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver GONADOTROPHINE CHORIONIQUE IBSA 5000 UI, poudre et solvant pour solution injectable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE GONADOTROPHINE CHORIONIQUE IBSA 5000 UI, poudre et solvant pour solution injectable ET DANS QUELS CAS EST-IL UTILISE ?
Qu’est-ce que GONADOTROPHINE CHORIONIQUE IBSA 5000 UI, poudre et solvant pour solution injectable ?
GONADOTROPHINE CHORIONIQUE IBSA contient de la gonadotrophine chorionique humaine hautement purifiée, une hormone obtenue à partir de l'urine humaine, appartenant à la famille des « gonadotrophines », qui sont des hormones naturelles impliquées dans la reproduction et la fertilité.
Dans quels cas GONADOTROPHINE CHORIONIQUE IBSA 5000 UI, poudre et solvant pour solution injectable est utilisé ?
GONADOTROPHINE CHORIONIQUE IBSA est utilisé :
· Pour aider au développement et à la maturation de plusieurs follicules (chacun contenant un œuf) chez les femmes ayant recours aux techniques d’assistance médicale à la procréation (une procédure qui peut vous aider à être enceinte) comme la « fécondation in vitro ».
· Pour favoriser la libération d’un œuf par les ovaires (induction de l'ovulation) chez les femmes qui ne produisent pas d’œufs (« anovulation ») ou qui produisent trop peu d’œufs (« oligo-ovulation »).
Ce médicament doit être utilisé sous la surveillance de votre médecin, sauf avis contraire de votre médecin.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER GONADOTROPHINE CHORIONIQUE IBSA 5000 UI, poudre et solvant pour solution injectable ?
· si vous êtes allergique à la gonadotrophine chorionique humaine ou à l’un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6).
· si vous avez des maladies non traitées touchant la thyroïde, l'hypophyse ou les glandes surrénales
· si vous avez un cancer de l'ovaire, de l'utérus ou du sein
· si vous êtes dans une situation rendant généralement une grossesse normale impossible, telle qu’une insuffisance ovarienne, absence d'utérus, ménopause précoce, obstruction des trompes de Fallope, fibromes utérins ou d’autres malformations des organes sexuels
· si vous avez récemment eu des saignements vaginaux inexpliqués
Informez votre médecin ou pharmacien si vous êtes dans une de ces situations, car ce médicament n’est peut-être pas celui qui vous convient.
Avertissements et précautions
Avant de débuter le traitement, votre médecin doit avoir vérifié que vos organes sexuels ne présentent pas d’anomalie.
Adressez-vous à votre médecin avant d’utiliser GONADOTROPHINE CHORIONIQUE IBSA si vous souffrez ou avez souffert dans le passé de l’une des affections suivantes :
· malformation des organes sexuels
· maladie chronique (comme le diabète, les troubles cardiovasculaires, etc.).
· complication vasculaire (c'est-à-dire risque accru de survenue de caillots sanguins, antécédents ou antécédents familiaux de caillots sanguins, surpoids)
Examens médicaux
Jusqu’à dix jours après l’administration de GONADOTROPHINE CHORIONIQUE IBSA, un test de grossesse peut donner un résultat faux-positif.
Pendant le traitement par GONADOTROPHINE CHORIONIQUE IBSA, les événements suivants peuvent survenir :
Syndrome d'hyperstimulation ovarienne (SHO)
Les traitements par des hormones gonadotropes telles que GONADOTROPHINE CHORIONIQUE IBSA peuvent provoquer un syndrome d'hyperstimulation ovarienne (SHO). Il s'agit d'une situation médicale grave où les ovaires sont trop stimulés et les follicules en croissance deviennent plus gros que la normale. Dans de rares cas, un SHO sévère peut mettre la vie en danger. Par conséquent, une surveillance étroite par votre médecin est très importante. Pour vérifier les effets du traitement, votre médecin effectuera des échographies de vos ovaires. Votre médecin peut également vérifier les taux d’hormones sanguines (voir également rubrique 4).
Le SHO provoque une accumulation soudaine de liquide dans les régions abdominale (estomac) et thoracique et peut provoquer la formation de caillots sanguins. Prévenez immédiatement votre médecin si vous présentez :
· un gonflement et douleur sévères dans la région de l'estomac (abdomen)
· mal au cœur (nausées)
· des vomissements
· une prise de poids rapide due à une accumulation de liquide
· de la diarrhée
· une diminution du débit urinaire
· des difficultés à respirer
Torsion ovarienne
La torsion ovarienne est la torsion d'un ovaire. La torsion de l'ovaire peut entraîner l'interruption du flux sanguin vers l'ovaire.
Avant de commencer à utiliser ce médicament, il est important d'informer votre médecin si vous :
· avez déjà eu un SHO
· êtes enceinte ou pensez l'être
· avez déjà subi une chirurgie de l'estomac (abdominale)
· avez déjà eu une torsion d'un ovaire
· avez eu ou avez actuellement des kystes à l’ovaire ou aux ovaires.
Caillots sanguins (thrombose)
La grossesse augmente le risque de survenue de caillots sanguins.
Si vous présentez des facteurs de risque de survenue de caillots sanguins (par exemple si vous êtes en surpoids, si vous ou votre famille présente des antécédents de caillots sanguins), le risque de survenue de caillots sanguins au cours d’une FIV pourrait être augmenté.
Les caillots sanguins peuvent entraîner de graves problèmes de santé, tels que :
· blocage de vos poumons (embolie pulmonaire)
· accident vasculaire cérébral
· crise cardiaque
· diminution du flux sanguin vers les organes vitaux pouvant entraîner des lésions sur vos organes
· diminution du flux sanguin (thrombose veineuse profonde) vers votre bras ou votre jambe pouvant entraîner la perte de votre bras ou de votre jambe.
Naissances multiples, malformations congénitales, fausses couches ou complications de grossesse
Si le traitement par GONADOTROPHINE CHORIONIQUE IBSA entraîne une grossesse, il existe un risque plus important d'avoir des jumeaux ou des naissances multiples. Les grossesses multiples comportent un risque accru pour la santé de la mère et de ses bébés au moment de la naissance. Chez les femmes suivant un traitement de fertilité, il existe un risque légèrement plus important de survenue de fausse couche ou de grossesse hors de l'utérus (grossesse extra-utérine). Par conséquent, votre médecin doit effectuer une échographie précoce pour exclure la possibilité d'une grossesse en dehors de l'utérus. Les naissances multiples sont plus probables si vous prenez d'autres médicaments qui encouragent l'ovulation (par exemple hMG).
On ne sait pas si le traitement par FIV provoque des malformations congénitales ou certains cancers des organes sexuels.
Enfants et adolescents
Ce médicament n’est pas destiné à une utilisation chez l’enfant ou l’adolescent.
Autres médicaments et GONADOTROPHINE CHORIONIQUE IBSA 5000 UI, poudre et solvant pour solution injectable
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament, y compris sans ordonnance médicale. Ceci est particulièrement important si vous prenez des médicaments qui :
· stimulent l'ovulation (par exemple hMG);
· contiennent de la cortisone, en particulier à doses élevéesGONADOTROPHINE CHORIONIQUE IBSA 5000 UI, poudre et solvant pour solution injectable avec des aliments, boissons et de l’alcool
Sans objet.
Ne prenez pas GONADOTROPHINE CHORIONIQUE IBSA si vous êtes enceinte ou si vous allaitez. Si vous pensez être enceinte, demandez conseil à votre médecin avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
GONADOTROPHINE CHORIONIQUE IBSA ne modifie pas votre capacité à conduire des véhicules ou à utiliser des machines.
GONADOTROPHINE CHORIONIQUE IBSA 5000 UI, poudre et solvant pour solution injectable contient du sodium.
Ce médicament contient moins de 1 mmol de sodium (23 mg) par solution reconstituée, c'est-à-dire qu'il est essentiellement « sans sodium ».
3. COMMENT UTILISER GONADOTROPHINE CHORIONIQUE IBSA 5000 UI, poudre et solvant pour solution injectable ?
GONADOTROPHINE CHORIONIQUE IBSA est une poudre à dissoudre avec un liquide (solvant) avant utilisation ; il est administré par injection sous la peau (par voie sous-cutanée) ou dans un muscle (par voie intramusculaire). La solution est obtenue en mélangeant le solvant avec la poudre et doit être utilisée immédiatement après la préparation.
Veillez à toujours prendre ce médicament en suivant exactement les indications de votre médecin. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
Comment utiliser GONADOTROPHINE CHORIONIQUE IBSA 5000 UI, poudre et solvant pour solution injectable
GONADOTROPHINE CHORIONIQUE IBSA est administrée en injection sous la peau (par voie sous-cutanée) ou dans le muscle (injection intramusculaire).
Chaque flacon doit être utilisé une seule fois et l’injection doit être faite dès la préparation faite.
La dose recommandée de GONADOTROPHINE CHORIONIQUE IBSA est de 5 000 UI ou 10 000 UI à administrer 24 à 48 heures après l'obtention d'une stimulation optimale de la croissance folliculaire.
Après vous avoir dispensé les conseils et la formation nécessaire, votre médecin peut vous demander de vous injecter GONADOTROPHINE CHORIONIQUE IBSA vous-même.
Pour la première fois, votre médecin doit :
· vous avoir indiqué précisément comment préparer la bonne dose à injecter
· vous avoir montré comment préparer la solution à injecter
· vous avoir indiqué les zones d’injection possibles
· vous avoir fait pratiquer une injection sous-cutanée.
Avant de vous injecter vous-même GONADOTROPHINE CHORIONIQUE IBSA, lisez attentivement les instructions suivantes :
Comment préparer et injecter GONADOTROPHINE CHORIONIQUE IBSA 5000 UI, poudre et solvant pour solution injectable, en utilisant 1 flacon de poudre :
La solution doit être préparée juste avant l’injection. Chaque flacon est à usage unique.
GONADOTROPHINE CHORIONIQUE IBSA doit avoir été préparé uniquement avec le solvant fourni dans l’étui en suivant les étapes suivantes :
Etape 1
Lavez-vous les mains avant de préparer la solution. Préparez une surface de travail propre. Il est important que vos mains et tous les accessoires que vous utilisez soient aussi propres que possible.
Etape 2
Placez sur la surface propre tous les accessoires suivants :
· deux cotons imbibés d’alcool (non fournis),
· un flacon contenant la poudre de GONADOTROPHINE CHORIONIQUE IBSA,
· une seringue préremplie de solvant
· une aiguille longue pour la reconstitution et pour l’injection intramusculaire,
· une aiguille courte pour l’injection sous-cutanée.
Etape 3
|
|
· Retirez uniquement le capuchon de la seringue préremplie. · Montez l’aiguille de reconstitution (aiguille longue) avec son capuchon protecteur attaché sur la seringue et vérifiez que l’aiguille est bien fixée afin d’éviter les fuites de solution. En cas de fuite de solution, essayez de mieux fixer l’aiguille en exerçant une légère rotation. · Posez précautionneusement la seringue sur la surface de travail propre. · Evitez de toucher l’aiguille. |
Etape 4
|
|
· Retirez le bouchon de plastique coloré du flacon de GONADOTROPHINE CHORIONIQUE IBSA en le soulevant doucement. · Désinfectez la surface du bouchon en caoutchouc avec un coton imbibé d'alcool et laissez sécher. |
Etape 5
|
|
· Prenez la seringue, retirez le capuchon protecteur de l’aiguille et insérez l’aiguille au milieu du bouchon en caoutchouc du flacon de GONADOTROPHINE CHORIONIQUE IBSA. · Appuyez fermement sur le piston et injectez lentement le solvant dans le flacon de poudre à travers le bouchon en caoutchouc, afin de faire descendre toute la solution dans le flacon de poudre. · NE PAS SECOUER mais faire doucement rouler le flacon entre vos doigts jusqu’à dissolution complète de la poudre, en prenant soin d’éviter la formation de mousse. |
Etape 6
|
|
Une fois la poudre dissoute (ce qui habituellement se produit immédiatement), aspirez doucement la solution dans la seringue comme décrit ci-dessous : · Avec la seringue toujours en place, retournez le flacon tête en bas. · Assurez-vous que l’extrémité de l’aiguille est bien recouverte par le liquide. · Tirez doucement sur le piston afin d’aspirer toute la solution de GONADOTROPHINE CHORIONIQUE IBSA dans la seringue. · Vérifiez que la solution reconstituée est claire et incolore. |
Préparation de doses plus élevées en utilisant plus d’un flacon de poudre :
Si votre médecin vous a recommandé la dose supérieure de 10 000 UI, cela peut être réalisé en utilisant deux flacons de poudre avec une seringue préremplie de solvant.
Lors de la préparation de 2 flacons de GONADOTROPHINE CHORIONIQUE IBSA, à la fin de l’étape 3 ci-dessus, prélevez le contenu reconstitué du premier flacon dans la seringue et injectez-le lentement dans un deuxième flacon. Répétez les étapes 4 à 6 avec l’autre flacon. La solution doit être claire et incolore.
Injection intramusculaire du médicament :
Pour les injections intramusculaires, votre médecin ou votre infirmière préparera et injectera GONADOTROPHINE CHORIONIQUE IBSA sur le côté de votre cuisse ou sur la fesse.
Injection de la solution en sous-cutanée :
|
|
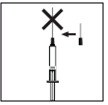
· Lorsque la seringue contient la dose prescrite, remettez le capuchon protecteur sur l’aiguille longue. Remplacez l’aiguille longue par l’aiguille courte pour injection sous-cutanée avec son capuchon protecteur. Veuillez vérifier que l’aiguille est correctement fixée et poussez fermement l'aiguille courte contre le réservoir de la seringue, puis tournez-le légèrement pour s’assurer qu’il est bien vissé et pour créer un joint afin d’éviter les fuites de solution. |
|
|
|
|
|
· Retirez le capuchon protecteur de l’aiguille. Diriger l'aiguille vers le haut puis tapotez légèrement la seringue de façon à ce que les bulles d’air remontent. · Appuyez sur le piston jusqu'à ce qu’un peu de liquide apparaisse en haut de l’aiguille. · N’UTILISEZ PAS la solution si elle est trouble ou contient des particules |
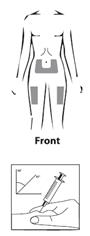
Site d’injection :
|
|
· Votre médecin ou votre infirmière vous aura déjà indiqué où injecter GONADOTROPHINE CHORIONIQUE IBSA sur votre corps. Généralement les endroits sont la cuisse ou le ventre en-dessous du nombril. · Désinfectez la zone où l'injection va être faite avec un coton imbibé d’alcool. · Pincez fermement la peau entre vos doigts. De l’autre main, enfoncez l’aiguille d’un coup sec avec un angle de 45 ou 90 degrés. |
Injection de la solution :
· Injectez sous la peau comme vous l’a indiqué votre médecin.
· N’injectez pas directement dans une veine.
· Appuyez doucement et fermement sur le piston afin d’injecter correctement la solution et pour éviter d’abîmer les tissus.
Prenez tout le temps nécessaire pour injecter le volume de solution prescrite.
Retrait de l’aiguille :
· Retirez immédiatement l'aiguille et appuyez sur le point d'injection.
· Un massage doux sur le point d’injection - en maintenant la pression - aide à disperser la solution de GONADOTROPHINE CHORIONIQUE IBSA et à soulager tout inconfort.
Jetez tous les accessoires utilisés :
Une fois l’injection terminée, toutes les aiguilles et seringues vides doivent être immédiatement jetées dans un récipient approprié. Toute solution non utilisée ou déchet doit être éliminé conformément à la réglementation en vigueur.
Si vous avez utilisé plus de GONADOTROPHINE CHORIONIQUE IBSA 5000 UI, poudre et solvant pour solution injectable que vous n’auriez dû
Les effets d’un surdosage de GONADOTROPHINE CHORIONIQUE IBSA ne sont pas connus ; néanmoins, un syndrome d’hyperstimulation ovarienne n’est pas exclu (voir la rubrique 4). Si vous avez utilisé plus de GONADOTROPHINE CHORIONIQUE IBSA que vous n’auriez dû, consultez immédiatement votre médecin ou votre pharmacien.
Si vous oubliez d’utiliser GONADOTROPHINE CHORIONIQUE IBSA 5000 UI, poudre et solvant pour solution injectable
Si vous oubliez d'utiliser GONADOTROPHINE CHORIONIQUE IBSA, contactez immédiatement votre médecin.
Si vous arrêtez d’utiliser GONADOTROPHINE CHORIONIQUE IBSA 5000 UI, poudre et solvant pour solution injectable
Consultez votre médecin si vous envisagez de ne pas utiliser ce médicament.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Arrêtez d’utiliser GONADOTROPHINE CHORIONIQUE IBSA 5000 UI, poudre et solvant pour solution injectable et consultez immédiatement un médecin si vous remarquez l’un des effets indésirables graves suivants ; vous pourriez avoir besoin d’un traitement médical en urgence :
· stimulation excessive légère ou modérée des ovaires (syndrome d'hyperstimulation ovarienne), qui se manifeste par une hypertrophie des ovaires, des kystes ovariens, des douleurs abdominales accompagnées de vomissements et de nausées (voir également la rubrique 2 sous «Syndrome d'hyperstimulation ovarienne»). Il s'agit d'un effet indésirable fréquent (pouvant affecter jusqu'à 1 personne sur 10).
· stimulation excessive et sévère des ovaires (syndrome d'hyperstimulation ovarienne) caractérisée par des douleurs dans le bas-ventre (bassin), des nausées, des vomissements, une prise de poids, une accumulation de liquides dans l'abdomen (ascite) ou la poitrine (épanchement pleural). Cet événement est peu fréquent (peut affecter jusqu'à 1 personne sur 100)
· rupture d'un kyste ovarien (conséquence rare d'un SHO sévère, peut affecter jusqu'à 1 personne sur 1000)
· formation de caillots dans les vaisseaux sanguins (événements thromboemboliques), en tant que complication du syndrome d'hyperstimulation ovarienne. Cet événement est rare (peut affecter jusqu'à 1 personne sur 1000)
· réactions allergiques généralisées sévères pouvant inclure: gonflement du visage, des yeux, des lèvres, de la gorge ou de la langue, des difficultés respiratoires, une respiration sifflante, une éruption cutanée ; effet indésirable rare (peut affecter jusqu'à 1 personne sur 1000)
Les effets indésirables suivants ont aussi été rapportés :
Très fréquent (susceptibles d’affecter jusqu’à 1 patient sur 10) :
· réaction au site d'injection pouvant inclure rougeur, ecchymose, gonflement, démangeaisons ou douleur
· gonflement (œdème)
· changements d’humeur
· maux de tête
· seins douloureux.
Peu fréquent (susceptibles d’affecter jusqu’à 1 patient sur 100) :
· agitation, fatigue
Rare (susceptibles d’affecter jusqu’à 1 patient sur 1000) :
· gonflement des couches profondes de la peau, souvent observé avec de l'urticaire (urticaire)
· éruptions cutanées généralisées
Si vous ressentez l'un des effets indésirables rares indiqués ci-dessus, contactez immédiatement votre médecin qui évaluera s'il faut arrêter le traitement par GONADOTROPHINE CHORIONIQUE IBSA ou vous rendre immédiatement au service des urgences de l'hôpital le plus proche.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER GONADOTROPHINE CHORIONIQUE IBSA 5000 UI, poudre et solvant pour solution injectable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
A conserver à une température ne dépassant pas 25°C. Conserver le flacon et la seringue préremplie de solvant dans l’emballage d’origine, à l’abri de la lumière.
A utiliser immédiatement après reconstitution. N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage extérieur, le flacon et la seringue préremplie de solvant. Lorsque la date de péremption est exprimée au format mois/année, la date de péremption fait référence au dernier jour de ce mois. N’utilisez pas GONADOTROPHINE CHORIONIQUE IBSA si vous remarquez que la solution n'a pas l'air limpide (trouble ou avec présence de particules visibles). Une fois reconstituée, la solution doit être limpide et incolore.
Ne jetez aucun médicament au tout-à-l’égout. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient GONADOTROPHINE CHORIONIQUE IBSA 5000 UI, poudre et solvant pour solution injectable
· La substance active est : gonadotrophine chorionique humaine
Chaque flacon contient 5000 UI de gonadotrophine chorionique humaine, produite à partir d’urine humaine.
· Les autres composants sont :
Flacon de poudre: lactose monohydraté
Seringue préremplie de solvant (chlorure de sodium à 0,9%) : eau pour préparations injectables, chlorure de sodium.
GONADOTROPHINE CHORIONIQUE IBSA se présente sous la forme d’un :
· Flacon de poudre : poudre lyophilisée blanchâtre à blanche
Solvant en seringue préremplie (chlorure de sodium à 0.9%) : solution claire et incolore.
La boite de 1 contient :
Un étui en plastique contenant la poudre dans un flacon (verre de type I), scellé avec un bouchon en caoutchouc et maintenu en place avec un capuchon amovible. 1 mL de solvant dans une seringue préremplie (verre de type I), 1 aiguille longue pour la reconstitution et pour l'injection intramusculaire et 1 aiguille courte pour l'injection sous-cutanée.
La boite multiple contient 10 étuis en plastique, comme décrit ci-dessus.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
PARC DE SOPHIA ANTIPOLIS
LES TROIS MOULINS, 280, RUE DE GOA
06600 ANTIBES
Exploitant de l’autorisation de mise sur le marché
IBSA PHARMA SAS
PARC DE SOPHIA ANTIPOLIS
LES TROIS MOULINS, 280, RUE DE GOA
06600 ANTIBES
VIA MARTIRI DI CEFALONIA 2
26900 LODI
ITALIE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).