Dernière mise à jour le 01/12/2025
KLIOGEST, comprimé pelliculé
Ce médicament n'est ou ne sera bientôt plus disponible sur le marché.
Si vous prenez actuellement ce médicament, il vous est recommandé d'en parler avec votre médecin
ou avec votre pharmacien qui pourra vous orienter vers un autre traitement.
Indications thérapeutiques
KLIOGEST appartient à la classe des traitements hormonaux substitutifs (THS) combinés continus, il doit donc être pris tous les jours sans interruption. KLIOGEST est utilisé chez les femmes ménopausées dont les dernières règles remontent à plus d’un an.
Les comprimés contiennent deux hormones : l’estradiol 2 mg (estrogène identique à celui fabriqué par les ovaires) et l’acétate de noréthistérone 1 mg (progestatif qui agit de façon similaire à la progestérone fabriquée par le corps humain).
KLIOGEST est utilisé pour :
Le soulagement des symptômes survenant après la ménopause
Durant la ménopause, la quantité d’estrogènes produits par le corps de la femme diminue. Cette diminution peut provoquer certains symptômes tels que des sensations de chaleur au niveau du visage, du cou et de la poitrine (« bouffées de chaleur »). KLIOGEST soulage ces symptômes après la ménopause. KLIOGEST ne vous sera prescrit que si vos symptômes altèrent votre vie quotidienne de manière importante.
La prévention de l’ostéoporose
Après la ménopause, certaines femmes peuvent développer une fragilité des os (ostéoporose). Vous devez discuter de toutes les éventualités de traitement avec votre médecin.
Si vous présentez un risque accru de fractures dues à l’ostéoporose et que les autres médicaments ne vous conviennent pas, vous pouvez utiliser KLIOGEST pour la prévention de l’ostéoporose après la ménopause.
KLIOGEST est destiné aux femmes qui ont un utérus intact et qui sont ménopausées depuis plus d’un an.
L'expérience de ce traitement chez les femmes âgées de plus de 65 ans est limitée.
Présentations
> 1 distributeur journalier polystyrène polypropylène de 28 comprimé(s)
Code CIP : 331 455-5 ou 34009 331 455 5 2
Déclaration d'arrêt de commercialisation : 24/01/2025
Cette présentation n'est pas agréée aux collectivités
- Prix hors honoraire de dispensation : 6,25 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 7,27 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 24/09/2025 | Réévaluation suite saisine Ministères (CT) | Le service médical rendu par ACTIVELLE 1 mg/ 0,5 mg (estradiol, acétate de noréthistérone), KLIOGEST 2 mg/ 1 mg (estradiol, acétate de noréthistérone), NOVOFEMME 1 mg/1 mg (estradiol, acétate de noréthistérone) et TRISEQUENS 2 mg/ 2 mg-1 mg/ 1 mg (estradiol, acétate de noréthistérone) reste important dans le traitement hormonal substitutif (THS) des symptômes de déficit en estrogènes chez les femmes ménopausées et dans la prévention de l'ostéoporose post-ménopausique chez les femmes ayant un risque accru de fracture ostéoporotique et présentant une intolérance ou une contre-indication aux autres traitements indiqués dans la prévention de l'ostéoporose. |
| Important | Avis du 13/04/2016 | Renouvellement d'inscription (CT) | Le service médical rendu par les spécialités ACTIVELLE, KLIOGEST, NOVOFEMME et TRISEQUENS dans : • le traitement hormonal substitutif (THS) des symptômes de déficit en estrogènes chez les femmes ménopausées reste important chez les patientes dont les troubles du climatère sont ressentis comme suffisamment gênant pour altérer leur qualité de vie, lorsque ces spécialités sont utilisées selon les préconisations de la Commission. • la prévention de l'ostéoporose post-ménopausique chez les femmes ayant un risque accru de fracture ostéoporotique et présentant une intolérance ou une contre-indication aux autres traitements indiqués dans la prévention de l'ostéoporose en cas de troubles du climatère et de ménopause récente, après une fracture mineure ou s’il existe un T-score bas, lorsque ces spécialités sont utilisées selon les préconisations de la Commission. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 24/09/2025 | Réévaluation suite saisine Ministères (CT) | ACTIVELLE (estradiol, acétate de noréthistérone), KLIOGEST (estradiol, acétate de noréthistérone), NOVOFEMME (estradiol, acétate de noréthistérone) et TRISEQUENS (estradiol, acétate de noréthistérone) n’apportent pas d’amélioration du service médical rendu (ASMR V) dans la stratégie thérapeutique. |
ANSM - Mis à jour le : 07/12/2023
KLIOGEST, comprimé pelliculé
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
estradiol (sous forme d’estradiol hémihydraté) ......................................................................... 2 mg
acétate de noréthistérone........................................................................................................ 1 mg
pour un comprimé pelliculé
Excipient(s) à effet notoire : lactose monohydraté.
Chaque comprimé blanc contient 36,3 mg de lactose monohydraté.
Pour la liste complète des excipients, voir rubrique 6.1.
Comprimé pelliculé blanc, biconvexe, gravé avec NOVO 281. Diamètre : 6 mm.
4.1. Indications thérapeutiques
Prévention de l’ostéoporose post-ménopausique chez les femmes ayant un risque accru de fractures ostéoporotiques et présentant une intolérance ou une contre-indication aux autres traitements indiqués dans la prévention de l’ostéoporose (voir rubrique 4.4).
L’expérience de ce traitement chez les femmes âgées de plus de 65 ans est limitée.
4.2. Posologie et mode d'administration
Un comprimé doit être pris par voie orale une fois par jour, sans interruption, de préférence au même moment de la journée.
Pour débuter ou poursuivre un traitement dans l’indication des symptômes post-ménopausiques, la dose minimale efficace doit être utilisée pendant la durée la plus courte possible (voir rubrique 4.4).
Chez les femmes présentant une aménorrhée et ne suivant pas de traitement hormonal substitutif (THS) ou chez les femmes ayant précédemment suivi une autre hormonothérapie substitutive combinée continue, le traitement par KLIOGEST peut être débuté n'importe quel jour. Chez les femmes précédemment traitées par un THS séquentiel, le traitement doit débuter juste après la fin des saignements de privation.
Si la patiente a oublié de prendre un comprimé, celui-ci doit être pris dès que possible dans les 12 heures qui suivent l’heure habituelle de la prise. Si plus de 12 heures se sont écoulées, le comprimé doit être jeté. L’oubli d’un comprimé peut favoriser la survenue de métrorragies et de spottings.
· Cancer du sein connu ou suspecté ou antécédent de cancer du sein
· Tumeurs malignes estrogéno-dépendantes connues ou suspectées ou antécédent de tumeur maligne estrogéno-dépendante (par exemple : cancer de l’endomètre)
· Hémorragie génitale non diagnostiquée
· Hyperplasie endométriale non traitée
· Antécédent de thromboembolie veineuse ou thromboembolie veineuse en évolution (thrombose veineuse profonde, embolie pulmonaire)
· Troubles thrombophiliques connus (par exemple : déficit en protéine C, en protéine S ou en antithrombine (voir rubrique 4.4))
· Antécédent d’accident thromboembolique artériel ou accident thromboembolique artériel en évolution (par exemple : angor, infarctus du myocarde)
· Affection hépatique aiguë ou antécédent d’affection hépatique, jusqu’à normalisation des tests hépatiques
· Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1
· Porphyrie.
4.4. Mises en garde spéciales et précautions d'emploi
Dans l'indication du traitement des symptômes de la ménopause, un THS ne doit être instauré que si les troubles sont perçus par la patiente comme altérant sa qualité de vie. Dans tous les cas, une réévaluation du rapport bénéfice/risque doit être effectuée au moins une fois par an. Le THS peut être poursuivi tant que Ie bénéfice est supérieur au risque encouru.
Les preuves concernant les risques associés à l’utilisation d’un THS chez les femmes en ménopause précoce sont limitées. Cependant, en raison du faible risque absolu chez les femmes plus jeunes, le rapport bénéfice/risque peut être plus favorable chez ces femmes que chez les femmes plus âgées.
Examen clinique et surveillance
Avant de débuter ou de recommencer un THS, il est indispensable d'effectuer un examen clinique et gynécologique complet (incluant Ie recueil des antécédents médicaux personnels et familiaux), en tenant compte des contre-indications et précautions d'emploi. Pendant toute la durée du traitement, des examens réguliers sont recommandés, leur nature et leur fréquence étant adaptées à chaque patiente. Les femmes doivent être informées du type d'anomalies mammaires pouvant survenir sous traitement ; ces anomalies doivent être signalées au médecin traitant ou à l’infirmier/ère (voir paragraphe « Cancer du sein » ci-dessous). Les examens, incluant les outils d’imagerie appropriés, par exemple une mammographie, doivent être pratiqués selon les recommandations en vigueur, et adaptés à chaque patiente.
Conditions nécessitant une surveillance
Si l'une des conditions suivantes survient, est survenue précédemment, et/ou s'est aggravée au cours d'une grossesse ou d'un précédent traitement hormonal, la patiente devra être étroitement surveillée. Les conditions suivantes peuvent réapparaître ou s'aggraver au cours du traitement par KLIOGEST en particulier :
· léiomyome (fibrome utérin) ou endométriose,
· facteurs de risque thromboemboliques (voir ci-dessous),
· facteurs de risque de tumeurs estrogéno-dépendantes, par exemple : 1er degré d’hérédité pour le cancer du sein,
· hypertension artérielle,
· troubles hépatiques (par exemple : adénome hépatique),
· diabète avec ou sans atteinte vasculaire,
· lithiase biliaire,
· migraine ou céphalée (sévère),
· lupus érythémateux disséminé,
· antécédent d’hyperplasie endométriale (voir ci-dessous),
· épilepsie,
· asthme,
· otospongiose.
Arrêt immédiat du traitement
Le traitement doit être arrêté en cas de survenue d’une contre-indication ou dans les cas suivants :
· ictère ou altération de la fonction hépatique,
· augmentation significative de la pression artérielle,
· céphalée inhabituelle de type migraine,
· grossesse.
Hyperplasie endométriale et carcinome
Chez les femmes ayant un utérus intact, le risque d'hyperplasie et de carcinome endométriaux est augmenté en cas d'administration prolongée d'estrogènes seuls. Une augmentation du risque de cancer de l’endomètre a été rapportée chez les utilisatrices d’estrogènes seuls par rapport aux non-utilisatrices, de 2 à 12 fois en fonction de la durée de traitement et de la dose d’estrogène (voir rubrique 4.8). Après l’arrêt du traitement, le risque peut rester élevé pendant au moins 10 ans.
Chez les femmes non hystérectomisées, l’ajout d'un progestatif pendant au moins 12 jours par mois sur un cycle de 28 jours ou l’instauration d’une association estroprogestative continue prévient l’augmentation du risque associée à un traitement à base d’estrogènes seuls.
Des métrorragies et des spottings peuvent survenir au cours des premiers mois de traitement. Si ces évènements persistent après les premiers mois de traitement, débutent un certain temps après le début du traitement ou s’ils persistent après l'arrêt du traitement, leur cause doit être recherchée. Cette démarche peut nécessiter une biopsie endométriale afin d’exclure une pathologie maligne.
Cancer du sein
Les données disponibles montrent une augmentation du risque de cancer du sein chez les femmes prenant un traitement estroprogestatif ou chez celles prenant un THS à base d’estrogènes seuls, ce risque étant dépendant de la durée du traitement.
Traitement estro-progestatif combiné
L’essai randomisé contrôlé versus placebo Women’s Health Initiative study (WHI) et une méta-analyse des études épidémiologiques prospectives montrent tous deux une augmentation du risque de survenue de cancer du sein chez les femmes traitées par un THS estro-progestatif combiné, apparaissant au bout d’environ 3 (1-4) ans de traitement (voir rubrique 4.8).
Traitement par des estrogènes seuls
L’étude WHI n’a pas montré d’augmentation du risque de cancer du sein chez les femmes hystérectomisées traitées par estrogènes seuls. Les études observationnelles ont généralement rapporté une légère augmentation du risque de cancer du sein diagnostiqué, ce risque étant plus faible que chez les utilisatrices d’association estrogènes-progestatifs (voir rubrique 4.8).
Les résultats d’une importante méta-analyse ont montré qu’après avoir arrêté le traitement, le risque additionnel diminue dans le temps et la durée nécessaire pour qu’il revienne à la normale dépend de la durée de la prise du THS. Lorsqu’un THS a été suivi pendant plus de 5 ans, le risque peut perdurer 10 ans ou plus.
Les THS, en particulier les traitements estroprogestatifs combinés, augmentent la densité mammaire à la mammographie, ce qui pourrait gêner le diagnostic de cancer du sein.
Cancer de l’ovaire
Le cancer ovarien est beaucoup plus rare que le cancer du sein. Les données épidémiologiques provenant d'une importante méta-analyse suggèrent une légère augmentation du risque chez les femmes prenant un THS par estrogènes seuls ou par une combinaison d'estrogènes et de progestatifs, qui apparaît dans les cinq ans suivant le début de l'utilisation du produit et diminue progressivement après l'arrêt du traitement. D’autres études, y compris l’essai WHI (Women’s Health Initiative), suggèrent qu’un risque similaire ou légèrement inférieur peut être associé avec une utilisation de THS combinés (voir rubrique 4.8).
Thromboembolie veineuse
Le THS est associé à un risque de 1,3 à 3 fois plus élevé de survenue d’une thromboembolie veineuse (TEV), par exemple une thrombose veineuse profonde ou une embolie pulmonaire. La probabilité de survenue d’un tel évènement est plus élevée au cours de la première année d’utilisation du THS (voir rubrique 4.8).
Les patientes présentant un état thrombophilique connu ont un risque augmenté de TEV et la prise d’un THS pourrait augmenter ce risque. Les THS sont donc contre-indiqués chez ces patientes (voir rubrique 4.3).
Généralement, les facteurs de risque reconnus de TEV sont : utilisation d’estrogènes, âge élevé, intervention chirurgicale majeure, immobilisation prolongée, obésité (IMC > 30 kg/m²), grossesse/postpartum, lupus érythémateux disséminé (LED) et cancer. En revanche, il n’existe aucun consensus sur le rôle possible des varices sur le risque thromboembolique veineux.
Comme chez tous les patients en période postopératoire, des mesures prophylactiques doivent être appliquées pour prévenir une TEV après une intervention chirurgicale. Si une immobilisation prolongée doit suivre une intervention chirurgicale programmée, l’arrêt provisoire du THS, 4 à 6 semaines avant l’intervention, est recommandé. Le traitement ne doit pas être réintroduit avant que la patiente ait retrouvé toute sa mobilité.
Chez les femmes sans antécédent personnel de TEV mais ayant un parent du premier degré avec un antécédent de TEV à un âge jeune, un dépistage peut être proposé après avoir attentivement présenté ses limites (seules certaines anomalies thrombophiliques sont identifiées par dépistage).
Si une anomalie thrombophilique est identifiée, associée à une TEV chez des membres de la famille ou si le déficit est « sévère » (par exemple : déficit en antithrombine, en protéine S ou en protéine C, ou association de déficits), le THS est contre-indiqué.
Chez les femmes sous traitement anticoagulant chronique, le rapport bénéfice/risque de l’utilisation du THS doit être soigneusement évalué.
Si une TEV se développe après l’initiation du traitement, ce dernier devra être arrêté. Il devra être recommandé aux patientes de contacter immédiatement leur médecin en cas de symptômes évoquant un évènement thromboembolique (par exemple : gonflement douloureux d’une jambe, douleur soudaine dans la poitrine, dyspnée).
Maladie coronarienne
Les essais randomisés contrôlés n’ont pas mis en évidence de protection contre les infarctus du myocarde chez les femmes ayant ou non une maladie coronarienne et prenant une association estroprogestative ou un THS à base d’estrogènes seuls.
Le risque relatif de maladie coronarienne lors de l’utilisation d’une association estroprogestative est légèrement augmenté. Comme le risque absolu de base d’une maladie coronarienne est fortement dépendant de l’âge, le nombre de cas supplémentaires de maladie coronarienne liés à l’utilisation d’une association estroprogestative est très bas chez les femmes en bonne santé proches de la ménopause, mais augmente avec l’âge.
Accident vasculaire cérébral ischémique
L’utilisation d’une association estroprogestative ou d’un traitement à base d’estrogènes seuls est associée à une augmentation du risque d’accident vasculaire cérébral ischémique jusqu’à 1,5 fois. Le risque relatif ne change pas avec l’âge ou la durée de la ménopause. Cependant, comme le risque de base d’accident vasculaire cérébral est fortement dépendant de l’âge, le risque global d’accident vasculaire cérébral chez les femmes prenant un THS augmente avec l’âge (voir rubrique 4.8).
Hypothyroïdie
Les patientes nécessitant une hormonothérapie thyroïdienne substitutive doivent faire contrôler régulièrement leur fonction thyroïdienne pendant la prise du THS afin de s’assurer que les taux d’hormones thyroïdiennes restent dans une mesure acceptable.
Autres pathologies
Les estrogènes pouvant provoquer une rétention hydrique, les patientes présentant une anomalie rénale ou cardiaque doivent donc être étroitement surveillées.
Les femmes avec une hypertriglycéridémie préexistante doivent être étroitement surveillées pendant le traitement estrogénique substitutif ou pendant le traitement hormonal substitutif car de rares cas d’augmentation importante du taux plasmatique des triglycérides conduisant à une pancréatite ont été observés sous estrogénothérapie.
Les estrogènes exogènes peuvent provoquer ou aggraver les symptômes d’angiœdème héréditaire ou acquis.
Au cours du traitement par les estrogènes, une augmentation des taux plasmatiques de la TBG (thyroid binding globulin) est observée, conduisant à une élévation des taux plasmatiques des hormones thyroïdiennes totales mesurés par PBI (protein-bound iodine), de la T4 totale (mesurée sur colonne ou par RIA (radioimmunoassay)) et de la T3 totale (mesurée par RIA). La fixation de la T3 sur la résine est diminuée, reflétant l’augmentation de la TBG. Les concentrations des fractions libres de T4 et de T3 restent inchangées.
Les taux sériques d’autres protéines de liaison telles que la CBG (corticoid binding globulin) et la SHBG (sex-hormone binding globulin) peuvent être augmentés entraînant, respectivement, une augmentation des taux circulants de corticostéroïdes et de stéroïdes sexuels. Les concentrations des fractions libres ou biologiquement actives des hormones restent inchangées. D’autres protéines plasmatiques peuvent également être augmentées (angiotensinogène/substrat de la rénine, alpha-1-antitrypsine et céruloplasmine).
L’utilisation d’un THS n’améliore pas les fonctions cognitives. Des données suggèrent que le risque de probable démence est augmenté chez les femmes débutant une association estroprogestative continue ou un THS à base d’estrogènes seuls après 65 ans.
Augmentation des taux d’ALAT
Au cours des essais cliniques sur le traitement de l’infection par le virus de l’hépatite C (VHC) par l’association ombitasvir/paritaprévir/ritonavir avec et sans dasabuvir, les élévations du taux d’ALAT au-delà de 5 fois la limite supérieure de la normale (LSN) étaient significativement plus fréquentes chez les femmes utilisant des médicaments contenant de l’éthinylestradiol, tels que des CHC. Des élévations du taux d’ALAT ont également été observées chez les patientes traitées par glécaprévir/pibrentasvir utilisant des médicaments contenant de l’éthinylestradiol, tels que des CHC. Chez les femmes utilisant des médicaments contenant des estrogènes autres que l’éthinylestradiol, comme l’estradiol, la fréquence des élévations du taux d’ALAT était similaire à celle observée chez les femmes n’utilisant aucun estrogène ; cependant, étant donné le nombre limité de femmes prenant ces autres estrogènes, il convient d’être prudent en cas de co-administration avec l’association médicamenteuse ombitasvir/paritaprévir/ritonavir avec ou sans dasabuvir et avec le traitement par glécaprévir/pibrentasvir. Voir rubrique 4.5.
KLIOGEST contient du lactose monohydraté. Ce médicament ne doit pas être utilisé chez les patients présentant une intolérance au galactose, un déficit en lactase de Lapp ou un syndrome de malabsorption du glucose ou du galactose (maladies héréditaires rares).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Le métabolisme des estrogènes et des progestatifs peut être augmenté par l'utilisation concomitante de médicaments inducteurs enzymatiques, en particulier des enzymes du cytochrome P450, comme les anticonvulsivants (par exemple : phénobarbital, phénytoïne, carbamazépine) et les anti-infectieux (par exemple : rifampicine, rifabutine, névirapine, éfavirenz).
Le ritonavir, le télaprévir et Ie nelfinavir, bien que connus comme de puissants inhibiteurs enzymatiques, ont paradoxalement des propriétés inductrices quand ils sont utilisés de manière concomitante avec des hormones stéroïdiennes. Les préparations à base de plantes contenant du millepertuis (Hypericum perforatum) peuvent modifier Ie métabolisme des estrogènes et des progestatifs.
L'augmentation du métabolisme des estrogènes et des progestatifs peut conduire à une diminution de l'effet thérapeutique et à une modification du profil des saignements utérins.
Effet du THS à base d’estrogènes sur d’autres médicaments
Il a été démontré que les contraceptifs hormonaux contenant des estrogènes diminuent significativement les concentrations plasmatiques de lamotrigine lorsqu’ils sont administrés de façon concomitante, en raison de l’induction de la glucuronidation de la lamotrigine. Cela peut réduire le contrôle des crises. Bien que l’interaction potentielle entre le traitement hormonal substitutif et la lamotrigine n’ait pas été étudiée, on s’attend à ce qu’une interaction similaire existe, ce qui peut conduire à une réduction du contrôle des crises chez les femmes prenant les deux médicaments en association.
Interactions pharmacodynamiques
Au cours des essais cliniques sur le traitement de l’infection par le VHC par l’association médicamenteuse ombitasvir/paritaprévir/ritonavir avec et sans dasabuvir, les élévations du taux d’ALAT au-delà de 5 fois la limite supérieure de la normale (LSN) étaient significativement plus fréquentes chez les femmes utilisant des médicaments contenant de l’éthinylestradiol, tels que des CHC. Chez les femmes utilisant des médicaments contenant des estrogènes autres que l’éthinylestradiol, comme l’estradiol, la fréquence des élévations du taux d’ALAT était similaire à celle observée chez les femmes n’utilisant aucun estrogène ; cependant, étant donné le nombre limité de femmes prenant ces autres estrogènes, il convient d’être prudent en cas de co-administration avec l’association médicamenteuse ombitasvir/paritaprévir/ritonavir avec ou sans dasabuvir et avec le traitement par glécaprévir/pibrentasvir (voir rubrique 4.4).
Certaines analyses de laboratoire peuvent être modifiées par les traitements à base d’estrogènes, telles que les tests de tolérance au glucose ou de la fonction thyroïdienne.
Les médicaments inhibant l’activité des enzymes hépatiques microsomiales, comme le kétoconazole, peuvent augmenter les taux circulants des substances actives de KLIOGEST.
L’administration concomitante de ciclosporine peut entraîner une augmentation des taux sanguins de ciclosporine, de créatinine et des transaminases, suite à la diminution du métabolisme hépatique de la ciclosporine.
4.6. Fertilité, grossesse et allaitement
Grossesse
KLIOGEST n’est pas indiqué au cours de la grossesse.
La découverte d'une grossesse pendant le traitement par KLIOGEST impose l'arrêt immédiat du traitement.
Les données cliniques sur un nombre limité de grossesses exposées révèlent des effets indésirables de la noréthistérone sur le fœtus. À des doses supérieures à celles habituellement contenues dans les contraceptifs oraux et les THS, des cas de masculinisation de fœtus femelles ont été observés.
À ce jour, la plupart des études épidémiologiques n'ont pas mis en évidence d'effet tératogène ou fœtotoxique chez les femmes enceintes exposées par mégarde à des associations estroprogestatives.
KLIOGEST n’est pas indiqué au cours de l'allaitement.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
KLIOGEST n’a aucun effet connu sur l’aptitude à conduire des véhicules et à utiliser des machines.
Expérience clinique
Les effets indésirables le plus fréquemment rapportés au cours des essais cliniques réalisés avec KLIOGEST étaient des saignements vaginaux et des douleurs/tensions mammaires, rapportés chez environ 10 à 30 % des patientes. Les saignements vaginaux survenaient habituellement dans les premiers mois de traitement. Les douleurs mammaires disparaissaient en général après quelques mois de traitement. Tous les effets indésirables observés lors des essais cliniques randomisés, dont la fréquence était plus élevée chez les patientes traitées par KLIOGEST ou par un THS similaire, par rapport au placebo, et considérés comme probablement liés au traitement, sont présentés ci-dessous :
|
Classes de systèmes d’organes |
Très fréquents ≥ 1/10 |
Fréquents ≥ 1/100 ; < 1/10 |
Peu fréquents ≥ 1/1 000 ; < 1/100 |
Rares ≥ 1/10 000 ; < 1/1 000 |
|
Infections et infestations |
|
Candidose génitale ou vaginite, voir aussi « Affections des organes de reproduction et du sein » |
|
|
|
Affections du système immunitaire |
|
|
Hypersensibilité, voir aussi « Affections de la peau et du tissu sous-cutané » |
|
|
Troubles du métabolisme et de la nutrition |
|
Rétention hydrique, voir aussi « Troubles généraux et anomalies au site d’administration » |
|
|
|
Affections psychiatriques |
|
Dépression ou aggravation d’une dépression |
Nervosité |
|
|
Affections du système nerveux |
|
Céphalée, migraine ou aggravation d’une migraine |
|
|
|
Affections vasculaires |
|
|
Thrombophlébite superficielle |
Embolie pulmonaire Thrombophlébite profonde |
|
Affections gastro-intestinales |
|
Nausées Douleur abdominale, gonflement ou gêne abdominale |
Flatulence ou ballonnement |
|
|
Affections de la peau et du tissu sous-cutané |
|
|
Alopécie, hirsutisme ou acné Prurit ou urticaire |
|
|
Affections musculo-squelettiques et systémiques |
|
Douleur dorsale Crampes aux membres inférieurs |
|
|
|
Affections des organes de reproduction et du sein |
Douleur ou tension mammaire Hémorragie vaginale |
Œdème mammaire ou hypertrophie mammaire Apparition, réapparition ou aggravation de fibromes utérins |
|
|
|
Troubles généraux et anomalies au site d’administration |
|
Œdème périphérique |
Inefficacité du médicament |
|
|
Investigations |
|
Prise de poids |
|
|
Expérience après commercialisation
En plus des évènements précédemment mentionnés, les effets indésirables présentés ci-dessous ont été rapportés spontanément et sont considérés comme probablement liés à KLIOGEST. La fréquence de ces effets indésirables spontanés est très rare (< 1/10 000, fréquence indéterminée (ne peut être estimée sur la base des données disponibles)). Le recueil des effets indésirables après commercialisation est susceptible d’être sous-évalué particulièrement en ce qui concerne les effets indésirables bien connus. Les fréquences présentées doivent donc être interprétées dans ce contexte :
· tumeurs bénignes et malignes (incluant kystes et polypes) : cancer de l’endomètre,
· affections du système immunitaire : réactions d’hypersensibilité généralisée (par exemple : réaction/choc anaphylactique),
· affections psychiatriques : insomnie, anxiété, augmentation ou diminution de la libido,
· affections du système nerveux : vertiges, accident vasculaire cérébral,
· affections oculaires : troubles visuels,
· affections vasculaires : aggravation de l’hypertension artérielle,
· affections cardiaques : infarctus du myocarde,
· affections gastro-intestinales : dyspepsie, vomissement,
· affections hépatobiliaires : maladie de la vésicule biliaire, lithiase biliaire, aggravation de lithiase biliaire, récidive d’une lithiase biliaire,
· affections de la peau et du tissu sous-cutané : séborrhée, rash, œdème angioneurotique,
· affection des organes de reproduction et du sein : hyperplasie endométriale, prurit vulvovaginal,
· investigations : perte de poids, augmentation de la pression artérielle.
D’autres effets indésirables ont été rapportés lors de l’administration d’un traitement estroprogestatif :
· affections de la peau et du tissu sous-cutané : chloasma, érythème polymorphe, érythème noueux, purpura vasculaire
· probable démence après 65 ans (voir rubrique 4.4)
· sécheresse oculaire
· changements de la composition du film lacrymal.
Risque de cancer du sein
Un risque multiplié jusqu’à 2 de diagnostiquer un cancer du sein a été rapporté chez les femmes prenant une association estroprogestative pendant plus de 5 ans.
L’augmentation du risque est plus faible chez les utilisatrices d’estrogènes seuls comparativement aux utilisatrices d’associations estroprogestatives.
Le niveau de risque est dépendant de la durée d’utilisation (voir rubrique 4.4).
Les estimations du risque absolu basées sur les résultats de la plus grande étude randomisée contrôlée versus placebo (l’étude WHI) et de la plus grande méta-analyse des études épidémiologiques prospectives sont présentées ci-après :
Plus importante méta-analyse d’études épidémiologiques prospectives
Estimation du risque additionnel de cancer du sein après 5 ans de traitement chez des femmes ayant un IMC de 27 (kg/m2)
|
Âge au début du THS (ans) |
Incidence pour 1 000 femmes non utilisatrices de THS sur une période de 5 ans (50-54 ans)* |
Risque relatif |
Nombre de cas supplémentaires pour 1 000 utilisatrices de THS après 5 ans |
|
THS à base d’estrogènes seuls |
|||
|
50 |
13,3 |
1,2 |
2,7 |
|
Association estroprogestative |
|||
|
50 |
13,3 |
1,6 |
8,0 |
*Issu des taux d’incidence de base en Angleterre en 2015 chez des femmes ayant un IMC de 27 (kg/m2).
Remarque : étant donné que l’incidence de base du cancer du sein diffère selon les pays de l’UE, le nombre de cas supplémentaires de cancer du sein variera proportionnellement.
Estimation du risque additionnel de cancer du sein après 10 ans de traitement chez des femmes ayant un IMC de 27 (kg/m2)
|
Âge au début du THS (ans) |
Incidence pour 1 000 femmes non utilisatrices de THS sur une période de 10 ans (50-59 ans)* |
Risque relatif |
Nombre de cas supplémentaires pour 1 000 utilisatrices de THS après 10 ans |
|
THS à base d’estrogènes seuls |
|||
|
50 |
26,6 |
1,3 |
7,1 |
|
Association estroprogestative |
|||
|
50 |
26,6 |
1,8 |
20,8 |
*Issu des taux d’incidence de base en Angleterre en 2015 chez des femmes ayant un IMC de 27 (kg/m2).
Remarque : étant donné que l’incidence de base du cancer du sein diffère selon les pays de l’UE, le nombre de cas supplémentaires de cancer du sein variera proportionnellement.
Études américaines WHI – Risque supplémentaire de cancer du sein après 5 ans d’utilisation
|
Tranche d’âge (ans) |
Incidence pour 1 000 femmes dans le groupe placebo sur 5 ans |
Risque relatif et IC 95 % |
Cas supplémentaires pour 1 000 utilisatrices de THS sur 5 ans (IC 95 %) |
|
Estrogènes conjugués équins seuls |
|||
|
50-79 |
21 |
0,8 (0,7-1,0) |
-4 (-6-0)* |
|
Association d’estrogènes conjugués équins et de médroxyprogestérone** |
|||
|
50-79 |
17 |
1,2 (1,0-1,5) |
+4 (0-9) |
*Étude WHI chez les femmes sans utérus n’ayant pas montré d’augmentation du risque de cancer du sein.
**Lorsque l’analyse était restreinte aux femmes n’ayant pas pris de THS avant l’étude, il n’y avait pas d’augmentation du risque pendant les 5 premières années de traitement. Après 5 ans, le risque était supérieur aux non-utilisatrices.
Risque de cancer de l’endomètre
Le risque de cancer de l’endomètre est d’environ 5 pour 1 000 femmes ayant un utérus intact et n’utilisant pas de THS.
Chez les femmes ayant un utérus intact, l’utilisation d’un THS à base d’estrogènes seuls n’est pas recommandée car cela augmente le risque de cancer de l’endomètre (voir rubrique 4.4).
Dans les études épidémiologiques, l’augmentation du risque de cancer de l’endomètre dépendait de la durée de traitement à base d’estrogènes seuls et de la dose d’estrogène et variait entre 5 et 55 cas supplémentaires diagnostiqués pour 1 000 femmes âgées de 50 à 65 ans.
L’ajout d’un progestatif au traitement par estrogènes seuls pendant au moins 12 jours par cycle peut éviter cette augmentation du risque. Dans l’étude « Million Women Study », l’utilisation pendant 5 ans d’un THS combiné (séquentiel ou continu) n’a pas augmenté le risque de cancer de l’endomètre (RR de 1,0 (0,8-1,2)).
Risque de cancer ovarien
L’utilisation d’un THS par estrogènes seuls ou par une combinaison d’estrogènes et de progestatifs a été associée à une légère augmentation du risque de cancer ovarien diagnostiqué (voir rubrique 4.4).
Une méta-analyse portant sur 52 études épidémiologiques a signalé un risque accru de cancer ovarien chez les femmes prenant actuellement un THS par rapport aux femmes n'en ayant jamais pris (RR 1,43, IC 95 % 1,31-1,56). Chez les femmes âgées de 50 à 54 ans, prendre un THS pendant cinq ans entraîne l'apparition d'un cas supplémentaire pour 2 000 utilisatrices. Chez les femmes âgées entre 50 à 54 ans qui ne prennent pas de THS, un diagnostic de cancer ovarien sera posé chez environ 2 femmes sur 2 000 sur une période de cinq ans.
Risque de thromboembolie veineuse
Le THS est associé à une augmentation de 1,3 à 3 fois du risque relatif de survenue d’une thromboembolie veineuse (TEV), c’est-à-dire thrombose veineuse profonde ou embolie pulmonaire. La probabilité de survenue d’un tel évènement est plus élevée au cours de la première année d’utilisation du THS (voir rubrique 4.4). Les résultats des études WHI sont présentés ci-dessous :
Études WHI – Risque supplémentaire de TEV sur une période d’utilisation de 5 ans
|
Tranche d’âge (ans) |
Incidence pour 1 000 femmes dans le groupe placebo sur 5 ans |
Risque relatif et IC 95 % |
Cas supplémentaires pour 1 000 utilisatrices de THS sur 5 ans (IC 95 %) |
|
Estrogènes seuls par voie orale* |
|||
|
50-59 |
7 |
1,2 (0,6-2,4) |
1 (-3-10) |
|
Association estroprogestative par voie orale |
|||
|
50-59 |
4 |
2,3 (1,2-4,3) |
5 (1-13) |
*Étude chez les femmes sans utérus.
Risque de maladie coronarienne
Le risque de développer une maladie coronarienne est légèrement augmenté chez les utilisatrices d’une association estroprogestative après 60 ans (voir rubrique 4.4).
Risque d’accident vasculaire cérébral ischémique
L’utilisation d’une association estroprogestative ou d’un traitement à base d’estrogènes seuls est associée à une augmentation du risque relatif d’accident vasculaire cérébral ischémique jusqu’à 1,5 fois. Le risque d’accident vasculaire cérébral hémorragique n’est pas augmenté lors de l’utilisation d’un THS.
Le risque relatif ne dépend pas de l’âge ou de la durée du traitement, mais le risque de base de survenue d’un accident vasculaire cérébral est fortement dépendant de l’âge. Le risque global d’accident vasculaire cérébral chez les femmes prenant un THS augmente avec l’âge (voir rubrique 4.4).
Études WHI combinées – Risque supplémentaire d’accident vasculaire cérébral ischémique* sur une période d’utilisation de 5 ans
|
Tranche d’âge (ans) |
Incidence pour 1 000 femmes dans le groupe placebo sur une période de 5 ans |
Risque relatif et IC 95 % |
Cas supplémentaires pour 1 000 utilisatrices de THS sur 5 ans (IC 95 %) |
|
50-59 |
8 |
1,3 (1,1-1,6) |
3 (1-5) |
*Sans distinction entre les accidents vasculaires cérébraux ischémiques et hémorragiques.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Les symptômes d’un surdosage en estrogènes oraux sont une tension mammaire, des nausées, des vomissements et/ou des métrorragies. Un surdosage en progestatifs peut entraîner une humeur dépressive, de la fatigue, de l’acné et de l’hirsutisme. Le traitement doit être symptomatique.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : progestatifs et estrogènes en association fixe, code ATC : G03FA01.
Estradiol
Le principe actif, 17 β-estradiol de synthèse, est chimiquement et biologiquement identique à l’estradiol endogène humain. Il remplace l’arrêt de production des estrogènes chez les femmes ménopausées et soulage les symptômes climatériques de la ménopause.
Les estrogènes préviennent la perte osseuse liée à la ménopause ou à une ovariectomie.
Acétate de noréthistérone
Progestatif de synthèse ayant des effets similaires à ceux de la progestérone, hormone sexuelle féminine naturelle. Les estrogènes stimulent la croissance de l’endomètre et majorent le risque d’hyperplasie et de cancer de l’endomètre. L’association d’un progestatif chez les femmes non hystérectomisées entraîne une réduction du risque d’hyperplasie de l’endomètre induit par les estrogènes.
Informations sur les études cliniques
· Soulagement des symptômes liés au déficit estrogénique
Le soulagement des symptômes de la ménopause survient au cours des premières semaines de traitement.
KLIOGEST est un THS combiné continu prescrit dans le but d’éviter les hémorragies de privation régulières normalement associées à un THS cyclique ou séquentiel. Au cours du 10ème au 12ème mois de traitement, environ 94 % des femmes ont présenté une aménorrhée (pas de saignement ni de spotting). Des saignements et/ou des spottings sont apparus chez 30 % des femmes traitées au cours des trois premiers mois de traitement et 6 % au cours du 10ème au 12ème mois de traitement.
· Prévention de l’ostéoporose
Le déficit en estrogènes à la ménopause est associé à un renouvellement osseux accru et une diminution de la masse osseuse. L’effet des estrogènes sur la densité minérale osseuse est dose-dépendant. La protection est efficace tout au long du traitement. A l’arrêt du THS, la perte osseuse reprend au même rythme que chez les femmes non traitées.
Les résultats de l'essai WHI et d'une méta-analyse de plusieurs essais montrent que l'utilisation d'un traitement estrogénique substitutif, seul ou en association à un progestatif - principalement chez des femmes en bonne santé - diminue le risque de fractures de la hanche, des vertèbres et d'autres fractures ostéoporotiques. Des données limitées suggèrent que les THS pourraient également prévenir des fractures chez des femmes ayant une faible densité minérale osseuse et/ou une ostéoporose établie.
Les effets de KLIOGEST sur la densité minérale osseuse de femmes ménopausées ont été étudiés sur 2 ans, dans un essai clinique randomisé, en double aveugle, comparatif versus placebo (n = 327 dans un essai incluant 48 sous KLIOGEST). L’ensemble des femmes incluses recevaient une substitution calcique à des doses quotidiennes de 1 000 mg. Comparé aux femmes traitées par le placebo, KLIOGEST a diminué de façon significative la perte osseuse au niveau du rachis lombaire, de la hanche, du radius distal et de l’ensemble du squelette. Dans les cas de ménopause récente (1 à 5 ans après les dernières règles), après 2 ans de traitement par KLIOGEST, l’augmentation de la densité minérale osseuse par rapport à la valeur de base aux niveaux du rachis lombaire, de la tête fémorale et du trochanter fémoral était respectivement de 5,4 ± 0,7 %, 2,9 ± 0,8 % et 5,0 ± 0,9 %. La densité minérale osseuse est restée identique ou a augmenté chez 91 % des femmes sous KLIOGEST après deux ans de traitement.
5.2. Propriétés pharmacocinétiques
Après l’administration orale de 17 β-estradiol sous forme micronisée, l’absorption au niveau du tractus gastro-intestinal est rapide. Il subit un important effet de premier passage hépatique et des autres organes entériques. Après administration d’une dose unique de 1 mg d’un comprimé de KLIOGEST, un pic de concentration plasmatique d’environ 44 pg/ml (161 pmol/l) (entre 30 et 53 pg/ml (entre 110 et 194 pmol/l)), est atteint en 6 heures. La demi-vie du 17 β-estradiol est d’environ 18 heures. Il circule lié à la SHBG (37 %) et à l’albumine (61 %), alors qu’environ 1-2 % sont sous forme non liée. Le métabolisme du 17 β-estradiol s’effectue principalement dans le foie et l’intestin, mais également dans les organes cibles et il implique la formation de métabolites moins actifs ou inactifs, en particulier l’estrone, les catécholestrogènes et plusieurs sulfates et glycuronides d’estrogènes. Les estrogènes sont excrétés avec la bile, où ils sont hydrolysés et réabsorbés (circulation entéro-hépatique), et principalement éliminés dans les urines sous forme biologiquement inactive.
Après administration orale, l’acétate de noréthistérone est rapidement absorbé et transformé en noréthistérone (NET). Il subit un métabolisme de premier passage hépatique et des autres organes entériques. Après administration d’une dose unique de 1 mg, le pic de concentration plasmatique d’environ 9 ng/ml (30 nmol/l) (entre 6 et 11 ng/ml (entre 20 et 37 nmol/l)) est atteint en 1 heure. La demi-vie terminale de la NET est d’environ 10 heures. La NET se lie à la SHBG (36 %) et à l'albumine (61 %). Les principaux métabolites sont les isomères de la 5α-dihydro-NET et de la tétrahydro-NET, qui sont principalement éliminés dans les urines sous forme de dérivés sulfo- ou glucurono-conjugués.
La pharmacocinétique de l’estradiol n’est pas influencée par l’acétate de noréthistérone.
Les propriétés pharmacocinétiques chez les personnes âgées n’ont pas été étudiées.
5.3. Données de sécurité préclinique
Les profils de toxicité de l’estradiol et de l’acétate de noréthistérone sont bien connus.
Toutes les données de sécurité préclinique utiles pour le prescripteur sont incluses dans les autres rubriques du RCP.
Lactose monohydraté, amidon de maïs, hydroxypropylcellulose, talc, stéarate de magnésium.
Pelliculage blanc : hypromellose, triacétine, talc.
4 ans.
6.4. Précautions particulières de conservation
À conserver à une température ne dépassant pas 25°C.
Ne pas mettre au réfrigérateur.
Conserver le distributeur journalier dans l’emballage extérieur, à l’abri de la lumière.
6.5. Nature et contenu de l'emballage extérieur
1 distributeur journalier de 28 comprimés ou 3 distributeurs journaliers de 28 comprimés.
Le distributeur journalier de 28 comprimés comprend 3 parties :
· un fond en polypropylène coloré opaque
· un couvercle circulaire en polystyrène transparent
· un cadran central en polystyrène coloré opaque.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
10-12 COURS MICHELET
92800 PUTEAUX
FRANCE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· CIP 34009 331 455 5 2 : distributeur journalier de 28 comprimés
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 07/12/2023
estradiol/acétate de noréthistérone
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que KLIOGEST, comprimé pelliculé et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre KLIOGEST, comprimé pelliculé ?
3. Comment prendre KLIOGEST, comprimé pelliculé ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver KLIOGEST, comprimé pelliculé ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE KLIOGEST, comprimé pelliculé ET DANS QUELS CAS EST-IL UTILISE ?
KLIOGEST appartient à la classe des traitements hormonaux substitutifs (THS) combinés continus, il doit donc être pris tous les jours sans interruption. KLIOGEST est utilisé chez les femmes ménopausées dont les dernières règles remontent à plus d’un an.
Les comprimés contiennent deux hormones : l’estradiol 2 mg (estrogène identique à celui fabriqué par les ovaires) et l’acétate de noréthistérone 1 mg (progestatif qui agit de façon similaire à la progestérone fabriquée par le corps humain).
KLIOGEST est utilisé pour :
Le soulagement des symptômes survenant après la ménopause
Durant la ménopause, la quantité d’estrogènes produits par le corps de la femme diminue. Cette diminution peut provoquer certains symptômes tels que des sensations de chaleur au niveau du visage, du cou et de la poitrine (« bouffées de chaleur »). KLIOGEST soulage ces symptômes après la ménopause. KLIOGEST ne vous sera prescrit que si vos symptômes altèrent votre vie quotidienne de manière importante.
La prévention de l’ostéoporose
Après la ménopause, certaines femmes peuvent développer une fragilité des os (ostéoporose). Vous devez discuter de toutes les éventualités de traitement avec votre médecin.
Si vous présentez un risque accru de fractures dues à l’ostéoporose et que les autres médicaments ne vous conviennent pas, vous pouvez utiliser KLIOGEST pour la prévention de l’ostéoporose après la ménopause.
KLIOGEST est destiné aux femmes qui ont un utérus intact et qui sont ménopausées depuis plus d’un an.
L'expérience de ce traitement chez les femmes âgées de plus de 65 ans est limitée.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE KLIOGEST, comprimé pelliculé ?
Antécédents médicaux et examens réguliers
L’utilisation d’un traitement hormonal substitutif comporte des risques qui doivent être pris en considération lors de l’initiation du traitement ou lors de la poursuite du traitement.
L’expérience chez les femmes traitées ayant une ménopause précoce (due à une insuffisance ovarienne ou une chirurgie) est limitée. Si vous avez une ménopause précoce, les risques d’utilisation d’un traitement hormonal substitutif peuvent être différents. Parlez-en à votre médecin.
Avant de commencer (ou recommencer) à prendre un traitement hormonal substitutif (THS), votre médecin vous interrogera sur vos antécédents médicaux personnels et familiaux. Votre médecin peut décider de faire un examen clinique. Celui-ci peut inclure l’examen de vos seins et/ou un examen gynécologique, si nécessaire.
Dès que vous commencez KLIOGEST, vous devez consulter votre médecin pour des examens réguliers (au moins une fois par an). Lors de ces examens médicaux, parlez à votre médecin des bénéfices et des risques encourus si vous continuez à prendre KLIOGEST.
Faites régulièrement une mammographie, tel que recommandé par votre médecin.
Ne prenez jamais KLIOGEST, comprimé pelliculé :
Si l’une des situations suivantes s’applique à votre cas, si vous n’êtes pas sûre concernant l’un des points ci-dessous, parlez-en à votre médecin avant de prendre KLIOGEST.
Ne prenez jamais KLIOGEST :
· si vous avez, avez eu ou si vous pensez avoir un cancer du sein.
· si vous avez, avez eu ou si vous pensez avoir un cancer de la paroi de l’utérus (cancer de l’endomètre) ou un cancer estrogéno-dépendant.
· si vous avez des saignements vaginaux inexpliqués.
· si vous avez un épaississement excessif de la muqueuse utérine (hyperplasie endométriale) qui n’est pas traité.
· si vous avez ou avez eu un caillot sanguin dans une veine (thromboembolie veineuse), dans la jambe (thrombose veineuse profonde) ou dans les poumons (embolie pulmonaire)
· si vous avez un trouble de la coagulation sanguine (tel qu’un déficit en protéine C, en protéine S ou en antithrombine).
· si vous avez ou avez précédemment eu une maladie causée par des caillots sanguins dans les artères, telle qu’une crise cardiaque, un accident vasculaire cérébral ou une angine de poitrine.
· si vous avez ou avez eu une maladie du foie et que vos analyses hépatiques ne sont pas revenues aux valeurs normales.
· si vous avez une maladie rare du sang appelée « porphyrie » qui est transmise dans une même famille (héréditaire).
· si vous êtes allergique (hypersensible) à l’estradiol, à l’acétate de noréthistérone ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Si l’une de ces situations survient pour la première fois lors de la prise de KLIOGEST, arrêtez de prendre KLIOGEST et consultez immédiatement votre médecin.
Avertissements et précautions
Avant de commencer le traitement, prévenez votre médecin si vous avez déjà eu un des problèmes suivants, car ils pourraient récidiver ou s’aggraver au cours du traitement par KLIOGEST. Si tel est le cas, vous devrez consulter votre médecin plus souvent pour des examens de contrôle :
· fibrome dans votre utérus,
· développement de la muqueuse utérine en dehors de votre utérus (endométriose) ou un antécédent de développement excessif de la muqueuse utérine (hyperplasie endométriale),
· risque plus élevé de développer des caillots sanguins (voir « Caillots sanguins dans une veine (thromboembolie veineuse) »)
· risque plus élevé de développer un cancer sensible aux estrogènes (par exemple, si votre mère, votre sœur ou votre grand-mère a développé un cancer du sein),
· pression artérielle élevée,
· troubles hépatiques comme une tumeur bénigne du foie,
· diabète,
· calculs biliaires,
· migraine ou maux de tête sévères,
· une maladie du système immunitaire qui affecte plusieurs organes du corps (lupus érythémateux disséminé, LED),
· épilepsie,
· asthme,
· une maladie affectant le tympan et l’audition (otospongiose),
· un taux très élevé de lipides dans votre sang (triglycérides),
· une rétention d’eau due à des problèmes cardiaques ou rénaux,
· angiœdème héréditaire ou acquis,
· maladie au cours de laquelle votre thyroïde n’arrive pas à produire assez d’hormones thyroïdiennes (hypothyroïdie) et vous êtes traitée avec une hormonothérapie thyroïdienne substitutive,
· intolérance au lactose.
Arrêtez de prendre KLIOGEST et consultez immédiatement un médecin
Si vous remarquez l’une des situations suivantes lorsque vous prenez un traitement hormonal substitutif :
· l’une des conditions mentionnées dans la rubrique « Ne prenez jamais KLIOGEST »,
· jaunissement de votre peau ou du blanc de vos yeux (jaunisse). Cela peut être le signe d’une maladie du foie,
· gonflement du visage, de la langue et/ou de la gorge et/ou difficultés à déglutir ou urticaire, associés à des difficultés à respirer, qui suggèrent un angiœdème,
· une forte augmentation de votre pression artérielle (les symptômes peuvent être : mal de tête, fatigue, vertiges),
· maux de tête de type migraines qui apparaissent pour la première fois,
· si vous êtes enceinte,
· si vous remarquez des signes de caillots sanguins, tels que :
o gonflement douloureux et rougeur des jambes
o douleur soudaine dans la poitrine
o difficultés pour respirer.
Pour plus d’informations, voir « Caillots sanguins dans une veine (thromboembolie veineuse) ».
Remarque : KLIOGEST n’est pas un contraceptif. Si vos dernières règles remontent à moins de 12 mois ou si vous avez moins de 50 ans, vous pourriez encore avoir besoin d’une contraception supplémentaire afin de ne pas être enceinte. Demandez conseil à votre médecin.
THS et cancer
Épaississement excessif de la muqueuse utérine (hyperplasie endométriale) et cancer de la muqueuse utérine (cancer de l’endomètre)
La prise d’un THS à base d’estrogènes seuls augmente le risque d’épaississement excessif de la muqueuse utérine (hyperplasie endométriale) et de cancer de la muqueuse utérine (cancer de l’endomètre).
Le progestatif contenu dans KLIOGEST vous protège contre ce risque supplémentaire.
Comparaison
Chez les femmes ayant un utérus intact et ne prenant pas de THS, on estime qu’en moyenne 5 pour 1 000 auront un cancer de l’endomètre diagnostiqué entre 50 et 65 ans.
Chez les femmes entre 50 et 65 ans, ayant un utérus intact et prenant un THS à base d’estrogènes seuls, on estime qu’entre 10 et 60 pour 1 000 utilisatrices (c’est-à-dire entre 5 et 55 cas supplémentaires) auront un cancer de l’endomètre diagnostiqué, en fonction de la dose et de la durée d’utilisation.
Saignements irréguliers
Vous pouvez avoir des saignements irréguliers ou des gouttes de sang (« spottings ») pendant les premiers 3 à 6 mois où vous prenez KLIOGEST. Cependant, si les saignements irréguliers :
· continuent après les 6 premiers mois d’utilisation,
· commencent alors que vous prenez KLIOGEST depuis plus de 6 mois,
· continuent alors que vous avez arrêté de prendre KLIOGEST,
Consultez votre médecin dès que possible.
Cancer du sein
Les données montrent une augmentation du risque de cancer du sein chez les femmes prenant une association estroprogestative ou chez les femmes prenant un traitement hormonal substitutif (THS) à base d’estrogènes seuls. Cette augmentation du risque dépend de la durée de suivi du THS. L’augmentation du risque devient significative au bout de 3 ans d’utilisation. Après avoir arrêté le THS, le risque supplémentaire diminuera avec le temps, mais pourra perdurer 10 ans ou plus si vous avez suivi un THS pendant plus de 5 ans.
Comparaison
Chez les femmes âgées de 50 à 54 ans qui ne prennent pas de THS, on estime qu’en moyenne 13 à 17 sur 1 000 auront un cancer du sein diagnostiqué sur une période de 5 ans.
Chez les femmes âgées de 50 ans qui débutent un THS à base d'estrogènes seuls pendant 5 ans, on dénombrera 16 à 17 cas sur 1 000 utilisatrices (soit 0 à 3 cas supplémentaires).
Chez les femmes âgées de 50 ans qui débutent un THS estroprogestatif pendant 5 ans, on dénombrera 21 cas sur 1 000 utilisatrices (soit 4 à 8 cas supplémentaires).
Chez les femmes âgées de 50 à 59 ans qui ne prennent pas de THS, un diagnostic de cancer du sein sera posé, en moyenne, chez environ 27 femmes sur 1 000 après une période de dix ans.
Chez les femmes âgées de 50 ans qui débutent un THS à base d’estrogènes seuls pendant 10 ans, on dénombrera 34 cas sur 1 000 utilisatrices (soit 7 cas supplémentaires).
Chez les femmes âgées de 50 ans qui débutent un THS estroprogestatif pendant 10 ans, on dénombrera 48 cas sur 1 000 utilisatrices (soit 21 cas supplémentaires).
Contrôlez régulièrement vos seins. Consultez votre médecin si vous remarquez un changement tel que :
· creux dans la peau,
· modifications du mamelon,
· grosseur que vous pourriez voir ou sentir.
Par ailleurs, il vous est conseillé de prendre part aux programmes de mammographie de dépistage qui pourront vous être proposés. Lors des mammographies de dépistage, il est important que vous indiquiez au personnel infirmier/professionnel de santé réalisant la radiographie que vous utilisez un THS car ce traitement peut augmenter la densité de vos seins, ce qui peut affecter les résultats de la mammographie. Lorsque la densité du sein est augmentée, la mammographie peut ne pas détecter toutes les grosseurs.
Cancer ovarien
Le cancer de l’ovaire est rare (beaucoup plus rare que le cancer du sein). L’utilisation d’un THS par estrogènes seuls ou par une combinaison d’estrogènes et de progestatifs a été associée à une légère augmentation du risque de cancer ovarien.
Le risque de cancer ovarien varie en fonction de l’âge. Par exemple, chez les femmes âgées entre 50 et 54 ans qui ne prennent pas de THS, un diagnostic de cancer ovarien sera posé chez 2 femmes sur 2 000 en moyenne sur une période de 5 ans. Chez les femmes ayant pris un THS pendant 5 ans, il y aura environ 3 cas sur 2 000 utilisatrices (soit environ un cas supplémentaire).
Effet du THS sur le cœur et la circulation sanguine
Caillots sanguins dans une veine (thromboembolie veineuse)
Le risque de caillots sanguins dans les veines est multiplié par environ 1,3 à 3 chez les utilisatrices de THS par rapport aux non-utilisatrices, en particulier au cours de la première année de traitement.
Les caillots sanguins peuvent être graves et si l’un d’entre eux atteint les poumons, il peut provoquer une douleur dans la poitrine, un essoufflement, un évanouissement ou même la mort.
Vous avez plus de risques d’avoir un caillot sanguin dans vos veines si vous êtes âgée ou si vous êtes dans l’une des situations suivantes. Informez votre médecin si vous êtes dans l’une des situations suivantes :
· vous ne pouvez pas marcher pendant une longue période à cause d’une opération chirurgicale majeure, d’une blessure ou d’une maladie (voir rubrique 3 « Si vous devez subir une chirurgie »)
· vous êtes en surpoids sévère (IMC > 30 kg/m²)
· vous avez un problème de coagulation nécessitant un traitement à long terme avec un médicament destiné à la prévention des caillots sanguins
· l’un de vos proches a déjà eu un caillot sanguin dans une jambe, un poumon ou un autre organe
· vous avez un lupus érythémateux disséminé (LED)
· vous avez un cancer.
Concernant les symptômes d’un caillot sanguin, voir « Arrêtez de prendre KLIOGEST et consultez immédiatement un médecin ».
Comparaison
Chez les femmes âgées d’une cinquantaine d’années et ne prenant pas de THS, on estime que sur une période de 5 ans, en moyenne 4 à 7 pour 1 000 pourraient avoir un caillot sanguin dans une veine.
Chez les femmes âgées d’une cinquantaine d’années et prenant un THS estroprogestatif depuis 5 ans, il y aura 9 à 12 cas pour 1 000 utilisatrices (c’est-à-dire 5 cas supplémentaires).
Maladie cardiaque (crise cardiaque)
Il n’a pas été mis en évidence qu’un THS puisse prévenir les crises cardiaques.
Les femmes de plus de 60 ans utilisant un THS estroprogestatif ont un risque légèrement augmenté de développer une maladie cardiaque par rapport aux non-utilisatrices de THS.
Accident vasculaire cérébral (AVC)
Chez les utilisatrices d’un THS, le risque d’accident vasculaire cérébral est augmenté d’environ 1,5 fois par rapport aux non-utilisatrices. Le nombre de cas supplémentaires d’accident vasculaire cérébral dû à l’utilisation d’un THS augmente avec l’âge.
Comparaison
Chez les femmes âgées d’une cinquantaine d’années et ne prenant pas de THS, on estime qu’environ 8 pour 1 000 pourraient avoir un accident vasculaire cérébral sur une période de 5 ans.
Chez les femmes âgées d’une cinquantaine d’années et prenant un THS, il y aura 11 cas pour 1 000 utilisatrices sur une période de 5 ans (c’est-à-dire 3 cas supplémentaires).
Autres maladies
Le THS ne prévient pas la perte de mémoire. Le risque de perte de mémoire pourrait être augmenté chez les femmes qui débutent un THS après 65 ans. Demandez conseil à votre médecin.
Enfants et adolescents
Sans objet.
Autres médicaments et KLIOGEST, comprimé pelliculé
Certains médicaments peuvent interagir avec l’effet de KLIOGEST et entraîner des saignements irréguliers. Cela concerne les médicaments suivants :
· Médicaments pour le traitement de l’épilepsie (comme le phénobarbital, la phénytoïne et la carbamazépine)
· Médicaments pour le traitement de la tuberculose (comme la rifampicine et la rifabutine)
· Médicaments pour le traitement de l’infection au VIH (comme la névirapine, l’éfavirenz, le ritonavir et le nelfinavir)
· Préparations à base de plantes contenant du millepertuis (Hypericum perforatum).
Le THS peut modifier le mode d’action de certains autres médicaments :
· Un médicament contre l’épilepsie (lamotrigine), car il pourrait augmenter la fréquence des crises
· Médicaments utilisés dans le traitement de l’infection par le virus de l’hépatite C (VHC) (tels que l’association ombitasvir/paritaprévir/ritonavir avec ou sans dasabuvir, et le glécaprévir/pibrentasvir), peut entraîner une augmentation de certains paramètres du fonctionnement du foie (augmentation du taux d’ALAT, une enzyme du foie) chez les femmes utilisant des contraceptifs contenant de l’éthinylestradiol. KLIOGEST contient de l’estradiol à la place de l’éthinylestradiol. On ne sait pas si une augmentation du taux d’ALAT peut se produire lors de l’utilisation de KLIOGEST avec cette association contre le VHC.
D’autres médicaments peuvent augmenter les effets de KLIOGEST :
· Médicaments contenant du kétoconazole (fongicide).
KLIOGEST peut avoir un effet sur un traitement concomitant avec de la ciclosporine.
Informez votre médecin ou votre pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament, y compris un médicament obtenu sans ordonnance, un médicament à base de plantes ou tout autre produit naturel. Votre médecin vous conseillera.
Analyses du sang
Si vous devez subir un examen sanguin, dites à votre médecin ou au personnel du laboratoire que vous prenez KLIOGEST car ce médicament peut modifier les résultats de certaines analyses.
KLIOGEST, comprimé pelliculé avec des aliments et boissons
Les comprimés peuvent être pris avec ou sans aliments et boissons.
Grossesse et allaitement
Grossesse : KLIOGEST est indiqué uniquement chez les femmes ménopausées. Si vous découvrez que vous êtes enceinte, arrêtez de prendre KLIOGEST et contactez votre médecin.
Allaitement : vous ne devez pas prendre KLIOGEST si vous allaitez.
Conduite de véhicules et utilisation de machines
KLIOGEST n’a pas d’effet connu sur la capacité à conduire des véhicules ou à utiliser des machines.
KLIOGEST, comprimé pelliculé contient du lactose monohydraté
Si vous avez une intolérance à certains sucres, contactez votre médecin avant de prendre KLIOGEST.
3. COMMENT PRENDRE KLIOGEST, comprimé pelliculé ?
Prenez un comprimé par jour, de préférence à la même heure chaque jour. Prenez le comprimé avec un verre d’eau.
Prenez un comprimé par jour sans interruption. Après avoir utilisé les 28 comprimés du distributeur journalier, enchaînez directement avec un autre distributeur.
Pour plus d’informations sur l’utilisation du distributeur journalier, voir les instructions d’utilisation à la fin de cette notice.
Vous pouvez débuter le traitement par KLIOGEST n’importe quel jour selon votre convenance. Cependant, si vous passez d’un autre THS avec lequel vous aviez des saignements mensuels à KLIOGEST, commencez votre traitement dès la fin de vos saignements.
Votre médecin doit vous prescrire la plus faible dose avec la durée la plus courte possible qui permettra de soulager vos symptômes. Contactez votre médecin si vous pensez que la dose est trop forte ou trop faible.
Si vous avez pris plus de KLIOGEST, comprimé pelliculé que vous n’auriez dû
Consultez immédiatement votre médecin ou votre pharmacien.
Une prise plus importante d’estrogènes que celle prescrite par votre médecin peut provoquer une tension mammaire, des nausées, des vomissements et/ou des saignements gynécologiques irréguliers (métrorragies). Une prise de progestérone plus importante que celle prescrite par votre médecin peut entraîner une humeur dépressive, de la fatigue, des boutons sur le visage (acné) et une croissance excessive des poils du corps ou visage (hirsutisme).
Si vous oubliez de prendre KLIOGEST, comprimé pelliculé
Si l'oubli d'un comprimé est constaté dans les 12 heures qui suivent l’heure habituelle de la prise, prenez immédiatement le comprimé oublié. Si plus de 12 heures se sont écoulées, poursuivez le traitement normalement en prenant le comprimé suivant le lendemain au moment habituel. Ne prenez pas de dose double pour compenser le comprimé que vous avez oublié de prendre.
L’oubli d’une dose peut favoriser la survenue de saignements ou de gouttes de sang (spottings) si vous avez toujours votre utérus.
Si vous arrêtez de prendre KLIOGEST, comprimé pelliculé
Si vous souhaitez arrêter de prendre KLIOGEST, contactez d’abord votre médecin. Votre médecin vous expliquera les effets liés à l’arrêt du traitement et pourra discuter des alternatives avec vous.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
Si vous devez subir une chirurgie
Si vous devez vous faire opérer, indiquez au chirurgien que vous prenez KLIOGEST. Vous pourriez avoir besoin d’arrêter la prise de KLIOGEST 4 à 6 semaines environ avant l’opération afin de réduire le risque de caillot sanguin (voir rubrique 2 « Caillots sanguins dans une veine (thromboembolie veineuse) »). Demandez à votre médecin à partir de quand vous pourrez reprendre KLIOGEST.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les maladies suivantes sont rapportées plus fréquemment chez les femmes utilisant un THS par rapport aux femmes n’en utilisant pas :
· cancer du sein
· développement anormal ou cancer de la paroi de l’utérus (hyperplasie endométriale ou cancer de l’endomètre)
· cancer ovarien
· caillots sanguins dans les veines des jambes ou des poumons (thromboembolie veineuse)
· maladie cardiovasculaire
· accident vasculaire cérébral
· possible perte de mémoire, si le traitement est débuté après 65 ans.
Pour plus d’informations sur ces effets indésirables, voir rubrique 2 « Quelles sont les informations à connaître avant de prendre KLIOGEST, comprimé pelliculé ? ».
Hypersensibilité/réactions allergiques (effet indésirable peu fréquent – survient chez 1 à 10 utilisatrices sur 1 000) : même si cet effet est peu fréquent, des réactions d’hypersensibilité ou des réactions allergiques peuvent survenir. Les signes d’hypersensibilité ou de réaction allergique peuvent inclure un ou plusieurs des symptômes suivants : urticaire, démangeaison, gonflement, difficultés pour respirer, pression artérielle faible (pâleur et froideur de la peau, rythme cardiaque accéléré), vertiges, sueurs, qui pourraient être les signes d’un choc ou d’une réaction anaphylactique. Si l’un de ces symptômes survient, arrêtez de prendre KLIOGEST et consultez immédiatement un médecin.
Effets indésirables très fréquents (survient chez plus d’1 utilisatrice sur 10)
· Douleur ou tension dans les seins
· Saignement vaginal.
Effets indésirables fréquents (survient chez 1 à 10 utilisatrices sur 100)
· Maux de tête
· Prise de poids causée par une rétention d’eau
· Inflammation vaginale
· Migraine ou aggravation d’une migraine existante
· Mycose vaginale
· Dépression ou aggravation d’une dépression existante
· Nausées
· Douleur, gonflement ou gêne abdominale
· Grossissement ou gonflement des seins (œdème des seins)
· Douleur dans le dos
· Douleur dans les jambes
· Apparition, réapparition ou aggravation d’un fibrome utérin (tumeur bénigne de l’utérus)
· Gonflement des bras et des jambes (œdème périphérique)
· Prise de poids.
Effets indésirables peu fréquents (survient chez 1 à 10 utilisatrices sur 1 000)
· Ballonnement ou flatulence
· Acné
· Chute de cheveux (alopécie)
· Pilosité anormale (type masculin)
· Démangeaisons ou urticaire
· Inflammation d’une veine (thrombophlébite superficielle)
· Inefficacité du médicament
· Réaction allergique
· Nervosité.
Effets indésirables rares (survient chez 1 à 10 utilisatrices sur 10 000)
Caillot dans les vaisseaux sanguins des jambes ou des poumons (thrombose veineuse profonde, embolie pulmonaire).
Effets indésirables très rares (survient chez moins de 1 utilisatrice sur 10 000)
· Cancer de la paroi de l’utérus (cancer de l’endomètre)
· Développement excessif de la muqueuse utérine (hyperplasie endométriale)
· Augmentation de la pression artérielle ou aggravation d’une pression artérielle élevée
· Apparition, réapparition ou aggravation de maladie de la vésicule biliaire ou de calculs biliaires
· Sécrétion excessive de sébum, éruption cutanée
· Œdème aigu ou récurrent (œdème angioneurotique)
· Insomnie, vertige, anxiété
· Modification du désir sexuel
· Troubles visuels
· Perte de poids
· Vomissements
· Brûlures d’estomac
· Démangeaison génitale et vaginale
· Crise cardiaque et accident vasculaire cérébral.
Autres effets indésirables des THS combinés
Les effets indésirables suivants ont été rapportés avec d’autres THS :
· Troubles cutanés divers :
o décoloration de la peau, en particulier au niveau du visage et du cou, connue sous le terme de « masque de grossesse » (chloasma),
o nodules cutanés rouges et douloureux (érythème noueux),
o éruption cutanée avec rougeurs ou lésions en forme de bulle (érythème polymorphe)
o coloration ou tâches rouges ou violettes de la peau et/ou des muqueuses (purpura),
· Sécheresse des yeux
· Modification de la composition des larmes.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER KLIOGEST, comprimé pelliculé ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette et sur l’emballage extérieur après « EXP ». La date de péremption fait référence au dernier jour de ce mois.
À conserver à une température ne dépassant pas 25°C.
Ne pas mettre au réfrigérateur.
Conserver le distributeur journalier dans l’emballage extérieur, à l’abri de la lumière.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient KLIOGEST, comprimé pelliculé
· Les substances actives sont :
estradiol (sous forme d’estradiol hémihydraté).......................................................................... 2 mg
acétate de noréthistérone........................................................................................................ 1 mg
· Les autres composants sont : lactose monohydraté, amidon de maïs, hydroxypropylcellulose, talc et stéarate de magnésium
· Le pelliculage blanc contient : hypromellose, triacétine et talc.
Qu’est-ce que KLIOGEST, comprimé pelliculé et contenu de l’emballage extérieur
Les comprimés pelliculés de KLIOGEST sont blancs et ronds, d’un diamètre de 6 mm. Les comprimés sont gravés NOVO 281.
Présentations :
· 1 distributeur journalier de 28 comprimés pelliculés.
· 3 distributeurs journaliers de 28 comprimés pelliculés.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
10-12 COURS MICHELET
92800 PUTEAUX
FRANCE
Exploitant de l’autorisation de mise sur le marché
NOVO NORDISK
10-12 COURS MICHELET
92800 PUTEAUX
FRANCE
NOVO ALLÉ
DK-2880 BAGSVÆRD
DANEMARK
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
{MM/AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
INSTRUCTIONS D’UTILISATION
Comment utiliser le distributeur journalier
|
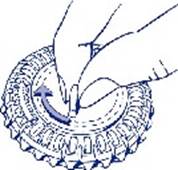
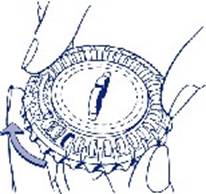
1. Sélection du jour Faites tourner le cadran central du distributeur journalier de façon à placer Ie jour de la semaine en face de la petite languette en plastique. |
|
|
|
|
|
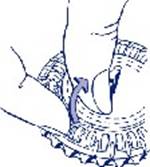
2. Prise du premier comprimé Cassez la languette en plastique et faites sortir le premier comprimé.
|
|
|
|
|
|
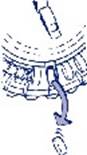
3. Déplacement du cadran tous les jours Le jour suivant, faites simplement avancer d'1 cran le cadran transparent en le tournant dans le sens des aiguilles d'une montre, comme indiqué par la flèche. Faites sortir le comprimé suivant. Rappelez-vous de ne prendre qu’1 seul comprimé par jour. Le cadran transparent ne peut être tourné que lorsque le comprimé se trouvant dans l'ouverture a été retiré.
|
|
|
|
|