Dernière mise à jour le 01/12/2025
REANUTRIFLEX OMEGA E, émulsion pour perfusion
Indications thérapeutiques
REANUTRIFLEX OMEGA E contient des liquides et des substances appelées acides aminés, électrolytes et acides gras, qui sont essentiels pour permettre à l’organisme de se développer et de se rétablir. Le produit contient également des calories sous la forme de glucides et de lipides.
REANUTRIFLEX OMEGA E est administrée à des adultes, à des adolescents et à des enfants âgés de plus de 2 ans.
REANUTRIFLEX OMEGA E vous est administré lorsque vous êtes dans l’incapacité de vous alimenter normalement. Ce peut être le cas dans de nombreuses situations, par exemple lorsque vous récupérez d’une intervention chirurgicale, de blessures ou de brûlures ou lorsque vous ne pouvez pas absorber les aliments par l’intermédiaire de votre estomac et de vos intestins.
Composition en substances actives
-
émulsion ( Composition pour 1000 ml d'émulsion après mélange )
- > isoleucine 3,284 g
- > leucine 4,384 g
- lysine3,186 g
- sous forme de : chlorhydrate de lysine3,98 g
- > méthionine 2,736 g
- > thréonine 2,54 g
- > valine 3,604 g
- > arginine 3,78 g
- histidine1,753 g
- sous forme de : chlorhydrate d'histidine monohydraté2,368 g
- sous forme de : glucose monohydraté158,4 g
Présentations
> 5 poche(s) en polypropylène SEBS : styrène-éthylène-butylène-styrène copolyester-éther suremballée(s)/surpochée(s) à 3 compartiments de 625 mL (250 mL de solution d’acides aminés + 125 mL d’émulsion lipidique + 250 mL de solution de glucose)
Code CIP : 34009 300 774 5 0
Déclaration de commercialisation : 28/02/2019
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 84,21 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 85,23 €
- Taux de remboursement :65%
> 5 poche(s) en polypropylène SEBS : styrène-éthylène-butylène-styrène copolyester-éther suremballée(s)/surpochée(s) à 3 compartiments de 1250 mL (500 mL de solution d’acides aminés + 250 mL d’émulsion lipidique + 500 mL de solution de glucose)
Code CIP : 34009 300 774 6 7
Déclaration de commercialisation : 16/04/2019
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 138,16 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 139,18 €
- Taux de remboursement :65%
> 5 poche(s) en polypropylène SEBS : styrène-éthylène-butylène-styrène copolyester-éther suremballée(s)/surpochée(s) à 3 compartiments de 1875 mL (750 mL de solution d’acides aminés + 375 mL d’émulsion lipidique + 750 mL de solution de glucose)
Code CIP : 34009 300 774 7 4
Déclaration de commercialisation : 03/04/2019
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 154,80 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 155,82 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 21/02/2018 | Inscription (CT) | Le service médical rendu par REANUTRIFLEX OMEGA E, émulsion pour perfusion est important dans les indications de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 21/02/2018 | Inscription (CT) | Cette spécialité est un complément de gamme qui n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport aux présentations déjà inscrites. |
ANSM - Mis à jour le : 30/01/2024
REANUTRIFLEX OMEGA E, émulsion pour perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
|
Compartiment supérieur |
Dans 1 000 mL |
Poche de 625 mL |
Poche de 1 250 mL |
Poche de |
|
Glucose monohydraté |
158,4 g |
99,00 g |
198,0 g |
297,0 g |
|
équivalent glucose |
144,0 g |
90,00 g |
180,0 g |
270,0 g |
|
Phosphate monosodique dihydraté |
2,496 g |
1,560 g |
3,120 g |
4,680 g |
|
Acétate de zinc dihydraté |
7,024 mg |
4,390 mg |
8,780 mg |
13,17 mg |
|
Compartiment central |
Dans 1 000 mL |
Poche de 625 mL |
Poche de 1 250 mL |
Poche de |
|
Triglycérides à chaîne moyenne |
20,00 g |
12,50 g |
25,00 g |
37,50 g |
|
Huile de soja raffinée |
16,00 g |
10,00 g |
20,00 g |
30,00 g |
|
Triglycérides d’acides gras oméga 3 |
4,000 g |
2,500 g |
5,000 g |
7,500 g |
|
Compartiment inférieur |
Dans 1 000 mL |
Poche de 625 mL |
Poche de 1 250 mL |
Poche de |
|
Isoleucine |
3,284 g |
2,053 g |
4,105 g |
6,158 g |
|
Leucine |
4,384 g |
2,740 g |
5,480 g |
8,220 g |
|
Chlorhydrate de lysine |
3,980 g |
2,488 g |
4,975 g |
7,463 g |
|
équivalent lysine |
3,186 g |
1,991 g |
3,982 g |
5,973 g |
|
Méthionine |
2,736 g |
1,710 g |
3,420 g |
5,130 g |
|
Phénylalanine |
4,916 g |
3,073 g |
6,145 g |
9,218 g |
|
Thréonine |
2,540 g |
1,588 g |
3,175 g |
4,763 g |
|
Tryptophane |
0,800 g |
0,500 g |
1,000 g |
1,500 g |
|
Valine |
3,604 g |
2,253 g |
4,505 g |
6,758 g |
|
Arginine |
3,780 g |
2,363 g |
4,725 g |
7,088 g |
|
Chlorhydrate d’histidine monohydraté |
2,368 g |
1,480 g |
2,960 g |
4,440 g |
|
équivalent histidine |
1,753 g |
1,095 g |
2,191 g |
3,286 g |
|
Alanine |
6,792 g |
4,245 g |
8,490 g |
12,73 g |
|
Acide aspartique |
2,100 g |
1,313 g |
2,625 g |
3,938 g |
|
Acide glutamique |
4,908 g |
3,068 g |
6,135 g |
9,203 g |
|
Glycine |
2,312 g |
1,445 g |
2,890 g |
4,335 g |
|
Proline |
4,760 g |
2,975 g |
5,950 g |
8,925 g |
|
Sérine |
4,200 g |
2,625 g |
5,250 g |
7,875 g |
|
Hydroxyde de sodium |
1,171 g |
0,732 g |
1,464 g |
2,196 g |
|
Chlorure de sodium |
0,378 g |
0,237 g |
0,473 g |
0,710 g |
|
Acétate de sodium trihydraté |
0,250 g |
0,157 g |
0,313 g |
0,470 g |
|
Acétate de potassium |
3,689 g |
2,306 g |
4,611 g |
6,917 g |
|
Acétate de magnésium tétrahydraté |
0,910 g |
0,569 g |
1,137 g |
1,706 g |
|
Chlorure de calcium dihydraté |
0,623 g |
0,390 g |
0,779 g |
1,169 g |
|
Électrolytes [mmol] |
Dans 1 000 mL |
Poche de 625 mL |
Poche de 1 250 mL |
Poche de |
|
Sodium |
53,6 |
33,5 |
67 |
100,5 |
|
Potassium |
37,6 |
23,5 |
47 |
70,5 |
|
Magnésium |
4,2 |
2,65 |
5,3 |
7,95 |
|
Calcium |
4,2 |
2,65 |
5,3 |
7,95 |
|
Zinc |
0,03 |
0,02 |
0,04 |
0,06 |
|
Chlorure |
48 |
30 |
60 |
90 |
|
Acétate |
48 |
30 |
60 |
90 |
|
Phosphate |
16 |
10 |
20 |
30 |
|
|
Dans 1 000 mL |
Poche de 625 mL |
Poche de 1 250 mL |
Poche de |
|
Teneur en acides aminés [g] |
56,0 |
35,0 |
70,1 |
105,1 |
|
Teneur en azote [g] |
8 |
5 |
10 |
15 |
|
Teneur en glucides [g] |
144 |
90 |
180 |
270 |
|
Teneur en lipides [g] |
40 |
25 |
50 |
75 |
Excipient(s) à effet notoire : La quantité totale de sodium pour 1 000 ml dans l'émulsion prête à l'emploi est de 54,1 mmol (1 244 mg).
Pour la liste complète des excipients, voir rubrique 6.1.
Solutions d’acides aminés et de glucose : solutions limpides, incolores à jaune paille.
Émulsion lipidique : émulsion d’huile dans l’eau, d’apparence blanc laiteux.
|
|
Dans 1 000 mL |
Poche de 625 mL |
Poche de 1 250 mL |
Poche de |
|
Valeur énergétique sous forme de lipides (kJ [kca]) |
1 590 |
995 |
1 990 |
2 985 |
|
Valeur énergétique sous forme de glucides (kJ [kca]) |
2 415 |
1 510 |
3 015 |
4 520 |
|
Valeur énergétique sous forme de protéines (kJ [kca]) |
940 |
585 |
1 170 |
1 755 |
|
Valeur énergétique non protéique (kJ [kca]) |
4 005 |
2 505 |
5 005 |
7 510 |
|
Valeur énergétique totale (kJ [kca]) |
4 945 |
3 090 |
6 175 |
9 260 |
|
Osmolalité [mOsm/kg] |
2 115 |
2 115 |
2 115 |
2 115 |
|
Osmolarité théorique [mOsm/L] |
1 545 |
1 545 |
1 545 |
1 545 |
|
pH |
5,0 – 6,0 |
5,0 – 6,0 |
5,0 – 6,0 |
5,0 – 6,0 |
4.1. Indications thérapeutiques
REANUTRIFLEX OMEGA E est indiqué chez l’adulte, l’adolescent et l’enfant âgé de plus de deux ans.
4.2. Posologie et mode d'administration
La posologie doit être ajustée en fonction des besoins spécifiques du patient.
Il est recommandé d’administrer REANUTRIFLEX OMEGA E en continu. Une augmentation du débit de perfusion par paliers au cours des 30 premières minutes jusqu’à atteindre le débit de perfusion souhaité permet d’éviter d’éventuelles complications.
Adultes
La dose quotidienne maximale est de 35 mL/kg de masse corporelle, soit :
2,0 g d’acides aminés /kg de masse corporelle par jour
5,04 g de glucose /kg de masse corporelle par jour
1,4 g de lipides /kg de masse corporelle par jour
Le débit de perfusion maximal est de 1,7 mL/kg de masse corporelle par heure, soit :
0,1 g d’acides aminés /kg de masse corporelle par heure
0,24 g de glucose /kg de masse corporelle par heure
0,07 g de lipides /kg de masse corporelle par heure
Pour un patient pesant 70 kg, ceci correspond à un débit de perfusion maximal de 119 mL par heure. Les quantités de substrat administrées sont alors de 6,8 g d’acides aminés par heure, 17,1 g de glucose par heure et 4,8 g de lipides par heure.
Population pédiatrique
Nouveau-nés, nourrissons et jeunes enfants âgés de moins de deux ans
REANUTRIFLEX OMEGA E est contre-indiqué chez les nouveau-nés, les nourrissons et les jeunes enfants âgés de moins de 2 ans chez lesquels l’acide aminé cystéine peut être considéré comme essentiel sous certaines conditions (voir rubrique 4.3).
Enfants âgés de 2 ans à 18 ans
Aucune étude clinique n’a été réalisée dans la population pédiatrique.
REANUTRIFLEX OMEGA E ne peut fournir qu’un apport nutritionnel et énergétique de base aux patients pédiatriques.
Selon les besoins individuels, une supplémentation en carnitine peut être envisagée chez les patients pédiatriques sensés recevoir une NP pendant plus de 4 semaines.
La posologie exacte dépend des dépenses énergétiques du patient et de sa capacité à métaboliser les principes actifs contenus dans REANUTRIFLEX OMEGA E. Elle doit donc être adaptée individuellement en fonction de l’âge, du poids corporel, de l’état clinique et de la maladie sous-jacente.
Compte tenu des besoins individuels des patients pédiatriques, REANUTRIFLEX OMEGA E pourrait ne pas couvrir suffisamment la totalité des besoins en énergie, en nutriments, en électrolytes et en liquides. Dans de tels cas, des acides aminés, des glucides et/ou des lipides, des minéraux et/ou des liquides supplémentaires doivent être apportés en complément, le cas échéant.
Le niveau d’hydratation du patient pédiatrique doit être pris en compte dans le calcul de la posologie. La taille de la poche doit être choisie en conséquence.
De plus, les besoins quotidiens en liquides, en glucose et en énergie diminuent avec l’âge. C’est pourquoi deux groupes d’âge, de 2 à 12 ans et de 12 à 18 ans, sont pris en compte.
Dose journalière maximale
Selon les recommandations pédiatriques, la dose dépend non seulement de l’âge, mais aussi de l’état de santé (affection en phase aiguë, stable, de récupération) du patient pédiatrique.
Pour REANUTRIFLEX OMEGA E, dans le groupe d’âge de 2 à 12 ans, la concentration en magnésium est le facteur limitant pour la dose journalière maximale, quel que soit le stade de l’affection.
Dans le groupe d’âge de 12 à 18 ans, la concentration en glucose devient le facteur limitant dans les phases aiguë et stable, tandis que la concentration en magnésium est le facteur limitant dans la phase de récupération.
Les doses journalières maximales sont détaillées dans le tableau ci-dessous :
|
|
2 à ≤ 12 ans |
12 à 18 ans |
||||||
|
|
Recommandé |
REANUTRIFLEX OMEGA E |
Recommandé |
REANUTRIFLEX OMEGA E |
||||
|
|
|
Phase aiguë |
Phase stable |
Phase de récupération |
|
Phase aiguë |
Phase stable |
Phase de récupération |
|
Dose journalière maximale [mL/kg/j] |
|
24 |
|
9,5 |
20 |
24 |
||
|
|
|
correspondant à |
|
correspondant à |
||||
|
Liquides [mL/kg/j] |
60‑100 |
24 |
50‑70 |
9,5 |
20 |
24 |
||
|
Acides aminés [g/kg/j] |
1,0‑2,0 (2,5) |
1,34 |
1,0‑2,0 |
0,53 |
1,12 |
1,34 |
||
|
Glucose [g/kg/j] |
|
|
|
|
||||
|
Phase aiguë |
1,4‑3,6 |
3,46 |
0,7‑1,4 |
1,37 |
- |
- |
||
|
Phase stable |
2,2‑5,8 |
1,4‑2,9 |
- |
2,88 |
- |
|||
|
Phase de récupération |
4,3‑8,6 |
2,9‑4,3 |
- |
- |
3,46 |
|||
|
Lipides [g/kg/j] |
≤ 3 |
0,96 |
≤ 3 |
0,38 |
0,8 |
0,96 |
||
|
Énergie [kcal/kg/j] |
|
|
|
|
||||
|
Phase aiguë |
30‑45 |
28,3 |
20‑30 |
11,2 |
- |
- |
||
|
Phase stable |
40‑60 |
25‑40 |
- |
23,6 |
- |
|||
|
Phase de récupération |
55‑75 |
30‑55 |
- |
- |
28,3 |
|||
|
Sodium [mmol/kg/j] |
1‑3 |
1,29 |
1‑3 |
0,51 |
1,07 |
1,29 |
||
|
Potassium [mmol/kg/j] |
1‑3 |
0,9 |
1‑3 |
0,36 |
0,75 |
0,90 |
||
|
Calcium [mmol/kg/j] |
0,25‑0,4 |
0,10 |
0,25‑0,4 |
0,04 |
0,08 |
0,10 |
||
|
Magnésium [mmol/kg/j] |
0,1 |
0,10 |
0,1 |
0,04 |
0,08 |
0,10 |
||
|
Chlorure [mmol/kg/j] |
2‑4 |
1,15 |
2‑4 |
0,46 |
0,96 |
1,15 |
||
|
Phosphate [mmol/kg/j] |
0,2‑0,7 |
0,38 |
0,2‑0,7 |
0,15 |
0,32 |
0,38 |
||
|
Phase aiguë = phase de réanimation lorsque le patient nécessite un soutien de ses organes vitaux (sédation, ventilation mécanique, vasopresseurs, réanimation liquidienne) ; phase stable = le patient est stable ou peut être sevré de ce soutien vital ; phase de récupération = le patient est mobilisé. |
||||||||
Chez les enfants, il peut être nécessaire de débuter la thérapie nutritionnelle à la moitié de la posologie ciblée. La dose doit ensuite être augmentée par paliers en fonction de la capacité métabolique du patient jusqu’à atteindre la posologie maximale.
Vitesse de perfusion maximale
Selon les recommandations pédiatriques, la vitesse de perfusion maximale dépend non seulement de l’âge, mais aussi de l’état de santé (affection en phase aiguë, stable, de récupération) du patient pédiatrique.
Pour REANUTRIFLEX OMEGA E, la vitesse de perfusion du glucose est le facteur limitant pour les deux groupes d’âge pédiatrique, quel que soit le stade de l’affection.
Les vitesses de perfusion maximales par heure sont détaillées dans le tableau ci-dessous.
|
|
Groupe d’âge pédiatrique |
|||||||
|
|
2 à ≤ 12 ans |
12 à 18 ans |
||||||
|
|
Recommandé |
REANUTRIFLEX OMEGA E |
Recommandé |
REANUTRIFLEX OMEGA E |
||||
|
|
|
Phase aiguë |
Phase stable |
Phase de récupération |
|
Phase aiguë |
Phase stable |
Phase de récupération |
|
Vitesse de perfusion maximale [mL/kg/h] |
|
0,63 |
1,25 |
1,67 |
|
0,42 |
0,83 |
1,25 |
|
|
|
correspondant à |
|
correspondant à |
||||
|
Acides aminés [g/kg/h] |
≤ 0,1 |
0,035 |
0,07 |
0,094 |
≤ 0,1 |
0,024 |
0,046 |
0,07 |
|
Glucose [g/kg/h] |
|
|
|
|
|
|
|
|
|
Phase aiguë |
0,09 |
0,09 |
- |
- |
0,03‑0,06 |
0,06 |
- |
- |
|
Phase stable |
0,09‑0,18 |
- |
0,18 |
- |
0,06‑0,12 |
- |
0,12 |
- |
|
Phase de recuperation |
0,18‑0,24 |
- |
- |
0,24 |
0,12‑0,18 |
- |
- |
0,18 |
|
Lipides [g/kg/h] |
≤ 0,15 |
0,025 |
0,05 |
0,067 |
≤ 0,15 |
0,017 |
0,033 |
0,05 |
Patients atteints d’insuffisance rénale/hépatique
La posologie doit être ajustée individuellement chez les patients atteints d’insuffisance hépatique ou rénale (voir également rubrique 4.4).
Patients sous nutrition parentérale per-dialytique
La nutrition parentérale per-dialytique s’adresse aux patients sous dialyse n’étant pas en état de dénutrition aiguë, lorsque les conseils nutritionnels ou le traitement par des compléments nutritionnels oraux se sont révélés inefficaces. La sélection de volume adapté de REANUTRIFLEX OMEGA E à utiliser pour une nutrition parentérale per-dialytique doit reposer sur l’intervalle de temps séparant les prises spontanées des prises recommandées. Il convient également de prendre en compte la tolérance métabolique. Pour l’utilisation de REANUTRIFLEX OMEGA E chez des patients sous nutrition parentérale per-dialytique, la vitesse de perfusion maximale par heure est de 2,3 mL/kg/heure, ce qui correspond à 0,13 g/kg/heure d’acides aminés, 0,33 g/kg/heure de glucose et 0,092 g/kg/heure de lipides administrés pendant 4 heures. En tenant compte des pertes connues en acides aminés (taux de rétention de 73 %) et en glucose (25 g/session de dialyse de 4 heures) pendant la dialyse, le patient recevra au final 0,095 g/kg/heure d’acides aminés, 0,24 g/kg/heure de glucose et 0,092 g/kg/heure de lipides. Pour un patient de 70 kg et une session de dialyse de 4 heures, cela correspond à 27 g d’acides aminés, 67 g de glucose, 26 g de lipides et 644 mL de liquide.
Durée du traitement
La durée du traitement dans le cadre des indications spécifiées n’est pas limitée. Lors de l’administration de REANUTRIFLEX OMEGA E, il est nécessaire d’assurer un apport en quantités appropriées en oligo-éléments et en vitamines.
Durée de la perfusion pour une poche unique
La durée de perfusion recommandée pour une poche de nutrition parentérale est de 24 h maximum.
Mode d’administration
Voie intraveineuse. À administrer exclusivement en perfusion dans une voie veineuse centrale.
Pendant la nutrition parentérale per-dialytique, la poche doit être administrée par la chambre veineuse compte-gouttes des lignes de circulation extracorporelle.
· Anomalies congénitales du métabolisme des acides aminés
· Hyperlipidémie sévère caractérisée par une hypertriglycéridémie (≥ 1 000 mg/dL ou 11,4 mmol/L)
· Coagulopathie sévère
· Hyperglycémie ne répondant pas à des doses d’insuline allant jusqu’à 6 unités d’insuline/heure
· Acidose
· Cholestase intrahépatique
· Insuffisance hépatique sévère
· Insuffisance rénale sévère en l’absence de traitement de substitution rénale
· Diathèse hémorragique en voie d’aggravation
· Événements thromboemboliques aigus, embolie lipidique
En raison de sa composition, REANUTRIFLEX OMEGA E ne doit pas être utilisé chez les nouveau-nés, les nourrissons et les jeunes enfants âgés de moins de 2 ans.
Les contre-indications générales à la nutrition parentérale comprennent :
· Etat circulatoire instable avec menace pour le pronostic vital (états de collapsus et de choc)
· Phases aiguës d’un infarctus du myocarde et d’un accident vasculaire cérébral
· Etat métabolique instable (ex., syndrome postagression sévère, coma d’origine indéterminée)
· Apport cellulaire en oxygène insuffisant
· Perturbations de l’équilibre hydro-électrolytique
· Œdème pulmonaire aigu
· Insuffisance cardiaque décompensée
4.4. Mises en garde spéciales et précautions d'emploi
Une attention particulière est requise en cas d’élévation de l’osmolarité sérique.
Les perturbations de l’équilibre hydro-électrolytique ou acido-basique doivent être corrigées avant de débuter la perfusion.
Une perfusion trop rapide peut conduire à une surcharge hydrique avec des concentrations sériques en électrolytes pathologiques, d’une hyperhydratation et d’un œdème pulmonaire.
Tout signe ou symptôme d’une réaction anaphylactique (tel que fièvre, frissons, rash ou une dyspnée) doit conduire à l’arrêt immédiat de la perfusion.
La concentration sérique en triglycérides doit être surveillée lors de la perfusion de REANUTRIFLEX OMEGA E.
Selon l’état métabolique du patient, une hypertriglycéridémie occasionnelle peut survenir. Si la concentration plasmatique en triglycérides dépasse 4,6 mmol/L (400 mg/dL) pendant l’administration des lipides, il est recommandé de réduire le débit de perfusion. La perfusion doit être interrompue si la concentration plasmatique en triglycérides dépasse 11,4 mmol/L (1 000 mg/dL) car ces taux ont été associés à des cas de pancréatite aiguë.
Patients présentant des troubles du métabolisme lipidique
REANUTRIFLEX OMEGA E doit être administré avec prudence chez les patients présentant des perturbations du métabolisme lipidique avec augmentation des triglycérides sériques, notamment en cas d’insuffisance rénale, de diabète, de pancréatite, d’altération de la fonction hépatique, d’hypothyroïdie (avec hypertriglycéridémie), de sepsis et de syndrome métabolique. En cas d’administration de REANUTRIFLEX OMEGA E chez des patients présentant ces affections, une surveillance plus fréquente des triglycérides sériques est nécessaire pour s’assurer de l’élimination des triglycérides et du maintien de taux de triglycérides stables inférieurs à 11,4 mmol/L (1 000 mg/dL).
En cas d’hyperlipidémies combinées et en cas de syndrome métabolique, les taux de triglycérides réagissent au glucose, aux lipides et à la suralimentation. La dose doit être ajustée en conséquence. Les autres sources de lipides et de glucose doivent être évaluées et surveillées, ainsi que les médicaments interférant avec leur métabolisme.
La présence d’une hypertriglycéridémie 12 heures après l’administration de lipides indique également une perturbation du métabolisme lipidique.
Comme pour toute solution contenant des glucides, l’administration de REANUTRIFLEX OMEGA E peut entraîner une hyperglycémie. La glycémie doit être surveillée. En cas d’hyperglycémie, le débit de perfusion doit être diminué ou de l’insuline doit être administrée. Si d’autres solutions de glucose intraveineuses sont administrées au patient de façon concomitante, la quantité supplémentaire de glucose administrée doit être prise en compte.
Une interruption de l’administration de l’émulsion peut être indiquée si la glycémie dépasse 14 mmol/L (250 mg/dL) pendant l’administration.
La réalimentation ou la réplétion des patients dénutris ou souffrant de déplétion peut entraîner une hypokaliémie, une hypophosphatémie et une hypomagnésémie. Il est impératif de surveiller étroitement les électrolytes sériques. Une supplémentation adéquate en électrolytes en fonction des écarts par rapport aux valeurs normales est nécessaire.
Il est nécessaire de contrôler les concentrations en électrolytes sériques, l’équilibre hydrique, l’équilibre acido-basique, ainsi que les numérations sanguines, la coagulation et les fonctions hépatique et rénale.
Une substitution en électrolytes, vitamines et oligo-éléments peut être nécessaire, selon les besoins. REANUTRIFLEX OMEGA E contenant du zinc, du magnésium, du calcium et du phosphate, des précautions doivent être prises en cas d’administration concomitante de solutions contenant ces oligoéléments.
REANUTRIFLEX OMEGA E est une préparation de composition complexe. Il est donc fortement conseillé de ne pas lui adjoindre d’autres solutions (dont la compatibilité n’a pas été démontrée ; voir rubrique 6.2).
REANUTRIFLEX OMEGA E ne doit pas être administré en même temps que du sang dans la même ligne de perfusion en raison du risque de pseudo-agglutination (voir rubrique 4.5).
Comme pour toute solution intraveineuse, en particulier celles destinées à la nutrition parentérale, la perfusion de REANUTRIFLEX OMEGA E doit être effectuée dans des conditions d’asepsie strictes.
Patients pédiatriques
A ce jour, il n’y a aucune expérience clinique quant à l’utilisation de REANUTRIFLEX OMEGA E chez les enfants et les adolescents.
Patients âgés
En règle générale, la posologie est la même que chez l’adulte, mais la prudence est de rigueur lorsque les patients présentent d’autres affections, telles qu’une insuffisance cardiaque ou une insuffisance rénale qui peuvent fréquemment être associées à un âge avancé.
Patients atteints de diabète ou dont la fonction cardiaque ou rénale est altérée
Comme toutes les solutions pour perfusion de grand volume, REANUTRIFLEX OMEGA E doit être administré avec prudence chez les patients dont la fonction cardiaque ou rénale est altérée.
L’expérience de l’utilisation de REANUTRIFLEX OMEGA E chez les patients atteints de diabète ou présentant une insuffisance rénale est limitée.
Mises en garde spéciales/précautions concernant les excipients
Ce médicament contient 1,244 mg de sodium par ml, ce qui équivaut à 0,062 % de l’apport alimentaire quotidien maximal recommandé par l’OMS de 2 g de sodium par adulte.
Pour un adulte de 70 kg, la dose quotidienne maximale de ce médicament équivaut à 152 % de l’apport alimentaire quotidien maximal de sodium recommandé par l’OMS.
REANUTRIFLEX OMEGA E a une teneur élevée en sodium. Cela doit être pris en considération chez les patients suivant un régime hyposodé strict.
Interférences avec les analyses biologiques
Les lipides contenus dans le produit peuvent interférer avec certaines analyses de laboratoire (ex., bilirubine, lactate déshydrogénase, saturation en oxygène) si le sang est prélevé avant que les lipides n’aient été suffisamment éliminés de la circulation sanguine.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Certains médicaments, comme l’insuline, peuvent interférer avec le système des lipases de l’organisme. Ce type d’interaction semble toutefois n’avoir qu’une importance clinique limitée.
L’héparine administrée aux doses cliniques provoque une libération transitoire de lipoprotéine lipase dans la circulation. Ceci peut entraîner dans un premier temps une augmentation de la lipolyse plasmatique, suivie d’une diminution transitoire de la clairance des triglycérides.
L’huile de soja a une teneur naturelle en vitamine K1. Cela peut interférer avec l’effet thérapeutique des dérivés coumariniques qui doit être étroitement surveillés chez les patients traités par ces médicaments.
Les solutions contenant du potassium, telles que REANUTRIFLEX OMEGA E, doivent être utilisées avec prudence chez les patients recevant des médicaments qui augmentent les concentrations sériques en potassium, tels que les diurétiques d’épargne potassique (triamtérène, amiloride, spironolactone), les IEC (ex., captopril, énalapril), les antagonistes des récepteurs de l’angiotensine II (ex., losartan, valsartan), la ciclosporine et le tacrolimus.
Les corticostéroïdes et l’ACTH sont associés à une rétention hydrosodée.
REANUTRIFLEX OMEGA E ne doit pas être administré en même temps que du sang dans la même ligne de perfusion en raison du risque de pseudo-agglutination (voir également rubrique 4.4).
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n’existe pas de données ou il existe des données limitées sur l’utilisation de REANUTRIFLEX OMEGA E chez la femme enceinte. Les études effectuées chez l’animal sont insuffisantes pour permettre de conclure sur la toxicité sur la reproduction (voir rubrique 5.3).
Une nutrition parentérale peut s’avérer nécessaire pendant la grossesse. REANUTRIFLEX OMEGA E ne doit être utilisé chez la femme enceinte qu’après une évaluation soigneuse.
Allaitement
Les composants/métabolites de REANUTRIFLEX OMEGA E sont excrétés dans le lait maternel mais, à doses thérapeutiques, aucun effet sur les nouveau-nés/nourrissons allaités n’est attendu. Néanmoins, l’allaitement est déconseillé chez les mères recevant une nutrition parentérale.
Fertilité
Aucune donnée n’est disponible en lien avec l’utilisation de REANUTRIFLEX OMEGA E.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Dans le cadre d’une utilisation correcte, en termes de surveillance de la posologie et de respect des restrictions et des instructions de sécurité, la survenue d’effets indésirables reste possible. La liste suivante comprend un certain nombre de réactions systémiques pouvant être associées à l’utilisation de REANUTRIFLEX OMEGA E.
Les effets indésirables sont classés par fréquence, selon la convention suivante :
Très fréquent (≥ 1/10)
Fréquent (≥ 1/100, < 1/10)
Peu fréquent (≥ 1/1 000, < 1/100)
Rare (≥ 1/10 000, < 1/1 000)
Très rare (< 1/10 000)
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
Affections hématologiques et du système lymphatique
Rare : Hypercoagulation
Fréquence indéterminée : Leucopénie, thrombopénie
Affections du système immunitaire
Rare : Réactions allergiques (p. ex., réactions anaphylactiques, éruptions
dermiques, œdème laryngé, buccal et facial)
Troubles du métabolisme et de la nutrition
Peu fréquent : Perte d’appétit
Très rare : Hyperlipidémie, hyperglycémie, acidose métabolique
La fréquence de ces effets indésirables dépend de la dose et peut être plus élevée dans des conditions de surdosage absolu ou relatif en lipides.
Affections du système nerveux
Rare : Céphalées, somnolence
Affections vasculaires
Rare : Hypertension ou hypotension, bouffées congestives
Affections respiratoires, thoraciques et médiastinales
Rare : Dyspnée, cyanose
Affections gastro-intestinales
Peu fréquent : Nausées, vomissements
Affections hépatobiliaires
Fréquence indéterminée : Cholestase
Affections de la peau et du tissu sous-cutané
Rare : Érythème, sudation
Affections musculo-squelettiques et systémiques
Rare : Douleurs dorsales, osseuses, thoraciques ou lombaires
Troubles généraux et anomalies au site d’administration
Rare : Élévation de la température corporelle, sensation de froid, frissons
Très rare : Syndrome de surcharge graisseuse (voir détails ci-dessous)
Si des effets indésirables surviennent, la perfusion doit être interrompue.
Si le taux de triglycérides augmente au-delà de 11,4 mmol/L (1 000 mg/dL) pendant la perfusion, la perfusion doit être interrompue. En cas de taux supérieurs à 4,6 mmol/L (400 mg/dL), la perfusion peut être poursuivie à dose réduite (voir rubrique 4.4).
En cas de reprise de la perfusion, le patient doit être étroitement surveillé, en particulier au début, et les triglycérides sériques doivent être mesurés à intervalles rapprochés.
Informations sur des effets indésirables particuliers
Les nausées, les vomissements et le manque d’appétit sont des symptômes fréquemment liés à des affections constituant des indications pour la nutrition parentérale et peuvent en même temps être associés à la nutrition parentérale elle-même.
Syndrome de surcharge graisseuse
Une altération de la capacité à éliminer les triglycérides peut conduire à un « syndrome de surcharge graisseuse », pouvant être dû à un surdosage. Les signes d’une surcharge métabolique doivent être surveillés. L’origine peut être soit génétique (métabolisme individuel différent) soit due à une perturbation du métabolisme lipidique en raison d’antécédents ou de pathologies en cours d’évolution. Ce syndrome peut également apparaître lors d’une hypertriglycéridémie sévère, même au débit de perfusion recommandé, et en association avec une modification brutale de l’état clinique du patient telle qu’une altération de la fonction rénale ou une infection. Le syndrome de surcharge graisseuse se caractérise par une hyperlipidémie, une fièvre, une infiltration lipidique, une hépatomégalie avec ou sans ictère, une splénomégalie, une anémie, une leucopénie, une thrombopénie, des troubles de la coagulation, une hémolyse et une réticulocytose, des résultats anormaux des tests de la fonction hépatique et un coma. Les symptômes sont généralement réversibles si la perfusion de l’émulsion lipidique est interrompue.
En cas d’apparition de signes d’un syndrome de surcharge graisseuse, la perfusion de REANUTRIFLEX OMEGA E doit être immédiatement arrêtée.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
Symptômes de surdosage hydro-électrolytique
Hyperhydratation, déséquilibre électrolytique et œdème pulmonaire
Symptômes de surdosage en acides aminés
Pertes rénales d’acides aminés entraînant un déséquilibre des acides aminés, nausées, vomissements et tremblements
Symptômes de surdosage en glucose
Hyperglycémie, glycosurie, déshydratation, hyperosmolalité, coma hyperglycémique/hyperosmolaire
Symptômes de surdosage lipidique
Voir rubrique 4.8.
Traitement
La perfusion doit être immédiatement arrêtée en cas de surdosage. Les autres mesures thérapeutiques à prendre dépendent des symptômes spécifiques et de leur sévérité. En cas de reprise de la perfusion après résorption des symptômes, il est recommandé d’augmenter progressivement le débit de perfusion en effectuant des contrôles fréquents.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
L’objectif de la nutrition parentérale est d’apporter les nutriments et l’énergie nécessaires à la croissance et/ou à la régénération des tissus, ainsi qu’au maintien de l’ensemble des fonctions de l’organisme.
Les acides aminés jouent un rôle particulièrement important dans la mesure où certains d’entre eux sont des composants essentiels à la synthèse des protéines. L’administration simultanée de sources d’énergie (glucides/lipides) est nécessaire afin de réserver les acides aminés à la régénération des tissus et à l’anabolisme et afin d’éviter leur utilisation comme source d’énergie.
Le glucose est métabolisé de façon ubiquitaire dans l’organisme. Certains tissus et organes, tels que le système nerveux central, la moelle osseuse, les érythrocytes, l’épithélium tubulaire, couvrent leurs besoins énergétiques exclusivement à partir du glucose. En outre, le glucose joue un rôle d’élément constitutif structurel de base de certaines substances cellulaires.
Grâce à leur forte valeur énergétique, les lipides constituent une source efficace d’énergie. Les triglycérides à chaîne longue apportent à l’organisme les acides gras essentiels à la synthèse des composants cellulaires. Dans ces buts, l’émulsion lipidique contient des triglycérides à chaîne moyenne et à chaîne longue (dérivés de l’huile de soja et de l’huile de poisson).
La fraction des triglycérides à longue chaîne contient des triglycérides oméga 6 et oméga 3 pour l’apport en acides gras polyinsaturés. Ils sont principalement destinés à prévenir et traiter le déficit en acides gras essentiels, mais constituent également une source d’énergie. REANUTRIFLEX OMEGA E contient des acides gras oméga 6 essentiels, majoritairement sous la forme d’acide linoléique, et des acides gras oméga 3 essentiels sous la forme d’acide alpha‑linolénique, d’acide eicosapentaénoïque et d’acide docosahexaénoïque. Le rapport entre acides gras oméga 6 et oméga 3 contenus dans REANUTRIFLEX OMEGA E est d’environ 2,5/1.
Les triglycérides à chaîne moyenne sont plus rapidement hydrolysés, éliminés de la circulation et complètement oxydés, par comparaison avec les triglycérides à chaîne longue. Ils sont le substrat énergétique privilégié, en particulier lorsqu’un trouble de la dégradation et/ou de l’utilisation des triglycérides à longue chaîne est présent, p. ex. en cas de déficit en lipoprotéine lipase et/ou de déficit en cofacteurs de la lipoprotéine lipase.
5.2. Propriétés pharmacocinétiques
REANUTRIFLEX OMEGA E est perfusé par voie intraveineuse. Par conséquent, tous les substrats sont immédiatement disponibles pour la métabolisation.
Distribution
La dose, le débit de perfusion, la situation métabolique et les facteurs individuels propres au patient (niveau de jeûne) ont un impact majeur sur les concentrations maximales de triglycérides atteintes. Lorsque le produit est utilisé conformément aux instructions, dans le respect des recommandations posologiques, les concentrations des triglycérides ne dépassent généralement pas 4,6 mmol/L (400 mg/dL).
Les acides gras à chaîne moyenne ont une faible affinité pour l’albumine. Les expérimentations effectuées chez l’animal en administrant des émulsions pures de triglycérides à chaîne moyenne ont montré que les acides gras à chaîne moyenne pouvaient franchir la barrière hémato-encéphalique en cas de surdosage. Aucun effet indésirable n’a été observé avec une émulsion contenant un mélange de triglycérides à chaîne moyenne et de triglycérides à chaîne longue, tant que les triglycérides à chaîne longue exercent un effet inhibiteur sur l’hydrolyse des triglycérides à chaîne moyenne.
Par conséquent, les effets toxiques sur le cerveau peuvent être exclus après administration de REANUTRIFLEX OMEGA E.
Les acides aminés sont incorporés dans de nombreuses protéines au sein de divers organes. Par ailleurs, chaque acide aminé est également conservé sous forme libre dans le sang et à l’intérieur des cellules.
Le glucose étant hydrosoluble, il est distribué dans l’ensemble de l’organisme par l’intermédiaire du sang. Dans un premier temps, la solution de glucose est distribuée dans le compartiment intravasculaire, puis elle est absorbée dans le compartiment intracellulaire.
Aucune donnée n’est disponible concernant le franchissement de la barrière placentaire par les composants.
Biotransformation
Lorsqu’ils n’entrent pas dans la synthèse des protéines, les acides aminés sont métabolisés de la façon suivante. Le groupement aminé est séparé du squelette carboné par transamination. La chaîne carbonée est soit oxydée directement en CO2, soit utilisée comme substrat pour la néoglucogenèse dans le foie. Le groupement aminé est également métabolisé en urée dans le foie.
Le glucose est métabolisé en CO2 et H2O par l’intermédiaire des voies métaboliques connues. Une partie du glucose est utilisée pour la synthèse lipidique.
Après la perfusion, les triglycérides sont hydrolysés en glycérol et en acides gras. Ces derniers sont tous deux incorporés dans les voies physiologiques de la production d’énergie, de la synthèse de molécules biologiques actives, de la néoglucogenèse et de la re-synthèse lipidique.
Plus précisément, les acides gras polyinsaturés oméga 3 à longue chaîne remplacent l’acide arachidonique pour jouer le rôle de substrat eicosanoïde dans les membranes cellulaires et réduisent la production d’eicosanoïdes et de cytokines inflammatoires dans l’organisme. Cela peut être bénéfique chez les patients présentant un risque de développer un état hyper‑inflammatoire et un sepsis.
Élimination
Seules des quantités mineures d’acides aminés sont excrétées sous forme inchangée dans les urines.
Le surplus de glucose est excrété dans les urines uniquement si le seuil rénal de rétention du glucose est atteint.
Les triglycérides de l’huile de soja et les triglycérides à chaîne moyenne sont tous deux métabolisés complètement en CO2 et H2O. De petites quantités de lipides sont perdues uniquement lors de la desquamation des cellules cutanées et autres membranes épithéliales. Pratiquement aucune excrétion rénale ne se produit.
5.3. Données de sécurité préclinique
Aucune étude préclinique n’a été réalisée avec REANUTRIFLEX OMEGA E.
Aucun effet toxique n’est attendu lors de l’utilisation des mélanges de nutriments administrés comme traitement substitutif à la posologie recommandée.
Toxicité sur la reproduction
Des phyto-œstrogènes tels que le ß-sitostérol peuvent être présents dans diverses huiles végétales, en particulier l’huile de soja. Une altération de la fertilité a été mise en évidence chez le rat et le lapin après administration sous-cutanée et intra-vaginale de ß-sitostérol. Après administration de ß‑sitostérol pur, on a constaté une diminution de la masse testiculaire et une réduction de la concentration des spermatozoïdes chez le rat mâle, ainsi qu’une réduction du taux de gravidité chez la lapine. Cependant, en l’état actuel des connaissances, les effets observés chez l’animal ne semblent pas avoir de pertinence dans la pratique clinique.
REANUTRIFLEX OMEGA E ne doit pas être administré en même temps que du sang ; voir rubriques 4.4 et 4.5.
2 ans
Après retrait de l’emballage protecteur et après mélange des contenus de la poche :
La stabilité physico-chimique après reconstitution du mélange de glucose, d’acides aminés et de lipides a été démontrée pendant 7 jours à une température comprise entre +2°C et +8°C ainsi que pendant 2 jours supplémentaires à +25°C.
Après ajout d’additifs compatibles :
D’un point de vue microbiologique, le produit doit être utilisé immédiatement après ajout des additifs. S’il n’est pas utilisé immédiatement après l’ajout des additifs, les durées et conditions de conservation avant utilisation sont sous la responsabilité de l’utilisateur.
Après première ouverture (perforation du site de perfusion) :
Le mélange doit être utilisé immédiatement après ouverture du conditionnement.
6.4. Précautions particulières de conservation
À conserver à une température ne dépassant pas +25°C.
Ne pas congeler. En cas de congélation accidentelle, jeter la poche.
Conserver la poche dans l’emballage extérieur, à l'abri de la lumière.
6.5. Nature et contenu de l'emballage extérieur
REANUTRIFLEX OMEGA E est fourni dans des poches souples multicompartiments constituées de plusieurs couches. La couche interne en contact avec la solution est composée de polypropylène. La paire de sites à la base de la poche est constituée de polypropylène et de styrène-éthylène/butylène-styrène (SEBS). Les poches multicompartiments contiennent :
· 625 mL (250 mL de solution d’acides aminés + 125 mL d’émulsion lipidique + 250 mL de solution de glucose)
· 1 250 mL (500 mL de solution d’acides aminés + 250 mL d’émulsion lipidique + 500 mL de solution de glucose)
· 1 875 mL (750 mL de solution d’acides aminés + 375 mL d’émulsion lipidique + 750 mL de solution de glucose)
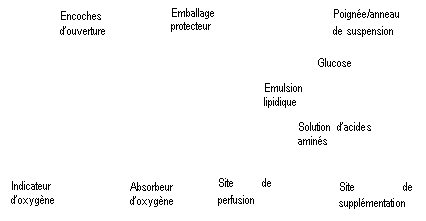
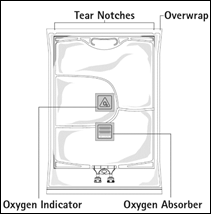
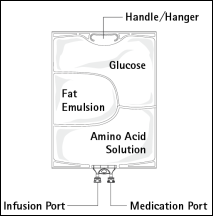
Figure A Figure B
Figure A : La poche multicompartiments est conditionnée dans un emballage protecteur. Un absorbeur d’oxygène et un indicateur d’oxygène sont placés entre la poche et l’emballage protecteur ; le sachet d’absorbeur d’oxygène est constitué d’une substance inerte et contient de l’hydroxyde de fer.
Figure B : Le compartiment supérieur contient une solution de glucose, le compartiment central contient une émulsion lipidique et le compartiment inférieur contient une solution d’acides aminés.
Le compartiment supérieur et le compartiment central peuvent être connectés au compartiment inférieur en ouvrant la soudure intermédiaire (soudure pelable).
La conception de la poche permet de mélanger les acides aminés, le glucose, les lipides et les électrolytes dans un compartiment unique. L’ouverture de la soudure pelable aboutit à un mélange stérile formant une émulsion.
Les différents formats de conditionnement sont présentés dans des boîtes contenant cinq poches.
Présentations : 5 × 625 mL, 5 × 1 250 mL et 5 × 1 875 mL.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Les médicaments de nutrition parentérale doivent être visuellement inspectés avant utilisation afin de vérifier l’absence de détérioration, de changement de coloration et d’instabilité de l’émulsion.
Ne pas utiliser les poches en cas de détérioration. L’emballage protecteur, le conditionnement primaire (poche) et les soudures non permanentes entre les compartiments doivent être intacts. Utiliser uniquement si les solutions d’acides aminés et de glucose sont limpides et incolores à jaune paille, et si l’émulsion lipidique forme un liquide homogène d’apparence blanc laiteux. Ne pas utiliser si les solutions contiennent des particules.
Après mélange des trois compartiments, ne pas utiliser si l’émulsion présente un changement de coloration ou des signes de séparation de phase (gouttes d’huile, film huileux). Cesser immédiatement la perfusion en cas de changement de coloration ou de signes de séparation de phase.
Avant d’ouvrir l’emballage protecteur, contrôler la couleur de l’indicateur d’oxygène (voir la figure A). Ne pas utiliser le produit si l’indicateur d’oxygène a viré au rose. Ne l’utiliser que si l’indicateur d’oxygène est jaune.
Préparation du mélange
Les règles d’asepsie doivent être strictement respectées lors de la manipulation du produit.
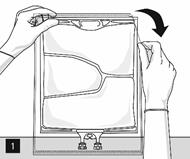
Pour ouvrir : Déchirer l’emballage protecteur en utilisant les encoches d’ouverture (fig. 1). Sortir la poche de son emballage protecteur. Jeter l’emballage protecteur, l’indicateur d’oxygène et l’absorbeur d’oxygène.
Inspecter visuellement le conditionnement primaire (poche) afin de vérifier l’absence de fuite. En cas de fuite, la poche doit être éliminée car sa stérilité ne peut être garantie.
Mélange de la poche et ajout d’additifs
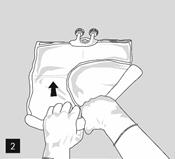
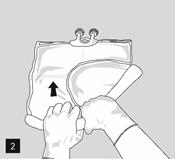
Pour ouvrir et mélanger successivement les compartiments, enrouler la poche avec les deux mains, en commençant par ouvrir la soudure pelable séparant le compartiment supérieur (glucose) du compartiment inférieur (acides aminés) (fig. 2).
Continuer ensuite à exercer une pression de façon à ouvrir la soudure pelable séparant le compartiment central (lipides) du compartiment inférieur (fig. 3).

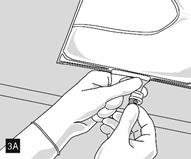
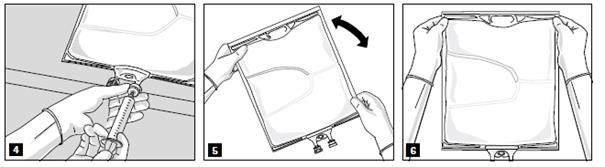
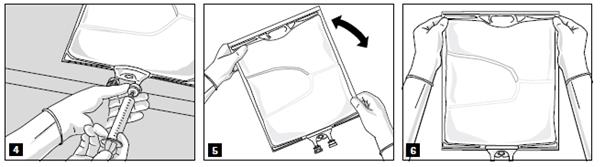
Lorsque tous les compartiments sont mélangés et après avoir retiré l’opercule en aluminium (fig. 3A), les additifs compatibles peuvent être ajoutés via le site de supplémentation (fig. 4). Mélanger soigneusement le contenu de la poche (fig. 5) et inspecter visuellement le mélange (fig. 6). Le mélange est une émulsion d’huile dans l’eau d’apparence homogène blanc laiteux. L’émulsion ne doit présenter aucun signe de séparation de phase.
REANUTRIFLEX OMEGA E peut être mélangé aux additifs suivants jusqu’aux limites supérieures des concentrations ou quantités maximales décrites ci-dessous après supplémentation. Les mélanges obtenus sont stables pendant 7 jours à une température comprise entre +2°C et +8°C ainsi que pendant 2 jours supplémentaires à +25°C.
· Électrolytes : prendre en compte les électrolytes déjà présents dans la poche ; la stabilité a été démontrée pour une quantité totale allant jusqu’à 200 mmol/L de sodium et de potassium, 9,6 mmol/L de magnésium et 6,4 mmol/L de calcium dans le mélange ternaire.
· Phosphate : la stabilité a été démontrée jusqu’à une concentration maximale de 20 mmol/L pour le phosphate inorganique ou jusqu’à une concentration maximale de 30 mmol/L pour le phosphate organique (pas les deux à la fois).
· Alanyl-glutamine : jusqu’à 24 g/L.
· Oligo-éléments et vitamines : la stabilité a été démontrée avec des préparations d’oligo-éléments et de vitamines disponibles sur le marché (par exemple Tracutil, Cernevit) conformément aux doses standards recommandées par le fabricant du micronutriment.
Des informations sur les additifs décrits ci-dessus ainsi que la durée de conservation de ces additifs peuvent être fournies sur demande par le fabricant.
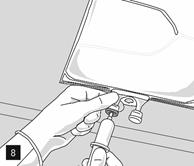
Préparation de la perfusion
L’émulsion doit être systématiquement ramenée à température ambiante avant la perfusion.
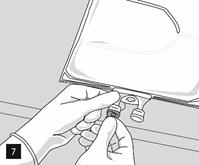
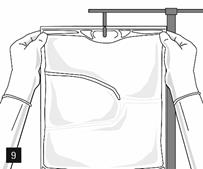
Retirer l’opercule en aluminium du site de perfusion (fig. 7) et fixer la ligne de perfusion (fig. 8). Utiliser une ligne de perfusion sans prise d’air ou fermer la prise d’air si une ligne de perfusion avec prise d’air est utilisée. Suspendre la poche sur une potence pour perfusion (fig. 9) et procéder à la perfusion selon la technique standard.
À usage unique strict. Le conditionnement et les résidus de produit inutilisés doivent être éliminés après utilisation.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Ne pas reconnecter des conditionnements partiellement utilisés.
Si des filtres sont utilisés, ils doivent être perméables aux lipides (taille des pores ≥ 1,2 µm).
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 300 774 6 7 : 1250 ml en poche à trois compartiments (polypropylène-SEBS/SEBS/copolyester-éther). Boîte de 5.
· 34009 300 774 7 4 : 1875 ml en poche à trois compartiments (polypropylène-SEBS/SEBS/copolyester-éther). Boîte de 5.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
ANSM - Mis à jour le : 30/01/2024
REANUTRIFLEX OMEGA E, émulsion pour perfusion
Acides aminés, Glucose, Lipides, Electrolytes
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, ou votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, ou votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que REANUTRIFLEX OMEGA E, émulsion pour perfusion et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser REANUTRIFLEX OMEGA E, émulsion pour perfusion ?
3. Comment utiliser REANUTRIFLEX OMEGA E, émulsion pour perfusion ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver REANUTRIFLEX OMEGA E, émulsion pour perfusion ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE REANUTRIFLEX OMEGA E ET DANS QUELS CAS EST-IL UTILISE ?
REANUTRIFLEX OMEGA E contient des liquides et des substances appelées acides aminés, électrolytes et acides gras, qui sont essentiels pour permettre à l’organisme de se développer et de se rétablir. Le produit contient également des calories sous la forme de glucides et de lipides.
REANUTRIFLEX OMEGA E est administrée à des adultes, à des adolescents et à des enfants âgés de plus de 2 ans.
REANUTRIFLEX OMEGA E vous est administré lorsque vous êtes dans l’incapacité de vous alimenter normalement. Ce peut être le cas dans de nombreuses situations, par exemple lorsque vous récupérez d’une intervention chirurgicale, de blessures ou de brûlures ou lorsque vous ne pouvez pas absorber les aliments par l’intermédiaire de votre estomac et de vos intestins.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER REANUTRIFLEX OMEGA E ?
N’utilisez jamais REANUTRIFLEX OMEGA E :
· si vous êtes allergique aux substances actives, aux œufs, à l’arachide, au soja, au poisson ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· Ce médicament ne doit pas être administré aux nouveau-nés, aux nourrissons et aux jeunes enfants âgés de moins de deux ans.
Par ailleurs, vous ne devez pas utiliser REANUTRIFLEX OMEGA E si vous souffrez de l’un des troubles suivants :
· problèmes de circulation sanguine constituant une menace pour votre pronostic vital comme ceux pouvant se produire si vous êtes en état de collapsus ou de choc
· crise cardiaque ou accident vasculaire cérébral
· trouble sévère de la coagulation du sang, risque de saignement (coagulopathie sévère, terrain hémorragique en voie d’aggravation)
· obstruction de vaisseaux sanguins par des caillots de sang ou de graisse (embolie)
· insuffisance hépatique sévère
· altération de la sécrétion biliaire (cholestase intrahépatique)
· insuffisance rénale sévère en l’absence de traitement de substitution rénale
· perturbations de la composition en sels de votre organisme
· présence d’eau en quantité insuffisante ou excessive dans votre corps
· présence d’eau dans vos poumons (œdème pulmonaire)
· insuffisance cardiaque sévère
· certains troubles du métabolisme, tels que
o quantité excessive de lipides (graisses) dans le sang
o anomalies congénitales du métabolisme des acides aminés
o taux de sucre dans le sang anormalement élevé dont le contrôle nécessite l’administration de plus de 6 unités d’insuline par heure
o anomalies du métabolisme pouvant survenir après des opérations ou des blessures
o coma d’origine indéterminée
o apport en oxygène insuffisant dans les tissus
o taux d’acide anormalement élevé dans le sang
Avertissements et précautions
Adressez-vous à votre médecin, à votre pharmacien ou à votre infirmier/ère avant d’utiliser REANUTRIFLEX OMEGA E.
Veuillez informer votre médecin si :
· vous avez des problèmes au cœur, au foie ou aux reins ;
· vous souffrez de certains types de troubles métaboliques tels qu’un diabète, des taux anormaux de graisses dans le sang et des altérations de la composition en liquides et en sels ou de l’équilibre acido-basique de votre organisme.
Les signes précoces d’une réaction allergique (tels que fièvre, frissons, éruption cutanée ou essoufflement) seront étroitement surveillés lorsque vous recevrez ce médicament.
Le personnel infirmier pourra également prendre les mesures nécessaires pour s’assurer que les besoins de votre corps en liquides et en électrolytes sont satisfaits. En plus de REANUTRIFLEX OMEGA E, il est possible que l’on vous administre des nutriments (éléments nutritionnels) supplémentaires afin que vos besoins soient entièrement couverts.
Enfants
Autres médicaments et REANUTRIFLEX OMEGA E
Informez votre médecin, votre pharmacien ou votre infirmier/ère si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
REANUTRIFLEX OMEGA E peut interagir avec d’autres médicaments. Informez votre médecin, votre pharmacien ou votre infirmier/ère si vous prenez ou recevez l’un des médicaments suivants :
· insuline,
· héparine,
· médicaments utilisés pour prévenir la formation indésirable de caillots de sang, comme la warfarine ou les autres dérivés coumariniques,
· médicaments favorisant le débit urinaire (diurétiques),
· médicaments utilisés pour traiter l’hypertension artérielle ou des problèmes cardiaques (inhibiteurs de l’enzyme de conversion [IEC] et antagonistes des récepteurs de l’angiotensine II),
· médicaments utilisés lors des greffes d’organes, comme la ciclosporine et le tacrolimus,
· médicaments utilisés pour traiter l’inflammation (corticostéroïdes),
· préparations hormonales affectant l’équilibre hydrique (hormone adrénocorticotrope, appelée ACTH).
REANUTRIFLEX OMEGA E avec des aliments
Sans objet.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament. Si vous êtes enceinte, vous recevrez ce médicament uniquement si votre médecin ou pharmacien juge qu’il est absolument indispensable à votre rétablissement. Il n’existe pas de données disponibles sur l’utilisation de REANUTRIFLEX OMEGA E chez la femme enceinte.
L’allaitement est déconseillé chez les mères recevant une nutrition parentérale.
Conduite de véhicules et utilisation de machines
Ce médicament est normalement administré à des patients immobilisés, à l’hôpital ou dans une clinique par exemple, ce qui exclut la possibilité de conduire des véhicules ou d’utiliser des machines. Cependant, le médicament en lui-même n’a aucune influence sur l’aptitude à conduire des véhicules et à utiliser des machines.
REANUTRIFLEX OMEGA E contient du sodium
Ce médicament contient 1,244 mg de sodium (composant principal du sel de cuisine/table) par ml. Cela équivaut à 0,062% de l’apport alimentaire quotidien maximal recommandé de sodium pour un adulte.
La dose journalière maximale recommandée de ce médicament contient 3 048 mg de sodium (présent dans le sel de table). Cela équivaut à 152 % de l’apport alimentaire quotidien maximal recommandé de sodium pour un adulte.
Parlez-en à votre médecin ou votre pharmacien si vous avez besoin d’une poche ou plus d’une poche quotidiennement pendant une période prolongée, surtout si vous devez suivre un régime à faible teneur en sel (sodium).
3. COMMENT UTILISER REANUTRIFLEX OMEGA E ?
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
Ce médicament vous sera administré en perfusion intraveineuse (goutte à goutte), c’est-à-dire directement dans une veine à l’aide d’un petit tube. Ce médicament doit être administré uniquement dans une de vos grosses veines (centrales).
La durée de perfusion recommandée pour une poche de nutrition parentérale est de 24 h maximum.
Votre médecin ou pharmacien déterminera la quantité de ce médicament dont vous avez besoin et pendant combien de temps vous devrez être traité(e) par ce médicament.
Utilisation chez les enfants
Ce médicament ne doit pas être donné aux nouveau-nés, aux nourrissons et aux jeunes enfants âgés de moins de deux ans.
Votre médecin déterminera la quantité de ce médicament dont votre enfant aura besoin et pendant combien de temps votre enfant devra être traité par ce médicament.
Si vous avez utilisé plus de REANUTRIFLEX OMEGA E que vous n’auriez dû :
Si vous avez reçu une quantité excessive de ce médicament, vous pourriez présenter ce que l’on appelle un « syndrome de surcharge » et les symptômes suivants :
· excès de liquides et troubles électrolytiques
· présence d’eau dans vos poumons (œdème pulmonaire)
· pertes d’acides aminés dans les urines et perturbation de l’équilibre en acides aminés
· vomissements, nausées
· frissons
· taux de sucre élevé dans le sang
· présence de glucose dans les urines
· déficit hydrique
· concentration du sang beaucoup plus importante que la normale (hyperosmolalité)
· altération ou perte de conscience due à un taux de sucre extrêmement élevé dans le sang
· augmentation du volume du foie (hépatomégalie) avec ou sans jaunisse (ictère)
· augmentation du volume de la rate (splénomégalie)
· dépôts de graisse dans les organes internes
· anomalies des constantes de la fonction hépatique
· diminution du nombre de globules rouges (anémie)
· diminution du nombre de globules blancs (leucopénie)
· diminution du nombre de plaquettes (thrombopénie)
· augmentation des globules rouges immatures (réticulocytose)
· destruction des cellules sanguines (hémolyse)
· hémorragie ou tendance aux saignements
· trouble de la coagulation du sang (mise en évidence par des modifications des temps de saignement, temps de coagulation, temps de prothrombine, etc )
· fièvre
· taux de graisses élevés dans le sang
· perte de conscience
Si l’un de ces symptômes apparaît, la perfusion doit être immédiatement interrompue.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demander plus d’informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les effets indésirables suivants peuvent être graves. Si l’un des effets indésirables suivants survient, prévenez immédiatement votre médecin ; il arrêtera de vous donner ce médicament :
Rare (pouvant affecter jusqu’à 1 personne sur 1 000) :
· réactions allergiques, avec par exemple réactions cutanées, essoufflement, gonflement des lèvres, de la bouche et de la gorge, difficultés à respirer
Les autres effets indésirables comprennent :
Peu fréquent (pouvant affecter jusqu’à 1 personne sur 100) :
· sensation nauséeuse, vomissements, perte d’appétit
Rare (pouvant affecter jusqu’à 1 personne sur 1 000) :
· tendance accrue du sang à former des caillots
· coloration bleuâtre de la peau
· essoufflement
· maux de tête
· bouffées de chaleur
· rougeur de la peau (érythème)
· transpiration
· frissons
· sensation de froid
· élévation de la température corporelle
· somnolence
· douleur au niveau de la poitrine, du dos, des os ou de la région lombaire
· diminution ou augmentation de la pression artérielle
Très rare (pouvant affecter jusqu’à 1 personne sur 10 000) :
· taux de graisses ou de sucre anormalement élevés dans le sang
· taux élevés de substances acides dans le sang
· un excès de lipides peut entraîner un syndrome de surcharge graisseuse. Pour plus d’informations à ce sujet, veuillez-vous reporter au paragraphe « Si vous avez utilisé plus de REANUTRIFLEX OMEGA E que vous n’auriez dû » dans la rubrique 3. Les symptômes disparaissent normalement après l’arrêt de la perfusion.
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) :
· diminution du nombre de globules blancs (leucopénie)
· diminution du nombre de plaquettes (thrombopénie)
· altération de la sécrétion de la bile (cholestase)
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER REANUTRIFLEX OMEGA E ?
Tenir ce médicament hors de la vue et de la portée des enfants.
À conserver à une température ne dépassant pas +25 °C.
Ne pas congeler. En cas de congélation accidentelle, jeter la poche.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette. La date de péremption fait référence au dernier jour de ce mois.
Conserver la poche dans l’emballage extérieur, à l'abri de la lumière.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient REANUTRIFLEX OMEGA E
· Les substances actives contenues dans le mélange prêt à l’emploi sont :
|
Compartiment supérieur |
Dans 1 000 mL |
Poche de 625 mL |
Poche de 1 250 mL |
Poche de 1 875 mL |
|
Glucose monohydraté |
158,4 g |
99,00 g |
198,0 g |
297,0 g |
|
équivalent glucose |
144,0 g |
90,00 g |
180,0 g |
270,0 g |
|
Phosphate monosodique dihydraté |
2,496 g |
1,560 g |
3,120 g |
4,680 g |
|
Acétate de zinc dihydraté |
7,024 mg |
4,390 mg |
8,780 mg |
13,17 mg |
|
Compartiment central |
Dans 1 000 mL |
Poche de 625 mL |
Poche de 1 250 mL |
Poche de 1 875 mL |
|
Triglycérides à chaîne moyenne |
20,00 g |
12,50 g |
25,00 g |
37,50 g |
|
Huile de soja raffinée |
16,00 g |
10,00 g |
20,00 g |
30,00 g |
|
Triglycérides d’acides gras oméga 3 |
4,000 g |
2,500 g |
5,000 g |
7,500 g |
|
Compartiment inférieur |
Dans 1 000 mL |
Poche de 625 mL |
Poche de 1 250 mL |
Poche de 1 875 mL |
|
Isoleucine |
3,284 g |
2,053 g |
4,105 g |
6,158 g |
|
Leucine |
4,384 g |
2,740 g |
5,480 g |
8,220 g |
|
Chlorhydrate de lysine équivalent lysine |
3,980 g |
2,488 g 1,991 g |
4,975 g 3,982 g |
7,463 g 5,973 g |
|
Méthionine |
2,736 g |
1,710 g |
3,420 g |
5,130 g |
|
Phénylalanine |
4,916 g |
3,073 g |
6,145 g |
9,218 g |
|
Thréonine |
2,540 g |
1,588 g |
3,175 g |
4,763 g |
|
Tryptophane |
0,800 g |
0,500 g |
1,000 g |
1,500 g |
|
Valine |
3,604 g |
2,253 g |
4,505 g |
6,758 g |
|
Arginine |
3,780 g |
2,363 g |
4,725 g |
7,088 g |
|
Chlorhydrate d’histidine monohydraté équivalent histidine |
2,368 g 1,753 g |
1,480 g 1,095 g |
2,960 g 2,191 g |
4,440 g 3,286 g |
|
Alanine |
6,792 g |
4,245 g |
8,490 g |
12,73 g |
|
Acide aspartique |
2,100 g |
1,313 g |
2,625 g |
3,938 g |
|
Acide glutamique |
4,908 g |
3,068 g |
6,135 g |
9,203 g |
|
Glycine |
2,312 g |
1,445 g |
2,890 g |
4,335 g |
|
Proline |
4,760 g |
2,975 g |
5,950 g |
8,925 g |
|
Sérine |
4,200 g |
2,625 g |
5,250 g |
7,875 g |
|
Hydroxyde de sodium |
1,171 g |
0,732 g |
1,464 g |
2,196 g |
|
Chlorure de sodium |
0,378 g |
0,237 g |
0,473 g |
0,710 g |
|
Acétate de sodium trihydraté |
0,250 g |
0,157 g |
0,313 g |
0,470 g |
|
Acétate de potassium |
3,689 g |
2,306 g |
4,611 g |
6,917 g |
|
Acétate de magnésium tétrahydraté |
0,910 g |
0,569 g |
1,137 g |
1,706 g |
|
Chlorure de calcium dihydraté |
0,623 g |
0,390 g |
0,779 g |
1,169 g |
|
|
||||
|
Électrolytes [mmol] |
Dans 1 000 mL |
Poche de 625 mL |
Poche de 1 250 mL |
Poche de 1 875 mL |
|
Sodium |
53,6 |
33,5 |
67 |
100,5 |
|
Potassium |
37,6 |
23,5 |
47 |
70,5 |
|
Magnésium |
4,2 |
2,65 |
5,3 |
7,95 |
|
Calcium |
4,2 |
2,65 |
5,3 |
7,95 |
|
Zinc |
0,03 |
0,02 |
0,04 |
0,06 |
|
Chlorure |
48 |
30 |
60 |
90 |
|
Acétate |
48 |
30 |
60 |
90 |
|
Phosphate |
16 |
10 |
20 |
30 |
|
|
Dans 1 000 mL |
Poche de 625 mL |
Poche de 1 250mL |
Poche de |
|
Teneur en acides aminés [g] |
56,0 |
35,0 |
70,1 |
105,1 |
|
Teneur en azote [g] |
8 |
5 |
10 |
15 |
|
Teneur en glucides [g] |
144 |
90 |
180 |
270 |
|
Teneur en lipides [g] |
40 |
25 |
50 |
75 |
|
|
Dans 1 000 mL |
Poche de 625 mL |
Poche de 1 250mL |
Poche de |
|
Valeur énergétique sous forme de lipides (kJ [kcal]) |
1 590 |
995 |
1 990 |
2 985 |
|
Valeur énergétique sous forme de glucides (kJ [kcal]) |
2 415 |
1 510 |
3 015 |
4 520 |
|
Valeur énergétique sous forme de protéines (kJ [kcal]) |
940 |
585 |
1 170 |
1 755 |
|
Valeur énergétique non protéique (kJ [kcal]) |
4 005 |
2 505 |
5 005 |
7 510 |
|
Valeur énergétique totale (kJ [kcal]) |
4 945 |
3 090 |
6 175 |
9 260 |
|
|
|
|
|
|
|
Osmolalité [mOsm/kg] |
2 115 |
2 115 |
2 115 |
2 115 |
|
Osmolarité théorique [mOsm/L] |
1 545 |
1 545 |
1 545 |
1 545 |
|
pH |
5,0 – 6,0 |
5,0 – 6,0 |
5,0 – 6,0 |
5,0 – 6,0 |
· Les autres composants sont :
acide citrique monohydraté (pour l’ajustement du pH), phospholipides d’œuf pour préparations injectables , glycérol, oléate de sodium, tout-rac-α-tocophérol, hydroxyde de sodium (pour l’ajustement du pH) et eau pour préparations injectables.
Qu’est-ce que REANUTRIFLEX OMEGA E et contenu de l’emballage extérieur
REANUTRIFLEX OMEGA E est fourni dans des poches souples multicompartiments contenant :
· 625 mL (250 mL de solution d’acides aminés + 125 mL d’émulsion lipidique + 250 mL de solution de glucose)
· 1 250 mL (500 mL de solution d’acides aminés + 250 mL d’émulsion lipidique + 500 mL de solution de glucose)
· 1 875 mL (750 mL de solution d’acides aminés + 375 mL d’émulsion lipidique + 750 mL de solution de glucose)
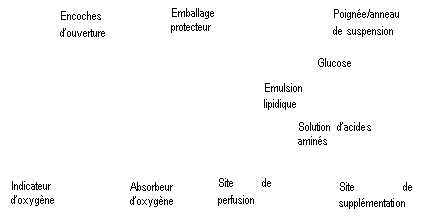
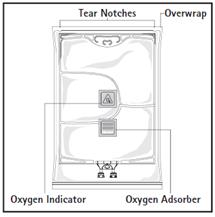
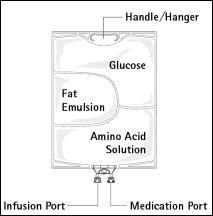
Figure A Figure B
Figure A : La poche multicompartiments est conditionnée dans un emballage protecteur. Un absorbeur d’oxygène et un indicateur d’oxygène sont placés entre la poche et l’emballage protecteur ; le sachet d’absorbeur d’oxygène est constitué d’une substance inerte et contient de l’hydroxyde de fer.
Figure B : Le compartiment supérieur contient une solution de glucose, le compartiment central contient une émulsion lipidique et le compartiment inférieur contient une solution d’acides aminés.
Les solutions de glucose et d’acides aminés sont limpides et incolores à jaune paille. L’émulsion lipidique est d’apparence blanc laiteux.
Le compartiment supérieur et le compartiment central peuvent être connectés au compartiment inférieur en ouvrant la soudure intermédiaire.
Les différents formats de conditionnement sont présentés dans des boîtes contenant cinq poches.
Présentations : 5x 625 mL, 5 x 1 250 mL et 5 x 1 875 mL
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
CARL-BRAUN-STRASSE 1
34212 MELSUNGEN
ALLEMAGNE
Exploitant de l’autorisation de mise sur le marché
26 RUE ARMENGAUD
92210 SAINT-CLOUD
CARL-BRAUN-STRASSE 1
34212 MELSUNGEN
ALLEMAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen et au Royaume-Uni (Irlande du Nord) sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé :
Les médicaments de nutrition parentérale doivent être visuellement inspectés avant utilisation afin de vérifier l’absence de détérioration, de changement de coloration et d’instabilité de l’émulsion.
Ne pas utiliser les poches en cas de détérioration. L’emballage protecteur, le conditionnement primaire (poche) et les soudures non permanentes entre les compartiments doivent être intacts. Utiliser uniquement si les solutions d’acides aminés et de glucose sont limpides et incolores à jaune paille, et si l’émulsion lipidique forme un liquide homogène d’apparence blanc laiteux. Ne pas utiliser si les solutions contiennent des particules.
Après mélange des trois compartiments, ne pas utiliser si l’émulsion présente un changement de coloration ou des signes de séparation de phase (gouttes d’huile, film huileux). Cesser immédiatement la perfusion en cas de changement de coloration ou de signes de séparation de phase.
Avant d’ouvrir l’emballage protecteur, contrôler la couleur de l’indicateur d’oxygène (voir la figure A). Ne pas utiliser le produit si l’indicateur d’oxygène a viré au rose. Ne l’utiliser que si l’indicateur d’oxygène est jaune.
Préparation du mélange
Les règles d’asepsie doivent être strictement respectées lors de la manipulation du produit.
Pour ouvrir : Déchirer l’emballage protecteur en utilisant les encoches d’ouverture (fig. 1). Sortir la poche de son emballage protecteur. Jeter l’emballage protecteur, l’indicateur d’oxygène et l’absorbeur d’oxygène.
Inspecter visuellement le conditionnement primaire (poche) afin de vérifier l’absence de fuite. En cas de fuite, la poche doit être éliminée car sa stérilité ne peut être garantie.
Mélange de la poche et ajout d’additifs
Pour ouvrir et mélanger successivement les compartiments, enrouler la poche avec les deux mains, en commençant par ouvrir la soudure pelable séparant le compartiment supérieur (glucose) du compartiment inférieur (acides aminés) (fig. 2).
Continuer ensuite à exercer une pression de façon à ouvrir la soudure pelable séparant le compartiment central (lipides) du compartiment inférieur (fig. 3).

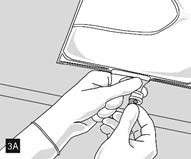
Lorsque tous les compartiments sont mélangés et après avoir retiré l’opercule en aluminium (fig. 3A), les additifs compatibles peuvent être ajoutés via le site de supplémentation (fig. 4). Mélanger soigneusement le contenu de la poche (fig. 5) et inspecter visuellement le mélange (fig. 6). Le mélange est une émulsion d’huile dans l’eau d’apparence homogène blanc laiteux. L’émulsion ne doit présenter aucun signe de séparation de phase.
REANUTRIFLEX OMEGA E peut être mélangé aux additifs suivants jusqu’aux limites supérieures des concentrations ou quantités maximales décrites ci-dessous après supplémentation. Les mélanges obtenus sont stables pendant 7 jours à une température comprise entre +2°C et +8°C ainsi que pendant 2 jours supplémentaires à +25°C.
· Électrolytes : prendre en compte les électrolytes déjà présents dans la poche ; la stabilité a été démontrée pour une quantité totale allant jusqu’à 200 mmol/L de sodium et de potassium, 9,6 mmol/L de magnésium et 6,4 mmol/L de calcium dans le mélange ternaire.
· Phosphate : la stabilité a été démontrée jusqu’à une concentration maximale de 20 mmol/L pour le phosphate inorganique ou jusqu’à une concentration maximale de 30 mmol/L pour le phosphate organique (pas les deux à la fois).
· Alanyl-glutamine : jusqu’à 24 g/L.
· Oligo-éléments et vitamines : la stabilité a été démontrée avec des préparations d’oligo-éléments et de vitamines disponibles sur le marché (par exemple Tracutil, Cernevit) conformément aux doses standards recommandées par le fabricant du micronutriment.
Des informations sur les additifs décrits ci-dessus ainsi que la durée de conservation de ces additifs peuvent être fournies sur demande par le fabricant.
Préparation de la perfusion
L’émulsion doit être systématiquement ramenée à température ambiante avant la perfusion.
Retirer l’opercule en aluminium du site de perfusion (fig. 7) et fixer la ligne de perfusion (fig. 8). Utiliser une ligne de perfusion sans prise d’air ou fermer la prise d’air si une ligne de perfusion avec prise d’air est utilisée. Suspendre la poche sur une potence pour perfusion (fig. 9) et procéder à la perfusion selon la technique standard.
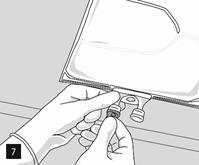
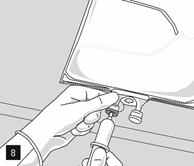
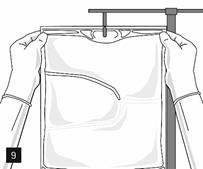
À usage unique strict. Le conditionnement et les résidus de produit inutilisés doivent être éliminés après utilisation.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Ne pas reconnecter des conditionnements partiellement utilisés.
Si des filtres sont utilisés, ils doivent être perméables aux lipides (taille des pores ≥ 1,2 µm).
Durée de conservation après retrait de l’emballage protecteur et après mélange des contenus de la poche
La stabilité physico-chimique après reconstitution du mélange de glucose, d’acides aminés et de lipides a été démontrée pendant 7 jours à une température comprise entre +2°C et +8°C ainsi que pendant 2 jours supplémentaires à +25°C.
Durée de conservation après ajout d’additifs compatibles
D’un point de vue microbiologique, le produit doit être utilisé immédiatement après ajout des additifs. S’il n’est pas utilisé immédiatement après l’ajout des additifs, les durées et conditions de conservation avant utilisation sont sous la responsabilité de l’utilisateur.
Après première ouverture (perforation du site de perfusion)
Le mélange doit être utilisé immédiatement après ouverture du conditionnement.
REANUTRIFLEX OMEGA E ne doit pas être mélangé avec d’autres médicaments dont la compatibilité n’a pas été documentée.
REANUTRIFLEX OMEGA E ne doit pas être administré en même temps que du sang dans la même ligne de perfusion en raison du risque de pseudo-agglutination.