Dernière mise à jour le 01/12/2025
UVESTEROL VITAMINE A.D.E.C., solution buvable
Indications thérapeutiques
Classe pharmacothérapeutique ; association de vitamines, code ATC : A11JA
Ce médicament est indiqué chez le nouveau-né (en particulier le nouveau-né prématuré) et le nourrisson présentant un risque de carence ou de malabsorption en vitamines A, D, E et C.
Présentations
> 1 flacon(s) en verre brun avec fermeture de sécurité enfant de 10 ml avec pipette(s) doseuse(s) polystyrène polyéthylène basse densité (PEBD)
Code CIP : 279 159-5 ou 34009 279 159 5 6
Déclaration de commercialisation : 01/12/2014
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
Autres informations
- Titulaire de l'autorisation : Laboratoires CRINEX
- Conditions de prescription et de délivrance :
- liste I
- réservé à l'usage HOSPITALIER
- Statut de l'autorisation : Valide
- Type de procédure : Procédure nationale
- Code CIS : 6 820 211 5
ANSM - Mis à jour le : 25/06/2024
UVESTEROL VITAMINE A.D.E.C., solution buvable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Concentrat de vitamine A synthétique (forme huileuse) ...................................................... 100 000 UI
(Quantité correspondante à ............................................................................................. 58,823 mg)
Ergocalciférol (vitamine D2) .............................................................................................. 33 333 UI
(Quantité correspondante à .............................................................................................. 0,833 mg)
Acétate d'alpha-tocophérol (vitamine E) ................................................................................ 0,167 g
Acide ascorbique (vitamine C) .............................................................................................. 1,667 g
Pour un flacon de 10 ml
1 dose de 0,3 mL= 3000 UI de vitamine A, 1000 UI de vitamine D, 5 mg de vitamine E et 50 mg de vitamine C.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution incolore à jaunâtre, limpide à légèrement opalescente avec une odeur de fruits rouges.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Posologie
La posologie usuelle est de 1 dose (0,3 mL) par jour.
Mode d'administration
La solution étant aqueuse, elle doit être systématiquement diluée avant administration dans un biberon de faible volume avant la tétée.
Afin de limiter le risque de fausse route lors de l'administration du produit, il est particulièrement important de suivre scrupuleusement le mode d'administration du produit:
Mode d’administration chez le nouveau-né et le nourrisson :
· Toujours administrer le produit avant la tétée ou le biberon.
· Utiliser exclusivement la pipette doseuse fournie dans la boîte :

· Prélever à l’aide de la pipette jusqu’au trait rouge correspondant à une dose.
· Diluer cette dose dans un petit volume de lait (environ 2 mL) dans une tétine adaptée à l’enfant. Si l’enfant est allaité au sein, la dilution peut se faire soit dans le lait de la maman, soit dans de l’eau :

· Prendre l’enfant éveillé, l’installer en position semi-assise au creux du bras, la tête reposée sur le bras :
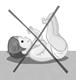

· Laisser l’enfant téter doucement la tétine, lui retirer la tétine une fois vide, puis lui donner le sein ou le biberon.

· Ne pas allonger l’enfant immédiatement après l’administration.
· Rincer la pipette et la tétine à l’eau après chaque utilisation.
· Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1
· Hypercalcémie
· Hypercalciurie
· Lithiase calcique
4.4. Mises en garde spéciales et précautions d'emploi
Par conséquent, afin de limiter ce risque, l'administration de l'Uvestérol vitaminé ADEC doit s'effectuer en respectant scrupuleusement le protocole d'administration du produit détaillé en rubrique 4.2.
En cas de reflux gastro-oesophagien, de problèmes digestifs ou de troubles de la déglutition, ne pas administrer pur, mais dans une tétine adaptée à l’enfant après dilution dans 2ml d'eau ou de lait selon le mode d'allaitement préconisé (voir rubrique 4.2).
Les vitamines A et D sont présentes dans de nombreux médicaments. La vitamine D est également présente dans de nombreux laits pour nouveau-nés et nourrissons.
Pour éviter tout surdosage, susceptible d'entraîner des effets indésirables graves, tenir compte des doses totales de vitamine D et de vitamine A en cas d'association avec un traitement contenant déjà ces vitamines ou en cas d'utilisation de lait supplémenté en vitamine D.
En raison d’un effet légèrement stimulant de la vitamine C, il est préférable de ne pas prendre ce médicament en fin de journée.
En cas d’apport en calcium, un contrôle régulier de la calciurie est indispensable.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
4.6. Fertilité, grossesse et allaitement
Sans objet.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Des cas de malaise vagal (apnée du nourrisson) et des cas de fausses routes ont été rapportés chez des nouveau-nés et nourrissons, sans pathologie connue, âgés notamment de moins de 1 mois lors de l'administration de l'UVESTEROL Vitaminé ADEC. La cause de ces cas n’a pas été clairement établie à ce jour (voir rubriques 4.2 et 4.4).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr..
Signes résultant de l'administration de doses excessives de vitamine D :
Signes cliniques:
· céphalées, asthénie, anorexie, amaigrissement, arrêt de croissance,
· nausées, vomissements,
· polyurie, polydipsie, déshydratation,
· hypertension artérielle,
· lithiase calcique, calcifications tissulaires, en particulier rénales et vasculaires, insuffisance rénale.
Signes biologiques:
· hypercalcémie, hypercalciurie, hyperphosphatémie, hyperphosphaturie.
Signes résultant de l'administration de doses excessives de vitamine A :
Aigu (doses supérieures à 150 000 UI):
· Signes cliniques: troubles digestifs, céphalées, hypertension intracrânienne (se manifestant chez le nourrisson par le bombement de la fontanelle), œdème papillaire, troubles psychiatriques, irritabilité, voire convulsions, desquamation généralisée retardée.
Chronique (risque d'intoxication chronique lors d'un apport prolongé de vitamine A à des doses supraphysiologiques chez un sujet non carencé):
· signes cliniques: hypertension intracrânienne, hyperostose corticale des os longs et soudure précoce épiphysaire. Le diagnostic est généralement porté sur la constatation de gonflements sous-cutanés sensibles ou douloureux au niveau des extrémités des membres. Les radiographies objectivent un épaississement périsoté diaphysaire au niveau du cubitus, du péroné, des clavicules et des côtes.
Conduite à tenir:
Cesser l'administration de ce médicament, réduire les apports calciques, augmenter la diurèse par des boissons abondantes.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : associations de vitamines, code ATC : A11JA
La vitamine D est une vitamine liposoluble. Elle exerce un rôle essentiel sur l'intestin, dont elle augmente la capacité à absorber le calcium et les phosphates et elle favorise la minéralisation du squelette, grâce à ses actions directes sur l'os en formation et à ses actions indirectes impliquant l'intestin, les parathyroïdes et l'os déjà minéralisé.
La vitamine A est une vitamine liposoluble. Elle joue un rôle important dans la formation du pourpre rétinien (nécessaire à l'adaptation de la vision lorsque la lumière diminue), dans la multiplication cellulaire et la trophicité épithéliale et tissulaire.
La vitamine E est une vitamine liposoluble, agissant comme agent anti-oxydant et au niveau de la synthèse de l'hème, très répandue dans tous les aliments.
La vitamine C est une vitamine hydrosoluble, largement répandue dans le monde vivant, apportée essentiellement par les végétaux (fruits frais, crudités, salades, légumes verts et autres légumes frais), nécessaire à l'homme pour les réactions d'oxydo-réduction.
5.2. Propriétés pharmacocinétiques
La vitamine D est absorbée dans l'intestin grêle de façon passive, puis rejoint la circulation générale par voie lymphatique, incorporée aux chylomicrons.
Après absorption, elle se lie à une protéine porteuse spécifique et est transportée jusqu'au foie pour y être convertie en 25-hydroxyvitamine D. Cette dernière se lie à son tour à la même protéine porteuse et est transportée jusqu'aux reins ou elle est transformée en sa forme active, la 1,25-dihydroxyvitamine D.
Ses sites de stockage essentiels sont le tissu adipeux, les muscles, mais aussi le sang. La 25 hydroxyvitamine D liée à sa protéine porteuse est la forme majeure de réserve circulante de la vitamine D. Sa demi-vie dans le sang est de 15 à 40 jours.
L'élimination de la vitamine D et de ses métabolites se fait par voie fécale, sous forme non transformée ou sous forme hydrosoluble (acide calcitroïque, dérivés glycuroconjugués).
Vitamine A
L'absorption digestive au niveau de l'intestin est liée à celle des graisses.
Le stockage hépatique est important (à 90 %) et se fait sous forme de rétinyl-esters principalement.
La vitamine A est liée au RBPP (rétinol binding plasmatic protein) formée par le foie.
L'élimination se fait par voie fécale et urinaire sous forme de dérivés.
Vitamine C
La résorption digestive est correcte avec absence d'accumulation. En cas d'apports supérieurs aux besoins, l'excès est éliminé par voie urinaire.
Vitamine E
Son absorption se fait au niveau de l'intestin grêle sous forme e micelles mixtes, selon un processus de diffusion. La principale forme circulante est l'α-tocophérol lié aux HDL et LDL.
Elle est stockée au niveau du tissu adipeux, du foie et des muscles.
L'élimination se fait sous forme conjuguée dans la bile.
5.3. Données de sécurité préclinique
18 mois.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C et à l'abri de la lumière.
6.5. Nature et contenu de l'emballage extérieur
10 ml de solution buvable en flacon en verre brun (de type III), fermé par un bouchon sécurité-enfant blanc (en polypropylène) muni d’un joint (en PEBD).
Pipette doseuse composée d'un piston gradué « 1 dose » (en polystyrène) et d'une pipette ou corps (en polyéthylène basse densité).
6.6. Précautions particulières d’élimination et de manipulation
Pas d'exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
1 BIS RUE RENE ANJOLVY
94250 GENTILLY
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 279 159 5 6 : 10 ml de solution buvable en flacon (verre brun) muni d'un bouchon sécurité-enfant + pipette doseuse graduée.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
Médicament réservé à l’usage hospitalier.
ANSM - Mis à jour le : 25/06/2024
UVESTEROL VITAMINE A.D.E.C., solution buvable
· Gardez cette notice, vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que UVESTEROL VITAMINE A.D.E.C., solution buvable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser UVESTEROL VITAMINE A.D.E.C., solution buvable ?
3. Comment prendre UVESTEROL VITAMINE A.D.E.C., solution buvable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver UVESTEROL VITAMINE A.D.E.C., solution buvable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE UVESTEROL VITAMINE A.D.E.C., solution buvable ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique ; association de vitamines, code ATC : A11JA
Ce médicament est indiqué chez le nouveau-né (en particulier le nouveau-né prématuré) et le nourrisson présentant un risque de carence ou de malabsorption en vitamines A, D, E et C.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER UVESTEROL VITAMINE A.D.E.C., solution buvable?
Ne prenez jamais UVESTEROL VITAMINE A.D.E.C., solution buvable dans les cas suivants :
· allergie aux principe(s) actif(s) ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· hypercalcémie (taux anormalement élevée de calcium dans le sang),
· hypercalciurie (taux anormalement élevé de calcium dans les urines),
· lithiase calcique (calcul rénal).
EN CAS DE DOUTE, IL EST INDISPENSABLE DE DEMANDER L'AVIS DE VOTRE MEDECIN OU DE VOTRE PHARMACIEN.
Avertissements et précautions
Adressez-vous à votre médecin, à votre pharmacien ou à votre infirmier/ère avant d’utiliser UVESTEROL VITAMINE A.D.E.C, solution buvable.
|
Des cas de fausse route ou de malaise avec apnée du nourrisson pouvant entraîner une cyanose ont été rapportés chez des nouveau-nés et des nourrissons, sans pathologie connue, lors de l'administration de l’UVESTEROL vitaminé ADEC, et ce, notamment au cours du premier mois de vie (voir rubrique : 4 « Quels sont les effets indésirables éventuels? »). Par conséquent, afin de limiter ce risque, l'administration de l’UVESTEROL vitaminé ADEC doit s'effectuer en respectant scrupuleusement le mode d'administration du produit détaillé dans la rubrique 3. (« Comment prendre UVESTEROL vitaminé ADEC, solution buvable? »). En cas de reflux gastro-oesophagien, de problèmes digestifs ou de troubles de la déglutition, ne pas administrer pur, mais dans une tétine adaptée à l’enfant après dilution dans 2ml d'eau ou de lait selon le mode d’allaitement préconisé (voir rubrique 3). |
Les vitamines A et D sont présentes dans de nombreux médicaments. La vitamine D est également présente dans de nombreux laits pour nouveau-né ou nourrisson.
Pour éviter tout surdosage, susceptible d'entraîner des effets indésirables graves, tenir compte des doses totales de vitamine D et de vitamine A en cas d'association avec un traitement contenant déjà ces vitamines ou en cas d'utilisation de lait supplémenté en vitamine D.
Respectez la posologie et la durée de traitement préconisée par le médecin.
En cas d'apport complémentaire en calcium, consultez votre médecin.
En raison d'un effet légèrement stimulant de la vitamine C, il est préférable de ne pas prendre ce médicament en fin de journée.
EN CAS DE DOUTE NE PAS HESITER A DEMANDER L'AVIS DE VOTRE MEDECIN OU DE VOTRE PHARMACIEN.
Autres médicaments et UVESTEROL VITAMINE A.D.E.C, solution buvable
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
UVESTEROL VITAMINE A.D.E.C., solution buvable avec des aliments et boissons
Sans objet.
Grossesse, allaitement et fertilité
Sans objet.
Conduite de véhicules et utilisation de machines
Sans objet.
Liste des excipients à effet notoire : sans objet.
3. COMMENT PRENDRE UVESTEROL VITAMINE A.D.E.C., solution buvable ?
La dose habituelle est de 1 dose par jour.
CE MEDICAMENT VOUS A ETE PERSONNELLEMENT DELIVRE DANS UNE SITUATION PRECISE :
· IL PEUT NE PAS ETRE ADAPTE A UN AUTRE CAS.
· NE PAS LE CONSEILLER A UNE AUTRE PERSONNE.
Mode et voie d'administration
Voie orale.
La solution étant aqueuse, elle doit être systématiquement diluée avant administration dans un biberon de faible volume avant la tétée.
Afin de limiter le risque de fausse route lors de l'administration du produit, il est particulièrement important de suivre scrupuleusement le mode d'administration du produit.
Afin d’éviter tout risque d’erreur médicamenteuse, la pipette doseuse doit être conservée avec le médicament dans l’emballage d’origine.
Mode d'administration chez le nouveau-né et le nourrisson :
· Toujours administrer le produit avant la tétée ou le biberon.
· Utiliser exclusivement la pipette doseuse fournie dans la boîte :

· Prélever à l'aide de la pipette jusqu’au trait rouge correspondant à une dose.
· Diluer cette dose dans un petit volume de lait (environ 2 mL) dans une tétine adaptée à l’enfant. Si l’enfant est allaité au sein, la dilution peut se faire soit dans le lait de la maman, soit dans de l’eau :
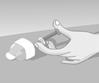
· Prendre l’enfant éveillé, l'installer en position semi-assise au creux du bras, la tête reposée sur le bras :
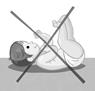

· Laisser l’enfant téter doucement la tétine, lui retirer la tétine une fois vide, puis lui donner le sein ou le biberon.

· Ne pas allonger l’enfant immédiatement après l’administration.
· Rincer la pipette et la tétine à l’eau après chaque utilisation.
Fréquence d'administration
En raison d'un effet légèrement stimulant de la vitamine C, il est préférable de ne pas prendre ce médicament en fin de journée.
Durée du traitement
Ne pas utiliser de façon prolongée sans l'avis de votre médecin.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Des cas de malaise vagal (apnée du nourrisson) et des cas de fausses routes ont été rapportés chez des nouveau-nés et nourrissons, sans pathologie connue, âgés notamment de moins de 1 mois lors de l'administration de l’UVESTEROL Vitaminé ADEC. La cause de ces cas n'a pas été clairement établie à ce jour (voir la rubrique 2 « Quelles sont les informations à connaitre avant de prendre UVESTEROL VITAMINE ADEC, solution buvable » et la rubrique 3 « Comment prendre UVESTEROL VITAMINE ADEC, solution buvable »).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER UVESTEROL VITAMINE A.D.E.C., solution buvable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur le flacon après EXP.
La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas 25°C et à l'abri de la lumière.
Ne jetez aucun médicament au tout-à-l'égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l'environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient UVESTEROL VITAMINE A.D.E.C., solution buvable
· Les substances actives sont :
Concentrat de vitamine A synthétique (forme huileuse) ................................................ 100 000 UI
(Quantité correspondante à ....................................................................................... 58,823 mg)
Ergocalciférol (vitamine D2) ........................................................................................ 33 333 UI
(Quantité correspondante à ........................................................................................ 0,833 mg)
Acétate d'alpha-tocophérol (vitamine E) .......................................................................... 0,167 g
Acide ascorbique (vitamine C) ....................................................................................... 1,667 g{
Pour un flacon de 10 ml
Pour une dose de 0,3 ml = 3000 UI de vitamine A, 1000 UI de vitamine D, 50 mg de vitamine C et 5 mg de vitamine E.
· Les autres composants sont :
Gallate de propyle, arôme fruits rouges (substances aromatisantes naturelles, préparations aromatisantes, propylèneglycol, eau), édétate disodique, acide citrique anhydre, phosphate trisodique, sorbate de potassium, saccharine sodique, polysorbate 80, hydroxyde de sodium, eau purifiée.
Qu’est-ce que UVESTEROL VITAMINE A.D.E.C., solution buvable et contenu de l’emballage extérieur
Ce médicament se présente sous forme de solution buvable incolore à jaunâtre, limpide à légèrement opalescente avec une odeur de fruits rouges.
Ce médicament est disponible en flacon de 10 ml avec pipette doseuse graduée.
Titulaire de l’autorisation de mise sur le marché
1 BIS RUE RENE ANJOLVY
94250 GENTILLY
Exploitant de l’autorisation de mise sur le marché
1 BIS RUE RENE ANJOLVY
94250 GENTILLY
1 BIS RUE RENE ANJOLVY
94250 GENTILLY
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’Ansm (France).