Dernière mise à jour le 01/12/2025
SALBUTAMOL VIATRIS 2,5 mg/2,5 ml, solution pour inhalation par nébuliseur en récipient unidose
Indications thérapeutiques
Ce médicament contient un bêta-2 mimétique : le salbutamol.
C’est un bronchodilatateur (il augmente le calibre des bronches) à action rapide (il agit en quelques minutes) et de courte durée (4 à 6 heures).
Il s’administre par inhalation (en l’inspirant) à l’aide d’un appareil pour nébulisation (encore appelé nébuliseur). Un nébuliseur est un dispositif permettant de transformer certains liquides en un nuage de gouttelettes (aérosol) délivrées à la sortie d'un embout buccal qui permet ainsi l'inhalation du médicament pour qu'il se dépose directement dans les bronches.
L’administration de salbutamol par un appareil de nébulisation doit être réservée au traitement des crises d’asthme graves et des poussées aiguës au cours de la bronchite chronique obstructive lorsque l'inhalation de fortes doses de salbutamol est nécessaire.
Si vous avez de l'asthme, en fonction de sa sévérité, votre médecin peut prescrire Salbutamol Viatris seul ou en complément d’un traitement de fond continu par un ou plusieurs autres médicaments, comme les corticoïdes par voie inhalée.
Présentations
> 60 récipient(s) unidose(s) polyéthylène de 2,5 ml
Code CIP : 365 843-8 ou 34009 365 843 8 9
Déclaration de commercialisation : 31/01/2006
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 9,74 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 10,76 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 22/02/2017 | Renouvellement d'inscription (CT) | Le service médical rendu par SALBUTAMOL MYLAN reste important dans les indications de l’AMM. |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
Autres informations
- Titulaire de l'autorisation : VIATRIS SANTE
- Conditions de prescription et de délivrance :
- liste I
- prescription réservée aux spécialistes et services PEDIATRIE
- prescription réservée aux spécialistes et services PNEUMOLOGIE
- réservé à l'usage en situation d'urgence selon l'article R5121-96 du code de la santé publique
- réservé à une structure d'assistance médicale mobile ou de rapatriement sanitaire
- Statut de l'autorisation : Valide
- Type de procédure : Procédure nationale
- Code CIS : 6 817 407 1
ANSM - Mis à jour le : 01/03/2024
SALBUTAMOL VIATRIS 2,5mg/2,5ml, solution pour inhalation par nébuliseur en récipient unidose
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Quantité correspondant à salbutamol base ................................................................................ 2,50 mg
Pour un récipient unidose de 2,5 ml.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution pour inhalation par nébuliseur.
4.1. Indications thérapeutiques
o Traitement des poussées aiguës des bronchopneumopathies chroniques obstructives de l’adulte.
Remarque : l’asthme aigu grave nécessite une hospitalisation en unité de soins intensifs.
Une oxygénothérapie et une corticothérapie par voie systémique doivent être envisagées en association au traitement bronchodilatateur.
4.2. Posologie et mode d'administration
La durée d’action du salbutamol est de 4 à 6 heures chez la plupart des patients.
o Adultes : la dose initiale de salbutamol recommandée est de 2,5 mg, soit 1 unidose de Salbutamol Viatris 2,5 mg/2,5 ml par nébulisation. Cette dose peut être augmentée jusqu’à 5 mg, soit 2 unidoses de 2,5 ml par nébulisation (ou 1 unidose de Salbutamol Viatris 5mg/2,5ml par nébulisation).
Chez l’adulte, des doses plus élevées, allant jusqu’à 40 mg de salbutamol par jour, peuvent être administrées sous surveillance médicale stricte à l’hôpital pour le traitement d’une broncho-obstruction sévère.
o Enfants et nourrissons : 50 à 150 µg de salbutamol/kg par nébulisation (soit 0,05 à 0,15 ml/kg de Salbutamol Viatris 2,5 mg/2,5 ml) sans généralement dépasser 5mg de salbutamol par nébulisation chez les enfants âgés de plus de 18 mois (soit 2 unidoses de Salbutamol Viatris 2,5mg/2,5 ml) et 2,5 mg de salbutamol par nébulisation chez les nourrissons de moins de 18 mois (soit 1 unidose de Salbutamol Viatris 2,5mg/2,5 ml).
La durée d’action bronchodilatatrice du salbutamol par voie inhalée est de 4 à 6 heures.
Sous surveillance médicale, la nébulisation peut être renouvelée toutes les 20 à 30 minutes en fonction du résultat clinique et de la tolérance du traitement sans excéder en général 4 nébulisations par jour.
Population pédiatrique :
L’efficacité clinique du salbutamol par nébulisation chez les nourrissons de moins de 18 mois est incertaine. Une hypoxie transitoire pouvant survenir, il convient de mettre en place une oxygénothérapie complémentaire.
Mode d’administration
Voie inhalée exclusivement.
Cette solution de salbutamol doit être administrée par voie inhalée à l’aide d’un appareil pour nébulisation (nébuliseur) muni d'un embout buccal.
NE PAS INJECTER - NE PAS BOIRE LE CONTENU DES UNIDOSES
Pour l’utilisation et l’entretien de l’appareil de nébulisation, se conformer aux instructions délivrées par le fabricant de l’appareil utilisé.
Beaucoup de nébuliseurs existant sur le marché fonctionnant en flux continu et l'aérosol contenant le médicament peut être libéré dans l'environnement. Les nébulisations de salbutamol doivent donc être réalisées dans une pièce correctement ventilée.
La solution est prête à l’emploi, cependant si une dilution est nécessaire, elle doit être réalisée dans du sérum physiologique stérile.
Retirer un récipient unidose de la plaquette.
Ouvrir le récipient en tordant vigoureusement son extrémité supérieure.
Presser le récipient pour le vider dans le réservoir du nébuliseur.
Assembler le nébuliseur pour l’administration selon les instructions du fabricant.
Eviter le contact des yeux par l’aérosol généré par le nébuliseur.
Avec les nébuliseurs pneumatiques, le débit d’air ou d’oxygène destiné à pulser la solution sera adapté en fonction de l’état du patient et des recommandations du fabricant de l’appareil de nébulisation.
La nébulisation ne doit en général pas excéder 10 à 20 minutes.
La technique d’utilisation par le patient doit être vérifiée régulièrement.
Après la nébulisation, la solution inutilisée restant dans la cuve de l’appareil doit être jetée. Le nettoyage et l’entretien du matériel se feront selon les recommandations du fabricant.
Les récipients unidoses ne contiennent aucun conservateur, ils doivent être utilisés immédiatement après l’ouverture. Un nouveau récipient doit être utilisé pour chaque nébulisation.
Le contenu des récipients unidoses partiellement ouverts ou endommagés ne doit pas être administré.
o Allergie à l’un des constituants.
o Intolérance à ce médicament (survenue de toux ou de bronchospasme survenant immédiatement après inhalation du produit). Dans ce cas, il conviendra d’interrompre ce traitement et de prescrire d’autres thérapeutiques ou d’autres formes d’administration.
4.4. Mises en garde spéciales et précautions d'emploi
L’administration de salbutamol à l’aide d’un nébuliseur doit être réservée aux situations aigues graves nécessitant l’inhalation d’une posologie élevée de produit par voie inhalée. Ces situations nécessitent une surveillance médicale avec possibilité de mise en place d’une réanimation (abord veineux et assistance respiratoire) ; une oxygénothérapie et une corticothérapie par voie systémique doivent généralement y être associées.
Comme avec les autres traitements administrés par voie inhalée, un bronchospasme paradoxal peut survenir, se manifestant par une augmentation de la dyspnée et des sifflements bronchiques immédiatement après l'inhalation du produit. Le bronchospasme sera traité par une autre présentation ou un autre bronchodilatateur à action rapide par voie inhalée (si disponible). Le traitement par Salbutamol Viatris en nébulisation doit être interrompu et, si nécessaire, être remplacé par un médicament bronchodilatateur à action rapide.
Les médicaments ayant une activité sympathomimétique, dont fait partie le salbutamol, peuvent entraîner des effets cardiovasculaires. Des cas d'ischémies myocardiques associées au salbutamol ont été rapportés lors de notifications spontanées depuis la commercialisation ainsi que dans la littérature. Les patients présentant une cardiopathie sévère sous-jacente (par exemple, cardiopathie ischémique, troubles du rythme ou insuffisance cardiaque sévère) devront être informés de la nécessité de consulter leur médecin en cas de douleur thoracique ou autres symptômes évocateurs d’une aggravation de leur cardiopathie. L'origine cardiaque de symptômes respiratoires telle qu'une dyspnée doit également être évoquée.
L’augmentation de la consommation de bronchodilatateurs de courte durée d’action (en particulier les bêta-2 agonistes utilisés pour soulager les symptômes) indique une détérioration du contrôle de l’asthme, et les patients doivent être avertis qu’ils doivent dans ce cas consulter un médecin dès que possible. La conduite thérapeutique du patient doit alors être réévaluée.
La surutilisation de bronchodilatateurs bêta mimétiques de courte durée d’action peut masquer la progression de la pathologie sous-jacente et contribuer à la détérioration du contrôle de l’asthme, entraînant une augmentation du risque d’exacerbations graves d’asthme et de la mortalité.
Les patients qui prennent un médicament à base de salbutamol par voie inhalée «à la demande» plus de deux fois par semaine (en plus des administrations en traitement préventif de l’asthme induit par l’effort) sont à risque de surutilisation de salbutamol et doivent donc être réexaminés (symptômes diurnes, réveils nocturnes, limitation des activités due à l’asthme) afin de réajuster leur traitement.
Précautions d’emploi
En cas d’infection bronchique ou de bronchorrhée abondante, un traitement approprié est nécessaire afin de favoriser la diffusion optimale du produit dans les voies respiratoires.
Le salbutamol doit être utilisé avec précaution chez les patients ayant reçu des doses importantes d’autres médicaments sympathomimétiques.
Le salbutamol en nébulisation doit être administré avec prudence en cas d’hyperthyroïdie, en cas d’affection cardio-vasculaire, notamment cardiomyopathie obstructive, troubles coronariens, troubles du rythme, hypertension artérielle, et en cas de diabète.
Les bêta-2 mimétiques à forte dose (en particulier par voie parentérale ou par nébulisation), peuvent être à l’origine d’une hypokaliémie potentiellement grave, pouvant favoriser la survenue de troubles du rythme cardiaque. Une surveillance de la kaliémie est recommandée dans la mesure du possible, en particulier lors de l’administration simultanée de thérapeutiques hypokaliémiantes, en cas d’hypoxie ou chez les sujets chez qui le risque de survenue de torsades de pointes est majoré (QT long ou traitements susceptibles d’augmenter le QTc).
Comme d'autres agonistes des récepteurs béta adrénergiques, le salbutamol peut induire une augmentation de la glycémie. Des cas d’acidocétose ont été rapportés chez les patients diabétiques. L’administration concomitante de corticoïdes peut majorer ces effets.
Des cas d'acidose lactique ont été très rarement rapportés en association à de fortes doses de bêta-2 agonistes de courte durée d’action par voie intraveineuse ou par voie inhalée par nébulisation, principalement chez des patients traités pour une exacerbation aiguë de leur asthme (voir 4.8 Effets indésirables). Une augmentation du taux d’acide lactique peut entraîner une dyspnée et une hyperventilation compensatoire, qui peut être interprétée à tort comme un signe d’échec au traitement de l’asthme conduisant à l'augmentation inapproprié du traitement par bêta-agoniste de courte durée d’action. Par conséquent, le risque d'acidose lactique doit faire l'objet d'une surveillance attentive en particulier dans les situations sévères.
Sportifs :
L’attention des sportifs sera attirée sur le fait que cette spécialité contient un principe actif pouvant induire une réaction positive des tests pratiqués lors des contrôles antidopage.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
+ Béta-bloquants non sélectifs
Le salbutamol et les bêta-bloquants non sélectifs, tel que le propranolol, ne doivent généralement pas être prescrits de façon concomitante.
+ Anesthésiques halogénés (halothane)
En cas d’intervention obstétricale, majoration de l’inertie utérine avec risque hémorragique ; par ailleurs, risque de survenue de troubles du rythme ventriculaire graves, par augmentation de la réactivité cardiaque.
Associations faisant l'objet de précautions d’emploi
+ Antidiabétiques
L'administration de bêta-2 mimétiques est associée à une augmentation de la glycémie, ce qui peut être interprété comme une diminution de l'effet du traitement antidiabétique, par conséquent, il peut être nécessaire de réajuster le traitement antidiabétique (voir rubrique 4.4). Renforcer la surveillance sanguine et urinaire.
4.6. Fertilité, grossesse et allaitement
Grossesse
En clinique, il existe un recul important, avec un nombre suffisant de grossesses documentées, pour que l’on puisse conclure à l’innocuité du salbutamol pendant la grossesse.
En conséquence, le salbutamol par voie inhalée peut être administré en cas de grossesse.
Lors de l’administration pendant la grossesse :
Une accélération du rythme cardiaque fœtal peut être observée parallèlement à la tachycardie maternelle. Il est exceptionnel de la voir persister à la naissance.
De même, les valeurs de la glycémie post-natale ne sont qu’exceptionnellement perturbées.
En cas d’administration avant l’accouchement, tenir compte de l’effet vasodilatateur périphérique des bêta-2 mimétiques.
Allaitement
Les bêta-2 mimétiques passent dans le lait maternel.
Fertilité
Il n'existe aucune information sur les effets du salbutamol sur la fertilité humaine. Il n'a pas été mis en évidence d'effet indésirable sur la fertilité chez l’animal (voir rubrique 5.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets secondaires sont cités ci-dessous, listés par classe organe et par fréquence.
Les fréquences sont définies en très fréquent (≥1/10), fréquent (³1/100 et <1/10), peu fréquent (³1/1000 et <1/100), rare (≥1/10000 et <1/1000) et très rare (<1/10000) y compris les cas isolés.
Les effets très fréquents et fréquents ont généralement été décrits dans les essais cliniques. Les effets indésirables rares et très rares sont généralement issus des notifications spontanées après commercialisation.
|
Classe organe |
Effets indésirables |
Fréquence |
|
Affections du système immunitaire |
Réactions d’hypersensibilité incluant : œdème angioneurotique, urticaire, prurit, bronchospasme, hypotension, collapsus. |
Très rare |
|
Troubles du métabolisme et de la nutrition |
Hypokaliémie.* |
Très rare |
|
Acidose lactique** |
Très rare |
|
|
Affections du système nerveux |
Céphalées, tremblements. |
Fréquent |
|
Affections psychiatriques |
Troubles du comportement : nervosité, agitation |
Très rare |
|
Affections cardiaques |
Tachycardie |
Fréquent |
|
Palpitations |
Peu fréquent |
|
|
Arythmies cardiaques (incluant fibrillation auriculaire, tachycardie supraventriculaire et extrasystoles) |
Très rare |
|
|
Ischémies myocardiques*** (voir rubrique 4.4) |
Indéterminé |
|
|
Affections vasculaires |
Vasodilatation périphérique. |
Très rare |
|
Affections respiratoires, thoraciques et médiastinales |
Bronchospasme paradoxal**** |
Très rare |
|
Affections gastro-intestinales |
Irritation de la bouche et de la gorge. |
Peu fréquent |
|
Affections musculo-squelettiques et systémiques |
Crampes musculaires |
Peu fréquent |
* Les bêta-2 mimétiques à fortes doses peuvent entraîner des hyperglycémies des hypokaliémies réversibles à l’arrêt du traitement.
** Des cas d'acidose lactique ont été très rarement rapportés chez des patients recevant du salbutamol par voie intraveineuse ou par voie inhalée par nébulisation pour le traitement d’exacerbations aiguës d'asthme.
*** La fréquence de survenue des ischémies myocardiques ne peut être déterminée car les cas rapportés sont issus de notifications spontanées depuis la commercialisation.
**** Comme avec d’autres produits inhalés, possibilité de survenue de toux et rarement de bronchospasme paradoxal à la suite de l’inhalation. Ne pas renouveler l’administration de ce médicament et utiliser un autre médicament bronchodilatateur à action rapide pour soulager le bronchospasme. Le traitement devra alors être réévalué pour envisager, le cas échéant, la prescription d’une alternative thérapeutique.
Peuvent également être observés des troubles digestifs (nausées, vomissements).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
Une hypokaliémie peut survenir suite à un surdosage en salbutamol. La kaliémie doit donc être surveillée en cas de surdosage.
Des nausées, vomissements et hyperglycémie ont été rapportées, en particulier chez les enfants et lorsque le surdosage est dû à une prise de salbutamol par voie orale.
Des cas d’acidose lactique ont été rapportés avec des doses élevées de béta-2 agonistes d’action rapide. En cas de surdosage, il convient donc de surveiller les taux sériques de lactate et le risque d’acidose lactique, en particulier en cas de persistance ou aggravation de la tachypnée malgré la disparition des symptômes de bronchospasme tels que les sibilants, qui peut être lié à l'acidose métabolique.
Conduite à tenir : surveillance et traitement symptomatique.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : BRONCHODILATATEUR BETA-2 MIMETIQUE A ACTION RAPIDE ET DE COURTE DUREE PAR VOIE INHALEE, code ATC : R03AC02.
Le salbutamol est un agoniste sélectif des récepteurs bêta2.
Après inhalation, le salbutamol exerce une action stimulante sur les récepteurs bêta-2 du muscle lisse bronchique assurant ainsi une bronchodilatation rapide, significative en quelques minutes, et persistant pendant 4 à 6 heures.
5.2. Propriétés pharmacocinétiques
Il n’y a pas de corrélation entre les taux sanguins et l'efficacité.
Après résorption pulmonaire l’élimination principalement urinaire se fait essentiellement par voie rénale sous forme de dérivés sulfoconjugués (moins de 2% sous forme inchangée).
5.3. Données de sécurité préclinique
Chlorure de sodium, acide sulfurique, eau purifiée.
2 ans.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
Conserver le conditionnement primaire dans l’emballage extérieur afin de protéger ce médicament contre la lumière.
Jeter le récipient unidose après utilisation.
6.5. Nature et contenu de l'emballage extérieur
2,5 ml en récipient unidose (PE) ; boîte de 10, 20, 30 et 60.
6.6. Précautions particulières d’élimination et de manipulation
Pas d'exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
1 RUE DE TURIN
69007 LYON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
o 365 665-2 : 2,5ml en récipient unidose (PE) : boîte de 10
o 365 666-9 : 2,5ml en récipient unidose (PE) : boîte de 20
o 365 667-5 : 2,5ml en récipient unidose (PE) : boîte de 30
o 365 843-8 : 2,5ml en récipient unidose (PE) : boîte de 60
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
Médicament à prescription réservée aux spécialistes en pneumologie ou en pédiatrie. Médicament pouvant être administré par tout médecin intervenant en situation d’urgence ou dans le cadre d’une structure d’assistance médicale mobile ou de rapatriement sanitaire (article R. 5121-96 du code de la santé publique).
ANSM - Mis à jour le : 01/03/2024
SALBUTAMOL VIATRIS 2,5mg/2,5ml, solution pour inhalation par nébuliseur en récipient unidose
Sulfate de salbutamol
o Gardez cette notice. Vous pourriez avoir besoin de la relire.
o Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
o Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
o Si vous ressentez un quelconque effet indésirable, qu'il soit mentionné ou non dans cette notice, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Voir rubrique 4.
1. Qu'est-ce que SALBUTAMOL VIATRIS 2,5mg/2,5ml, solution pour inhalation par nébuliseur en récipient unidose et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser SALBUTAMOL VIATRIS 2,5 mg/2,5 ml solution pour inhalation par nébuliseur en récipient unidose ?
3. Comment utiliser SALBUTAMOL VIATRIS 2,5mg/2,5ml, solution pour inhalation par nébuliseur en récipient unidose ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver SALBUTAMOL VIATRIS 2,5mg/2,5ml, solution pour inhalation par nébuliseur en récipient unidose ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE SALBUTAMOL VIATRIS 2,5mg/2,5ml, solution pour inhalation par nébuliseur en récipient UNIDOSE ET DANS QUELS CAS EST-IL UTILISE ?
Ce médicament contient un bêta-2 mimétique : le salbutamol.
C’est un bronchodilatateur (il augmente le calibre des bronches) à action rapide (il agit en quelques minutes) et de courte durée (4 à 6 heures).
Il s’administre par inhalation (en l’inspirant) à l’aide d’un appareil pour nébulisation (encore appelé nébuliseur). Un nébuliseur est un dispositif permettant de transformer certains liquides en un nuage de gouttelettes (aérosol) délivrées à la sortie d'un embout buccal qui permet ainsi l'inhalation du médicament pour qu'il se dépose directement dans les bronches.
L’administration de salbutamol par un appareil de nébulisation doit être réservée au traitement des crises d’asthme graves et des poussées aiguës au cours de la bronchite chronique obstructive lorsque l'inhalation de fortes doses de salbutamol est nécessaire.
Si vous avez de l'asthme, en fonction de sa sévérité, votre médecin peut prescrire Salbutamol Viatris seul ou en complément d’un traitement de fond continu par un ou plusieurs autres médicaments, comme les corticoïdes par voie inhalée.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER SALBUTAMOL VIATRIS 2,5mg/2,5ml, solution pour inhalation par nébuliseur en récipient unidose ?
N’utilisez jamais SALBUTAMOL VIATRIS 2,5mg/2,5ml, solution pour inhalation par nébuliseur en récipient unidose :
o Si vous êtes allergique au salbutamol (la substance active) ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Si vous ressentez une augmentation de la gêne respiratoire ou de la toux immédiatement après l’inhalation de ce produit, ne renouvelez pas la prise de ce médicament et contactez votre médecin.
En cas de doute, demandez l’avis de votre médecin ou de votre pharmacien.
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien ou votre infirmier/ère avant d’utiliser SALBUTAMOL VIATRIS 2,5 mg/2,5 ml, solution pour inhalation par nébuliseur en récipient unidose.
Faites attention avec ce médicament :
Ce produit actif en inhalation, doit atteindre l’extrémité des petites bronches. En cas d’encombrement des voies respiratoires par des mucosités abondantes, notamment en cas d’infection, son efficacité peut être diminuée. Consultez rapidement votre médecin afin qu’il mette en place un traitement adapté.
Prévenez votre médecin :
o si vous avez des problèmes en lien avec votre glande thyroïde,
o si vous avez des problèmes cardio-vasculaires, notamment certains troubles du rythme cardiaque, une angine de poitrine (sensation d'oppression thoracique et douleurs violentes localisées au niveau de la poitrine et pouvant s’étendre dans le bras gauche), ou une hypertension artérielle (augmentation de la pression du sang dans les artères),
o si vous avez un diabète afin qu'il détermine les modalités de traitement les mieux adaptées à votre cas.
Les médicaments à base de salbutamol par voie inhalée doivent être utilisés en fonction des besoins, plutôt qu’en prises régulières.
Si votre asthme est instable (par exemple si vos symptômes ou vos exacerbations d’asthme sont fréquents, comme un souffle court qui rend la parole, l’alimentation ou le sommeil difficiles, une toux, des sifflements lorsque vous respirez, si vous ressentez un serrement dans la poitrine ou si vos capacités physiques sont limitées par un essoufflement), vous devez avertir immédiatement votre médecin qui débutera ou augmentera les doses d’un traitement pour contrôler votre asthme, comme les corticostéroïdes par voie inhalée.
Avertissez rapidement votre médecin si votre médicament à base de salbutamol par voie inhalée ne vous soulage pas aussi bien que d’habitude (par exemple si vous avez besoin de doses plus importantes pour soulager vos difficultés respiratoires ou si votre médicament ne parvient pas à vous soulager pendant au moins trois heures) car votre asthme pourrait s’aggraver et vous pourriez avoir besoin d’un médicament différent.
Si vous utilisez un médicament à base de salbutamol par voie inhalée plus de deux fois par semaine pour traiter vos symptômes d’asthme (en plus des utilisations en prévention avant un exercice physique) cela indique que votre asthme est mal contrôlé, ce qui pourrait augmenter le risque de crise d’asthme sévère (aggravation de l’asthme), entraîner des complications graves et pourrait menacer votre pronostic vital, voire être fatal. Vous devez alors contacter votre médecin au plus vite pour modifier votre traitement pour l’asthme.
Si vous utilisez quotidiennement un médicament destiné à traiter l’inflammation des bronches (par exemple des «corticostéroïdes inhalés») il est important de continuer à prendre ce médicament anti-inflammatoire régulièrement, même si vous vous sentez mieux.
Autres médicaments et SALBUTAMOL VIATRIS 2,5mg/2,5ml, solution pour inhalation par nébuliseur en récipient unidose
Informez votre médecin ou pharmacien si vous prenez, avez pris récemment ou pourriez prendre tout autre médicament (en particulier des médicaments bêta-bloquants ou antidiabétiques), y compris un médicament obtenu sans ordonnance.
SALBUTAMOL VIATRIS 2,5mg/2,5ml, solution pour inhalation par nébuliseur en récipient unidose avec des aliments et boissons
Sans objet.
D'une façon générale, demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Ce médicament dans les conditions normales d'utilisation peut être utilisé pendant la grossesse.
Le salbutamol passe dans le lait maternel.
Sportifs
Attention, ce médicament contient un principe actif pouvant rendre positifs les tests pratiqués lors de contrôles antidopage.
Conduite de véhicules et utilisation de machines
Sans objet.
SALBUTAMOL VIATRIS 2,5mg/2,5ml, solution pour inhalation par nébuliseur en récipient unidose contient {excipient}
Sans objet.
3. COMMENT UTILISER SALBUTAMOL VIATRIS 2,5mg/2,5ml, solution pour inhalation par nébuliseur en récipient UNIDOSE ?
Posologie et fréquence d’administration
Respectez toujours la posologie indiquée par votre médecin. En cas de doute, consultez votre médecin ou votre pharmacien.
Chez l'adulte: la dose initiale de salbutamol recommandée par inhalation est de 2,5 mg, soit 1 unidose de SALBUTAMOL VIATRIS 2,5 mg/2,5 ml par nébulisation. Cette dose peut être augmentée jusqu’à 5 mg de salbutamol, soit 2 unidoses de Salbutamol Viatris 2,5 mg/2,5 ml par nébulisation (ou 1 unidose de SALBUTAMOL VIATRIS 5 mg/2,5 ml).
Chez l’adulte, des doses plus élevées, allant jusqu’à 40 mg de salbutamol par jour, peuvent être données sous surveillance médicale stricte à l’hôpital pour le traitement d’une obstruction sévère des voies respiratoires.
Chez l’enfants et le nourrisson : 50 à 150 µg de salbutamol/kg par nébulisation (soit 0,05 à 0,15 ml/kg de SALBUTAMOL VIATRIS 2,5 mg/2,5 ml) sans généralement dépasser 5mg de salbutamol par nébulisation chez les enfants âgés de plus de 18 mois (soit 2 unidoses de SALBUTAMOL VIATRIS 2.5mg/2,5 ml) et 2,5 mg de salbutamol par nébulisation chez les nourrissons de moins de 18 mois (soit 1 unidose de SALBUTAMOL VIATRIS 2,5mg/2,5 ml.
La durée d’action bronchodilatatrice du salbutamol par voie inhalée est de 4 à 6 heures.
Sous surveillance médicale, la nébulisation peut être renouvelée toutes les 20 à 30 minutes en fonction du résultat clinique et de la tolérance du traitement sans en général dépasser 4 nébulisations par jour.
Mode d’administration
Voie inhalée exclusivement.
Ce médicament est administré par voie inhalée (en inspirant) à l'aide d'un appareil pour nébulisation (appelé également nébuliseur).
NE PAS L'INJECTER. NE PAS BOIRE LE CONTENU DES UNIDOSES.
Pour l’utilisation et l’entretien de l’appareil de nébulisation, conformez-vous aux instructions délivrées par le fabricant de l’appareil utilisé.
Les séances de nébulisations doivent être réalisées dans un endroit correctement ventilé. Évitez le contact des yeux avec l’aérosol généré par le nébuliseur.
Mode d’emploi :
La solution est prête à l’emploi, cependant si une dilution est nécessaire, elle doit être réalisée dans du sérum physiologique stérile.
Figue 1 : Retirez un récipient unidose de la plaquette.
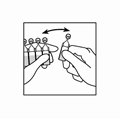

Figure 2 : Ouvrez le récipient en tordant vigoureusement son extrémité supérieure.
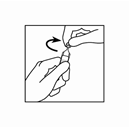

Figure 3 : Pressez le récipient pour le vider dans le réservoir du nébuliseur.
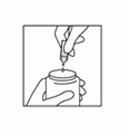

Assemblez le nébuliseur pour l’administration selon les instructions du fabricant.
Avec les appareils pneumatiques (dispositif utilisant notamment un compresseur d’air), le débit d’air ou d’oxygène destiné à pulser la solution sera adapté par le médecin en fonction de l’état du patient et des recommandations du fabricant de l’appareil de nébulisation.
Evitez le contact des yeux par l’aérosol généré par le nébuliseur.
La nébulisation ne doit en général pas excéder 10 à 20 minutes.
La technique d’utilisation par le patient doit être vérifiée régulièrement.
Après la nébulisation, la solution inutilisée restant dans la cuve de l’appareil doit être jetée.
Le nettoyage et l’entretien du matériel se feront selon les recommandations du fabricant.
Les récipients unidoses ne contiennent aucun conservateur, ils doivent être utilisés immédiatement après l’ouverture.
Un nouveau récipient unidose doit être utilisé pour chaque nébulisation. Le contenu des récipients unidoses partiellement ouverts ou endommagés ne doit pas être administré.
Si vous avez pris plus de SALBUTAMOL VIATRIS 2,5mg/2,5ml, solution pour inhalation par nébuliseur en récipient unidose que vous n’auriez dû :
Si vous avez pris accidentellement une dose supérieure à la dose recommandée, vous pouvez présenter des effets indésirables tels que tachycardie (accélération du rythme cardiaque), maux de tête, tremblements ou agitation (voir la rubrique 4 : « Quels sont les effets indésirables éventuels ? »).
Consultez votre médecin et emportez avec vous cette notice ou votre médicament afin que votre médecin sache de quel médicament il s'agit.
Si vous oubliez de prendre SALBUTAMOL VIATRIS 2,5mg/2,5ml, solution pour inhalation par nébuliseur en récipient unidose :
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez de prendre SALBUTAMOL VIATRIS 2,5mg/2,5ml, solution pour inhalation par nébuliseur en récipient unidose :
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Lors d'un traitement avec le salbutamol, certaines personnes peuvent parfois (fréquence de survenue non connue) ressentir une douleur dans le thorax (sensation d'oppression) qui peut être due à des problèmes cardiaques tels qu’une angine de poitrine. Prévenez rapidement votre médecin si vous ressentez de tels symptômes.
En cas d'aggravation de votre gêne respiratoire (respiration sifflante) juste après la prise de ce médicament, cessez immédiatement de l'utiliser, et contactez votre médecin dès que possible.
Si disponible, utilisez, dès que possible un autre médicament d’action rapide pour traiter votre asthme.
Peuvent également être observés :
· Fréquemment :
o tremblements des extrémités (pieds et mains),
o augmentations du rythme cardiaque,
o maux de tête.
· Peu fréquemment :
o palpitations,
o irritations de la bouche ou de la gorge,
o crampes musculaires.
· Rarement :
o comme avec d’autres produits administrés par voie inhalée, une toux ou une augmentation de la gêne respiratoire pourrait survenir à la suite de l’inhalation du produit. Dans ce cas, arrêtez le traitement et contactez votre médecin afin qu’il envisage un autre traitement.
· Très rarement :
o bouffées de chaleur, rougeurs sur la peau,
o nervosité, agitation,
o diminution du taux de potassium dans le sang,
o anomalies du rythme cardiaque,
o augmentation du taux d’acide lactique dans le sang (se manifestant par une respiration rapide, un essoufflement, même si vous ressentez une amélioration des sifflements respiratoires ; sensation de froid, douleurs à l'estomac, nausées et vomissements). Dans ce cas, arrêtez les traitements par Salbutamol Viatris nébulisation et contactez immédiatement votre médecin
o réactions allergiques pouvant se manifester par une sensation d’oppression dans la poitrine, des démangeaisons, un sifflement respiratoire, un gonflement des paupières, du visage et/ou des lèvres et éruption cutanée, une baisse de la tension artérielle pouvant aller jusqu’au malaise.
Des augmentations de la quantité de sucre dans le sang ont également été rapportées, régressant à l’arrêt du traitement.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER SALBUTAMOL VIATRIS 2,5mg/2,5ml, solution pour inhalation par nébuliseur en récipient UNIDOSE ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte. La date de péremption fait référence au dernier jour de ce mois.
Conservez le récipient unidose dans la boîte, à l’abri de la lumière, à une température ne dépassant pas +25°C.
Jetez le récipient unidose après utilisation.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
La substance active est le sulfate de salbutamol.
Un récipient unidose en contient 3,00 mg (correspondant à 2,50 mg de salbutamol).
Les autres composants sont :
Chlorure de sodium, acide sulfurique, eau purifiée
Une boîte contient 10, 20, 30 ou 60 récipients unidose.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
1 RUE DE TURIN
69007 LYON
Exploitant de l’autorisation de mise sur le marché
1 RUE DE TURIN
69007 LYON
1 RUE DE L’ARQUERIE
50200 COUTANCES
ou
LABORATOIRE UNITHER
151 RUE ANDRE DUROUCHEZ
ESPACE INDUSTRIEL NORD
CS 28028
AMIENS CEDEX 2, 80084 FRANCE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).