Dernière mise à jour le 08/01/2026
DEXOCOL 1 mg/mL, collyre en solution
Indications thérapeutiques
DEXOCOL contient de la dexaméthasone, un corticostéroïde utilisé pour inhiber les symptômes inflammatoires (tels que douleur, chaleur, gonflement et rougeur).
DEXOCOL est utilisé pour traiter l’inflammation de vos yeux.
En cas d’infection oculaire (rougeur de l’œil, larmoiement et sécrétions), un traitement spécifique de votre infection devra être associé à DEXOCOL (voir rubrique 2).
Le collyre en solution DEXOCOL est une solution stérile qui ne contient pas de conservateur.
Présentations
> 1 flacon polyéthylène basse densité (PEBD) de 6 mL avec embout compte-gouttes polyéthylène haute densité (PEHD) et silicone
Code CIP : 34009 301 797 3 4
Déclaration de commercialisation : 31/08/2021
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 6,77 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 7,79 €
- Taux de remboursement :65 %
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 09/09/2020 | Inscription (CT) | Le service médical rendu par ORATORIA 1 mg/ml (phosphate de dexaméthasone) est important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 09/09/2020 | Inscription (CT) | Cette spécialité est un hybride qui n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport au médicament de référence, DEXAFREE 1 mg/ml (phosphate sodique de dexaméthasone), collyre en solution en récipient unidose. |
ANSM - Mis à jour le : 05/03/2024
DEXOCOL 1 mg/mL, collyre en solution
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Phosphate de dexaméthasone................................................................................................. 1 mg
Sous forme de phosphate sodique de dexaméthasone.
Pour 1 mL de solution.
Excipient(s) à effet notoire : 1 mL de solution contient 1,976 mg de phosphates équivalent à 7,450 mg de phosphate disodique dodécahydraté.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution aqueuse limpide, incolore, sans particules étrangères visibles.
pH : 7,1-8,1.
Osmolalité : 270 ± 7,5 % mOsm/kg (250-290 mOsm/kg).
4.1. Indications thérapeutiques
Traitement des états inflammatoires non infectieux du segment antérieur de l’œil.
4.2. Posologie et mode d'administration
Ce médicament doit être utilisé uniquement sous étroite surveillance ophtalmologique.
La posologie habituelle est de 1 goutte, 4 à 6 fois par jour, dans l'œil malade.
Dans les cas sévères, le traitement peut débuter par 1 goutte toutes les heures, mais il convient de réduire la dose à une goutte toutes les 4 heures dès qu'une réponse favorable est observée. Une réduction progressive de la posologie est recommandée pour éviter un effet rebond.
La durée du traitement varie généralement de quelques jours à 14 jours au maximum.
Sujet âgé
L'utilisation de collyres à base de dexaméthasone est l'objet d'une longue expérience chez le sujet âgé. La posologie recommandée ci-dessus reflète de cette expérience clinique.
Population pédiatrique
L’efficacité et la tolérance n’ont pas été établies pour la population pédiatrique.
Chez l'enfant, il convient d'éviter tout traitement continu de longue durée par les corticoïdes en raison d'un risque éventuel d’inhibition de la fonction surrénalienne (voir rubrique 4.4).
Mode d’administration
Voie ophtalmique.
DEXOCOL est une solution stérile qui ne contient pas de conservateur.
Il est conseillé aux patients de se laver les mains avant instillation et d’éviter le contact de l’embout du flacon avec l’œil ou les structures voisines car cela pourrait provoquer des lésions oculaires.
Les patients doivent être informés que les collyres en solution, s’ils ne sont pas manipulés correctement, peuvent être contaminés par des bactéries communes connues pour provoquer des infections oculaires. L’utilisation de solutions contaminées peut occasionner de graves lésions oculaires entraînant une perte de la vision.
Le passage systémique peut être réduit par l'occlusion lacrymonasale en comprimant les voies lacrymales.
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
· Infections oculaires non contrôlées par un traitement anti-infectieux, telles que :
o Les infections bactériennes purulentes aiguës, y compris les infections à Pseudomonas et aux mycobactéries,
o Les infections fongiques,
o Les kératites épithéliales dues au virus Herpes simplex (kératite dendritique), au virus de la vaccine, au virus varicelle-zona et à la plupart des autres infections virales de la cornée et de la conjonctive,
o Kératite amibienne,
· Perforation, ulcération et lésion de la cornée associées à une ré-épithélialisation incomplète (voir aussi la rubrique 4.4),
· Hypertension oculaire connue provoquée par les glucocorticoïdes.
4.4. Mises en garde spéciales et précautions d'emploi
Les corticoïdes topiques ne doivent jamais être prescrits pour une rougeur de l'œil non diagnostiquée.
Pendant la durée du traitement avec la dexaméthasone en collyre, les patients doivent être surveillés à intervalles fréquents. L'utilisation prolongée de corticoïdes peut entraîner une hypertension oculaire / un glaucome (en particulier pour les patients ayant déjà eu une augmentation de la pression intra-oculaire suite à la prise de corticoïdes, une pression intra-oculaire élevée pré-existante ou un glaucome) ainsi que la formation d’une cataracte, en particulier chez les enfants et les sujets âgés.
L'utilisation de corticostéroïdes peut également entraîner des infections oculaires opportunistes (bactériennes, virales ou fongiques) dues à la suppression de la réponse de l'hôte ou au retard de la cicatrisation. De plus, les corticostéroïdes topiques oculaires peuvent favoriser, aggraver ou masquer les signes et symptômes d'infections oculaires opportunistes.
Les patients atteints d'une infection oculaire ne devraient recevoir un traitement local par corticoïde que lorsque l'infection a été contrôlée par un traitement anti-infectieux efficace. Ces patients doivent être surveillés attentivement et régulièrement par un ophtalmologiste.
Dans certaines conditions inflammatoires particulières telles que les épisclérites, les AINS sont le traitement de première intention. La dexaméthasone ne doit être utilisée que si les AINS sont contre-indiqués.
Les patients présentant une ulcération de la cornée ne doivent généralement pas recevoir de dexaméthasone topique, excepté lorsque l'inflammation est la cause principale d'un retard de cicatrisation et lorsque le traitement étiologique approprié a déjà été prescrit. Ces patients doivent être surveillés attentivement et régulièrement par un ophtalmologiste.
Un amincissement de la cornée et de la sclère peut accroître le risque de perforation en cas d'utilisation de corticoïdes locaux.
Des calcifications cornéennes ayant nécessité une greffe de cornée pour le recouvrement de la vue ont été rapportées chez des patients traités avec des préparations ophtalmologiques contenant des phosphates telles que DEXOCOL. Dès les premiers signes de calcifications cornéennes, le collyre doit être arrêté et le patient doit être traité par un collyre sans phosphate. Chez l'enfant, il convient d'éviter tout traitement continu de longue durée par les corticoïdes en raison d'un risque éventuel d'insuffisance surrénalienne.
Une cataracte sous-capsulaire postérieure peut apparaître à partir de certaines doses cumulées de dexaméthasone.
Les diabétiques sont également prédisposés à développer des cataractes sous-capsulaires après l'administration topique de corticoïdes.
L'utilisation de corticoïdes topiques dans le traitement d'une conjonctivite allergique n'est recommandée que pour les formes sévères de conjonctivites allergiques ne répondant pas au traitement standard et seulement sur une courte période.
Les patients ayant des antécédents d’hypersensibilité de contact à l’argent ne doivent pas utiliser ce médicament car les gouttes instillées peuvent contenir des traces d’argent provenant du flacon.
Un syndrome de Cushing et/ou une inhibition de la fonction surrénalienne associés à l’absorption systémique de dexaméthasone ophtalmique peuvent survenir après un traitement continu intensif ou à long terme chez des patients prédisposés, y compris chez les enfants et les patients traités par des inhibiteurs du CYP3A4 (incluant le ritonavir et le cobicistat). Dans ce cas, le traitement doit être arrêté progressivement.
Troubles visuels
Des troubles visuels peuvent apparaitre lors d’une corticothérapie par voie systémique ou locale. En cas de vision floue ou d’apparition de tout autre symptôme visuel apparaissant au cours d’une corticothérapie, un examen ophtalmologique est requis à la recherche notamment d’une cataracte, d’un glaucome, ou d’une lésion plus rare telle qu’une choriorétinopathie séreuse centrale, décrits avec l’administration de corticostéroïdes par voie systémique ou locale.
Il convient d'éviter le port de lentilles de contact pendant le traitement par un collyre à base de corticoïdes.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d’interaction n’a été réalisée.
En cas de traitement concomitant par un autre collyre en solution, il convient d'espacer les instillations de 15 minutes.
Des précipitations stromales superficielles de phosphate de calcium au niveau de la cornée ont été rapportées en cas d'utilisation concomitante de corticoïdes et de bêta-bloquants par voie topique.
Inhibiteurs du CYP3A4 (incluant le ritonavir et le cobicistat) : peuvent diminuer la clairance de la dexaméthasone, ce qui entraîne une augmentation des effets et une inhibition de la fonction surrénalienne/un syndrome de Cushing. L'association doit être évitée, sauf si le bénéfice est supérieur au risque accru d'effets secondaires systémiques des corticostéroïdes, auquel cas les patients doivent être surveillés pour les effets systémiques des corticostéroïdes.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n'existe pas de données suffisantes sur l'utilisation de dexaméthasone en collyre en solution pendant la grossesse pour évaluer les effets délétères potentiels. Les corticoïdes franchissent la barrière placentaire. Des effets tératogènes ont été observés chez les animaux (voir rubrique 5.3). Néanmoins, il n'existe aucune preuve à ce jour que des effets tératogènes soient induits chez l'homme. Après une administration de corticoïdes par voie générale, à des doses plus élevées, des effets sur le fœtus/nouveau-né ont été rapportés (retard de croissance intra-utérine, inhibition de la fonction corticosurrénale). Néanmoins, ces effets n'ont pas été rapportés lors d'un usage par voie oculaire.
Par mesure de précaution, il est préférable d'éviter l'utilisation de DEXOCOL pendant la grossesse.
Allaitement
On ignore si ce médicament est excrété dans le lait maternel. Cependant la dose totale de dexaméthasone est faible.
DEXOCOL peut être utilisé pendant l'allaitement.
Fertilité
Il n’y a pas d’information concernant un effet potentiel de la dexaméthasone 1 mg/mL sur la fertilité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets sur l'aptitude à conduire des véhicules et à utiliser des machines n'ont pas été étudiés.
Comme avec tous les collyres, une vision provisoirement trouble ou d'autres troubles de la vue peuvent affecter l'aptitude à conduire des véhicules ou à utiliser des machines. Si une vision trouble apparaît, le patient doit attendre jusqu'à ce que la vision soit revenue à la normale avant de conduire des véhicules ou d'utiliser des machines.
Tableau récapitulatif des effets indésirables
|
Classe de système d’organes |
Fréquence |
Effets indésirables |
|
Affections oculaires |
Très fréquent (≥ 1/10) |
Augmentation de la pression intra-oculaire* |
|
Fréquent (≥ 1/100, < 1/10) |
Gêne*, irritation*, brûlure*, picotements*, démangeaisons* et vision trouble*(voir rubrique 4.4) |
|
|
Peu fréquent (≥ 1/1 000, < 1/100) |
Réactions allergiques et d'hypersensibilité, retard de cicatrisation, cataracte capsulaire postérieure*, infections opportunistes, glaucome* |
|
|
Très rares (< 1/10 000, y compris cas isolés) |
Conjonctivite, mydriase, œdème facial, ptosis, uvéite induite par les corticoïdes, calcifications cornéennes, kératopathie cristalline, variations de l'épaisseur de la cornée*, œdème cornéen, ulcération de la cornée et perforation de la cornée |
|
|
Affections endocriniennes |
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) |
Syndrome de Cushing, inhibition de la fonction surrénalienne (voir également rubrique 4.4) |
* voir rubrique « Description de certains effets indésirables particuliers ».
Description de certains effets indésirables particuliers
Une augmentation de la pression intra-oculaire, un glaucome et une cataracte peuvent se produire. L'utilisation prolongée de corticoïdes peut entraîner une hypertension oculaire/un glaucome (en particulier pour les patients ayant déjà eu une augmentation de PIO suite à la prise de corticoïdes, une pression intra-oculaire élevée pré-existante ou un glaucome) ainsi que la formation d’une cataracte. Les enfants et les sujets âgés peuvent être particulièrement sensibles à l’augmentation de la pression intra-oculaire induite par les stéroïdes (voir rubrique 4.4).
L’augmentation de la pression intra-oculaire induite par un traitement topique corticoïde a été généralement observée dans les 2 semaines de traitement (voir rubrique 4.4).
Les diabétiques sont également plus susceptibles de développer une cataracte sous-capsulaire suite à l'administration de stéroïde topique.
Un inconfort, une irritation, une sensation de brûlure, des picotements, des démangeaisons et une vision trouble peuvent apparaître fréquemment immédiatement après l'instillation. Ces manifestations sont généralement modérés et de courtes durée et n'ont aucune conséquence.
Dans les maladies provoquant un amincissement de la cornée, l'utilisation topique de corticoïdes peut conduire dans certains cas à une perforation (voir rubrique 4.4).
En cas d’instillations fréquentes, une absorption systémique associée à une dépression de la fonction corticosurrénale peut survenir (voir également rubriques 4.2 et 4.4).
Des cas de calcification cornéenne ont été très rarement rapportés lors de l’utilisation de collyres contenant des phosphates chez certains patients présentant une altération significative de la cornée.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En cas de surdosage lors d'une administration topique, il convient d'arrêter le traitement. En cas d'irritation prolongée, il convient de rincer l'œil ou les yeux à l'eau stérile.
La symptomatologie due à une ingestion accidentelle n'est pas connue. Néanmoins, comme avec d'autres corticoïdes, le médecin peut envisager un lavage d'estomac ou le déclenchement de vomissements.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Le phosphate sodique de dexaméthasone est un ester inorganique hydrosoluble de dexaméthasone. Il s'agit d'un corticoïde de synthèse ayant une action anti-inflammatoire et antiallergique. La dexaméthasone a une action anti-inflammatoire plus puissante comparée à l'hydrocortisone (environ 25:1) et à la prednisolone (environ 5:1).
5.2. Propriétés pharmacocinétiques
En raison de ses propriétés hydrophiles, le phosphate sodique de dexaméthasone est peu absorbé par l'épithélium intact de la cornée.
Après son absorption par l'œil et la muqueuse nasale, le phosphate sodique de dexaméthasone est hydrolysé en dexaméthasone dans l'organisme.
Par la suite, la dexaméthasone et ses métabolites sont principalement éliminés par les reins.
5.3. Données de sécurité préclinique
Pouvoir mutagène et carcinogène
Les observations actuelles ne fournissent aucune preuve de propriétés génotoxiques cliniquement pertinentes des glucocorticoïdes.
Toxicité pour la reproduction
Dans les études chez l’animal, des résorptions fœtales et des fentes palatines ont été observées après administration de corticostéroïdes. Chez le lapin les corticostéroïdes ont produit des résorptions fœtales et de nombreuses anomalies au niveau de la tête, des oreilles, des membres et du palais.
De plus, une inhibition de la croissance intra-utérine et des modifications du développement fonctionnel du système nerveux central ont été observés.
30 mois.
Après première ouverture, le produit peut être conservé pendant un maximum de 28 jours et ne nécessite pas de précautions particulières de conservation.
6.4. Précautions particulières de conservation
Ce médicament ne nécessite pas de précautions particulières de conservation.
Pour les conditions de conservation du produit après première ouverture, voir rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
6 mL de solution dans un flacon en PEBD opaque blanc de 11 mL avec un embout Novelia blanc (PEHD et silicone) et un capuchon en PEHD blanc.
Conditionnements : 1 ou 3 flacons.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
22 Allée Camille Muffat
INEDI 5
06200 NICE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 797 3 4 : 6 mL en flacon (PEBD) avec embout compte-gouttes. Boîte de 1.
· 34009 301 797 4 1 : 6 mL en flacon (PEBD) avec embout compte-gouttes. Boîte de 3.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
ANSM - Mis à jour le : 05/03/2024
DEXOCOL 1 mg/mL, collyre en solution
Phosphate de dexaméthasone
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que DEXOCOL 1 mg/mL, collyre en solution et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser DEXOCOL 1 mg/mL, collyre en solution ?
3. Comment utiliser DEXOCOL 1 mg/mL, collyre en solution ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver DEXOCOL 1 mg/mL, collyre en solution ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE DEXOCOL 1 mg/mL, collyre en solution ET DANS QUELS CAS EST-IL UTILISE ?
DEXOCOL contient de la dexaméthasone, un corticostéroïde utilisé pour inhiber les symptômes inflammatoires (tels que douleur, chaleur, gonflement et rougeur).
DEXOCOL est utilisé pour traiter l’inflammation de vos yeux.
En cas d’infection oculaire (rougeur de l’œil, larmoiement et sécrétions), un traitement spécifique de votre infection devra être associé à DEXOCOL (voir rubrique 2).
Le collyre en solution DEXOCOL est une solution stérile qui ne contient pas de conservateur.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER DEXOCOL 1 mg/mL, collyre en solution ?
N’utilisez jamais DEXOCOL 1 mg/mL, collyre en solution :
· si vous êtes allergique au phosphate de dexaméthasone ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· si vous souffrez d'une infection oculaire pour laquelle vous n’êtes pas traité,
· en cas d'atteintes de la surface de l’œil (perforation, ulcération ou lésions qui n’ont pas complètement cicatrisé),
· en cas d'hypertension oculaire connue provoquée par les glucocorticoïdes (famille des corticoïdes).
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien ou votre infirmier/ère avant d’utiliser DEXOCOL 1 mg/mL, collyre en solution.
· Ne pas injecter, ne pas avaler.
· Eviter le contact de l'embout avec l'œil ou les paupières.
· Une surveillance ophtalmologique étroite est requise durant l'utilisation de DEXOCOL dans tous les cas et en particulier :
o chez les enfants et le sujet âgé. Une surveillance ophtalmologique plus fréquente est recommandée,
o si vous avez une infection oculaire. Utilisez DEXOCOL seulement si l'infection est contrôlée par un traitement anti-infectieux,
o si vous présentez un ulcère de la cornée, une plaie ouverte sur la surface de l’œil avec parfois une douleur extrême, des larmoiements, un strabisme et une perte de la vue. N'utilisez pas DEXOCOL sauf lorsque l'inflammation est la cause principale du retard de cicatrisation.
o si vous présentez une augmentation de la pression intra-oculaire. Si vous avez déjà réagi à un traitement corticoïde local par une augmentation de la pression intra-oculaire, vous présentez un risque de développer une augmentation de la pression intra-oculaire si vous êtes traité par DEXOCOL,
o si vous avez un glaucome, une maladie qui peut provoquer des dommages au nerf optique et pourrait entraîner une perte de la vue.
· Dès les premiers signes de calcifications cornéennes, le collyre doit être arrêté et le patient doit être traité par un collyre sans phosphate.
· Enfant : ne pas utiliser en traitement de longue durée, sans interruption.
· Si vous avez une conjonctivite allergique sévère (rougeur, gonflement, démangeaisons, et larmoiement de l’œil) qui ne répond pas à un traitement standard, vous devez prendre DEXOCOL uniquement sur une courte durée.
· Diabétique : si vous êtes diabétique, vous devez en informer votre ophtalmologiste ou opticien.
· Si vous avez un œil rouge non diagnostiqué, vous ne devez pas utiliser DEXOCOL.
· Lentilles de contact : vous devez éviter le port des lentilles de contact pendant le traitement par DEXOCOL.
Si vous avez des antécédents d’hypersensibilité de contact au métal d’argent, vous ne devez pas utiliser ce médicament.
Adressez-vous à votre médecin si vous ressentez un gonflement et une prise de poids au niveau de votre tronc et de votre visage car ce sont généralement les premières manifestations d'un syndrome appelé le syndrome de Cushing. L’inhibition de la fonction des glandes surrénales peut se développer après l’arrêt d'un traitement à long terme ou intensif avec DEXOCOL. Parlez-en à votre médecin avant d'arrêter le traitement par vous-même. Ces risques sont particulièrement importants chez les enfants et les patients traités par un médicament appelé ritonavir ou cobicistat.
Contactez votre médecin en cas de vision floue ou d’autres troubles visuels.
Enfants et adolescents
Sans objet.
Autres médicaments et DEXOCOL 1 mg/mL, collyre en solution
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
En cas de traitement concomitant par un autre collyre en solution, attendez 15 minutes entre chaque instillation.
L’utilisation concomitante locale de corticoïdes et de bêta-bloquants (pour le traitement de l’hypertension oculaire) peut provoquer des précipitations de phosphate de calcium à la surface de la cornée.
Informez votre médecin si vous utilisez du ritonavir ou du cobicistat, car cela peut augmenter la quantité de dexaméthasone dans votre sang.
DEXOCOL 1 mg/mL, collyre en solution avec des aliments et des boissons
Sans objet.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Il n'existe pas de données suffisantes sur l'utilisation de dexaméthasone pendant la grossesse pour évaluer les effets indésirables potentiels. C'est pourquoi il est recommandé de ne pas utiliser DEXOCOL pendant la grossesse.
On ignore si ce médicament est excrété dans le lait maternel. Cependant la dose totale de dexaméthasone est faible. En conséquence, DEXOCOL peut être utilisé pendant l’allaitement.
Conduite de véhicules et utilisation de machines
Vous pouvez avec une vision provisoirement trouble après avoir utilisé le collyre. Ne pas conduire de véhicules ou utiliser des machines avant le retour de la vision normale.
DEXOCOL 1 mg/mL, collyre en solution contient des phosphates
Ce médicament contient 1,976 mg de phosphate dans chaque mL de solution, ce qui équivaut à 7,450 mg de phosphate disodique dodécahydraté.
Si vous souffrez de dommages sévères de la cornée (couche transparente située à l’avant de l’œil) les phosphates peuvent causer, dans de très rares cas, des troubles de la vision en raison de l’accumulation de calcium pendant le traitement (nuage).
3. COMMENT UTILISER DEXOCOL 1 mg/mL, collyre en solution ?
La dose recommandée est de 1 goutte, 4 à 6 fois par jour, dans l'œil malade. Dans les cas graves, le traitement peut débuter par 1 goutte toutes les heures et doit être réduit à 1 goutte toutes les 4 heures dès qu'une réponse favorable est observée. Une réduction progressive de la posologie est recommandée pour éviter un effet rebond.
Personnes âgées
Aucun ajustement de posologie n'est nécessaire.
Utilisation chez les enfants
Ne pas utiliser en traitement de longue durée, sans interruption.
Mode d'administration
Voie ophtalmique : ce médicament est destiné à être administré dans l'œil.
Evitez le contact de l’embout du flacon multidose avec l’œil ou les zones autour de l’œil. Cela pourrait provoquer des lésions à l’œil. Le collyre en solution pourrait être contaminé par des bactéries pouvant provoquer des infections menant à de graves lésions de l’œil, voire une perte de la vision.
Pour éviter une éventuelle contamination du flacon multidose, éviter le contact de l’embout du flacon avec toute surface.
Avant instillation du collyre :
· Lavez-vous les mains avant d’ouvrir le flacon.
· N’utilisez pas le médicament si vous remarquez que la bague d’inviolabilité sur le col du flacon est cassée avant la première utilisation.
· Lors de l'utilisation du flacon pour la première fois, avant de faire tomber une goutte dans l'œil, essayez d’utiliser le flacon en le pressant doucement pour faire tomber une goutte loin de votre œil.
· Lorsque vous êtes certain que vous pouvez faire tomber une goutte à la fois, choisissez la position qui vous est le plus confortable pour l'instillation des gouttes (vous pouvez vous asseoir, vous allonger sur le dos, ou vous tenir debout devant un miroir).
Instillation :
|
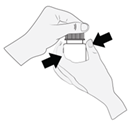
1. Tenez le flacon juste en dessous du capuchon et tournez le capuchon pour ouvrir le flacon. Ne touchez rien avec l’embout du flacon pour éviter toute contamination de la solution.
|
|
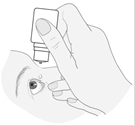
2. Inclinez la tête vers l'arrière et maintenez le flacon au-dessus de votre œil. |
|
3. Tirez la paupière inférieure vers le bas et regardez vers le haut. Pressez doucement le flacon au milieu et laissez une goutte tomber dans votre œil. Veuillez noter qu'il pourrait y avoir quelques secondes de délai entre le moment où vous pressez le flacon et le moment où la goutte tombe. N’appuyez pas trop fort. Si vous avez un doute sur la façon d’administrer votre médicament, demandez plus d’informations à votre médecin, votre pharmacien ou votre infirmière.
|
|
4. Clignez des yeux plusieurs fois pour répartir la goutte sur la surface de l’œil.
|
|
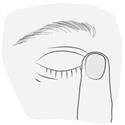
5. Après instillation de DEXOCOL, appuyez sur le coin intérieur de l’œil avec un doigt, près du nez, pendant quelques minutes. Cela permet d’éviter la propagation du médicament dans le reste du corps.
|
|
6. Répétez les instructions 2 – 5 pour instiller une goutte dans l’autre œil si votre médecin vous l’a indiqué. Parfois, un seul œil a besoin d’un traitement, votre médecin vous indiquera si cela vous concerne et quel œil doit être traité. |
|
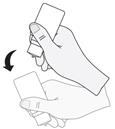
7. Après chaque utilisation et avant de remettre le bouchon, le flacon doit être secoué une fois vers le bas, sans toucher l'extrémité du compte-gouttes, afin d'éliminer tout résidu de liquide sur l’embout. Cela est nécessaire afin de pouvoir instiller des gouttes ultérieurement.
|
Après avoir instillé toutes les doses, il peut rester un peu de DEXOCOL dans le flacon. Ne vous inquiétez pas car une quantité supplémentaire de DEXOCOL a été ajoutée, vous aurez la quantité totale de DEXOCOL que votre médecin vous a prescrit. N'essayez pas d'utiliser l'excédent de médicament restant dans le flacon après avoir terminé le traitement.
Fréquence d'administration
4 à 6 fois par jour.
Durée du traitement
La durée du traitement varie généralement de quelques jours à 14 jours au maximum.
Si vous avez utilisé plus de DEXOCOL 1 mg/mL, collyre en solution que vous n’auriez dû :
Rincez l'œil à l'eau stérile si vous avez instillé trop de produit dans votre œil et que vous ressentez une irritation prolongée.
Contactez immédiatement votre médecin ou votre pharmacien.
Si vous oubliez d’utiliser DEXOCOL 1 mg/mL, collyre en solution :
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez d’utiliser DEXOCOL 1 mg/mL, collyre en solution :
N’arrêtez pas de prendre votre traitement brusquement. Consultez toujours votre médecin si vous décidez d'arrêter le traitement.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Troubles endocriniens :
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
Troublesoculaires :
Très fréquent (pouvant affecter plus de 1 patient sur 10) :
· pression intra-oculaire élevée, après 2 semaines de traitement.
Fréquent (pouvant affecter jusqu’à 1 patient sur 10) :
· gêne, irritation, brûlure, picotements, démangeaisons et vision trouble après l'instillation. Ces manifestations sont généralement modérées et de courte durée.
Peu fréquent (pouvant affecter jusqu’à 1 patient sur 100) :
· signes de réaction allergique,
· retard de cicatrisation,
· opacification du cristallin (cataracte),
· infections,
· pression intra-oculaire élevée glaucome.
Très rare (pouvant affecter jusqu’à 1 patient sur 10 000) :
· inflammation des membranes de l'œil entraînant rougeur, larmoiement et irritation (conjonctivite),
· dilatation de la pupille (mydriase),
· gonflement de la face (œdème facial),
· paupière tombante (ptosis),
· inflammation de l'iris provoquant douleurs et rougeurs (uvéite),
· dépôt de calcium sur la surface de l’œil (calcification de la cornée),
· inflammation de la surface de l’œil entraînant vision trouble, yeux secs, sensibilité à la lumière, brûlure, larmoiement et sensation d’avoir du sable dans l’œil (kératopathie cristalline),
· variations de l'épaisseur de la surface de l’œil,
· gonflement de la surface de l’œil (œdème cornéen),
· ulcération de la surface de l’œil entraînant douleurs, larmoiement, strabisme et perte de la vue,
· formation de petits trous sur la surface de l’œil (perforation de la cornée).
Si vous souffrez de dommages sévères de la couche transparente située à l’avant de l’oeil (la cornée) les phosphates peuvent causer, dans de très rares cas, des troubles de la vision en raison de l’accumulation de calcium pendant le traitement.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER DEXOCOL 1 mg/mL, collyre en solution ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas le collyre pendant plus de 28 jours après la première ouverture du flacon. Notez la date à laquelle vous avez ouvert le flacon dans l’espace prévu à cet effet sur l’étiquette du flacon et la boîte.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage et le flacon après EXP. La date de péremption fait référence au dernier jour de ce mois.
Ce médicament ne nécessite pas de précautions particulières de conservation.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient DEXOCOL 1 mg/mL, collyre en solution
· La substance active est :
Phosphate de dexaméthasone........................................................................................... 1 mg
Sous forme de phosphate sodique de dexaméthasone.
Pour 1 mL de solution.
· Les autres composants sont :
Phosphate disodique dodécahydraté, chlorure de sodium, édétate disodique, acide chlorhydrique (pour l’ajustement du pH), hydroxyde de sodium (pour l’ajustement du pH), eau pour préparations injectables.
Qu’est-ce que DEXOCOL 1 mg/mL, collyre en solution et contenu de l’emballage extérieur
DEXOCOL 1 mg/mL collyre en solution se présente sous la forme d’une solution limpide de 6 mL contenue dans un flacon en PEBD opaque blanc de 11 mL avec un embout Novelia blanc (PEHD et silicone) et un capuchon en PEHD blanc.
Chaque boîte contient 1 ou 3 flacons.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
22 Allée Camille Muffat
INEDI 5
06200 NICE
Exploitant de l’autorisation de mise sur le marché
22 Allée Camille Muffat
INEDI 5
06200 NICE
6 DERVENAKION STR.
15351 PALLINI, ATTIKI
GRECE
OU
EXCELVISION
27 RUE DE LA LOMBARDIERE
ZI LA LOMBARDIERE
07100 ANNONAY
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).